
中国海洋湖沼学会主办。
文章信息
- 阚宏玉, 苗亮, 杜杨, 李明云, 巩晓琳, 李文雅, 孙振南, 石海瑞, 张立宁. 2022.
- KAN Hong-Yu, MIAO Liang, DU Yang, LI Ming-Yun, GONG Xiao-Lin, LI Wen-Ya, SUN Zhen-Nan, SHI Hai-Rui, ZHANG Li-Ning. 2022.
- 香鱼(Plecoglossus altivelis)致病性类志贺邻单胞菌的分离与生化药敏鉴定
- ISOLATION, BIOCHEMICAL IDENTIFICATION, AND ANTIBIOTIC SENSITIVITY OF PATHOGENETIC PLESIOMONAS SHIGELLOIDES ISOLATED FROM SWEETFISH PLECOGLOSSUS ALTIVELIS
- 海洋与湖沼, 53(6): 1476-1486
- Oceanologia et Limnologia Sinica, 53(6): 1476-1486.
- http://dx.doi.org/10.11693/hyhz20220300074
文章历史
-
收稿日期:2022-03-24
收修改稿日期:2022-05-12
2. 宁波大学 水产生物技术教育部重点实验室 浙江宁波 315832;
3. 浙江省海洋水产养殖研究所 浙江温州 325005
2. Key Laboratory of Aquacultral Biotechnology, Ministry of Education, Ningbo University, Ningbo 315832, China;
3. Zhejiang Mariculture Research Institute, Wenzhou 325005, China
香鱼(Plecoglossus altivelis)隶属胡瓜鱼目(Osmeriformes)、香鱼科(Plecoglossidae)、香鱼属(Plecoglossus), 为一年生小型洄游性鱼类, 又名油香鱼、八月香等, 因肉质细嫩, 散发独特清香, 被誉为“淡水鱼之王”。香鱼野生种群主要生活在我国、朝鲜半岛、日本等地的沿海溪流中, 从我国辽宁的鸭绿江至广西的北仑河皆有分布, 但因人工水利工程建设、栖息地退化等原因, 我国香鱼野生种质资源已逐渐退化。我国在20世纪90年代已实现香鱼的全人工育苗和养殖(李明云等, 1995), 浙江和福建两省为主养殖区。
香鱼对水质非常敏感, 近年来随着养殖规模扩大、养殖密度增加、气候恶劣等因素的影响导致香鱼养殖水环境恶化, 病害频繁暴发, 给香鱼养殖业造成了严重的经济损失。目前对香鱼病害已有部分研究报道, 日本的香鱼养殖业中常见病害为由嗜冷黄杆菌(Kim et al, 2010a, 2010b; Nakayama et al, 2016; Shimizu et al, 2016)引起的细菌性冷水病(bacterial cold water disease, BCWD), 患病症状为鳃、肝、肾的贫血, 吻部、体侧或尾部组织糜烂和溃疡, 严重时可见穿孔(Iida et al, 1996; Okamura, 2013; Kumagai, 2016)。我国香鱼养殖业常见病症为弧菌病(谢鸿伟, 2021), 病原为鳗弧菌(李长红等, 2009), 该病在日本的香鱼中偶尔也有发生(Kanno et al, 1990), 症状以体表溃疡为主要, 其他的症状为食欲减退, 浮头, 离群游动, 肾脏、脾脏肿大等。其他主要病原还有杀香鱼假单胞菌(Nishimori et al, 2000; Kobayashi et al, 2006)、佩鲁兰新副变形虫(Crosbie et al, 2010)、嗜冷黄杆菌(Dyková et al, 1980)、香鱼格留虫(Zhou et al, 2018)、鲇爱德华氏菌(Nagai et al, 2008; Sakai et al, 2008; Hassan et al, 2010)、嗜水气单胞菌(张呈念等, 2009)等, 但对病原感染的致病机理等研究皆不够深入。
类志贺邻单胞菌(Plesiomonas shigelloides)是肠杆菌科邻单胞菌属的唯一种, 已有该菌造成鲫(Carassius auratus)、大口黑鲈(Micropterus salmoides)、斑点叉尾
2021年7月下旬, 第6号强台风“烟花”过境后, 浙江省宁海县的养殖香鱼暴发病害, 病鱼体表溃烂, 死亡严重。为了探明本次香鱼病害的病原, 我们对病鱼进行了组织病理切片观察和菌株分离, 分离菌株经生化特性和分子生物学鉴定为类志贺邻单胞菌, 回归感染实验确认了该菌株为本次香鱼病害的病原菌, 随后对该菌株进行了药物敏感性实验和毒力基因、耐药基因的检测, 研究结果可为香鱼养殖中病原鉴定及病害防控提供参考资料。
1 材料与方法 1.1 实验用鱼患病香鱼于2021年8月中旬取自宁海县某养殖场, 为人工养殖的8月龄香鱼[体质量(86.9±14.1) g], 当时正值发病死亡高峰期, 从养殖水泥池中捞取症状明显的濒死病鱼, 用氧气包运回实验室进行取样。作为对照及用于回归感染的鱼为本实验室循环水系统中养殖的健康香鱼[体质量(22.4±1.7) g]。
1.2 组织病理学观察对病鱼进行无菌解剖, 剪取鳃、肝、脾、肠、肌肉组织(约5 mm×5 mm×3 mm), 置于4%多聚甲醛溶液中固定24 h, 之后进行脱水、透明、浸蜡、包埋、切片、贴片、脱蜡等步骤, 再进行H.E染色, 用中性树脂封片后, 与健康香鱼的组织切片一同观察, 并进行组织病理学比较。
1.3 菌株分离与保存以无菌操作取病鱼中肠置于灭菌EP管中, 加入pH=7.0的灭菌磷酸缓冲盐溶液(phosphate buffer saline, PBS) 0.5 mL, 将肠组织充分剪碎并震荡混匀, 2 000 g离心5 min, 取上清液0.1 mL涂布在TSA平板(杭州微生物试剂有限公司)上。将平板置于培养箱中28 ℃培养12 h, 再用划线法进行分离纯化, 然后将单菌落接种在TSB液体培养基中培养, 后将菌液分装至无菌冻存管中、加入等体积的20%无菌甘油置于–80 ℃冰箱中保存备用。
1.4 分离菌株的生化鉴定使用VITEK 2 Compact全自动微生物鉴定系统(bioMérieux公司, 法国)和VITEK 2 GN鉴定卡(bioMérieux公司, 法国)对分离菌株做生化鉴定, 步骤如下: 用无菌棒将菌落从培养基接种至装有3 mL无菌0.9%生理盐水的清洁塑料管中并摇匀, 用比浊仪将菌悬液浓度调整至0.50~0.63麦氏单位范围内, 然后将菌悬液管及GN鉴定卡置于载卡台上进行检测。
1.5 病原菌的分子生物学鉴定与分析用细菌基因组DNA提取试剂盒(天根生化科技有限公司)提取分离菌株的基因组DNA, 并将提取后的DNA浓度调整至100 ng/μL作为PCR模板。用16S rDNA引物27F/1492R (Edwards et al, 1989)进行PCR扩增。反应体系为: 2×Es Taq MasterMix (Dye) (江苏康为世纪生物科技股份有限公司) 10 μL, 上、下游引物各1 μL, DNA模板0.5 μL, 用无菌水补齐至20 μL。扩增程序为: 95 ℃热启动5 min; 95 ℃变性30 s、58 ℃退火30 s、72 ℃延伸90 s, 循环30次; 72 ℃后延伸10 min。
用E.Z.N.A Gel Extraction Kit试剂盒(Omega Bio-tek公司, 美国)纯化PCR产物后送至由生工生物工程(上海)股份有限公司测序。对测得序列进行校准后在NCBI网站进行BLAST比对(https://blast.ncbi.nlm.nih.gov/Blast.cgi), 选取同源性较高的同种菌株的16S rDNA和同科其他菌种16S rDNA、并以金黄色葡萄球菌(Staphylococcus aureus)的16S rDNA序列作为外群, 用MEGA11软件以近邻法构建系统进化树, 步长检验次数设为1 000。
1.6 回归感染实验将纯化后的分离菌株接种于TSB液体培养基中, 28 ℃培养18 h。用无菌PBS冲洗培养物, 计数后经梯度稀释制成4个浓度的菌悬液: 1×109、1×108、1×107、1×106 CFU/mL。随机取50尾健康香鱼并按每组10尾分为5组, 其中4组分别腹腔注射不同浓度的菌悬液100 μL, 另1组作为对照注射PBS溶液100 μL。每组均设施3个重复。感染实验共进行7 d, 每天观察记录各组鱼的存活情况。使用改良寇式法(孙瑞元, 1963)计算半致死剂量LD50, 公式为
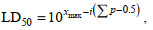 (1)
(1)式中, xmax为最大剂量的对数值, i为相邻两组剂量对数值的差值, ∑p为各组死亡率总和。
1.7 药物敏感性试验采用纸片扩散法(K-B法)对分离菌株进行细菌药敏检测。将菌液浓度调整至1×107 CFU/mL, 涂布在TSA平板上。用无菌镊子夹取抗生素纸片(杭州微生物试剂有限公司)贴在培养基上, 28 ℃培养24 h后用游标卡尺测量抑菌圈直径。共检测了25种抗生素药物的敏感性, 根据CLSI发布的肠杆菌科药敏试验判读标准(CLSI, 2018)和试剂盒说明书中的说明进行药敏性判读。
1.8 毒力基因与耐药基因的检测根据Ekundayo等(2018)报道的类志贺邻单胞菌的毒力基因和耐药基因, 从GenBank数据库中获取相关序列, 用Primer-BLAST工具(https://www.ncbi.nlm.nih.gov/tools/primer-blast/)设计用于扩增毒力基因和耐药基因的引物(引物信息见表 3、表 4), 引物由生工生物工程(上海)股份有限公司合成。PCR反应体系为: 2×Es Taq MasterMix (Dye) 10 μL, 上、下游引物各1 μL, 菌株DNA模板0.5 μL, 用无菌水补齐至20 μL。PCR扩增程序为: 95 ℃热启动5 min; 95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸1 min, 循环30次; 72 ℃后延伸10 min。PCR产物进行1%琼脂糖凝胶电泳检测, 凝胶成像后根据各引物扩增条带的有无判定菌株是否具有该基因。
2 结果 2.1 病鱼解剖和组织病理学观察患病香鱼症状表现为: 皮肤和肌肉组织溃烂, 溃烂处鳞片和皮肤脱落, 周围皮肤充血, 肌肉组织突出, 肛门红肿。解剖后可见肠道肿胀, 肠壁变薄、出血, 肠腔内有淡黄色炎性黏液(图 1)。切片观察显示: 健康香鱼肌肉结构完整、肌纤维排列规则(图 2a), 病鱼突出的肌肉中肌纤维断裂、肌纤维周围可见红细胞和炎性细胞浸润, 呈坏死性肌炎表现(图 2b); 病鱼的鳃丝和鳃小片中红细胞增多、鳃丝间细胞和黏液细胞增多、细胞边界不明显并有淋巴细胞浸润, 部分鳃丝上皮细胞瓦解(图 2d); 健康香鱼肝脏细胞边界清晰, 血红细胞均匀而随机分布(图 2e), 病鱼肝细胞的细胞核呈空泡样, 部分肝细胞与周围肝细胞之间产生缝隙而被“隔离”, 核内染色质边集, 部分细胞凋亡、溶解(图 2f); 健康香鱼的脾脏红细胞区和白细胞区边界明显(图 2g), 患病香鱼脾脏内红细胞数量减少, 细胞排列不规则, 白细胞聚集, 核深染, 细胞之间出现空泡(图 2h); 健康香鱼肠组织中上皮细胞排列紧密, 可见明显毛细血管和肠腺(图 2i), 病鱼肠道内黏膜上皮细胞脱落、溶解(图 2j)。
 |
| 图 1 患病香鱼皮肤、肌肉、肠道和肛门的病理学症状 Fig. 1 Pathological symptoms at skin, muscle, intestine, and anus of diseased P. altivelis 注: a. 患病香鱼侧面观, 箭头所示为皮肤和肌肉组织溃烂处; b. 香鱼解剖图, 上方箭头所示肠道肿胀、变薄, 肠道充血、出血, 肠腔内有淡黄色炎性黏液, 下方箭头所示肛门红肿 |
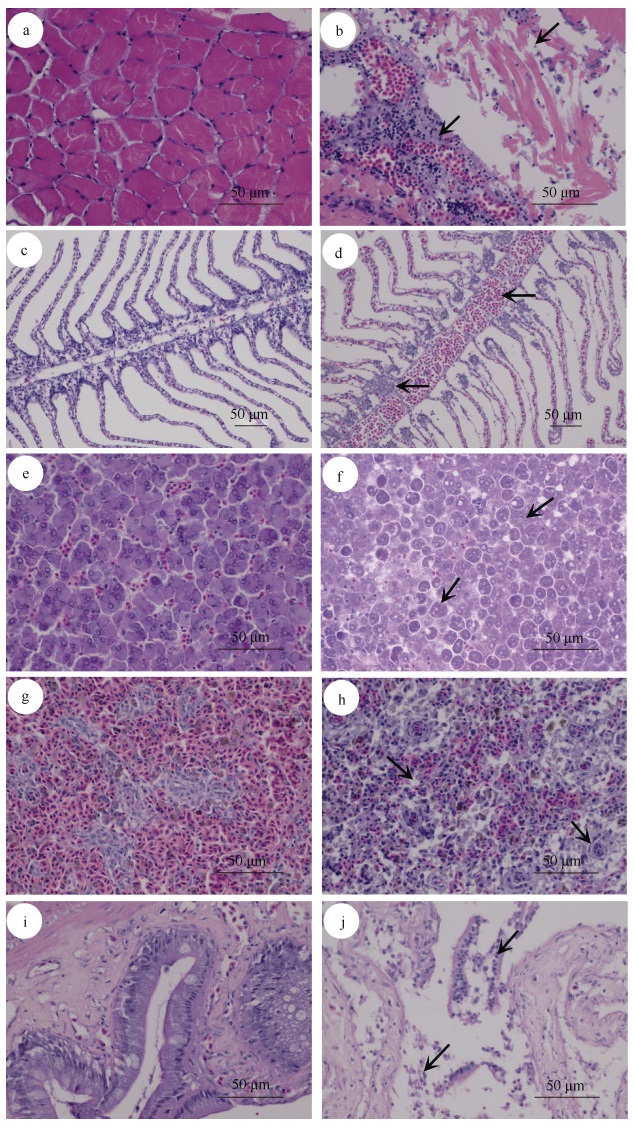 |
| 图 2 患病香鱼与健康香鱼5种组织切片 Fig. 2 Five tissue sections of diseased and healthy P. altivelis 注: a~b. 肌肉; c~d. 鳃; e~f. 肝脏; g~h. 脾脏; i~j. 肠。a, c, e, g, i为健康香鱼组织; b, d, f, h, j为病鱼组织。比例尺=50 μm |
将分离菌株编号为NH21, 该菌株经培养12 h后形成的菌落低凸、圆形, 直径1~2 mm, 边缘光滑, 表面湿润(图 3a)。染色显示该菌株为革兰氏阴性菌, 100×油镜观察菌体呈杆状、端圆(图 3b)。
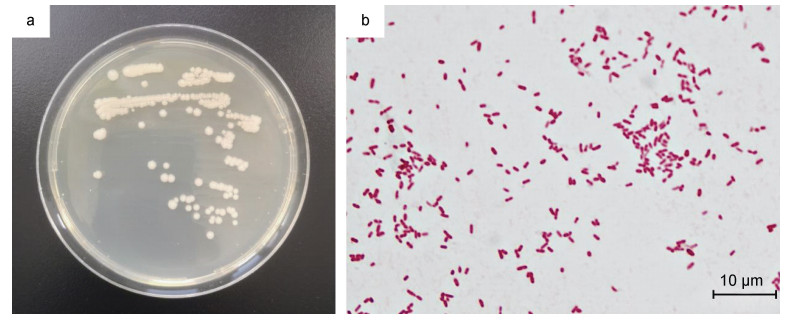 |
| 图 3 分离菌株NH21的菌落形态(a)和革兰氏染色涂片(b) Fig. 3 Colony morphology (a) and Gram-stained smear (b) of isolated strain NH21 |
根据VITEK 2 GN鉴定卡的结果, VITEK 2 Compact生化鉴定系统分析本实验分离到的NH21菌株为类志贺邻单胞菌(准确率99.9%), 各项鉴定结果见表 1。
| 鉴定项目 | 英文缩写 | 鉴定结果 | 鉴定项目 | 英文缩写 | 鉴定结果 | |
| 丙氨酸-苯丙氨酸-脯氨酸芳胺酶 | APPA | – | 蔗糖 | SAC | – | |
| 侧金盏花醇 | ADO | – | D-塔格糖 | dTAG | – | |
| 吡咯烷基芳胺酶 | PyrA | – | D-海藻糖 | dTRE | + | |
| L-阿拉伯醇 | lARL | – | 柠檬酸盐(钠) | CIT | – | |
| D-纤维二糖 | dCEL | – | 丙二酸盐 | MNT | – | |
| β-半乳糖苷酶 | BGAL | + | 5-酮-D-葡萄糖苷 | 5KG | – | |
| H2S产生 | H2S | – | 乳酸盐产碱 | lLATk | – | |
| β-N-乙酰葡萄糖苷酶 | BNAG | + | α-葡萄糖 | AGLU | – | |
| 谷氨酰芳胺酶 | AGLTp | – | 琥珀酸盐产碱 | SUCT | + | |
| D-葡萄糖 | dGLU | + | N-乙酰-β-半乳糖氨酶 | NAGA | – | |
| γ-谷氨酰转移酶 | GGT | – | α-半乳糖苷酶 | AGAL | + | |
| 葡萄糖 | OFF | + | 磷酸酶 | PHOS | – | |
| β-葡萄糖苷酶 | BGLU | – | 氨基乙酸芳胺酶 | GlyA | + | |
| D-麦芽糖 | dMAL | + | 鸟氨酸脱羧酶 | ODC | + | |
| D-甘露醇 | dMAN | – | 赖氨酸脱羧酶 | LDC | + | |
| D-甘露糖 | dMNE | + | 脱羧酶阴性控制 | 0DEC | – | |
| β-木糖苷酶 | BXYL | – | 组氨酸同化 | lHISa | – | |
| β-丙氨酸芳胺酶 | BAlap | – | COURMARATE | CMT | + | |
| L-脯氨酸芳胺酶 | ProA | + | β-葡萄糖苷酸酶 | BGUR | – | |
| 酯酶 | LIP | – | O/129耐受 | O129R | + | |
| 古老糖 | PLE | – | 谷氨酸-甘氨酸-精氨酸芳胺酶 | GGAA | – | |
| 酪氨酸芳胺酶 | TyrA | + | L-苹果酸盐同化 | lMLTa | + | |
| 尿素酶 | URE | – | ELLMAN | ELLM | + | |
| D-山梨醇 | dSOR | – | L-乳酸盐同化 | lLATa | – | |
| 注: “+”表示检测结果阳性; “–”表示检测结果为阴性 | ||||||
在以金黄色葡萄球菌为外群构建的系统进化树(图 4)中, 分离菌株NH21和9株类志贺邻单胞菌聚为一个紧密的大簇, NH21菌株与这9株类志贺邻单胞菌的同源性都 > 99% (99.23%~99.93%); 肠杆菌科的另外8种细菌(鼠疫耶尔森氏杆菌、迟缓爱德华氏菌、黏质沙雷氏菌、产气肠杆菌、肺炎克雷伯氏菌、肠炎沙门氏菌、宋内志贺菌、大肠杆菌)聚为另一个大簇。
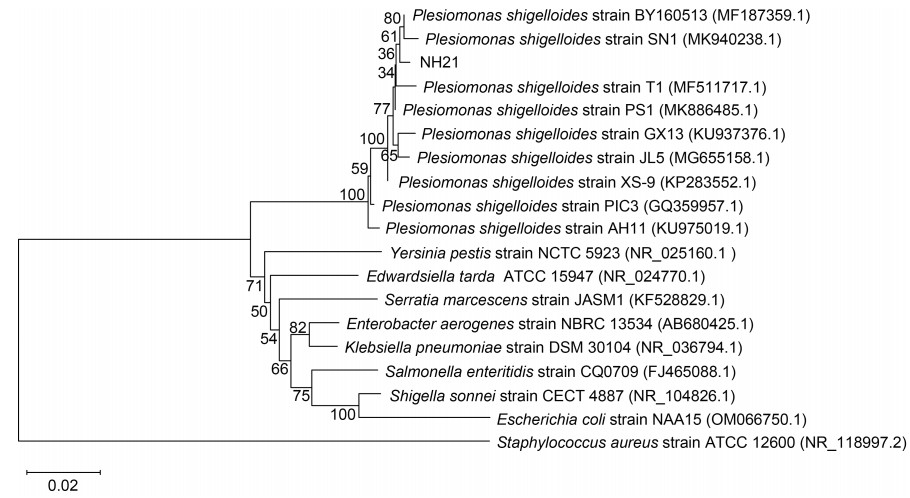 |
| 图 4 NH21菌株16S rDNA基因序列的系统发生树 Fig. 4 Phylogenetic tree of 16S rDNA gene sequences of strain NH21 注: 图中字体加粗的菌株编号即为本实验的分离菌株NH21 |
回归感染后的香鱼出现腹部充血、肛门红肿的症状, 与自然感染香鱼的病理症状相似。回归感染实验存活率见图 5。各个感染组香鱼出现死亡的时间与感染剂量呈正相关, 即感染剂量越大出现死亡的时间越早。感染剂量由高到低的4个实验组中香鱼死亡时间分别出现在感染后第1天、第2天、第3天和第6天, 至感染实验结束时(第7天)各组存活率分别为0%、20%、80%和90%。对照组香鱼全程无死亡。经计算, NH21菌株对香鱼的半致死剂量LD50=2.51×107 CFU/mL。
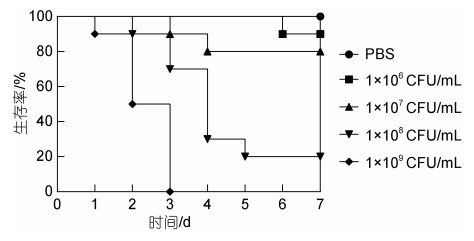 |
| 图 5 回归感染生存曲线 Fig. 5 The survival curve of artificial infection |
药物敏感性试验结果(表 2)显示: NH21菌株对阿奇霉素、头孢氨苄、新生霉素、多黏菌素B、头孢西丁、呋喃唑酮6种药物敏感, 对麦迪霉素、氨苄西林、羧苄西林、阿莫西林、链霉素、卡那霉素、环丙沙星、诺氟沙星、氯霉素、多西环素、四环素、磺胺异
| 抗生素种类 | 药物名称 | 剂量 | 耐药/mm | 中介/mm | 敏感/mm | 抑菌圈直径/mm | 耐药性 |
| 大环内酯类 | 红霉素 | 15 μg/片 | ≤13 | 14~22 | ≥23 | 17 | I |
| 阿奇霉素 | 15 μg/片 | ≤12 | — | ≥13 | 20 | S | |
| 克拉霉素 | 15 μg/片 | ≤13 | 14~17 | ≥18 | 14 | I | |
| 麦迪霉素 | 30 μg/片 | ≤13 | 14~17 | ≥18 | 9 | R | |
| β-内酰胺类 | 氨苄西林 | 10 μg/片 | ≤13 | 14~16 | ≥17 | 12 | R |
| 羧苄西林 | 10 μg/片 | ≤19 | 20~22 | ≥23 | 9 | R | |
| 阿莫西林 | 20 μg/片 | ≤13 | 14~17 | ≥18 | 11 | R | |
| 头孢氨苄 | 30 μg/片 | ≤14 | 15~17 | ≥18 | 24 | S | |
| 氨基糖苷类 | 链霉素 | 10 μg/片 | ≤11 | 12~14 | ≥15 | 0 | R |
| 庆大霉素 | 10 μg/片 | ≤12 | 13~14 | ≥15 | 13 | I | |
| 卡那霉素 | 30 μg/片 | ≤13 | 14~17 | ≥18 | 9 | R | |
| 喹诺酮类 | 环丙沙星 | 5 μg/片 | ≤15 | 16~20 | ≥21 | 10 | R |
| 诺氟沙星 | 10 μg/片 | ≤12 | 13~16 | ≥17 | 0 | R | |
| 左氧氟沙星 | 5 μg/片 | ≤13 | 14~16 | ≥17 | 14 | I | |
| 氯霉素类 | 氯霉素 | 30 μg/片 | ≤12 | 13~17 | ≥18 | 8 | R |
| 氟苯尼考 | 30 μg/片 | ≤12 | 13~17 | ≥18 | 13 | I | |
| 四环素类 | 多西环素 | 30 μg/片 | ≤12 | 13~15 | ≥16 | 11 | R |
| 四环素 | 30 μg/片 | ≤11 | 12~14 | ≥15 | 0 | R | |
| 磺胺类 | 磺胺异 唑 唑 |
300 μg/片 | ≤12 | 13~16 | ≥17 | 9 | R |
| 复方新诺明 | 1.25 μg/片 | ≤10 | 11~15 | ≥16 | 11 | I | |
| 氟喹诺酮类 | 氧氟沙星 | 5 μg/片 | ≤12 | 13~15 | ≥16 | 12 | R |
| 香豆素类 | 新生霉素 | 30 μg/片 | ≤12 | 13~16 | ≥17 | 17 | S |
| 多肽类 | 多黏菌素B | 300 IU/片 | ≤8 | 8~11 | ≥12 | 18 | S |
| 头霉素类 | 头孢西丁 | 30 μg/片 | ≤14 | 15~17 | ≥18 | 28 | S |
| 硝基呋喃类 | 呋喃唑酮 | 300 μg/片 | ≤14 | 15~16 | ≥17 | 32 | S |
| 注: R. 耐药; S. 敏感; I. 中介 | |||||||
11个细菌毒力基因的检测结果中(表 3)显示: NH21菌株存在9个毒力基因, 分别为feoB、csrA、ssb、phoP、csgG、waaA、panD、sodB、clpP; 未检测到毒力基因nanE和hsdM。所检测的8个耐药基因emrD、catB、macB、ksgA、tolC、ampE、bacA、acrA均在NH21菌株中被检测到(表 4)。
| 基因名称 | 引物序列 | 引物长度/bp | 产物长度/bp | 检测结果 |
| feoB | F: GGAGCGGTGTGACGGTTGAGAA | 22 | 318 | + |
| R: GCGACAGCAACGGCACATTGA | 21 | |||
| csrA | F: GCCGAGTTGGTGAAACCCTGAT | 22 | 146 | + |
| R: TTCAGCCTGGATGCGTTGGTAA | 22 | |||
| nanE | F: TTGTCTGGCGATGGCGGATTG | 21 | 155 | – |
| R: CGGCTTGCTTCAGTGCGGTTA | 21 | |||
| ssb | F: GACCGAATGGCACCGTGTTGT | 21 | 247 | + |
| R: TTGTGGCTGCTGTGGTTGACC | 21 | |||
| phoP | F: AGAGCAAGGACATCAGGTGGAT | 22 | 491 | + |
| R: GCAGTTCGGCATCGGCATAC | 20 | |||
| csgG | F: GCTATGCTGACATCGGCGTTAA | 22 | 291 | + |
| R: GCGTAAGTTGACGGCGACCT | 20 | |||
| waaA | F: GTGCTGTATGGCGTGGCTGAT | 21 | 210 | + |
| R: CTCGGTGACGGCTTGCTGTAAG | 22 | |||
| panD | F: ACCGTAACCCAAGCCGATCTG | 21 | 268 | + |
| R: GCTTATGCCGACGAGCTTCTTC | 22 | |||
| hsdM | F: AAGGTAGCCCACGCCGAGAAAT | 22 | 641 | – |
| R: AGACGCAGCAGGTTGGAGGATT | 22 | |||
| sodB | F: CAACGCCGCTCAAGTCTGGAA | 21 | 263 | + |
| R: GCAGTGGAGTGTGACCTTCAGT | 22 | |||
| clpP | F: GCCGATGGTTGTTGAGCAGACA | 22 | 532 | + |
| R: CACCGCTTCTTCAGCCGACAT | 21 |
| 基因名称 | 引物序列 | 引物长度/bp | 产物长度/bp | 检测结果 |
| emrD | F: AGTTGGTGTATGGTCCGCTGTC | 22 | 666 | + |
| R: CGCTAACGGCAATCCACATCAG | 22 | |||
| catB | F: TCGGTAATGGTGCGGTGATAGC | 22 | 150 | + |
| R: ACAGCCACCACTGCATCTCCT | 21 | |||
| macB | F: GCCAAGAAGTGCTCGCTATCCT | 22 | 1 135 | + |
| R: CCTACGCCGCCGACAATCAA | 20 | |||
| ksgA | F: GCTGACCGTGCGTGAACAAGA | 21 | 522 | + |
| R: CAGAACTGCTCCACCGTGATGT | 22 | |||
| tolC | F: TGGAGCAAGCGTACCGTGAGA | 21 | 329 | + |
| R: AATTGGCGATGGCGTGTTCAGT | 22 | |||
| ampE | F: CCAGTTTAGCCGCCGAGCAAT | 21 | 357 | + |
| R: GCCAATCCATCACCGACACCAT | 22 | |||
| bacA | F: GTGTTCTGGCGGCGGATGTT | 20 | 198 | + |
| R: ACCACCGACCACCAAGGCATA | 21 | |||
| acrA | F: CGGATGCTGATGGTGGTGGATG | 22 | 217 | + |
| R: CGCTGGCACTGACAACCTTCTG | 22 |
我国开展香鱼人工养殖已有近30年, 近年来病害频发给香鱼养殖业造成了巨大经济损失。香鱼养殖中常见细菌性疾病有弧菌病、假单胞菌病、气单胞菌病、链球菌病、柱形病、冷水病、类结节病等, 分别由弧菌、杀香鱼假单胞菌、气单胞菌、β溶血型链球菌、柱状黄杆菌、嗜冷黄杆菌、杀鱼巴斯德菌等引起(叶岩豹, 2004)。本实验中对患皮肤溃烂病的病鱼进行优势菌分离纯化, 通过革兰氏染色、生化和分子鉴定分离的菌株NH21为类志贺邻单胞菌, 并通过回归感染实验证实其为本次宁海县香鱼体表溃烂病的病原菌。
类志贺邻单胞菌是一种革兰氏阴性的兼性厌氧菌, 肠杆菌科(Enterobacteriaceae)邻单胞菌属(Plesiomonas)只有类志贺邻单胞菌一个种。类志贺邻单胞菌在自然界中广泛存在, 可感染的宿主多样, 例如: 钟震宇等(2018)报道了鹿茸部位出血继而引发败血症的雄性麋鹿脾脏病变, 在病灶分离到类志贺邻单胞菌; 李富祥等(2012)报道了从昆明某地患败血症的病死成年犬中分离到该菌; 另外也有大量的流行病学调查显示类志贺邻单胞菌也可引起人的腹泻(窦雪如, 2017; 李君萍等, 2020; 王小龙等, 2020)。在鱼类中, 类志贺邻单胞菌可感染太平洋双色鳗鲡(赖晓健等, 2016)、江鳕(张效平等, 2018)、鲫(傅芳等, 2019)、杂交鲟(张明洋等, 2019)、黄鳝(陈志勇等, 2020)、斑点叉尾
由于抗生素在人类生活和渔业生产上的广泛及不规范使用, 许多致病菌对一些常见的抗生素都产生了耐受性。药物敏感性实验显示, 本次分离到的香鱼致病性类志贺邻单胞菌NH21菌株对阿奇霉素、头孢氨苄、新生霉素、多黏菌素B、头孢西丁、呋喃唑酮敏感, 而对环丙沙星、诺氟沙星、氯霉素、多西环素、四环素、氧氟沙星等耐受。从其他鱼类中分离到的类志贺邻单胞菌也对一些常见的抗生素呈耐药性, 如张培等(2015)分离得到的ZP-1菌株对氨苄西林、阿莫西林、头孢氨苄、替考拉宁等12种抗生素耐受; 分离自斑点叉尾鮰的YZ1010菌株对环丙沙星、复方新诺明、羧苄西林、氨苄西林等14种抗生素耐受(吕小燕等, 2020)。鉴于目前在多种鱼类中分离到的致病性类志贺邻单胞菌对多种常用抗生素都具有抗药性并存在多种耐药基因, 今后对该病原菌的防治也应考虑多种方法, 例如赖晓健等(2016)发现五倍子、丁香、生地榆等中药对引起太平洋双色鳗鲡发病的类志贺邻单胞菌都有很好的抑菌效果, 何洋等(2022)分离到了一株类志贺邻单胞菌噬菌体, 这些研究都为今后该病的防治提供了新的思路。
根据上述研究, 类志贺邻单胞菌在不同的鱼类和不同地区内分离的菌株产生了不同的药敏试验结果, 同时也存在着不同程度的混合感染。在之后的水产养殖生产活动中, 需要各地政府应依托水产推广站、养殖研究所等社会机构, 设立鱼病疫情的协调机制, 加强管理, 在技术人员的指导下科学用药, 本研究结果可为今后制定统一的检测和治疗标准提供参考资料。
4 结论本研究从2021年8月浙江省宁海县某养殖场暴发体表溃烂病的香鱼病鱼体中分离到一株疑似病原菌NH21, 根据生化分析和分子生物学方法鉴定其为类志贺邻单胞菌。药敏试验表明NH21菌株对阿奇霉素等6种抗生素敏感, 对麦迪霉素等13种抗生素耐药。经PCR检测NH21菌株具有feoB等9个毒力基因9个和emrD等8个耐药基因。根据回归感染实验确定了NH21菌株的半致死剂量(LD50)值为2.51×107 CFU/mL。
王小龙, 滕臣刚, 张建新, 等, 2020. 苏州市一起疑似类志贺邻单胞菌引起的食物中毒调查与分析. 食品安全质量检测学报, 11(9): 3003-3008 |
叶岩豹, 2004. 香鱼增养殖技术. 杭州: 浙江科学技术出版社, 173-183
|
吕小燕, 袁汉文, 何爱美, 等, 2020. 斑点叉尾  致病性类志贺邻单胞菌的分离鉴定及药物敏感性. 河北渔业, (8): 33-37, 60 致病性类志贺邻单胞菌的分离鉴定及药物敏感性. 河北渔业, (8): 33-37, 60 |
庆辉, 周国勤, 陆健, 等, 2022. 大口黑鲈苗种致病性类志贺邻单胞菌的分离和鉴定. 水产科技情报, 49(1): 43-47 |
孙瑞元, 1963. 简捷实用的半数致死量综合计算法. 药学学报, 10(2): 65-74 |
李长红, 陈炯, 史雨红, 等, 2009. 宁海地区香鱼弧菌病病原菌鉴定. 微生物学报, 49(7): 931-937 DOI:10.3321/j.issn:0001-6209.2009.07.014 |
李君萍, 李晓宾, 王红, 等, 2020. 山西口岸首例输入性类志贺邻单胞菌感染性腹泻病例的调查分析. 口岸卫生控制, 25(1): 32-35 DOI:10.3969/j.issn.1008-5777.2020.01.010 |
李明云, 赵志东, 历九品, 等, 1995. 香鱼全海水工厂化人工育苗. 海洋渔业, (1): 18-19 |
李富祥, 王传禹, 杨仕标, 等, 2012. 1株犬类志贺邻单胞菌的分离鉴定及序列分析. 中国兽医学报, 32(12): 1824-1827 |
何洋, 秦旭颖, 荆兆元, 等, 2022. 一株类志贺邻单胞菌噬菌体生物学特性及全基因组分析. 微生物学报, 62(2): 650-660 |
张呈念, 史雨红, 李明云, 等, 2009. 一株引起香鱼出血症的嗜水气单胞菌的鉴定. 水产科学, 28(7): 370-373 DOI:10.3969/j.issn.1003-1111.2009.07.002 |
张明洋, 胡安东, 程振涛, 等, 2019. 杂交鲟类志贺邻单胞菌的分离鉴定及耐药性分析. 中国畜牧兽医, 46(1): 264-270 |
张效平, 杨星, 李小义, 等, 2018. 江鳕类志贺邻单胞菌的分离鉴定及药敏试验. 水产科学, 37(4): 533-538 |
张培, 朱爱华, 胡秀彩, 等, 2015. 金鱼类志贺邻单胞菌的分离鉴定及药敏试验. 水产科学, 34(6): 375-379 |
陈志勇, 邓平, 罗少波, 等, 2020. 黄鳝温室炼苗期致病性类志贺邻单胞菌的分离与鉴定. 水产科技情报, 47(5): 249-253 |
陈美群, 王冬平, 潘瑛子, 等, 2020. 鱼源致病性类志贺邻单胞菌的研究进展. 水产科学, 39(5): 780-786 |
钟震宇, 白加德, 李俊芳, 等, 2018. 半散放麋鹿大出血继发败血症的诊断. 黑龙江畜牧兽医, (14): 195-196 |
傅芳, 谈永萍, 王利, 等, 2019. 鲫鱼类志贺邻单胞菌的鉴定及其致病机制研究. 中国预防兽医学报, 41(12): 1215-1220, 1243 |
温周瑞, 许钦涵, 卢伶俐, 等, 2021. 黄颡鱼暴发性疾病病因分析及防治措施. 湖北农业科学, 60(20): 119-124 |
谢鸿伟, 2021. 香鱼弧菌病生态综合防控技术. 水产养殖, 42(7): 74-76 |
赖晓健, 杨方园, 李忠琴, 2016. 太平洋双色鳗鲡(Anguilla bicolor pacifica)致病性类志贺邻单胞菌的鉴定和中药敏感性研究. 海洋与湖沼, 47(6): 1185-1192 |
窦雪如, 2017. 2例腹泻病人粪便中类志贺邻单胞菌的分离与鉴定. 疾病监测与控制, 11(12): 980-981 |
CLSI (Clinical and Laboratory Standards Institute), 2018. Performance standards for antimicrobial susceptibility testing. 28th edition [R]. Wayne: CLSI: 31-37.
|
CROSBIE P B B, OGAWA K, NAKANO D, et al, 2010. Amoebic gill disease in hatchery-reared ayu, Plecoglossus altivelis (Temminck & Schlegel), in Japan is caused by Neoparamoeba perurans. Journal of Fish Diseases, 33(5): 455-458 |
DYKOVÁ I, LOM J, EGUSA S, 1980. Tissue reaction to Glugea plecoglossi infection in its natural host, Plecoglussus altivelis. Folia Parasitological (Praha), 27(3): 213-216 |
EDWARDS U, ROGALL T, BLÖCKER H, et al, 1989. Isolation and direct complete nucleotide determination of entire genes. Characterization of a gene coding for 16S ribosomal RNA . Nucleic Acids Research, 17(19): 7843-7853 |
EKUNDAYO T C, OKOH A I, 2018. Pathogenomics of virulence traits of Plesiomonas shigelloides that were deemed inconclusive by traditional experimental approaches. Frontiers in Microbiology, 9: 3077 |
HASSAN E S, MAHMOUD M M, DUNG N H, et al, 2010. Serological characterization of Edwardsiella ictaluri strains isolated from wild ayu Plecoglossus altivelis. Fish Pathology, 45(1): 43-46 |
IIDA Y, MIZOKAMI A, 1996. Outbreaks of coldwater disease in wild ayu and pale chub. Fish Pathology, 31(3): 157-164 |
KANNO T, NAKAI T, MUROGA K, 1990. Scanning electron microscopy on the skin surface of ayu Plecoglossus altivelis infected with Vibrio anguillarum. Diseases of Aquatic Organisms, 8: 73-75 |
KIM J H, GOMEZ D K, NAKAI T, et al, 2010a. Isolation and identification of bacteriophages infecting ayu Plecoglossus altivelis altivelis specific Flavobacterium psychrophilum. Veterinary Microbiology, 140(1/2): 109-115 |
KIM J H, GOMEZ D K, NAKAI T, et al, 2010b. Plasmid profiling of Flavobacterium psychrophilum isolates from ayu (Plecoglossus altivelis altivelis) and other fish species in Japan. Journal of Veterinary Science, 11(1): 85-87 |
KOBAYASHI T, IMAI M, 2006. Histopathological features of ayu Plecoglossus altivelis experimentally infected with Pseudomonas plecoglossicida. Fish Pathology, 41(3): 91-97 |
KUMAGAI A, 2016. Bacterial cold-water disease in Salmonid fish and Ayu. Fish Pathology, 51(4): 153-157 |
NAGAI T, IWAMOTO E, SAKAI T, et al, 2008. Characterization of Edwardsiella ictaluri isolated from wild ayu Plecoglossus altivelis in Japan. Fish Pathology, 43(4): 158-163 |
NAKAYAMA H, TANAKA K, TERAMURA N, et al, 2016. Expression of collagenase in Flavobacterium psychrophilum isolated from cold-water disease-affected ayu (Plecoglossus altivelis). Bioscience, Biotechnology, and Biochemistry, 80(1): 135-144 |
NISHIMORI E, KITA-TSUKAMOTO K, WAKABAYASHI H, 2000. Pseudomonas plecoglossicida sp. nov., the causative agent of bacterial haemorrhagic ascites of ayu, Plecoglossus altivelis. International Journal of Systematic and Evolutionary Microbiology, 50(1): 83-89 |
OKAMURA T, 2013. Mortality of cultured ayu Plecoglossus altivelis with deep skin ulceration on the thoracic region. Fish Pathology, 48(3): 105-108 |
SAKAI T, KAMAISHI T, SANO M, et al, 2008. Outbreaks of Edwardsiella ictaluri infection in ayu Plecoglossus altivelis in Japanese rivers. Fish Pathology, 43(4): 152-157 |
SALERNO A, ČIŽNÁR I, KROVACEK K, et al, 2010. Phenotypic characterization and putative virulence factors of human, animal and environmental isolates of Plesiomonas shigelloides. Folia Microbiologica (Praha), 55(6): 641-647 |
SHIMIZU M, GODA H, YAMASAKI K, et al, 2016. Draft genome sequence of Flavobacterium psychrophilum Strain KTEN-1510 with Genotype A/G-C, isolated from an ayu (Plecoglossus altivelis altivelis) in the Kagami River, Kochi, Japan. Genome Announcements, 4(1): e01762-15 |
ZHOU Q J, CHAI F C, CHEN J, 2018. First record of Glugea plecoglossi (Takahashi & Egusa.1977), a microsporidian parasite of ayu (Plecoglossus altivelis altivelis Temminck & Schlegel. 1846) in Mainland China. Journal of Fish Diseases, 41(1): 165-169 |
 2022, Vol. 53
2022, Vol. 53


