
中国海洋湖沼学会主办。
文章信息
- 王庆敏, 黄智慧, 马爱军, 孙志宾, 王新安, 刘志峰, 徐荣静. 2022.
- WANG Qing-Min, HUANG Zhi-Hui, MA Ai-Jun, SUN Zhi-Bin, WANG Xin-An, LIU Zhi-Feng, XU Rong-Jing. 2022.
- 不同铁水平饲养对大菱鲆(Scophthalmus maximus)生长及耐低氧能力影响的研究
- EFFECT OF DIFFERENT IRON LEVELS IN FEED ON GROWTH AND HYPOXIA TOLERANCE OF TURBOT SCOPHTHALMUS MAXIMUS
- 海洋与湖沼, 53(6): 1503-1512
- Oceanologia et Limnologia Sinica, 53(6): 1503-1512.
- http://dx.doi.org/10.11693/hyhz20220300083
文章历史
-
收稿日期:2022-03-31
收修改稿日期:2022-04-29
2. 中国农业科学院研究生院 北京 100081;
3. 青岛海洋科学与技术试点国家实验室海洋生物学与生物技术功能实验室 山东青岛 266071;
4. 烟台开发区天源水产有限公司 山东烟台 264003
2. Graduate School of Chinese Academy of Agricultural Sciences, Beijing 100081, China;
3. Laboratory for Marine Biology and Biotechnology, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071, China;
4. Yantai Tianyuan Aquatic Co. Ltd., Yantai 264003, China
现代集约化鱼类养殖过程中易受到环境应激的影响, 常见的应激因子有温度、溶解氧、盐度、pH值、氨氮和亚硝酸盐等(洪磊等, 2004; 郭晓丽, 2021), 其中溶解氧是鱼类机体存活必不可少的环境因子之一(洪磊等, 2004; 李根芳等, 2021)。实际养殖水体环境中溶解氧含量波动大且分布不均, 水环境中高浓度溶解氧, 可抑制氨氮、亚硝酸盐、硫化氢等有害物质的产生, 同时可减轻它们对养殖动物的毒害作用, 增强养殖动物食欲, 提高饵料利用率, 降低养殖动物病害发生率, 促进生长发育; 反之, 低氧胁迫通过影响胚胎发育、形态结构、呼吸、摄食及生长代谢、抗氧化(李黎等, 2005; 吴志昊等, 2011)等生命过程威胁鱼类生存。因此, 探究提高鱼类耐低氧能力的方法对水产养殖具有重要意义, 有助于提高养殖产量和经济价值。近年来, 越来越多的研究揭示了缺氧条件下鱼体生理和代谢变化, 但在提高鱼类耐低氧能力方面的研究还比较有限。
面对低氧胁迫, 鱼类通常通过代偿作用机制增强血液携氧能力来提高血氧含量, 在这过程中铁作为血液中氧的运输载体在缺氧条件下其需求量必然会增加; 研究显示在溶解氧含量低的条件下细胞对铁的吸收、转运、循环再利用等过程都会随之发生改变, 鱼类机体需要合成更多的血红蛋白以增加氧气的供应(Xu et al, 2017), 因此铁元素在鱼类应对低氧胁迫时发挥着重要作用, 研究其对鱼体应对低氧胁迫的影响具有重要的意义。
铁作为细胞色素的重要组成成分, 参与鱼类细胞内的氧化还原供能过程, 该过程释放的能量用来形成高能磷酸键, 供给肌肉收缩和代谢过程(如糖代谢、脂代谢、氧化磷酸化等), 有研究表明鱼类机体用以健康生长的能量释放与线粒体聚集铁的水平呈正比关系。近年来的研究表明饲料中添加适量的铁在维持鱼类生长方面发挥了重要作用(Gatlin et al, 1986; Andersen et al, 1996; 魏万权等, 1999; Shiau et al, 2003; Ling et al, 2010; 汪华, 2012; Luo et al, 2017; 麻永财等, 2019; 冯伟, 2020; Zafar et al, 2020), 但外源铁离子变化对鱼类应对低氧胁迫的研究鲜有报道。
胁迫状态下, 血液生理生化指标尤其是糖、脂等能量代谢和酶活(SOD、GSH等)等指标, 能客观反映机体的应激状态和抗应激调节机制, 是被广泛用于评价鱼类的生理健康和环境适应性的标准之一(Singh et al, 2017)。本研究以硫酸亚铁为铁源, 制作不同铁含量饲料对大菱鲆幼鱼进行投喂, 探究外源铁离子摄入对大菱鲆在低氧胁迫过程中的影响, 从而为筛选既安全又能提高鱼体生长及抗逆性的功能饲料添加剂提供新的研究思路, 同时也为研究铁代谢对低氧胁迫调控机制的影响提供有效资料。
1 材料与方法 1.1 实验用鱼与饲养管理本实验所用的大菱鲆均来自烟台市开发区天源水产有限公司, 在圆形水池(直径2 m, 深1.5 m)中暂养10 d, 水温为(14.0±0.5) ℃, 氧气泵连续通氧, DO= (8.0±0.5) mg/L, 盐度为30, 每天早晚各一次投喂人工饵料。暂养结束后禁食3 d, 从暂养池中挑选个体均重为(20.0±5.0) g的健康、较为活跃的大菱鲆幼鱼600尾, 随机分到15个圆桶(直径1 m, 深1 m)中, 每桶40尾, 将15个桶随机分为A、B、C、D、E五个组, 每组3个重复组, 正常养殖环境[水温为(14.0±0.5) ℃, 盐度为30, 溶解氧DO=(8.0±0.5) mg/L]下分别投喂5种不同的实验饲料, 每天早晚各一次, 投喂1 h后放水, 每周对水体指标如温度、溶氧量、盐度进行抽测, 保持正常养殖环境稳定, 饲养周期为60 d, 饲养结束后停食24 h, 准确测量不同铁水平饲料饲养的大菱鲆体重生长指标, 并采集血清, 以备后续实验; 饲喂结束后选取不同外源铁离子饲料组投喂的大菱鲆, 开展低氧胁迫实验。
1.2 实验饲料与实验设计 1.2.1 饲料制作本实验根据鲆鲽类和其他鱼类大致需铁含量范围373~800 mg/kg (魏万权等, 1999; 汪华, 2012; 冯伟, 2020), 制作5种适量范围内的不同铁水平的饲料对大菱鲆幼鱼进行投喂, 优化不含外源铁基础饲料配方(张玉玲等, 2017) (表 1), 以硫酸亚铁(FeSO4·7H2O)为铁源, 饲料中铁的添加量为0、75、150、225、300 mg/kg, 分别制成五种不同铁水平的颗粒饲料, 并送青岛市华测检测技术有限责任公司检测, 最终饲料中铁水平检测结果见表 1。
| 原料组成/(mg/kg) | A | B | C | D | E |
| 鱼粉 | 480 | 480 | 480 | 480 | 480 |
| 虾粉 | 100 | 100 | 100 | 100 | 100 |
| 面粉 | 170 | 170 | 170 | 170 | 170 |
| 海洋红酵母 | 40 | 40 | 40 | 40 | 40 |
| 鱿鱼粉 | 30 | 30 | 30 | 30 | 30 |
| 海苔粉 | 10 | 10 | 10 | 10 | 10 |
| 谷朊粉 | 50 | 50 | 50 | 50 | 50 |
| 复合维生素 | 10 | 10 | 10 | 10 | 10 |
| 复合矿物质*(不含铁) | 10 | 10 | 10 | 10 | 10 |
| 鱼油 | 100 | 100 | 100 | 100 | 100 |
| 硫酸亚铁 | 0 | 75 | 150 | 225 | 300 |
| 饲料制成最终总铁含量 | 463 | 538 | 613 | 688 | 763 |
| 注: 复合矿物质*(单位: mg/kg): 氟化钠2, 碘化钾0.8, 氯化钴50, 硫酸铜10, 硫酸锌50, 硫酸镁1 200, 磷酸二氢钙3 000, 氯化钠100, 沸石粉5 100 | |||||
本实验对经过5种不同铁水平饲料饲喂60 d后的大菱鲆开展低氧胁迫实验。根据不同低氧情况下实验鱼的行为表现的预实验结果, 选择中度缺氧和重度缺氧两个浓度, 进行低氧胁迫试验, 即DO1=(4.0±0.5) mg/L和DO2=(2.0±0.5) mg/L。具体设计如下: 低氧控制的实验方法参照Burleson等(2011)的基础上略有修改。实验均在循环水养殖系统的封闭玻璃鱼缸(长×宽×高=90×60×40 cm)中进行, 低氧条件利用氮气调节至所需的溶解氧水平, 每隔4 h用溶氧仪(衡欣AZ8403)测量1次溶解氧水平, 以保持水中溶氧量稳定在设置水平, 同时为了减少气体与大气的交换, 玻璃缸上盖有封闭性良好的塑料盖, 低氧胁迫实验设置2个缺氧组[14 ℃, 盐度30, DO1=(4.0±0.5) mg/L, DO2=(2.0±0.5) mg/L]和对照组[14 ℃, 盐度30, DO=(8.0±0.5) mg/L], 每组10尾鱼, 3个重复共30尾。低氧胁迫实验期间不投喂, 12 h进行血清、组织采集, 用于后续实验; 低氧耐受实验设置1个缺氧组[DO=(2.0±0.5) mg/L], 每组10尾鱼, 3个重复, 从放入大菱鲆幼鱼(0 h)开始计时, 每2 h进行一次数据记录, 观察大菱鲆的活动及健康状况, 及时捞出死鱼, 并记录其存活状态、死亡数量, 全部实验鱼达到半数致死, 实验结束。
1.3 测定指标与方法 1.3.1 生长指标测定养殖实验结束后, 停食24 h, 准确测量不同铁水平饲料饲养的大菱鲆的体重生长指标, 并计算其增重率(WGR), 计算公式如下:
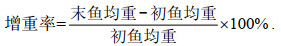 (1)
(1)各实验组随机抽取4尾鱼, 采样前均用MS-222 (100 mg/L)对鱼进行麻醉, 无菌条件下取其血液, 4 ℃放置6 h后, 3 500 r/min离心15 min后取血清于无菌离心管中, 放入–80 ℃保存, 用于血清生化指标检测。
1.3.3 酶活检测采集各实验组血清中的葡萄糖、胆固醇、甘油三酯、总超氧化物歧化酶(SOD), 采用酶标仪进行测定, 检测方法按照南京建成生物有限公司所研制的试剂盒说明书完成。
1.3.4 酶联免疫吸附实验检测血清中转铁蛋白检测血清中转铁蛋白(Tfa)含量的检测按照南京建成检测试剂盒中的说明书进行, 具体流程: 准备试剂、样品、标准品-向酶标包被板中加入已经准备好的样品、标准品、生物素抗原, 37 ℃反应30 min, 第一次洗板5次, 加入亲和素HRP, 37 ℃反应30 min, 第二次洗板5次, 加入显色液A、B, 37 ℃显色10 min, 按照加入显色液顺序依次加入终止液, 避光反应15~10 min之内酶标仪450 nm处依序测出各孔的吸光度(OD值)。
1.4 数据分析生长数据利用Excel 2010和SPSS 18.0统计软件进行分析, 酶联免疫测皮质醇、转铁蛋白的数据使用ELISAcalc进行计算, 拟合模型选用logistic曲线(四参数), 结果最终以平均值±标准误表示, 采用单因素方差分析(One-Way ANOVA), P < 0.05为差异显著, P < 0.01为差异极显著。
2 结果 2.1 常氧情况下不同铁水平饲养对大菱鲆生长的影响正常条件即常氧情况下, 饲料中不同铁水平对大菱鲆幼鱼生长指标影响结果见表 2, 分析结果显示, 饲料中不同铁水平对大菱鲆幼鱼的末均重、增重率影响较为显著(P < 0.05), 且随着饲料中铁水平的增加, 大菱鲆的末均重、增重率呈现先升高后下降趋势, 其中C、D两组显著高于其余三组(P < 0.05), 且C与D之间差异不明显(P > 0.05)。
| 项目 | A | B | C | D | E |
| 初均重/g | 22.42±0.76 | 21.97±0.09 | 22.24±4.37 | 23.02±0.23 | 21.35±0.07 |
| 末均重/g | 45.56±1.56a | 45.93±1.51a | 51.47±0.81b | 52.65±0.63b | 42.04±0.93a |
| 增重率(WGR)/% | 103.22±0.07a | 109±0.06a | 132.44±0.49b | 128.88±0.05b | 96.88±0.05a |
| 注: 结果最终以平均值±标准误表示, 同一行字母不同表示差异显著(P < 0.05), 下同 | |||||
不同铁水平饲养大菱鲆在常氧条件和低氧条件下血清转铁蛋白Tfa的变化结果见图 1, 结果显示, 正常溶氧量DO=(8.0±0.5) mg/L时, 随着饲料中铁水平的增加, 大菱鲆血清转铁蛋白含量呈现降低趋势, 但C、D、E三组之间的差异并不显著; 随着低氧胁迫逐渐加剧, A、B、C、D四组饲喂的大菱鲆血清转铁蛋白含量均呈下降趋势(P < 0.05), E组则呈先下降后上升趋势, 但上升趋势不显著。
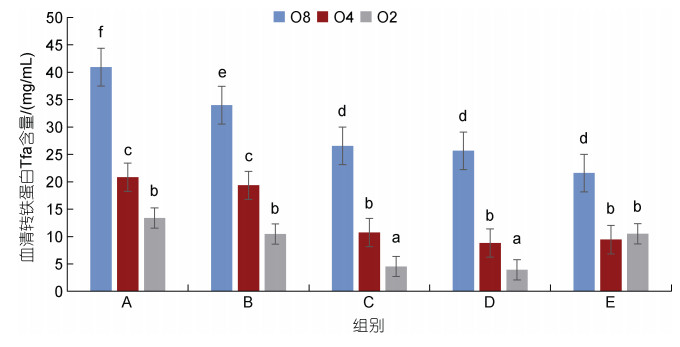 |
| 图 1 不同铁水平饲养大菱鲆在常氧条件和低氧条件下血清转铁蛋白Tfa含量的变化(平均值±标准误) Fig. 1 Changes of serum transferrin Tfa in S. maximus fed with different iron levels under normoxic and hypoxic conditions (mean±SE) 注: O8: 常氧组; O4: 缺氧组1; O2: 缺氧组2; 柱上不同字母表示差异显著(P < 0.05), 相同字母表示差异不显著(P > 0.05)。下同 |
不同铁水平饲养大菱鲆在常氧条件和低氧条件下血清葡萄糖(GLU)、胆固醇(TC)、甘油三酯(TG)含量的变化结果见图 2, 分析结果显示: (1) 常氧DO=(8.0±0.5) mg/L条件下, 随着饲料中铁水平的增加大菱鲆血清中GLU呈先升高后下降趋势, 其中C组高于D组GLU含量但差异不显著, 但C、D两组显著高于A、E两组, C组为峰点; 随着低氧胁迫加剧, GLU含量均呈现逐渐上升趋势且差异显著(P < 0.05)。(2) 常氧DO=(8.0±0.5) mg/L条件下, 大菱鲆幼鱼血清中TC、TG含量随着饲料铁水平的增加也呈先升高后下降趋势, 其中D组高于C组但差异不显著, 但C、D两组显著高于其余三组, D组为峰点; 随着低氧胁迫加剧, A、B、E三组铁水平饲喂的大菱鲆血清TC含量均呈逐渐上升趋势且差异显著(P < 0.05), C、D组则呈先上升后下降趋势; 而血清TG含量C、D、E三组均呈先上升后下降趋势, A、B组则呈逐渐上升趋势(P < 0.05)。
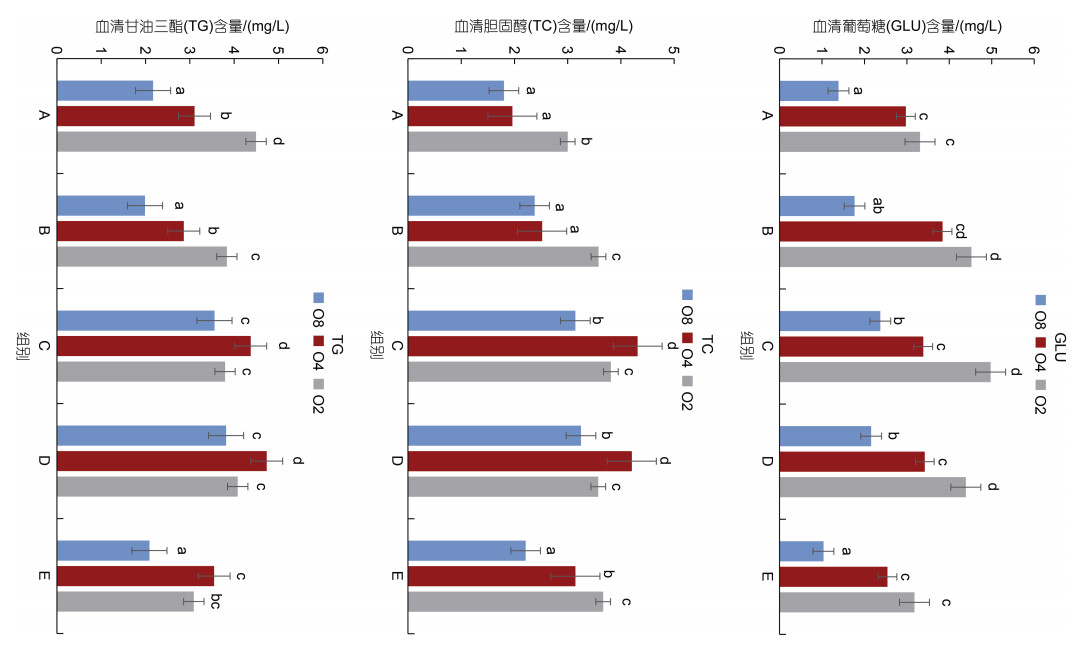 |
| 图 2 不同铁水平饲养大菱鲆在常氧条件和低氧条件下血清葡萄糖(GLU)、胆固醇(TC)、甘油三酯(TG)含量的变化(平均值±标准误差) Fig. 2 Changes of serum glucose (GLU), cholesterol (TC), and triglyceride (TG) contents in S. maximus fed at different iron levels under normoxic and hypoxic conditions (mean±SE) |
不同铁水平饲养大菱鲆在常氧条件和低氧条件下血清SOD和GSH-PX含量变化结果见图 3, 结果显示, (1) 常氧DO=(8.0±0.5) mg/L条件下, 随着饲料中铁水平的增加, 大菱鲆幼鱼血清SOD活性呈现先升高后降低的趋势, C组血清中SOD活性显著高于其他四组(P < 0.05); 随着低氧胁迫逐渐加剧, A、B、E三组大菱鲆幼鱼血清SOD活性呈逐渐升高的趋势(P < 0.05), 而C、D组SOD活性虽然也略有上升但差异并不显著。(2) 常氧DO=(8.0±0.5) mg/L条件下, 大菱鲆幼鱼血清中GSH-PX活性随着饲料铁水平的增加也呈先升高后下降趋势, D组血清GSH-PX活性显著高于A、B、E三组(P < 0.05); 随着低氧胁迫逐渐加剧, A、B组呈显著上升趋势(P < 0.05), C、D组虽上升但并不显著, E组呈现显著上升, 而后出现下降趋势但并不显著。
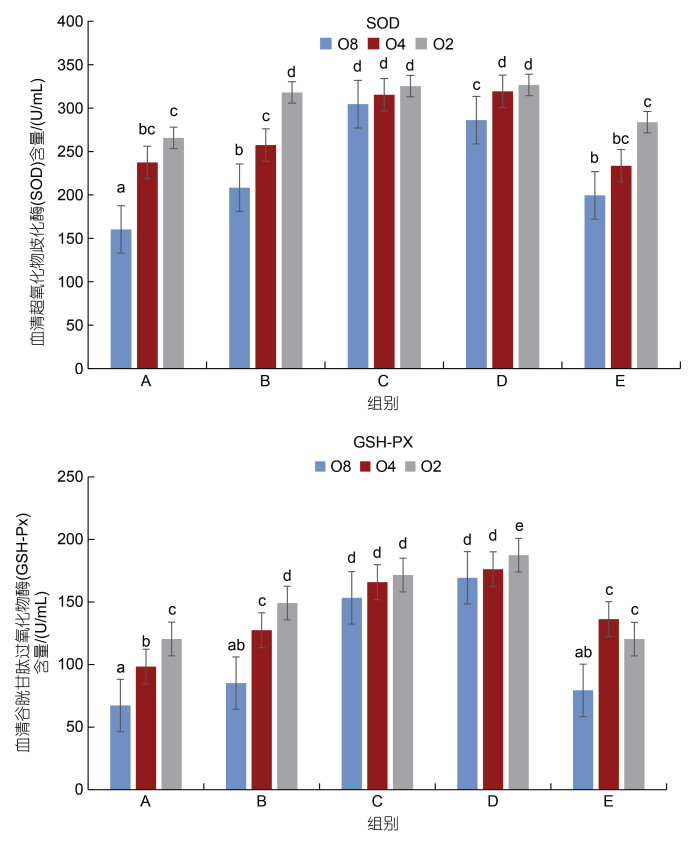 |
| 图 3 不同铁水平饲养大菱鲆在常氧条件和低氧条件下血清SOD和GSH-PX含量变化(平均值±标准误差) Fig. 3 Changes of serum SOD and GSH-PX contents in S. maximus fed at different iron levels under normoxic and hypoxic conditions (mean±SE) |
不同铁水平饲养大菱鲆对重度缺氧[DO=(2.0±0.5) mg/L]耐受情况见表 3, 随着饲料中铁水平的增加, 首尾死亡时间E < A < B < D < C, 末尾死亡时间C < D < B < E < A, 大菱鲆的死亡率D < C < B < E < A, 虽然C、D组死亡率差异不显著, 但均显著小于其他三组(P < 0.05)。
| 组别 | 数量 | 首死时间/h | 末死时间/h | 死亡历时/h | 死亡率/% |
| A | 30 | 15.0 | 41.0 | 26.0 | 70.67±3.06a |
| B | 30 | 17.5 | 40.0 | 22.5 | 49.33±1.63b |
| C | 30 | 24.0 | 35.0 | 21.0 | 35.00±2.18c |
| D | 30 | 20.0 | 37.5 | 17.5 | 31.67±2.00c |
| E | 30 | 13.5 | 40.5 | 27.0 | 61.33±0.89ab |
有研究表明缺铁或者铁吸收不足时, 不仅影响鱼类肌红蛋白、血红蛋白合成, 还会降低参与众多生命过程所必需的氧化还原酶的活性(Haase, 2010), 造成鱼类供氧不足, 易引发食欲不振、生长迟缓、抵抗力减弱、贫血甚至死亡等症状(张浩东等, 1998; Ye et al, 2007)。因此饲料中铁水平对鱼类的生长有着显著影响。本研究结果显示, 随着饲料中铁含量的增加, 实验幼鱼末均重、增重率均呈现先上升后下降趋势, 且C、D两组显著高于A、B、E三组(P > 0.05)。在尼罗罗非鱼的研究中, 其体重增长率随着饲料中铁含量增加而增加, 而超出一定范围后则出现下降, 与本研究结果一致(Shiau et al, 2003); 魏万权等(1999)对牙鲆的研究中向含铁量为323 mg/kg的基础饲料中添加0~50 mg/kg铁时, 能够显著促进牙鲆的生长, 添加80~140 mg/kg的铁反而会降低鱼的生长; 在军曹鱼(麻永财等, 2019)、印度囊鳃鲶鱼(Heteropneustes fossilis) (Zafar et al, 2020)、建鲤(Cyprinus carpio) (Ling et al, 2010)、斑点叉尾
铁作为重要的氧载体和电子传递体参与生物机体内的氧化还原供能过程, 影响着生物体的物质代谢和能量代谢(曲江斌等, 1998; Qiao et al, 2013)。在本实验中C、D组饲喂的大菱鲆幼鱼血清中葡萄糖(GLU)含量高于A、B、E三组, 这说明该两组饲喂的鱼在糖代谢方面比较旺盛, 供给机体生长发育所需要的能量较多。在生长性状对比实验中, 我们发现C、D组饲喂的鱼明显要比A、B、E三组饲喂的鱼在条件反射性游动、摄食等方面要旺盛。
而当生物体处于低氧环境时, 能量代谢会发生一系列变化, 糖类作为最有效的供能源, 也是在低氧胁迫下最常动用的能量物质(Li et al, 2018)。本研究结果显示: 随着低氧胁迫加剧, 五组铁水平饲喂的大菱鲆血清中GLU含量均呈现上升趋势, 这一结果与大口黑鲈研究相似, 说明低氧胁迫对糖代谢产生了显著影响(Sun et al, 2020); 相同低氧条件下, C、D组的GLU含量均显著高于其他三组, 该结果表明外源铁离子在适宜范围内添加, 可以提高鱼体糖代谢水平, 结合低氧耐受实验结果(表 4), 表明当GLU含量高时其提供的能量相对较高, 因此可能相应提高了鱼体低氧耐受能力。
铁作为机体基础代谢的必需微量元素之一, 在脂质代谢过程中, 参与一些酶和脂质转运蛋白的构成, 可以直接影响肝脏脂质负荷、代谢与分泌。血脂指标(TG, TC)可以反映机体脂代谢水平。本研究结果显示: 常氧条件下, 大菱鲆幼鱼血清中TG、TC含量逐渐升高, 这与在哺乳动物中的研究结果相似(张媛等, 2011)。Heinecke等(1984)认为, 体内铁不足可影响LDL的合成, 并能减弱动脉内膜粥样硬化斑块的形成, 在对中度缺铁大鼠的研究中发现, 中度缺铁会导致大鼠血清甘油三酯、胆固醇水平降低, 随着外源铁水平的增加, 显著升高; 也表明脂代谢过程中需要铁的参与, 所产生的一系列变化可能与肝脏功能活动的变化有关。
随着低氧胁迫加剧, 在C、D两组血清TG、TC含量呈下降趋势, 这与军曹鱼、鲢鱼低氧胁迫下血脂指标变化研究结果相似(胡利双, 2017; 郭志雄, 2020), 该结果表明随着低氧加剧, 鱼体耗能增加, 体内脂类物质消耗加快, TG和TC用于机体功能满足需求。然而, 低铁组(A、B)血清TG、TC含量均呈先上升后下降趋势, 高铁组(E)则呈上升趋势, 与上述结果不一致, 我们推测低铁摄入影响脂质代谢, 而低氧胁迫造成脂代谢紊乱, 但当两个胁迫因子(低铁、低氧)同时作用机体的影响机制尚不清楚, 还需要继续深入探究。
3.3 不同铁水平饲养大菱鲆在低氧胁迫条件下对其转铁蛋白的影响在生理情况下, 血清中的铁蛋白或转铁蛋白是判断机体铁缺乏或铁超负荷的有效标志物(张开羽等, 2020)。在本研究中, 无论在正常溶解氧[DO=(8.0±0.5) mg/L]还是低氧胁迫[DO=(4.0±0.5)、(2.0±0.5) mg/L]条件下, 随着饲料中铁水平的增加, 大菱鲆血清转铁蛋白含量均呈现降低趋势, 这表明饲料中上升的铁水平会抑制转铁蛋白的表达, 转铁蛋白含量越低无法结合过多游离铁造成铁超负荷状态, 过量的铁会导致过氧化物以及自由基的产生进而诱发氧化应激反应。有研究表明铁过量时, 转铁蛋白被抑制表达, 减少了机体摄取贮铁池或者红细胞生成器官中的铁, 与本研究结果一致(Yoshiga et al, 1997)。生物机体内约1 000 mg的铁储存在肝脏中、约3 mg与转铁蛋白结合后用于血液循环, 为大多数细胞供铁, 而1 800 mg的铁在红细胞中用于氧气运输和肌红蛋白合成(Hentze et al, 2004), 因此细胞内的铁和氧稳态紧密相连, 相应的传感器IRP和HIF的活动受铁和氧的可用性控制(Gassmann et al, 2015)。通过铁和氧控制系统的相互作用来调节铁水平相关基因的表达最终决定了红细胞生成的程度以及肠道对铁的吸收速度(Roy et al, 2000)。本研究中C、D、E三组Tfa含量随着低氧胁迫加剧进而降至最低, 说明急性缺氧条件下, 鱼类细胞对膳食铁的吸收和巨噬细胞的释放不能满足对红细胞生成以及充当氧气运输载体的需要, 铁吸收不足导致血色素水平降低, 体内供氧减少造成生理性缺氧, 从某种程度上讲, 缺铁具有模拟缺氧的作用, 因此, 铁和氧气必须以紧密协调的方式相互影响才能维持鱼类内环境稳态的平衡, 保证其健康生长发育。
3.4 不同铁水平饲养大菱鲆在低氧胁迫条件下对其抗氧化性的影响有研究发现, 在低氧条件下鱼类会表现出低氧应激反应, 虾虎鱼(Perccottus glenii) (Lushchak et al, 2007)、鳉鱼(Fundulus heteroclitus) (Du et al, 2016)等鱼类通过增加其抗氧化酶(T-AOC)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPx)等活性来提高其抗氧化能力(Shah et al, 2009; Wang et al, 2010; Lushchak, 2011)。本实验结果显示, 在正常溶氧量DO=(8.0±0.5) mg/L情况下C组大菱鲆血清中SOD活性最高, D组GPx活性最高, 且这两组的SOD、GPx活性显著高于A、C、E三组; 说明C、D组大菱鲆幼鱼抗氧化能力较强。在低氧胁迫实验中, A、B、E三组血清中SOD、GPx活性均呈显著升高的趋势, 说明随着低氧胁迫的加剧, 这三组均表现出低氧应激反应, 以清除鱼类机体产生的过多的ROS, 尽量减少低氧应激对机体损伤, 这与Behera等(2014)报道的通过向基础饲料中补充铁, 提高了野鲮鱼(Labeo rohita)肝脏中SOD活性的研究结果一致, 而C、D两组表现为不显著上升趋势, 但两种酶活性都显著高于其他组, 表明C、D组本身抗氧化能力较强可以更好地应对低氧应激反应, 从而表现为应激反应不强烈。不同组产生抗氧化差异的主要机理为, 铁过量(E组)时, 铁主要通过发生Fenton反应产生活性氧自由基及羟基, 损害脂质、蛋白质和DNA, 诱发氧化应激反应对鱼类机造成毒害作用, 低氧胁迫加剧了应激损伤。铁与硫共同构成铁硫中心参与多种氧化还原酶(如SOD、GSH等)的合成, 急性缺氧应激时, 铁缺乏(A、B组)导致合成原料不足, 降低了鱼类的抗氧化性, 而适量添加铁(C、D组)避免了以上两种问题。这与李根芳等(2021)的研究中适当补充外源铁离子能够提高斑马鱼肝脏细胞应对低氧胁迫的压力研究结果一致, 以上均说明饲料中适当添加铁离子可提高其抗氧化能力。
3.5 不同铁水平饲养大菱鲆在低氧胁迫条件下对其低氧耐受性的影响大量补铁可使血清铁浓度超过转铁蛋白的结合能力造成游离铁的产生(艾维, 2008), 这些游离铁通过Fenton反应催化产生过量活性氧(ROS), 造成氧化应激损伤。低氧耐受性比较实验结果显示, 在低氧DO=(2.0±0.5) mg/L应激条件下, 低铁组(A)死亡率显著高于其他四个小组, 推测是由于A组饲料中铁离子较低, 造成机体铁缺乏, 有研究显示, 缺铁自由基的产生和清除均需含铁酶类的参与, 缺铁时, 催化自由基产生和清除的酶活性都降低, 导致自由基清除障碍, 过多的自由基可攻击细胞膜、线粒体膜及溶酶体膜等, 从而对机体产生氧化损伤; 在低氧胁迫下, 加快自由基的产生, 最终导致机体失衡甚至死亡。高铁组(E)死亡率较高可能是高铁饲料饲喂后机体内储存了大量了游离铁, 产生了本身不能够清除的ROS, 低氧胁迫加剧了氧化应激损伤进而死亡。而C、D组死亡率显著低于其他三个小组, 从糖代谢、脂代谢以及抗氧化酶活性分析结果显示, 适量的铁离子, 对机体能量补给, 以及抗氧化系统的增强都具有促进作用, 因此可相对延长或提高大菱鲆耐低氧胁迫的能力。在细胞水平上, 李根芳等(2021)关于铁离子对斑马鱼肝脏细胞应答低氧胁迫的影响研究中发现, 补充外源铁离子可以提高胞内铁离子水平, 产生一些有益的ROS有助于提高低氧胁迫下细胞的生存率均与本研究结果一致。
4 结论本研究制作不同铁含量饲料对大菱鲆幼鱼进行投喂, 探究不同铁水平饲养对大菱鲆常氧下生长及耐低氧能力影响, 结果显示饲料中添加适量的铁, 能够显著改善大菱鲆的生长性能, 同时可以提高耐低氧能力。因此, 铁离子在鱼类机体应对低氧应激时发挥了重要作用, 具体的调控机制有待进一步研究。本文结果将为今后研制功能性饵料添加剂提供数据支撑, 进而为鱼类健康养殖提供新的研究思路, 同时也为深入探究鱼类铁代谢对低氧胁迫调控机制影响奠定基础。
艾维, 2008. 氧自由基和铁与肾间质损伤. 华北煤炭医学院学报, 10(5): 622-623 DOI:10.3969/j.issn.1008-6633.2008.05.020 |
冯伟, 2020. 饲料铁含量对鳙鱼生长性能、组织铁积累、转铁蛋白及铁调素的影响[D]. 武汉: 武汉轻工大学.
|
曲江斌, 厉保秋, 张春玲, 等, 1998. 铁贮存量对大鼠心肌、肝细胞超微结构及能量代谢的影响. 山东医科大学学报, 36(3): 214-216 |
李根芳, 胡瑞芹, 宋汝浩, 等, 2021. 铁离子对斑马鱼肝脏细胞应激低氧胁迫的影响[J/OL]. 上海海洋大学学报, 1-13[2022-05-26]. https://kns.cnki.net/kcms/detail/31.2024.s.20210802.1125.002.html.
|
李黎, 曹振东, 付世建, 2005. 环境缺氧(Hypoxia)及其对鱼类影响的研究进展. 现代渔业信息, 20(6): 6-8 DOI:10.3969/j.issn.1004-8340.2005.06.002 |
吴志昊, 尤锋, 王英芳, 等, 2011. 低氧和高氧对大菱鲆幼鱼红细胞核异常及氧化抗氧化平衡的影响. 上海海洋大学学报, 20(6): 808-813 |
汪华, 2012. 吉富罗非鱼对饲料铁、铜需要量的研究[D]. 武汉: 武汉工业学院.
|
张开羽, 侯斐, 张琳, 等, 2020. 血清铁蛋白与妊娠期糖尿病患者糖脂代谢的相关性研究. 海南医学, 31(21): 2743-2746 DOI:10.3969/j.issn.1003-6350.2020.21.007 |
张玉玲, 孔杰, 梁萌青, 等, 2017. 饲料中添加南极磷虾粉对营养强化阶段凡纳滨对虾亲虾产卵的影响. 中国海洋大学学报, 47(6): 69-77 |
张浩东, 任颖, 1998. 在生物体能量代谢中铁的载体作用. 生物学通报, 33(2): 16-17 |
张媛, 李红蔚, 郑芳, 等, 2011. 铁缺乏对大鼠血脂和肝脏脂质过氧化的影响. 中国慢性病预防与控制, 19(6): 577-579 |
胡利双, 2017. 低氧对鲢生理生化指标和心肌细胞凋亡的影响[D]. 重庆: 西南大学.
|
洪磊, 张秀梅, 2004. 环境胁迫对鱼类生理机能的影响. 海洋科学进展, 22(1): 114-121 DOI:10.3969/j.issn.1671-6647.2004.01.017 |
郭志雄, 2020. 低氧环境对军曹鱼幼鱼生化指标、相关基因表达的影响及其转录组学分析[D]. 湛江: 广东海洋大学.
|
郭晓丽, 2021. 热应激条件下大菱鲆心肌损伤及p53信号通路相关调控基因的功能研究[D]. 上海: 上海海洋大学.
|
麻永财, 张关荣, 李孟孟, 等, 2019. 军曹鱼营养需求与饲料研究进展. 水生生物学报, 43(3): 680-692 |
魏万权, 李爱杰, 李德尚, 等, 1999. 饲料中添加铁对牙鲆幼鱼生长的影响. 水产学报, 23(S1): 100-103 |
ANDERSEN F, MAAGE A, JULSHAMN K, 1996. An estimation of dietary iron requirement of Atlantic salmon, Salmo salar L., parr. Aquaculture Nutrition, 2(1): 41-47 DOI:10.1111/j.1365-2095.1996.tb00006.x |
BEHERA T, SWAIN P, RANGACHARULU P V, et al, 2014. Nano-Fe as feed additive improves the hematological and immunological parameters of fish, Labeo rohita H.. Applied Nanoscience, 4(6): 687-694 |
BURLESON M L, SILVA P E, 2011. Cross tolerance to environmental stressors: effects of hypoxic acclimation on cardiovascular responses of channel catfish (Ictalurus punctatus) to a thermal challenge. Journal of Thermal Biology, 36(4): 250-254 |
DU S N N, MAHALINGAM S, BOROWIEC B G, et al, 2016. Mitochondrial physiology and reactive oxygen species production are altered by hypoxia acclimation in killifish (Fundulus heteroclitus). Journal of Experimental Biology, 219(8): 1130-1138 |
GASSMANN M, MUCKENTHALER M U, 2015. Adaptation of iron requirement to hypoxic conditions at high altitude. Journal of Applied Physiology, 119(12): 1432-1440 |
GATLIN III D M, WILSON R P, 1986. Characterization of iron deficiency and the dietary iron requirement of fingerling channel catfish. Aquaculture, 52(3): 191-198 |
HAASE V H, 2010. Hypoxic regulation of erythropoiesis and iron metabolism. American Journal of Physiology Renal Physiology, 299(1): F1-F13 |
HEINECKE J W, ROSEN H, CHAIT A, 1984. Iron and copper promote modification of low density lipoprotein by human arterial smooth muscle cells in culture. Journal of Clinical Investigation, 74(5): 1890-1894 |
HENTZE M W, MUCKENTHALER M U, ANDREWS N C, 2004. Balancing acts: molecular control of mammalian iron metabolism. Cell, 117(3): 285-297 |
LI M X, WANG X D, QI C L, et al, 2018. Metabolic response of Nile tilapia (Oreochromis niloticus) to acute and chronic hypoxia stress. Aquaculture, 495: 187-195 |
LING J, FENG L, LIU Y, et al, 2010. Effect of dietary iron levels on growth, body composition and intestinal enzyme activities of juvenile Jian carp (Cyprinus carpio var.Jian). Aquaculture Nutrition, 16(6): 616-624 |
LUO Z, ZOU G Y, GAO Y, et al, 2017. Effect of dietary iron (Fe) levels on growth performance, hepatic lipid metabolism and antioxidant responses in juvenile yellow catfish Pelteobagrus fulvidraco. Aquaculture Nutrition, 23(6): 1475-1482 |
LUSHCHAK V I, 2011. Environmentally induced oxidative stress in aquatic animals. Aquatic Toxicology, 101(1): 13-30 |
LUSHCHAK V I, BAGNYUKOVA T V, 2007. Hypoxia induces oxidative stress in tissues of a goby, the rotan Perccottus glenii. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 148(4): 390-397 |
QIAO Y G, TAN B P, MAI K S, et al, 2013. Evaluation of iron methionine and iron sulphate as dietary iron sources for juvenile cobia (Rachycentron canadum). Aquaculture Nutrition, 19(5): 721-730 |
ROY C N, ENNS C A, 2000. Iron homeostasis: new tales from the crypt. Blood, 96(13): 4020-4027 |
SHAH Y M, MATSUBARA T, ITO S, et al, 2009. Intestinal hypoxia-inducible transcription factors are essential for iron absorption following iron deficiency. Cell Metabolism, 9(2): 152-164 |
SHIAU S Y, SU L W, 2003. Ferric citrate is half as effective as ferrous sulfate in meeting the iron requirement of juvenile tilapia, Oreochromis niloticus × O. aureus. The Journal of Nutrition, 133(2): 483-488 |
SINGH S, VERMA S K, KUMAR S, et al, 2017. Evaluation of oxidative stress and antioxidant status in chronic obstructive pulmonary disease. Scandinavian Journal of Immunology. 2017, 85(2): 130-137 |
SUN J L, ZHAO L L, WU H, et al, 2020. Acute hypoxia changes the mode of glucose and lipid utilization in the liver of the largemouth bass (Micropterus salmoides). Science of the Total Environment, 713: 135157 |
WANG D, WANG L H, ZHAO Y, et al, 2010. Hypoxia regulates the ferrous iron uptake and reactive oxygen species level via divalent metal transporter 1 (DMT1) Exon1B by hypoxia-inducible factor-1. IUBMB Life, 62(8): 629-636 |
XU M M, WANG J, XIE J X, 2017. Regulation of iron metabolism by hypoxia-inducible factors. Acta Physiologica Sinica, 69(5): 598-610 |
YE C X, LIU Y J, MAI K S, et al, 2007. Effect of dietary iron supplement on growth, haematology and microelements of juvenile grouper, Epinephelus coioides. Aquaculture Nutrition, 13(6): 471-477 |
YOSHIGA T, HERNANDEZ V P, FALLON A M, et al, 1997. Mosquito transferrin, an acute-phase protein that is up-regulated upon infection. Proceedings of the National Academy of Sciences of the United States of America, 94(23): 12337-12342 |
ZAFAR N, KHAN M A, 2020. Effects of dietary iron on growth, haematology, oxidative stress and hepatic ascorbic acid concentration of stinging catfish Heteropneustes fossilis. Aquaculture, 516: 734642 |
 2022, Vol. 53
2022, Vol. 53


