
中国海洋湖沼学会主办。
文章信息
- 郭祖霆, 朱阳, 曹慧敏, 李双, 周旭, 迟长凤, 苗增良. 2022.
- GUO Zu-Ting, ZHU Yang, CAO Hui-Min, LI Shuang, ZHOU Xu, CHI Chang-Feng, MIAO Zeng-Liang. 2022.
- 虎斑乌贼(Sepia pharaonis)FMRFamide G蛋白偶联受体基因的克隆与表达定位研究
- MOLECULAR IDENTIFICATION AND LOCALIZATION OF G-PROTEIN COUPLED RECEPTOR OF FMRFAMIDE IN PHARAOH CUTTLEFISH SEPIA PHARAONIS
- 海洋与湖沼, 53(6): 1548-1557
- Oceanologia et Limnologia Sinica, 53(6): 1548-1557.
- http://dx.doi.org/10.11693/hyhz20220400087
文章历史
-
收稿日期:2022-04-06
收修改稿日期:2022-06-11
神经肽泛指一类由神经内分泌组织分泌的小分子多肽, 广泛参与生物体的神经调节、生长、发育、生殖等多种生理活动(徐卫华, 1997)。目前已知的最大的神经肽家族FMRFamide相关肽(FLP)在很多门类的物种中都有表达(Price et al, 1977a; Muthal et al, 1994; Espinoza et al, 2000; Koda et al, 2002; Nichols, 2003; Grimmelikhuijzen et al, 2004)。FLP家族中以首次从光芒长文蛤(Macrocallista nimbosa)的神经节中发现的四肽FMRFamide为代表(Price et al, 1977b)。生理学研究发现其广泛参与多种生理过程, 包括摄食、心跳、渗透平衡(Salzet et al, 1994; Dockray, 2004)、变态、防御(Anderson et al, 2004)、免疫(Li et al, 2019)及繁殖、运动(Coates et al, 2002; Keating et al, 2003)等。神经肽通过其相应受体激活不同的信号通路介导不同的功能作用。作为神经递质, FMRFamide通过受体的介导激活腺苷酸环化酶, 并以cAMP为第二信使激活下游通路, 发挥相应的功能活性(Tensen et al, 1998)。
虎斑乌贼(Sepia pharaonis)是我国南海海域重要的经济头足类之一(陈道海等, 2013), 具有个体大、味道鲜美、饵料转换率高、抗病强、生长速度快等优良品质。然而, 由于人类的过度捕捞和海域环境的变化, 20世纪80年代以来虎斑乌贼的渔业资源日益缩减(励一鸣, 1989)。目前, 已攻克虎斑乌贼育苗和养殖技术。但是, 随着养殖规模的不断扩大和养殖技术的不断推广, 在其养殖过程中出现性早熟问题, 针对此开展其生殖调控机理研究势在必行。
头足类的某些物种, 如莱氏拟乌贼(Sepioteuthis lessoniana) (Ikeda et al, 2009)、商乌贼(Sepia officinalis) (Domingues et al, 2002)、大西洋鱿鱼(Illex illecebrosus) (Dawe et al, 2000)和蓝蛸(Octopus cyanea) (Heukelem, 1973)等性腺发育调控机制研究表明, 神经肽对头足类的生殖调控起重要作用(Onitsuka et al, 2009; Cao et al, 2016)。本文通过同源克隆及RACE (rapid amplification of cDNA end)技术克隆虎斑乌贼FMRFamide G蛋白偶联受体基因(SpFaGPCR)的cDNA全长序列, 并进行生物信息学分析; 利用实时荧光定量(Quantitative Real-time PCR, qRT-PCR)技术检测SpFaGPCR在雌性个体中的组织表达模式; 进一步采用原位杂交(in situ hybridization, ISH)技术定位分析SpFaGPCR在不同生殖调控相关组织中的分布特征。实验结果将为认识SpFaGPCR的功能特征提供基础数据, 对于进一步深入探究FMRFamide通过SpFaGPCR参与生殖调控的生理代谢过程具有一定的理论意义。
1 材料与方法 1.1 实验材料实验选用的野生虎斑乌贼[体重: (81.13±16.6) g, 胴长: (8.25±0.9) cm]购自广东省湛江市硇洲岛渔民。经乙醇麻醉后活体解剖, 取出视叶、脑、视网膜、副缠卵腺、缠卵腺等组织于RNA保存液中, 4 ℃过夜后转入–80 ℃冰箱保存备用; 另一部分固定于4%多聚甲醛4 ℃过夜。
1.2 全长cDNA的克隆 1.2.1 总RNA的提取及cDNA的合成Trizol法提取总RNA, 具体方法参照Zheng等(2021)。1.2% 琼脂糖及核酸分析仪(Eppendorf)分别检测总RNA的完整性、纯度及浓度。反转录合成cDNA根据试剂盒(TaKaRa, Japan)说明书进行, 保存于–20 ℃备用。
1.2.2 SpFaGPCR全长cDNA的克隆根据SMARTerTM RACE cDNA Amplification Kit (Clontech)说明书利用1.0 μg脑组织总RNA制备3′端和5′端RACE模板。设计虎斑乌贼FaGPCR基因的简并引物SpFaGPCR-F/R (表1)扩增、测序保守区序列。根据测序结果设计5′/3′端特异性RACE引物5′/3′-SpFaGPCR-outter/inner (Tm>70 ℃) (表1)分别进行两端未知序列的扩增。第一轮扩增的反应体系为: Ex Taq Mix 25 μL, 3′/5′-RACE模板 2.0 μL, 5′/3′-SpFaGPCR-outter 1.0 μL, 5′/3′-RACE Adapter 1.0 μL, RNase-free ddH2O 21 μL; 反应程序为94 ℃ 30 s, 72 ℃ 3 min, 5个循环; 94 ℃ 30 s, 70 ℃ 30 s, 72 ℃ 3 min, 5个循环;94 ℃ 30 s, 68 ℃ 30 s, 72 ℃ 3 min, 25个循环; 以第一轮的PCR产物为模板进行第二轮巢式PCR, 反应体系和程序参照第一轮。扩增产物经电泳检测、凝胶回收、连接转化后, 挑阳性单克隆送至上海生工进行测序拼接后获得SpFaGPCR的cDNA全长序列。
| 引物 | 序列(5′~3′) |
| 简并引物 | |
| SpFaGPCR-F | CTGGRCAACACSYYGAGTAT |
| SpFaGPCR-R | GGARACTSGCAGATAAKGMMA |
| RACE | |
| 5′-RACE Adapter | GGACAGTGGTGTAACG |
| 5′-SpFaGPCR-outter | ACGTGTGATTTCCAAG |
| 5′-SpFaGPCR-inner | ACCGCCTGGGTCCCCGCCT |
| 3′-RACE Adapter | TGGAAGCAGATCAACTTGAGTCAGGT |
| 3′-SpFaGPCR-outter | GTGGAAAGCATCAATCATCAGGC |
| 3′-SpFaGPCR-inner | ACGGGTCAGGTTCAGCATCAGGG |
| qRT-PCR | |
| Spβ-actin-F | GCCAGTTGCTCGTTACAG |
| Spβ-actin-R | GCCAACAATAGATGGGAAT |
| SpGAPDH-F | TGGTTCCTTGGCTTTTGCT |
| SpGAPDH-R | GGTGGTGGTGCGGGTAGT |
| FaGPCR-F | ATTATTGTTCTCAGCCGACGAA |
| FaGPCR-R | GGAAACTGGCAGATAAGGAAA |
| ISH | |
| A-SpFaGPCR-F | CTCGAGGGCTACTATTGGTGGTTTATC |
| A-SpFaGPCR-R | CCAGTCATTGTGGTTTCG |
| S-SpFaGPCR-F | GGCTACTATTGGTGGTTTATC |
| S-SpFaGPCR-R | CCAGTCATTGTGGTTTCG |
序列的同源比对、多序列比对和修饰、开放阅读框(ORF)的查找、氨基酸序列的预测、信号肽、蛋白的理化性质和蛋白结构域的预测、进化树的构建参考朱阳(2020)。
1.4 组织表达差异性采用qRT-PCR检测性成熟时期雌性个体SpFaGPCR的组织分布特点。按照试剂盒[TB GreenTM Premix Ex TaqTM II (Tli RNaseH Plus)]说明书操作。反应体系为: TB Green 12.5 μL、qSpFaGPCR-F/R 1.0 μL、cDNA 2.0 μL、RNase-free ddH2O 8.5 μL; 反应程序为: 95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 45 s, 40次循环。每个组织3个生物学重复, 每个样品3个平行。内参基因选用虎斑乌贼β-actin基因和GAPDH基因(见表1)。
采用2–ΔΔCt方法进行双内参计算和统计, 采用SPSS 18.0进行单因素方差分析分析(One-way ANOVA)和显著性差异分析(Duncan法), P<0.05为显著差异; 绘图采用GraphPad软件。
1.5 原位组织分布 1.5.1 组织切片固定过夜的各组织PBS清洗后, 经梯度甲醇(25%, 50%, 75%, 100%)逐级脱水2× 45 min/次, 二甲苯透明2×45 min/次, 继而透蜡3×1 h/次后包埋, 切片7 μm, 保存于–20 ℃备用。
1.5.2 探针制备原位杂交探针的引物A-SpFaGPCR-F/R、S-SpFaGPCR-F/R见表1。反义探针在F引物前加上启动子序列(GATCACTAATACGACTCACTATAGG), 正义探针在R引物前加上启动子序列。以脑组织cDNA为模板, 扩增反应及程序见表1。PCR产物作为模板利用DIG RNA Labeling Mix制备探针, 方法同朱阳(2020)。探针经纯化、质量和浓度检测后于–80 ℃保存备用。
1.5.3 原位杂交具体的方法步骤参照Zheng等(2020), 保存的组织切片经二甲苯脱蜡处理, 100%-90%-80%-70%-30%的乙醇梯度复水, 蛋白酶K 37 ℃消化8 min, Tris/甘氨酸终止消化反应。4%多聚甲醛再固定, 4×SSC孵育组织切片后滴加预杂交液(去离子甲酰胺500 μL, 20×SSC 250 μL, 50×Denhard’s solution 100 μL, 鲑鱼精子单链DNA 10 μL, RNase-free ddH2O 140 μL) 42 ℃预杂交2 h。预杂交结束后, 替换为预先80 ℃变性5 min的杂交液(去离子甲酰胺500 μL, 20×SSC 250 μL, 50×Denhard’s solution 100 μL, 鲑鱼精子单链DNA 10 μL, RNase-free ddH2O 90 μL, 1 g/mL硫酸葡聚糖50 μL, 探针3 ng/μL)置于50 ℃的恒温培养箱中孵育12~16 h。
1.5.4 Anti-DIG抗体孵育第二天杂交结束后, 组织切片用2×SSC、1×SSC、0.5×SSC、0.2×SSC梯度清洗2次, 每级15 min。将配置好的封闭液(1 mL PBS中各加20 μL山羊血清、20 μL 100 mg/mL BSA)滴加到组织片上室温封闭2~3 h, 抗体(1 : 1 000) 4 ℃孵育过夜。TBST清洗若干次后, 采用NBT/BCIP进行显色反应, 半小时更换一次显色液。显色完成后, 封片、拍照。
2 结果 2.1 cDNA全长序列分析将简并引物扩增序列与3′-RACE、5′-RACE扩增序列进行拼接, 获得SpFaGPCR的cDNA全长序列(图1), 共1 514 bp, 包含一个222 bp的5′-非编码区(untranslated region, UTR), 35 bp的3′-UTR, 1 257 bp 的开放阅读框(opening reading frame, ORF), 编码一个418个氨基酸残基组成的多肽。预测的多肽对分子量(MW)为49.8 kDa, 理论等电点(pI)为9.76。SignalP预测推导的SpFaGPCR的N端没有信号肽; SMART结构域分析显示SpFaGPCR有7个跨膜域, 预测有7个糖基化位点、36个磷酸化位点; 二级结构预测分析SpFaGPCR有α-螺旋和无规则卷曲。
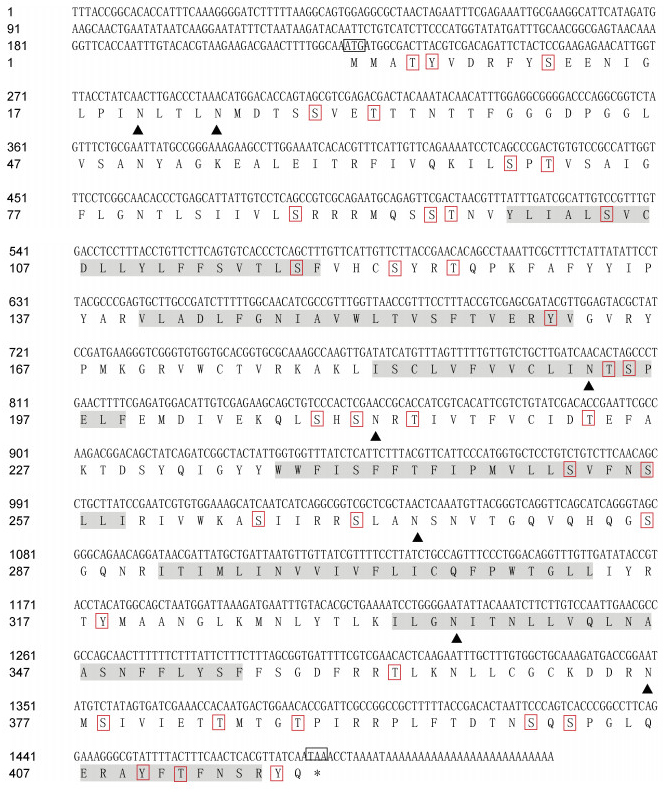 |
| 图 1 SpFaGPCR的核苷酸序列和预测的氨基酸序列 Fig. 1 Nucleotide sequence and deduced amino acid sequence of SpFaGPCR 注: 起始密码子(ATG)和终止密码子(TAA)用黑色线框标示, 跨膜区用灰色阴影标示, 糖基化位点用黑色三角号(▲)标示, 磷酸化位点用红色线框标示, 左侧数字分别代表对应的核苷酸和氨基酸编号分别用左侧数字代表 |
如图2所示, SpFaGPCR氨基酸序列与头足类动物曼氏无针乌贼(Sepiella japonica)、双斑蛸(Octopus bimaculoides)和双壳类动物美洲牡蛎(Crassostrea virginica)和长牡蛎(Crassostrea gigas)序列具有高度相似性, 相似性分别为98%、82%、65%和62%。
 |
| 图 2 SpFaGPCR (用▼表示)与其他代表物种FaGPCR的多序列比对 Fig. 2 Multiple alignment of representative species FaGPCR and SpFaGPCR (noted by▼) 注: 代表物种的GenBank号为: 曼氏无针乌贼(OL765296); 双斑蛸(XP_014770365.1); 美洲牡蛎(XP_022302913.1); 长牡蛎(XP_019929701.2)。TM: 跨膜区; IL: 胞内环; EL: 胞外环 |
用ClustalW对SpFaGPCR以及其他代表物种FaGPCR的氨基酸序列进行分析(图2), SpFaGPCR分别具有三个胞内环(Intracellular Loop, IL)和三个胞外环(Extracellular Loop, EL), 其中跨膜区(Transmembrane, TM)的序列更加保守。
SpFaGPCR与代表物种FaGPCR的最大似然法(Bootstrap 10000)系统进化分析(图3)显示: 虎斑乌贼与曼氏无针乌贼FaGPCR等头足类首先聚为一支, 再与双壳纲动物聚为姐妹支, 异盘并殖吸虫(Paragonimus heterotremus) FaGPCR作为外群。因此, 系统进化分析结果与传统的分类结果高度一致。
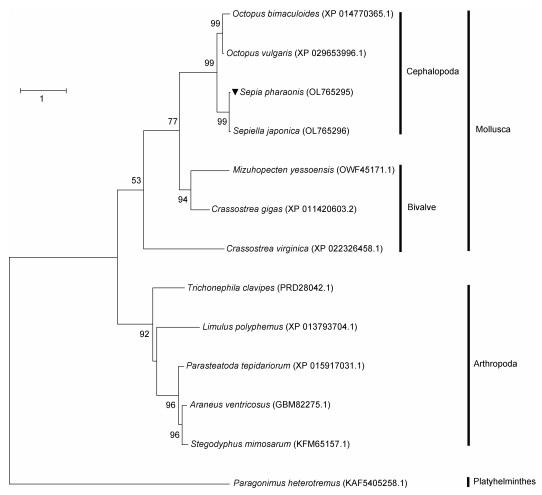 |
| 图 3 SpFaGPCR (用▼表示)与其他12种代表物种FaGPCR构建的最大似然法进化树 Fig. 3 SpFaGPCR (noted by ▼) and FaGPCRs of other 12 representative species are used to construct a phylogenetic tree based on the maximum likelihood method 注: 代表物种的GenBank号为: 曼氏无针乌贼(OL765296); 真蛸(Octopus vulgaris) (XP_029653996.1); 双斑蛸(XP_014770365.1); 虾夷扇贝(Mizuhopecten yessoensis) (OWF45171.1); 长牡蛎(XP_011420603.2); 美洲牡蛎(XP_022326458.1); 马蹄蟹(Limulus polyphemus) (XP_013793704.1); 温室希蛛(Parasteatoda tepidariorum) (XP_015917031.1); 大腹园蛛(Araneus ventricosus) (GBM82275.1); 隆头蛛(Stegodyphus mimosarum) (KFM65157.1); 金丝网蛛(Trichonephila clavipes) (PRD28042.1); 异盘并殖吸虫(Paragonimus heterotremus) (KAF5405258.1) |
选取成熟雌性虎斑乌贼十五种组织检测SpFaGPCR的组织分布表达, 以表达量最低的卵巢为参照(设定为1), 结果如图4所示。实验结果表明, SpFaGPCR在虎斑乌贼雌性的多种组织中均有表达。SpFaGPCR在脑、视叶、视腺和缠卵腺中的表达显著高于其他组织(P<0.05), 并且其在视叶的表达量最高(P<0.05)。而SpFaGPCR在其他组织的表达无显著差异(P>0.05)。
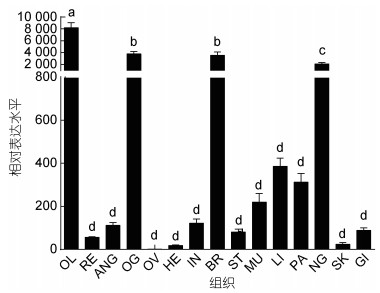 |
| 图 4 SpFaGPCR基因在虎斑乌贼不同组织中的表达 Fig. 4 The expression level of SpFaGPCR gene in different tissues 注: 结果以平均值±标准差(n=3)表示, 误差线上方不同字母代表存在显著差异(P<0.05)。组织缩写: OL: 视叶; RE: 视网膜; ANG: 副缠卵腺; OG: 视腺; OV: 卵巢; HE: 心脏; IN: 肠道; BR: 脑; ST: 胃; MU: 肌肉; LI: 肝脏; PA: 胰脏; NG: 缠卵腺; SK: 皮肤; GI: 鳃 |
如图5所示, 在视叶组织中, HE染色可以清晰观察到从外到内的组织结构依次为深层视网膜外细胞颗粒层、网质层、深层视网膜内细胞颗粒层、边缘髓质区、中央髓质区(图5-1)。原位杂交结果表明, 与正义探针相比(图5-2), 在中央髓质区域有SpFaGPCR的强烈阳性杂交信号, 边缘髓质区域的阳性信号较弱; 视叶皮层未检测到信号(图5-3, 4)。
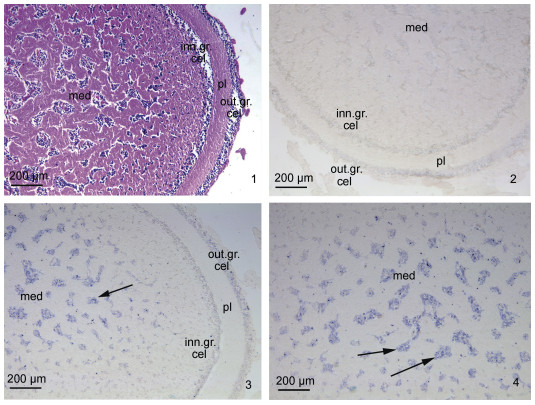 |
| 图 5 视叶组织的HE染色及SpFaGPCR基因mRNA的原位组织定位 Fig. 5 HE staining and localization of SpFaGPCR mRNA in the optic lobe 注: 1. 视叶组织的HE染色; 2: 正义探针; 3~4: 反义探针。med: 髓质; out.gr.cel: 深层视网膜外细胞颗粒层; inn.gr.cel: 深层视网膜内细胞颗粒层; pl: 网织层 |
在视网膜组织中(图6), HE染色可以清晰观察到感光细胞层、支持细胞层、上皮细胞层(图6-1)。与正义探针相比(图6-2, 4), 反义探针孵育后的视网膜只在视网膜感光细胞的感光层中被观察到了强烈的SpFaGPCR mRNA阳性杂交信号(图6-3, 5)。
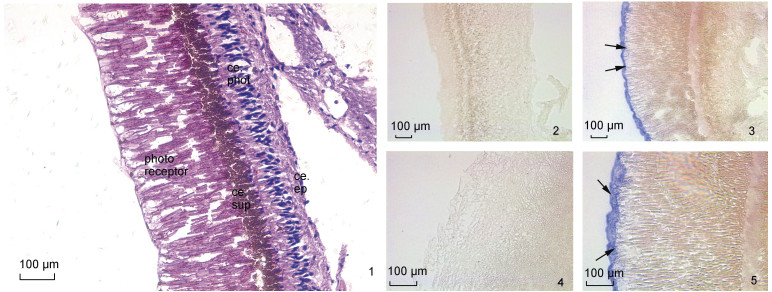 |
| 图 6 视网膜组织的HE染色及SpFaGPCR mRNA的原位组织定位 Fig. 6 HE staining and SpFaGPCR mRNA localization in the retina 注: 1. 视网膜的HE染色; 2、4. 正义探针; 3、5. 反义探针。photoreceptor: 感光细胞感受器部分; ce.phot: 感光细胞细胞体部分; ce.sup: 支持细胞; ce.ep: 上皮细胞 |
如图7所示: 与正义探针的无杂交信号对比(图7-2), 反义探针孵育后的缠卵腺叶瓣上有很明显的阳性杂交信号, 且杂交信号分布在叶瓣的外侧, 即纤毛生长的部位(图7-3, 4)。
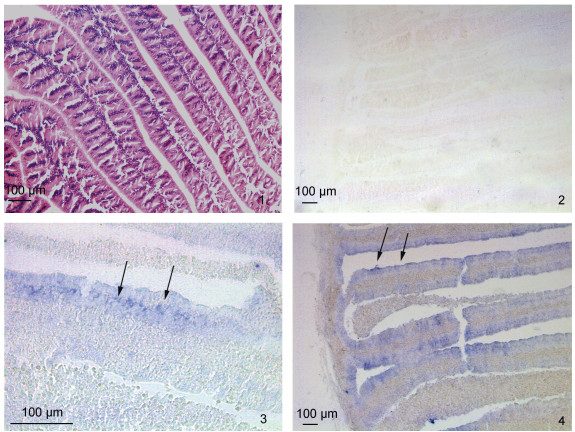 |
| 图 7 缠卵腺组织的HE染色及SpFaGPCR mRNA的原位组织定位 Fig. 7 HE staining and SpFaGPCR mRNA localization in the nidamental gland 注: 1. 缠卵腺的HE染色; 2. 正义探针; 3~4: 反义探针。阳性信号呈蓝色(黑色箭头表示) |
GPCR作为机体内非常重要的细胞信号转导受体家族之一, 广泛参与调控细胞对光照、激素、神经递质、趋化因子等的应答, 对调节生物体正常的生理代谢具有非常重要的意义(周庆同等, 2021)。神经肽、神经递质、神经调质、神经激素在机体内调控作用的发挥均需要通过靶细胞膜上受体的介导将信号转导到细胞内。GPCR是其中的一大类受体家族, 属于视紫质受体家族, 具有明显的七跨膜结构域。
本研究利用同源克隆和RACE技术, 获得了虎斑乌贼FMRFamide的G蛋白偶联受体(SpFaGPCR)基因的cDNA全长, 生物信息分析其有7个跨膜区; 多序列比对分析发现其与目前在头足类中发现的FaGPCR高度相似; 系统进化分析显示SpFaGPCR与头足纲、双壳纲等软体动物FaGPCR聚为姐妹支, 多角度证实了本研究克隆获得的SpFaGPCR属于FMRFamide的GPCR。预测SpFaGPCR有多个糖基化和磷酸化位点, 这可能有利于胞外部分糖基化和配体的结合及胞内磷酸化介导的脱敏作用和细胞内吞作用(Mertens et al, 2006)。实时荧光定量结果显示, SpFaGPCR在雌性个体的表达有显著差异, 主要在中枢神经系统和生殖系统中表达, 这与FLP是一种神经活性肽主要发挥神经内分泌的调控作用相关。SpFaGPCR在缠卵腺中有较高的表达量, 推测其可能参与到虎斑乌贼排卵等生殖活动中; 其次, SpFaGPCR在雌性个体的心脏、肌肉、肠道、胃等收缩性能较强的组织中也有一定的表达量, 可能与已发现的FMRFamide调控肌肉运动功能相关, 这一结果与FMRFamide高丰度表达于长牡蛎外套膜参与肌肉收缩相一致(Li et al, 2019)。GPCR被FLP激活后可激活或抑制一种特异酶(如cAMP、cGMP等), 并作为第二信使激活蛋白激酶, 蛋白激酶进而又激活磷酸激酶, 将ATP转换为ADP来介导相关反应; 另外, 被活化的GPCR也可以激活一些离子通道如Ga2+通道等, 引起膜电位的改变, 从而调节生物体的生理活动。Chin等(1994)报道发现FMRFamide受体对不同FMRFamide多肽的结合能力不同, 并且发现FMRFamide受体在接受FMRFamide类多肽结合激活时, GTP是必不可少的。推测, FMRFamide在细胞膜上与跨膜的FaGPCR结合, 参与介导各项生理活动的调控作用。
在解剖学上, 头足类的视叶由深层视网膜和髓质区两部分构成。其中, 深层视网膜由内颗粒细胞层、网织区和外颗粒细胞层组成, 其中, 网织区由四层放射状神经纤维组成(Moore, 1919; Newth, 1972)。研究表明, 头足类的深层视网膜构成其视觉分析系统, 而髓质是神经中枢(CNS)与运动和记忆相关的区域(Moore, 1919)。视神经将视网膜与视叶直接相连(Wells, 1978), 但目前对于视叶和视网膜两者在视神经活动中所起的作用尚不明确。Saidel(1982)报道视叶的神经纤维与基叶和嗅叶的神经纤维相互连接。Di Cosmo和Di Cristo报道在真蛸CNS的传出神经纤维中分别检测到了FMRFamide和GnRH的阳性信号(Di Cosmo et al, 1998), 这些神经肽甚至可以在深层视网膜内层、丛状层和外层发挥生理作用, 进而调节传入的视觉系统信号。在另一项研究中Di Cosmo等(1998)指出, 神经肽APGWamide分布于嗅叶的神经细胞和神经纤维。尽管有免疫阳性的神经纤维不与腺体细胞相接触, 但结果表明APGWamide能协助FMRFamide和GnRH参与控制视腺的活动。本文ISH结果表明SpFaGPCR强烈表达于视叶的中央髓质区、缠卵腺的叶瓣外层、视网膜的感光细胞感光体部分, 从而我们推测神经肽FMRFamide或者FLP可能通过与SpFaGPCR的互作在“视叶-脑-缠卵腺”通路上在神经内分泌水平调控生殖。Wells(1978)研究证明, 真蛸视腺神经被切除或大脑的拟柄状区被破坏将导致腺体增大、性腺增生。虽然效果不如切除视腺明显, 但是切断视神经或切除视叶也会产生类似的反应。据此他们推测, 光照可调控视腺的生理功能, 由复杂的神经网络介导该种抑制, 该信号网络从视网膜到视叶, 再到视腺。此外, 对人类视网膜GPCR的研究同样表明GPCR对视觉的形成起关键作用(Nemet et al, 2015), 据此, 我们推测虎斑乌贼视网膜感光细胞中的SpFaGPCR可能参与介导其视觉信号的形成与传导, 进而调控虎斑乌贼的生殖活动。
4 结论本研究采用同源克隆法与RACE技术首次获得了虎斑乌贼FMRFamide的G蛋白偶联受体基因cDNA全长序列, qRT-PCR技术检测结果表明SpFaGPCR在虎斑乌贼视叶、视腺、脑、缠卵腺中表达量显著高于其他组织, ISH技术定位分析发现SpFaGPCR在虎斑乌贼视叶的髓质区、视网膜的感光细胞和缠卵腺的瓣叶外层具有明显的阳性杂交信号。
朱阳, 2020. 虎斑乌贼两种FMRFamide受体基因的克隆和FMRFamide功能研究初探[D]. 舟山: 浙江海洋大学.
|
励一鸣, 1989. 全世界头足类资源及其动态(1981—1986). 现代渔业信息, 4(8): 13-19 |
陈道海, 郑亚龙, 2013. 虎斑乌贼(Sepia pharaonis)繁殖行为谱分析. 海洋与湖沼, 44(4): 931-936 |
周庆同, 戴之卓, 赵素文, 2021. G蛋白偶联受体的共同激活机制. 自然杂志, 43(1): 45-52 DOI:10.3969/j.issn.0253-9608.2021.01.007 |
徐卫华, 1997. 昆虫神经肽研究进展. 生物化学与生物物理进展, 24(2): 116-120 |
ANDERSON P A V, THOMPSON L F, MONEYPENNY C G, 2004. Evidence for a common pattern of peptidergic innervation of cnidocytes. The Biological Bulletin, 207(2): 141-146 DOI:10.2307/1543588 |
CAO Z H, SUN L L, CHI C F, et al, 2016. Molecular cloning, expression analysis and cellular localization of an LFRFamide gene in the cuttlefish Sepiella japonica. Peptides, 80: 40-47 DOI:10.1016/j.peptides.2015.10.005 |
CHIN G J, PAYZA K, PRICE D A, et al, 1994. Characterization and solubilization of the FMRFamide receptor of squid. The Biological Bulletin, 187(2): 185-199 DOI:10.2307/1542241 |
COATES J C, DE BONO M, 2002. Antagonistic pathways in neurons exposed to body fluid regulate social feeding in Caenorhabditis elegans. Nature, 419(6910): 925-929 DOI:10.1038/nature01170 |
DAWE E G, COLBOURNE E B, DRINKWATER K F, 2000. Environmental effects on recruitment of short-finned squid (Illex illecebrosus). ICES Journal of Marine Science, 57(4): 1002-1013 DOI:10.1006/jmsc.2000.0585 |
DI COSMO A, DI CRISTO C, 1998. Neuropeptidergic control of the optic gland of Octopus vulgaris: FMRF-amide and GnRH immunoreactivity. Journal of Comparative Neurology, 398(1): 1-12 DOI:10.1002/(SICI)1096-9861(19980817)398:1<1::AID-CNE1>3.0.CO;2-5 |
DOCKRAY G J, 2004. The expanding family of-RFamide peptides and their effects on feeding behaviour. Experimental Physiology, 89(3): 229-235 DOI:10.1113/expphysiol.2004.027169 |
DOMINGUES P M, SYKES A, ANDRADE J P, 2002. The effects of temperature in the life cycle of two consecutive generations of the cuttlefish Sepia officinalis (Linnaeus, 1758), cultured in the Algarve (South Portugal). Aquaculture International, 10(3): 207-220 DOI:10.1023/A:1022148802078 |
ESPINOZA E, CARRIGAN M, THOMAS S G, et al, 2000. A statistical view of FMRFamide neuropeptide diversity. Molecular Neurobiology, 21(1/2): 35-56 |
GRIMMELIKHUIJZEN C J P, WILLIAMSON M, HANSEN G N, 2004. Neuropeptides in Cnidarians [M]//FAIRWEATHER I. Cell Signalling in Prokaryotes and Lower Metazoa. Dordrecht: Springer: 115-139.
|
HEUKELEM W V, 1973. Growth and life-span of Octopus cyanea (Mollusca: Cephalopoda). Journal of Zoology, 169(3): 299-315 DOI:10.1111/j.1469-7998.1973.tb04559.x |
IKEDA Y, SUGIMOTO C, YONAMINE H, et al, 2009. Method of ethanol anaesthesia and individual marking for oval squid (Sepioteuthis lessoniana Férussac, 1831 in Lesson 1830–1831). Aquaculture Research, 41(1): 157-160 DOI:10.1111/j.1365-2109.2009.02305.x |
KEATING C D, KRIEK N, DANIELS M, et al, 2003. Whole-genome analysis of 60 G protein-coupled receptors in Caenorhabditis elegans by gene knockout with RNAi. Current Biology, 13(19): 1715-1720 DOI:10.1016/j.cub.2003.09.003 |
KODA A, UKENA K, TERANISHI H, et al, 2002. A novel amphibian hypothalamic neuropeptide: isolation, localization, and biological activity. Endocrinology, 143(2): 411-419 DOI:10.1210/endo.143.2.8630 |
LI M J, WANG M, WANG W L, et al, 2019. The immunomodulatory function of invertebrate specific neuropeptide FMRFamide in oyster Crassostrea gigas. Fish & Shellfish Immunology, 88: 480-488 |
MERTENS L, CLINCKSPOOR I, JANSSEN T, et al, 2006. FMRFamide related peptide ligands activate the Caenorhabditis elegans orphan GPCR Y59H11AL. 1. Peptides, 27(6): 1291-1296 DOI:10.1016/j.peptides.2005.11.017 |
MOORE A R, 1919. The selective action of nicotine on the central nervous system of the squid, Loligo pealii. Journal of General Physiology, 1(5): 505-508 DOI:10.1085/jgp.1.5.505 |
MUTHAL A V, CHOPDE C T, 1994. Anxiolytic effect of neuropeptide FMRFamide in rats. Neuropeptides, 27(2): 105-108 DOI:10.1016/0143-4179(94)90050-7 |
NEMET I, ROPELEWSKI P, IMANISHI Y, 2015. Rhodopsin trafficking and mistrafficking: signals, molecular components, and mechanisms. Progress in Molecular Biology and Translational Science, 132: 39-71 |
NEWTH D R, 1972. The anatomy of the nervous system of Octopus vulgaris. Journal of Neurology, Neurosurgery & Psychiatry, 35: 3-421 |
NICHOLS R, 2003. Signaling pathways and physiological functions of Drosophila melanogaster FMRFamide-related peptides. Annual Review of Entomology, 48: 485-503 DOI:10.1146/annurev.ento.48.091801.112525 |
ONITSUKA C, YAMAGUCHI A, KANAMARU H, et al, 2009. Molecular cloning and expression analysis of a GnRH-Like dodecapeptide in the swordtip squid, Loligo edulis. Zoological Science, 26(3): 203-208 DOI:10.2108/zsj.26.203 |
PRICE D A, GREENBERG M J, 1977a. Purification and characterization of a cardioexcitatory neuropeptide from the central ganglia of a bivalve mollusc. Preparative Biochemistry, 7(3/4): 261-281 |
PRICE D A, GREENBERG M J, 1977b. Structure of a molluscan cardioexcitatory neuropeptide. Science, 197(4304): 670-671 |
SAIDEL W M, 1982. Connections of the octopus optic lobe: an HRP study. The Journal of Comparative Neurology, 206(4): 346-358 |
SALZET M, BULET P, WATTEZ C, et al, 1994. FMRFamide-related peptides in the sex segmental ganglia of the Pharyngobdellid leech Erpobdella octoculata: identification and involvement in the control of hydric balance. European Journal of Biochemistry, 221(1): 269-275 |
TENSEN C P, COX K J, SMIT A B, et al, 1998. The lymnaea cardioexcitatory peptide (LyCEP) receptor: a G-protein-coupled receptor for a novel member of the RFamide neuropeptide family. The Journal of Neuroscience, 18(23): 9812-9821 |
WELLS M J, 1978. Octopus: Physiology and Behaviour of An Advanced Invertebrate. London: Chapman and Hill
|
ZHENG L B, QIU J Y, CHEN J, et al, 2020. Histopathological changes and piscidin 5-like location in infected Larimichthys crocea with parasite Cryptocaryon irritans. Fish & Shellfish Immunology, 99: 52-58 |
ZHENG L B, QIU J Y, LIU H H, et al, 2021. Molecular characterization and antiparasitic activity analysis of a novel piscidin 5-like type 4 from Larimichthys crocea. Molecular Immunology, 129: 12-20 |
 2022, Vol. 53
2022, Vol. 53


