
中国海洋湖沼学会主办。
文章信息
- 马文刚, 尹洪洋, 孙春阳, 王兆国, 魏一凡, 冯博轩, 奉杰, 许强, 李秀保, 王爱民. 2022.
- MA Wen-Gang, YIN Hong-Yang, SUN Chun-Yang, WANG Zhao-Guo, WEI Yi-Fan, FENG Bo-Xuan, FENG Jie, XU Qiang, LI Xiu-Bao, WANG Ai-Min. 2022.
- 热带典型珊瑚岛礁海洋牧场花刺参底播增殖容量及其生态效应预测
- THE ECOLOGICAL CARRYING CAPACITY OF STICHOPUS MONOTUBERCULATUS AND ECOLOGICAL EFFECT PREDICTION IN A TROPICAL CORAL REEF ISLAND MARINE RANCHING AREA
- 海洋与湖沼, 53(6): 1573-1584
- Oceanologia et Limnologia Sinica, 53(6): 1573-1584.
- http://dx.doi.org/10.11693/hyhz20220400092
文章历史
-
收稿日期:2022-04-07
收修改稿日期:2022-05-11
2. 大连海洋大学 辽宁大连 116023;
3. 中国科学院海洋研究所 山东青岛 266071
2. Dalian Ocean University, Dalian 116023, China;
3. Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China
海参是世界各大洋中广泛分布的古老类群, 尤其在热带海洋生态系统中具有重要的生态学功能(Purcell et al, 2016)。据调查, 热带海域的沉积食性海参在摄取底质有机碎屑的过程中造成的生物扰动促进表层沉积物颗粒再悬浮, 使珊瑚可再次利用水体营养物质, 扰动过程也促进了沉积物有机质的再循环, 加强了系统能流与物流的传递(田胜艳等, 2009; Purcell et al, 2016); 同时海参生长代谢释放的氨氮等营养盐不仅提高了寡营养珊瑚礁海区生物群落的生产力, 其还能通过自身的消化过程平衡海水碱度, 一定程度上有助于缓解海洋酸化对珊瑚礁的影响, 提高珊瑚礁生态系统的健康水平(杨红生等, 2016; Purcell et al, 2016)。
近年来, 随着国际市场对海参的需求增加, 可供人类食用的高价值海参长期面临过度捕捞的压力, 海参资源持续衰退(Jontila et al, 2014; Dolorosa et al, 2017)。热带海参因缺少人工底播增殖产业, 野生资源受到过度捕捞的影响更大。发展热带海参人工底播增殖可有效降低资源采捕压力, 保护珊瑚礁生态系统, 同时保证渔民获得稳定的经济收益。花刺参(Stichopus monotuberculatus)属于棘皮动物门(Echinodermata)、海参纲(Holothuroidea)、辛那参目(Synallactida)、刺参科(Stichopodidae), 俗称“黄肉参”, 广泛分布于我国华南沿海地区, 是我国南方热带海参的代表种类之一, 具有广阔的食用和医用开发价值(张玥等, 2021)。花刺参已突破规模化苗种繁育技术, 但底播增殖技术仍在研发探索过程中(廖玉麟, 1997; Hu et al, 2010)。热带珊瑚岛礁型海洋牧场是开展各种礁栖型海参底播增殖的绝佳区域, 优良的珊瑚礁生境和有效的资源管护可保证增殖效果, 海参的生态修复功能可有效维系珊瑚礁生态系统的健康(杨红生等, 2020)。三亚蜈支洲岛海洋牧场的珊瑚礁生态系统发达, 生物资源种类丰富, 红腹海参、绿刺参等野生海参生物多样性较高(黄端杰等, 2020), 是开展花刺参底播增殖的理想区域。
底播增殖前的生态容量评估环节是避免盲目制定放流计划带来投放密度过高引发生态风险等问题的有效手段(杨东等, 2017), 尤其在脆弱的珊瑚礁海洋牧场区。基于系统食物网结构和生物个体能量收支过程建立的静态生态系统能流模型, 在近年来常用于分析在生态系统背景下的海洋牧场建设效果(Heymans et al, 2016; 杨昊陈, 2019)。该模型是研究生态系统能量传递过程、生物群落间相互作用关系以及开展后续的目标种类增殖潜力评估的首选工具, 已广泛用于多种增殖种类的生态容量评估(张明亮等, 2013; 刘岩等, 2019)。
本文基于2020~2021年在蜈支洲岛海洋牧场开展的生物资源调查数据, 构建了近岛区珊瑚礁生态系统的Ecopath模型, 分析该生态系统结构和能量流动过程, 评估近岛区花刺参的增殖生态容量, 旨在为该海洋牧场的花刺参科学底播增殖工作提供参考依据。
1 材料与方法 1.1 数据来源蜈支洲岛位于海南省三亚市东部的海棠湾内, 岛中心的地理坐标为109°45′44″E, 18°18′43″N。为改善蜈支洲岛海域生态环境、恢复渔业资源, 自2010年起先后投放人工鱼礁7.5余万空方建设海洋牧场, 开展珊瑚礁基础生境修复和生物资源养护, 同步发展休闲旅游业。目前, 已成为我国第一个热带国家级休闲旅游型海洋牧场示范区。
蜈支洲岛海洋牧场位于我国重要的岸礁型珊瑚礁分布区, 海洋牧场经人为划分成近岛区及远岛毗邻区两部分, 近岛区主要为拥有高生物多样性的自然珊瑚礁生态系统, 经前期调查评估发现10 m以浅珊瑚礁海域(近岛区)是热带海参的优良栖息地, 分布有多种野生海参资源(黄端杰等, 2020), 因此将近岛区作为适于开展花刺参生态容量评估的目标海域。为评估花刺参的底播增殖生态容量, 于2020~2021年进行了4个季度月(2020年7月和11月, 2021年1月和4月)的生物资源及环境因子调查(马文刚等, 2022), 期间收集实验区域内的游泳生物、底栖生物等全部生物群落的数据并利用多种仪器获取水体叶绿素浓度、深度等数项环境参数。生物量等各项数据获取方式详见下文“功能组参数来源”部分, 获得的数据用于进行容量评估。站位设置见图 1。
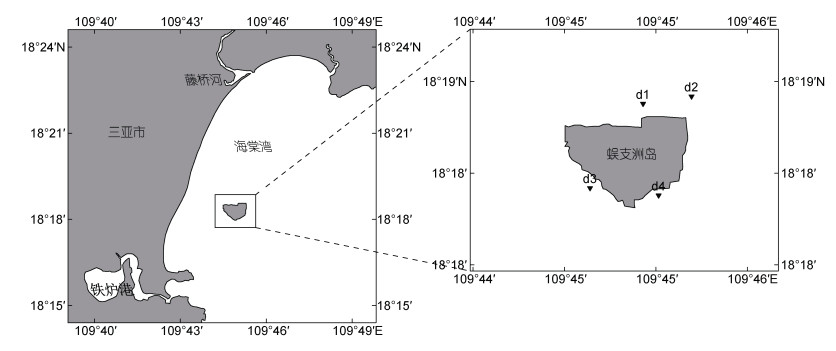 |
| 图 1 蜈支洲岛海洋牧场近岛区调查站位图 Fig. 1 Survey stations in the near island area of Wuzhizhou Island |
本研究运用EwE 6.6软件(Copyright (C) 1989, 1991 Free Software Foundation, Inc.)构建蜈支洲岛海洋牧场近岛区生态系统Ecopath模型。模型中, 生态系统由多组在生态学上相互关联的生物功能组构成, 功能组可以是有机碎屑、底栖生物、处于某一年龄阶段的一种生物或者某一类在生态特征上(食性组成等)相似的物种。建立的生物功能组应包括该生态系统中所有的物质或者能量流动过程。
根据热力学基本原理, 模型定义的生态系统中每一个生物功能组的物质或者能量输入与输出量需保持平衡, 并依据线性方程组定量生态系统中各功能组相关的生物学参数(Christensen et al, 2004)。该模型的参数化是基于以下两个主方程, 其中第一个表示和生产力相关的质量平衡模式, 另一个用来检验并确定该系统的质量平衡:
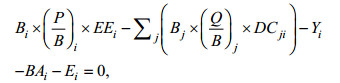 (1)
(1)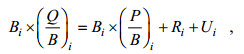 (2)
(2)式中, Bi是功能组i的生物量, 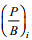
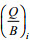
根据蜈支洲岛海洋牧场近岛区珊瑚礁生态系统中生物的摄食、栖息等生态特性以及海域实际增殖情况等模型的功能组设置原则, 将生物划分为20个功能组, 基本覆盖了该海域生态系统各营养级能量流动的全过程。其中, 齿颌眶棘鲈(Scolopsis ciliata)与横纹九棘鲈(Cephalopholis boenak)所处营养级高且生物量在游泳动物中较大, 红腹海参(Holothuria eduils)与蓝环冠海胆(Diadema savignyi)为调查中确定的优势种, 因此被单独划分为功能组。模型各功能组的主要组成物种见表 1。
| 序号 | 功能组 | 主要组成种类 |
| 1 | 其他肉食性鱼类 | 绿尾唇鱼(Cheilinus chlorourus), 新月锦鱼(Thalassoma lunare), 斑柄鹦天竺鲷(Ostorhinchus fleurieu), 星斑裸颊鲷(Lethrinus nebulosus), 单带眶棘鲈(Scolopsis monogramma), 花斑刺鳃鮨(Plectropomus leopardus)等 |
| 2 | 其他植食性鱼类 | 褐篮子鱼(Siganus fuscescens), 突角鼻鱼(Naso annulatus)等 |
| 3 | 其他杂食性鱼类 | 纹腹叉鼻鲀(Arothron hispidus), 黄鳍多棘鳞鲀(Sufflamen chrysopterum), 六线豆娘鱼(Abudefduf sexfasciatus)等 |
| 4 | 齿颌眶棘鲈 Scolopsis ciliata |
齿颌眶棘鲈(S. ciliata) |
| 5 | 横纹九棘鲈 Cephalopholis boenak |
横纹九棘鲈(C. boenak) |
| 6 | 花刺参 Stichopus monotuberculatus |
花刺参(S. monotuberculatus) |
| 7 | 红腹海参Holothuria eduils | 红腹海参(H. eduils) |
| 8 | 其他海参类 | 绿刺参(Stichopus chloronotus), 黑海参(Holothuria atra), 棘辐肛参(Actinopyga echinites)等 |
| 9 | 蓝环冠海胆 Diadema savignyi |
蓝环冠海胆(D. savignyi) |
| 10 | 软体类 | 金口蝾螺(Turbo argyrostomus), 塔形扭柱螺(Tectus pyramis), 角小核果螺(Drupella cornus), 库氏砗磲(Tridacna gigas)等 |
| 11 | 甲壳类 | 花纹爱洁蟹(Atergatis floridus), 小足真寄居蟹(Dardanus pedunculatus), 须赤虾(Metapenaeopsis barbata)等 |
| 12 | 其他棘皮动物 | 冠刺棘海胆(Echinothrix diadema), 蓝指海星(Linckia laevigata), 秉氏海齿花(Comanthus bennetti)等 |
| 13 | 大型藻类 | 紫杉状海门冬(Asparagopsis taxiformis), 半叶马尾藻(Sargassum hemiphyllum), 包式团扇藻(Padina boryana)等 |
| 14 | 珊瑚藻类 | 草皮海藻(Turf) |
| 15 | 小型底栖动物 | 多毛类(Polychaeta), 腹毛类(Gastrotricha), 线虫类(Nematoda)等 |
| 16 | 浮游动物 | 小拟哲水蚤(Paracalanus parvus), 锥形宽水蚤(Temora turbinate), 箭虫幼体(Sagitta larvae), 小齿海樽(Doliolum denticulatum)等 |
| 17 | 浮游植物 | 扁面角毛藻(Chaetoceros compressus), 透明辐杆藻(Bacteriastrum hyalinum), 叉状角藻(Ceratium furca), 束毛藻属(Trichodesmium spp.)等 |
| 18 | 石珊瑚 | 丛生盔形珊瑚(Galaxea fascicularis), 橙黄滨珊瑚(Porites lutes), 矛枝鹿角珊瑚(Acropora aspera), 青灰蔷薇珊瑚(Montipora grisea)等 |
| 19 | 共生藻 | 虫黄藻(Zooxanthellae) |
| 20 | 碎屑 | 颗粒有机碳和溶解有机碳 |
在Ecopath模型中, 各功能组的B、P/B、Q/B和EE值4个参数至少需要输入3个, 剩余未知参数可由模型计算得出。生物量、生产量及其他形式的能量流动以湿重(t/km2)计, 模型模拟周期为1年(马孟磊等, 2020)。
模型中生物量(B)参数大部分通过实地生物资源调查统计获得。浮游动物使用浅水Ⅰ型浮游生物网采集, 送检获得单位为mg/m3的数据后, 根据调查区域的平均水深换算成单位为t/km2的生物量; 浮游植物生物量使用采集不同层次水样中的年平均叶绿素浓度经过一系列比例转换获得(吴忠鑫, 2015); 礁栖性鱼类等游泳动物采用流刺网、垂钓、地笼网方式获取, 并结合视频样带法估算生物量; 海参、海胆和大型海藻等大型底栖生物采用热带珊瑚礁海域常用的潜水视频记录及样带采样法估算生物量; 珊瑚根据潜水样框覆盖面积计算生物量; 碎屑生物量根据Pauly等(1993)提出的经验公式估算; 小型底栖动物、甲壳类、软体类和共生藻的生物量数据现场调查难以准确统计, 因此参考其他生态特征相近的珊瑚礁生态系统的小型底栖动物生物量, 其他种类利用EE值进行模型推算(Fourriére et al, 2019; Calderon-Aguilera et al, 2021)。
游泳动物的P/B值等于瞬时总死亡率Z, 可采用Pauly(1980)的线性方程计算, 由于部分功能组鱼类资料不完善, 难以确定的P/B值参考七连屿珊瑚礁海域模型(洪小帆等, 2022); 其他的底栖生物、浮游生物、碎屑等功能组P/B与Q/B值参考纬度相近的珊瑚礁海域模型或生态系统相似的模型, 并根据蜈支洲岛海洋牧场近岛区的实际情况进行适当调整(陈作志等, 2010; Cáceres et al, 2016; 莫宝霖等, 2017; Fourriére et al, 2019; Calderon-Aguilera et al, 2021; 洪小帆等, 2022)。
功能组的食物组成矩阵数据来源于采集样品的胃含物分析与高通量测序技术及渔业数据库(https://www.fishbase.org)的历史汇总数据。渔获量参数的获取与四次季度月调查同步进行, 根据登船走访调研及蜈支洲岛旅游公司垂钓记录汇总整理所得。
1.3 模型的调试及增殖生态容量估算模型输入原始数据运行后, 可能会出现生态系统能量输入与输出不平衡的情况, 如EE值> 1, 表示生态系统对该功能组的利用量大于其生产量, 超出数值合理范围(张明亮等, 2013)。此时, 需要不断调整不平衡功能组的食物组成, 使所有功能组的EE≤1, 输入和输出保持平衡; 同时还需要兼顾其他参数处于合理范围, 即大部分生物功能组的食物转化效率(Production/Consumption, P/Q)值低于0.3 (理想数值为0.1~0.3之间) (Liu et al, 2009); 生产量/呼吸量(Production/Respiration, P/R) < 1。依据不同生境进行相应的调整, 直至整体符合生态学及热力学原则(洪小帆等, 2022), 从而获得合理的参数。
模型平衡后, 逐步提高花刺参功能组的生物量, 在多次模拟后直至模型中任一(与其食性紧密相关)功能组出现EE值=1的情况, 为该功能组生物量达到使系统能量平衡被打破的临界条件, 确定此时花刺参功能组的生物量为蜈支洲岛海洋牧场近岛区生态系统的花刺参增殖生态容量。
2 结果与分析 2.1 生态模型构建与能量流动经不断调试, 构建出蜈支洲岛海洋牧场近岛区花刺参增殖模型, 输入的各功能组参数和模型输出的结果如表 2所示。Ecopath模型中的Pedigree指数常被用以评价模型的可信度, 其数值越高, 表明模型越接近于生态系统的真实状态。与全球150个Ecopath模型的P指数范围0.164~0.678相比(Morissette et al, 2006), 本研究所构建的模型Pedigree指数为0.50, 表明模型的输入参数可信度较高, 模型整体质量也处于中上等水平。
| 序号 | 功能组 | 有效营养级 | 生物量/(t/km2) | 生产量/生物量/(a–1) | 消耗量/生物量/(a–1) | 生态营养效率 | 渔获量/[t/(km2·a)] |
| 1 | 横纹九棘鲈 Cephalopholis boenak |
3.52 | 1.507 | 1.400 | 10.870 | 0.301 | 0.100 |
| 2 | 齿颌眶棘鲈 Scolopsis ciliata |
3.37 | 2.448 | 1.460 | 14.690 | 0.308 | 0.400 |
| 3 | 其他肉食性鱼类 | 3.28 | 5.794 | 1.964 | 9.240 | 0.926 | 0.269 |
| 4 | 其他杂食性鱼类 | 2.62 | 1.673 | 2.960 | 10.570 | 0.643 | 0.151 |
| 5 | 其他棘皮动物 | 2.42 | 21.519 | 4.200 | 14.200 | 0.377 | — |
| 6 | 甲壳类 | 2.27 | 11.693 | 7.200 | 24.500 | 0.840 | — |
| 7 | 其他植食性鱼类 | 2.20 | 1.656 | 5.219 | 37.280 | 0.490 | 0.200 |
| 8 | 软体类 | 2.20 | 15.066 | 5.750 | 24.000 | 0.710 | 0.676 |
| 9 | 蓝环冠海胆 Diadema savignyi |
2.12 | 8.273 | 4.200 | 16.700 | 0.046 | — |
| 10 | 小型底栖动物 | 2.11 | 4.400 | 12.400 | 61.600 | 0.753 | — |
| 11 | 其他海参类 | 2.02 | 14.392 | 6.200 | 22.240 | 0.414 | — |
| 12 | 花刺参 S. monotuberculatus |
2.02 | 0.535 | 2.430 | 8.150 | 0.262 | — |
| 13 | 红腹海参 Holothuria eduils |
2.01 | 7.170 | 7.600 | 41.540 | 0.062 | — |
| 14 | 浮游动物 | 2.00 | 3.922 | 63.500 | 215.000 | 0.474 | — |
| 15 | 石珊瑚 | 2.00 | 127.900 | 3.100 | 10.500 | 0.116 | — |
| 16 | 大型藻类 | 1.00 | 2.252 | 80.000 | — | 0.469 | — |
| 17 | 珊瑚藻类 | 1.00 | 48.786 | 60.000 | — | 0.132 | — |
| 18 | 浮游植物 | 1.00 | 5.476 | 376.800 | — | 0.479 | — |
| 19 | 共生藻 | 1.00 | 14.493 | 238.000 | — | 0.360 | — |
| 20 | 碎屑 | 1.00 | 60.410 | — | — | 0.162 | — |
| 注: 加粗数字为模型输出参数 | |||||||
各功能组的营养转化效率在0.046~0.926之间。生态系统的营养级(有效营养级)范围为1~3.52, 其中营养级最低的功能组为大型藻类、珊瑚藻类、浮游植物、共生藻和碎屑, 其营养级均为1; 营养级最高的是横纹九棘鲈功能组, 为3.52; 其次为齿颌眶棘鲈, 营养级为3.37。花刺参营养级为2.02, 生态营养效率偏低, 为0.262。
Ecopath模型通过营养级聚合, 将各功能组的营养流合并为多个整数营养级, 近岛区生态系统的能流主要集中于前五级营养级(表 3)。第Ⅰ和第Ⅱ营养级的总流量较高, 分别占到系统总流量的78.89%和19.17%, 第Ⅳ和第Ⅴ营养级共占系统总流量的0.21%, 流经各营养级的能量随营养级的升高而逐级降低, 基本符合生态学能量金字塔规律。第Ⅰ营养级是生态系统物质和能量的主要来源, 其流向碎屑的量为5 919 t/km2, 占总流向碎屑量的78.62%, 第Ⅱ营养级流向碎屑的量占总量的19.76%, 生态系统大部分的能量未经有效利用就以碎屑的形式流失, 尤其对第Ⅰ营养级的初级生产力利用不够充分。
| 营养级 | 被捕食量 | 输出量 | 流向碎屑量 | 呼吸量 | 系统总流量 |
| V | 0.16 | 0.02 | 0.85 | 2.03 | 3.06 |
| Ⅳ | 2.99 | 0.19 | 12.55 | 24.96 | 40.69 |
| Ⅲ | 40.27 | 0.79 | 108.30 | 203.20 | 352.50 |
| Ⅱ | 351.70 | 0.79 | 1 488.00 | 2 083.00 | 3 924.00 |
| Ⅰ | 3 924.00 | 6 306.00 | 5 919.00 | 0.00 | 16 149.00 |
| 合计 | 4 319.00 | 6 308.00 | 7 529.00 | 2 314.00 | 20 469.00 |
蜈支洲岛海洋牧场近岛区模型能量通道示意图如图 2所示。根据生态系统中能量来源的差异, 海洋牧场近岛区生态系统由两条能量流动通道构成, 一条为牧食食物链, 另一条为碎屑食物链。
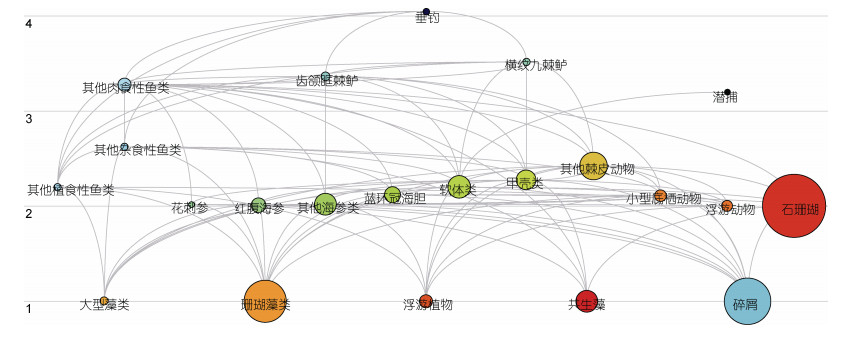 |
| 图 2 蜈支洲岛海洋牧场近岛区生态系统能量通道 Fig. 2 Ecosystem energy flow diagram in the marine ranching around Wuzhizhou Island 注: 圆圈表示各功能组; 圆圈面积表示功能组生物量的数值大小; 灰色连线表示功能组间能量传递路径 |
近岛区珊瑚礁生态系统的能量来源多样, 主要来源于珊瑚藻类和有机碎屑, 来源于初级生产者(大型藻类、珊瑚藻类、浮游植物、共生藻)的能量占总能流的57%, 来源于有机碎屑的能量占43%, 表明该生态系统的食物网结构以牧食食物链为主。由表 4可知, 蜈支洲岛海洋牧场近岛区生态系统的总平均能量传输效率为9.353%, 有机碎屑的总平均能量传输效率为9.096%, 低于初级生产者的传输效率。系统中来自初级生产者的能量或是来自碎屑的能量, 均表现为第Ⅲ营养级的传输效率最高, 同时第Ⅲ营养级的总能量传输效率达到11.65%。
| 能量来源 | 营养级 | |||
| Ⅱ | Ⅲ | Ⅳ | Ⅴ | |
| 生产者 | 9.066 | 11.460 | 8.165 | 6.102 |
| 碎屑 | 8.804 | 12.080 | 7.076 | 5.027 |
| 总流量 | 8.985 | 11.650 | 7.819 | 5.801 |
| 碎屑占总能流比: 0.43 | ||||
| 传递效率(营养级Ⅱ~Ⅳ的平均值) | ||||
| 初级生产者传递效率: 9.465% | ||||
| 有机碎屑传递效率: 9.096% | ||||
| 系统传递效率: 9.353% | ||||
花刺参为沉积食性, 在摄食沉积物的同时还会摄取底表和底内的小型底栖动物等, 其生物量的扩大会增加被摄食功能组的压力。生态系统中花刺参的增殖生态容量推算结果如表 5所示, 将花刺参作为一个单独功能组, 维持其他功能组的所有数据不变, 将调查时记录的花刺参生物量逐步提高。本模型中花刺参生物量扩大至206倍后, 小型底栖动物的EE值达到0.999, 继续增加花刺参生物量, 将会出现小型底栖动物的EE值大于1, 系统处于不平衡的状态。因此评估得出蜈支洲岛海洋牧场近岛区生态系统中花刺参的增殖生态容量为110.21 t/km2。
| 花刺参生物量/(t/km2) | 花刺参生物量倍数 | 小型底栖动物EE值 |
| 0.535 | 1.0 | 0.753 |
| 53.500 | 100.0 | 0.872 |
| 107.000 | 200.0 | 0.992 |
| 110.210 | 206.0 | 0.999 |
| 110.745 | 207.0 | >1.000 |
| 注: 加粗数字为达到生态容量 | ||
混合营养效应(mixed trophic impact, MTI)用于分析生态系统各功能组间的相互作用关系, 某一功能组生物量的变动会对其他功能组产生相应的正面或负面作用。图 3为蜈支洲岛海洋牧场近岛区生态系统各功能组间的营养关系。藻类等初级生产者和有机碎屑作为食物网能流的开始部分, 对大部分功能组产生正面影响, 如有机碎屑对沉积食性动物表现为正面影响, 对海参类的正面影响更为突出, 珊瑚藻类对其他植食性鱼类和蓝环冠海胆等表现为较强的正面影响; 其他肉食性鱼类营养级较高, 受捕食关系的影响, 对其他植食性鱼类、杂食性鱼类和横纹九棘鲈等功能组均产生较强的负面影响, 对于蓝环冠海胆、甲壳类和大型藻类等功能组则具有正面影响。
 |
| 图 3 蜈支洲岛海洋牧场近岛区生态系统混合营养关系图 Fig. 3 The mixed trophic impact in the marine ranching ecosystem around Wuzhizhou Island |
表 6为蜈支洲岛海洋牧场未全面进行花刺参底播增殖(现况)和增殖花刺参至生态容量时(增殖后)的特征。当前该生态系统的总流量为20 506.400 t/(km2·a), 总消耗量为4 356.572 t/(km2·a), 总输出量为6 307.762 t/(km2·a), 总呼吸量为2 313.544 t/(km2·a), 流向碎屑总量为7 528.520 t/(km2·a), 分别占系统总流量的21.24%、30.76%、11.28%、36.71%; 增殖后且达到生态容量时系统的总消耗量、总呼吸量、流向碎屑总量及总流量均略有增加, 同时总输出量有所降低。总初级生产量/总呼吸量(TPP/TR)、总初级生产量/总生物量(TPP/TB)、系统净生产量是衡量生态系统成熟度的重要指标, 至增殖生态容量后数值均有所降低; 系统连接指数(CI)、杂食性指数(SOI)、Finn’s循环指数(FCI)和Finn’s平均路径长度(MPL)能反映生态系统食物网的复杂程度, CI保持不变, SOI略有降低, 而FCI和MPL有所增加。
| 特征参数 | 现况 | 增殖后 |
| 总消耗量/[t/(km2·a)] | 4 356.572 | 5 250.423 |
| 总输出量/[t/(km2·a)] | 6 307.762 | 5 861.675 |
| 总呼吸量/[t/(km2·a)] | 2 313.544 | 2 762.114 |
| 流向碎屑总量/[t/(km2·a)] | 7 528.520 | 7 953.044 |
| 系统总流量/[t/(km2·a)] | 20 506.400 | 21 827.260 |
| 系统总生产量/[t/(km2·a)] | 9 791.710 | 10 060.700 |
| 能量总效率 | 0.000 21 | 0.000 21 |
| 总净初级生产量/[t/(km2·a)] | 8 619.996 | 8 622.479 |
| 总初级生产量/总呼吸量 | 3.726 | 3.122 |
| 系统净生产量/[t/(km2·a)] | 6 306.452 | 5 860.364 |
| 总初级生产量/总生物量 | 28.834 | 21.100 |
| 总生物量/总流量 | 0.015 | 0.019 |
| 连接指数 | 0.256 | 0.256 |
| 系统杂食指数 | 0.120 | 0.095 |
| Finn’s循环指数 | 2.485% | 4.549% |
| Finn’s平均路径长度 | 2.379 | 2.531 |
| 聚合度 | 33.35 | 31.29 |
本研究基于构建的蜈支洲岛海洋牧场近岛区的Ecopath模型, 定量分析了生态系统能量流动过程, 评价了花刺参底播增殖前与达到生态容量时生态系统的总体特征变化。
3.1.1 蜈支洲岛近岛区生态系统现状研究发现, 蜈支洲岛海洋牧场近岛区目前的生态系统的总流量为20 506.400 t/(km2·a), 与大亚湾等(陈作志等, 2010; 莫宝霖等, 2017; 黄梦仪等, 2019)邻近区域的系统总流量相比, 本研究区域的生态系统具有较高的整体活力, 主要归因于珊瑚岛礁海洋牧场特有的热带生物资源优势。研究区域内总平均能量传输效率为9.353%, 略低于林德曼能量传递效率(10%), 同时传递效率明显低于与本调查区域生境相似的珊瑚礁生态系统(13.45%) (洪小帆等, 2022), 并且除第Ⅲ营养级外, 其他各营养级的传递效率均未能达到10%, 说明系统能量流动路径有待进一步改善。系统中初级生产者流向碎屑的能量占整体流向碎屑量的78.62%, 碎屑功能组中被第Ⅱ营养级利用再次进入食物网循环的生物量仅占各营养级生产力直接流向碎屑总能流的16.24% [1 223 t/(km2·a)] (未在结果中展示), 生态系统表现为初级生产力的大部分能量未被利用, 转而流向了碎屑功能组, 以碎屑的形式储存于低营养级中, 并且被再次利用的比例偏低, 因此很有必要增加沉积食性海参等消费者以提升系统总体的能流效率, 同时提升珊瑚岛礁海洋牧场抵抗自然风险的能力。
在Ecopath输出结果中, 总体特征参数可以评价生态系统的稳定性、成熟度和发育状态等。研究者认为当没有任何人类干扰时, 生态系统倾向于向成熟方向发展, 成熟的系统表现出更高的能流通量和更复杂的营养结构(Lobry et al, 2008; Rahman et al, 2019)。生态系统的成熟度可由TPP/TR、TPP/TB、系统净生产量三个参数表征。当总体特征中的TPP/TR越是趋近于1时, 表明系统越稳定; 而在系统发育处于发展阶段, TPP/TR会表现为大于1, 如系统受到污染干扰, 初级生产力会小于总呼吸量, 数值小于1 (Abdul et al, 2016)。Ecopath模型输出的参数显示蜈支洲岛海洋牧场近岛区生态系统的TPP/TR值大于1, 为3.726, 同时TPP/TB比值也偏高, 为28.834, 表明生态系统处于初始发展阶段, 发育模式以生物量等资源积累为主(Fourriére et al, 2019), 同时TPP/TB的值可代表生态系统的活力, 数值越高于1, 说明生态系统越拥有较高的活力, 发展也越快, 表明蜈支洲岛海洋牧场生态系统仍处于快速发育阶段。系统净生产量为总初级生产量和总呼吸量之间的差值, 接近于0时被视为一个成熟的生态系统(Rahman et al, 2019), 而该系统净生产量为6 306.452 t/(km2·a), 数值偏大, 系统发育表现为不够成熟。
CI和SOI值分别为0.256和0.120, 远小于1, 该两种指标反映生态系统内部结构稳定性, 通常认为在一个成熟的系统中会更高(Abdul et al, 2016), 因此说明蜈支洲岛近岛区生态系统食物网复杂程度较低, 各功能组间联系紧密程度欠佳。
FCI和MPL值代表了系统中物质再循环的比例及能量流经食物链的平均长度(Abdul et al, 2016), 两者与系统的成熟度呈正相关, 且在成熟的系统中常表现出能量的高度循环利用。模型输出结果显示FCI和MPL分别为2.485%和2.379, 与其他类似海区生境相比该系统能量流经的营养级路径较短, 对流入碎屑功能组的能量再循环利用能力稍差, 并且抗外界干扰的能力偏弱(黄梦仪等, 2019; Calderon-Aguilera et al, 2021; 洪小帆等, 2022)。模型中未能采集到异养细菌等生物数据, 缺少部分微食物网能量循环的贡献, 可能也是导致FCI值偏低的原因之一。
综合上述指标表明, 未开展海参底播增殖的蜈支洲岛海洋牧场近岛区生态系统正处于向成熟演变的过程中, 食物网结构也在向网络拓扑状发展, 但目前系统初级生产力过剩, 有较多的能量未能被充分利用, 生境状况同相邻海区的沿岸生态系统相似(陈作志等, 2010; 刘岩等, 2019), 都处于稳定性较差且易受到外来因素干扰阶段, 还是一个不成熟的生态系统。究其原因, 可能与近海过度捕捞造成大型游泳动物数量偏少, 游泳动物多为生命周期短的小型鱼类占优相关(王新元等, 2021)。另外, 夏、秋季的强台风和暴风雨对生态系统的干扰可能也是原因之一(Huang et al, 2020)。
3.1.2 花刺参增殖达生态容量后生态系统状态预测根据Ecopath模型的估算, 花刺参至生态容量后系统总体特征参数会有一定程度变动, 系统总生物量由原始状态的298.955 t/km2上升至408.641 t/km2, 系统总流量较现况增长了6.44%, 至21 827.26 t/(km2·a), 系统总生产量也扩增2.75%, 说明随着花刺参的增殖, 系统总体规模将进一步扩大。
从参数表征的群落能量学方面来看, 至生态容量后TPP/TR、TPP/TB与系统净生产量数值均有不同程度的下降, 系统内的能量积累速度有所放缓, 与消耗速度有逐渐持平的趋势, 从而表明生态系统的发育程度进一步接近成熟。FCI和MPL均有所提高, 尤其以FCI有近一倍的增长, 推测由于受到大规模增殖花刺参的影响, 沉积食性生物对于有机物碎屑的摄食作用加强, 提高了生物与环境间物质的交换率及系统的再循环程度, 处于高营养级的捕食者可从稍低的营养级获取更加广泛的营养来源, 生物贡献更为充足, 进而影响到生态系统的发育状态。而CI和SOI参数几乎没有变化, 说明增殖花刺参的生物量控制在合理容量范围内, 未改变蜈支洲岛海洋牧场近岛区的生态系统结构, 系统依旧保持稳定。
由于花刺参食性较为单一, 数量在短时间内的增长会降低系统种间捕食关系的复杂程度与多样性(Thapanand et al, 2009), 造成短期内系统稳定性下降。但基于科学的生态容量及MTI (图 3)反映出增殖达到稳定的常态化后, 随着花刺参数量的增加, 其作为被捕食者, 可提供给甲壳类和肉食性鱼类等捕食者更多的摄食选择性(Purcell et al, 2016); 花刺参摄食产生的下行控制效应促使有机碎屑等低营养级的EE值提高, 将流入碎屑功能组的能量有效利用, 改善蜈支洲岛海洋牧场生态系统营养级之间的能量传递效率。
总体来看, 增殖花刺参后系统初级生产力会更接近于总呼吸量, 这将提高系统整体的循环程度及初级生产者与高营养级间的能量传递效率, 促使能量在系统中可更为充分地利用, 并且能量流经营养级的长度有所延长, 系统稳定性加强更趋近于成熟状态。
3.2 花刺参增殖生态容量分析根据前期实地采样数据, 蜈支洲岛海洋牧场近岛区花刺参的资源密度较低, 生物量为0.535 t/km2, 仅占模型估算生态容量的0.49%, 近岛区具有较大规模的增殖空间。经模型估算的花刺参增殖生态容量为110.21 t/km2, 增殖潜力有200余倍, 由于系统初级生产力偏高且碎屑能量富余, 增殖的花刺参有丰富食物来源, 并且其营养级较低, 多以沉积物中的碎屑有机质为食, 生物量的增加不会对饵料生物产生过大压力, 因此增殖空间较大。
本研究估算的生态容量与北方日照前三岛底播增殖刺参的生态容量(109.40 t/km2)相近(邢坤, 2009), 但远低于吴忠鑫等(2013)利用Ecopath模型估算的荣成人工鱼礁区刺参的生态容量(309.40 t/km2)及长岛县砣矶岛通过饵料供给方法估计的刺参容量(789.60 t/km2) (李元山等, 1996)。影响增殖海域生态容量的原因主要有两方面: 一是增殖种不同, 刺参(Apostichopus japonicus)是生活于北方温带浅海的主要食用海参, 而花刺参是生活在热带珊瑚礁内的种类(廖玉麟, 2001), 种的差别以及偏好生境的差异导致两种海参摄食行为、摄食偏好特征等都会有一定的差异; 二是栖息生境的不同, 蜈支洲岛海洋牧场近岛区为典型的热带珊瑚礁生态系统, 这是一个具有极高生物多样性和高度复杂生态过程的系统(Alva-Basurto et al, 2014), 与温带和亚热带海域的人工鱼礁生态系统及天然岩礁生态系统相比(刘鸿雁等, 2019), 珊瑚礁生态系统的总流量(TST)普遍更高, 食物网营养关系与能量流动过程也更为复杂, 同种生物会处于多个不同的营养水平, 以动态的关系联结在一起(Liu et al, 2009; Enochs et al, 2017), 一种生物数量的大幅增加会带动整个系统能流发生较大的改变。
造成生态容量南北差异的原因还有海洋牧场生物群落组成、饵料丰富度等方面: 首先, 与北方调查海域沉积食性海参仅有刺参一种相比, 蜈支洲岛海洋牧场区域除花刺参外还有数种与其食性相近的热带沉积食性海参共存(如红腹海参、绿刺参、棘辐肛参等) (黄端杰等, 2020), 生态位相近会加剧相同资源的竞争, MTI反映了花刺参生物量的增加对红腹海参等其他沉积食性生物产生负面作用(图 3), 压缩了花刺参的生态容量; 其次, 研究区域的大型藻类生物量在低营养盐和高植食性动物生物量的限制下维持在相对较低的水平, 避免了与珊瑚的竞争(李元超等, 2015), 沉积物海藻来源有机碎屑输入量与北方大型海藻脱落产生的碎屑相比量级差距极大(吴忠鑫等, 2013), 即使珊瑚礁区潜在食物来源丰富, 但也不足以弥补碎屑量的巨大差距, 因而限制了花刺参的生态容量; 第三, 北方海域在底播刺参的同时还会放流其他生物(如埋栖性贝类、经济鱼类等), 多个增殖品种分属不同营养层次, 能有效地在多个生态位对冗余能量进行利用(杨超杰等, 2016), 如经滤食性动物代谢后可供给海区的生源要素与有机碎屑量更高, 食物来源丰富可使刺参的生态容量进一步扩大, 所以南北方海域两种海参的增殖生态容量会有较大的差异。
生态容量计算的最终目标是评估底播数量和经济规模, 在制定花刺参底播增殖计划时需兼顾生态与经济效益。随着野外刺参种群因过度采捕而数量锐减(杨红生等, 2016), 以资源恢复及高质量海洋水产蛋白供应为导向的底播增殖资源等需求的持续增长, 使用能量平衡建模以评估大范围水域生态容量技术可以通过生态可持续的方式指导该行业的发展, 这将是一个长期监测的项目。应该注意的是, 模型评估的生态容量是一个理论上的最大增殖上限, 根据渔业管理的公认标准, 将蜈支洲岛海洋牧场近岛区实际的花刺参生物量控制在生态容量数值的一半, 是较为稳妥的底播增殖方案(吴忠鑫等, 2013), 此时的生物量接近最大可持续产量(Maximum sustained yield, MSY), 放流生物的增长率最高。MSY的管理还考虑到了Ecopath静态模型所不能描述的生态容量固有的动态变化问题, 兼顾了因自然和人为干扰导致海区各类环境因子大幅波动, 继而影响增殖目标种的存活率及未来的海区生态容量(Byron et al, 2011)。
Ecopath模型本身未能考虑生态系统动态变化影响, 但它为当前花刺参在海区的底播增殖提供了一种生态容量评估方法, 下一步可通过生态与渔业数据的整合将动态模拟与空间建模方法联系起来, 利用EwE工具中Ecosim模块开发更稳健的食物网模型, 并加强它们作为管理工具的潜力, 指导完成生态型放流的目标和珊瑚礁区建设的有序发展。
4 结论本研究构建的蜈支洲岛海洋牧场近岛区生态系统Ecopath模型较全面地量化并展示了该系统的生物量、食物网和能流结构。通过与邻近海域及成熟系统的总体特征参数比较得出蜈支洲岛海洋牧场近岛区的生态系统仍处于发育阶段; 利用模型进一步评估了底播增殖经济种花刺参的生态容量, 结果表明其具有较大的增殖潜力。未来应基于该结果, 确定相应的底播增殖规划, 建立基于珊瑚礁生态系统的增殖回捕管理策略, 以实现热带海洋牧场海珍品资源产出功能, 促进南方增殖型海洋牧场的快速发展。
马文刚, 夏景全, 魏一凡, 等, 2022. 三亚蜈支洲岛海洋牧场近岛区底表大型底栖动物群落结构及评价. 热带海洋学报, 41(03): 135-146 |
马孟磊, 陈作志, 徐姗楠, 等, 2020. 南海北部陆坡海域生态系统营养结构和能量流动分析. 水产学报, 44(10): 1685-1694 DOI:10.11964/jfc.20190811924 |
王新元, 李建龙, 章翔, 等, 2021. 三亚蜈支洲岛热带海洋牧场渔业资源现状及季节变动. 海洋与湖沼, 52(6): 1557-1566 |
田胜艳, 张文亮, 张锐, 2009. 大型底栖动物在海洋生态系统中的作用. 盐业与化工, 38(2): 50-54 |
邢坤, 2009. 刺参生态增养殖原理与关键技术[D]. 青岛: 中国科学院研究生院(海洋研究所): 65-78.
|
刘岩, 吴忠鑫, 杨长平, 等, 2019. 基于Ecopath模型的珠江口6种增殖放流种类生态容纳量估算. 南方水产科学, 15(4): 19-28 |
刘鸿雁, 杨超杰, 张沛东, 等, 2019. 基于Ecopath模型的崂山湾人工鱼礁区生态系统结构和功能研究. 生态学报, 39(11): 3926-3936 |
李元山, 牟绍敦, 冯月群, 等, 1996. 海珍品综合增养殖中的种间关系和生态容纳量的研究. 海洋湖沼通报, (1): 24-30 |
李元超, 杨毅, 郑新庆, 等, 2015. 海南三亚后海海域珊瑚礁生态系统的健康状况及其影响因素. 生态学杂志, 34(4): 1105-1112 |
杨东, 周政权, 张建设, 等, 2017. 烟台牟平海洋牧场夏季大型底栖动物群落特征. 海洋科学, 41(5): 134-143 |
杨红生, 许帅, 林承刚, 等, 2020. 典型海域生境修复与生物资源养护研究进展与展望. 海洋与湖沼, 51(4): 809-820 |
杨红生, 肖宁, 张涛, 2016. 棘皮动物学研究现状与展望. 海洋科学集刊, (51): 125-131 DOI:10.12036/hykxjk20160719004 |
杨昊陈, 2019. 基于Ecopath模型的唐山海洋牧场人工鱼礁区生态效果评估[D]. 大连: 大连海洋大学: 4-37.
|
杨超杰, 吴忠鑫, 刘鸿雁, 等, 2016. 基于Ecopath模型估算莱州湾朱旺人工鱼礁区日本蟳、脉红螺捕捞策略和刺参增殖生态容量. 中国海洋大学学报(自然科学版), 46(11): 168-177 DOI:10.16441/j.cnki.hdxb.20160112 |
吴忠鑫, 2015. 山东俚岛人工鱼礁区生态效果初步评价[D]. 青岛: 中国海洋大学: 51-53.
|
吴忠鑫, 张秀梅, 张磊, 等, 2013. 基于线性食物网模型估算荣成俚岛人工鱼礁区刺参和皱纹盘鲍的生态容纳量. 中国水产科学, 20(2): 327-337 |
张玥, 高菲, 许强, 2021. 花刺参幼参摄食和消化器官形态学和组织学研究. 海洋通报, 40(2): 198-205 |
张明亮, 冷悦山, 吕振波, 等, 2013. 莱州湾三疣梭子蟹生态容量估算. 海洋渔业, 35(3): 303-308 |
陈作志, 邱永松, 2010. 南海北部生态系统食物网结构、能量流动及系统特征. 生态学报, 30(18): 4855-4865 |
洪小帆, 陈作志, 张俊, 等, 2022. 基于Ecopath模型的七连屿礁栖性生物的生态承载力分析. 热带海洋学报, 41(1): 15-27 |
莫宝霖, 秦传新, 陈丕茂, 等, 2017. 基于Ecopath模型的大亚湾海域生态系统结构与功能初步分析. 南方水产科学, 13(3): 9-19 |
黄梦仪, 徐姗楠, 刘永, 等, 2019. 基于Ecopath模型的大亚湾黑鲷生态容量评估. 中国水产科学, 26(1): 1-13 |
黄端杰, 许强, 李秀保, 等, 2020. 三亚蜈支洲岛珊瑚礁-沙质底复合区棘皮动物群落结构. 海洋与湖沼, 51(1): 103-113 |
廖玉麟, 1997. 中国动物志: 棘皮动物门: 海参纲. 北京: 科学出版社
|
廖玉麟, 2001. 我国的海参. 生物学通报, 36(9): 1-3 |
ABDUL W O, ADEKOYA E O, 2016. Preliminary Ecopath model of a tropical coastal estuarine ecosystem around bight of Benin, Nigeria. Environmental Biology of Fishes, 99(12): 909-923 |
ALVA-BASURTO J C, ARIAS-GONZÁLEZ J E, 2014. Modelling the effects of climate change on a Caribbean coral reef food web. Ecological Modelling, 289: 1-14 DOI:10.1016/j.ecolmodel.2014.06.014 |
BYRON C, LINK J, COSTA-PIERCE B, et al, 2011. Calculating ecological carrying capacity of shellfish aquaculture using mass-balance modeling: Narragansett Bay, Rhode Island. Ecological Modelling, 222(10): 1743-1755 |
CÁCERES I, ORTIZ M, CUPUL-MAGAÑA A L, et al, 2016. Trophic models and short-term simulations for the coral reefs of Cayos Cochinos and Media Luna (Honduras): a comparative network analysis, ecosystem development, resilience, and fishery. Hydrobiologia, 770(1): 209-224 DOI:10.1007/s10750-015-2592-7 |
CALDERON-AGUILERA L E, REYES-BONILLA H, OLAN-GONZALEZ M, et al, 2021. Estimated flows and biomass in a no-take coral reef from the eastern tropical Pacific through network analysis. Ecological Indicators, 123: 107359 DOI:10.1016/j.ecolind.2021.107359 |
CHRISTENSEN V, WALTERS C J, 2004. Ecopath with Ecosim: methods, capabilities and limitations. Ecological Modelling, 172(2/3/4): 109-139 DOI:10.1016/j.ecolmodel.2003.09.003 |
DOLOROSA R G, SALAZAR C B, DELFIN M T V, et al, 2017. Sea cucumber fisheries in Rasa Island Wildlife Sanctuary, Narra, Palawan, Philippines. SPC Beche-de-mer Information Bulletin, 37: 9-20 |
ENOCHS I C, GLYNN P W, 2017. Trophodynamics of eastern Pacific coral reefs [M] // GLYNN P, MANZELLO D, ENOCHS I. Coral Reefs of the Eastern Tropical Pacific. Dordrecht: Springer: 291-314.
|
FOURRIÉRE M, ALVARADO J J, CORTÉS J, et al, 2019. Energy flow structure and role of keystone groups in shallow water environments in Isla del Coco, Costa Rica, Eastern Tropical Pacific. Ecological Modelling, 396: 74-85 DOI:10.1016/j.ecolmodel.2019.01.004 |
HEYMANS J J, COLL M, LINK J S, et al, 2016. Best practice in Ecopath with Ecosim food-web models for ecosystem-based management. Ecological Modelling, 331: 173-184 DOI:10.1016/J.ECOLMODEL.2015.12.007 |
HU C Q, XU Y H, WEN J, et al, 2010. Larval development and juvenile growth of the sea cucumber Stichopus sp. (Curry fish). Aquaculture, 300(1-4): 73-79 DOI:10.1016/j.aquaculture.2009.09.033 |
HUANG J Z, WANG F X, ZHAO H W, et al, 2020. Reef benthic composition and coral communities at the Wuzhizhou Island in the south China sea: the impacts of anthropogenic disturbance. Estuarine, Coastal and Shelf Science, 243: 106863 DOI:10.1016/j.ecss.2020.106863 |
JONTILA J B S, BALISCO R A T, MATILLANO J A, 2014. The sea cucumbers (Holothuroidea) of Palawan, Philippines. AACL Bioflux, 7(3): 194-206 |
LIU P J, SHAO K T, JAN R Q, et al, 2009. A trophic model of fringing coral reefs in Nanwan Bay, southern Taiwan suggests overfishing. Marine Environmental Research, 68(3): 106-117 |
LOBRY J, DAVID V, PASQUAUD S, et al, 2008. Diversity and stability of an estuarine trophic network. Marine Ecology Progress Series, 358: 13-25 DOI:10.3354/meps07294 |
MORISSETTE L, HAMMILL M O, SAVENKOFF C, 2006. The trophic role of marine mammals in the northern Gulf of St. Lawrence. Marine Mammal Science, 22(1): 74-103 DOI:10.1111/j.1748-7692.2006.00007.x |
PAULY D, 1980. On the interrelationships between natural mortality, growth parameters, and mean environmental temperature in 175 fish stocks. ICES Journal of Marine Science, 39(2): 175-192 |
PAULYA D, SORIANO-BARTZ M L, PALOMARESA M L D, 1993. Improved construction, parametrization and interpretation of steady-state ecosystem models [C] // Presented at the Ninth Shrimp and Fin Fisheries Management Workshop. Kuwait: ICLARM.
|
PURCELL S, CONAND C, UTHICKE S, et al, 2016. Ecological roles of exploited sea cucumbers [M] // Hughes R N, Hughes D J, Smith I P, et al. Oceanography and Marine Biology. London: Taylor & Francis Group: 367-386.
|
RAHMAN M F, LIN Q, SHAN X J, et al, 2019. Temporal changes of structure and functioning of the Bohai Sea ecosystem: insights from Ecopath models. Thalassas: An International Journal of Marine Sciences, 35(2): 625-641 DOI:10.1007/s41208-019-00139-1 |
THAPANAND T, JUTAGATEE T, WONGRAT P, et al, 2009. Trophic relationships and ecosystem characteristics in a newly-impounded man-made lake in Thailand. Fisheries Management and Ecology, 16(2): 77-87 DOI:10.1111/j.1365-2400.2008.00601.x |
 2022, Vol. 53
2022, Vol. 53


