中国海洋湖沼学会主办。
文章信息
- 宋晨, 许丽婷, 王晓波, 孟周, 韩庆喜. 2022.
- SONG Chen, XU Li-Ting, WANG Xiao-Bo, MENG Zhou, HAN Qing-Xi. 2022.
- 浙江舟山海域大型底栖动物群落组成及主要影响因子分析
- COMPOSITION AND MAIN ENVIRONMENTAL FACTORS OF MACROBENTHOS COMMUNITY IN SEA AREA OF ZHOUSHAN ISLANDS, ZHEJIANG
- 海洋与湖沼, 53(6): 1585-1597
- Oceanologia et Limnologia Sinica, 53(6): 1585-1597.
- http://dx.doi.org/10.11693/hyhz20220300066
文章历史
-
收稿日期:2022-03-16
收修改稿日期:2022-04-28
2. 国家海洋局宁波海洋环境监测中心站 浙江宁波 315012;
3. 禹治环境科技(浙江)有限公司 浙江宁波 315199
2. Marine Environmental Monitoring Centre of Ningbo, SOA, Ningbo 315012, China;
3. Yuzhi Environmental Technology (Zhejiang) Co., Ltd., Ningbo 315199, China
舟山海域地处浙江省东北部和长江口南侧, 西与杭州湾相接(《中国海岛志》编纂委员会, 2014), 受长江巨大径流量(年平均9.24×1011 m3) (周进等, 2018)和入海泥沙(年平均泥沙输入量约0.5×108 t) (胡敦欣等, 2001)的影响。长江径流携大量泥沙入海后与海水混合形成盐度略低的长江冲淡水, 并与该海域的黑潮、台湾暖流和闽浙沿岸流等水系共同作用于舟山海域(Gong et al, 1996; Ichikawa et al, 2002; 刘清河等, 2020), 共同塑造了该海域复杂的物理、化学、生物和地质进程以及多变的生态环境(Chen et al, 1999; Qiu et al, 2018)。舟山海域是东海海区著名的上升流区, 兼之受长江、钱塘江、甬江等河流丰富营养盐输入的影响(周伟华等, 2006), 使得舟山海域水质肥沃, 浮游植物大量繁殖, 浮游动物种类多且数量大(俞存根等, 2010), 为岱衢族大黄鱼(Larimichthys crocea)、带鱼(Trichiurus japonicus)和三疣梭子蟹(Portunus trituberculatus)等多种重要渔业生物提供了重要的产卵、育幼以及索饵洄游的场所(李建生等, 2004), 形成了中国最为著名的舟山渔场。近年来, 舟山海域经历了污水排放、捕捞、航运、清淤等形式多样、强度不一的人为扰动和环境变化(刘录三等, 2012; 张洪亮等, 2012), 对该海域的生物化学进程、生物多样性以及渔业生产等带来了深远的影响(Fan et al, 2014; Han et al, 2019)。
海洋底栖生物具有高度的生物多样性和复杂的生态学关系(李新正等, 2010; 沈国英等, 2010)。其中, 大型底栖动物物种多样性较高、生活史较长、运动性较弱, 其群落组成等信息能够灵敏地反应环境变化和人为扰动对生态环境的综合影响(Pearson et al, 1978; 蔡立哲, 2003; Qiu et al, 2018), 并可准确反映有机质积累等长期生态学效应(Pearson et al, 1978; 于子山等, 2001; Han et al, 2013; Kanaya et al, 2018)。根据2019~2020年舟山海域2个航次的大型底栖动物和环境因子的调查数据资料, 结合该海域已有的大型底栖动物群落组成等历史资料和研究报道, 分析舟山附近海域大型底栖动物群落组成特点及其与环境因子的内在关联, 旨在为东海近岸海域大型底栖动物群落的演变规律研究提供基础数据和科学依据。
1 材料与方法 1.1 调查区域和时间于2019年7~8月(夏季)至2020年7~8月(夏季)对舟山及邻近海域进行了2个航次的大型底栖动物调查取样, 调查区域为29°~31°N, 122°~124°E, 设置12个相同站位, 站位点分别标记为Z1~Z12, 站1、3、5、6、7、9、11分布在舟山, 站2、4、8、10、12分布在舟山邻近海域。站位分布如图 1所示。
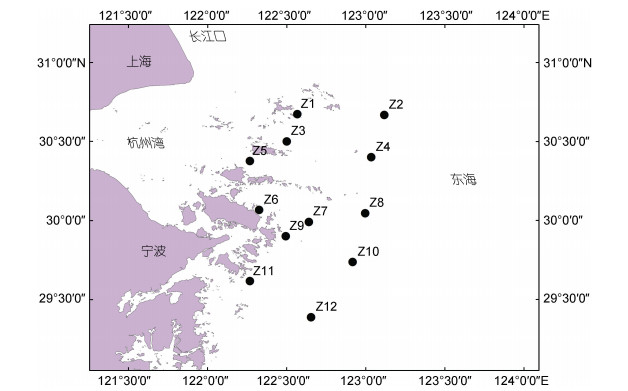 |
| 图 1 2019~2020年舟山及附近海域大型底栖动物采样站位分布图 Fig. 1 The sampling stations of macrobenthos in Zhoushan and adjacent areas during 2019~2020 |
采用0.1 m2的箱式采泥器进行大型底栖动物样品采集, 每站采集两次, 采集的泥样在船上用1.0 mm和0.5 mm孔径的套筛冲洗, 所得大型底栖动物样品采用75%的酒精固定, 带回实验室进行鉴定分析。
在实验室用1%的虎红酒精溶液对固定样品进行染色分拣, 将拣出的大型底栖动物在体视解剖镜(SZ61, 日本奥林巴斯)下进行形态学的分类鉴定, 鉴定到尽可能低的分类阶元, 物种的分类学归属参照WoRMS (www.marinespecies.org)的最新分类系统, 螠虫在本文中将被归于环节动物门多毛纲, 将不再单统计螠门。鉴定完成之后, 对该站位的所有物种进行计数和称量, 计数时, 易断的纽形动物和多毛类按头部计数, 蛇尾类按体盘数计数; 称重时, 将标本置于卫生纸上将其表面浸润的酒精拭干, 采用电子天平(600772, 上海花潮电器有限公司, 精度0.01 g)称量并记录, 管栖多毛类动物剥去栖居的泥管, 软体动物带贝壳称重。计算每个物种的丰度(ind./m2)和生物量(g/m2)。调查规范依据《海洋调查规范》第6部分: 海洋生物调查(中华人民共和国国家质量监督检验检疫总局等, 2008)。
水深、水温和盐度采用YSI水质检测仪测量(YSI, Ohio, USA)进行测量; pH采用pH计法; 溶解氧采用碘量法; 化学需氧量采用碱性高锰酸钾法; 活性磷酸盐采用磷钼蓝分光光度法/流动注射法; 亚硝酸盐采用奈乙二胺分光光度法/流动注射法; 硝酸盐采用锌-镉还原法/流动注射法; 铵盐采用次溴酸盐氧化法/流动注射法; 活性硅酸盐采用硅钼蓝法/流动注射法; 悬浮物采用过滤物重量法; 叶绿素a采用荧光分光光度法。
1.3 优势种分析大型底栖动物群落的优势种有着多种形式的计算方法和判定标准, 相对重要性指数(index of relative importance, IRI)全面考虑了大型底栖动物群落的个体数量、大小和分布频率密度等情况, 能够定量地反应出优势种在目标海域的地位、重要性和数量分布的变化情况(韩洁等, 2004), 更能反映优势种在群落生产力的重要性(Smith et al, 2003), 因此采用相对重要性指数(对大型底栖动物优势种进行排序和分析。优势度IRI计算公式(Pinkas et al, 1971)如下:
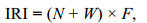 (1)
(1)式中, N为某一物种在该站位中的个体数百分比(单位: %), W为该种在该站位中的生物量百分比(单位: %), F为该种出现的站位数与总站位数的比率(单位: %)。
1.4 数据处理使用软件ArcGIS Desktop 10.6绘制采样站位分布图和环境因子及群落相关参数的分布图; 使用Microsoft Excel 2010计算优势度; 使用多元统计软件PRIMER (Plymouth Routines in Multivariate Ecological Research) version 6.0计算群落中各个站位的Shannon-Wiener多样性指数和Margalef物种丰富度指数、物种等级聚类(Cluster)和主坐标分析(principal coordinates analysis, PcoA); 使用R studio 1.1.447计算大型底栖动物的群落参数和环境因子的斯皮尔曼等级相关矩阵; 使用PASW Statistics 18.0计算群落参数之间的显著性差异和环境因子间的Pearson相关性分析。
在计算物种等级聚类(Cluster)之前, 先对大型底栖动物的数据进行整理, 经二次方根转化为Bray-Curtis矩阵, 再进行计算。在相关性系数和多重双变量相关的P值的计算过程中使用了Bonferroni-Holm较正。
2 结果 2.1 舟山及邻近海域大型底栖动物群落的优势种根据2019~2020年在舟山及邻近海域采集到的标本, 共鉴定出大型底栖动物56种, 其中多毛类动物28种, 甲壳动物8种, 软体动物7种, 棘皮动物6种, 刺胞动物3种、纽形动物2种, 星虫动物和脊索动物各1种。其中2019年有大型底栖动物30种, 2020年有37种, 两年共有物种有9种。多毛类动物是出现最多的动物类群, 占总种数的50.00%, 甲壳动物和软体动物次之, 分别占总物种数量的14.29%和12.50%。在使用箱式采泥器采泥时, 所采获的大型底栖动物以底内动物为主, 但是也采集到了一些底上动物, 如脊索动物中的鱼类孔鰕虎鱼(Trypauchen vagina), 甲壳动物中的日本鼓虾(Alpheus japonicus)、无刺口虾蛄(Oratosquillina inornata)、拉氏爱琴虾(Aegaeon lacazei)、直额蟳[Charybdis (Goniohellenus) truncate]等, 均具备一定的游泳能力和垂直移动能力。
2019~2020年间舟山及其邻近海域的大型底栖动物的优势度最大的10种优势种(表 1)如下: 分别为刺胞动物门的星虫爱氏海葵(Edwardsia sipunculoides), 多毛类动物的不倒翁虫(Sternaspis chinensis)、异足科索沙蚕(Kuwaita heteropoda, 即以前文献中出现的异足索沙蚕)、智利巢沙蚕(Diopatra chiliensis)、埃刺梳鳞虫(Ehlersileanira incisa)、竹节虫(Maldane sp.)和双唇索沙蚕(Lumbrineris cruzensis), 甲壳动物中的沟纹拟盲蟹(Typhlocarcinops canaliculatus), 棘皮动物的棘刺锚参(Protankyra bidentata)以及纽形动物门的纽虫(Nemertea)。在此10种优势种中, 除竹节虫和智利巢沙蚕外, 其余8种在2019和2020年两年间, 其相对重要性指数至少在某一年在前10位, 其中不倒翁虫在这两年的相对重要性指数均在前10位。在2019年, 相对重要性指数最高的是异足科索沙蚕(IRI= 588.37)和星虫爱氏海葵(IRI=451.80); 在2020年相对重要性指数最高的则为纽虫(IRI=2752.89)和沟纹拟盲蟹(IRI=393.08)。
| 类群 | 物种及拉丁名 | 相对重要性指数IRI | ||
| 2019年 | 2020年 | 两年 | ||
| 刺胞动物门 | 星虫爱氏海葵Edwardsia sipunculoides | 451.80 | 74.11 | 255.36 |
| 多毛类动物 | 不倒翁虫Sternaspis chinensis | 84.99 | 123.05 | 102.88 |
| 异足科索沙蚕Kuwaita heteropoda | 588.37 | 161.12 | ||
| 智利巢沙蚕Diopatra chiliensis | 81.52 | 49.95 | 67.5 | |
| 埃刺梳鳞虫Ehlersileanira incisa | 116.52 | 41.51 | 76.92 | |
| 竹节虫Maldane sp. | 55.38 | 111.54 | 80.3 | |
| 双唇索沙蚕Lumbrineris cruzensis | 316.68 | 87.54 | ||
| 纽形动物门 | 纽虫Nemertea | 2752.89 | 616.99 | |
| 节肢动物 | 沟纹拟盲蟹Typhlocarcinops canaliculatus | 16.27 | 393.08 | 142.44 |
| 棘皮动物 | 棘刺锚参Protankyra bidentata | 45.68 | 128.31 | 84.79 |
在2019~2020整个研究时间范围内, 舟山及其邻近海域大型底栖动物群落的总丰度组成如表 2所示: 多毛类(57.36%), 纽形动物门(15.49%), 节肢动物门(10.32%), 软体动物门(8.41%), 棘皮动物门(3.82), 刺胞动物门(3.63%), 脊索动物门(0.57%)和星虫动物(0.38%)。除纽虫外, 丰度最高的4个物种均为多毛纲动物, 即双唇索沙蚕、奇异稚齿虫(Paraprionospio pinnata)、持真节虫(Euclymene annandalei)、异足科索沙蚕, 此5种占据了整个采样周期丰度的33.08%。在采样周期内, 丰度最高的10种动物为日本刺沙蚕(Hediste japonica)、智利巢沙蚕、不倒翁虫、竹节虫、双唇索沙蚕、麦杆虫(Caprella sp.)、持真节虫、奇异稚齿虫、异足科索沙蚕和纽虫, 它们的丰度占据了总丰度的49.72%, 此10种动物除日本刺沙蚕和麦秆虫外, 在一个或两个采样季度的相对重要性指数在前十位。
| 类群 | 丰度 | 生物量 | |||
| 百分比/% | 平均值/(ind./m2) | 百分比/% | 平均值/(g/m2) | ||
| 刺胞动物 | 3.63 | 1.32 | 31.54 | 1.76 | |
| 环节动物 | 57.36 | 20.83 | 12.76 | 0.71 | |
| 纽形动物 | 15.49 | 5.63 | 2.68 | 0.15 | |
| 软体动物 | 8.41 | 3.06 | 11.57 | 0.65 | |
| 节肢动物 | 10.32 | 3.75 | 15.95 | 0.89 | |
| 棘皮动物 | 3.82 | 1.39 | 16.62 | 0.93 | |
| 星虫动物 | 0.38 | 0.14 | 1.02 | 0.06 | |
| 脊索动物 | 0.57 | 0.21 | 7.86 | 0.44 | |
| 合计 | 100.00 | 36.32 | 100.00 | 5.59 | |
在2019~2020整个研究时间范围内, 舟山及其邻近海域大型底栖动物群落的生物量组成如表 2所示: 多毛类(12.76%), 纽形动物门(2.68%), 节肢动物门(15.95%), 软体动物门(11.57%), 棘皮动物门(16.62), 刺胞动物门(31.54%), 脊索动物门(7.87%)和星虫动物(1.02%)。在整个采样周期, 刺胞动物门的星虫爱氏海葵、棘皮动物的棘刺锚参、脊索动物门的孔鰕虎鱼以及甲壳动物门的沟纹拟盲蟹是生物量的最大贡献者, 分别贡献了总生物量的29.30%、9.22%、7.86%和6.83%。对生物量来说, 较大个体的偶见种占据了较高的比例, 在生物量最高的前10物种中, 其中有6个物种, 包括江户明樱蛤(Moerella jedoensis)、无刺口虾蛄(Oratosquillina inornata)、节织纹螺(Nassarius hepaticus)、海棒槌(Paracaudina chilensis)、日本鼓虾(Alpheus japonicus)、红带织纹螺(Nassarius succinctus)仅出现一次, 但这6个物种的合计生物量占据了群落总生物量的23.14%。
2.3 舟山及邻近海域大型底栖动物丰富度指数和多样性指数在2019~2020整个研究时间范围内, 舟山及其邻近海域大型底栖动物群落的丰富度指数和多样性指数如表 3所示: 2019年, 舟山及其邻近海域各站位出现的底栖动物种类数为1~10种, 平均为4.67种; 丰富度指数(d)为0~1.85, 平均值为0.96; 多样性指数(H′)为0~2.23, 平均值为1.24; 舟山海域各站位出现的底栖动物种类数平均为3.34种, 丰富度指数(d)平均为0.74, 多样性指数(H′)平均为1.00; 舟山邻近海域各站位出现的底栖动物种类数平均为6.40种, 丰富度指数(d)平均为1.26, 多样性指数(H′)平均为1.58。2020年, 舟山及其邻近海域各站位出现的底栖动物种类数为1~11种, 平均为6.17种; 丰富度指数(d)为0~2.24, 平均值为1.45; 多样性指数(H′)为0~2.17, 平均值为1.56; 舟山海域各站位出现的底栖动物种类数平均为5.00种, 丰富度指数(d)平均为1.21, 多样性指数(H′)平均为1.35; 舟山邻近海域各站位出现的底栖动物种类数平均为7.80种, 丰富度指数(d)平均为1.80, 多样性指数(H′)平均为1.85。总体来看, 2020年舟山及邻近海域大型底栖动物的总物种数、丰富度指数和多样性指数高于2019年, 且两年舟山海域大型底栖动物的总物种数、丰富度指数和多样性指数均高于舟山邻近海域。
| 年份 | 站号 | 总物种数 | 丰富度指数(d) | 多样性指数(H′) |
| 2019 | Z1 | 5 | 1.13 | 1.48 |
| Z2 | 8 | 1.71 | 2.02 | |
| Z3 | 6 | 1.41 | 1.75 | |
| Z4 | 6 | 1.16 | 1.59 | |
| Z5 | 1 | 0 | 0 | |
| Z6 | 3 | 0.74 | 1.10 | |
| Z7 | 5 | 1.18 | 1.56 | |
| Z8 | 10 | 1.85 | 2.23 | |
| Z9 | 3 | 0.74 | 1.10 | |
| Z10 | 6 | 1.20 | 1.41 | |
| Z11 | 1 | 0 | 0 | |
| Z12 | 2 | 0.37 | 0.64 | |
| 平均值 | 4.67 | 0.96 | 1.24 | |
| 2020 | z1 | 7 | 1.71 | 1.89 |
| z2 | 11 | 2.24 | 2.17 | |
| z3 | 7 | 1.71 | 1.83 | |
| z4 | 9 | 2.08 | 1.96 | |
| z5 | 3 | 0.77 | 1.04 | |
| z6 | 3 | 0.71 | 1.05 | |
| z7 | 9 | 2.12 | 2.03 | |
| z8 | 8 | 1.82 | 1.91 | |
| z9 | 5 | 1.42 | 1.61 | |
| z10 | 5 | 1.27 | 1.47 | |
| z11 | 1 | 0 | 0 | |
| z12 | 6 | 1.59 | 1.75 | |
| 平均值 | 6.17 | 1.45 | 1.56 |
等级Cluster聚类(图 2)结果表明, 舟山及邻近海域的大型底栖动物群落的相似性较低, 大型底栖动物群落仅可在17%左右的相似性水平上分成5组, 显示出明显的年际差异, 2020年站位除Z9和Z11站外, 均聚到同一个组内; 不同站位的群落结构相似性不高, 聚类未能获得较好的结果。随后, 通过对各采样站位和各年份的底栖群落进行了SIMPER分析, 结果也与以上结果相符, 群落的平均相似性只有9.80%。对两年大型底栖动物群落的SIMPER单因子分析显示, 舟山及其邻近海域大型底栖动物不同年份的群落平均相似性维持在较低的水平, 2020年平均相似性略高, 也仅19.97%, 2019年平均相似性仅有11.23%。异足科索沙蚕和双唇索沙蚕是2019年群落相似性的主要贡献者, 仅异足科索沙蚕的相似性贡献率即达37.79%, 两个物种的累积贡献率达55.14%; 而纽虫则为2020年群落相似性的最重要贡献者, 其单种的群落相似性贡献率即达64.39%。两年间的群落不相似性高达95.52%。大型底栖动物群落间的显著的年际变化也有PcoA分析(图 3)中得到进一步直观展示, 后续的ANOSIM验证结果显示statistic R=0.459, Significance=0.001 < 0.01, 处于差异极显著水平。同时对两年的物种数、丰度、生物量、丰富度指数和多样性指数做Kruskal-Wallis检验, 结果显示: 仅丰富度指数存在显著性差异(P < 0.05), 物种数、丰度、生物量和多样性指数不存在显著性差异(P > 0.05)。
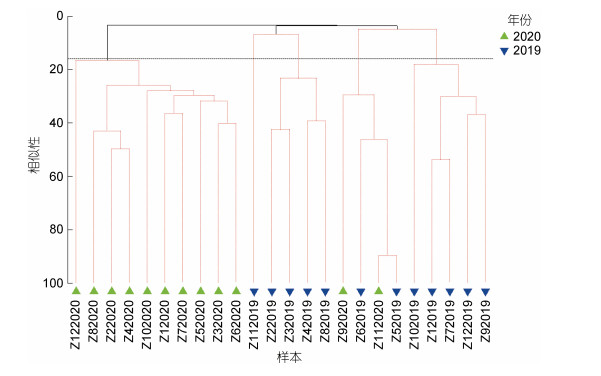 |
| 图 2 2019~2020年舟山及其邻近海域大型底栖动物群落的聚类分析 Fig. 2 Cluster analysis of macrobenthic community in Zhoushan Islands and adjacent waters during 2019~2020 |
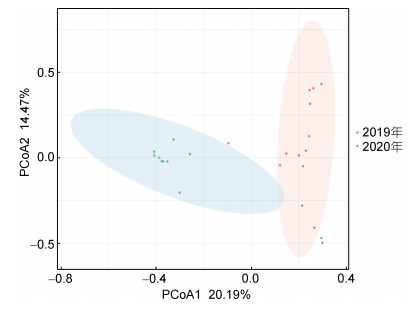 |
| 图 3 舟山海域大型底栖动物群落PCoA主坐标分析图 Fig. 3 PCoA results of macrobenthic community in Zhoushan Island and the adjacent |
2019~2020年舟山海域大型底栖动物群落与环境因子的斯皮尔曼等级相关矩阵(图 4)显示, 大型底栖动物群落受水深、温度、盐度、溶解氧和硝酸氮等环境因子的影响较大, 包括物种数、丰度、丰富度(Margalef物种丰富度指数)和多样性(Shannon-Wiener多样性指数), 但生物量受环境因子的影响较小。在显著影响舟山海域大型底栖动物群落的4个因子中, 群落参数与水深、盐度呈现较高的正相关性, 而与温度和硝酸氮呈现较高的负相关性。经过进一步的显著性验证, 群落丰度与水深存在显著的正相关性(P < 0.05); 物种数和丰度均与盐度存在显著的正相关性(P < 0.05); 而物种数和物种丰富度均与硝酸氮存在显著的负相关性(P < 0.05)。
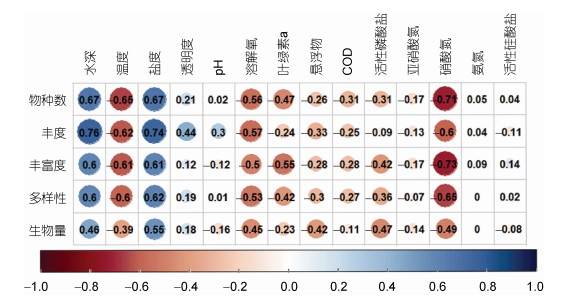 |
| 图 4 2019~2020年舟山海域大型底栖动物群落与环境因子的斯皮尔曼等级相关矩阵 Fig. 4 The Spearman rank correlation matrix between macrobenthic community parameters and environmental factors during 2019~2020 in Zhoushan and adjacent waters |
同时, 使用SPSS软件对水深、温度、盐度和硝酸氮做皮尔逊双变量相关分析, 结果(表 4)显示, 盐度与水深呈显著正相关, 盐度和硝酸氮呈显著负相关, 硝酸氮和水深呈显著负相关。
| 环境因子 | 水深 | 盐度 | 硝酸氮 | 温度 |
| 水深 | 1 | |||
| 盐度 | 0.78** | 1 | ||
| 硝酸氮 | –0.81** | –0.60** | 1 | |
| 温度 | –0.80** | –0.85** | 0.63** | 1 |
| 注: **表示在P < 0.01水平(双侧)上显著 | ||||
经过两年的调查, 本研究在舟山及邻近海域的12个站位共发现大型底栖动物56种, 多毛类动物、甲壳动物和软体动物是主要成分, 这种群落组成结构与前人研究结果相似(王晓波等, 2016)。其中多毛类动物共28种, 占总种数的50.00%, 甲壳动物共8种, 占总种数的14.29%, 软体动物共7种, 占总种数的12.50%, 这说明舟山及附近海域营养物质丰富, 有利于多毛类动物的生存(徐兆东等, 2015)。
在2019~2020年的研究中, 通过采泥器进行样品采样, 捕获了部分大型底上动物, 如脊索动物中的孔

大型底栖动物优势种在群落结构中占据重要地位, 对群落结构和群落环境的形成具有明显的控制作用(Santos et al, 1983; Ruiz-Navarro et al, 2019), 是底栖生态系统物质循环和能量流动中主要的消费者和转移者, 其变化能够准确地反映所处环境长期、宏观变化(Fukumori et al, 2008), 其长期演变研究可为海洋生物多样性及生态动力学研究提供重要的科学依据(彭松耀等, 2017)。
与舟山海域以往的历史研究相类似, 多毛类动物仍然占据着大型底栖动物群落的绝对优势, 相对重要性指数排名前10的优势种中有多毛类动物6种, 不倒翁虫为绝对的优势种; 与此同时, 生物量占比较高的物种也被列入优势种, 如星虫爱氏海葵、沟纹拟盲蟹以及棘刺锚参等大个体生物。底质对多毛类的分布有重要作用(王金宝等, 2006)。不倒翁虫也被称为泥鸮(mud owls) (Jose et al, 2014), 是一种很常见的广温广盐性种类, 从浅滩到深海均有分布, 为底泥有机物摄食者(严润玄等, 2020), 对较细的底质环境具有一定的偏好(Jumars et al, 2015), 对生活海域中盐度和混浊度有很强的忍耐能力, 当然这与其生活于底质当中, 而底质中盐度和浑浊度的改变程度比水体中盐度和浑浊度的改变要小得多有关(Townsend et al, 2006)。不倒翁虫对环境的很强的适应能力使得它成为舟山附近海域的优势种, 如舟山西南金塘岛附近海域(杨磊等, 2017)以及舟山北部岱山海域(章飞军等, 2017), 说明舟山附近海域底泥富含有机物质。除此之外, 在渤海湾近岸(王瑜等, 2010)、莱州湾(周红等, 2010)、烟台四十里湾(杨陆飞等, 2019)、胶州湾(王金宝等, 2006)、北黄海(曲方圆等, 2009)、苏北浅滩(范士亮等, 2010)、长江口(李宝泉等, 2007; 刘录三等, 2008)、杭州湾(寿鹿等, 2012)、象山港(王金辉等, 2006; 廖一波等, 2014)、乐清湾(王航俊等, 2020)、闽北(程宏等, 2018)、洞头(贾胜华等, 2016)等海域也为优势种。
3.2 舟山海域大型底栖动物群落丰度、生物量、丰富度指数和多样性指数在122°30′~123°30′E的舟山海域, 为长江冲淡水与外海海水的交汇区, 此处已经基本远离长江入海泥沙沉降区, 底质稳定, 海水盐度较近岸水域高, 兼之台湾暖流入侵带来的大量磷盐(Fan et al, 2014), 底栖生物种类呈现复杂化, 生物量、栖息密度以及生物多样性指数较高(刘录三等, 2008), 并且总体上呈现一种自长江入海口向舟山东部外海逐渐递增的趋势(刘勇等, 2008), 并在124°E附近物种多样性达到最高(李宝泉等, 2007), 舟山海域大型底栖生物的生物量、丰度和多样性指数也呈现由近岸向外海递增的趋势(贾海波等, 2011)。
参考近舟山海域近三十年来大型底栖动物的研究报道(表 5), 在2019~2020年的研究中舟山海域大型底栖动物群落的物种数量(56种)和群落丰度(36.32 ind./m2)与过去的研究报道差别不大。2019~2020年采集到的56种大型底栖动物, 仅少于1988年的102种、2009年4月的84种以及1996~2005年的69种, 但是, 1988年、2009年和1996~2005年三次调查研究均使用了阿氏拖网和采泥器两种采样方式, 包含了大量的大型底上动物(胡颢琰等, 2009; 贾海波等, 2011), 物种数量在1988~1989年达到最高, 但该研究为3个季节的采样数据。贾海波等(2011)年在舟山外海采集到的大量多毛类(190.8 ind./m2), 使其丰度远高于其他数据。在舟山海域的大型底栖动物群落研究中, 多毛类动物通常会占据群落的绝对优势, 主要优势种为不倒翁虫等, 且群落的斑块或镶嵌状分布格局相当明显, 这与大型底栖动物分布深受底质状况影响, 与底质微生境中的不规则斑块分布密不可分(Snelgrove et al, 1994)。舟山海域的群落生物量在1996~2009年间基本稳定在12 g/m2左右, 而在2019~2020年间仅5.59 g/m2, 处于近三十年的较低水平, 其原因首先可能是优势种多为多毛类动物, 个体较小, 其次本研究采集的泥样用1.0 mm和0.5 mm孔径的套筛冲洗, 从而导致生物量低, 最后可能与近年来频繁的人为扰动有关。舟山海域水产养殖和轮渡运输等活动频繁, 可能会对底栖动物造成影响。1988~1989年以及2015年5~10月在舟山港以及金塘岛的生态调查, 其获得的大型底栖动物群落生物量处于更低的水平, 最低生物量仅0.142 g/m2 (杨磊等, 2017)。该海域地处杭州湾与南部象山港的通道位置, 是著名的镇海—舟山水道, 是太平洋潮波进入杭州湾的四条水道之一, 具有最大的落潮流, 受杭州湾高悬浮沙含量以及反复沉积再悬浮(大冲大淤)的影响(中国海湾志编纂委员会, 1992), 并受海水表底层盐度明显分层等影响, 大型底栖动物在此生存困难(Meng et al, 2021), 因而物种数量少、丰度和生物量较之2019~2020年的研究更低。
| 年份 | 物种数量 | 丰度/(ind./m2) | 生物量/(g/m2) | 优势种 | 参考文献 |
| 1988~1989 | 102 | 33.6 | 2.20 | 采泥大型底栖动物以多毛类占绝对优势 | (唐静亮等, 1990) |
| 1996~2005 | 69 | 41.3 | 12.46 | 白虾群落占优势地位 | (胡颢琰等, 2009) |
| 2005.07 | 44 | 33.00 | 12.45 | — | (王延明等, 2008) |
| 2009.04 | 84 | 208.5 | 11.62 | 常见种双鳃内卷齿蚕(Aglaophamus dibranchis)、色斑角吻沙蚕(Goniada maculata)、双形拟单指虫(Cossurella dimorpha) | (贾海波等, 2011) |
| 2012~2016 | — | — | — | 不倒翁虫为绝对优势种, 日本鼓虾、纵沟纽虫、豆形胡桃蛤、圆锯齿吻沙蚕、异足科索沙蚕和圆筒原核螺 | (严润玄等, 2020) |
| 2015.05~10 | 27 | 15.34 | 0.142 | 春季为不倒翁虫、西格织纹螺(Nassarius siquijorensis)和豆形胡桃蛤(Nucula faba) 秋季为不倒翁虫、树蛰虫(Pista cristata)和豆形胡桃蛤 |
(杨磊等, 2017) |
| 2019~2020 | 56 | 36.32 | 5.59 | 不倒翁虫、纽虫(Nemertea)等12种 | 本研究 |
2019~2020年的研究区域为122°00′~123°30′E, 未到124°E。2020年舟山及邻近海域大型底栖动物的总物种数、丰富度指数和多样性指数高于2019年, 且两年舟山海域大型底栖动物的总物种数、丰富度指数和多样性指数均高于舟山邻近海域。从丰富度指数和多样性指数来看, 本研究也呈现一种自长江入海口向舟山东部外海逐渐递增的趋势。蔡立哲等(2002)在研究海洋底栖动物种类多样性指数污染程度评价标准时指出, 一般来说, H′值小于1, 重污染; H′值在1~2之间, 中等污染; H′值在2~3之间, 轻度污染; H′值大于3, 清洁。依此标准, 2020年的舟山及邻近海域的污染程度低于2019年, 且两年的舟山邻近海域的污染程度低于舟山海域, 但该海域仍处于中等污染状态。与历史调查结果相比较, 2016年舟山近海海域底栖动物多样性指数平均值为1.05 (蔡丽萍等, 2018), 2019年多样性指数平均值为1.24, 2020年多样性指数平均值为1.56, 可以看出, 多样性指数逐步上升, 绿水青山就是金山银山的呼吁已在舟山海域初具成效, 但仍需长期坚持保护环境的政策。
3.3 舟山海域大型底栖动物群落的主要影响因子大型底栖动物对海洋环境变化比较敏感, 水质和生态环境等的变化会导致底栖动物群落结构及其习性发生变化(其木乐等, 2020)。根据舟山及邻近海域大型底栖动物群落年际差异分析可以得知, 两年的大型底栖动物群落相似性较低存在显著的年际变化且两年丰富度指数存在显著性差异, 这种年际变化差异极有可能是环境因子变化造成的。在舟山海域, 影响大型底栖动物群落组成和结构的最重要的环境因子包括水深、底层水盐度和硝态氮(NO3), 但这3个参数并非孤立的环境参数, 三者之间的联系异常紧密, SPSS的皮尔逊双变量相关分析(表 4)结果显示, 盐度与水深的相关性高达0.78, 盐度与硝酸氮的相关性高达-0.60, 而水深与硝酸氮的相关性高达–0.81。
尽管舟山海域远离长江口达上百公里, 但长江和钱塘江等河流带来的大量冲淡水对舟山海域的影响仍十分深远, 长江冲淡水与外海海水在此交汇, 如较靠近杭州湾的Z5站, 水深18 m, 表层盐度只有15.27, 而底层盐度为21.53; 邻近的Z3, 水深28 m, 表层盐度和底层盐度分别为23.89和34.23, 表层和底层的盐度差异非常显著。部分大型底栖动物可容忍大幅度的盐度变化(盐度5~55) (De Villiers et al, 1999), 因此大型底栖动物的丰度、物种丰富度等不随盐度的改变而改变(Teske et al, 2001)。但在2019~2020年的研究中发现, 舟山海域大型底栖动物的物种数量、丰度、丰富度和多样性等与盐度具有显著的正相关关系(P < 0.05), 即随着盐度的上升, 大型底栖动物的群落物种数量、丰度和丰富度随之上升。在河口海域, 盐度往往是决定底栖生物群落分布的重要因子(Ysebaert et al, 2002), 其对河口底栖动物分布(Holland et al, 1987; Gaston et al, 1998; Ysebaert et al, 2002; Teske et al, 2003; Chainho et al, 2006)和群落结构具有决定性作用(Rakocinski et al, 1997)。盐度梯度作为生物的生理屏障, 对狭盐性物种的分布进行胁迫限制, 包括底栖动物、鱼类和浮游动物(Teske et al, 2003)。盐度可通过扰动底质的稳定性, 进而对大型底栖动物群落产生扰动(Van Diggelen et al, 2016)。通常, 大型底栖动物的物种丰富度、丰度和多样性会随盐度的升高而增加, 但底内食碎屑动物的比例会随盐度增高而降低(Gaston et al, 1998; Weslawski, 1999; Udalov et al, 2004)。
20世纪以来的富营养化均与过量的氮磷营养盐输入有关(Rabalais et al, 2009)。2019~2020年的研究中发现舟山海域大型底栖动物物种数和物种丰富度与硝酸氮呈显著的负相关关系, 即随着硝酸氮含量的上升, 大型底栖动物的群落物种数量和物种丰富度随之下降。舟山海域受邻近杭州湾和象山港的影响, 无机氮和活性磷酸盐超标严重, 氮磷含量的升高将直接导致水体富营养化, 湾内海水为劣四类水质, 呈重度富营养化状态(中华人民共和国生态环境部, 2021)。在富营养化水环境中, 大型底栖动物受到NH4+和NO2–等无机氮化合物的直接毒性效应(Camargo et al, 2006), 对海洋大型底栖动物的生长速率、生殖和代谢产生影响(Jessen et al, 2015)。持续的富营养化扰动的存在, 减弱了大型底栖动物的运动能力、摄食效率和生物扰动活性(Briggs et al, 2015), 降低了底栖动物的物种丰富度、丰度和现存生物量(Kodama et al, 2011), 触发大型底栖动物群落组成由多样性和异质性较高、营养级较复杂的双壳类、多毛类和甲壳动物转向大量耐受性较强、生命寿限较短的食底泥者机会种(Tomašových et al, 2018), 其现存生物量也将大幅降低(Kemp et al, 2005); 而以小型多毛类为主的群体, 由于粒径大小或消化功能问题不易被游泳动物摄食(Jumars et al, 2015), 从而引发游泳动物群落组成和结构的改变(Peterson et al, 2000)。长此以往, 碳传递限制导致的生物量降低将会引发整个底栖食物网的巨大破坏和经济渔业的变迁(Norkko et al, 2010)。
此外, 本文研究得出大型底栖动物生物量受环境因子的影响较小, 此研究结果与纪莹璐等(2021)在青岛董家口研究结果相似, 即大型底栖动物生物量与各环境因子均无显著相关, 但也有的研究得出的结论差异较大, 即大型底栖动物生物量与有机质质量分数、粉砂和黏土质量分数等显著相关(田胜艳等, 2020)。影响大型底栖动物的环境因子众多, 除本文采集到的环境因子外, 沉积物的粒径、泥砂黏土含量、有机质含量等因素也能对底栖动物群落产生影响, 应在今后对舟山海域的研究中增加这些因素的测定及研究, 探究舟山海域底栖环境的变化, 更加合理地利用该海域。
4 结论(1) 2019~2020年在舟山及邻近海域共采集到大型底栖动物56种, 其中包含部分大型底上动物, 如舟山海域的优势或常见底上动物无刺口虾蛄、直额蟳和孔鰕虎鱼等。依相对重要性指数来看, 2019年最高的是异足科索沙蚕和星虫爱氏海葵, 而在2020年则为纽虫和沟纹拟盲蟹。
(2) 舟山海域大型底栖动物群落的物种数量和群落丰度与过去30年差别不大, 且多毛类动物占据群落的绝对优势, 主要优势种为不倒翁虫等; 但群落生物量处于近三十年的较低水平。2020年舟山及邻近海域大型底栖动物的总物种数、丰富度指数和多样性指数高于2019年, 且两年舟山海域大型底栖动物的总物种数、丰富度指数和多样性指数均高于舟山邻近海域。
(3) 在舟山附近海域, 水深、底层水盐度和硝态氮(NO3)是形成并构建大型底栖动物群落组成和结构的最重要的环境因子。其中, 盐度和水深与大型底栖动物的物种数量、丰度、丰富度和多样性等均具有显著的正相关关系, 而硝态氮(NO3)与物种数和物种丰富度呈显著的负相关关系。
《中国海岛志》编纂委员会, 2014. 中国海岛志 浙江卷 第二册 舟山群岛南部. 北京: 海洋出版社
|
于子山, 张志南, 韩洁, 2001. 渤海大型底栖动物次级生产力的初步研究. 青岛海洋大学学报, 31(6): 867-871 DOI:10.3969/j.issn.1672-5174.2001.06.007 |
王延明, 李道季, 方涛, 等, 2008. 长江口及邻近海域底栖生物分布及与低氧区的关系研究. 海洋环境科学, 27(2): 139-143, 164 DOI:10.3969/j.issn.1007-6336.2008.02.010 |
王金宝, 李新正, 王洪法, 2006. 胶州湾多毛类环节动物优势种的生态特点. 动物学报, 52(1): 63-69 |
王金辉, 杨春旺, 孙亚伟, 等, 2006. 象山港大型底栖动物的生物多样性和次级生产力研究. 天津农学院学报, 13(2): 24-28 DOI:10.3969/j.issn.1008-5394.2006.02.006 |
王晓波, 江河, 李伯康, 等, 2016. 浙江渔山列岛海域大型底栖动物群落组成和结构研究. 海洋通报, 35(6): 666-673 |
王航俊, 姚炜民, 林义, 等, 2020. 乐清湾大型底栖动物群落及其与环境因子之间的关系. 海洋学报, 42(2): 75-86 DOI:10.3969/j.issn.0253-4193.2020.02.008 |
王瑜, 刘录三, 刘存歧, 等, 2010. 渤海湾近岸海域春季大型底栖动物群落特征. 环境科学研究, 23(4): 430-436 DOI:10.13198/j.res.2010.04.56.wangy.008 |
中华人民共和国生态环境部, 2021. 2020年中国海洋生态环境状况公报[R]. 北京: 生态环境部.
|
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会, 2008. 海洋调查规范第6部分: 海洋生物调查: GB/T 12763.6-2007[S]. 北京: 中国标准出版社.
|
中国海湾志编纂委员会, 1992. 中国海湾志第五分册. 北京: 海洋出版社
|
田胜艳, 张文亮, 于子山, 等, 2010. 胶州湾大型底栖动物的丰度、生物量和生产量研究. 海洋科学, 34(6): 81-87 |
曲方圆, 于子山, 刘卫霞, 等, 2009. 北黄海春季大型底栖生物群落结构. 中国海洋大学学报, 39(增刊1): 109-114 |
刘录三, 郑丙辉, 李宝泉, 等, 2012. 长江口大型底栖动物群落的演变过程及原因探讨. 海洋学报, 34(3): 134-145 |
刘录三, 孟伟, 田自强, 等, 2008. 长江口及毗邻海域大型底栖动物的空间分布与历史演变. 生态学报, 28(7): 3027-3034 |
刘勇, 线薇薇, 孙世春, 等, 2008. 长江口及其邻近海域大型底栖动物生物量、丰度和次级生产力的初步研究. 中国海洋大学学报, 38(5): 749-756 |
刘清河, 马林, 李新正, 2020. 东海北部小型底栖动物群落对径流及黑潮暖流入侵的响应. 海洋学报, 42(2): 52-64 DOI:10.3969/j.issn.0253-4193.2020.02.006 |
刘瑞玉, 1955. 中国北部的经济虾类. 北京: 科学出版社
|
纪莹璐, 张亮, 宿凯, 等, 2021. 青岛董家口春季大型底栖动物群落结构及其与环境因子关系. 海洋湖沼通报, 43(5): 99-108 |
寿鹿, 曾江宁, 廖一波, 等, 2012. 杭州湾大型底栖动物季节分布及环境相关性分析. 海洋学报, 34(6): 151-159 |
严润玄, 冯明, 王晓波, 等, 2020. 浙江北部海域大型底栖动物优势种的时空分布. 海洋与湖沼, 51(5): 1162-1174 |
李宝泉, 李新正, 王洪法, 等, 2007. 长江口附近海域大型底栖动物群落特征. 动物学报, 53(1): 76-82 |
李建生, 李圣法, 任一平, 等, 2004. 长江口渔场渔业生物群落结构的季节变化. 中国水产科学, 11(5): 432-439 DOI:10.3321/j.issn:1005-8737.2004.05.009 |
李新正, 刘录三, 李宝泉, 2010. 中国海洋大型底栖生物: 研究与实践. 北京: 海洋出版社
|
杨陆飞, 陈琳琳, 李晓静, 等, 2019. 烟台牟平海洋牧场季节性低氧对大型底栖动物群落的生态效应. 生物多样性, 27(2): 200-210 |
杨磊, 黄瑞换, 卢占晖, 等, 2017. 金塘岛海域大型底栖动物分布及其与环境因子的关系. 浙江海洋学院学报(自然科学版), 36(4): 295-301, 307 DOI:10.3969/j.issn.1008-830X.2017.04.003 |
沈国英, 黄凌风, 郭丰, 等, 2010. 海洋生态学. 3版. 北京: 科学出版社
|
宋海棠, 俞存根, 薛利建, 等, 2006. 东海经济虾蟹类. 北京: 海洋出版社
|
张洪亮, 梁君, 贺舟挺, 等, 2012. 岱衢洋渔业动物多样性分析. 水生生物学报, 36(5): 922-931 |
其木乐, 李宁, 白露超, 等, 2020. 湟水河上游底栖动物群落结构及其与环境因子间的关系. 南京农业大学学报, 43(1): 72-79 |
范士亮, 王宗兴, 徐勤增, 等, 2010. 苏北浅滩邻近海域秋季大型底栖动物生态特征. 海洋科学进展, 28(4): 489-497 DOI:10.3969/j.issn.1671-6647.2010.04.009 |
周伟华, 殷克东, 朱德第, 2006. 舟山海域春季浮游植物生物量及东海原甲藻赤潮频发机制初探. 应用生态学报, 17(5): 887-893 DOI:10.3321/j.issn:1001-9332.2006.05.026 |
周红, 华尔, 张志南, 2010. 秋季莱州湾及邻近海域大型底栖动物群落结构的研究. 中国海洋大学学报, 40(8): 80-87 |
周进, 付婧, 韩庆喜, 2018. 长江口大型底栖动物. 北京: 中国农业出版社
|
胡敦欣, 杨作升, 2001. 东海海洋通量关键过程. 北京: 海洋出版社
|
胡颢琰, 施建荣, 刘志刚, 等, 2009. 长江口及其附近海域底栖生物生态调研. 环境污染与防治, 31(11): 84-87, 106 DOI:10.3969/j.issn.1001-3865.2009.11.022 |
俞存根, 陈全震, 陈小庆, 等, 2010. 舟山渔场及邻近海域鱼类种类组成和数量分布. 海洋与湖沼, 41(3): 410-417 |
俞存根, 陈全震, 陈小庆, 等, 2011. 舟山渔场及邻近海域虾蛄类的种类组成和数量分布. 大连海洋大学学报, 26(2): 153-156 DOI:10.3969/j.issn.1000-9957.2011.02.011 |
贾胜华, 曾江宁, 廖一波, 等, 2016. 洞头列岛及邻近海域大型底栖动物群落结构的研究. 海洋学研究, 34(2): 83-92 DOI:10.3969/j.issn.1001-909X.2016.02.011 |
贾海波, 胡颢琰, 唐静亮, 等, 2011. 陆源有机污染对舟山海域大型底栖生物分布的影响. 中国环境监测, 27(5): 65-69 DOI:10.3969/j.issn.1002-6002.2011.05.016 |
徐兆东, 石洪华, 李乃成, 等, 2015. 庙岛群岛南部海域大型底栖动物群落结构及其与环境因子的关系. 环境科学研究, 28(5): 704-712 |
唐静亮, 胡颢琰, 1990. 舟山港海域底栖生物生态的初步研究. 海洋环境科学, 9(4): 35-39 |
章飞军, 柳涛, 应岳, 等, 2017. 岱山海域大型底栖动物多样性分析. 海洋开发与管理, 34(9): 120-124 |
彭松耀, 李新正, 徐勇, 等, 2017. 十年间黄海大型底栖动物优势种的变化. 海洋与湖沼, 48(3): 536-542 |
韩庆喜, 2009. 中国及相关海域褐虾总科系统分类学和动物地理学研究[D]. 青岛: 中国科学院研究生院(海洋研究所).
|
韩洁, 张志南, 于子山, 2004. 渤海中、南部大型底栖动物的群落结构. 生态学报, 24(3): 531-537 |
程宏, 王金辉, 唐娅菲, 等, 2018. 春季闽北海域大型底栖动物群落特征及环境质量分析. 上海海洋大学学报, 27(2): 238-249 |
蔡立哲, 2003. 大型底栖动物污染指数(MPI). 环境科学学报, 23(5): 625-629 |
蔡立哲, 马丽, 高阳, 等, 2002. 海洋底栖动物多样性指数污染程度评价标准的分析. 蔡立哲, 马丽, 高阳, 等, 41(5): 641-646 |
蔡丽萍, 金敬林, 吴盈子, 2018. 2016年夏季舟山近岸海域底栖生物调查与研究. 海洋开发与管理, 35(9): 82-87 |
廖一波, 曾江宁, 寿鹿, 等, 2014. 象山港人工鱼礁投放对大型底栖动物群落结构的影响. 海洋与湖沼, 45(3): 487-495 |
BRIGGS K B, HARTMANN V A, YEAGER K M, et al, 2015. Influence of hypoxia on biogenic structure in sediments on the Louisiana continental shelf. Estuarine, Coastal and Shelf Science, 164: 147-160 |
CAMARGO J A, ALONSO Á, 2006. Ecological and toxicological effects of inorganic nitrogen pollution in aquatic ecosystems: a global assessment. Environment International, 32(6): 831-849 |
CHAINHO P, COSTA J L, CHAVES M L, et al, 2006. Seasonal and spatial patterns of distribution of subtidal benthic invertebrate communities in the Mondego River, Portugal–a poikilohaline estuary. Hydrobiologia, 555(1): 59-74 |
CHEN J Y, LI D J, CHEN B L, et al, 1999. The processes of dynamic sedimentation in the Changjiang Estuary. Journal of Sea Research, 41(1/2): 129-140 |
DE VILLIERS C, HODGSON A, FORBES A, 1999. Studies on estuarine macroinvertebrates [M] // ALLANSON B, BAIRD D. Estuaries of South Africa. Cambridge: Cambridge University Press: 167-191.
|
FAN W, SONG J B, 2014. A numerical study of the seasonal variations of nutrients in the Changjiang River estuary and its adjacent sea area. Ecological Modelling, 291: 69-81 |
FUKUMORI K, OI M S, DOI H, et al, 2008. Bivalve tissue as a carbon and nitrogen isotope baseline indicator in coastal ecosystems. Estuarine, 79(1): 45-50 |
GASTON G R, RAKOCINSKI C F, BROWN S S, et al, 1998. Trophic function in estuaries: response of macrobenthos to natural and contaminant gradients. Marine and Freshwater Research, 49(8): 833-846 |
GONG G C, LEE CHEN Y L, LIU K K, 1996. Chemical hydrography and chlorophyll a distribution in the East China Sea in summer: implications in nutrient dynamics. Continental Shelf Research, 16(12): 1561-1590 |
HAN Q X, WANG X B, 2019. Macrobenthic biomass and secondary production in the northern East China sea and the relative importance of environmental variables. Pacific Science, 73(2): 249-259 |
HAN Q X, WANG Y Q, ZHANG Y, et al, 2013. Effects of intensive scallop mariculture on macrobenthic assemblages in Sishili Bay, the northern Yellow Sea of China. Hydrobiologia, 718(1): 1-15 |
HOLLAND A F, SHAUGHNESSY A T, HIEGEL M H, 1987. Long-term variation in mesohaline Chesapeake Bay macrobenthos: spatial and temporal patterns. Estuaries, 10(3): 227-245 |
ICHIKAWA H, BEARDSLEY R C, 2002. The current system in the Yellow and East China Seas. Journal of Oceanography, 58(1): 77-92 |
JESSEN C, BEDNARZ V N, RIX L, et al, 2015. Marine eutrophication [M] // ARMON R H, HÄNNINEN O. Environmental Indicators. Dordrecht: Springer: 177-203.
|
JOSE H M P M, MUTHUVELU S, SIVARAJ S, et al, 2014. A note on the occurrence of Sternaspis scutata (Renier 1807) – a sternaspid polychaete from sundarban mangroves, West Bengal, India. Bombay Natural History Society, 111(1): 23-25 |
JUMARS P A, DORGAN K M, LINDSAY S M, 2015. Diet of worms emended: an update of polychaete feeding guilds. Annual Review of Marine Science, 7: 497-520 |
KANAYA G, NAKAMURA Y, KOIZUMI T, 2018. Ecological thresholds of hypoxia and sedimentary H2S in coastal soft-bottom habitats: a macroinvertebrate-based assessment. Marine Environmental Research, 136: 27-37 |
KEMP W M, BOYNTON W R, ADOLF J E, et al, 2005. Eutrophication of Chesapeake Bay: historical trends and ecological interactions. Marine Ecology Progress Series, 303: 1-29 |
KODAMA K, HORIGUCHI T, 2011. Effects of hypoxia on benthic organisms in Tokyo Bay, Japan: a review. Marine Pollution Bulletin, 63(5/12): 215-220 |
MENG Z, HAN Q Z, WANG X B, 2021. Distribution pattern of macrobenthic composition, diversity and secondary production in Hangzhou Bay, northern East China Sea. Regional Studies in Marine Science, 47: 101956 |
NORKKO J, NORKKO A, THRUSH S F, et al, 2010. Conditional responses to increasing scales of disturbance, and potential implications for threshold dynamics in soft-sediment communities. Marine Ecology Progress Series, 413: 253-266 |
PEARSON T H, ROSENBERG R, 1978. Macrobenthic succession in relation to organic enrichment and pollution of the marine environment. Oceanography and Marine Biology: An Annual Review, 16: 229-311 |
PETERSON C H, SUMMERSON H C, THOMSON E, et al, 2000. Synthesis of linkages between benthic and fish communities as a key to protecting essential fish habitat. Bulletin of Marine Science, 66(3): 759-774 |
PINKAS L, OLIPHANT M S, IVERSON I L K, 1971. Fish bulletin 152. Food habits of albacore, bluefin tuna, and bonito in California Waters [R]. California: The Resources Agency, Department of Fish and Game: 1-105.
|
QIU B C, ZHONG X, LIU X S, 2018. Assessment of the benthic ecological status in the adjacent waters of Yangtze River Estuary using marine biotic indices. Marine Pollution Bulletin, 137: 104-112 |
RABALAIS N N, TURNER R E, DÍAZ R J, et al, 2009. Global change and eutrophication of coastal waters. ICES Journal of Marine Science, 66(7): 1528-1537 |
RAKOCINSKI C F, BROWN S S, GASTON G R, et al, 1997. Macrobenthic responses to natural and contaminant-related gradients in northern gulf of Mexico estuaries. Ecological Applications, 7(4): 1278-1298 |
RUIZ-NAVARRO A, FERNÁNDEZ V, ABADÍA J, et al, 2019. Foliar fertilization of two dominant species in a semiarid ecosystem improves their ecophysiological status and the use efficiency of a water pulse. Environmental and Experimental Botany, 167: 103854 |
SANTOS S L, BLOOM S A, 1983. Evaluation of succession in an estuarine macrobenthic soft-bottom community near Tampa, Florida. Internationale Revue der Gesamten Hydrobiologie und Hydrographie, 68(5): 617-632 |
SMITH M D, KNAPP A K, 2003. Dominant species maintain ecosystem function with non-random species loss. Ecology Letters, 6(6): 509-517 |
SNELGROVE P V R, BUTMAN C A, 1994. Animal-sediment relationships revisited: cause versus effect. Oceanography and Marine Biology: An Annual Review, 32: 111-177 |
TESKE P R, WOOLDRIDGE T, 2001. A comparison of the macrobenthic faunas of permanently open and temporarily open/closed South African estuaries. Hydrobiologia, 464(1): 227-243 |
TESKE P R, WOOLDRIDGE T H, 2003. What limits the distribution of subtidal macrobenthos in permanently open and temporarily open/closed South African estuaries? Salinity vs. sediment particle size. Estuarine, Coastal and Shelf Science, 57(1/2): 225-238 |
TOMAŠOVÝCH A, GALLMETZER I, HASELMAIR A, et al, 2018. Tracing the effects of eutrophication on molluscan communities in sediment cores: outbreaks of an opportunistic species coincide with reduced bioturbation and high frequency of hypoxia in the Adriatic Sea. Paleobiology, 44(4): 575-602 |
TOWNSEND M, WORSFOLD T M, SMITH P R J, et al, 2006. Occurrence of Sternaspis scutata (Polychaeta: Sternaspidae) in the English Channel. Cahiers de Biologie Marine, 47(3): 281-285 |
UDALOV A A, BURKOVSKII I V, MOKIEVSKII V O, et al, 2004. Changes in the general characteristics of micro-, meio-, and macrobenthos along the salinity gradient in the White Sea estuary. Oceanology, 44(4): 514-525 |
VAN DIGGELEN A D, MONTAGNA P A, 2016. Is salinity variability a benthic disturbance in estuaries?. Estuaries and Coasts, 39(4): 967-980 |
WESLAWSKI J, 1999. Influence of salinity and suspended matter on benthos of an Arctic tidal flat. ICES Journal of Marine Science, 56(Suppl): 194-202 |
YSEBAERT T, HERMAN P M J, 2002. Spatial and temporal variation in benthic macrofauna and relationships with environmental variables in an estuarine, intertidal soft-sediment environment. Marine Ecology Progress Series, 244: 105-124 |
 2022, Vol. 53
2022, Vol. 53


