
中国海洋湖沼学会主办。
文章信息
- 王文涛, 俞志明, 宋秀贤, 郭宏红, 任向征. 2023.
- WANG Wen-Tao, YU Zhi-Ming, SONG Xiu-Xian, GUO Hong-Hong, REN Xiang-Zheng. 2023.
- 球形棕囊藻同化吸收硝酸盐的氮氧稳定同位素分馏研究
- NITROGEN AND OXYGEN STABLE ISOTOPIC FRACTIONATION OF NITRATE ASSIMILATION BY PHAEOCYSTIS GLOBOSE
- 海洋与湖沼, 54(1): 67-74
- Oceanologia et Limnologia Sinica, 54(1): 67-74.
- http://dx.doi.org/10.11693/hyhz20220400105
文章历史
-
收稿日期:2022-04-22
收修改稿日期:2022-05-30
2. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 山东青岛 266071;
3. 中国科学院海洋大科学研究中心 山东青岛 266071;
4. 中国科学院大学 北京 100049;
5. 青岛科技大学化学与分子工程学院 山东青岛 266042
2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
4. University of Chinese Academy, Beijing 100049, China;
5. College of Chemistry and Molecular Engineering, Qingdao University of Science and Technology, Qingdao 266042, China
球形棕囊藻(Phaeocystis globosa)属于定鞭藻纲, 在南北极及热带的海洋中均有分布, 其存在单细胞和囊体细胞两种可相互转化的生活形态, 是少数具有复杂异型生活史的海洋藻之一(齐雨藻等, 2001)。球形棕囊藻赤潮是一种全球广泛分布的生态灾害, 自1997年以来我国沿海多地也均有相关报道, 暴发时会产生大量溶血性毒素与有机泡沫, 形成最大直径约两到三厘米的囊体, 严重威胁近海的生态健康和人类安全(陈菊芳等, 1999; 齐雨藻等, 2001; 沈萍萍等, 2018)。此外, 球形棕囊藻是重要的二甲基硫化物(dimethyl sulfide, DMS)生产者, 对全球的硫循环和气候调节均有影响(朱蓉等, 2013; 涂俊杰等, 2022)。充分了解球形棕囊藻的生长特性, 摸清环境因素对该赤潮暴发的控制机制, 是相关生态灾害防控的重要基础之一。
氮是海洋浮游植物生长的基础, 在人类活动的影响下, 过量氮营养盐被排放入海, 导致部分海域呈现富营养化特征, 是引发赤潮灾害的重要因素之一。针对球形棕囊藻吸收利用氮营养盐的研究发现, 球形棕囊藻赤潮多暴发于相对较高浓度、较高比例硝酸盐的海域, 如欧洲北海(Tungaraza et al, 2003)、广西北部湾(Lv et al, 2019)、深圳大鹏湾等(刘悦等, 2022)。室内培养实验也证实, 球形棕囊藻在硝酸盐为主要氮源体系中具有更高单细胞丰度, 并可以形成囊体(王艳等, 2006, 2013; 梁大勇等, 2018)。基于上述研究可知, 充分了解环境硝酸盐变化对球形棕囊藻生长的影响, 是我们理解球形棕囊藻赤潮暴发机制的关键环节之一。
然而由于海水中的硝酸盐具有高度的时空异质性和环境敏感性, 传统分析方法无法精准刻画其生物地球化学过程, 在阐释硝酸盐迁移转化方面存在较大困难。近些年, 硝酸盐稳定同位素技术逐渐成为研究海洋氮循环和氮驱动生态过程的重要技术。由于其具有氮、氧两种稳定同位素作为限制参数, 因此可以更加精准地解析硝酸盐的来源, 准确刻画关键循环过程(Sigman et al, 2019)。尽管硝酸盐稳定同位素技术尚未应用于球形棕囊藻赤潮暴发机制方面的研究, 但是作为开展近海富营养化和生态灾害研究的前沿方法, 该技术已在相关领域展现出了极高的应用前景(杨志等, 2012; 陈法锦等, 2013)。
硝酸盐氮、氧稳定同位素技术研究氮循环关键过程建立在稳定同位素分馏效应的基础上, 即某元素的数种稳定同位素在生物作用下以不同速率迁移转化, 使得参与反应的物质产生同位素比值变化, 从而记录相关转化过程的信息(Altabet, 2005; 洪义国, 2013)。例如海洋中的浮游植物在同化吸收硝酸盐时, 理论上会优先利用轻同位素, 导致反应物重同位素富集, 引起同位素比值的变化。因此了解相关过程的分馏系数是利用稳定同位素技术解析物质循环转化的基础。
鉴于目前尚未有相关研究揭示球形棕囊藻同化吸收硝酸盐过程的氮、氧稳定同位素变化及其分馏特征, 通过开展室内培养实验, 获取营养盐浓度、硝酸盐氮、氧稳定同位素等关键参数, 计算球形棕囊藻同化吸收硝酸盐的稳定同位素分馏系数, 分析其变化规律与控制因素, 并与其他海洋藻类的研究结果进行对比。本研究首次获取了球形棕囊藻同化吸收硝酸盐的氮、氧双稳定同位素分馏系数, 丰富了海洋浮游植物同位素分馏数据库, 为硝酸盐稳定同位素技术的运用和球形棕囊藻赤潮暴发机制研究提供了重要的基础数据。
1 材料与方法 1.1 实验材料本研究所用藻种为球形棕囊藻(Phaeocystis globosa), 取自中国科学院海洋研究所海洋微藻培养库。培养实验所用的海水为经0.45 μm混合纤维膜过滤后于121 ℃灭菌30 min的天然海水。藻种在f/2培养基(Guillard, 1975), 温度20 ℃, 光照度5 000 lx, 光暗比L︰D=12︰12的条件下培养至指数生长期用于实验。
1.2 实验方法取单个囊体, 离心破碎后, 经200 μm筛绢过滤, 放入灭菌的天然海水中进行饥饿培养, 监测硝酸盐浓度, 待其低于检测限后开始实验。向其中加入f/2培养基, 分装至39个75 cm2的无菌细胞培养瓶, 在20 ℃、12︰12光照黑暗比条件下培养, 每2天取3瓶样品, 使用GF/F滤膜过滤100 mL水样, 50 mL滤液加入1滴氯仿固定后置于–20 ℃冷冻保存, 用于测定氮、磷、硅等营养盐浓度, 50mL滤液装入无菌洁净离心管中置于−20 ℃冷冻保存, 用于测定硝酸盐氮、氧稳定同位素。
1.3 样品分析营养盐的浓度借助连续流动分析仪进行测定(Skalar, 荷兰), 分别使用镉铜还原法测定硝酸盐(NO3-), 重氮-偶氮法测定亚硝酸盐(NO2-), 靛酚蓝法测定铵盐(NH4+), 磷钼蓝法测定磷酸盐(PO43-), 硅钼蓝法测定硅酸盐(SiO32-)。获得的标准曲线满足相关系数≥0.999, 并借助标准溶液进行中间校准以控制数据质量。NO3-、NO2-和NH4+的检测限均为0.07 μmol/L, PO43-的检测限为0.06 μmol/L, SiO32-的检测限为0.04 μmol/L, 数据重复性的相对标准偏差均优于5%。
海水样品中的硝酸盐氮、氧稳定同位素值(δ15N-NO3-和δ18O-NO3-)使用反硝化细菌法进行测定(Sigman et al, 2001; Casciotti et al, 2002), 即通过培育成熟的反硝化细菌将海水中的NO3-转化为N2O气体, 经过Precon-GC-IRMS (Thermo Fisher, 美国)联用, 测定δ15N和δ18O的同位素值。测定的数据通过实验室的工作标准及国际公认标准USGS34和IAEA-N3进行矫正, δ15N-NO3-和δ18O-NO3-样品的数据重现性分别优于±0.2‰和±0.5‰。该反应会将水体中的NO3-和NO2-统一转化, 因此测定的δ15N和δ18O实际为NO3-+NO2-的总和, 但是由于NO2-浓度不超过NO3-浓度的1%, 因此理论上NO2-的影响可以忽略。
1.4 分馏系数计算球形棕囊藻同位素分馏系数(ε)的计算基于Rayleigh公式:
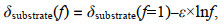 (1)
(1)其中, f代表了反应物的剩余比例, δsubstrate(f)则代表该时刻反应物的稳定同位素比值, δsubstrate(f=1)代表初始时期反应物的稳定同位素比值, 即未发生反应物消耗(f=1)时。Rayleigh模型适用于封闭体系, 即在反应过程中未发生反应物的补充。由于本计算是基于反应物的同位素比值变化, 因此可有效避免藻类对海水其他氮源吸收的干扰, 分馏系数更准确。
2 结果与讨论 2.1 球形棕囊藻培养实验五项营养盐变化特征在实验初始阶段, 五项营养盐NO3-、NO2-、NH4+、PO43-和SiO32-的浓度分别为(272.65±2.10)、(0.84± 0.03)、(9.64±1.83)、(46.98±1.23)和(4.46±0.06) μmol/L。随培养时间, NO3-、NH4+和PO43-均呈现不同程度的下降特征, 至第11天分别下降至(168.48±1.51)、(4.86±0.83)和(37.84±0.64) μmol/L, 在该过程中NO3-和PO43-浓度分别降低了约100和10 μmol/L (图 1)。通过对培养体系观察发现, 第11天培养瓶中出现直径约2~3 mm的小囊体, 判断NO3-对球形棕囊藻的生长、成囊均起到重要作用, 与其他学者的研究结果一致(王艳等, 2006, 2013; 梁大勇等, 2018)。
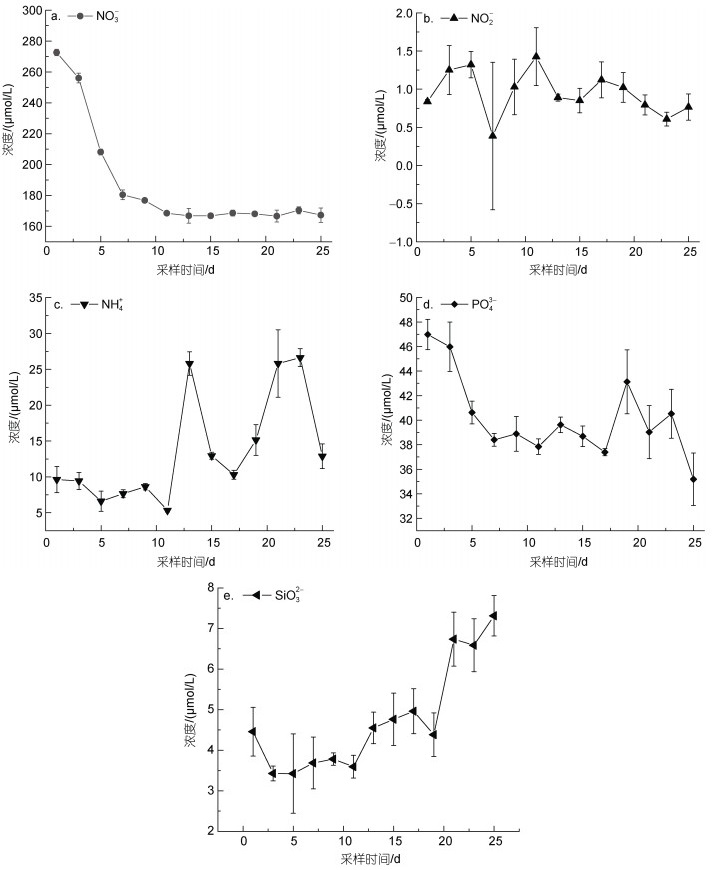 |
| 图 1 五项营养盐浓度(NO3-、NO2-、NH4+、PO43-和SiO32-)随时间的变化特征 Fig. 1 Variation characteristics of nutrient concentrations (NO3-, NO2-, NH4+, PO43- and SiO32-) with culture time |
随后, NO3-和PO43-的浓度并未出现明显波动, 而NH4+则在第13天出现较大幅度的升高, 达到(25.80±1.64) μmol/L (图 1c), 且伴随较多2~3 cm的大囊体出现。由于无机氮并未出现浓度降低的特征, 因此推测水体中的有机氮可能对囊体的生长起到重要作用, 而NH4+可作为副产物。如梁大勇等(2018)研究发现球形棕囊藻在尿素培养环境下可形成更多囊体。此后NH4+浓度逐渐降低至(11.11±1.48) μmol/L (第17天), 并在第21天出现第二次升高, 达到(25.81±4.74) μmol/L (第21天), 后逐渐降低(图 1c)。在此过程中, 球形棕囊藻逐渐变白且囊壁较脆弱, 应处于衰亡期。该阶段NH4+等无机氮可能是受到藻际微生物的矿化作用产生。
2.2 球形棕囊藻培养实验硝酸盐氮、氧稳定同位素变化特征在实验开始时期, δ15N-NO3-和δ18O-NO3-的值分别为−0.38‰±0.04‰和23.95‰±0.50‰, 随时间逐渐上升, 其中δ15N-NO3-在第13天达到相对高值, 为1.52‰±0.14‰ (图 2a), 与NO3-减少到相对低点[(166.82±4.82) μmol/L]的时间节点相吻合(图 1a)。δ18O-NO3-则在第7天达到相对高值, 为25.59‰± 0.37‰ (图 2b)。这种NO3-浓度减少, 氮、氧稳定同位素升高的特征指示了球形棕囊藻对NO3-的同化吸收过程。即在该过程中, 藻体首先会吸收原子质量轻的原子(14N和16O), 使得培养基剩余反应物中较重的原子(15N和18O)比重升高, 最终令δ15N和δ18O的值升高。
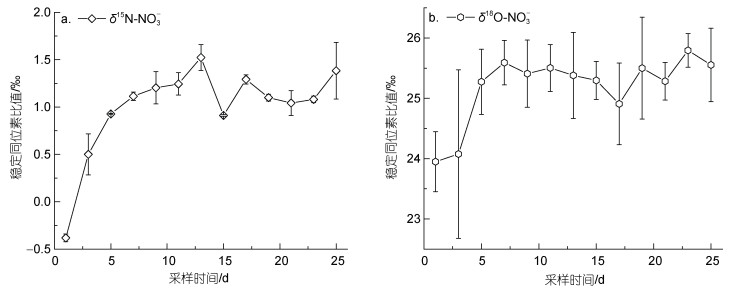 |
| 图 2 硝酸盐氮、氧稳定同位素值(δ15N-NO3-和δ18O-NO3-)随时间的变化特征 Fig. 2 Temporal variation of nitrogen and oxygen stable isotopes in nitrate (δ15N-NO3-and δ18O-NO3-) |
与NH4+第一次升高阶段相对应, 当其浓度降低后, δ15N-NO3-值也出现明显降低至0.911‰±0.01‰ (图 2a), 同时NO2-也出现一定上升(图 1b)。根据上述变化, 推测该第一次生产的铵盐被迅速硝化, 从而使得δ15N-NO3-值降低, 且作为中间产物的NO2-升高。
2.3 硝酸盐氮、氧稳定同位素分馏系数变化特征通过使用Rayleigh公式对球形棕囊藻同化吸收硝酸盐的氮、氧双稳定同位素分馏系数(15ε和18ε)均进行了计算。结果显示, 初始15ε和18ε值分别为14.06‰和2.02‰, 随后15ε迅速降低至4.85‰而18ε升高至4.91‰, 二者值大致相等。此后15ε和18ε逐渐降低并较为稳定, 平均值分别为3.32‰±0.38‰和3.12‰±0.59‰ (图 3)。上述结果说明当球形棕囊藻同化吸收硝酸盐时, 会引起氮、氧稳定同位素出现等效变化, 从而导致分馏系数相等, 符合NO3-消耗的同位素变化特征。
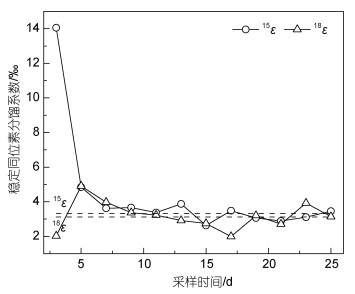 |
| 图 3 硝酸盐氮、氧稳定同位素分馏系数(15ε和18ε)的变化特征 Fig. 3 Temporal variation of nitrogen and oxygen stable isotopic fractionations (15ε and 18ε)in nitrate 注: 分馏系数从第3天开始计算, 虚线表示第7~25天对应分馏系数的平均值 |
由于测定技术限制, 早期针对硝酸盐同化吸收分馏系数的研究仅能测定氮的稳定同位素变化, 而随着反硝化细菌法的研发, 氮、氧双同位素数据的同步获取为研究氮循环提供了更多可参考的信息(Sigman et al, 2001; Casciotti et al, 2002)。基于这一技术, Granger等(2004)分析了4种典型海洋藻同化吸收NO3-的同位素分馏, 首次发现了15ε︰18ε≈1的特征。通过后续研究, 将其判定为真核生物硝酸盐还原酶对稳定同位素的分馏特性(Granger et al, 2010; Karsh et al, 2012)。需注意的是, 并非所有的藻类均会产生15ε︰18ε≈1的分馏系数比例, 原核生物可能引起15ε︰18ε≈0.5的变化特征(Granger et al, 2010)。
然而值得注意的是, 在球形棕囊藻同化吸收硝酸盐时, 氮、氧稳定同位素并非一直按照等比或近似等效变化。氮的分馏系数最初达到了14.06‰, 随后逐渐下降, 最终稳定在3.3‰左右, 而氧的分馏则从2.02‰上升至4.91‰, 后稳定在3.1‰左右。这种前期展现出的N、O分馏系数差异可能是受到两方面的因素所致: 一方面可能由于是藻类对外界环境变化的应激响应, 突然增加的氮源导致球形棕囊藻在实验初期同化吸收增强, 产生较高的分馏系数, 而后随球形棕囊藻对环境适应, 其产生的硝酸盐分馏系数降低; 而另一方面可能由于剧烈的硝酸盐跨膜运输所致(Karsh et al, 2014)。后者的详细讨论将与2.4部分中的不同微藻间分馏系数比较一起叙述。
2.4 典型微藻同化吸收硝酸盐的稳定同位素分馏系数对比目前针对海洋微藻同化吸收硝酸盐过程所引发的同位素分馏情况, 国内外已有一定的研究积累。总体来看, 海洋微藻氮、氧稳定同位素分馏具有较大范围, 按照纲的分类, 大部分的微藻的15ε呈现甲藻纲 < 蒲林藻纲 < 硅藻纲的特征(表 1)。本研究的球形棕囊藻15ε和18ε分别为3.32‰±0.38‰和3.12‰±0.59‰, 恰好符合这一特点。这可能与藻类本身对营养盐的同化吸收特性相关。
| 名称 | 15ε/‰ | 18ε/‰ |
| 普林藻纲(Premnesiophyceae) | ||
| Phaeocystis globosa | 3.32 ± 0.38 a | 3.12 ± 0.59 a |
| Emiliania huxleyi | 4.5 ± 0.2 b | |
| Isochrysis galbana | 3.2 ± 0.4 b | |
| 3.2 ± 1.0 c | ||
| Pavlova lutheri | 3.6 ± 0.5 b | |
| 0.9 ± 3.5 c | ||
| Cricosphaera carterae | 7.4 d | |
| 硅藻纲(Bacillariophyceae) | ||
| Thalassiosira weissflogii | 6.2 ± 0.4 b | |
| 12 ± 3 c | ||
| 5.6 ± 1.5~16.9 ± 0.3 e | 5.1 ± 1.5~18.2 ± 0.3 e | |
| Thalassiosira pseudonana | 5.2 ± 0.4 f | |
| 6.7 ± 0.2~7.1 ± 0.4 e | 5.8 ± 0.8~7.5 ± 0.6 e | |
| Thalassiosira oceanica | 8.9 ± 0.5~13.4 ± 1.8 e | 7.8 ± 0.3~12.6 ± 0.9 e |
| Chaetoceros simplex | 2.7 ± 0.3 b | |
| Chaetoceros sp. | 0.9~4.5 g | |
| Skeletonema costatum | 2.7 ± 0.3 b | |
| 9 ± 2 c | ||
| 9 ± 0.2 h | ||
| Emiliana huxleyi | 19.7 ± 0.5~20.4 ± 0.6 e | 19.7 ± 0.5~21.0 ± 0.5 e |
| Ditylum brightwellii | 3.3 ± 0.4 b | |
| Phaeodactylum tricornutum | 4.8 ± 0.3 b | |
| 1~23 h | ||
| 4.6 ± 0.2~8.0 ± 0.8 i | 5.2 ± 0.9~8.1 ± 0.6 i | |
| Pseudonitzchia hemii | 4.8 ± 0.2~6.4 ± 0.3 i | 5.4 ± 0.2~7.2 ± 0.5 i |
| 甲藻纲(Dinophyceae) | ||
| Amphidinium carterae | 2.2 ± 0.3 b | |
| Prorocentrum minimum | 2.5 ± 0.3 b | |
| 绿藻纲(Chlorophyceae) | ||
| Dunaliella tertiolecta | 2.2 ± 0.2 b | |
| 3.4 ± 1.9 c | ||
| Chlorella vulgaris | 8.6 ± 0.5 i | 7.9 ± 0.6 i |
| Chlorella pyrenoidosa | 5.7 ± 0.2~6.1 ± 0.8 i | 6.4 ± 0.9~6.9 ± 0.2 i |
| 隐藻纲(Cryptophyceae) | ||
| Chroomonas salina | 2.2 ± 0.9 c | |
| 蓝藻纲(Cyanophyceae) | ||
| Synechococcus sp. | 5.4 ± 0.6 b | |
| 2.2 ± 0.2~5.1 ± 0.1 i | 2.9 ± 0.1~6.0 ± 0.2 i | |
| 注: a: 本研究; b: Needoba et al (2003); c: Montoya et al (1995); d: Wada (1980); e: Granger et al (2004); f: Waser et al (1998); g: Wada et al(1978); h: Pennock et al (1996); I: Granger et al (2010) | ||
硝酸盐同化吸收涉及跨膜运输、跨膜释放和酶还原三个主要步骤, 且均会引发同位素分馏(图 4)。根据Karsh等(2012, 2014)针对硅藻的系列研究, 上述三个过程引发的氮稳定同位素分馏分别为2.0‰±0.3‰、1.2‰±0.4‰和26.6‰±0.2‰, 三者之间存在较大的分馏差异。参考该结果, 针对本研究发现的球形棕囊藻15ε呈现由高逐渐降低的特点, 推测在前期酶还原过程较为活跃, 发生酶还原过程的NO3-与参与跨膜运输的NO3-比例相对较高, 从而令其引发的15ε占据较高比重, 而后酶还原过程逐渐减弱, 从而使得15ε逐渐降低。
 |
| 图 4 浮游植物同化吸收硝酸盐的过程示意与发生的稳定同位素分馏(参考自Karsh et al, 2014) Fig. 4 The schematic process of nitrate assimilation by phytoplankton and correlated stable isotopic fractionations (modified from Karsh et al, 2014) 注: εin表示进入细胞膜的分馏, εout表示出细胞膜的分馏, εNR表示硝酸盐还原的分馏, NR表示硝酸盐还原, Norg表示有机氮 |
此外, 藻类同化吸收引起的稳定同位素分馏系数大小既取决于藻类自身特性, 也与藻的培养方式有关。当黑暗等减缓藻细胞光合作用时, 硝酸盐向胞外的释放速率与硝酸盐在胞内的还原速率可以达到相对较高比例, 胞内经还原酶改造的硝酸盐同位素信号释放到胞外, 从而降低胞内外的硝酸盐稳定同位素差异, 令基质稳定同位素值与分馏系数升高(Needoba et al, 2004)。综上, 本实验使用的12︰12光照培养方式, 以及计算的15ε和18ε值, 可较客观反映球形棕囊藻同化吸收硝酸盐过程的分馏系数特征。
3 结论与展望本文开展了针对球形棕囊藻(Phaeocystis globosa)同化吸收硝酸盐的氮、氧稳定同位素分馏研究。结果表明:
(1) 在球形棕囊藻培养过程中, NO3-的同化吸收过程明显, 其浓度迅速降低而δ15N-NO3-和δ18O-NO3-的值同步升高, 同时培养过程中出现两次NH4+浓度升高, 推测与有机氮的利用和藻类矿化有关;
(2) 球形棕囊藻同化吸收硝酸盐过程的15ε和18ε均值分别为3.32‰±0.38‰和3.12‰±0.59‰, 二者呈现1︰1的比例特征, 分馏系数小于大部分的硅藻纲而大于甲藻纲;
(3) 根据微藻同化吸收与硝酸盐跨膜运输等多个过程对同位素分馏的影响, 球形棕囊藻生长前中期的硝酸盐还原酶活性较高, 可能是引起氮分馏系数由高逐渐降低的重要原因。
本结果首次给出了球形棕囊藻的氮、氧稳定同位素分馏系数, 补充了海洋微藻同位素分馏数据库, 为稳定同位素技术研究赤潮暴发的环境驱动机制提供关键基础数据。在此基础上, 后续可以进一步开展针对球形棕囊藻微观环境氮循环过程的研究, 精准阐明营养环境对球形棕囊藻不同生活史阶段和赤潮暴发的影响, 以期为近海赤潮灾害研究提供重要支撑。
王艳, 邓坤, 王小冬, 2013. 球形棕囊藻囊体形成中光照、营养盐和共存硅藻的影响. 生态科学, 32(2): 165-170 |
王艳, 唐海溶, 蒋磊, 等, 2006. 硝酸盐对球形棕囊藻生长和硝酸还原酶活性的影响. 植物学通报, 23(2): 138-144 |
朱蓉, 杨桂朋, 于娟, 等, 2013. 不同氮磷比及铁浓度对球形棕囊藻二甲基硫和二甲巯基丙酸内盐生产的影响. 中国海洋大学学报, 43(10): 67-75 |
刘悦, 李丽, 翟晓辉, 等, 2022. 深圳大鹏湾一次球形棕囊藻藻华的发生过程及成因分析. 热带海洋学报, 41(3): 164-171 |
齐雨藻, 沈萍萍, 王艳, 2001. 棕囊藻属(Phaeocystis)的分类与生活史(综述). 热带亚热带植物学报, 9(2): 174-184 DOI:10.3969/j.issn.1005-3395.2001.02.016 |
杨志, 陈敏, 2012. 海水硝酸盐氮、氧同位素组成研究进展. 地球科学进展, 27(3): 268-275 |
沈萍萍, 齐雨藻, 欧林坚, 2018. 中国沿海球形棕囊藻(Phaeocystis globosa)的分类、分布及其藻华. 海洋科学, 42(10): 146-162 |
陈法锦, 陈建芳, 张海生, 2013. 硝酸盐氮氧同位素在海洋氮循环中的应用进展. 矿物岩石地球化学通报, 32(1): 127-133 |
陈菊芳, 徐宁, 江天久, 等, 1999. 中国赤潮新记录种──球形棕囊藻(Phaeocystis globosa). 暨南大学学报(自然科学版), 20(3): 124-129 |
洪义国, 2013. 硝酸盐氮氧稳定同位素分馏过程记录的海洋氮循环研究进展. 地球科学进展, 28(7): 751-764 |
涂俊杰, 高配配, 刘春颖, 等, 2022. 不同氮磷比对球形棕囊藻释放含硫化合物及DMSP降解途径的影响. 中国海洋大学学报, 52(4): 87-96 |
梁大勇, 王小冬, 王艳, 2018. 不同氮源对球形棕囊藻生长和囊体形成的影响. 海洋科学进展.2018, 36(2): 272-278 |
ALTABET M A, 2005. Isotopic tracers of the marine nitrogen cycle: present and past [M] // Marine Organic Matter: Biomarkers, Isotopes and DNA. Berlin, USA: Springer: 251-293.
|
CASCIOTTI K L, SIGMAN D M, HASTINGS M G, et al, 2002. Measurement of the oxygen isotopic composition of nitrate in seawater and freshwater using the denitrifier method. Analytical Chemistry, 74(19): 4905-4912 |
GRANGER J, SIGMAN D M, NEEDOBA J A, et al, 2004. Coupled nitrogen and oxygen isotope fractionation of nitrate during assimilation by cultures of marine phytoplankton. Limnology and Oceanography, 49(5): 1763-1773 |
GRANGER J, SIGMAN D M, ROHDE M M, et al, 2010. N and O isotope effects during nitrate assimilation by unicellular prokaryotic and eukaryotic plankton cultures. Geochimica et Cosmochimica Acta, 74(3): 1030-1040 |
GUILLARD R R L, 1975. Culture of phytoplankton for feeding marine invertebrates [M] // Culture of Marine Invertebrate Animals. Boston, USA: Springer: 29-60.
|
KARSH K L, GRANGER J, KRITEE K, et al, 2012. Eukaryotic assimilatory nitrate reductase fractionates N and O isotopes with a ratio near unity. Environmental Science & Technology, 46(11): 5727-5735 |
KARSH K L, TRULL T W, SIGMAN D M, et al, 2014. The contributions of nitrate uptake and efflux to isotope fractionation during algal nitrate assimilation. Geochimica et Cosmochimica Acta, 132: 391-412 |
LV X, WU Z, SONG X, et al, 2019. Nutritional strategy for the preferential uptake of NO3--N by Phaeocystis globosa. Hydrobiologia, 846(1): 109-122 |
MONTOYA J P, MCCARTHY J J, 1995. Isotopic fractionation during nitrate uptake by phytoplankton grown in continuous culture. Journal of Plankton Research, 17(3): 439-464 |
NEEDOBA J A, SIGMAN D M, HARRISON P J, 2004. The mechanism of isotope fractionation during algal nitrate assimilation as illuminated by the 15N/14N of intracellular nitrate. Journal of Phycology, 40(2): 517-522 |
NEEDOBA J A, WASER N A, HARRISON P J, et al, 2003. Nitrogen isotope fractionation in 12 species of marine phytoplankton during growth on nitrate. Marine Ecology Progress Series, 255: 81-91 |
PENNOCK J R, VELINSKY D J, LUDLAM J M, et al, 1996. Isotopic fractionation of ammonium and nitrate during uptake by Skeletonema costatum: Implications for δ15N dynamics under bloom conditions. Limnology and Oceanography, 41(3): 451-459 |
SIGMAN D M, CASCIOTTI K L, ANDREANI M, et al, 2001. A bacterial method for the nitrogen isotopic analysis of nitrate in seawater and freshwater. Analytical Chemistry, 73(17): 4145-4153 |
SIGMAN D M, FRIPIAT F, 2019. Nitrogen isotopes in the ocean. Encyclopedia of Ocean Sciences, 1: 263-278 |
TUNGARAZA C, ROUSSEAU V, BRION N, et al, 2003. Contrasting nitrogen uptake by diatom and Phaeocystis-dominated phytoplankton assemblages in the North Sea. Journal of Experimental Marine Biology and Ecology, 292(1): 19-41 |
WADA E, 1980. Nitrogen isotope fractionation and its significance in biogeochemical processes occurring in marine environments [M] // GOLDBERG E D, HORIBE Y. Isotope Marine Chemistry. Tokyo, Japan: Uchida-Rokakuho: 375-398.
|
WADA E, HATTORI A, 1978. Nitrogen isotope effects in the assimilation of inorganic nitrogenous compounds by marine diatoms. Geomicrobiology Journal, 1(1): 85-101 |
WASER N A D, HARRISON P J, NIELSEN B, et al, 1998. Nitrogen isotope fractionation during the uptake and assimilation of nitrate, nitrite, ammonium, and urea by a marine diatom. Limnology and Oceanography, 43(2): 215-224 |
 2023, Vol. 54
2023, Vol. 54


