中国海洋湖沼学会主办。
文章信息
- 林治豪, 张焕新, 唐学玺, 王影. 2023.
- LIN Zhi-Hao, ZHANG Huan-Xin, TANG Xue-Xi, WANG Ying. 2023.
- 环烷酸对淡水微藻生理生化特征的影响
- EFFECT OF NAPHTHENIC ACID ON PHYSIOLOGICAL AND BIOCHEMICAL CHARACTERISTICS OF FRESHWATER MICROALGAE
- 海洋与湖沼, 54(1): 87-97
- Oceanologia et Limnologia Sinica, 54(1): 87-97.
- http://dx.doi.org/10.11693/hyhz20220400096
文章历史
-
收稿日期:2022-04-13
收修改稿日期:2022-05-27
2. 山东师范大学地理与环境学院 山东济南 250014;
3. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 山东青岛 266237
2. College of Geography and Environment, Shandong Normal University, Jinan 250014, China;
3. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China
随着原油不断开采, 世界优质原油的储量逐渐下降。高酸原油由于储量丰富, 价格低廉在国际市场上越来越受重视(童晓光等, 2018)。高酸原油在开采和运输的过程中, 不可避免地会导致高酸石油污染物的泄漏。环烷酸(naphthenic acids, NAs)天然存在于石油中, 是石油中主要的酸性成分, 在高酸原油中大量存在(田松柏, 2005)。作为石油中主要的毒性成分之一, 环烷酸的生态毒性研究成为了石油污染研究中重要的问题(Clemente et al, 2005)。了解环烷酸对水生生态环境的影响对环烷酸污染的风险评估和生态修复具有重要的意义。
环烷酸是一类环烷基直链羧酸的统称, 其分子中一般含有一个或多个饱和环, 通用分子式为CnH2n+zO2, 其中n代表碳原子数; Z代表不饱和度, Z的数值通常是−2的倍数; 有些环烷酸还含有芳香酸、氮、硫等其他元素(Swigert et al, 2015)。环烷酸化学性质稳定, 具有低挥发性, 分子结构中同时存在烷基憎水基团和羧基亲水基团, 因而具有表面活性剂的特性, 能以分子或者环烷酸盐的形式溶于水并在水环境中持久存在(Leung et al, 2001)。这种可溶性使得环烷酸具有生物积累性和生物放大效应, 大大提高了环烷酸在水环境中的扩散能力。环烷酸会从石油开采区渗透并污染附近的湖泊和湿地等水域环境, 研究表明在加拿大的阿尔伯塔采矿区附近的自然湿地中环烷酸的浓度可达10~60 mg/L(Clemente et al, 2005; Vander et al, 2021)。目前已在土壤、地下水、河流、湖泊、沉积物等环境介质及蚯蚓、淡水鱼等生物体内检测到环烷酸(Scott et al, 2020)。
环烷酸具有较强的生物毒性, 已有研究表明环烷酸对哺乳动物、鸟类、淡水鱼类、两栖类、细菌等具有很强的生物毒性, 影响个体的发育和繁殖、干扰内分泌系统, 甚至造成个体死亡(Li et al, 2017)。环烷酸低剂量长时间的水域毒性效应近几年受到越来越多的关注。最新研究表明, 环烷酸的低剂量长时间的暴露对斑马鱼等淡水鱼、蚯蚓等具有生殖毒性、内分泌干扰效应和免疫阻断效应(Quinlan et al, 2015)。也有研究表明, 极低的环烷酸浓度(100 μg/L)长期暴露也会对蚍蜉等水生动物造成慢性损伤(Pomfret et al, 2021)。
在前期的实验中发现环烷酸会对三角褐指藻等海洋微藻造成急性毒性效应(Zhang et al, 2018), 但是对淡水微藻的研究并未见相关报道。相比于海洋, 陆域石油的储量更大, 环烷酸等石油污染物对淡水水域的潜在污染量更大, 污染传播速率更快, 因此亟需了解环烷酸对淡水域生态系统的危害。淡水微藻是淡水域生态系统中重要的初级生产者, 在水域生态系统的营养传递、生产力水平稳定及碳循环等方面均发挥重要作用。因此, 本实验选用模式微藻——莱茵衣藻(Chlamydomonas reinhardtii)和小球藻(Chlorella vulgaris)作为受试生物, 研究环烷酸对微藻生理生化特征的效应机制, 为环烷酸对微藻的毒性效应和兴奋效应提供理论与实践经验, 同时也为水生生态系统中环烷酸污染的生态风险预测与规避提供前瞻性的研究资料。
1 材料与方法 1.1 实验材料本实验选用模式淡水微藻莱茵衣藻(Chlamydomonas reinhardtii)和小球藻(Chlorella vulgaris), 由中国海洋大学藻种库提供。藻种的培养使用蒸馏水, 培养基为f/2培养基(不含硅), 培养条件为光照强度80 μmol photons/(m2·s), 光照周期12 h/12 h, 温度(20±1) ℃, pH=7.4±0.1。
根据文献检索及前期现场调查结果, 拟选择水域环境和生物体内广泛存在的7碳环烷酸(C7H12O2)为污染因子。环烷酸购自Sigma公司(美国Sigma-Aldrich公司, CAS: 1338-24-5)。
1.2 环烷酸的配置及浓度测定将环烷酸与蒸馏水按照1︰9的比例进行混合并倒入烧杯中, 然后使用磁力搅拌器在加盖密封、避光的条件下连续搅拌24 h, 使环烷酸与蒸馏水充分混匀。避光静置5 h后倒取下层水相, 为环烷酸母液。母液使用0.22 μm微孔滤膜进行抽滤和除菌, 静置于4 ℃冰箱内, 避光密封保存并在实验期间保存使用。环烷酸能够体现亲水性, 因此可以分析出它在水中的浓度。
采用岛津气相色谱质谱联用仪(日本岛津公司GCMS-QP2020 NX)进行浓度分析。在这之后检测环烷酸在水中的具体溶解度。样品的前处理: 本研究先取一定量的样品以丙酮︰正己烷为1︰1的混合溶剂萃取, 所有样本上层的正己烷通过无水硫酸钠进行干燥处理, 在这以后旋转蒸发, 相应的置换溶剂选择的是正己烷, 并通过硅胶和氧化钼构建而成的多段柱进行净化, 然后将样品旋蒸, 通过氮吹仪进行浓缩处理之后, 将其放置到带螺旋盖样品瓶内, 最后完成GC-MS分析。测定条件参数: 色谱柱(TG-5MS, 15 m, 0.25 mm, 0.1 μm), 程序升温: 160 ℃ (2 min), 35 ℃/min升温至320 ℃ (10 min), 检测器根据实际需求选择的是EI离子源, 并利用离子扫描的方式, 相应的传输线温度等于300 ℃, 实际的离子源温度等于250 ℃。采用的载气类型主要为氦气, 具体的载气流速等于l.5 mL/min。而对于进样模式来说, 其主要为SSL进样口, 其进样量等于1 μL。结合GC-MS测定的数据, 进而分析出三组环烷酸母液中所含环烷酸的实际浓度值, 见表 1。
| 序号 | 组分名称 | 质量百分比% | CAS编号 |
| 1 | 环烷酸 | 12~13 | 1338-24-5 |
| 2 | 环烷酸 | 16~18 | 1338-24-5 |
| 3 | 环烷酸 | 10~13 | 1338-24-5 |
将处于对数生长期的两种淡水微藻接种入f/2培养基, 培养基盛于容量为500 mL的三角瓶中进行急性毒性试验, 两种微藻的起始浓度分别为236.5×104和550.6×104 cells/mL。根据预实验的模拟结果, 将实验分为6个处理组, 每个处理组中环烷酸质量浓度分别为0、0.5、2、4、8、16 mg/L, 其中0 mg/L为空白对照组, 每个实验组设计三个平行实验。实验持续96 h, 每隔8 h摇藻一次, 防止藻细胞沉淀。在两种微藻接种后的0、24、48、72及96 h共5个阶段在超净工作台内进行藻细胞取样。每个时间点分别检测各个组的种群密度、叶绿素a含量(chlorophyll a, chl a)、抗氧化酶过氧化物歧化酶(superoxide dismutase, SOD)和过氧化氢酶(Catalase, CAT)活性, 活性氧(Reactive Oxygen Species, ROS)阳性率和生理生化指标(多糖、蛋白质和粗脂的含量)。
1.4 实验方法 1.4.1 种群密度及抑制率两种微藻的种群密度的检测使用血球计数板计数法。每次取样取1 mL藻液, 加入10 μL的鲁格试剂固定并染色藻细胞。在光学显微镜(日本Olympus公司CX31)下, 使用血细胞计数板测定细胞密度, 并计算藻细胞的种群密度。然后根据OECD (1984)规定的方法分析环烷酸对两种微藻的抑制率: 根据每次采样时的藻细胞密度, 绘制出不同浓度环烷酸处理组的藻细胞密度随时间变化的变化曲线, 即生长曲线。然后按照下列公式计算出抑制率:
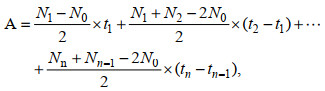 (1)
(1) (2)
(2)式中, IA表示特定浓度下藻类种群密度的抑制率(%); A表示生长曲线所包围的面积; A0表示96 h空白对照组生长曲线所包围的面积; At表示96 h处理组生长曲线所包围的面积; t1表示实验开始后首次测定的时间(24 h); tn表示第n次测定的时间(h); tn–1表示第n–1次测定的时间(h); N0表示藻类的起始细胞密度; Nn表示tn时刻测定的藻细胞的密度(cells/mL); Nn–1表示tn–1时刻测定的藻细胞的密度(cells/mL)。
1.4.2 光合色素含量的测定使用丙酮浸提法检测叶绿素a的含量。每次取样时取5 mL藻液, 藻细胞使用10 mL体积分数为90%的丙酮浸提48 h。浸提后4 ℃下离心15 min (4 000 r/min), 取上清液备用。叶绿素a含量通过UV-8000紫外分光光度计(上海元析有限公司)进行测定。用体积分数为90%的丙酮作为空白标零, 对样品进行350~700 nm的波长扫描, 读取663和645 nm处的吸光度。重复取样5次, 计算平均值。叶绿素a的含量按照如下公式计算(Lichtenthaler et al, 1983):
 (3)
(3)式中, cchl a代表叶绿素a的含量(μg/cell), x和y分别代表663和645 nm波长下的吸光值, N代表采样时间点下的细胞密度(cells/mL)。
1.4.3 抗氧化酶活力的测定粗酶液提取: 每次采样后将150 mL藻液经1.2 μm孔径的微孔滤膜过滤后收集滤膜上的藻泥, 将藻泥移入冰浴预冷的研钵内并加入1 mL磷酸缓冲液(pH=7.4)和适量石英砂, 在冰浴下将藻泥充分研磨。研磨后的匀浆液4 ℃下10 000 r/min离心10 min, 提取上清液即为粗酶提取液, 放于4 ℃冰箱保存备用。可溶性蛋白含量的测定, 采用考马斯亮蓝G-250法进行。使用Sigma (美国Sigma-Aldrich公司)的SOD活性测定试剂盒和CAT活性测定试剂盒对粗酶液进行测定。
1.4.4 ROS阳性率的测定微藻ROS阳性率的检测采用2′7′-荧光素-乙酰乙酸酯(DCFH-DA)染色法进行(Zhao et al, 2020)。DCFH-DA购买自美国Sigma-Aldrich公司, CAS编号为4091-99-0, 实验前配置为500 μmol/L的工作液。每次取样时取20 mL藻液, 经1.2 μm孔径的微孔滤膜过滤后重悬于1 mL的蒸馏水中。取500 μL的重悬液并加入5 μL的DCFH-DA工作液, 摇床避光孵育40 min。随后4 ℃ 4 000 r/min离心两次, 并用500 μL蒸馏水重悬沉淀。
最后一次冲洗沉淀的重悬液避光保存在4 ℃, 并在2 h内完成检测。使用CytoFLEX流式细胞仪(美国Beckman公司), 在FITC通道(激发光488 nm, 吸收光为525~565 nm)检测单个藻细胞二氯荧光素(DCF)的荧光强度, 并根据细胞的染色程度计算出ROS阳性率。
1.4.5 粗脂含量的测定本实验用乙醚-石油醚法测定微藻粗脂的含量(马帅等, 2010)。每次取样时取50 mL藻液, 经1.2 μm孔径的微孔滤膜过滤后重悬于1 mL的蒸馏水中, 在4 ℃下8 000 r/min离心10 min, 去掉上清, 保留藻泥。藻泥中加入3 mL蒸馏水, 超声破碎20 min, 然后8 000 r/min 4 ℃下离心10 min, 去掉沉淀, 保留上清液。按照水︰乙醚︰石油醚=3︰1︰2的比例加入乙醚和石油醚, 并在20 ℃下浸提粗脂5 h。浸提后取上层有机层, 使用旋转蒸发仪在60 ℃下蒸发有机溶剂, 蒸发完全后于95 ℃干燥2 h烘干多余的水分, 冷却后称量得到粗脂干重。
1.4.6 蛋白质含量的测定采用考马斯亮蓝G-250法测定微藻蛋白质的含量(赵英永等, 2006), 试剂盒购买自Sigma公司(美国Sigma-Aldrich)。每次取样时取40 mL藻液, 经1.2 μm孔径的微孔滤膜过滤后收集藻泥, 并放入−21 ℃的冰箱中使藻泥完全冷冻, 然后放入40 ℃的温水浴15 min使藻泥融化, 重复冻融步骤3次使细胞破碎。在藻泥中加入3 mL磷酸缓冲液, 超声破碎细胞20 min。随后在4 ℃下6 000 r/min离心10 min, 取1 mL上清液, 加入5 mL考马斯亮蓝后混匀。以蒸馏水组作为空白标零, 在595 nm处测定吸光度, 并利用标准曲线算出待测藻液蛋白质的含量。
1.4.7 多糖含量的测定采用硫酸-苯酚法测定微藻的多糖含量(孟迎迎等, 2017)。每次取样时取藻液40 mL, 经1.2 μm孔径的微孔滤膜过滤后收集藻泥, 并放于−20 ℃的冰箱中使藻泥完全冷冻, 然后放入40 ℃的温水浴15 min使藻泥融化, 重复以上冻融步骤3次使细胞破碎。在藻泥中加入3 mL磷酸缓冲液, 超声破碎细胞20 min。随后在4 ℃下6 000 r/min离心10 min, 取1 mL上清液, 按照待测液︰苯酚︰浓硫酸=1︰1︰5的比例加入苯酚和浓硫酸, 混匀后静置20 min; 取1 mL蒸馏水加入苯酚和浓硫酸, 混匀后静置20 min作为蒸馏水组。待反应完全后用蒸馏水组标零, 在490 nm处测定吸光度, 并利用标准曲线算出待测藻液蛋多糖的含量。
1.4.8 数据的统计与分析使用IBM SPSS Statistics 25 (美国SPSS公司)软件对实验中所有的数据进行单因素方差分析(One-way ANOVA), 检验处理组和对照组差异的显著性。数据首先进行方差齐性检验, 数据等方差时使用LSD (Least Significant Difference, 最小显著性差异法)分析和S-N-K (Student Newman Keuls)检验, 不等方差时使用塔姆黑尼T2检验差异显著性, 显著性水平设定为0.05。
2 结果 2.1 不同浓度环烷酸对微藻种群增长的影响如图 1a所示, 莱茵衣藻在48~72 h, 0.5~2 mg/L环烷酸胁迫组细胞密度明显高于对照组(P<0.05); 8和16 mg/L环烷酸胁迫组细胞密度均低于对照组, 差异极显著(P<0.01)。在96 h, 8和16 mg/L环烷酸胁迫组细胞密度低于对照组, 差异极显著(P<0.01)。如图 1b所示, 小球藻在24~72 h, 0.5~4 mg/L环烷酸胁迫组细胞密度明显高于对照组, 差异显著(P<0.05)。72~96 h, 8~16 mg/L环烷酸胁迫组细胞密度明显低于对照组, 差异极显著(P<0.01)。如图 1c所示, 根据环烷酸对两种微藻的种群抑制率结果, 低浓度剂量处理下(0.5~4 mg/L), 环烷酸能够刺激两种微藻的种群增长; 高浓度剂量处理下(8~16mg/L), 环烷酸则对两种微藻表现出明显的抑制效应。
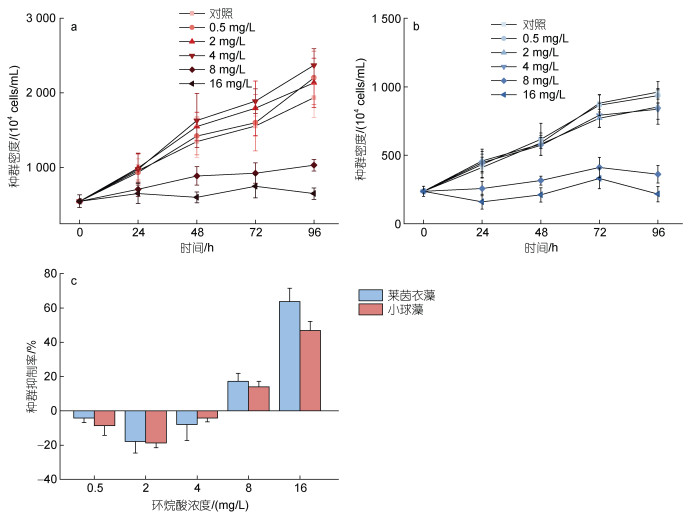 |
| 图 1 莱茵衣藻(a)和小球藻(b)在不同浓度剂量环烷酸胁迫下, 不同受试时间的生长曲线; 不同浓度环烷酸处理96 h下两种微藻的种群抑制率(c) Fig. 1 The growth curve of C. reinhardtii (a) and C. vulgaris (b) exposed to NAs at different concentrations in different durations; the inhibition rate of different concentrations of NAs on the growth of two species of phytoplankton in 96 h (c) |
图 2描述了不同环烷酸浓度剂量胁迫下两种微藻叶绿素a含量随着受试时间的变化。如图 2a所示, 与对照组相比, 24~96 h内高浓度环烷酸(8~16 mg/L)处理组莱茵衣藻的叶绿素含量显著降低(P<0.01), 且随着时间的变化色素含量持续降低。96 h下, 莱茵衣藻色素含量呈现出剂量效应: 0.5~16 mg/L内, 环烷酸浓度越高, 对莱茵衣藻色素含量的呈现出越强的抑制趋势。24~96 h内高浓度环烷酸(8~16 mg/L)处理组小球藻的叶绿素a含量表现出与莱茵衣藻相同的变化趋势(图 2b), 均抑制了小球藻的叶绿素a含量, 其中72和96 h与对照组相比差异极显著(P<0.01)。环烷酸浓度为0.5~4 mg/L的处理组对小球藻的叶绿素a含量具有一定的促进作用, 其中48 h叶绿素a的含量与对照组相比差异显著(P<0.05)。
 |
| 图 2 不同环烷酸浓度剂量胁迫下莱茵衣藻(a)和小球藻(b)叶绿素a含量随着受试时间的变化 Fig. 2 The Chl a content at C. reinhardtii (a) and C. vulgaris (b) exposed to different concentrations of NAs 注: **代表P<0.01(差异极显著), *代表P<0.05(差异显著) |
图 3描述了不同剂量的环烷酸胁迫下两种微藻抗氧化酶活性的变化, 其中图 3a, 3b描述了两种微藻SOD酶活力的变化; 图 3c, 3d描述了两种微藻CAT酶活力的变化。如图 3a所示, 在24 h环烷酸暴露初期, 浓度为2~8 mg/L的环烷酸处理组莱茵衣藻的SOD活性呈现上升趋势, 与对照组相比差异显著(P<0.05), 2 mg/L处理组表现出极显著差异(P<0.01)。随着时间的推移, 浓度为2~4 mg/L的环烷酸处理组莱茵衣藻的SOD值明显高于处理组, 差异极显著(P<0.01)。96 h下, 2~4 mg/L的环烷酸处理组莱茵衣藻的活性呈现上升趋势, 8和16 mg/L的环烷酸处理组莱茵衣藻SOD活性呈现显著下降的趋势(P<0.01)。如图 3b所示, 与莱茵衣藻相同, 环烷酸在24 h暴露初期刺激小球藻的SOD活性, 其中8 mg/L处理组的小球藻SOD活性和对照相比显著升高(P<0.05)。在48 h下, 不同浓度的环烷酸对小球藻表现出显著的刺激效应, 和对照组相比, 2和4 mg/L处理组小球藻的SOD活性显著升高(P<0.05); 8 mg/L和16 mg/L处理组小球藻的SOD活性极显著升高(P<0.01)。在环烷酸暴露的后期, 72和96 h内, 2和4 mg/L环烷酸对小球藻SOD活性的刺激效应逐渐减弱, 而在96 h下高浓度环烷酸(8和16 mg/L)处理对小球藻SOD活性表现出显著的抑制效应(P<0.01)。
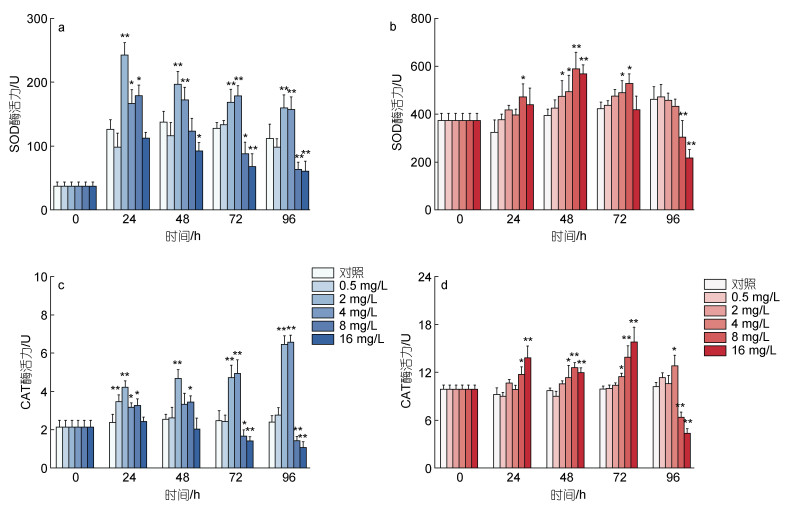 |
| 图 3 不同浓度环烷酸剂量胁迫下莱茵衣藻(a, c)、小球藻(b, d)抗氧化酶的活性在不同时间下的变化 Fig. 3 The effect of different NAs concentrations on the activities of antioxidant enzymes of C. reinhardtii (a, c) and C. vulgaris (b, d) in different durations 注: **代表P<0.01(差异极显著), *代表P<0.05(差异显著) |
如图 3c和图 3d所示, 24~96 h低浓度环烷酸处理(0.5~4 mg/L)和高浓度环烷酸处理(8和16 mg/L)下莱茵衣藻和小球藻的CAT酶活力与SOD酶活力的变化基本趋势一致。96 h下低浓度处理组(2和4 mg/L)莱茵衣藻的CAT酶活性显著高于空白对照组, 高浓度环烷酸处理组(8和16 mg/L)莱茵衣藻和小球藻的CAT酶活性显著低于空白对照组。
2.4 不同浓度环烷酸对微藻活性氧阳性率的影响图 4描述了不同浓度的环烷酸胁迫下两种微藻ROS阳性率的变化。如图 4a所示, 2 mg/L和4 mg/L环烷酸处理下在24 h和48 h会降低莱茵衣藻ROS的阳性率, 72 h和96 h不会显著影响莱茵衣藻的ROS阳性率。8和16 mg/L环烷酸处理下在24~96 h均会造成莱茵衣藻的ROS阳性率显著上升(P<0.05), 其中48 h和96 h下两种浓度处理组的莱茵衣藻的ROS阳性率表现为极显著上升(P<0.01)。如图 4b所示, 0~96 h, 0.5~4 mg/L环烷酸对小球藻的ROS阳性率没有显著变化。8和16 mg/L环烷酸处理下在24~48 h造成小球藻ROS阳性率的下降, 其中8 mg/L处理组的小球藻ROS阳性率和对照组相比表现出显著下降(P<0.05); 8和16 mg/L环烷酸处理在72和96 h造成小球藻ROS阳性率逐渐上升, 96 h两种浓度处理下小球藻ROS阳性率和对照组相比极显著上升(P<0.01)。
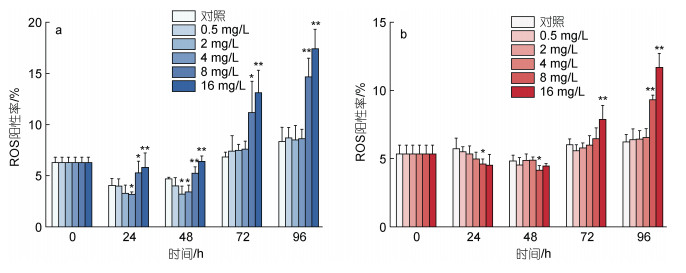 |
| 图 4 不同浓度环烷酸剂量胁迫下莱茵衣藻(a)、小球藻(b)的ROS阳性率在不同时间下的变化 Fig. 4 The effect of different NAs concentrations on the ROS positive rate of C. reinhardtii (a) and C. vulgaris (b) in different durations 注: **代表P<0.01(差异极显著), *代表P<0.05(差异显著) |
处理浓度为0.5~4 mg/L的环烷酸在24~48 h对莱茵衣藻的粗脂含量表现出抑制作用, 其中48 h下0.5 mg/L和2 mg/L处理组和对照组相比表现出显著差异(P<0.05); 在72~96 h对莱茵衣藻的粗质含量表现出刺激效应, 96 h下0.5~4 mg/L的环烷酸处理组莱茵衣藻的粗脂含量极显著高于对照组(P<0.01)。8 mg/L的环烷酸在24 h显著刺激莱茵衣藻粗脂的含量(P<0.05), 在72 h和96 h对莱茵衣藻的粗脂含量则表现出抑制效应(P<0.05)。16 mg/L的环烷酸在24~ 96 h对莱茵衣藻的粗质含量均表现出显著的抑制效应(P<0.01)。图 5b描述了不同浓度的环烷酸处理对小球藻粗脂含量的影响, 不同浓度环烷酸处理组小球藻的粗脂含量与莱茵衣藻表现出了相同的变化趋势。不同的是4 mg/L的环烷酸处理下在24 h和96 h对小球藻粗脂含量表现出刺激效应(P<0.05)。
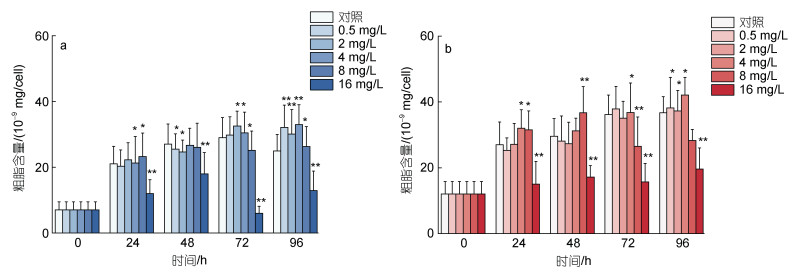 |
| 图 5 不同剂量浓度环烷酸胁迫下莱茵衣藻(a)、小球藻(b)粗脂含量在不同时间下的影响 Fig. 5 The effect of different NAs concentrations on the crude fat content of C. reinhardtii (a) and C. vulgaris (b) in different durations 注: ** 代表P<0.01(差异极显著), *代表P<0.05(差异显著) |
如图 6a所示, 在24 h环烷酸暴露初期, 浓度为8和16 mg/L环烷酸处理组的莱茵衣藻的蛋白质含量呈现上升趋势, 和对照组相比差异极显著(P<0.01)。暴露48 h后, 浓度为0.5~16 mg/L的环烷酸表现出刺激莱茵衣藻蛋白质含量的趋势, 其中2 mg/L处理组表现为显著差异(P<0.01), 4~16 mg/L处理组表现为极显著差异(P<0.05)。随着时间的增加, 在96 h下, 各个处理组的莱茵衣藻蛋白质的含量呈现出下降的趋势, 和对照相比差异极显著(P<0.01)。如图 6b所示, 24 h下, 2、8和16 mg/L环烷酸处理会刺激小球藻蛋白质的含量(P<0.05)。而在48~96 h, 所有浓度的环烷酸处理均会抑制小球藻的蛋白质的含量, 其中8 mg/L环烷酸处理组的小球藻在72和96 h的蛋白质含量显著低于对照组(P<0.05), 48 h下蛋白质含量极显著降低(P<0.01); 16 mg/L的环烷酸处理组的小球藻在48~96 h蛋白质含量显著低于对照组(P<0.01)。
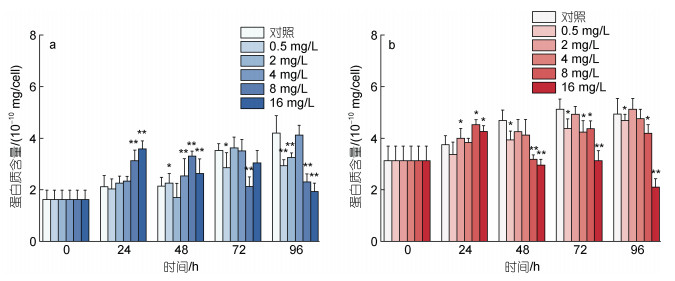 |
| 图 6 不同剂量浓度环烷酸胁迫下莱茵衣藻(a)、小球藻(b)蛋白质含量在不同时间下的影响 Fig. 6 The effect of different NAs concentrations on the protein content of C. reinhardtii (a) and C. vulgaris (b) in different durations 注: ** 代表P<0.01(差异极显著), *代表P<0.05(差异显著) |
图 7描述了不同浓度环烷酸胁迫下, 两种微藻多糖含量的变化。如图 7a所示, 8 mg/L环烷酸在24~96 h对莱茵衣藻多糖含量表现出刺激效应, 其中24 h和96 h表现为显著刺激(P<0.05), 72 h表现为极显著刺激(P<0.01)。16 mg/L环烷酸在24~96 h对莱茵衣藻多糖含量表现出极显著的刺激效应(P<0.01)。0.5~ 4 mg/L环烷酸在24~96 h不会显著影响莱茵衣藻多糖的含量。不同浓度环烷酸在24 h会刺激小球藻多糖含量, 2和8 mg/L处理组表现为显著刺激(P<0.05), 4和16 mg/L处理组表现为极显著刺激(P<0.01)。48 h下8和16 mg/L环烷酸处理会极显著刺激小球藻多糖含量(P<0.01)。在72~96 h不同浓度环烷酸对小球藻多糖含量无显著变化, 但2 mg/L环烷酸处理在96 h显著刺激小球藻多糖含量(P<0.01)。
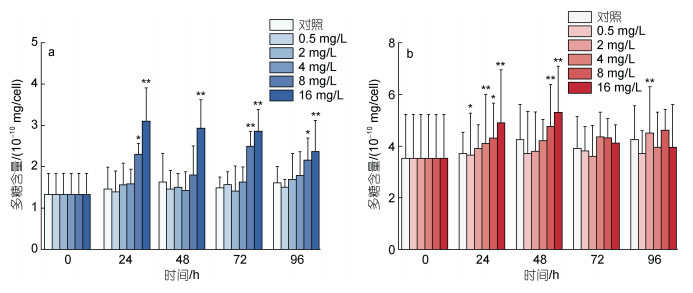 |
| 图 7 不同剂量浓度环烷酸胁迫下莱茵衣藻(a)、小球藻(b)多糖含量在不同时间下的影响 Fig. 7 The effect of different NAs concentrations on the polysaccharide content of C. reinhardtii (a) and C. vulgaris (b) in different durations 注: ** 代表P<0.01(差异极显著), *代表P<0.05(差异显著) |
本研究根据环境浓度设置了实验浓度为0.5、2、4、8和16 mg/L的环烷酸处理组, 发现0~96 h所有剂量的环烷酸均对莱茵衣藻和小球藻的种群增长和生理生化特征造成了一定的影响。在96 h下, 不同浓度环烷酸胁迫下两种淡水微藻均表现出了高度一致的毒性效应: 96 h内低浓度环烷酸胁迫(0.5~4 mg/L)对淡水微藻造成持续的毒性兴奋效应, 刺激了微藻种群的增长; 96 h下高浓度环烷酸胁迫(8~16 mg/L)会对淡水微藻造成急性毒性效应, 抑制种群增长。研究结果表明环烷酸对淡水微藻的种群及生理过程具有明显的剂量和时间效应, 高酸原油污染能对水生生态系统的稳定造成潜在威胁, 因此, 环烷酸应作为高酸石油泄漏风险区的重点监测对象。
伴随着实验浓度的增加, 环烷酸对淡水微藻的抑制效应也相应地增加。8和16 mg/L环烷酸处理组中莱茵衣藻和小球藻的种群增长几乎停滞。在溢油事故区或原油开采区环烷酸的浓度为10~60 mg/L (Clemente et al, 2005; Vander et al, 2021), 远高于实验设置的浓度, 说明石油污染事故中, 环烷酸是造成生态破坏的重要组分之一。在低浓度环烷酸处理组中(0.5、2和4 mg/L), 环烷酸可以促进莱茵衣藻和小球藻的种群生长, 这种低浓度、短时间引起生物体产生刺激性的毒性效应, 被称为毒物兴奋效应(Calabrese et al, 1999)。这种反应主要根据生物体内自身的毒物适应机制所决定, 一般表现在低浓度毒物刺激下造成生物体某些生理生化过程过度表达, 并对其生长发育起到积极的作用。欧晓明等(2003)发现较低浓度(1 mg/L)的新型除草剂HNPC-C9908作用于小球藻时表现出明显的生长刺激作用, 而高浓度(>25 mg/L)则使藻细胞生长缓慢, 细胞叶绿体解体。低浓度的多溴联苯醚处理海水小球藻(0.1~3 μg/L)、牟氏角毛藻(0.1~5 μg/L)和赤潮异弯藻(0.1~1 μg/L)对藻体生长具有短暂的促进作用(李卓娜, 2009)。溢油事故中, 环烷酸经过长期的稀释降解后, 由高浓度抑制效应转为低浓度刺激效应, 可能导致溢油后藻华频繁的爆发(周利等, 2013)。
不同浓度环烷酸处理对两种淡水微藻的生理生化特征的影响与种群密度的影响一致, 低浓度环烷酸下(0.5、2和4 mg/L)在96 h对两种淡水微藻表现出促进脂质、蛋白质等物质积累的趋势; 高浓度环烷酸处理下(8~16 mg/L)在96 h对莱茵衣藻和小球藻则表现出抑制效应, 叶绿素a的含量和脂质的含量下降而多糖含量上升。叶绿素a是植物体内重要的捕光色素, 其含量可以直接影响光合效率。蔡卓平(2009)在研究微藻的毒性兴奋效应时发现低浓度有机磷农药会刺激微藻体内的叶绿素a含量升高, 提高植物的固碳效率并刺激蛋白质的合成转运, 进而使得藻细胞生长旺盛、分裂速度加快。不同浓度的环烷酸在96 h内通过抑制或者促进淡水微藻体内叶绿素a的含量上升, 影响淡水微藻光合固碳的能力, 进而影响种群增长速率。低浓度环烷酸胁迫会刺激叶绿素a的含量增加从而加强光合固碳效率, 而高浓度环烷酸胁迫则会抑制叶绿素a的含量, 降低光合固碳的效率。光合效率在脂质合成中也发挥了重要的作用。脂质是高度还原的化合物, 合成时需要大量光合作用中的产物还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate, NADPH)作为还原剂(Li-Beisson et al, 2019)。低浓度环烷酸刺激淡水微藻的光合效率上升, 产生大量的NADPH和三磷酸腺苷(ATP)可用于叶绿体中脂质的合成, 导致脂质过量积累。但是高浓度环烷酸刺激下, 光合作用受到抑制, NADPH等光合作用中间产物含量下降, 导致脂质合成受阻。在高浓高度环烷酸胁迫下, 微藻细胞的ROS阳性率上升, 细胞受到严重的氧化损伤, 细胞也可能通过减少脂质的合成以对抗氧化损伤。研究表明由于脂质是高度还原的化合物, 机体内过多的ROS会介导脂质的氧化, 形成丙二醛等脂质过氧化物对细胞造成严重损伤, 因此当藻类细胞受到严重的氧化应激时, 细胞内会协调脂质储存在塑球蛋白中并从叶绿体运往胞质进行降解等行为以减少胞内脂质的含量(Xu et al, 2020)。在环烷酸的胁迫下, 两种淡水微藻多糖的含量在高浓度环烷酸刺激下显著上升, 说明多糖类物质在淡水微藻适应环烷酸胁迫时发挥了重要的作用。淀粉性多糖是植物体重要的储能物质。和脂质相比, 多糖类物质没有还原性, 且合成时不需要大量的NADPH提供还原力, 可能是淡水微藻应对高浓度环烷酸时主要的储能物质。同时, 功能性多糖的增加可以帮助淡水微藻调节胞内渗透压、提高抗氧化活性从而适应高浓度环烷酸的胁迫。可溶性多糖是植物体内进行渗透调节的重要物质, 并具有清除植物体内ROS、激活抗氧化酶活性的作用(张露, 2020)。研究表明慈姑多糖、枸杞多糖等多糖类物质具有抗氧化活性和抑制细胞凋亡等作用, 在面对金属离子胁迫和抵抗细菌污染等发挥了重要的作用(Liu et al, 2022a, 2022b)。因此多糖类物质在储能和抗氧化活性上对淡水微藻适应高浓度环烷酸胁迫都可能发挥了重要的作用。
所有环烷酸处理组中, 两种海洋微藻都表现出了显著的氧化应激效应。低浓度环烷酸处理组(0.5、2和4 mg/L)的莱茵衣藻和小球藻SOD和CAT酶活性显著上升, ROS水平维持在相对稳定的状态, 说明抗氧化酶在微藻体内对环烷酸造成的氧化损伤发挥了积极的作用。高浓度环烷酸处理组(8~16 mg/L)的莱茵衣藻和小球藻SOD和CAT活性显著降低且ROS含量上升, 说明高浓度环烷酸会对淡水微藻造成严重的氧化损伤并破坏微藻体内的抗氧化酶系统, 对微藻造成不可恢复的氧化损伤。在适应环烷酸造成的氧化胁迫时, 莱茵衣藻和小球藻的抗氧化酶酶活表现出了种属差异, 小球藻SOD和CAT活性的增加幅度显著低于莱茵衣藻; 低浓度环烷酸胁迫下, 小球藻表现出了更稳定的ROS水平说明小球藻比莱茵衣藻更容易适应环烷酸造成的氧化损伤。SOD和CAT是生物体抗氧化机制的中心酶之一, SOD和CAT活性的增加表示氧化损伤的增加, 几乎所有的氧化胁迫都可以诱导SOD活性的显著增加(杨国远等, 2012)。在石油中其他的多环芳烃的研究中同样发现: 低浓度刺激微藻生长时, 会造成氧化应激反应; 高浓度抑制反应时, 造成氧化损伤(洪有为等, 2008), 与本实验结果一致。
尽管96 h下高浓度处理组的莱茵衣藻和小球藻的各项生理指标都表现出抑制效应, 但是通过不同时间下的生理指标可以发现: 8 mg/L处理组的莱茵衣藻和小球藻的SOD活性、CAT活性、粗脂含量和蛋白质含量, 16 mg/L处理组的莱茵衣藻和小球藻蛋白质含量在暴露初期都表现出了刺激效应。这说明高浓度环烷酸对微藻的毒性抑制具有时间效应。高浓度环烷酸暴露的初期, 莱茵衣藻和小球藻的抗氧化系统和脂质、蛋白质等也会受到毒性兴奋效应, 积极抵御环烷酸造成的氧化损伤。但是随着暴露时间的推移, 高浓度环烷酸造成的毒性逐渐增强, ROS含量升高, 导致两种微藻抗氧化系统被破坏, 并进一步造成种群抑制的现象。
4 结论低浓度的环烷酸(0.5~4 mg/L)会造成淡水微藻96 h持续的毒物兴奋效应, 刺激种群增长; 高浓度的环烷酸(8~16 mg/L)会造成淡水微藻急性毒性效应, 抑制种群生长。不同浓度的环烷酸胁迫均会影响淡水微藻的生理活性。低浓度环烷酸处理会刺激淡水微藻的叶绿素a含量积累, 导致光合效率升高, 脂质积累量上升, 有利于种群增长。高浓度环烷酸处理会抑制叶绿素a的含量并受到急性的过氧化损伤, 导致脂质含量下降, 并积累多糖类物质用于储能和抵抗环烷酸胁迫。环烷酸会对淡水微藻造成氧化损伤, 造成ROS含量上升, 且两种微藻的抗氧化酶SOD和CAT对环烷酸处理具有种属差异。研究还发现高浓度环烷酸对淡水微藻的急性损伤具有时间效应, 毒性随着胁迫时间的延长而逐渐增强。综上, 本研究发现低浓度环烷酸对浮游植物具有兴奋效应; 高浓度环烷酸对浮游植物具有时间依赖的急性毒性效应, 原因可能是环烷酸剂量影响了淡水微藻的能量存储方式。
马帅, 付莉莉, 汪萌, 等, 2010. 从微藻中提取粗脂的方法比较. 中国油脂, 35(5): 77-79 |
田松柏, 2005. 原油中石油酸的分析与分布规律研究. 石油化工腐蚀与防护, 22(2): 1-5 |
李卓娜, 2009. 2, 2′, 4, 4′ -四溴联苯醚(BDE-47)对4种海洋微藻的毒性效应研究[D]. 青岛: 中国海洋大学: 24-26.
|
杨国远, 万凌琳, 雷学青, 等, 2014. 重金属铅、铬胁迫对斜生栅藻的生长、光合性能及抗氧化系统的影响. 环境科学学报, 34(6): 1606-1614 |
张露, 2021. 一株耐酸微藻的分离鉴定及其对金属离子胁迫的生理响应[D]. 合肥: 合肥工业大学: 34-38.
|
欧晓明, 雷满香, 黄明智, 等, 2003. 新除草剂HNPC-C9908对小球藻生长的影响研究. 农药学学报, 5(3): 16-23 DOI:10.3321/j.issn:1008-7303.2003.03.003 |
周利, 唐丹玲, 孙景, 2013. 海洋溢油后浮游植物藻华观测分析和机制探讨. 生态科学, 32(6): 692-702 |
孟迎迎, 姚长洪, 刘娇, 等, 2017. 微藻生物质成分检测方法评述. 中国生物工程杂志, 37(7): 133-143 |
赵英永, 戴云, 崔秀明, 等, 2006. 考马斯亮蓝G-250染色法测定草乌中可溶性蛋白质含量. 云南民族大学学报(自然科学版), 15(3): 235-237 |
洪有为, 袁东星, 2008. 典型多环芳烃对红树林区硅藻的毒性效应. 海洋环境科学, 27(4): 338-342 |
童晓光, 张光亚, 王兆明, 等, 2018. 全球油气资源潜力与分布. 石油勘探与开发, 45(4): 727-736 |
蔡卓平, 2009. 有机磷农药对海洋微藻的毒物兴奋效应及其机理研究[D]. 广州: 暨南大学: 77-79.
|
CALABRESE E J, BALDWIN L A, HOLLAND C D, 1999. Hormesis: a highly generalizable and reproducible phenomenon with important implications for risk assessment. Risk Analysis, 19(2): 261-281 |
CLEMENTE J S, FEDORAK P M, 2005. A review of the occurrence, analyses, toxicity, and biodegradation of naphthenic acids. Chemosphere, 60(5): 585-600 |
LEUNG S S C, MACKINNON M D, SMITH R E H, 2001. Aquatic reclamation in the Athabasca, Canada, oil sands: naphthenate and salt effects on phytoplankton communities. Environmental Toxicology and Chemistry, 20(7): 1532-1543 |
LI-BEISSON Y, THELEN J J, FEDOSEJEVS E, et al, 2019. The lipid biochemistry of eukaryotic algae. Progress in Lipid Research, 74: 31-68 |
LI C, FU L, STAFFORD J, et al, 2017. The toxicity of oil sands process-affected water (OSPW): a critical review. Science of the Total Environment, 601-602: 1785-1802 |
LICHTENTHALER H K, WELLBURN A R, 1983. Determinations of total carotenoids and chlorophylls a and b of leaf extracts in different solvents. Biochemical Society Transactions, 11(5): 591-592 DOI:10.1042/bst0110591 |
LIU J F, LI Y C, PU Q S, et al, 2022b. A polysaccharide from Lycium barbarum L.: structure and protective effects against oxidative stress and high-glucose-induced apoptosis in ARPE-19 cells. International Journal of Biological Macromolecules, 201: 111-120 |
LIU H S, ZHOU M Y, ZHANG X, et al, 2022a. Sagittaria sagittifolia polysaccharide protects against six-heavy-metal- induced hepatic injury associated with the activation of Nrf2 pathway to regulate oxidative stress and apoptosis. Journal of Inorganic Biochemistry, 232: 111810 |
OECD, 1984, OECD Guidelines for the testing of chemicals, section 2 [M] // Test No. 207: Earthworm, Acute Toxicity Tests. Paris, France: OECD, doi: 10.1787/9789264070042-en.
|
POMFRET S M, BRUA R B, MILANI D, et al, 2021. Metabolomic analysis of hexagenid mayflies exposed to sublethal concentrations of naphthenic acid. Frontiers in Molecular Biosciences, 8: 669082 |
QUINLAN P J, TAM K C, 2015. Water treatment technologies for the remediation of naphthenic acids in oil sands process-affected water. Chemical Engineering Journal, 279: 696-714 |
SCOTT A C, ZUBOT W, DAVIS C W, et al, 2020. Bioaccumulation potential of naphthenic acids and other ionizable dissolved organics in oil sands process water (OSPW) – A review. Science of the Total Environment, 712: 134558 |
SWIGERT J P, LEE C, WONG D C L, et al, 2015. Aquatic hazard assessment of a commercial sample of naphthenic acids. Chemosphere, 124: 1-9 |
VANDER MEULEN I J, KLEMISH J L, PERU K M, et al, 2021. Molecular profiles of naphthenic acid fraction compounds from mine lease wetlands in the Athabasca Oil Sands Region. Chemosphere, 272: 129892 |
XU C C, FAN J L, SHANKLIN J, 2020. Metabolic and functional connections between cytoplasmic and chloroplast triacylglycerol storage. Progress in Lipid Research, 80: 101069 |
ZHANG H X, TANG X X, SHANG J G, et al, 2018. The effect of naphthenic acids on physiological characteristics of the microalgae Phaeodactylum tricornutum and Platymonas helgolandica var. tsingtaoensis. Environmental Pollution, 240: 549-556 |
ZHAO Y R, TANG X X, QU F Y, et al, 2020. ROS-mediated programmed cell death (PCD) of Thalassiosira pseudonana under the stress of BDE-47. Environmental Pollution, 262: 114342 |
 2023, Vol. 54
2023, Vol. 54


