
中国海洋湖沼学会主办。
文章信息
- 沈宏孝, 李涛, 李爱芬. 2023.
- SHEN Hong-Xiao, LI Tao, LI Ai-Fen. 2023.
- 一株蹄形藻(Kirchneriella sp.)的生长和油脂积累潜力评价
- EVALUATION OF GROWTH AND LIPID ACCUMULATION POTENTIAL OF KIRCHNERIELLA SP.
- 海洋与湖沼, 54(1): 113-124
- Oceanologia et Limnologia Sinica, 54(1): 113-124.
- http://dx.doi.org/10.11693/hyhz20220500145
文章历史
-
收稿日期:2022-05-30
收修改稿日期:2022-08-13
2. 中国科学院南海海洋研究所 中国科学院热带海洋生物资源与生态重点实验室 广东省海洋药物重点实验室 广东广州 510301;
3. 南方海洋科学与工程广东省实验室(广州) 广东广州 511458
2. Key Laboratory of Tropical Marine Bio-resources and Ecology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangdong Provincial Key Laboratory of Marine Medicine, Guangzhou 510301, China;
3. Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou), Guangzhou 511458, China
产油微藻生长速度快, 环境适应性强, 可作为生物柴油生产的替代原料(Chisti, 2007), 然而, 高成本使得微藻生物柴油的规模化生产难以实现(Feng et al, 2021), 选育性状优良的产油藻株是解决高成本问题的可行策略。绿藻是产油微藻最大的候选类群, 绿藻的平均总脂含量可达干重25%以上, 脂肪酸组成合理, 适宜作为生物柴油的生产原料(Hu et al, 2008)。蹄形藻(Kirchneriella sp.)属于绿藻门、绿藻纲、环藻目、硒藻科, 广泛存在于自然界的各种水体中, 具有较强的环境适应能力, 研究表明, 蹄形藻可以积累高含量的储藏性脂类(郑和龙, 2019), 是一种具有微藻油脂生产潜力的藻株。
评价一株微藻是否具有生物柴油的开发潜力, 除了评价其总脂含量(产量)和生长速率外, 脂肪酸组成和光能转化效率等指标同样重要(Hu et al, 2008)。油脂的脂肪酸组成可以影响生物柴油的稳定性和理化特性(Wu et al, 2014), 微藻吸收的光能一部分用于光化学反应Y(Ⅱ), 一部分以非光化学淬灭[non-photochemical quenching, Y(NPQ)]形式耗散, 即调节性的光保护机制耗散为热, 剩余能量以非光诱导的非光化学猝灭[non-photoinduced non-photochemical quenching, Y(NO)]形式耗散, 即热量和发出荧光, 拥有更高比例Y(Ⅱ)和更少比例Y(NPQ)+Y(NO)的产油微藻在光能利用效率方面更具优势, 可以作为产油潜力藻种的评价指标之一。
许多种类的微藻在营养充足条件下, 细胞内的碳水化合物和蛋白质占主要比例, 而脂类以膜脂为主, 其干重含量通常不超过20%, 只有在营养胁迫条件下, 细胞改变碳流分配转而大量合成储藏性脂类, 才能表现出其特有的脂类积累潜力(Liu et al, 2012)。低氮胁迫是一种高效的诱导脂质积累的策略(Shen et al, 2016)。苏怡等(2017)将BG-11培养基中氮浓度由1.5 g/L降低为0.5 g/L时, 获得了更高的油脂产量。佐夫色绿藻(Chlorella zofingiensis)在氮缺乏时总脂产率由68.1 mg/(L·d)提高到87.1 mg/(L·d) (Feng et al, 2012)。此外, 氮浓度也可以影响微藻的脂肪酸组成, 从而影响生物柴油的特性(Najafabadi et al, 2015)。Yaakob等(2021)报道缺氮条件会导致饱和脂肪酸和单不饱和脂肪酸比例增加。上述研究表明, 评价一株微藻是否可以作为生物柴油的生产原料, 应该适当设置一些胁迫因素诱导油脂积累, 从而评估其最大油脂积累能力。
本研究以分离自暨南大学明湖的一株淡水单细胞绿藻JNU-3201为研究对象, 首先利用形态和分子技术鉴定该藻种的种属, 随后设置不同浓度的硝酸盐处理组进行一次性培养, 探讨该藻生长、色素含量、光合效率、主要生化组成(总脂、可溶性蛋白、总碳水化合物)及脂肪酸组成的变化, 评估其油脂积累能力, 并利用现有模型对该藻生物柴油的主要参数进行预测, 研究结果为该藻能否作为微藻油或者生物柴油的生产原料提供理论依据。
1 材料与方法 1.1 实验材料及保种蹄形藻JNU-3201, 分离自暨南大学明湖(113°36′E, 23°14′N), 现保存于暨南大学水生生物研究中心。
保种: 蹄形藻JNU-3201培养于含有适量改良BG-11培养基的三角瓶, 棉花、纱布、牛油纸封口, 室温[(25±1) ℃]放置。每隔30 d左右, 更换新鲜的改良BG-11培养基。改良BG-11培养基配方如下: 18.0 mmol/L NaNO3, 0.175 mmol/L K2HPO4·3H2O, 0.304 mmol/L MgSO4·7H2O, 0.245 mmol/L CaCl2·2H2O, 0.241 mmol/L NaCO3, 11.7 μmol/L FeCl3·6H2O, 31.1 μmol/L柠檬酸, 11.7 μmol/L EDTANa2·2H2O, 46.1 μmol/L H3BO3, 9.15 μmol/L MnCl2·4H2O, 0.77 μmol/L ZnSO4·7H2O, 1.62 μmol/L Na2MoO4·2H2O, 9.15 μmol/L Co(NO3)2·6H2O, 0.32 μmol/L CuSO4·5H2O (Andersen, 2005)。
1.2 培养条件及实验设置蹄形藻JNU-3201置于改良BG-11中培养7 d后, 采用3 500 r/min离心收集藻细胞, 重悬浮于不同氮浓度的改良BG-11培养基后进行一次性培养。培养装置为柱状光生物反应器(Φ 3.0 cm × 60 cm, 300 mL), 接种密度OD750=1.00±0.05, 设置4种NaNO3浓度, 分别为3.6、9.0、18.0和36.0 mmol/L, 通入1% CO2的空气, 培养温度为(25±1) ℃, 24 h持续单侧光照射, 光强为300 μmol photons/(m2·s), 培养周期18 d, 每组设置3个平行样(n=3)。
1.3 藻种鉴定使用光学显微镜BX53 (Olympus, 东京, 日本)进行形态学观察, 利用CTAB法(Chen et al, 2014)进行DNA的提取, 引物序列为A(5′-ACCTGGTTGATCCT GCCAGT-3′)和B(5′-TGATCCTTCTGCAGGTTCACC TAC-3′), PCR产物回收和纯化后, 委托北京擎科生物科技有限公司进行测序, 使用MEGA 7软件, 应用最大似然法(Maximum Likelihood, ML)构建系统进化树。
1.4 生物量测定取5 mL藻液置于预先烘干至恒重的滤膜上, 抽滤, 随后将滤膜置于100 ℃烘箱烘至恒重, 计算公式: 生物量(单位: g/L)=200×(m1–m0), 其中, m1是带有生物质的滤膜重量, m0是空的滤膜重量。
1.5 细胞密度测定取藻液1 mL, 用超纯水适度稀释, 使用细胞计数板(柏奥易杰, 北京, 中国)在显微镜下计数, 每个样品重复计数8次, 计算其平均值作为该样品的细胞密度(单位: cells/mL)。
1.6 色素含量测定取藻液1 mL, 3 500 r/min离心5 min后弃上清, 加入5 mL无水甲醇, 避光70 ℃水浴20 min, 冷却至室温, 3 500 r/min离心5 min, 上清液测定470、652和665 nm波长下的吸光值, 利用以下公式计算色素含量。
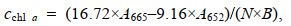 (1)
(1)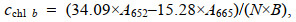 (2)
(2)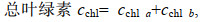 (3)
(3)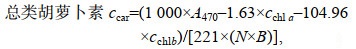 (4)
(4)其中, cchl a是叶绿素a含量(单位: mg/g), cchl b是叶绿素b含量(单位: mg/g), cchl是总叶绿素含量(单位: mg/g), ccar是总类胡萝卜素含量(单位: mg/g), A470是470 nm处的吸光度值, A652是652 nm处的吸光度值, A665是665 nm处的吸光度值, N是稀释倍数, B是生物量(单位: g/L)。
1.7 叶绿素荧光参数测定藻液暗适应20 min, 利用脉冲调制式叶绿素荧光仪XE-PAM (Walz, Effectnich, 德国)测定光系统Ⅱ的实际光合效率Y(Ⅱ)、调节性光保护机制的热耗散Y(NPQ)、被动热耗散和荧光能Y(NO)。先打开测量光[<0.1 μmol photons/(m2·s)]照射30 s, 随后开启饱和脉冲光[4 000 μmol photons/(m2·s)]照射0.8 s, 测得最大荧光Fm, 打开光化光[300 μmol photons/(m2·s)]照射10 min, 测得F, 再次打开饱和脉冲光[4 000 μmol photons/(m2·s)]照射0.8 s, 测量Fm′。
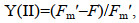 (5)
(5)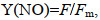 (6)
(6)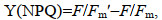 (7)
(7)其中, Fm是所有PSII中心关闭的情况下, 样品暗适应后的最大荧光值; Fm′是在所有PSⅡ中心关闭的情况下, 照射样品后的最大荧光值; F是打开光化光之后测得的荧光值。
1.8 主要生化组成测定及产率计算称取100 mg藻粉, 利用两步有机溶剂抽提法进行总脂的提取(第一步为甲醇︰二甲亚砜=9︰1, 第二步为正己烷︰乙醚=1︰1), 利用重量法测定总脂含量(Khozin et al, 2005)。称取脱脂藻渣10 mg, 利用0.5 mol/L的NaOH溶液进行可溶性蛋白的提取, 采用Lowry法测定可溶性蛋白含量(Lowry et al, 1951)。称取脱脂藻渣10 mg, 利用0.5 mol/L的H2SO4溶液, 进行总碳水化合物的提取, 采用苯酚-硫酸法测定总碳水化合物含量(Dubois et al, 1956)。
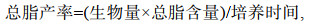 (8)
(8) (9)
(9)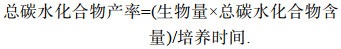 (10)
(10)称取25 mg干藻粉, 加入2 mL H2SO4︰无水甲醇︰甲苯(体积比为2︰88.2︰9.8)混合溶液, 80 ℃的水浴1.5 h, 随后加入1 mL纯水和1 mL正己烷震荡分层, 取上层有机相用氮气吹干, 同时加入1 mL十七烷酸甲酯, 利用GC-2014气相色谱仪(Shimadzu, 日本)进行测定(Khozin-Goldberg et al, 2005), 色谱条件为: 以高纯氮气为载气, DB-5毛细管柱, 进样口温度260 ℃, 60 ℃保留2 min, 30 ℃/min升温至120 ℃, 1.5 ℃/min升温至250 ℃保留2 min, 检测器为FID。
1.10 物柴油参数测定使用Biodiesel Analyzer (Version 2.2)计算生物柴油质量参数, 包括: 十六烷值、运动黏度、比重、密度、碘值、氧化稳定性, 计算公式如下:
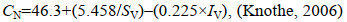 (11)
(11) (12)
(12) (13)
(13) (14)
(14)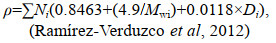 (15)
(15)其中, CN是十六烷值, SV是皂化值(单位: mg KOH/g), IV是碘值(单位: g I2/100 g), υ是运动黏度(单位: mm2/s), ρ是密度(单位: g/cm3), N是油样中特定脂肪酯的百分比, M是脂肪酯的相对分子质量, D是脂肪酯中双键的数量, Ni是生物柴油中给定脂肪酸的百分比, Mwi是脂肪酸的分子量, Di是给定脂肪酸中双键的数量。
1.11 数据分析使用Origin 9.0进行科研制图, 使用SPSS 22.0对数据进行单因素方差分析, P<0.05表示显著性差异。
2 结果 2.1 绿藻JNU-3201的形态特征和种属鉴定绿藻JNU-3201在光学显微镜呈马蹄形, 其长度为4~6 μm, 宽度为1~2 μm, 无聚集生长现象(图 1a, 1b)。构建基于18s rRNA序列的系统进化树, 该藻株与肥壮蹄形藻(Kirchneriella obesa ACOI 3125)亲缘关系最近(图 1c), 初步将其鉴定为蹄形藻(Kirchneriella sp.), 隶属于绿藻门(Chlorophyta)、绿藻纲(Chlorophyceae)、环藻目(Sphaeropleales)、硒藻科(Selenastraceae)、蹄形藻属(Kirchneriella sp.)。
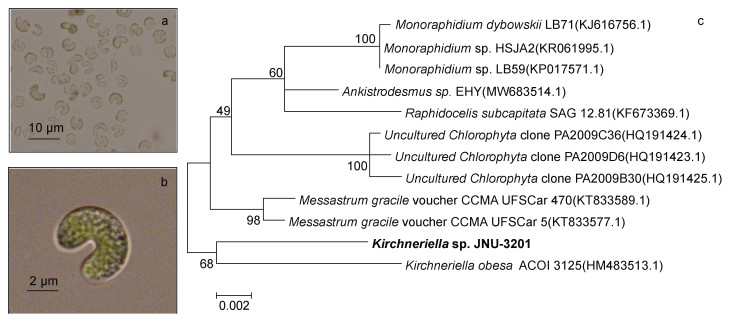 |
| 图 1 蹄形藻JNU-3201显微图片(a, b)与基于18s rRNA的系统进化树(c) Fig. 1 Cell morphology of the Kirchneriella sp. JNU-3201 (a, b) and phylogenetic tree based on 18s rRNA (c) 注: 图中加粗字体表示本研究所用藻株的编号 |
不同氮浓度下蹄形藻JNU-3201的生长表现出显著差异。随氮浓度增加, 蹄形藻JNU-3201生物量逐渐增加(图 2a), 培养结束时, 36.0 mmol/L组生物量最高[(6.53±0.11) g/L], 3.6 mmol/L组生物量[(2.93±0.06) g/L]显著低于另外3个实验组(P < 0.05)。3.6、9.0和18.0 mmol/L组的细胞密度在第6天后基本不再增加, 36.0 mmol/L组第8天后不再增加(图 2b)。初始氮浓度越低, 培养物颜色变化越明显(图 2c), 3.6和9.0 mmol/L组培养前3天颜色由深绿色变为浅绿色, 培养结束时变为橙黄色, 而18.0和36.0 mmol/L组的培养物颜色始终保持绿色。
随着初始氮浓度增加, 总叶绿素含量和总类胡萝卜素含量增高。培养前2天, 9.0、18.0和36.0 mmol/L组总叶绿素含量和总类胡萝卜素含量增加, 第2天总叶绿素含量达到最高值, 分别为(22.88±1.82)、(25.37± 1.87)和(28.19±2.03) mg/g, 同时总类胡萝卜素含量也达到最高值, 分别为(6.17±0.44)、(6.14±0.52)和(6.70±0.33) mg/g。随后逐渐下降, 3.6和9.0 mmol/L组总叶绿素含量和总类胡萝卜素含量比18.0和36.0 mmol/L组降低速度更快(图 3a, 3b)。氮浓度越低, 类胡萝卜素/叶绿素越高(图 3c), 说明类胡萝卜素比例不断提高, 表观现象反映于培养物颜色变为橙色(图 2c)。
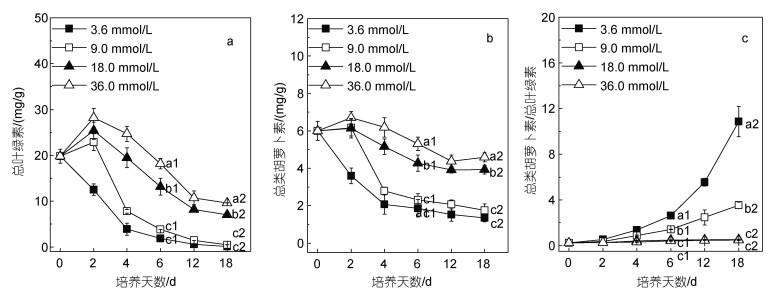 |
| 图 3 不同氮素水平下蹄形藻JNU-3201的色素含量 Fig. 3 pigment content of Kirchneriella sp. JNU-3201 under different nitrogen levels 注: a: 总叶绿素; b: 总类胡萝卜素; c: 总类胡萝卜素/总叶绿素; 图 3a中a1~c1代表第6天总叶绿素含量的显著性差异, a2~c2代表第18天总叶绿素含量的显著性差异; 图 3b中a1~c1代表第6天总类胡萝卜素含量的显著性差异, a2~c2代表第18天总类胡萝卜素含量的显著性差异; 图 3c中a1~c1代表第6天总类胡萝卜素/总叶绿素的显著性差异, a2~c2代表第18天总类胡萝卜素/总叶绿素的显著性差异 |
叶绿素荧光参数可以表征藻细胞光合效率的变化。如图 4所示, 随着培养时间的延续, 蹄形藻JNU-3201在4种氮浓度条件下的Y(Ⅱ)比例逐渐减少, 3.6 mmol/L组Y(Ⅱ)比例的降速明显快于18.0和36.0 mmol/L组。3.6和9.0 mmol/L组Y(NO)比例的增加速度较快, 表明氮浓度低, 光能偏向于被动耗散为热量和发出荧光(图 2c)。培养12天后, 18.0和36.0 mmol/L组Y(NPQ)比例显著增加, 表明氮充足条件可以减少培养后期藻细胞光系统的损伤。
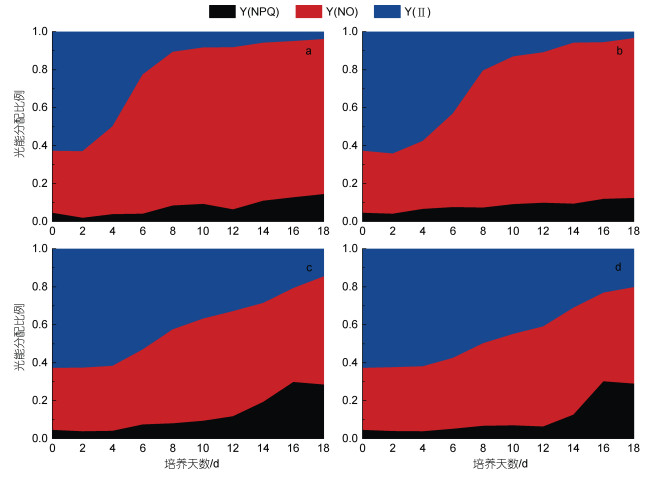 |
| 图 4 不同氮素浓度条件下蹄形藻JNU-3201光能分配比例的变化 Fig. 4 Changes in the proportion of light energy in Kirchneriella sp. JNU-3201 under different nitrogen concentrations 注: a: 氮素浓度3.6 mmol/L; b: 氮素浓度9.0 mmol/L; c: 氮素浓度18.0 mmol/L; d: 氮素浓度36.0 mmol/L; 测定点: 0、2、4、6、8、10、12、14、16、18天 |
不同氮浓度条件下, 培养前3天藻细胞优先积累碳水化合物, 3.6 mmol/L组碳水化合物的积累速率高于其他处理组(图 5b), 培养第3~6天, 9.0、18.0、36.0 mmol/L组碳水化合物继续积累, 培养第6天各浓度组碳水化合物含量达到最高值, 之后逐渐降低(图 5b)。培养开始后, 3.6 mmol/L组蛋白质含量迅速下降, 培养第0~3天, 9.0、18.0和36.0 mmol/L组蛋白质含量增加, 差异不显著, 3天后各浓度组蛋白质含量持续下降, 培养第3~6天, 下降速度较快, 6天后下降速度变慢, 氮浓度越低, 蛋白质含量下降越快(图 5c)。前3天脂质含量降低, 3天后脂质含量迅速增加, 3~18天脂质持续积累(图 5a), 培养至18天, 3.6、9.0、18.0和36.0 mmol/L组总脂含量(干重)分别为46.92%±1.52%、42.25%±2.12%、39.66%±7.61%和37.31%±5.52%, 表明降低氮浓度有利于蹄形藻JNU-3201积累脂质。随培养进行, 各浓度组总脂产量逐渐增加, 培养至18天, 18.0 mmol/L组总脂产量最高为(2.43±0.06) g/L。随培养进行, 3.6、9.0、18.0 mmol/L组总碳水化合物和可溶性蛋白产量逐渐降低, 36.0 mmol/L组总碳水化合物和可溶性蛋白产量先增加后降低, 第12天总碳水化合物和可溶性蛋白产量都达到最大值, 分别为(1.28±0.01)和(1.98±0.01) g/L。
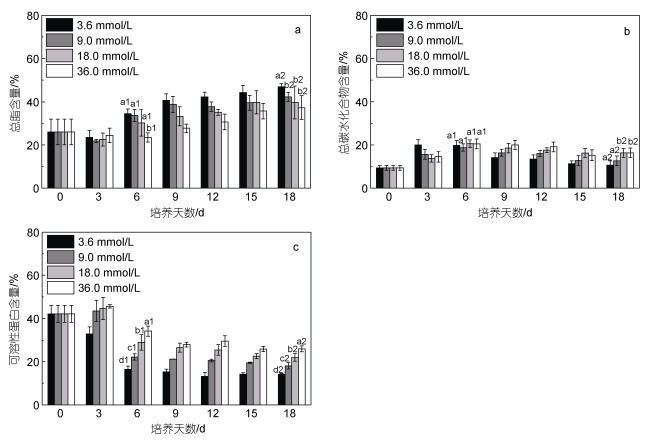 |
| 图 5 蹄形藻JNU-3201总脂、总碳水化合物、可溶性蛋白含量变化(干重) Fig. 5 Changes in total lipid, total carbohydrate and soluble protein contents of Kirchneriella sp. JNU-3201 (in dry weight) 注: a: 总脂; b: 总碳水化合物; c: 可溶性蛋白; 图 5a中a1~b1代表第6天总脂含量的显著性差异, a2~b2代表第18天总脂含量的显著性差异; 图 5b中a1代表第6天总碳水化合物含量无显著性差异, a2~b2代表第18天总碳水化合物含量的显著性差异; 图 5c中a1~d1代表第6天可溶性蛋白含量的显著性差异, a2~d2代表第18天可溶性蛋白含量的显著性差异 |
| 产量/(g/L) | NaNO3浓度/(mmol/L) | 培养天数 | ||
| 第6天 | 第12天 | 第18天 | ||
| 总脂 | 3.6 | 1.01±0.02 | 1.23±0.02 | 1.38±0.06 c1 |
| 9.0 | 1.71±0.01 | 1.93±0.03 | 2.32±0.02 b1 | |
| 18.0 | 1.79±0.06 | 2.04±0.07 | 2.43±0.06 a1 | |
| 36.0 | 1.24±0.04 | 2.05±0.02 | 2.42±0.02 a1 | |
| 总碳水化合物 | 3.6 | 0.58±0.01 | 0.39±0.01 | 0.31±0.01 d2 |
| 9.0 | 0.95±0.02 | 0.82±0.01 | 0.69±0.02 c2 | |
| 18.0 | 1.21±0.01 | 1.01±0.02 | 1.00±0.03 b2 | |
| 36.0 | 1.08±0.03 | 1.28±0.01 | 1.07±0.01 a2 | |
| 可溶性蛋白 | 3.6 | 0.48±0.01 | 0.38±0.01 | 0.42±0.03 d3 |
| 9.0 | 1.13±0.03 | 1.05±0.01 | 0.99±0.05 c3 | |
| 18.0 | 1.71±0.05 | 1.48±0.03 | 1.35±0.04 b3 | |
| 36.0 | 1.81±0.02 | 1.98±0.01 | 1.70±0.03 a3 | |
| 注: a1~c1代表第18天总脂产量的显著性差异; a2~d2代表第18天总碳水化合物产量的显著性差异; a3~d3代表第18天可溶性蛋白产量的显著性差异 | ||||
蹄形藻JNU-3201的主要脂肪酸包括棕榈酸(C16︰0)、油酸(C18︰1)亚油酸(C18︰2), 含量最高的脂肪酸为油酸(C18︰1)(表 2), 培养至9天, 9.0、18.0和36.0 mmol/L组油酸含量分别为总脂肪酸(total fatty acid, TFA)的56.5%±1.1%、56.1%±1.2%和58.2%±1.2%, 之后逐渐下降。随培养进行, 3.6 mmol/L组油酸含量不断增加, 培养至18天, 3.6 mmol/L组油酸含量最高, 为58.8%±1.2% TFA。3.6和9.0 mmol/L组的棕榈油酸(C16︰1)含量低于对照组(18.0 mmol/L), 36.0 mmol/L组棕榈油酸含量高于18.0 mmol/L组, 培养至18天, 4组氮浓度下C16和C18脂肪酸占比之和均超过95%。3.6 mmol/L组单不饱和脂肪酸含量最高(61.5%±0.6% TFA), 9.0 mmol/L组饱和脂肪酸含量最高(24.4%± 0.2% TFA)。
| 脂肪酸种类 | 对照组 | 不同NaNO3浓度 | |||||||||
| 第0天 | 第9天 | 第18天 | |||||||||
| 3.6 mmol/L | 9.0 mmol/L | 18.0 mmol/L | 36.0 mmol/L | 3.6 mmol/L | 9.0 mmol/L | 18.0 mmol/L | 36.0 mmol/L | ||||
| C16︰0 | 14.4±0.3 | 14.5±0.3 | 15.9±0.3 | 16.4±0.3 | 15.6 ±0.3 | 15.2 ±0.3 | 17.6±0.4 | 13.9±0.3 | 13.8±0.3 | ||
| C16︰1 | 4.6±0.1 | 6.4±0.1 | 1.7±0.0 | 2.6±0.1 | 1.9±0.0 | 1.9 ±0.0 | 1.7±0.0 | 4.0±0.1 | 4.4±0.1 | ||
| C18︰0 | 9.9±0.2 | 8.5±0.2 | 4.0±0.1 | 4.7±0.1 | 4.5±0.1 | 4.6 ±0.1 | 3.9±0.1 | 4.9±0.1 | 5.4±0.1 | ||
| C18︰1 | 32.1±0.6 | 40.3±0.8 | 56.5±1.1 | 56.1±1.2 | 58.2 ±1.2 | 58.8 ±1.2 a1 | 54.6±1.1 b1 | 48.6±1.0 c1 | 43.5 ±0.9d1 | ||
| C18︰2 | 11.9±0.2 | 13.6±0.3 | 11.6±0.2 | 9.2±0.2 | 9.3±0.2 | 9.8 ±0.2 | 11.1±0.2 | 15.9±0.3 | 18.9±0.4 | ||
| C18︰3 n6 | 0.7±0.0 | 2.0±0.0 | 0.8±0.0 | 0.8±0.0 | 0.6±0.0 | 0.5 ±0.0 | 0.9±0.0 | 1.3±0.0 | 1.3±0.0 | ||
| C18︰3 n3 | 13.4±0.3 | 8.7±0.2 | 6.7±0.1 | 6.5±0.1 | 6.0±0.1 | 5.9 ±0.1 | 6.4±0.1 | 7.3±0.1 | 8.2±0.2 | ||
| 其他 | 13.0±0.3 | 6.0±0.1 | 2.9±0.1 | 3.7±0.1 | 3.9±0.1 | 3.4 ±0.1 | 3.8±0.1 | 4.0±0.0 | 4.7±0.1 | ||
| C16-C18 | 87.0±0.2 | 94.0±0.3 | 97.1±0.3 | 96.3±0.3 | 96.1±0.3 | 96.6 ±0.3 | 96.2±0.3 | 96.0±0.3 | 95.3±0.3 | ||
| SFA | 24.2±0.2 | 23.1±0.2 | 19.9±0.2 | 21.2±0.2 | 20.1±0.2 | 21.9 ±0.2 | 24.4±0.2 | 22.3±0.2 | 23.2±0.2 | ||
| MUFA | 36.7±0.4 | 46.7±0.5 | 58.2±0.6 | 58.6±0.6 | 60.1±0.6 | 61.5 ±0.6 | 56.9±0.6 | 53.2±0.6 | 48.4±0.5 | ||
| PUFA | 39.0±0.2 | 30.3±0.2 | 21.9±0.1 | 20.2±0.1 | 19.8±0.1 | 16.6 ±0.1 | 18.7±0.1 | 24.5±0.1 | 28.4±0.2 | ||
| 注: SFA: 饱和脂肪酸; MUFA: 单不饱和脂肪酸; PUFA: 多不饱和脂肪酸; a1~d1代表第18天油酸的显著性差异。 | |||||||||||
根据蹄形藻JNU-3201的脂肪酸组成, 利用Biodiesel Analyzer软件对其生物柴油质量参数进行预测, 并与中国生物柴油标准BD100 (S10)和欧盟生物柴油标准EN 14214对比, 预测结果如表 3所示。随初始氮浓度增加, 十六烷值和运动黏度降低, 均符合EN14214和BD100 (S10)标准。不同氮浓度组比重相同, 均是0.88 kg/L, 符合EN 14214标准。密度和氧化稳定性符合BD100 (S10)标准, 随氮浓度增加, 氧化稳定性水平降低, 碘值增加, 符合EN 14214标准。
| 生物柴油参数 | 不同NaNO3浓度 | BD100 (S10) | EN 14214 | |||
| 3.6 mmol/L | 9.0 mmol/L | 18.0 mmol/L | 36.0 mmol/L | |||
| 十六烷值 | 59.69±0.21a1 | 59.40±0.13a1 | 58.43±0.07a1 | 57.87 ±0.26a1 | ≥51 | > 51 |
| 运动黏度/(mm2/s) | 4.90±0.01a2 | 4.88±0.01a2 | 4.79±0.01a2 | 4.73±0.01a2 | 1.9~6.0 | 3.5~5.0 |
| 比重/(kg/L) | 0.88±0.01a3 | 0.88±0.01a3 | 0.88±0.02a3 | 0.88±0.01a3 | – | 0.86~0.90 |
| 密度/(g/cm3) | 0.87±0.01a4 | 0.87±0.02a4 | 0.88±0.01a4 | 0.88±0.01a4 | 0.82~0.90 | 0.86~0.90 |
| 碘值/(g I2 /100 g) | 48.23±0.11d5 | 51.51±0.32c5 | 62.29±0.48b5 | 68.57±0.66a5 | – | < 120 |
| 氧化稳定性/h | 9.88±0.04a6 | 9.00±0.05b6 | 7.40±0.02c6 | 6.77±0.03d6 | ≥6 | – |
| 注: BD 100: 中国生物柴油标准(中华人民共和国国家质量监督检验检疫总局, 2017); S10: 硫含量不超过10 mg/kg; EN 14214: 欧盟生物柴油标准(European Committee for Standardization, 2008); –: 未给出标准值; a1代表十六烷值无显著性差异; a2代表运动黏度无显著性差异; a3代表比重无显著性差异; a4代表密度无显著性差异; a5~d5代表碘值的显著性差异; a6~d6代表氧化稳定性的显著性差异。 | ||||||
蹄形藻是一种分布广泛的淡水单细胞绿藻, 经常被发现于湖泊、水库、池塘、沼泽和稻田等水体, 最近一些研究表明该种藻具有较强的环境适应能力和较快的生长速率。Hussian等(2018)从埃及曼扎拉湖(Lake Manzala)中分离出31株绿藻, 发现蹄形藻为显著优势种。郑和龙(2019)报道蹄形藻的细胞分裂速率显著高于尖状栅藻、斜生栅藻和小球藻。Dextro (2021)的研究表明蹄形藻比索罗金小球藻(Chlorella sorokiniana)具有更强的竞争力。上述特性有利于蹄形藻在户外培养时减少杂藻污染的机会。蹄形藻JNU-3201在氮浓度3.6~36.0 mmol/L条件下均能正常生长, 说明其具有较强的氮浓度适应范围。许多微藻在较高的氮浓度条件下, 细胞生长受到严重抑制。石岩峻等(2004)研究结果表明较高的氮浓度下微小原甲藻(Prorocentrum minimum)生物量、比生长速率以及细胞密度均最低, 不利于其生长。本研究表明蹄形藻JNU-3201的生物量与氮浓度呈正相关, 这与许多以往报道一致(Breuer et al, 2012; Zhu et al, 2014; Delgado et al, 2021)。蹄形藻JNU-3201在氮浓度36.0 mmol/L取得最高生物量为(6.53±0.11) g/L, 与以往报道的自养藻种生物量相比, 处于相对中上水平。
不同氮浓度培养条件下, 微藻的生长情况呈现显著差异, 高氮组获得了比低氮组更高的细胞密度, 由于细胞之间存在遮光效应, 高氮组单位藻细胞接收到的光量子数低于低氮组。从另外一个角度考虑, 低氮组由于氮限制的影响, 藻细胞的光合色素合成受阻, 因此, 低氮组细胞的叶绿素含量低于高氮组[由培养物的颜色变化(图 2c)可以看出], 光合色素含量降低对微藻的光吸收能力产生负面影响, 从而导致低氮组细胞吸收的光量子或者参与光反应的光量子比例少于高氮组, 具体比例需要更加深入的量化研究进行确定。值得注意的是, 蹄形藻JNU-3201的最高细胞密度并未在氮浓度36.0 mmol/L时获得, 而是在氮浓度9.0 mmol/L时获得, 这一结果与李涛(2013)对荒漠栅藻和韦氏真眼点藻的研究结果类似, 推测其原因可能是适当氮胁迫水平下微藻优先进行细胞分裂, 以保证细胞密度, 待外界条件好转再进行营养生长, 具体机制还需要通过分子手段进一步验证。
3.2 蹄形藻JNU-3201的光能分配特性利用叶绿素荧光技术可以探究藻细胞吸收光能后的能量分配情况。常用以下三个参数表征能量(激发能)的去向: Y(Ⅱ)、Y(NO)和Y(NPQ), 三者之和为1。其中, Y(Ⅱ)反映藻细胞光合效率的高低; Y(NO)为被动耗散为热量和发出荧光的能量, 反映光系统Ⅱ反应中心关闭时的荧光耗散, 其值升高说明藻细胞光系统受到损伤; Y(NPQ)反映藻细胞通过光保护机制耗散为热的能量, 是光系统的可逆调节过程(Klughammer et al, 2008)。藻细胞在正常生长条件下, 通常具有较高的Y(Ⅱ), 而在轻微胁迫条件下, Y(Ⅱ)降低, Y(NPQ)和Y(NO)升高, 而当Y(NO)大幅度升高时, 表明藻细胞正面临不可逆的光系统损伤。在本研究中, 由Y(Ⅱ)看出, 在培养前期蹄形藻JNU-3201具有较高的光合效率, 随培养进行, Y(Ⅱ)减少、Y(NO)+Y(NPQ)大幅增加, 说明藻细胞用于光反应的光能越来越少, 随着氮浓度的越低, Y(Ⅱ)降低幅度越明显, Y(NO)+Y(NPQ)增加幅度越大, Y(NO)+Y(NPQ)增加可能与缺氮导致的光系统蛋白合成受阻或者蛋白分解有关。大量研究表明低氮胁迫可以诱导产油微藻快速积累油脂, 但低氮浓度却明显降低了藻细胞的光合效率。光合作用是微藻一切能量的来源, 光合效率降低势必会影响微藻的生长和主要产物的积累。
大量研究表明, 产油微藻的光合效率与其油脂含量常呈现负相关, 特别是在氮限制条件下尤为明显, 氮限制导致光合色素合成受阻, 色素蛋白复合物和Rubisco酶分解加剧, 从而显著降低藻细胞的光合效率, 但氮限制可以改变碳流分配, 促进产油藻细胞合成更多的储藏性脂类, “低光合效率”与“高油脂含量”这一矛盾一直是藻类学家试图解决的科学问题。李涛等(2011)发现可能存在不同类型的产油微藻, 其中一种就是绿色产油微藻, 在培养末期, 绿色藻细胞依然可以大量合成油脂, 本研究的蹄形藻在培养中期已变为黄色, 说明它通过光合作用同化碳源的能力减弱, 虽然碳流倾向于合成储藏性油脂, 但由于其光合固碳能力减弱, 因此对细胞最终的油脂产量会产生一定影响。藻细胞在氮充足条件下, 具有较高光合效率, 但藻细胞合成油脂的能力较弱, 在氮限制条件下, 藻细胞大量合成油脂, 但光合效率较弱, 因此寻找适宜的氮浓度, 在“保证藻细胞具有较高光合效率的前提下, 诱导微藻合成储藏性油脂”也是一种提高油脂产量的策略, 这也是针对本研究藻种的一种有效策略。
3.3 蹄形藻JNU-3201三大物质变化及油脂产量分析蹄形藻JNU-3201的脂类、蛋白质和碳水化合物含量在培养周期内呈现趋势性变化规律, 随培养时间的延续, 藻细胞的脂类含量逐渐增加, 而蛋白质含量和碳水化合物含量呈现降低趋势, 上述结果表明蹄形藻JNU-3201用于储藏能量和碳源的主要物质可能是脂类, 其总脂含量最高可达40%以上, 对比以往研究结果, 绿藻平均总脂含量(干重)25% (Hu et al, 2008), 说明该藻具有较好的油脂生产潜力, 可以认为是一株产油微藻。此外, 脂类、蛋白质和碳水化合物含量的变化趋势与氮浓度高低存在相关性, 低氮有利于脂类的积累, 而高氮更有利于蛋白质和碳水化合物的积累, 这一规律与大多数研究相似, 如微芒藻、真眼点藻、小球藻等(辜博等, 2011; Zhang et al, 2013; Adenan et al, 2016)。
低氮限制可以显著促进微藻油脂的积累, 一方面, 低氮限制作为一种逆境条件, 微藻通过合成一些储存物质(油脂和碳水化合物)或者减少高耗能代谢(如细胞分裂), 从而保证细胞渡过逆境, 而油脂作为高效的能量和碳源储藏物, 对产油微藻来说是一种较优选择; 另一方面, 从脂类代谢层面, 微藻通过加强脂类合成代谢的关键酶, 例如甘油-3-磷酸酰基转移酶、溶血磷脂酸酰基转移酶或二酰基甘油酰基转移酶, 从而加强油脂的合成(Taylor et al, 2002; Lardizabal et al, 2008; Zheng et al, 2008)。
低氮胁迫是诱导产油微藻油脂积累的有效条件之一, 但并非获得最高总脂产量的必要条件, 因为总脂产量是生物量和总脂含量的乘积, 其数值高低不仅与藻细胞的总脂含量有关, 与生物量也存在较大关系(Rodolfi et al, 2009)。海绿球藻(Halochlorococcum sarcotum)和微绿球藻(Nannochloris oculata)均在最高总脂含量的实验组中, 总脂产量达到最高值, 分别为0.25和0.23 g/L(梁英等, 2020)。共培养栅藻(Scenedesmus sp.)和酵母(Yeast CCMY), 在最高生物量的实验组, 总脂产量最高为0.29 g/L (Suastes-Rivas et al, 2020)。本研究中蹄形藻JNU-3201在非最高生物量、非最高总脂含量的实验组, 获得最高总脂产量为(2.43±0.06) g/L, 上述结果表明不同藻株的总脂产量受到总脂含量和生物量影响的权重不同, 获得微藻最高总脂产量需要根据藻种特性, 选取适宜的诱导方式。
Hu等(2008)对近60年的能源藻株进行分析汇总, 报道绿藻平均总脂含量(干重)达到25%。许瑾等(2011)研究报道24株产油藻的总脂含量(干重)和总脂产量, 分别为15.57%~53.30%和0.57~2.36 g/L, 其中9株产油藻的总脂含量(干重)高于40%。蹄形藻JNU-3201的总脂含量(干重)最高可达46.92±1.52%, 总脂产量达到(2.43±0.06) g/L, 对比以往研究结果, 说明蹄形藻JNU-3201具有较好的油脂生产潜力, 可作为产油候选藻株。
3.4 蹄形藻JNU-3201脂肪酸变化特性及生物柴油性能评价脂肪酸按照饱和程度划分为饱和脂肪酸、单不饱和脂肪酸和多不饱和脂肪酸。Moser(2014)研究表明高比例的饱和脂肪酸与单不饱和脂肪酸, 是作为生物柴油原料的有利条件之一。蹄形藻JNU-3201饱和脂肪酸与单不饱和脂肪酸的总含量高达总脂肪酸的83.4%±0.4%, 具有作为生物柴油原材料的潜力。油酸(C18︰1)的氧化稳定性强于亚油酸(C18︰2)和亚麻酸(C18︰3)(罗晓岚等, 2010)。蹄形藻JNU-3201含量最高的脂肪酸是油酸, 可达到总脂肪酸的58.8%±1.2%, 低氮限制(3.6 mmol/L)促进油酸的积累, 表明氮限制可能有利于增强其油脂的氧化稳定性。本研究富氮组(36.0 mmol/L)的多不饱和脂肪酸含量比对照组(18.0 mmol/L)增加了15.9%。有研究表明细胞膜中不饱和脂肪酸比例提高, 有利于提高膜的流动性(Pancha et al, 2015), 这可能是蹄形藻JNU-3201耐受高氮胁迫的原因之一, 其耐受机制还需要从分子层面进一步研究。
生物柴油样品的质量参数可以反映生物柴油性能, 但其实验测定过程冗长且成本较高, 获取足够多的样本、详细分析等过程也可能存在各种阻碍(Talebi et al, 2013)。生物柴油的质量参数由原材料的脂肪酸组成所决定, 分析脂肪酸组成可以预测生物柴油性能。Talebi等(2014)基于前人报道的高可靠性建模数据, 开发出一个新型评价生物柴油样品质量参数的软件Biodiesel Analyzer, 以便于快速高效分析生物柴油的性能, 降低筛选生物柴油原材料的成本。本研究中蹄形藻JNU-3201的6项生物柴油参数均符合BD100 (S10)和EN14214标准, 初步表明蹄形藻JNU-3201可以作为生产生物柴油的原材料。
4 结论新分离的淡水藻株鉴定为蹄形藻(Kirchneriella sp.), 该藻主要储能物质为脂质。蹄形藻富含油酸(C18︰1)、棕榈酸(C16︰0)和亚油酸(C18︰2), 十六烷值、运动黏度、比重、密度、碘值等6项生物柴油质量参数均符合BD100(S10)和EN14214标准。该藻产油能力受氮素水平的影响较为显著, 在最低氮浓度条件下(3.6 mmol/L), 获得最高总脂含量(46.92%±1.52%, 干重), 在18.0 mmol/L条件下, 总脂产量最高达到(2.43±0.06) g/L。上述研究表明蹄形藻JNU-3201是一株具有开发潜力的优质产油藻株。
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会, 2017. B5柴油: GB 25199-2017[S]. 北京: 中国标准出版社.
|
石岩峻, 胡晗华, 马润宇, 等, 2004. 不同氮磷水平下微小原甲藻对营养盐的吸收及光合特性. 过程工程学报, 4(6): 554-560 |
许瑾, 张成武, 李爱芬, 等, 2011. 华南地区淡水产油微藻藻株的分离与筛选. 可再生能源, 29(1): 66-71 |
苏怡, 高保燕, 黄罗冬, 等, 2017. 不同氮源及氮浓度对真眼点藻纲微藻生长及油脂积累的影响. 水生生物学报, 41(3): 677-691 |
李涛, 2013. 产油微藻的筛选与评价、高产油策略及其差异性研究[D]. 广州: 暨南大学: 82.
|
李涛, 李爱芬, 桑敏, 等, 2011. 富油能源微藻的筛选及产油性能评价. 中国生物工程杂志, 31(4): 98-105 |
罗晓岚, 朱文鑫, 2010. 油茶籽油加工和油茶资源综合利用. 中国油脂, 35(9): 13-17 |
郑和龙, 2019. 不同氮素浓度对5株微藻生长及其生化组成特征的影响[D]. 广州: 暨南大学: 24-25, 15-16.
|
梁英, 纪维玮, 石伟杰, 等, 2020. 氮限制时间对海绿球藻和微绿球藻生长、总脂含量及脂肪酸组成的影响. 海洋科学, 44(2): 45-55 |
辜博, 费小雯, 胡新文, 等, 2011. 营养元素限制对微芒藻Y-002油脂积累的影响. 热带作物学报, 32(5): 789-795 DOI:10.3969/j.issn.1000-2561.2011.05.003. |
ADENAN N S, YUSOFF F M, MEDIPALLY S R, et al, 2016. Enhancement of lipid production in two marine microalgae under different levels of nitrogen and phosphorus deficiency. Journal of Environmental Biology, 37(Special issue): 669-676 |
ANDERSEN R A, 2005. Algal Culturing Techniques. Burlington: Elsevier, 435-436
|
BREUER G, LAMERS P P, MARTENS D E, et al, 2012. The impact of nitrogen starvation on the dynamics of triacylglycerol accumulation in nine microalgae strains. Bioresource Technology, 124: 217-226 DOI:10.1016/j.biortech.2012.08.003 |
CHEN Z R, LEI X Q, ZHANG B Z, et al, 2014. First report of Pseudobodo sp, a new pathogen for a potential energy-producing algae: Chlorella vulgaris cultures. PLoS One, 9(3): e89571 DOI:10.1371/journal.pone.0089571 |
CHISTI Y, 2007. Biodiesel from microalgae. Biotechnology Advances, 25(3): 294-306 DOI:10.1016/j.biotechadv.2007.02.001 |
DELGADO R T, DOS SANTOS GUARIEIRO M, ANTUNES P W, et al, 2021. Effect of nitrogen limitation on growth, biochemical composition, and cell ultrastructure of the microalga Picocystis salinarum. Journal of Applied Phycology, 33(4): 2083-2092 DOI:10.1007/s10811-021-02462-8 |
DEXTRO R B, 2021. Growth dynamic on a co-cultivation of two Chlorophyta microalgae exposed to copper. Acta Limnologica Brasiliensia, 33: e16 DOI:10.1590/s2179-975x0420 |
DUBOIS M, GILLES K A, HAMILTON J K, et al, 1956. Colorimetric method for determination of sugars and related substances. Analytical Chemistry, 28(3): 350-356 DOI:10.1021/ac60111a017 |
European Committee for Standardization, 2008. Automotive fuels-Fatty acid methyl esters (FAME) for diesel engines-Requirements and test methods: SS-EN 14214: 2008 [S]. Brussels.
|
FENG P Z, DENG Z Y, FAN L, et al, 2012. Lipid accumulation and growth characteristics of Chlorella zofingiensis under different nitrate and phosphate concentrations. Journal of Bioscience and Bioengineering, 114(4): 405-410 DOI:10.1016/j.jbiosc.2012.05.007 |
FENG Y J, XIAO J M, CUI N, et al, 2021. Enhancement of lipid productivity and self-flocculation by cocultivating Monoraphidium sp. FXY-10 and Heveochlorella sp. Yu under mixotrophic mode. Applied Biochemistry and Biotechnology, 193(10): 3173-3186 DOI:10.1007/s12010-021-03593-x |
HU Q, SOMMERFELD M, JARVIS E, et al, 2008. Microalgal triacylglycerols as feedstocks for biofuel production: perspectives and advances. The Plant Journal, 54(4): 621-639 DOI:10.1111/j.1365-313X.2008.03492.x |
HUSSIAN A E M, EL-MONEM A M A, NAPIÓRKOWSKA-KRZEBIETKE A, et al, 2018. Short-term changes in phytoplankton assemblages and their potential for heavy metal bioaccumulation - a laboratory study. Oceanological and Hydrobiological Studies, 47(3): 260-274 DOI:10.1515/ohs-2018-0025 |
KHOZIN-GOLDBERG I, SHRESTHA P, COHEN Z, 2005. Mobilization of arachidonyl moieties from triacylglycerols into chloroplastic lipids following recovery from nitrogen starvation of the microalga Parietochloris incisa. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 1738(1/2/3): 63-71 |
KLUGHAMMER C, SCHREIBER U, 2008. Complementary PS Ⅱ quantum yields calculated from simple fluorescence parameters measured by PAM fluorometry and the saturation pulse method. PAM Application Notes, 1: 27-35 |
KNOTHE G, 2006. Analyzing biodiesel: standards and other methods. Journal of the American Oil Chemists' Society, 83(10): 823-833 DOI:10.1007/s11746-006-5033-y |
LARDIZABAL K, EFFERTZ R, LEVERING C, et al, 2008. Expression of umbelopsis ramanniana DGAT2A in seed increases oil in soybean. Plant Physiology, 148(1): 89-96 DOI:10.1104/pp.108.123042 |
LIU W H, HUANG Z W, LI P, et al, 2012. Formation of triacylglycerol in Nitzschia closterium f. minutissima under nitrogen limitation and possible physiological and biochemical mechanisms. Journal of Experimental Marine Biology and Ecology, 418/419: 24-29 DOI:10.1016/j.jembe.2012.03.005 |
LOWRY O H, ROSEBROUGH N J, FARR A L, et al, 1951. Protein measurement with the Folin phenol reagent. The Journal of Biological Chemistry, 193(1): 265-275 |
MOSER B R, 2014. Impact of fatty ester composition on low temperature properties of biodiesel-petroleum diesel blends. Fuel, 115: 500-506 |
NAJAFABADI H A, MALEKZADEH M, JALILIAN F, et al, 2015. Effect of various carbon sources on biomass and lipid production of Chlorella vulgaris during nutrient sufficient and nitrogen starvation conditions. Bioresource Technology, 180: 311-317 |
PANCHA I, CHOKSHI K, MAURYA R, et al, 2015. Salinity induced oxidative stress enhanced biofuel production potential of microalgae Scenedesmus sp. CCNM 1077. Bioresource Technology, 189: 341-348 |
RAMÍREZ-VERDUZCO L F, RODRÍGUEZ-RODRÍGUEZ J E, DEL RAYOJARAMILLO-JACOB A, 2012. Predicting cetane number, kinematic viscosity, density and higher heating value of biodiesel from its fatty acid methyl ester composition. Fuel, 91(1): 102-111 |
RODOLFI L, ZITTELLI G C, BASSI N, et al, 2009. Microalgae for oil: strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor. Biotechnology and Bioengineering, 102(1): 100-112 |
SHEN X F, LIU J J, CHAUHAN A S, et al, 2016. Combining nitrogen starvation with sufficient phosphorus supply for enhanced biodiesel productivity of Chlorella vulgaris fed on acetate. Algal Research, 17: 261-267 |
SUASTES-RIVAS J K, HERNÁNDEZ-ALTAMIRANO R, MENA-CERVANTES V Y, et al, 2020. Biodiesel production, through intensification and profitable distribution of fatty acid methyl esters by a microalgae-yeast co-culture, isolated from wastewater as a function of the nutrients' composition of the culture media. Fuel, 280: 118633 |
TALEBI A F, MOHTASHAMI S K, TABATABAEI M, et al, 2013. Fatty acids profiling: a selective criterion for screening microalgae strains for biodiesel production. Algal Research, 2(3): 258-267 |
TALEBI A F, TABATABAEI M, CHISTI Y, 2014. Biodiesel analyzer: a user-friendly software for predicting the properties of prospective biodiesel. Biofuel Research Journal, 2: 55-57 |
TAYLOR D C, KATAVIC V, ZOU J T, et al, 2002. Field testing of transgenic rapeseed cv. Hero transformed with a yeast sn-2 acyltransferase results in increased oil content, erucic acid content and seed yield. Molecular Breeding, 8(4): 317-322 |
WU H Q, MIAO X L, 2014. Biodiesel quality and biochemical changes of microalgae Chlorella pyrenoidosa and Scenedesmus obliquus in response to nitrate levels. Bioresource Technology, 170: 421-427 |
YAAKOB M A, MOHAMED R M S R, AL-GHEETHI A, et al, 2021. Influence of nitrogen and phosphorus on microalgal growth, biomass, lipid, and fatty acid production: an overview. Cells, 10(2): 393 |
ZHANG J J, WAN L L, XIA S, et al, 2013. Morphological and spectrometric analyses of lipids accumulation in a novel oleaginous microalga, Eustigmatos cf. polyphem (Eustigmatophyceae). Bioprocess and Biosystems Engineering, 36(8): 1125-1130 |
ZHENG P Z, ALLEN W B, ROESLER K, et al, 2008. A phenylalanine in DGAT is a key determinant of oil content and composition in maize. Nature Genetics, 40(3): 367-372 |
ZHU S N, HUANG W, XU J, et al, 2014. Metabolic changes of starch and lipid triggered by nitrogen starvation in the microalga Chlorella zofingiensis. Bioresource Technology, 152: 292-298 |
 2023, Vol. 54
2023, Vol. 54



