中国海洋湖沼学会主办。
文章信息
- 闫舒恒, 王旭雷, 王立军, 顾文辉, 解修俊, 高山, 羌玺, 卓锦涛, 郭梦林, 刘雪华, 王宗灵, 王广策. 2023.
- YAN Shu-Heng, WANG Xu-Lei, WANG Li-Jun, GU Wen-Hui, XIE Xiu-Jun, GAO Shan, QIANG Xi, ZHUO Jin-Tao, GUO Meng-Lin, LIU Xue-Hua, WANG Zong-Ling, WANG Guang-Ce. 2023.
- 细弱红翎菜(Solieria tenuis)的物种鉴定及其在青岛市琅琊台湾海域的生长调查研究
- A SOLIERIA TENUIS BLOOM IN LANGYATAI BAY, QINGDAO: SPECIES IDENTIFICATION AND GROWTH INVESTIGATION
- 海洋与湖沼, 54(1): 149-159
- Oceanologia et Limnologia Sinica, 54(1): 149-159.
- http://dx.doi.org/10.11693/hyhz20220400107
文章历史
-
收稿日期:2022-04-02
收修改稿日期:2022-06-12
2. 青岛海洋科学与技术试点国家实验室 海洋生物学与生物技术功能实验室 山东青岛 266200;
3. 中国科学院海洋大科学研究中心 山东青岛 266071;
4. 中国科学院大学地球与行星科学学院 北京 100049;
5. 中国海洋大学海洋生命学院 山东青岛 266071;
6. 自然资源部第一海洋研究所海洋生态研究中心 山东青岛 266100
2. Marine Biology and Biotechnology Laboratory, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266200, China;
3. Center for ocean Mega-Science, Chinese academy of sciences, Qingdao 266071, China;
4. College of Earth and Planetary Sciences, University of Chinese Academy of Science, Beijing 100049, China;
5. College of Marine Life Sciences, Ocean University of China, Qingdao 266071, China;
6. Marine Ecology Research Center, First Institute of Oceanography, MNR, Qingdao 266100, China
细弱红翎菜(Solieria tenuis J.Zhang & E.Xia)是一种海产大型底栖红藻, 隶属于红藻门(Rhodophyta)真红藻纲(Florideophyceae)杉藻目(Gigartinales)红翎菜科(Solieriaceae)红翎菜属(Solieria J.Agardh)(夏邦美等, 1999)。红翎菜科有18属94种, 其中麒麟菜属(Eucheuma J.Agardh)、鸡冠菜属(Meristotheca J.Agardh)、Sarcodiotheca Kylin和红翎菜属的物种数不少于10种(Guiry et al, 2022)。红翎菜科中很多类群是重要的经济藻种, 例如, 卡帕藻属(Kappaphycus Doty)的长心卡帕藻K. alvarezii (Doty) L.M.Liao和麒麟菜属的麒麟菜E. denticulatum (N.L.Burman) Collins & Hervey生产的卡拉胶占据了90%以上的全球市场份额(Porse et al, 2017)。红翎菜属的一些物种也是富含卡拉胶的经济海藻资源(Stephanie et al, 2010)。红翎菜属的主要鉴定特征包括: (1) 藻体圆柱形或扁压, 分枝基部多缢缩; (2) 藻体内部构造为多轴型, 髓部由疏松的丝状细胞构成; (3) 四分孢子囊为目字形分裂; (4) 囊果内部有一大的融合胞(Min-Thein et al, 1976)。根据以上特征, 全球范围内共描述了10个红翎菜属物种, 该属各种间在藻体大小、枝径、枝型、固着器类型、皮层细胞大小、髓丝排列等特征上存在差异(Núñez Resendiz et al, 2018)。
红翎菜S. mollis (Harvey) Kylin最早由棒藻属(Rhabdonia Hooker f. & Harvey)物种修订而来, 其模式标本产地为澳大利亚(Kylin, 1932)。以后, 有报道称该物种也分布在亚洲海域(曾呈奎等, 1962; Lee et al, 1986), 其中文名“红翎菜”源于山东省青岛市胶南等地的地方俗称(曾呈奎等, 1962)。Kraft等(1983)通过研究, 发现产于澳大利亚的红翎菜(S. mollis)为单轴型结构, 因此将该物种转移至Antrocentrum Kraft & Min-Thein属, 后又被修订为A. molle (Harvey) Kraft & G.W.Saunders(Kraft et al, 2021)。然而, Xia等(1984)通过详细的形态学研究发现我国报道的红翎菜(S. mollis)与澳大利亚产的“红翎菜(S. mollis)”并非同一物种。我国产的“红翎菜(S. mollis)”符合红翎菜属的主要鉴定特征, 并由此描述为一新种: 细弱红翎菜S. tenuis J.Zhang & E.Xia, 模式标本产地为山东省青岛市(Xia et al, 1984)。该种为潮间带底栖类群, 主要生长在中潮带有泥沙覆盖的岩石上或石沼中, 在我国辽宁省、河北省、山东省、浙江省、福建省、广东省和广西壮族自治区均有分布(夏邦美等, 1999)。此外, 该种在日本(吉田忠生, 1998)、毛里求斯(Silva et al, 1996)、韩国(Lee et al, 2001)和伊朗(Kokabi et al, 2015)等海域也有报道。然而, 该物种缺少可靠的分子标记序列信息, 相关研究只能基于其形态学特征展开讨论(Núñez Resendiz et al, 2018)。
细弱红翎菜在我国主要分布于黄渤海沿岸, 为当地习见种(曾呈奎等, 1962)。琅琊台湾位于山东半岛西南海岸, 青岛市西海岸新区西南部, 面积26 km2, 与黄海相接; 陈家贡湾是琅琊台湾西北部的内湾, 泥质滩岸, 湾顶修有贡口拦海坝, 坝内为大规模水产养殖区。2021年7月末, 贡口拦海坝处出现大量悬浮生长的大型红藻(图 1a, 1b), 通过实地调研和室内分析, 本研究鉴定该红藻为细弱红翎菜, 并对其生长和分布特征展开了讨论。
 |
| 图 1 贡口拦海坝近海侧出现大量悬浮生长的某种大型红藻 Fig. 1 The large population of suspending red algae along the Gongkou Dam 注: a. 当地民众采集食用该种海藻; b. 大量红藻沿坝基堆积形成宽约20~30 m的藻带 |
2021年8~10月期间在山东省青岛市西海岸新区琅琊台湾贡口拦海坝(GKB)和湾内养殖筏架区(FJ), 以及其周边区域(董家口港码头(DJK)、撒牛沟村(SNG)、琅琊港码头(LYG)、古镇营村(GZY))开展了调查与采样工作(图 2); 并结合近年来在青岛海域调查采集的细弱红翎菜样本一并进行分析(附表1)。
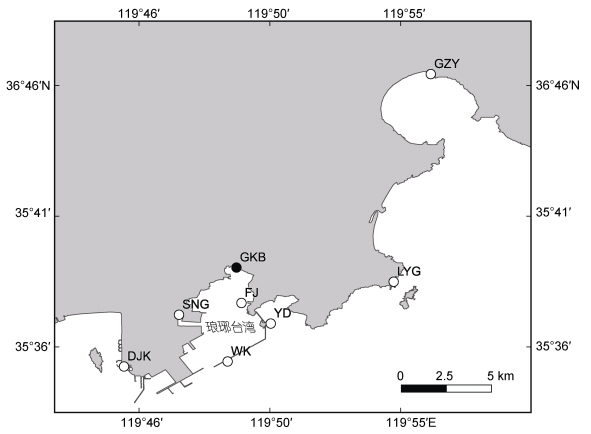 |
| 图 2 调查位点示意图 Fig. 2 Distribution of investigation sites GKB: 贡口拦海坝; DJK: 董家口港区堤坝; SNG: 撒牛沟村; WK: 琅琊台湾湾口; FJ: 陈家贡湾海上养殖筏架区; YD: 琅琊台湾鸭岛; LYG: 琅琊港码头; GZY: 古镇营村; 实心圆点为本研究中大量悬浮红藻群体的出现位点, 空心圆点示其他调查位点 |
潮间带海域在退潮时开展样本采集工作, 海上养殖筏架区雇佣小型渔船前往采集。使用50 cm×50 cm样方框, 沿拦海坝随机多点取样, 采集样方框内所有细弱红翎菜样本。
1.1.3 环境信息采集记录采集红藻样本的生境并拍照, 在各调查点采集水样。使用大疆无人机(DJI Mavic 2 Pro)与水下无人机(潜蛟MINI)记录调查点水面及水下环境、藻体的分布情况。
1.2 室内样本处理红藻样本清水冲洗干净, 优先选择藻体完整且具成熟囊果的个体制作腊叶标本并编号, 选取一些样品作为冰冻切片和DNA提取的材料。样方取样的样品烘箱60 ℃烘干至恒重, 并称重记录。
水样在采集后迅速抽滤冻存, 送至中国科学院海洋研究所分析测试中心测定硝酸盐、亚硝酸盐、铵盐、活性磷酸盐和活性硅酸盐含量。使用SPSS软件处理数据, 参照《海水水质标准(GB 3097-1997)》对主要水环境要素进行评价。
1.3 物种鉴定 1.3.1 形态学研究取洁净样本于解剖镜(尼康, SMZ1500, 日本)下观察藻体外部形态并拍照。用刀片切取藻体主轴中段、囊果等部位, 使用包埋剂(樱花, 日本)包埋后, 液氮速冻定型, 使用冰冻切片机(Thermo Fisher, CryoStar NX50, 美国)制备冰冻切片。在倒置显微镜(Nikon, Eclipse Ti, 日本) 下观察并拍摄内部解剖结构。
1.3.2 分子标记的获取与系统发育分析每号样本取约10mg材料研磨, 使用商品化DNA提取试剂盒E.Z.N.A. Plant DNA Kit (Omega, 美国)提取DNA。
以提取DNA为模板, 使用热循环仪(TaKaRa Bio Inc., TP600, 日本), 选择分子标记rbcL基因(编码1, 5-二磷酸核酮糖羧化酶/加氧酶大亚基)和coxI基因(编码细胞色素C氧化酶亚基Ⅰ)进行PCR (聚合酶链式反应)扩增。所用引物组合见表 1。设定PCR程序: 94 ℃ 5 min; 94 ℃ 1 min、45 ℃ 1 min、72 ℃ 1 min 38个循环; 72 ℃ 5 min (Núñez Resendiz et al, 2018)。PCR产物送至生工生物工程(上海)股份有限公司进行DNA测序, 所得序列用于后续的分子系统发育分析, 其中两段rbcL序列在分析前使用SnapGene v4.3.6进行拼接处理。
| 分子标记 | 引物组合 | 引物序列 | 参考文献 | |
| rbcL | F7/R753 | F7 | 5′-AACTCTGTAGAACGNACAAG-3′ | Gavio et al, 2002; Freshwater et al, 1994; Lin et al, 2001 |
| R753 | 5′-GCTCTTTCATACATATCTTCC-3′ | |||
| F645/RrbcS Start | F645 | 5′-ATGCGTTGGAAAGAAAGATTCT-3′ | ||
| RrbcS Start | 5′-TGTGTTGCGGCCGCCCTTGTGTTAGTCTCAC-3′ | |||
| coxI | COXI43F/COXI1549R | COXI43F | 5′-TCAACAAATCATAAAGATATTGGWACT-3′ | Geraldino et al, 2006 |
| COXI1549R | 5′-AGGCATTTCTTCAAANGTATGATA-3′ | |||
从NCBI(美国国立生物技术信息中心)数据库下载所需参考序列(附表2), 分别与拼接后的rbcL基因序列和coxI基因序列一同进行系统发育分析: 使用MEGA X的ClustalW算法进行多序列联配(Thompson et al, 1994; Kumar et al, 2018), 根据密码子顺序使用PartitionFinder v2.0 (Guindon et al, 2010; Lanfear et al, 2017)分隔序列, 根据密码子位点分别计算最优进化模型; 使用RaxML v8.0.0 (Stamatakis, 2014)构建最大似然树, 2个基因均选用GTR+I+G进化模型, 非参数bootstrap方法设定1 000次重复; MrBayes v3.01 (Ronquist et al, 2003)构建贝叶斯树, rbcL序列密码子前2位选择GTR+I+G模型, 第3位选择GTR+G模型, coxI序列密码子第1、3位选择GTR+G模型, 第2位选择GTR+I+G模型; 设定运行代数1 000 000代, 抽样频率1 000代, 丢弃前25%的树, 计算剩余树中50%的多数一致树; 序列间的遗传距离在MEGA X中使用Kimura two-parameter模型计算。
2 结果与分析 2.1 物种鉴定 2.1.1 形态学鉴定按生长方式, 本研究调查采集的样本包括悬浮和定生两种类型(图 3a, 3b)。贡口拦海坝处样本均悬浮, 藻体紫红色, 圆柱形, 高度约5~20 cm, 主轴宽1~2 mm, 质软多肉, 分枝不规则互生, 基部强烈缢缩, 顶端尖细, 可达四回分枝, 无固着器。藻体内部构造由皮层和髓层组成, 最内层的髓部为疏松散乱排列的丝状细胞, 丝径7~10 μm; 内皮层细胞较大, (127~179)×(96~141) μm, 近圆形, 2~3层; 外皮层细胞较小, (10~12)×(6~8) μm, 含色素体, 1~2层(图 3c)。定生样本外部形态和内部结构与悬浮样本基本一致, 但基部具盘状固着器和支持枝, 支持枝顶端或近顶端又可着生盘状固着器(图 3d); 一些定生样本具有囊果, 散生于藻体分枝上, 埋卧于内皮层, 半球形, 略微隆起于藻体表面, 直径659~797 μm。横切面观, 成熟囊果中央具有一个大的融合胞, 融合胞向各个方向生出产孢丝, 产孢丝顶端形成果孢子囊, 果孢子囊外围有不育丝组成囊果被(图 3e, 3f)。
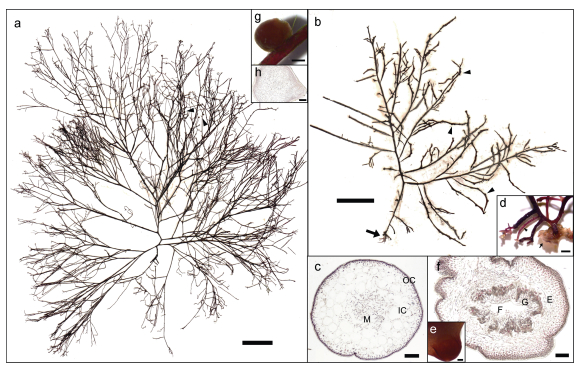 |
| 图 3 细弱红翎菜形态特征与解剖结构 Fig. 3 Morphological characteristics and anatomical structures of S. tenuis 注: a. 贡口拦海坝处悬浮生长细弱红翎菜样本外部形态(腊叶标本), 箭头示着生寄生藻, 比例尺=2 cm, 标本号QD365; b. 定生细弱红翎菜样本外部形态(腊叶标本), 箭头示着生囊果、箭形示基部固着器及支持枝, 比例尺=2 cm, 标本号QD388; c. 藻体主轴横切面观, M: 髓部、IC: 内皮层、OC: 外皮层, 比例尺=200 μm, 标本号QD358; d. 定生细弱红翎菜固着器系统, 箭形示盘状固着器、箭头示支持枝, 比例尺=200 μm, 标本号QD388; e. 细弱红翎菜囊果表面观, 比例尺=200 μm, 标本号QD388; f. 细弱红翎菜囊果横切面观, F: 融合胞、G: 产孢丝, 顶端生有果孢子、E: 果被, 比例尺=100 μm, 标本号QD388; g. 细弱红翎菜着生寄生藻外观形态, 比例尺=500 μm, 标本号QD379; h. 细弱红翎菜寄生藻切面观, 比例尺=200 μm, 标本号QD358 |
通过研究藻体的外部形态、内部构造和繁殖器官等特征, 结合细弱红翎菜模式标本比较分析, 本研究所采集的样本符合细弱红翎菜的鉴定特征。
此外, 在本次调查中还发现少量细弱红翎菜藻株分枝上生有圆球体, 经切面观察, 该球状体内部构造包括丝状细胞组成的髓部和3~5层含有色素体的外皮层(图 3g, 3h), 其特征和其寄主细弱红翎菜基本一致, 因此可初步确认这一圆球体为一种近源寄生藻。该寄生藻藻体外部具有较厚的胶质层, 通过外皮层与宿主相融合。
2.1.2 分子系统发育分析本研究扩增了17号样本16条rbcL基因序列, 并结合13条NCBI下载的相关序列进行分析。联配后, 构建了序列长度为1 386个碱基(nt)的数据集, 保守位点1 100 nt, 最大简约位点150 nt。基于该数据集分别构建了最大似然树和贝叶斯树, 获得了相同的拓扑结构(图 4)。红翎菜科的其他属种, 包括麒麟菜属、琼枝藻属(Betaphycus Doty)和卡帕藻属构成外群。细弱红翎菜与产于法国和新西兰的2个红翎菜属未知物种(Solieria sp.)聚为一枝(支持度100%), 其遗传距离小于0.22%, 并和产于印度的串珠红翎菜(新拟名) S. jaasundii Mshigeni & Papenfuss、产于法国的属模式种索状红翎菜(新拟名) S. chordalis (C.Agardh) J.Agardh、产于委内瑞拉的弯顶红翎菜(新拟名) S. incurvata Núñez Resendiz, Dreckmann, Ardito, León-Tejera & Sentíes和产于美国的丝状红翎菜(新拟名) S. filiformis (Kützing) Gabrielson组成第一类群; 产于澳大利亚的网结红翎菜(新拟名) S. anastomosa P.W.Gabrielson & Kraft和粗壮红翎菜S. robusta (Greville) Kylin、产于日本的太平洋红翎菜S. pacifica (Yamada) Yoshida以及产于印度的硬红翎菜(新拟名) S. dura (Zanardini) F.Schmitz组成红翎菜属的第二类群。在第一类群中, 与细弱红翎菜亲缘关系最近的物种为串珠红翎菜, 二者遗传距离范围为3.36%~3.53%。本研究也基于coxI进行了系统发育分析, 成功扩增了细弱红翎菜11条序列, 结合8条已公开相关序列, 构建了系统发育进化树。同rbcL基因系统发育树类似, coxI基因系统发育树结果同样表明本研究样本隶属于红翎菜属(附图1)。结合形态学鉴定和分子系统发育分析两方面的研究结果, 产于法国和新西兰的2个红翎菜属未知物种也应该鉴定为细弱红翎菜。
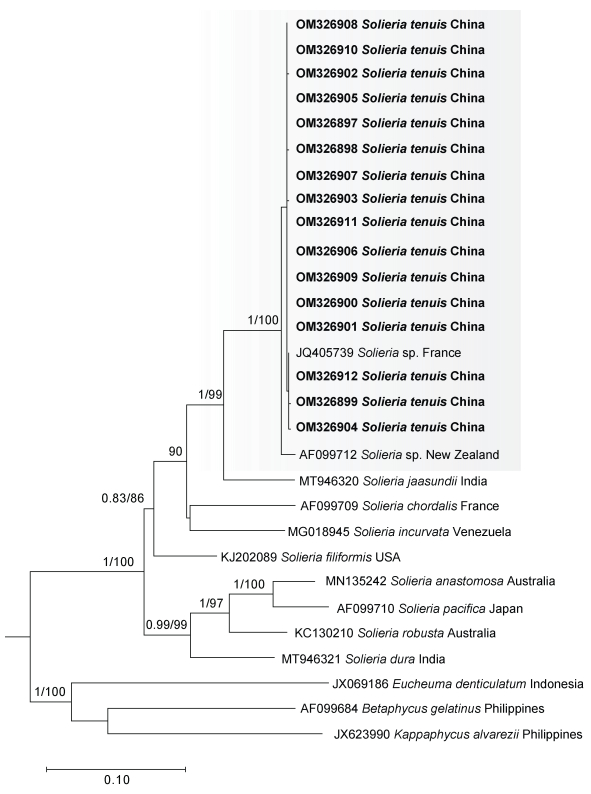 |
| 图 4 基于rbcL基因构建的最大似然树 Fig. 4 ML (Maximum Likelihood) tree based on rbcL gene 注: 系统发育分析共用29条序列, 粗体为本研究新扩增序列, 仅显示贝叶斯分析后验概率≥0.80/最大似然分析Bootstrap值≥80的节点数值; 灰色底框示本研究获取序列与外部序列聚合而成的单系进化枝 |
2021年7月下旬至8月初, 大量细弱红翎菜悬浮生长于贡口拦海坝南侧部分坡面和滩涂上, 形成宽约20~30 m的堆积带。根据水下无人机拍摄结果以及退大潮后的观察, 该处海域主要为泥砂底质, 仅近堤坝处有一些乱石块。坝的东西两端藻体堆积面积扩大, 而坝中部的闸门两侧有200余米无藻体分布, 总覆盖面积约为37 370 m2; 藻体鲜干比8.99, 单位生物量(干重)为(159.93±46.09) g/m2, 总生物量约为6 t(干重)。此处细弱红翎菜于2021年7月末形成规模, 不排除5月或6月就已经大量增殖。8~9月期间堆积藻体逐渐减少, 至2021年10月基本完全消失。
琅琊台湾营养盐测定结果显示, 位于湾顶的贡口拦海坝两侧氮磷硅水平均较高, 临海的南侧为细弱红翎菜出现区域。湾内其他位点氮磷水平均符合国标Ⅰ类水质标准; 湾内整体水质状况较好, 但氮磷比偏高, 各位点均超出Redfield比值(附图2)。
2.3 细弱红翎菜分布与习性调查除贡口拦海坝外, 通过调查我们还发现了5处细弱红翎菜的分布点, 包括同位于琅琊台湾湾内的海上养殖筏架区、撒牛沟村滩涂; 邻近湾口的董家口港区堤坝; 及湾外的琅琊港码头和距离较远(约15.60 km)的古镇营村滩涂。
不同点的细弱红翎菜群体存在一定差异(表 2)。5处分布点的藻体均定生, 除养殖筏架区的藻体生长于养殖浮绳上外, 其他样本生长于有泥沙覆盖的岩石上; 拦海坝处藻体最大, 但没有固着器和繁殖结构; 分布在湾外的琅琊港码头和古镇营村的类群中有成熟的雌配子体; 此外, 悬浮群体中存在一些携带寄生藻的个体, 这一现象同样发现于撒牛沟村样本中。然而, 各个分布点的细弱红翎菜数量都显著低于贡口拦海坝处悬浮红翎菜的生物量, 未发现定生的大规模细弱红翎菜藻场。
| 分布点 | 习性 | 藻体高度/cm | 藻体特征 | 生物量* |
| 贡口拦海坝(GKB) | 悬浮生长 | 20.10±3.99 | 营养株, 有寄生藻 | +++ |
| 海上养殖筏架区(FJ) | 定生于水下养殖浮绳上 | 13.37±2.28 | 营养株 | ++ |
| 撒牛沟村(SNG) | 定生在潮间带中下部泥沙覆盖的岩石上 | 7.11±1.68 | 营养株, 有寄生藻 | + |
| 董家口港区(DJK) | 定生在潮间带中上部泥沙覆盖的岩石上 | 4.38±1.32 | 营养株 | + |
| 琅琊港码头(LYG) | 定生在潮间带有沙覆盖的石头上 | 12.93±2.12 | 营养株, 成熟雌配子体 | + |
| 古镇营村(GZY) | 定生在潮间带中下部泥沙覆盖的岩石上 | 9.45±3.61 | 营养株, 成熟雌配子体 | + |
| 注: *: 生物量数据均为干重; +++: 生物量≥100 g/m2; ++: 100 > 生物量≥10 g/m2; +: 生物量 < 10 g/m2 | ||||
2021年7月底至10月初, 青岛市西海岸新区琅琊台湾海域出现大规模悬浮红藻, 本研究通过实地调研, 结合形态学和系统发育分析鉴定该物种为细弱红翎菜。
细弱红翎菜形态鉴定特征包括: 藻体基部具有盘状固着器及支持枝, 分枝基部明显缢缩、顶端逐渐尖细; 髓部由疏松排列的丝体组成, 内皮层较大而外皮层细胞较小; 以及半球形的囊果等(Xia et al, 1984; 夏邦美等, 1999)。本研究样品无论在外观形态、内部构造还是在囊果特征方面均与其相吻合。我们也首次在细弱红翎菜藻体上发现圆球形的寄生藻, 这一现象类似于江蓠属(Gracilaria Greville)个体表面寄生的蓠生藻(Gracilariophila Setchell & H.L.Wilson)(张峻甫等, 1978), 属于近源寄生藻。
全球累计报道红翎菜属物种有16个, 其中现阶段承认的物种只有10个(Guiry et al, 2022), 其中细弱红翎菜和叉枝红翎菜(新拟名)S. dichotoma Yoshida缺乏常用分子标记序列数据, 而本研究为前者首次提供了明确的分子信息。基于rbcL和coxI基因的系统发育分析, 细弱红翎菜与红翎菜属其他8个物种遗传距离较大(rbcL > 3%, coxI > 4%), 形成了不同的进化枝, 从分子层面验证了细弱红翎菜的系统地位。与细弱红翎菜亲缘关系最近的物种为串珠状红翎菜, 该种沿轴规律缢缩, 外形呈串珠状(Mshigeni et al, 1981), 易于区分; 而产于日本的叉枝红翎菜藻体扁压, 具有典型的二叉状分枝及边缘小枝(吉田忠生, 1998), 在外观形态上与细弱红翎菜差异明显; 其他红翎菜物种也与我们的样本存在可区分的形态特征差异(表 3)。Fredericq等(1999)和Mineur等(2012)分别记录了产于新西兰和法国的未知红翎菜物种, 我们的系统发育分析结果证实这两个物种实际上为细弱红翎菜。因此, 该物种的全球分布范围从西北太平洋拓展至南太平洋和东大西洋海域, 也暗示了该物种在全球温带亚热带海域广泛分布的可能性。值得注意的是, 有研究称产于法国的细弱红翎菜并不是本土物种, 但该类群早在2005年便已出现, 且已在一些地区形成相当大的生物量(Mineur et al, 2012), 表明该物种具有较强的适应性和扩散能力。
| 物种名称* | 藻体大小 | 主轴特征 | 枝顶端形态 | 分枝类型 | 固着器类型 |
| Solieria tenuis | 藻体直立, 高至20 cm | 圆柱形, 宽1~2 mm | 渐尖 | 不规则互生分枝, 可达四回; 基部强烈缢缩 | 盘状固着器与支持枝组成的固着系统 |
| Solieria jaasundii[1] | 藻体直立, 高10~15 cm | 圆柱形, 轴规律缢缩呈串珠状 | 钝圆 | 分枝多生于主轴缢缩处, 串珠状规律缢缩 | — |
| Solieria chordalis[2] | 藻体直立 | 圆柱形, 宽至1 mm | 锐尖 | 二叉状分枝; 远端多不定小枝; 基部不缢缩 | 支持枝组成的固着系统 |
| Solieria incurvata[3] | 藻体直立, 高10~13 cm | 圆柱形, 宽0.8~1.4 mm | 锐尖, 多弯曲 | 分枝对生或互生; 基部逐渐缢缩; 主轴远端发出的分枝多于近基部 | 单个盘状固着器 |
| Solieria filiformis[4] | 藻体直立, 高5~24 cm | 圆柱形, 宽0.5~2 mm | 锐尖 | 近基部二叉状分枝, 远端互生或侧生 | 支持枝组成的固着系统 |
| Solieria anastomosa[5] | 藻体匍匐, 高至7 cm | 扁压, 宽约5 mm | 锐尖 | 相邻分枝偶见融合现象 | 仅固着器, 无支持枝 |
| Solieria pacifica[6] | 藻体直立, 高至40 cm | 扁压至扁平, 宽至15 mm | 锐尖 | 2~3回互生分枝; 基部缢缩 | 单个盘状或不规则盾状固着器 |
| Solieria robusta[7] | 藻体直立, 高至30 cm | 圆柱形或略微扁压, 宽1~5 mm | 渐尖 | 不规则分枝; 基部通常缢缩 | 支持枝组成的固着系统 |
| Solieria dura[8] | 藻体直立, 高至45 cm | 扁压 | 锐尖 | 数回不规则分枝; 基部强烈缢缩 | 单个盘状固着器 |
| Solieria dichotoma[9] | 藻体直立, 高20~30 cm | 扁压至扁平, 宽15~25 mm | 渐尖 | 数回不规则二叉状分枝; 边缘有不定小枝 | 多个盘状固着器 |
| 注: 各物种基于rbcL系统发育树(图 4)中亲缘关系的远近排列, “—“代表无信息。参考文献: [1] Mshigeni et al, 1981; [2] Agardh, 1842; [3] Núñez-Resendiz et al, 2018; [4] Littler et al, 2000; [5] Gabrielson et al, 1984; [6] Yoshida, 1989; [7] Minthein et al, 1976; [8] Zanardini, 1858; [9] 吉田忠生, 1998 | |||||
大型红藻是近海底栖群落的重要成员, 然而一些物种也可以脱离着生基质自由生活, 这一现象在红翎菜科中较为常见(Núñez Resendiz et al, 2019), 同属的丝状红翎菜、索状红翎菜都有悬浮群体的记录(Farnham, 1980; Perrone et al, 1994)。一般认为, 泥沙等软性底质会影响孢子的附着, 从而使藻类倾向于选择无性繁殖策略, 导致悬浮生活的生态型群体的产生(Kain et al, 1995; Guillemin et al, 2008)。Norton等(1983)对营悬浮生活的大藻形态进行了总结, 认为无固着器结构和营无性繁殖是其最显著的特征。Perrone等(1994)详细描述了意大利马雷皮科诺(Mare Piccolo)海湾悬浮丝状红翎菜群体的生长情况, 在软泥底质上, 悬浮的丝状红翎菜和Agardhiella subulata (C.Agardh) Kraft & M.J.Wynne可形成厚达3~5 m的海藻床; 丝状红翎菜个体无固着器, 但在出现硬质基质时个别藻体可以二次定生, 形成小规模的定生群体; 在连续5年的逐月观察中未发现成熟的配子体个体、营无性繁殖。这些现象和我们的实地调查记录较为类似: 细弱红翎菜个体悬浮于泥沙底质的陈家贡湾底, 形成大规模生物量, 无固着器和成熟繁殖结构; 在琅琊台湾的调查中, 也发现了若干疑似二次定生的小规模群体。因此我们认为, 贡口拦海坝处的大规模细弱红翎菜群体是营悬浮生活的特殊生态型, 这也是本物种悬浮类群的首次记录。
无性繁殖的悬浮红藻群体可以形成可观的规模, 如亚太冷水沿岸, 悬浮伊谷草Ahnfeltia tobuchiensis (Kanno & Matsubara) Makienko主导的伊谷草床厚度可达到0.15~1 m (Skriptsova et al, 2016); 波罗的海悬浮蠕虫叉红藻Furcellaria lumbricalis (Hudson) J.V.Lamouroux年产量在10万t以上(Weinberger et al, 2020); 智利沿海的智利江蓠G. chilensis C.J.Bird, McLachlan et E.C.Oliveira悬浮藻体资源被持续开采约20年, 这一特性也被应用于养殖生产中(Guillemin et al, 2008)。这样的悬浮红藻床多位于水流扰动较少的环境, 可以稳定存在数十年甚至上百年。悬浮红藻群体同样也可以随水流运动而漂流, 并不断扩大生物量的规模(Núñez Resendiz et al, 2019)。在本研究中, 贡口拦海坝处的大规模细弱红翎菜群体与稳定的悬浮红藻藻床不同, 仅存在了三个月的时间, 便基本消失。据此我们推测, 此处的悬浮群体来源于别处, 而可能存在一个悬浮或定生的源头藻场, 在某种外部扰动下, 部分藻体随水流运动至贡口拦海坝下, 由于坝内存在大规模水产养殖区, 坝两侧富营养化程度较高, 导致这一无性繁殖的悬浮群体快速大量增殖, 从而形成了大规模堆积的现象。因此我们对琅琊台湾及其周边地区开展了源头藻场的调查。我们发现了一些定生群体, 但生物量均远小于拦海坝处的悬浮群体; 湾内一些沿岸群体类似于悬浮群体, 携带少见的寄生藻, 提示湾内各类群间可能存在一定联系; 调查过程中, 一些当地民众称暴发点以北的滩涂上也有大规模红藻的分布, 在我们的调查中也发现了少量定生红翎菜分布, 其中一个分布点古镇营村已距拦海坝逾15 km, 提示了细弱红翎菜在本海域分布的广泛性。然而, 目前我们尚未发现其他较大规模的红翎菜群体, 源头藻场的确定还需要进一步的调查。
全球范围内, 大型海藻暴发增殖而引发的藻华问题日益增加, 虽然“绿潮”和“金潮”仍是最主要的大藻藻华灾害(Smetacek et al, 2013), 但近年来我国一些绿潮灾害中, 已经开始出现了一定比例的悬浮红藻, 如Song等(2019)报道渤海海域的本地绿潮中混杂大量的悬浮红藻, 并鉴定为龙须菜; 然而, 通过比对文中龙须菜图片和贡口拦海坝细弱红翎菜标本, 我们发现二者在外部形态上极为相似, 尤其是藻体的分枝基部均强烈缢缩, 初步认为该物种实际可能为细弱红翎菜。结合本研究在贡口拦海坝的实地调研结果, 提示着细弱红翎菜悬浮群体存在潜在的生态风险。
4 结论本研究报道了一次发生于青岛市琅琊台湾海域区的一种红藻物种大规模堆积的“藻华”现象。结合形态学与系统发育分析研究, 鉴定该物种为细弱红翎菜, 并首次描述了细弱红翎菜的悬浮生态型和一种寄生红藻, 进一步完善了该物种的形态学和生态习性研究。细弱红翎菜分布较为广泛, 可能具有较强的迁移和适应能力, 能够不依赖基质自由悬浮生长, 并形成较大规模的生物量, 可能存在一定的生态风险; 另一方面, 细弱红翎菜本身也是优质的卡拉胶原料, 也可食用, 具有潜在的经济价值。然而, 目前细弱红翎菜的相关研究仍较少, 其生态风险和综合利用需要进一步关注。
电子附件材料:
附图1, 2及附表1, 2见http://dx.doi.org/10.11693/hyhz20220400107
吉田忠生, 1998. 新日本海藻誌: 日本産海藻類総覧. 東京: 内田老鶴圃, 1201
|
张峻甫, 夏邦美, 1978. 中国产的几种寄生红藻. 海洋科学集刊, (14): 119-127 |
夏邦美, 张峻甫, 1999. 中国海藻志·第二卷红藻门·第五册伊谷藻目杉藻目红皮藻目. 北京: 科学出版社, 201
|
曾呈奎, 张德瑞, 张峻甫, 等, 1962. 中国经济海藻志. 北京: 科学出版社, 198
|
AGARDH J G, 1842. Algae Maris Mediterranei et Adriatici, Observationes in Diagnosin Specierum et Dispositionem Generum. Paris, France: Apud Fortin, Masson et Cie, 464
|
BÁRBARA I, GALLARDO T, CREMADES J, et al, 2013. Pseudopolyides furcellarioides gen.et sp.nov.(Gigartinales, Rhodophyta) an erect member of the Cruoriaceae based on morphological and molecular evidence. Phycologia, 52(2): 191-203 DOI:10.2216/12-040.1 |
DUMILAG R V, LIAO L M, LLUISMA A O, 2014. Phylogeny of Betaphycus (Gigartinales, Rhodophyta) as inferred from COI sequences and morphological observations on B.philippinensis. Journal of Applied Phycology, 26(1): 587-595 DOI:10.1007/s10811-013-0063-y |
FARNHAM W F, 1980. Studies on aliens in the marine flora of southern England [M] //PRICE J H, IRVINE D E G, FARNHAM W F. The shore Environment. London: Academic Press: 875-914.
|
FREDERICQ S, FRESHWATER D W, HOMMERSAND M H, 1999. Observations on the phylogenetic systematics and biogeography of the Solieriaceae (Gigartinales, Rhodophyta) inferred from rbcL sequences and morphological evidence. Hydrobiologia, 398/399: 25-38 |
FRESHWATER D W, RUENESS J, 1994. Phylogenetic relationships of some European Gelidium (Gelidiales, Rhodophyta) species, based on rbcL nucleotide sequence analysis. Phycologia, 33(3): 187-194 DOI:10.2216/i0031-8884-33-3-187.1 |
GABRIELSON P W, KRAFT G T, 1984. The marine algae of Lord Howe Island (NSW) the family Solieriaceae (Gigartinales, Rhodophyta). Brunonia, 7(2): 217-251 DOI:10.1071/BRU9840217 |
GAVIO B, FREDERICQ S, 2002. Grateloupia turuturu (Halymeniaceae, Rhodophyta) is the correct name of the non-native species in the Atlantic known as Grateloupia doryphora. European Journal of Phycology, 37(3): 349-359 DOI:10.1017/s0967026202003839 |
GERALDINO P J L, YANG E C, BOO S M, 2006. Morphology and molecular phylogeny of Hypnea flexicaulis (Gigartinales, Rhodophyta) from Korea. Algae, 21(4): 417-423 DOI:10.4490/ALGAE.2006.21.4.417 |
GUILLEMIN M L, FAUGERON S, DESTOMBE C, et al, 2008. Genetic variation in wild and cultivated populations of the haploid-diploid red alga Gracilaria chilensis: how farming practices favor asexual reproduction and heterozygosity. Evolution, 62(6): 1500-1519 DOI:10.1111/j.1558-5646.2008.00373.x |
GUINDON S, DUFAYARD J F, LEFORT V, et al, 2010. New algorithms and methods to estimate maximum-likelihood phylogenies: assessing the performance of PhyML 3.0. Systematic Biology, 59(3): 307-321 DOI:10.1093/sysbio/syq010 |
GUIRY M D, GUIRY G M, 2022. Solieria J. Agardh, 1842: AlgaeBase. World-wide electronic publication, National University of Ireland, Galway [R/OL]. [2022-04-21]. https://www.algaebase.org/search/genus/detail/?genus_id=33013.
|
KAIN J M, DESTOMBE C, 1995. A review of the life history, reproduction and phenology of Gracilaria. Journal of Applied Phycology, 7(3): 269 DOI:10.1007/BF00004001 |
KOKABI M, YOUSEFZADI M, 2015. Checklist of the marine macroalgae of Iran. Botanica Marina, 58(4): 307-320 DOI:10.1515/bot-2015-0001 |
KRAFT G T, MIN-THEIN U, 1983. Claviclonium and Antrocentrum, two new genera of Acrotylaceae (Gigartinales, Rhodophyta) from southern Australia. Phycologia, 22(2): 171-183 DOI:10.2216/i0031-8884-22-2-171.1 |
KRAFT G T, SAUNDERS G W, 2021. The Acrotylaceae (Gigartinales) revisited: molecular data indicate family-level differences in one of the most enigmatic red-algal families. Australian Systematic Botany, 34(3): 305-326 DOI:10.1071/sb20027 |
KUMAR S, STECHER G, LI M, et al, 2018. MEGA X: molecular evolutionary genetics analysis across computing platforms. Molecular Biology and Evolution, 35(6): 1547-1549 DOI:10.1093/molbev/msy096 |
KYLIN H, 1932. Die Florideenordnung Gigartinales. Lund, Sweden: Håkan Ohlssons Buchdruckerei, 88
|
LANFEAR R, FRANDSEN P B, WRIGHT A M, et al, 2017. PartitionFinder 2: new methods for selecting partitioned models of evolution for molecular and morphological phylogenetic analyses. Molecular Biology and Evolution, 34(3): 772-773 |
LEE I K, KANG J W, 1986. A check list of marine algae in Korea. Algae, 1(1): 311-325 |
LEE Y, KANG S, 2001. A Catalogue of the Seaweeds in Korea. Cheju, South Korea: Cheju National University Press
|
LI Y, LIU N, WANG X M, et al, 2018. Comparative genomics and systematics of Betaphycus, Eucheuma, and Kappaphycus (Solieriaceae: Rhodophyta) based on mitochondrial genome. Journal of Applied Phycology, 30(6): 3435-3443 DOI:10.1007/s10811-018-1450-1 |
LIN S M, FREDERICQ S, HOMMERSAND M H, 2001. Systematics of the Delesseriaceae (Ceramiales, Rhodophyta) based on large subunit rDNA and rbcL sequences, including the Phycodryoideae, subfam.Nov. Journal of Phycology, 37(5): 881-899 DOI:10.1046/j.1529-8817.2001.01012.x |
LITTLER D S, LITTLER M M, 2000. Caribbean Reef Plants: An Identification Guide to the Reef Plants of the Caribbean, Bahamas, Florida and Gulf of Mexico. Washington, USA: OffShore Graphics Inc., 542
|
MINEUR F, LE ROUX A, STEGENGA H, et al, 2012. Four new exotic red seaweeds on European shores. Biological Invasions, 14(8): 1635-1641 DOI:10.1007/s10530-012-0186-0 |
MIN-THEIN U, WOMERSLEY H B S, 1976. Studies on southern Australian taxa of Solieriaceae, Rhobdoniaceae and Rhodophyllidaceae (Rhodophyta). Australian Journal of Botany, 24(1): 1-166 DOI:10.1071/bt9760001 |
MSHIGENI K E, PAPENFUSS G F, 1981. Solieria jaasundii, a new species of red algae (Gigartinales, Solieriaceae) from Tanzania. Botanica Marina, 24(1): 1-8 DOI:10.1515/botm.1981.24.1.1 |
NORTON T A, MATHIESON A C, 1983. The biology of unattached seaweeds [M]//ROUND F E, CHAPMAN D J. Progress in Phycological Research. Amsterdam: Elsevier: 333-386.
|
NÚÑEZ RESENDIZ M L, ARDITO S, LEÓN-TEJERA H, et al, 2018. Solieria incurvata (Solieriaceae, Rhodophyta), a new species from Venezuela based on morpho-anatomical and molecular evidence. Botanica Marina, 61(4): 383-393 DOI:10.1515/bot-2018-0010 |
NÚÑEZ RESENDIZ M L, DRECKMANN K M, SENTÍES A, et al, 2019. Marine red algae (Rhodophyta) of economic use in the algal drifts from the Yucatan Peninsula, Mexico. Phytotaxa, 387(3): 219-240 DOI:10.11646/phytotaxa.387.3.3 |
PERRONE C, CECERE E, 1994. Two solieriacean algae new to the mediterranean: Agardhiella subulata and Solieria filiformis (Rhodophyta, Gigartinales). Journal of Phycology, 30(1): 98-108 DOI:10.1111/j.0022-3646.1994.00098.x |
PORSE H, RUDOLPH B, 2017. The seaweed hydrocolloid industry: 2016 updates, requirements, and outlook. Journal of Applied Phycology, 29(5): 2187-2200 DOI:10.1007/s10811-017-1144-0 |
RONQUIST F, HUELSENBECK J P, 2003. MrBayes 3: Bayesian phylogenetic inference under mixed models. Bioinformatics, 19(12): 1572-1574 DOI:10.1093/bioinformatics/btg180 |
SCHNEIDER C W, PETERSON E S, SAUNDERS G W, 2020. Two new species of Solieriaceae (Rhodophyta, Gigartinales) from the euphotic and mesophotic zones off Bermuda, Meristotheca odontoloma and Tepoztequiella muriamans. Phycologia, 59(2): 177-185 DOI:10.1080/00318884.2020.1719326 |
SILVA P C, BASSON P W, MOE R L, 1996. Catalogue of the Benthic Marine Algae of the Indian Ocean. Berkeley, USA: University of California Press, 1165
|
SKRIPTSOVA A V, SABITOVA L I, CHERBADGY I I, 2016. The decadal changes in the Ahnfeltia bed in the Peter the Great Bay (Sea of Japan): possible causes. Journal of Applied Phycology, 28(1): 417-427 DOI:10.1007/s10811-015-0524-6 |
SMETACEK V, ZINGONE A, 2013. Green and golden seaweed tides on the rise. Nature, 504(7478): 84-88 DOI:10.1038/nature12860 |
SONG W, WANG Z L, LI Y, et al, 2019. Tracking the original source of the green tides in the Bohai Sea, China. Estuarine, Coastal and Shelf Science, 219: 354-362 DOI:10.1016/j.ecss.2019.02.036 |
STAMATAKIS A, 2014. RAxML version 8: a tool for phylogenetic analysis and post-analysis of large phylogenies. Bioinformatics, 30(9): 1312-1313 DOI:10.1093/bioinformatics/btu033 |
STEPHANIE B, ERIC D, SOPHIE F M, et al, 2010. Carrageenan from Solieria chordalis (Gigartinales): structural analysis and immunological activities of the low molecular weight fractions. Carbohydrate Polymers, 81(2): 448-460 DOI:10.1016/j.carbpol.2010.02.046 |
TAN J, LIM P E, PHANG S M, et al, 2012. Assessment of four molecular markers as potential DNA barcodes for red algae Kappaphycus Doty and Eucheuma J.agardh (Solieriaceae, Rhodophyta). PLoS One, 7(12): e52905 DOI:10.1371/journal.pone.0052905 |
THOMPSON J D, HIGGINS D G, GIBSON T J, 1994. CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice. Nucleic Acids Research, 22(22): 4673-4680 DOI:10.1093/nar/22.22.4673 |
WEINBERGER F, PAALME T, WIKSTRÖM S A, 2020. Seaweed resources of the Baltic Sea, Kattegat and German and Danish North Sea coasts. Botanica Marina, 63(1): 61-72 DOI:10.1515/bot-2019-0019 |
XIA E Z, ZHANG J F, 1984. A new species of Solieria from China. Chinese Journal of Oceanology and Limnology, 2(1): 119-124 DOI:10.1007/BF02888400 |
YOSHIDA T, 1989. Solieria pacifica (Yamada) Yoshida, comb.nov.(Solieriaceae, Rhodophyta) from Japan. Japanese Journal of Phycology, 37(4): 268-270 |
ZANARDINI G, FIGARI A, 1858. Plantarum in Mari Rubro Hucusque Collectarum. Venice, Italy: I.R.Istituto veneto, 101
|
 2023, Vol. 54
2023, Vol. 54


