中国海洋湖沼学会主办。
文章信息
- 董福霖, 黄天晴, 刘恩慧, 谷伟, 王高超, 郭福元, 王炳谦, 徐革锋. 2023.
- DONG Fu-Lin, HUANG Tian-Qing, LIU En-Hui, GU Wei, WANG Gao-Chao, GUO Fu-Yuan, WANG Bing-Qian, XU Ge-Feng. 2023.
- 高温胁迫对虹鳟(Oncorhynchus mykiss)肝脏中抗氧化酶活性和免疫相关基因表达的影响
- EFFECT OF THERMAL STRESS ON ACTIVITY OF ANTIOXIDANT ENZYMES AND EXPRESSION OF IMMUNE-RELATED GENES IN LIVER OF RAINBOW TROUT (ONCORHYNCHUS MYKISS)
- 海洋与湖沼, 54(1): 225-232
- Oceanologia et Limnologia Sinica, 54(1): 225-232.
- http://dx.doi.org/10.11693/hyhz20220300064
文章历史
-
收稿日期:2022-03-16
收修改稿日期:2022-05-06
2. 上海海洋大学 上海 201306;
3. 烟台经海海洋渔业有限公司 山东烟台 264006
2. Shanghai Ocean University, Shanghai 201306, China;
3. Yantai Jinghai Marine Fishery Co. Ltd., Yantai 264006, China
虹鳟(Oncorhynchus mykiss)属于鲑形目、鲑科、大麻哈鱼属, 自从1959年引入我国以后, 成为我国广泛养殖的冷水鱼品种, 截止到2020年底, 我国的虹鳟产量达到了3.8万t (农业农村部渔业渔政管理局等, 2021)。虹鳟适宜的水温是12~18 ℃, 当超过20 ℃时, 虹鳟的摄食量就会减少, 生长速度放缓, 当超过26 ℃时, 虹鳟出现浮头, 呼吸频率降低, 并且有些鱼出现侧游、腹部向上的现象(马芳, 2019)。同时姜旭阳等(2019)对虹鳟幼鱼的温度耐受性研究表明, 虹鳟幼鱼的高温临界温度为26.5 ℃。所以夏季高温是虹鳟养殖环节中最大的威胁之一, 因此研究高温胁迫条件下虹鳟的生理响应和调控机制, 开展功能基因筛选和验证, 对耐高温品种的选育具有重要的理论价值和现实意义。
热休克蛋白(heat shock proteins, HSPs)是指在应激情况下生物体内的细胞新合成的或超量合成的一类蛋白质(王艳妮, 2016), 主要作用是保护机体抵抗不良环境刺激, 几乎存在于所有生物体(周彦静, 2017), 对模式物种的广泛研究揭示了热休克蛋白的三个主要家族: 热休克蛋白90 (heat shock proteins 90, HSP90, 85~90 kDa)、热休克蛋白70 (heat shock proteins 70, HSP70, 68~73 kDa)和低分子量热休克蛋白(16~47 kDa) (Demeke et al, 2016)。热休克蛋白10 (heat shock proteins 10, HSP10)参与细胞过程中的免疫反应、信号传导以及调节细胞凋亡环节。而HSP70则是目前研究最广泛的分子伴侣之一, 并在应激耐受过程中通过折叠新生多肽和恢复热损伤蛋白方式起作用(Zhang et al, 2014)。白细胞介素-8 (Interleukin- 8, il-8)和白细胞介素-1 (Interleukin-1, il-1)是两种重要的促炎细胞因子, 也是炎症反应的标志物(Corripio- Miyar et al, 2007)。其中il-1β (Interleukin-1β)在微生物入侵、组织损伤和包括自身免疫性疾病在内的免疫反应中发挥重要作用(Ma, 2016)。缺氧诱导因子(Hypoxia inducible factor, hif)一类高度保守的转录因子家族, 是氧稳态和低氧适应性反应的主要调节因子(Semenza, 1999)。hif-1α (Hypoxia inducible factor 1α, hif-1α)通过调节供氧和新陈代谢基因的表达来协调生物对缺氧的反应(Hochachka et al, 2001; Semenza, 2012)。
过高的温度通过产生活性氧(Reactive oxygen species, ROS)进而导致鱼体出现氧化应激(Madeira et al, 2013), 并进一步造成氧化损伤, 鱼类对此的应对方式主要是调节氧化应激相关基因的表达, 调控多种酶的合成, 而超氧化物歧化酶(Superoxide dismutase, SOD)和过氧化氢酶(catalase, CAT)是鱼类应对应激的关键酶(姜旭阳等, 2021)。为了响应ROS的生成, SOD将超氧化物阴离子分解为过氧化氢, CAT将过氧化氢分解为氧和水(Kim et al, 2017), 避免过多的活性氧对核酸、蛋白质以及脂质造成损伤(Tomanek et al, 2010)。有许多研究表明, 高温与SOD和CAT的活性变化显著相关, 在对翘嘴鳜(Siniperca chuatsi) (张晨光等, 2021)、褐牙鲆(Paralichthys olivaceus) (徐冬冬等, 2010)以及梭鲈(Sander lucioperca) (Li et al, 2019)等鱼的研究中发现, 高温显著改变了肝脏中SOD和CAT的活性, 因此SOD和CAT的活性变化可以看作鱼类高温应激状态的指示物。而肿瘤坏死因子α (tumor necrosis factor α, TNFα)则是一种重要的炎症因子。
高温胁迫会导致鱼类产生单链和双链DNA的断裂和染色体碎片。随机扩增多态性DNA (Random Amplified Polymorphic DNA, RAPD)技术是一种可靠的、灵敏的DNA损伤检测技术(赖金龙等, 2015)。目前利用RAPD检测鱼类的DNA损伤基本集中在重金属胁迫方面, 如重铬酸钾对鲤鱼(Cyprinus carpio) (Kumar et al, 2015)以及铀对斑马鱼(Brachydanio rerio) (Lerebours et al, 2013)的毒性研究, 而使用RAPD研究高温对鱼类的DNA损伤较少, 本研究评估了RAPD作为检测高温胁迫下虹鳟DNA损伤标志物的可行性。
本研究以虹鳟“水科一号”新品种为实验材料开展高温胁迫实验, 通过比较高温胁迫下不同实验组中鱼的抗氧化酶活性、免疫相关基因表达和DNA片段化的研究, 为高温胁迫下虹鳟应答机制的解析和耐高温品系的选育奠定基础。
1 材料与方法 1.1 实验鱼虹鳟“水科一号”幼鱼体质量(24.8±10.0) g, 体长(13.2±5.0) cm, 来自黑龙江水产研究所渤海冷水性鱼类试验站。
实验水族箱为循环控温玻璃水族箱, 规格为150 cm×60 cm×50 cm, 水深为50 cm。实验鱼在水族箱中驯养两周, 连续曝气, 水温控制在(16.0±0.2) ℃, pH值7.2~7.5, 溶解氧7.8~10.0 mg/L, 每日投喂商业饲料两次, 投喂30 min后清理剩余饲料。试验期间, 投喂方式、pH值、溶解氧与驯养期间保持一致。
1.2 实验设计在(16.0±0.2) ℃水温下驯养两周后, 选取体质健康、规格均一的虹鳟90尾进行试验, 根据预实验结果, (26.0±0.2) ℃下12 h可以区分出敏感组和耐受组。实验组共60尾, 平均分在两个玻璃水族箱中, 从(16.0±0.2) ℃开始升温, 每日升高1 ℃, 直至(26.0±0.2) ℃后12 h进行采样。此时, 每个水族箱中能保持游泳平衡、可以自由游动的个体定义为耐受组, 失去平衡、无法自游动的个体定义为敏感组。同时, 另外选取体质健康、规格均一的虹鳟30尾始终在(16.0±0.2) ℃下饲养, 此组为对照组。
1.3 RNA的提取和cDNA的合成每组采集6尾鱼的肝脏组织迅速置于液氮中, 后存于–80 ℃中保存, 直到用于后续实验。RNA的提取采用bioflux公司的总RNA提取试剂盒, 按照说明书进行肝脏组织的RNA提取。
cDNA的反转录采用TaKaRa公司的PrimeScript RT试剂盒, 按照说明进行反转录, 加入500 ng的Total RNA, 2 μL 5×PrimeScript RT Master Mix混匀后进行反转录反应: 37 ℃ 15 min, 85 ℃ 5 s, 4 ℃ 1 min。反转录成的cDNA在–20 ℃中保存备用。
1.4 SOD、CAT以及TNF-α的活性检测每组采集6尾鱼的肝脏放于冻存管中并于–80 ℃中保存。将肝脏组织在生理盐水中匀浆, 随后在4 ℃, 6 000 r/min下离心10 min。取上清用于SOD、CAT以及TNF-α的活性的测定。SOD、CAT活性测定按照南京建成生物工程研究所试剂盒(A001-1, A007-1-1)及相关说明测定。TNF-α活性测定按照上海酶联试剂盒(ml077404)及相关说明测定。
1.5 随机扩增多态性DNA-PCR每组采集3尾鱼的尾鳍到装有无水乙醇的采样管中, 并在4 ℃保存, 直到用于下一步实验。DNA提取使用biospin组织基因组DNA提取试剂盒按照说明进行提取, 使用ScanDrop测定浓度和纯度后, 放–20 ℃保存备用。
采用了5个随机引物(表 1)对三个组的DNA多态性进行了测试。25 μL反应体系由30 ng基因组DNA、2.5 μL 10×buffer、5 μL dNTP、1.25 μL引物(10 mmol/L)、2.5 μL Mg2+(5 mmol/L)以及H2O组成。反应在伯乐C1000 PCR仪中按照: 95 ℃预变性反应4 min, 95 ℃变性1 min, 36 ℃退火45 s, 72 ℃延伸1 min, 45个循环, 最后72 ℃延伸5 min。最终PCR产物在1.5%琼脂糖凝胶中于110 V电压下电泳30 min, 并在凝胶成像系统中进行观察和拍照。
| 名称 | 引物序列(5’~3’) |
| RAPD1 | GATGACCGCC |
| RAPD2 | GAACGGACTC |
| RAPD3 | TGCGTGCTTG |
| RAPD4 | GGAAGTCGCC |
| RAPD5 | CTGAGGTCTC |
根据GenBank已公布的虹鳟hif-1α的编码序列(AF304864.1)、β-actin cDNA全序列(AB196465)、il-1β的编码序列(AJ298294), il-8的编码序列(AJ279069)、hsp70的编码序(BT073047.1)以及大西洋鲑(Salmo salar) hsp10的编码序列(BT043672.1)使用Primer 5.0软件设计实时荧光定量PCR上、下游引物。所有引物合成均由生工生物工程(上海)股份有限公司完成。引物序列见表 2。
| 基因 | 引物序列(5’~3’) | GenBank登录号 |
| β-actin | F: CTACCTGATGAAGATCCTGACGG R: CAGCTTCTCCTTGATGTCTCGTA |
AB196465 |
| il-1β | F: ACATTGCCAACCTCATCATCG R: TTGAGCAGGTCCTTGTCCTTG |
AJ298294 |
| il-8 | F: AGAATGTCAGCCAGCCTTGT R: TCTCAGACTCATCCCCTCAGT |
AJ279069 |
| hsp70 | F: CAAGATCACCATCACCAACG R: TCCTACTACGTGTCTCCCTC |
BT073047.1 |
| hif-1α | F: AGGACCTGGACCTGGAGATGTTG R: CGCACAGAAGAGCACAGAGAAGAG |
AF304864.1 |
| hsp10 | F: AGGCTCCACCAACCAGAAAG R: CAGCATCACGGAACAGGAAG |
BT043672.1 |
| 注: F表示正向引物; R表示反向引物 | ||
使用TaKaRa公司的TB Green® Premix Ex TaqTM进行定量实时PCR, 条件如下: 30 s的95 ℃预变性, 40个循环的PCR反应(95 ℃, 5 s; 60 ℃, 34 s), 最后, 95 ℃ 15 s, 60 ℃ 60 s, 95 ℃ 15 s。
1.7 数据统计分析实验数据以平均值±标准差(mean±SD)表示, 采用Spss 26中的One-way ANOVA进行单因素方差分析以及T检验对不同实验处理组进行显著性分析, P < 0.05表示存在显著差异, 并用GraphPad Prism8.0作图。使用Image Lab软件对RAPD-PCR的产物进行条带分析。
2 结果 2.1 高温胁迫下肝脏中SOD、CAT的活性和TNF-α含量分析高温胁迫条件下虹鳟肝脏中SOD和CAT的活性均呈现了显著上升的趋势, 敏感组和耐受组均显著高于对照组(P < 0.05), 其中敏感组和耐受组中SOD活性分别是对照组的1.2倍和1.1倍; 而CAT的活性, 两组则均为对照组的1.4倍。同时, SOD和CAT的活性在敏感组和耐受组中均未发现显著差异(图 1a, 1b)。TNF-α含量在热应激后, 未发生显著变化(图 1c)。
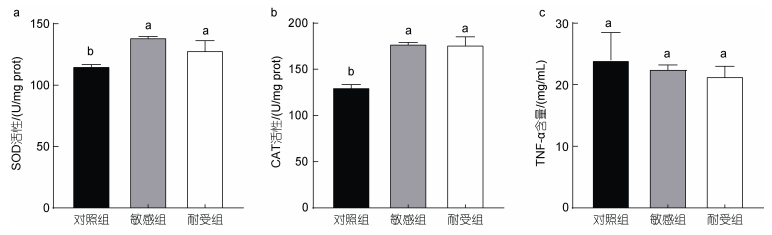 |
| 图 1 高温胁迫下虹鳟肝脏组织中SOD和CAT的活性和TNF-α含量 Fig. 1 SOD and CAT activity and TNF-α content in the liver tissue of rainbow trout under thermal stress 注: 图中柱上标记不同的字母代表不同实验组中相对表达存在显著差异(P < 0.05) |
对RAPD-PCR的结果进行分析发现, 在采用相同的五条随机引物的情况下, 对照组和耐受组分别产生了19.3个和19.6个DNA条带, 而敏感组则产生了24个DNA条带(图 2)。
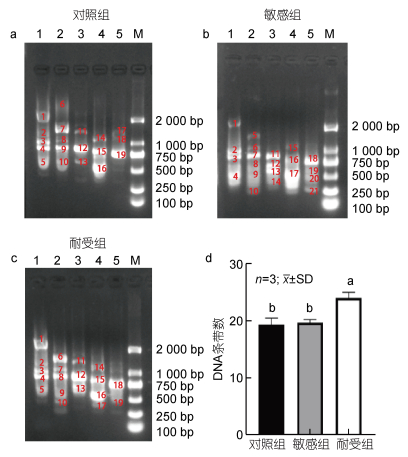 |
| 图 2 对照组(a)、敏感组(b)和耐受组(c) RAPD-PCR分析结果 Fig. 2 Results of RAPD-PCR analysis of control (a), sensitive (b), and tolerant (c) groups 注: 图中标注不同的字母代表不同实验组中相对表达存在显著差异(P < 0.05) |
通过qRT-PCR方法检测了il-1β、il-8、hif-1α、hsp10和hsp70基因在不同实验组肝脏中的表达水平。如图 3a所示, hif-1α的表达在敏感组和耐受组表现出不同的趋势, 相比与对照组, 敏感组中hif-1α表达上调, 而在耐受组中未发现明显变化; 敏感组中hif-1α的表达分别为对照组和耐受组的1.7倍和1.8倍。如图 3b、图 3c所示, il-1β和il-8两个基因表达均大幅上调, 显著高于对照组(P < 0.05), il-1β在敏感组和耐受组中没有观察到差异, 而敏感组il-8的相对表达为耐受组的1.28倍。两个热应激蛋白相关的基因hsp10和hsp70在热应激后也显著上调(P < 0.05); 两个基因在敏感和耐受组的表达均显著高于对照组, 敏感组中hsp10的相对表达量为耐受组的16.5倍, 而hsp70表达量为耐受组的0.72倍(图 3d, 3e)。
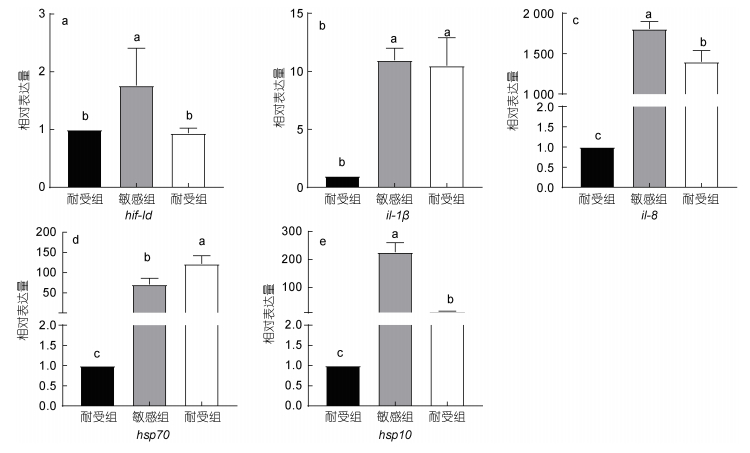 |
| 图 3 高温胁迫下虹鳟肝脏中hif-1α (a)、il-1β (b)、il-8 (c)、hsp70 (d)和hsp10 (e)基因的相对表达 Fig. 3 The relative expressions of hif-1α (a), il-1β (b), il-8 (c), hsp70 (d), and hsp10 (e) genes in rainbow trout liver under thermal stress 注: 图中标注不同的字母代表不同实验组中相对表达存在显著差异(P < 0.05) |
水产养殖中高温胁迫造成鱼体疾病暴发频率升高、代谢及免疫能力下降等一系列危害, 直接影响养殖的经济效益。本研究在26 ℃的高温胁迫条件下, 通过虹鳟是否游泳失衡、同时无法自由游动区分出敏感组和耐受组, 在此基础上研究了两者之间肝脏中的抗氧化酶活性和免疫相关基因表达上的差异, 为进一步探究虹鳟高温胁迫调控机制和培育虹鳟耐高温优良品系提供理论依据。
高温胁迫会导致鱼类体内产生氧化损伤, 其中氧化应激下的SOD和CAT活性的变化已经有许多报道(杨洪帅等, 2014; 孙永旭等, 2019)。快速的升温会导致鱼类体内产生过量的ROS和自由基, 而SOD和CAT则是快速清除活性氧和自由基的酶类(史鲲鹏等, 2018)。本研究中, 敏感组和耐受组的SOD活性和CAT的活性显著高于照组(P < 0.05)。说明高温使敏感组和耐受组均产生了氧化应激, 体内的活性氧和自由基增多, 鱼体通过增强抗氧化酶活性来消除多余的活性氧以及自由基, 减轻肌体损伤。而敏感组与耐受组的CAT和SOD差异不显著, 原因可能是虹鳟在接近极限耐受温度条件下, 应激个体的CAT和SOD酶活性达到阈值, 导致虹鳟的抗氧化酶活性对高温的响应不敏感。TNF-α是一种内源性致热原, 在机体炎症反应中发挥重要作用。本研究中的实验组和对照组中TNF-α含量不存在显著差异, 与在猪(胡艳欣等, 2006)、大鼠(Lan et al, 2019)中发现的结果一致, 我们认为这可能与TNF-α内源性致热原的性质有关, 同时在虹鳟热应激时肝脏中TNF-α发挥的免疫作用较小。
此外, 活性氧增多还会导致DNA氧化损伤, 包括链断裂、碱基错配等(Zhou et al, 2011)。在本研究中, DNA损伤通过RAPD图谱反映出来, 敏感组相比于对照组和耐受组出线了条带强度的改变和扩增条带的增加现象, 说明高温敏感组遭受到了更严重的DNA损伤。RAPD是一种经济、快速、简单的分子标记, 同时RAPD对鱼类伤害较小, 只需要尾鳍就可以进行检测, 我们认为, 在虹鳟养殖过程中, 可以用RAPD评估虹鳟热应激状态, 可以作为虹鳟高温耐受的标志, 同时开发相关的RAPD标记, 用于辅助耐高温品系的选育。
高温胁迫产生的氧化应激会导致体内的hsps表达量的变化, hsps发挥自己的生物学功能, 减少高温应激对机体产生的损害(Iwama et al, 1998)。在本研究中, 敏感组和耐受组的hsp70表达相对于对照组均显著上升(P < 0.05), 而耐受组又显著高于敏感组(P < 0.05)。类似结果也在西伯利亚鲟(Acipenser baerii) (田照辉等, 2013)和大黄鱼(Larimichthys crocea) (Xu et al, 2018)发现。我们推测, hsp70在虹鳟在应对热应激上起到了保护组织和细胞的作用。hsp10的相对表达也在高温胁迫后上调, 并且敏感组中上调幅度显著大于耐受组(P < 0.05)。而hsp10的主要功能是参与免疫反应以及调节细胞凋亡(Akyol et al, 2006; 赵考考, 2011), 我们推测, 敏感组中肝脏受到更严重的损伤, 细胞凋亡程度大于耐受组, 所以敏感组中hsp10表达量显著高于耐受组。炎症反应是机体产生的一种自身保护性反应, 目的是修复受损组织, 消除有害刺激(郭勋等, 2020)。同时机体的炎症反应也是检测健康状态的重要指标之一, il-8和il-1β是两种重要的促炎因子, 在调节炎症反应中发挥重要作用(Liang et al, 2022)。本研究中il-1β、il-8表达均发生上调, 但敏感组中的il-8表达显著高于耐受组, 说明高温导致虹鳟幼鱼产生肝脏的炎症反应, 敏感组肝脏受损更加严重。此外我们认为hsp70、hsp10表达差异是导致虹鳟温度耐受性的差异原因之一。
氧气和容量限制的热耐受性(OCLTT)是Pörtner提出的一个基于血液中O2的热依赖性和有氧能力的相应变化的综合概念(Pörtner et al, 2017; Jutfelt et al, 2018)。这一假说认为, 呼吸系统和心血管系统在极端温度下会受到损害, 从而限制了组织和细胞获得氧气的能力。基于这个理论, Joyce等(2020)做出了一个推论, 缺氧和耐热性是相关的, 同时在Anttila等(2013)对大西洋鲑的研究中表明, 临界最高温度与耐缺氧能力呈显著正相关。hif-1α控制代谢和氧气供应相关基因的表达, 在协调细胞对缺氧的反应中发挥着重要的作用, Hif-1是参与血管生成、红细胞生成和葡萄糖代谢的基因, 同时也被证明在黑鲫(Carassius carassius) (Rissanen et al, 2006)中参与调节体温和缺氧之间的相互作用。在本研究中, 敏感组中hif-1α的表达量显著高于(P < 0.05)对照组和耐受组, 而耐受组和对照组间则未发现显著的差异。在Saravia等(2021)对南极鱼(Harpagifer antarcticus)的研究中发现肝脏中hif-1α在临界最高温度时表达显著升高, 这与本研究中的敏感组表现出了相同的趋势。而hif-1α作为一些基因表达的重要调控因子, 会对缺氧做出反应(Cai et al, 2014), 因此我们推测, 敏感组和耐受组表现出的差异是因为敏感组对温度更为敏感, 为弥补高温带来的损伤, 加快了代谢率和呼吸频率, 所以上调了hif-1α的表达, 因此我们认为耐缺氧能力是影响虹鳟温度耐受性的重要因素。
4 结论以上结果表明hif-1α、hsp70和hsp10在虹鳟高温胁迫中发挥重要作用, 我们认为可以从这些基因中发掘潜在的SNP位点, 作为虹鳟高温选育潜在的分子标记。而RAPD可以用于评估虹鳟热应激状态, 并作为虹鳟高温耐受的潜在标志。
马芳, 2019. 虹鳟热应激相关miRNA及其靶基因鉴定、生物信息学分析及靶向关系验证[D]. 兰州: 甘肃农业大学: 10-11.
|
王艳妮, 2016. 热应激对虹鳟免疫指标及热休克蛋白基因HSP47 mRNA表达的影响[D]. 兰州: 甘肃农业大学: 6-7.
|
田照辉, 徐绍刚, 王巍, 等, 2013. 急性热应激对西伯利亚鲟HSP70 mRNA表达、血清皮质醇和非特异性免疫的影响. 水生生物学报, 37(2): 344-350 |
史鲲鹏, 董双林, 周演根, 等, 2018. 不同倍性虹鳟幼鱼对急性温度胁迫的抗氧化响应. 应用生态学报, 29(9): 3102-3110 DOI:10.13287/j.1001-9332.201809.001 |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会, 2021. 中国渔业统计年鉴-2021. 北京: 中国农业出版社, 25
|
孙永旭, 董宏标, 王文豪, 等, 2019. 温度对大口黑鲈幼鱼不同组织抗氧化能力及免疫相关蛋白表达的影响. 生态科学, 38(3): 18-25 |
杨洪帅, 王辉, 刘加慧, 等, 2014. 高温对吉富罗非鱼幼鱼生长及超氧化物歧化酶、乳酸脱氢酶活力的影响. 广东海洋大学学报, 34(1): 15-20 |
张晨光, 丁炜东, 曹哲明, 等, 2021. 急性高温胁迫对翘嘴鳜幼鱼抗氧化酶和消化酶活性及热休克蛋白基因表达的影响. 南方农业学报, 52(3): 815-826 DOI:10.3969/j.issn.2095-1191.2021.03.030 |
周彦静, 2017. 持续热应激下虹鳟热应激蛋白基因HSP90α和HSP10 mRNA表达、组织损伤及血细胞凋亡变化[D]. 兰州: 甘肃农业大学: 8-9.
|
赵考考, 2011. 热休克蛋白10的研究进展. 医学综述, 17(1): 1-3 DOI:10.3969/j.issn.1006-2084.2011.01.001 |
胡艳欣, 佘锐萍, 张洪玉, 等, 2006. 热应激后猪血清中IL-2、IFN-γ及TNF-α水平的动态变化. 畜牧兽医学报, 37(5): 496-499 DOI:10.3321/j.issn:0366-6964.2006.05.015 |
姜旭阳, 黄铭, 杨小刚, 等, 2021. 急性高温胁迫对虹鳟和硬头鳟幼鱼抗氧化酶活性的影响. 中国水产科学, 28(1): 57-65 |
姜旭阳, 董双林, 刘骋跃, 等, 2019. 虹鳟和硬头鳟幼鱼对温度的耐受性. 中国海洋大学学报, 49(3): 57-62 |
徐冬冬, 楼宝, 詹炜, 等, 2010. 高温胁迫对褐牙鲆生长及肝脏抗氧化酶活性的影响. 水产学报, 34(7): 1099-1105 |
郭勋, 程珂, 马春松, 等, 2020. 饲料中维生素D3的添加水平对黄颡鱼幼鱼生长和Toll样受体TLR18、TLR19和TLR21的影响. 水生生物学报, 44(3): 461-469 |
赖金龙, 胡健慧, 付倩, 等, 2015. 改良彗星实验和RAPD技术检测DNA损伤的实验研究. 实验技术与管理, 32(6): 45-50, 54 |
AKYOL S, GERCEL-TAYLOR C, REYNOLDS L C, et al, 2006. HSP-10 in ovarian cancer: expression and suppression of T-cell signaling. Gynecologic Oncology, 101(3): 481-486 |
ANTTILA K, DHILLON R S, BOULDING E G, et al, 2013. Variation in temperature tolerance among families of Atlantic salmon (Salmo salar) is associated with hypoxia tolerance, ventricle size and myoglobin level. Journal of Experimental Biology, 216(7): 1183-1190 |
CAI X H, HUANG Y T, ZHANG X, et al, 2014. Cloning, characterization, hypoxia and heat shock response of hypoxia inducible factor-1 (HIF-1) from the small abalone Haliotis diversicolor. Gene, 534(2): 256-264 |
CORRIPIO-MIYAR Y, BIRD S, TSAMOPOULOS K, et al, 2007. Cloning and expression analysis of two pro-inflammatory cytokines, IL-1β and IL-8, in haddock (Melanogrammus aeglefinus). Molecular Immunology, 44(6): 1361-1373 |
DEMEKE A, TASSEW A, 2016. Heat shock protein and their significance in fish health. Research & Reviews: Journal of Veterinary Sciences, 2(1): 66-68 |
HOCHACHKA P W, LUTZ P L, 2001. Mechanism, origin, and evolution of anoxia tolerance in animals. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 130(4): 435-459 |
IWAMA G K, THOMAS P T, FORSYTH R B, et al, 1998. Heat shock protein expression in fish. Reviews in Fish Biology and Fisheries, 8(1): 35-56 |
JOYCE W, PERRY S F, 2020. Hypoxia inducible factor-1 α knockout does not impair acute thermal tolerance or heat hardening in zebrafish. Biology Letters, 16(7): 20200292 |
JUTFELT F, NORIN T, ERN R, et al, 2018. Oxygen-and capacity-limited thermal tolerance: blurring ecology and physiology. Journal of Experimental Biology, 221(1): jeb169615 |
KIM J H, PARK H J, KIM K W, et al, 2017. Growth performance, oxidative stress, and non-specific immune responses in juvenile sablefish, Anoplopoma fimbria, by changes of water temperature and salinity. Fish Physiology and Biochemistry, 43(5): 1421-1431 |
KUMAR P, KUMAR R, NAGPURE N S, et al, 2015. In vivo assessment of DNA damage in Cyprinus carpio after exposure to potassium dichromate using RAPD. Turkish Journal of Veterinary and Animal Sciences, 39(2): 121-127 |
LAN R X, LI S Q, CHANG Q Q, et al, 2019. Chitosan oligosaccharides protect sprague dawley rats from cyclic heat stress by attenuation of oxidative and inflammation stress. Animals, 9(12): 1074 |
LEREBOURS A, CAMBIER S, HISLOP L, et al, 2013. Genotoxic effects of exposure to waterborne uranium, dietary methylmercury and hyperoxia in zebrafish assessed by the quantitative RAPD-PCR method. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 755(1): 55-60 |
LI C J, WANG Y F, WANG G C, et al, 2019. Physicochemical changes in liver and Hsc70 expression in pikeperch Sander lucioperca under heat stress. Ecotoxicology and Environmental Safety, 181: 130-137 |
LIANG H L, GE X P, XIA D, et al, 2022. The role of dietary chromium supplementation in relieving heat stress of juvenile blunt snout bream Megalobrama amblycephala. Fish & Shellfish Immunology, 120: 23-30 |
MA X J, 2016. Regulation of Cytokine Gene Expression in Immunity and Diseases. Dordrecht: Springer
|
MADEIRA D, NARCISO L, CABRAL H N, et al, 2013. Influence of temperature in thermal and oxidative stress responses in estuarine fish. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 166(2): 237-243 |
PÖRTNER H O, BOCK C, MARK F C, 2017. Oxygen-and capacity-limited thermal tolerance: bridging ecology and physiology. Journal of Experimental Biology, 220(15): 2685-2696 |
RISSANEN E, TRANBERG H K, SOLLID J, et al, 2006. Temperature regulates hypoxia-inducible factor-1 (HIF-1) in a poikilothermic vertebrate, crucian carp (Carassius carassius). Journal of Experimental Biology, 209(6): 994-1003 |
SARAVIA J, PASCHKE K, OYARZÚN-SALAZAR R, et al, 2021. Effects of warming rates on physiological and molecular components of response to CTMax heat stress in the Antarctic fish Harpagifer antarcticus. Journal of Thermal Biology, 99: 103021 |
SEMENZA G L, 1999. Regulation of mammalian O2 homeostasis by hypoxia-inducible factor 1. Annual Review of Cell and Developmental Biology, 15(1): 551-578 |
SEMENZA G L, 2012. Hypoxia-inducible factors in physiology and medicine. Cell, 148(3): 399-408 |
TOMANEK L, ZUZOW M J, 2010. The proteomic response of the mussel congeners Mytilus galloprovincialis and M. trossulus to acute heat stress: implications for thermal tolerance limits and metabolic costs of thermal stress. Journal of Experimental Biology, 213(20): 3559-3574 |
XU K D, XU H X, HAN Z Q, 2018. Genome-wide identification of hsp70 genes in the large yellow croaker (Larimichthys crocea) and their regulated expression under cold and heat stress. Genes, 9(12): 590 |
ZHANG C N, TIAN H Y, LI X F, et al, 2014. The effects of fructooligosaccharide on the immune response, antioxidant capability and HSP70 and HSP90 expressions in blunt snout bream (Megalobrama amblycephala Yih) under high heat stress. Aquaculture, 433: 458-466 |
ZHOU L, LI J Q, LIN X F, et al, 2011. Use of RAPD to detect DNA damage induced by nitrofurazone in marine ciliate, Euplotes vannus (Protozoa, Ciliophora). Aquatic Toxicology, 103(3/4): 225-232 |
 2023, Vol. 54
2023, Vol. 54


