
中国海洋湖沼学会主办。
文章信息
- 曹慧敏, 朱阳, 郭祖霆, 李双, 周旭, 迟长凤, 郑利兵. 2023.
- CAO Hui-Min, ZHU Yang, GUO Zu-Ting, LI Shuang, ZHOU Xu, CHI Chang-Feng, ZHENG Li-Bing. 2023.
- 虎斑乌贼FMRFamide的表达定位及其Na+通道受体基因的克隆鉴定、表达分析
- FMRFAMIDE LOCALIZATION AND MOLECULAR CHARACTERIZATION, AND THE EXPRESSION OF ITS Na+ CHANNEL RECEPTOR IN SEPIA PHARAONIS
- 海洋与湖沼, 54(1): 233-245
- Oceanologia et Limnologia Sinica, 54(1): 233-245.
- http://dx.doi.org/10.11693/hyhz20220400097
文章历史
-
收稿日期:2022-04-13
收修改稿日期:2022-06-19
神经肽是一类内源性的小分子活性多肽, 广泛存在于动物的神经系统中直接或间接地调控生理活动(Cao et al, 2016)。FMRFamide (Phe-Met-Arg-Phe- NH2)样肽(FMRFamide-like peptide, FLP)是已知的最大的神经肽家族(Espinoza et al, 2000), 典型代表FMRFamide是1977年从光芒长文蛤(Macrocallista nimbosa) (Price et al, 1977)的神经节中首次发现。在1987年, 首次在真蛸(Octopus vulgaris) (Martin et al, 1987)中枢神经系统的静脉血清中鉴定出了FMRFamide。FMRFamide除了参与调节心跳(Salzet et al, 1994)、摄食(Dockray, 2004)、肌肉收缩(Li et al, 2019)外, 还可以调节海兔(Aplysia)突触可塑性(Guan et al, 2003), 促进散大蜗牛(Helix aspersa)血糖调控(Rőszer et al, 2014), 参与亮大蜗牛(Helix lucorum)细胞凋亡(Röszer et al, 2006), 调节真蛸传入的视觉系统的信号(di Cosmo et al, 1998), 进而调控头足类的生殖过程(di Cristo et al, 2003)。FMRFamide作为一种神经肽, 通过结合受体起着内分泌、自分泌或旁分泌等不同的作用。研究显示, 除了G蛋白偶联受体(GPCR)外, 神经肽FMRFamide还存在阿米洛利敏感的Na+通道受体, 属于ENaC/DEG离子通道受体家族(Green et al, 1994)。目前, 在软体动物中发现的唯一一类由神经肽直接调控的离子通道是加州海兔FaNaC (Furukawa et al, 2006)。FaNaC作为ENaC/DEG离子通道家族成员之一, 显著特征是含有一个巨大的胞外域, 两个疏水性跨膜区域之间含有保守的半胱氨酸,
虎斑乌贼(Sepia pharaonis)生长速度快、个体大, 是经济价值较高的养殖品种。多年的人工养殖条件下, 虎斑乌贼表现出了与其他人工养殖品种如曼氏无针乌贼(Sepiella japonica) (Cao et al, 2016)、商乌贼(Sepia officinalis) (Domingues et al, 2002)、滑柔鱼(Illex illecebrosus) (Durward et al, 1980)、蓝蛸(Octopus cyanea) (Van Heukelem, 1976)等类似的性腺发育早熟现象, 导致成体规格小型化(郑小东等, 2010; Cao et al, 2016), 严重制约了其养殖业的健康可持续发展。然而, 到目前为止, 有关其生长发育及生殖过程的调控机制还未得到很好的阐述。
本文通过同源克隆及RACE (rapid amplification of cDNA end)技术克隆虎斑乌贼Na+通道受体(SpFaNaC)的cDNA全长序列, 并进行生物信息学分析; 利用实时荧光定量(Quantitative Real-time PCR, qRT-PCR)技术检测SpFaNaC在雌性个体中的组织分布模式; 进一步采用原位杂交(in situ hybridization, ISH)和免疫组织化学(immumohistochemical staining, IHC)技术定位分析SpFMRFamide和SpFaNaC在不同组织中的分布特征。实验结果将为认识SpFMRFamide和SpFaNaC的功能特征提供基础数据, 对于进一步深入探究FMRFamide通过SpFaNaC参与调控的生理代谢过程具有重要的理论意义, 同时为头足类的种质资源的恢复和保护奠定一定的理论基础。
1 材料与方法 1.1 样品来源实验所用性成熟V期虎斑乌贼[体重: (81.13±16.6) g, 胴长: (8.25±0.9) cm]购自广东省湛江市硇洲岛渔民。乌贼生殖时期鉴定与活体解剖, 参照蒋霞敏等(2008)方法, 取脑、视叶、缠卵腺等组织于RNA保存液中, 4 ℃过夜后转入–80 ℃冰箱保存备用; 取2.5 cm× 2.5 cm×0.2 cm规格大小的组织于4%多聚甲醛浸泡24 h, 于4 ℃保存备用。
1.2 SpFaNaC基因全长cDNA的克隆 1.2.1 RNA提取及cDNA的合成虎斑乌贼脑组织总RNA的提取采用常规的Trizol法, 通过蛋白抽提、核酸沉淀、洗涤后, 加入适量的DEPC水溶解, 1.2%的琼脂糖凝胶电泳、核酸分析仪分别进行提取RNA质量、浓度的检测。cDNA依据试剂盒(TaKaRa, Japan)说明书进行反转录合成, 置于–20 ℃备用。
1.2.2 SpFaNaC全长cDNA的克隆根据SMARTerTM RACE cDNA Amplification Kit (Clontech)说明书利用1.0 μg脑组织总RNA制备3’端和5’端RACE模板。根据实验室转录组文库中搜索到的FaNaC基因设计虎斑乌贼FaNaC基因在保守区的引物SpFaNaC-F/R (表 1), 扩增、测序保守区段序列。根据测序的序列设计 5’/3’端特异性RACE引物5’/3'-SpFaNaC-outter/inner (Tm > 70 ℃) (表 1)进行两端未知序列的扩增, 产物经电泳检测、凝胶回收后连接pMD-19T并转化Escherichia coli DH5α, 挑阳性单克隆送至上海生工进行测序、拼接, 进而获得SpFaNaC的cDNA全长序列。
| 引物名称 | 序列(5’~3’) |
| 核心片段引物 | |
| SpFaNaC-F | TACCTGTGGCTGCCGTTCTT |
| SpFaNaC-R | AGTTGTCTCCTGACATGGTTGGA |
| cDNA末端快速扩增(RACE) | |
| 5'-RACE Adapter | GGACAGTGGTGTAACG |
| 5'-SpFaNaC-outter | GACCCACCTGTTGGTGGTTATGGT |
| 5'-SpFaNaC-inner | GCGCCAATATCCCTGACCAAAAC |
| 3'-RACE Adapter | TGGAAGCAGATCAACTTGAGTCAGGT |
| 3'-SpFaNaC-inner | TTACGTTCGGGTGACCAAAAC |
| 3'-SpFaNaC-outter | CTGCTTATGCCCTGCATTTGCCG |
| 实时荧光定量PCR(qRT-PCR) | |
| qSpFaNaC-F | GATTACTACCTGTGGCTGCCGT |
| qSpFaNaC-R | GCCCTGTTCATTGTGAACTCTTT |
| Spβ-actin-F | GCCAGTTGCTCGTTACAG |
| Spβ-actin-R | GCCAACAATAGATGGGAAT |
| SpGAPDH-F | TGGTTCCTTGGCTTTTGCT |
| SpGAPDH-R | GGTGGTGGTGCGGGTAGT |
| 原位杂交(ISH) | |
| A-SpFMRF-F | CAGTGTTCGACGAAAGCG |
| A-SpFMRF-R | TCTTGGTCTCATTGTGGTTTCG |
| S-SpFMRF-F | TCAGTGTTACTATTGGTGGTTTATC |
| S-SpFMRF-R | TCTTGGTCCTCAGGGTTT |
| A-SpFaNaC-F | CTGCTTGTGATTGTGGGG |
| A-SpFaNaC-R | GATCACTAATACGACTCACTATAGGGAGGGCCTGTAGAATGGGT |
| S-SpFaNaC-F | GATCACTAATACGACTCACTATAGGGCTGCTTGTGATTGTGGGG |
| S-SpFaNaC-R | GAGGGCCTGTAGAATGGGT |
序列的同源比对、多序列比对、分析和修饰、开放阅读框(ORF)的查找、氨基酸序列的预测、信号肽、蛋白的理化性质和蛋白结构域的预测、进化树的构建参考朱阳(2020)。
1.4 SpFaNaC的组织分布模式根据获得的SpFaNaC全长cDNA序列, 用Primer Premier 5.0设计特异性引物qSpFaNaC-F/R (表 1)进行qRT-PCR检测性成熟时期雌性个体SpFaNaC的组织分布特点。反应体系为: TB Green 12.5 μL, qSpFaNaC-F/R 1.0 μL, cDNA 2.0 μL, RNase-free ddH2O 8.5 μL; 反应程序为: 95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 45 s, 40次循环; 扩增结束后设置熔解曲线以确保所用引物在扩增过程的特异性。每个组织3个生物学重复, 每个样品3个平行。内参基因选用虎斑乌贼β-actin和GAPDH基因(见表 1)。
在数据处理与分析上, 以2–△△Ct方法进行双内参计算、统计, 单因素方差分析和显著性差异分析方法与朱阳(2020)一致。
1.5 SpFMRF及SpFaNaC的原位杂交 1.5.1 原位杂交探针制备根据前期实验室获得的SpFMRF序列及本研究中扩增的SpFaNaC序列设计制备探针的引物(表 1), 反义探针在R引物前加上启动子序列GATCACTAATACGACTCACTATAGG, 正义探针需在F引物前加上启动子序列。经PCR扩增并测序的序列作为模板进行探针制备, 反应结束后利用RNA-Clean up kit纯化反转录产物, 电泳检测探针质量, 核酸分析仪检测浓度后分装至–80 ℃保存备用。
1.5.2 原位杂交具体方法参照Zheng等(2020), 石蜡切片经过二甲苯脱蜡、乙醇梯度复水、蛋白酶K消化、4%多聚甲醛再固定后, 滴加预杂交液于42 ℃预杂交2 h。加入3 ng/μL探针的杂交液于80 ℃变性5 min后置于冰上备用。预杂交结束后, 弃掉预杂交液, 滴加杂交液于切片上, 于暗盒中50 ℃孵育16 h。第二天, 孵育探针结束的组织切片经梯度柠檬酸钠缓冲液(saline sodium citrate buffer, SSC buffer)漂洗后, 滴加封闭液于室温封闭2~3 h, 再与抗地高辛-AP抗体(1︰2 000) (Roche)室温孵育2~3 h。一系列漂洗后, 进行NBT/BCIP显色、封片、拍照。
1.6 SpFMRFamide的免疫组化利用Anti-FMRFamide抗体(ImmunoStar, USA)对虎斑乌贼脑组织中FMRFamide的表达分布进行检测, 具体步骤为: 石蜡切片经二甲苯脱蜡处理, 100%- 95%-85%-70%乙醇中复水, 每次5 min; 将组织切片置于3% H2O2 (PBS配置)室温处理10 min, PBS漂洗; 滴加5% BSA室温封闭20 min, 滴加Anti-FMRFamide抗体(1︰2 000) 4 ℃过夜后PBS漂洗; 滴加二抗IgG (1︰1 000), 室温30 min, PBS漂洗; 滴加SABC复合物, 室温反应30 min, PBS漂洗; DAB法显色, 苏木精复染后, 经70%-85%-95%-100%乙醇复水处理, 每次3 min; 二甲苯再次透明、封片、拍照。
2 结果 2.1 SpFaNaC基因的cDNA信息经测序拼接得到SpFaNaC cDNA全长2 090 bp (图 1), 其中包含5’-非编码区(untranslated region, UTR) 262 bp, 3’-UTR 46 bp, 开放阅读框(open reading frame, ORF) 1 782 bp, 编码593个氨基酸。分子量MW为63.9 kDa, 理论等电点pI为12.5。SignalP在线预测SpFaNaC的N端没有信号肽; SMART分析显示SpFaNaC有2个跨膜区。预测SpFaNaC有6个糖基化位点, 36个丝氨酸位点、22个苏氨酸位点和12个酪氨酸位点, 共有70个磷酸化位点。预测该蛋白的三级结构: 包含α螺旋结构(45%)、扩展链(12%)和无规则卷曲(43%)。
 |
| 图 1 虎斑乌贼FaNaC的核苷酸序列和预测的氨基酸序列 Fig. 1 The nucleotide and deduced amino acid sequences of FaNaC in S. pharaonis 注: 起始密码子(ATG)和终止密码子(TAA)位于黑色线框内。糖基化位点用黑色三角号在氨基酸下面标出, 磷酸化位点位于红色线框, 跨膜区域用淡灰色阴影表示 |
NCBI Blast序列比对结果显示, SpFaNaC与头足纲和腹足纲的FaNaC具有较高的相似性, 其中与真蛸预测的FaNaC序列相似性高达77%, 与中华章鱼(Octopus sinensis)为77%, 与双斑蛸(Octopus bimaculoides)为76%, 与散大蜗牛为45%, 与静水椎实螺(Lymnaea stagnalis)为42%。
ClustalW对SpFaNaC进行了多序列比对分析(图 2), 结果显示FaNaC有2个跨膜区(TM)、2个胞内环(IL)和1个胞外环(EL)。蛋白的N端与C端都位于细胞质内, 中间绝大部分氨基酸位于胞外区。FaNaC蛋白在TM1区后80~90个氨基酸残基处有一个与FMRFamide结合的特异性位点。
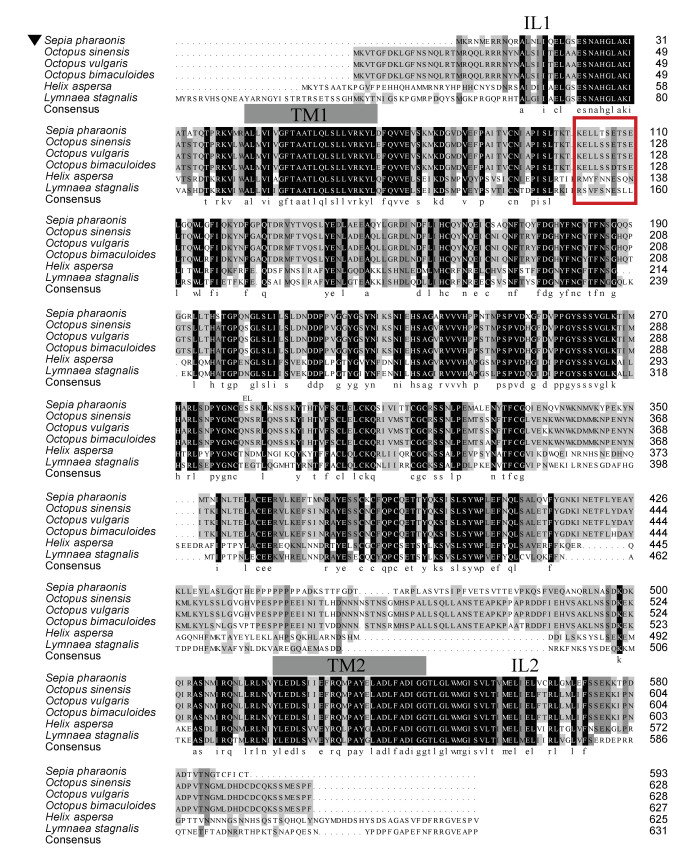 |
| 图 2 SpFaNaC的氨基酸序列(用▼表示)与其他物种的FaNaC多序列比对 Fig. 2 Multiple amino acid sequence alignment of SpFaNaC (noted by ▼) with other representative species 注: 比对序列的GenBank登录号为: 中华章鱼(XP_029650472.1)、真蛸(QHX41573.1)、双斑蛸(XP_014786424.1)、散大蜗牛(2202327A)、静水椎实螺 (AAK20896.1)。相同的氨基酸残基用黑色表示, 相似的氨基酸残基用灰色表示。对比图标出了SpFaNaC的跨膜区(TM)、胞内环(IL)、胞外环(EL)。红框内为FMRFamide的结合位点 |
进一步利用NCBI数据库中筛选的16条代表性物种的FaNaC氨基酸序列, 通过Mega X软件基于最大似然法(Bootstrap 10000)构建系统进化树(图 3)。结果显示, SpFaNaC首先与曼氏无针乌贼FaNaC聚在一起, 头足纲FaNaC与双壳纲、腹足纲动物FaNaC聚为姐妹支, 腕足动物门和节肢动物门动物FaNaC作为外支, 其进化分析结果与传统的分类高度一致。
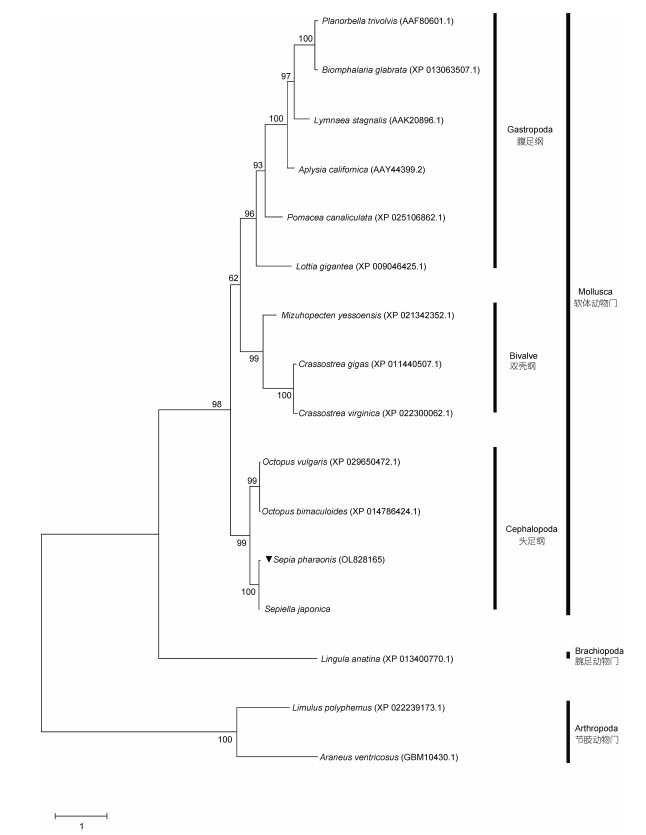 |
| 图 3 基于SpFaNaC的蛋白序列和其他物种的相应蛋白序列构建系统发育树 Fig. 3 Phylogenetic tree constructed based on the protein sequences of SpFaNaC in addition to those of other species 注: 采用MEGA X软件, 采用极大似然法构建系统发育树。代表物种的GenBank号为: 真蛸(XP_029650472.1)、双斑蛸(XP_014786424.1)、虾夷扇贝(Mizuhopecten yessoensis) (XP_021342352.1)、福寿螺(Pomacea canaliculata) (XP_025106862.1)、霸王莲花青螺(Lottia gigantea) (XP_009046425.1)、长牡蛎(Crassostrea gigas) (XP_011440507.1)、美洲牡蛎(Crassostrea virginica) (XP_022300062.1)、光滑双脐螺(Biomphalaria glabrata) (XP_013063488.1)、加利福尼亚海兔(Aplysia californica) (AAY44399.2)、静水椎实螺(AAK20896.1)、三旋卷丽螺(Planorbella trivolvis) (AAF80601.1)、海豆芽(Lingula anatina) (XP_013400770.1)、美洲鲎(Limulus polyphemus) (XP_022239173.1)、大腹园蛛(Araneus ventricosus) (GBM10430.1)、散大蜗牛(2202327A) |
利用qRT-PCR技术通过2–△△Ct方法检测了SpFaNaC在成年虎斑乌贼的组织分布特点, 结果如图 4所示: SpFaNaC在检测的所有组织中均有一定的表达, 以鳃组织中的表达量作为参照设定为1。在各组织间的两两比较中, 脑和视叶的表达量显著高于其他组织(P < 0.05), 其中, 在脑组织中SpFaNaC表达量最高, 其他组织表达无显著差异(P < 0.05)。
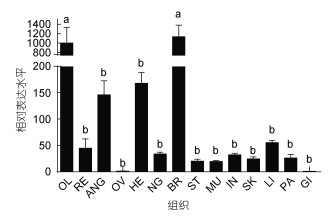 |
| 图 4 SpFaNaC基因组织表达差异性分析 Fig. 4 The expression profiles of SpFaNaC in various tissues of S.pharaonis 注: 结果表示均值±标准差(n=3)。误差线上标不同的字母表示差异显著(P < 0.05)。组织名称缩写: OL: 视叶; RE: 视网膜; ANG: 副缠卵腺; OV: 卵巢; HE: 心脏; NG: 缠卵腺; BR: 脑; ST: 胃; MU: 肌肉; IN: 肠道; SK: 皮肤; LI: 肝脏; PA: 胰脏; GI: 鳃 |
通过原位杂交方法对SpFMRFamide前体mRNA (同“SpFMRFamide”基因)在组织中的表达进行了定位(图 5)。与正义探针处理的组织无任何杂交信号(图 5a)相比, 反义探针标记后的视叶组织中清晰可见SpFMRFamide前体基因mRNA的阳性杂交信号, 主要分布在视叶的中央髓质区、边缘髓质区、内细胞颗粒层和外细胞颗粒层, 在边缘髓质区的阳性信号较少、强度较弱, 在网织层无阳性信号(图 5b)。同时, 在虎斑乌贼食道上神经团中出现了FMRFamide前体基因较为稀疏的阳性杂交信号(图 5c, 5d), 主要分布在食道上神经团的基叶、垂直叶和嗅叶中, 且以这三个亚叶交界处的信号最为集中。
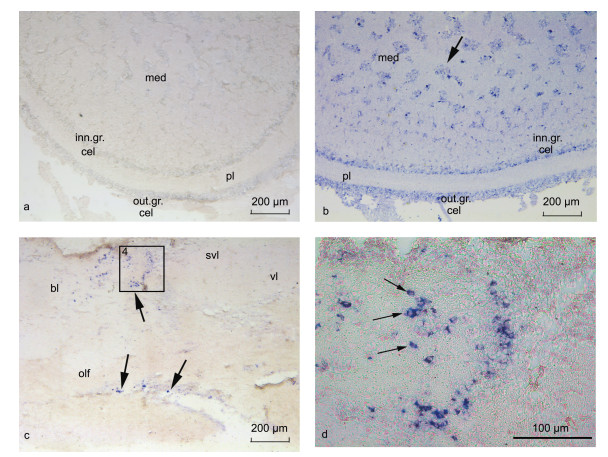 |
| 图 5 SpFMRF前体基因mRNA的视叶和脑的原位杂交定位 Fig. 5 SpFMRFamide precursor gene mRNA localization in brain and optic lobe 注: a. 视叶组织的正义探针对照组; b. 视叶组织的反义探针处理组; c. 食道上神经团的反义探针处理组; d. 图 3中黑色线框所标注区域放大图。蓝色为阳性信号, 标尺在图片右下方显示。缩写: bl (basal lobes): 基叶; svl (subvertical lobe): 亚垂直叶; vl (vertical lobe): 垂直叶; olf (olfactory lobe): 嗅叶; med (medulla): 髓质; out.gr.cel (outer granule cells layer): 外颗粒细胞层; inn.gr.cel (inner granule cells layer): 内颗粒细胞层; pl (plexiform zone): 网织层 |
mRNA在虎斑乌贼视网膜、视叶和脑组织中的原位杂交结果如图 6所示, 与正义探针无任何杂交信号相比(图 6a, 6c), 反义探针孵育后的各组织中能观察到明显的蓝色阳性杂交信号。其中, 视网膜中能观察到较为微弱的蓝色阳性杂交信号, 且阳性信号存在于感光细胞的细胞体部分(图 6b); 视叶组织中也能清晰地观察到SpFaNaC mRNA的阳性杂交信号, 主要分布在深层视网膜的内颗粒细胞层、外细胞颗粒层, 网织层和髓质区域无阳性信号(图 6d); 在脑中也清晰地观察到了大量的阳性杂交信号(图 6e, 6f, 6g, 6h), 杂交信号较多、较强; 主要分布在垂直叶、亚垂直叶、基叶、足叶、嗅叶区域, 且大量的阳性信号同样在这几个亚叶的交界区最为集中。
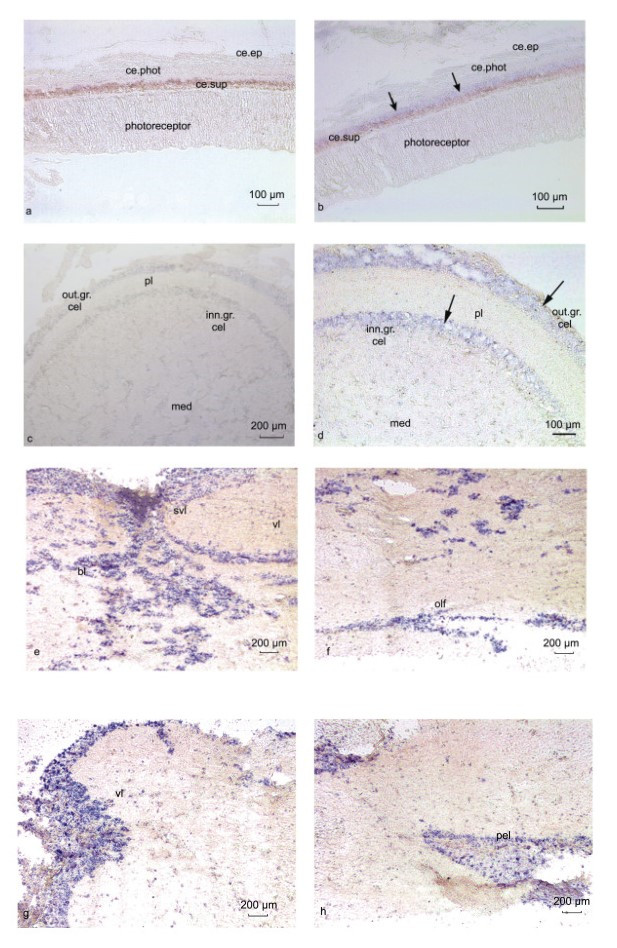 |
| 图 6 SpFaNaC基因mRNA在视网膜、视叶和脑的原位杂交定位 Fig. 6 SpFaNaC mRNA localization in the retina, optic lobe, and brain 注: a. 视网膜正义探针; b. 视网膜反义探针; c. 视叶正义探针; d. 视叶反义探针; e. SpFaNaC mRNA在脑部基叶和亚垂直叶的原位杂交定位; f. SpFaNaC mRNA在脑部嗅叶的原位杂交定位; g. SpFaNaC mRNA在脑部垂直叶的原位杂交定位; h. SpFaNaC mRNA在脑部足叶的原位杂交定位。黑色箭头表示阳性信号(蓝色), 标尺显示在图片右下方。photoreceptor: 感光细胞感受器; ce.phot (photoreceptor cell body part): 感光细胞细胞体; ce.sup (supporting cell): 支持细胞; ce.ep (epithelial): 上皮细胞。med (medulla): 髓质; out.gr.cel (outer granule cells layer): 外颗粒细胞层; inn.gr.cel (inner granule cells layer): 内颗粒细胞层; pl (plexiform zone): 网织层; bl (basal lobes): 基叶; vl (vertical lobe): 垂直叶; svl (subvertical lobe): 亚垂直叶; olf (olfactory lobe): 嗅叶; pel (pedal lobe): 足叶 |
原位杂交实验在转录水平上分析了SpFMRFamide的组织定位, 本实验利用免疫组化技术进一步研究其在蛋白水平上的组织分布定位, 如图 7所示: 与不加anti-FMRFamide抗体的对照中只有蓝色细胞核无任何信号相比(图 7b, 7g), anti-FMRFamide抗体孵育后的视叶组织和食道上神经团明显存在铁锈色的阳性免疫信号。
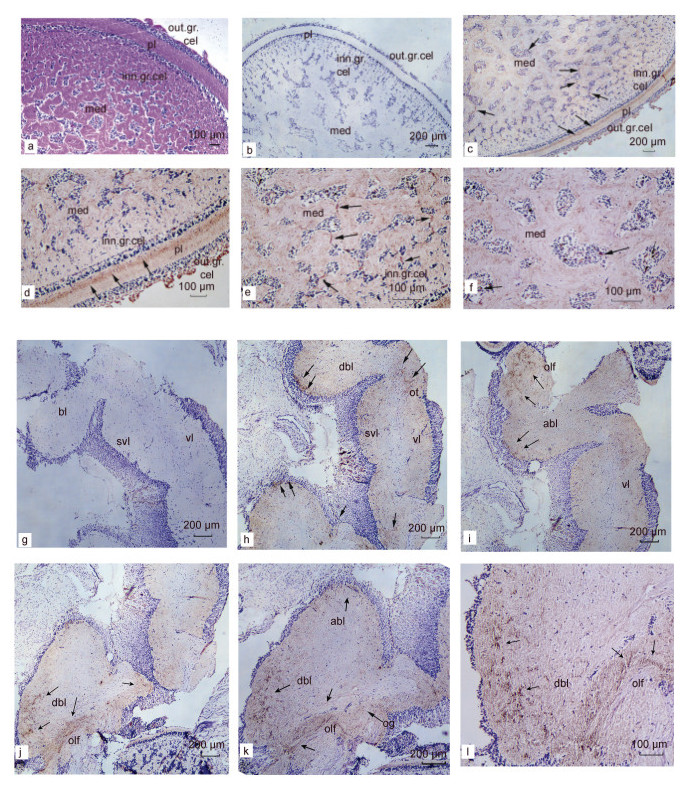 |
| 图 7 虎斑乌贼视叶组织和食道上神经团中FMRFamide分布定位 Fig. 7 FMRFamide distribution in the optic lobe and supraesophageal mass of the brain in S.pharaonis 注: a. 视叶HE染色; b. 视叶对照组; c. 视叶FMRFamide表达; d. 深层视网膜FMRFamide表达; e~f. 视叶髓质FMRFamide表达; g. 食道上神经团对照组; h~l. 食道上神经团FMRFamide表达。黑色箭头表示阳性信号(铁锈色), 细胞核为蓝色, 标尺显示在图片的右下角。med (medulla): 髓质; out.gr.cel (outer granule cells layer): 外颗粒细胞层; inn.gr.cel (inner granule cells layer): 内颗粒细胞层; pl (plexiform zone): 网织层; bl (basal lobes): 基叶; vl (vertical lobe): 垂直叶; svl (subvertical lobe): 亚垂直叶; dbl (dorsal basal lobe): 背基叶; abl (anterior basal lobe): 前基叶; olf (olfactory lobe): 嗅叶; ot (optic tract): 视神经束; og (optic gland): 视腺 |
其中, 在视叶组织的深层视网膜的网织层放射状神经纤维部位检测到了大量的免疫阳性信号(图 7c, 7d), 外细胞颗粒层外缘也有较强的铁锈色阳性免疫信号, 推测此部位可能是视叶组织与脑、视网膜相连接的神经纤维; 在边缘髓质区中存在铁锈色连接成的带状信号分布(图 7e), 在中央髓质区也观察到了零星的阳性免疫信号的分布(图 7f), 可见不规则的阳性免疫反应信号沿传入丛状神经纤维束向各个方向延伸。在脑食道上神经团中主要分布在垂直叶、亚垂直叶、嗅叶、视腺、背基叶和前基叶区域, 其中, 背基叶和嗅叶中的阳性信号密度较高于其他部位, 且这些区域存在的密集阳性信号呈扩散状(图 7h, 7i); 在背基叶和嗅叶两个区域相连接交界区域的阳性信号最为集中, 且呈簇状分布(图 7j, 7k, 7l)。总之, 阳性免疫信号主要集中于不同亚叶的边缘, 在亚叶中心较少或几乎无信号。
3 讨论 3.1 神经肽FMRFamide的内分泌调控作用Wells等1959年证明破坏视叶神经将导致头足类视腺和性腺的增生, 推测视叶和视腺具有抑制生殖系统的发育的调控作用(Wells, 1978)。1998年Le Gall等人提出FMRFamide是抑制腺体活动的活性物质(Le Gall et al, 1988)。本研究中观察到SpFMRFamide前体基因大量表达于视叶中, 在脑组织不同亚叶的交界区域也有少量分布, 推测FMRFamide可能在神经系统中发挥信息传递的作用; 课题组前期的细胞实验研究发现只有FMRFamide与GnRH共同刺激时会抑制卵巢细胞的分泌活动(Zhu et al, 2020), 推测在头足类的生殖调控轴上, FMRFamide与GnRH存在某种未知的相互调控关系, 并且这种调控很可能直接影响生殖过程。
头足类大脑的视觉分析系统位于视叶的深层视网膜, 而与运动和记忆相关的功能区域位于髓质区(Moore, 1919)。1998年, Cosmo和Cristo推测头足类FMRFamide的主要转录表达区位于其食道上神经团的拟柄状区和嗅叶, 并通过FMRFamide参与对生殖的调控(di Cristo et al, 2003)。本研究免疫组化结果观察到FMRFamide的免疫信号大量存在于虎斑乌贼视叶的网织层、髓质区, 而这些信号终止于外颗粒细胞层; 在视叶外缘的视神经束也有强烈的阳性信号。FMRFamide前体在虎斑乌贼视叶和嗅叶中的高度表达为支持头足类通过视觉系统来调控FMRFamide的分泌, 进而通过FMRFamide调控相应生理功能这些观点提供了有效支撑。Saidel(1982)研究证实了头足类中存在开始于嗅叶终止于深层视网膜的神经纤维, 可能这些来自视叶的神经纤维一直将信号传递给了视网膜; 此外, 头足类嗅叶的后小叶和中小叶中存在若干FMRFamide免疫反应阳性的神经细胞(di Cristoet al, 2003), di Cristo等(2003)也同样推测视叶中的神经肽FMRFamide来源于嗅叶, 这些报道与本研究中脑组织的背基叶和嗅叶中存在大量阳性免疫信号, 尤其在这两个亚叶的组织交接区的结果相似。然而, 我们的研究并不完全支持这一观点, 本研究利用原位杂交和免疫组化技术检测到SpFMRFamide在视叶中的表达显著高于在嗅叶中的表达。头足类的嗅叶一直被认为是化学感受器官中的嗅觉器官(Bolshakov et al, 2002; Brockway et al, 2002), 来自嗅叶和拟柄状区的全部信息被输入到视网膜, 进而调节感光细胞的活性。
据报道, 在软体动物中, FMRFamide可以引起心脏兴奋和心脏抑制, 调节中枢神经系统内的突触传递, 调节内脏和躯体肌肉, 调节唾液腺, 并在肾脏的渗透调节中发挥作用(Khan et al, 1998), 并且FMRFamide可以通过作用于心脏动脉瓣膜来调节血淋巴的分布(Mercier et al, 2003)。FaRPs在扇贝中刺激淀粉酶的分泌并且调节渗透压, 有研究证明在蛭类中FMRFamide充当抗利尿激素(Krajniak, 2005)。FMRFamide参与动物体的消化、生殖和渗透压调节等多项生理活动, 其具体调控方式还需进一步研究。
3.2 FaNaC介导的生理调控作用到目前为止, 尚未描述FaNaC相互作用蛋白, 有趣的是, 散大蜗牛FaNaC (HaFaNaC)的C末端与I型PDZ结合基(S/T-x-V/L)具有同源性(Songyang et al, 1997), 推测FaNaC可能与含PDZ域的蛋白质互作。本研究中SpFaNaC在脑和视叶中有极高的表达, 在视叶的深层视网膜、食道上神经团的各叶都有SpFaNaC的阳性表达。HaFaNaC (Lingueglia et al, 1995)和静水椎实螺FaNaC (LsFaNaC) (Perry et al, 2001)在神经系统中和足肌中被检测到, 并且LsFaNaC显然比HaFaNaC分布更广泛。但是, 海兔免疫组化结果表明该蛋白只在少量神经元细胞表达, 此结果与电生理实验结果只有少量神经元细胞具有依赖Na+的快速兴奋性反应相一致(Davey et al, 2001); 在哺乳动物细胞(Belkin et al, 1993)和非洲爪蟾(Xenopus laevis)卵母细胞(Lingueglia et al, 1995)中异源表达FaNaC的生理特性类似于散大蜗牛的C2神经元所表现的FMRFamide离子通道特性(Green et al, 1994)。Davey等的原位杂交结果显示智利螺旋蜗牛(Helisoma trivolvis)的C2神经元和散大蜗牛足神经节中的多巴胺神经元中也存在FaNaC阳性表达(Davey et al, 2001), 表明GDN与FMRFamide神经元之间可能存在互作关系。
FMRFamide与FaNaC互作引起细胞的快速去极化。FMRFamide对FaNaC的作用与其他突触或神经元配体-门控通道的激活相类似, 表达FMNa酰胺的神经元存在于富含FMRFamide的神经节中(Davey et al, 2001), 因此, 被FMRFamide激活的通道也许会在含有FMRFamide的神经元形成的连接处参与突触的迅速传递; GDN的电生理实验表明, FaNaC可能在突触传递的终末过程中发生(Davey et al, 2001), 然而, FaNaC参与的突触生理学仍有待进一步实验验证。在前期研究中, 电生理实验证实加州海兔(Ruben et al, 1986; Belkin et al, 1993)、静水椎实螺(Skingsley et al, 1993; Perry et al, 2001)的神经元受到FMRFamide刺激时会通过激活钠离子通道的方式快速去极化; FaNaCs在各类神经元中都有表达, FMRFamide是FaNaCs的激活剂, 阿米洛利能抑制FMRFamide诱导的电流能, 而且这个影响的过程不受GPCR的活化, 同时, FMRFamide还可以调控ASICs酸电流(Kellenberger et al, 2015; Vick et al, 2015)。FMRFamide能够显著提高亮大蜗牛离体脑神经节NO的合成水平, 而FaNaC的抑制剂盐酸阿米洛利能够显著降低其产NO的水平, 说明在神经系统产NO的通路中, FMRFamide可以通过激活FaNaC将信号转导进入细胞内促进NO的产生(Röszer et al, 2004)。以上结果表明FMRFamide与Na+通道受体存在相互调控关系, 两者具体互作方式有待进一步研究。
4 结论本研究利用同源克隆和RACE技术获得了虎斑乌贼神经肽FMRFamide的Na+通道受体(SpFaNaC)的cDNA全长序列, 采用序列分析探讨其与头足纲、腹足纲和双壳纲的相似性。采用qRT-PCR检测到SpFaNaC主要分布在中枢神经系统的脑和视叶, 并进一步采用ISH对其在脑、视叶和视网膜进行了定位。同时, 采用ISH和IHC技术观察到神经肽FMRFamide主要分布在视叶的中央髓质区、边缘髓质区、内细胞颗粒层和外细胞颗粒层。
朱阳, 2020. 虎斑乌贼两种FMRFamide受体基因的克隆和FMRFamide功能研究初探[D]. 舟山: 浙江海洋大学.
|
郑小东, 林祥志, 王昭凯, 等, 2010. 日本无针乌贼全人工养殖条件下生活史研究. 海洋湖沼通报, (3): 24-28 DOI:10.3969/j.issn.1003-6482.2010.03.004 |
蒋霞敏, 符方尧, 李正, 等, 2008. 人工养殖曼氏无针乌贼生殖系统的解剖学与组织学研究. 中国水产科学, 15(1): 63-72 DOI:10.3321/j.issn:1005-8737.2008.01.008 |
BELKIN K J, ABRAMS T W, 1993. FMRFamide produces biphasic modulation of the LFS motor neurons in the neural circuit of the siphon withdrawal reflex of Aplysia by activating Na+ and K+ currents. Journal of Neuroscience, 13(12): 5139-5152 DOI:10.1523/JNEUROSCI.13-12-05139.1993 |
BOLSHAKOV K V, ESSIN K V, BULDAKOVA S L, et al, 2002. Characterization of acid-sensitive ion channels in freshly isolated rat brain neurons. Neuroscience, 110(4): 723-730 DOI:10.1016/S0306-4522(01)00582-6 |
BROCKWAY L M, ZHOU Z H, BUBIEN J K, et al, 2002. Rabbit retinal neurons and glia express a variety of ENaC/DEG subunits. American Journal of Physiology: Cell Physiology, 283(1): C126-C134 DOI:10.1152/ajpcell.00457.2001 |
CAO Z H, SUN L L, CHI C F, et al, 2016. Molecular cloning, expression analysis and cellular localization of an LFRFamide gene in the cuttlefish Sepiella japonica. Peptides, 80: 40-47 DOI:10.1016/j.peptides.2015.10.005 |
COSCOY S, LINGUEGLIA E, LAZDUNSKI M, et al, 1998. The Phe-Met-Arg-Phe-amide-activated sodium channel is a tetramer. Journal of Biological Chemistry, 273(14): 8317-8322 DOI:10.1074/jbc.273.14.8317 |
DAVEY F, HARRIS S J, COTTRELL G A, 2001. Histochemical localisation of FMRFamide-gated Na+ channels in Helisoma trivolvis and Helix aspersa neurones. Journal of Neurocytology, 30(11): 877-884 DOI:10.1023/A:1020656915810 |
DI COSMO A, DI CRISTO C D, 1998. Neuropeptidergic control of the optic gland of Octopus vulgaris: FMRF-amide and GnRH immunoreactivity. Journal of Comparative Neurology, 398(1): 1-12 DOI:10.1002/(SICI)1096-9861(19980817)398:1<1::AID-CNE1>3.0.CO;2-5 |
DI CRISTO C, BOVI P D, DI COSMO A, 2003. Role of FMRFamide in the reproduction of Octopus vulgaris: molecular analysis and effect on visual input. Peptides, 24(10): 1525-1532 DOI:10.1016/j.peptides.2003.07.018 |
DOCKRAY G J, 2004. The expanding family of -RFamide peptides and their effects on feeding behaviour. Experimental Physiology, 89(3): 229-235 DOI:10.1113/expphysiol.2004.027169 |
DOMINGUES P M, SYKES A, ANDRADE J P, 2002. The effects of temperature in the life cycle of two consecutive generations of the cuttlefish Sepia officinalis (Linnaeus, 1758), cultured in the Algarve (South Portugal). Aquaculture International, 10(3): 207-220 DOI:10.1023/A:1022148802078 |
DURWARD R D, VESSEY E, O'DOR R K, 1980. Reproduction in the squid, Illex illecebrosus: first observations in captivity and implications for the life cycle. Journal of Northwest Atlantic Fishery Science, (6): 7-13 |
ESPINOZA E, CARRIGAN M, THOMAS S G, et al, 2000. A statistical view of FMRFamide neuropeptide diversity. Molecular Neurobiology, 21(1/2): 35-56 |
FURUKAWA Y, MIYAWAKI Y, ABE G, 2006. Molecular cloning and functional characterization of the Aplysia FMRFamide- gated Na+ channel. Pflügers Archiv, 451(5): 646-656 DOI:10.1007/s00424-005-1498-z |
GREEN K A, FALCONER S W P, COTTRELL G A, 1994. The neuropeptide Phe-Met-Arg-Phe-NH2 (FMRFamide) directly gates two ion channels in an identified Helix neurone. Pflügers Archiv, 428(3/4): 232-240 |
GUAN Z H, KIM J H, LOMVARDAS S, et al, 2003. P38 MAP kinase mediates both short-term and long-term synaptic depression in Aplysia. Journal of Neuroscience, 23(19): 7317-7325 DOI:10.1523/JNEUROSCI.23-19-07317.2003 |
KELLENBERGER S, SCHILD L, 2015. International Union of Basic and Clinical Pharmacology. XCI. structure, function, and pharmacology of acid-sensing ion channels and the epithelial Na+ channel. Pharmacological Reviews, 67(1): 1-35 DOI:10.1124/pr.114.009225 |
KHAN H R, PRICE D A, DOBLE K E, et al, 1998. FMRFamide-related peptides, partial serotonin depletion, and osmoregulation in Helisoma duryi (Mollusca: Pulmonata). Journal of Comparative Neurology, 393(1): 25-33 DOI:10.1002/(SICI)1096-9861(19980330)393:1<25::AID-CNE3>3.0.CO;2-S |
KRAJNIAK K G, 2005. Annelid endocrine disruptors and a survey of invertebrate fmrfamide-related peptides. Integrative and Comparative Biology, 45(1): 88-96 DOI:10.1093/icb/45.1.88 |
LE GALL S, FÉRAL C, VAN MINNEN J, et al, 1988. Evidence for peptidergic innervation of the endocrine optic gland in Sepia by neurons showing FMRFamide-like immunoreactivity. Brain Research, 462(1): 83-88 DOI:10.1016/0006-8993(88)90588-4 |
LI M J, WANG M, WANG W L, et al, 2019. The immunomodulatory function of invertebrate specific neuropeptide FMRFamide in oyster Crassostrea gigas. Fish & Shellfish Immunology, 88: 480-488 |
LINGUEGLIA E, CHAMPIGNY G, LAZDUNSKI M, et al, 1995. Cloning of the amiloride-sensitive FMRFamide peptide-gated sodium channel. Nature, 378(6558): 730-733 DOI:10.1038/378730a0 |
MARTIN R, VOIGT K H, 1987. The neurosecretory system of the Octopus vena cava: a neurohemal organ. Experientia, 43(5): 537-543 DOI:10.1007/BF02143582 |
MERCIER A J, FRIEDRICH R, BOLDT M, 2003. Physiological functions of FMRFamide-like peptides (FLPs) in crustaceans. Microscopy Research and Technique, 60(3): 313-324 DOI:10.1002/jemt.10270 |
MOORE A R, 1919. The selective action of nicotine on the central nervous system of the squid, Loligo pealii. Journal of General Physiology, 1(5): 505-508 DOI:10.1085/jgp.1.5.505 |
PERRY S J, STRAUB V A, SCHOFIELD M G, et al, 2001. Neuronal expression of an FMRFamide-gated Na+ channel and its modulation by acid pH. Journal of Neuroscience, 21(15): 5559-5567 DOI:10.1523/JNEUROSCI.21-15-05559.2001 |
PRICE D A, GREENBERG M J, 1977. Structure of a molluscan cardioexcitatory neuropeptide. Science, 197(4304): 670-671 DOI:10.1126/science.877582 |
RÖSZER T, JENEI Z, GÁLL T, et al, 2004. A possible stimulatory effect of FMRFamide on neural nitric oxide production in the central nervous system of Helix lucorum L.. Brain, Behavior and Evolution, 63(1): 23-33 DOI:10.1159/000073757 |
RÖSZER T, KAPPELMAYER J, NAGY G G et al, 2006. The neuropeptide FMRFamide can protect cells against apoptosis in the snail digestive gland. Apoptosis, 11(2): 173-182 DOI:10.1007/s10495-006-3391-4 |
RŐSZER T, KISS-TÓTH É D, 2014. FMRF-amide is a glucose- lowering hormone in the snail Helix aspersa. Cell and Tissue Research, 358(2): 371-383 DOI:10.1007/s00441-014-1966-x |
RUBEN P, JOHNSON J W, THOMPSON S, 1986. Analysis of FMRF-amide effects on Aplysia bursting neurons. Journal of Neuroscience, 6(1): 252-259 DOI:10.1523/JNEUROSCI.06-01-00252.1986 |
SAIDEL W M, 1982. Connections of the octopus optic lobe: an HRP study. Journal of Comparative Neurology, 206(4): 346-358 DOI:10.1002/cne.902060403 |
SALZET M, BULET P, WATTEZ C, et al, 1994. FMRFamide- related peptides in the sex segmental ganglia of the Pharyngobdellid leech Erpobdella octoculata: identification and involvement in the control of hydric balance. European Journal of Biochemistry, 221(1): 269-275 DOI:10.1111/j.1432-1033.1994.tb18738.x |
SKINGSLEY D R, BRIGHT K, SANTAMA N, et al, 1993. A molecularly defined cardiorespiratory interneuron expressing SDPFLRFamide/GDPFLRFamide in the snail Lymnaea: monosynaptic connections and pharmacology. Journal of Neurophysiology, 69(3): 915-927 DOI:10.1152/jn.1993.69.3.915 |
SONGYANG Z, FANNING A S, FU C, et al, 1997. Recognition of unique carboxyl-terminal motifs by distinct PDZ domains. Science, 275(5296): 73-77 DOI:10.1126/science.275.5296.73 |
VAN HEUKELEM W F, 1976. Growth, bioenergetics and life-span of Octopus cyanea and Octopus maya [D]. Honolulu, USA: University of Hawaii: 3-5.
|
VICK J S, ASKWITH C C, 2015. ASICs and neuropeptides. Neuropharmacology, 94: 36-41 DOI:10.1016/j.neuropharm.2014.12.012 |
WELLS M J, 1978. Octopus: physiology and behaviour of an advanced invertebrate. London: Chapman and Hall
|
ZHENG L B, QIU J Y, CHEN J, et al, 2020. Histopathological changes and piscidin 5-like location in infected Larimichthys crocea with parasite Cryptocaryon irritans. Fish & Shellfish Immunology, 99: 52-58 |
ZHU Y, SUN L L, WU J H, et al, 2020. An FMRFamide neuropeptide in cuttlefish Sepia pharaonis: Identification, characterization, and potential function. Molecules, 25(7): 1636 DOI:10.3390/molecules25071636 |
 2023, Vol. 54
2023, Vol. 54


