
中国海洋湖沼学会主办。
文章信息
- 钟爱华, 王迎宾, 毕澜方, 徐浩磊. 2023.
- ZHONG Ai-Hua, WANG Ying-Bin, BI Lan-Fang, XU Hao-Lei. 2023.
- 溶藻弧菌体外刺激泥蚶(Tegillarca granosa)血细胞后早期转录组研究
- THE TRANSCRIPTOMIC ANALYSIS OF IN VITRO HEMOCYTES OF BLOOD CLAM (TEGILLARCA GRANOSA) CHALLENGED WITH VIBRIO ALGINOLYTICUS
- 海洋与湖沼, 54(1): 286-295
- Oceanologia et Limnologia Sinica, 54(1): 286-295.
- http://dx.doi.org/10.11693/hyhz20220500123
文章历史
-
收稿日期:2022-05-10
收修改稿日期:2022-07-21
贝类没有淋巴细胞介导的特异性体液免疫和细胞免疫, 只有以血细胞为基础的固有免疫, 贝类血细胞能吞噬外源性或内源性抗原, 还能产生各种非特异性体液因子参与宿主免疫防御。吞噬后的病原主要通过两条途径被杀伤, 第一条途径是吞噬小体与含有水解酶的溶酶体融合, 水解消化病原微生物, 包拉米虫感染后欧洲扁牡蛎(Ostrea edulis)血细胞中多种水解酶活力上升(Xue et al, 2000); 第二条途径是通过呼吸暴发激活细胞膜上的NADPH氧化酶, 从而产生大量活性氧来杀灭病原微生物。
近年来, 随着高通量转录组测序技术的应用, 对特定组织、器官mRNA进行全貌分析成为可能。通过对特定组织或器官所表达的mRNA分析, 能明确细胞内的调控网络及分子机制。目前, 转录组测序已应用于鱼类、虾蟹类和贝类, 如环境适应机制、免疫反应机制研究。Zhao等(2015)研究了盐度胁迫下凡纳滨对虾血细胞转录组, 发现差异表达基因涉及免疫信号通路、细胞凋亡和能量代谢等。Hu等(2022)研究了溶解氧和温度对硬壳蛤(Mercenaria mercenaria)鳃转录组影响, 发现内质网蛋白质加工和泛素介导的蛋白质水解在响应低氧和高温胁迫中发挥重要作用。Ren等(2021)通过转录组测序, 获得了菲律宾蛤仔的Toll样受体种类及其对溶藻弧菌的响应特征。
溶藻弧菌(Vibrio alginolyticus)属弧菌科、弧菌属, 是一种短杆状革兰氏阴性菌, 无荚膜和芽孢, 与哈维氏弧菌、副溶血弧菌并称海洋三大优势弧菌, 其中溶藻弧菌居首, 是海洋中常见的条件致病菌。泥蚶(Tegillarca granosa)属软体动物门(Mollusca)、双壳纲(Bivalvia)、列齿目(Taxodonta)、蚶科(Arcidae), 是我国传统养殖贝类。统计显示2015年以来我国蚶类养殖总面积约4.534万hm2, 总产量约417.31万t。随着泥蚶养殖规模的扩大, 病害问题日益突出, 当外界条件不良或生物本身抵抗力下降时, 往往能引发弧菌病流行, 近年来多地养殖泥蚶大量死亡, 弧菌病是导致死亡的重要原因。弧菌性疾病轻则影响泥蚶产量, 重则导致泥蚶大量死亡, 造成巨大经济损失, 使泥蚶养殖业面临挑战, 因此开展泥蚶抗病机制研究十分必要。血细胞是泥蚶免疫防御的主要执行者, 细菌入侵后, 血细胞会对入侵者做出反应以清除细菌。目前有关泥蚶研究主要集中在养殖技术、病害防治以及功能基因克隆等方面(李太武等, 2003; 朱泽闻等, 2011; 许家辉等, 2018), 溶藻弧菌入侵后泥蚶血细胞mRNA表达量变化规律研究较少, 本文拟研究溶藻弧菌体外刺激泥蚶血细胞后早期转录组动态变化, 明确泥蚶免疫反应的分子途径, 以确定有助于改善泥蚶健康状况和降低死亡率的免疫性能标记, 探索泥蚶免疫应答的分子机制, 以期为泥蚶抗病机理研究奠定理论基础。
1 材料与方法 1.1 样本准备实验用泥蚶来自浙江省舟山市南珍市场, 选择反应迅速、贝壳完整的泥蚶, 运回实验室暂养5 d。暂养结束后, 随机选30个大小近似一致的泥蚶, 每15个泥蚶一组, 用无菌解剖刀小心割开闭壳肌后, 用无菌注射器从外套腔中小心抽取血淋巴置于无菌离心管中, 每组取10 mL血淋巴, 1 000 r/min离心3 min后, 去上清液, 用10 mL无菌Hanks液(NaCl: 8 g/L, Na2HPO4·12H2O: 0.126 g/L; KH2PO4: 0.068 g/L, KCl: 0.48 g/L, MgSO4: 0.098 8 g/L, CaCl2: 0.148 g/L, D-葡萄糖: 18 g/L, NaHCO3: 0.358 g/L)重悬浮。
实验用溶藻弧菌为CICC21664标准菌株, 将菌株划线接种在TCBS培养基上, 37 ℃培养24 h后, 挑取形态特征一致的菌落, 用无菌Hanks液制成悬浮液后, 调整细菌密度至5×1010 CFU/mL。每组血淋巴中加入100 μL溶藻弧菌悬浮液, 混匀后, 混合液置于25 ℃培养箱中孵育。一组于孵育0 h、3 h和6 h取混合液1 mL, 置于无菌离心管中, 1 000 r/min离心3 min后, 去上清液, 向沉淀中加入2 mL Trizol (Invitrogen, CA, USA)裂解液, 用移液器反复吹打裂解液, 直到无明显细胞团块, 室温静置5 min, 待细胞完全裂解后保存于–80 ℃超低温冰箱中用于转录组测序。一组用于血细胞染色观察。
1.2 RNA提取、cDNA文库构建与测序总RNA提取按照Trizol® Reagent试剂盒操作步骤进行, 获得的总RNA用RNA 1000 Nano LabChip Kit试剂盒(Agilent, CA, USA)和Bioanalyzer 2100进行定性定量检测, 选取高质量RNA (浓度≥200 ng/μL, OD260/OD280在1.8~2.2, 总量≥5 μg, RIN > 9.0)进行文库构建。提取的总RNA用包含Oligo(dT)的磁珠富集mRNA, 然后用片段化试剂(Fragmentation Buffer)将富集的mRNA随机打断成短片段, 以短片段mRNA为模板, 用六碱基随机引物(Random hexamers)合成cDNA第一链, 随后加入RNaseH、dNTPs、DNA Polymerase I和缓冲液合成二链cDNA, 加入End Repair Mix将双链的cDNA修复成平末端, 然后在3’端加上碱基A并加上接头。获得的cDNA进行PCR扩增, 共15个循环, 扩增试剂盒为Sample Preparation Kit (Illumina, San Diego, CA), 扩增产物用1%琼脂糖电泳后, 回收200~300 bp的条带, 用TBS380 (Picogreen)定量检测后, 进行高通量测序, 测序平台为Illumina HiSeq NovaSeq 6000, 测序读长为双端PE150。
1.3 转录组de novo组装测序获得的原始数据(Raw Date)使用Fastp去除reads中的接头序列, 去除没有插入片段的reads, 修剪掉序列3’末端质量值小于20的碱基, 若修剪后的序列仍有质量值小于10的碱基, 则整条序列去除, 否则保留, 去除含模块碱基N的reads, 舍弃质量修剪以及去除接头后长度小于30 bp的序列, 剩余序列用于后续分析。过滤后的数据(Clean reads), 用Trinity软件从头进行组装, 首先将reads拼接为长片段contigs, 去除冗余后将contigs分组, 然后将contigs连接成两端不能再延长的片段即为Unigenes。
1.4 基因功能注释NCBI-NR (http://www.ncbi.nlm.nih.gov/)和Swiss- Prot (https://www.uniprot.org/)数据库注释分析采用DIAMOND (Buchfink et al, 2015)软件, 期望值为E < 1e-5; 使用BLAST2GO、HMMER3NR和KOBAS软件在GO (http://www.geneontology.org)、Pfam (http://pfam.xfam.org/)和KEGG (http://www.genome.jp/kegg/)数据库中进行比对, 对Unigenes信息进行注释。
1.5 差异表达基因分析先采用RSEM软件将质控后的Clean reads数据与组装的Unigene序列进行比对, 获得Unigene的read数目, 然后计算每百万读段中来自于某转录本的读段数TPM (Transcripts Per Kilobase Million), 确定Unigene的表达量。使用R软件中的DEGseq包筛选差异表达基因, 差异表达基因选择标准为多重检验矫正后的P-adjust值< 0.001且|log2Fold Change| > 1。采用KOBAS软件进行差异表达基因KEGG通路富集分析。
1.6 血涂片染色溶藻弧菌和泥蚶血细胞孵育后0、1、3、6和24 h, 取血细胞制作血涂片, 制作的血涂片采用瑞氏吉姆萨染色液(南京建成)染色, 染色方法参考说明书稍作修改, 具体为染色液A液染色1 min, 然后加B液染色8 min, 染色完成后水洗, 晾干后显微镜下观察, 10×100倍下采用佳能数码相机拍照。
2 结果 2.1 测序数据质控和组装在0 h、3 h和6 h, 泥蚶血细胞中分别获得7.11 G、7.01 G和6.96 G原始数据(raw bases), 经修剪、过滤不合格序列后, 三个时间点有效数据(clean bases)分别为6.81 G、6.71 G和6.67 G, 有效序列(clean reads)分别为45 984 396、45 465 728和45 249 166条, 有效序列Q20质量得分为97.99%、97.85%和97.53%, Q30得分为93.85%、93.63%和93.02%, GC含量为41.55%、40.97%和40.43%。
获得的有效序列经从头组装后, 共获得24 456个Unigenes, 最长Unigene长度为17 988 bp, 最短Unigene长度为201 bp, N50长度为879 bp。
2.2 基因功能注释组装后的Unigenes分别比对到NR、Swiss-Prot、Pfam、GO和KEGG五个数据库, 10 649个基因在五个数据库中获得注释, 注释率为43.54% (图 1)。比对结果显示, 10 402个Unigenes与NR数据库中已知基因同源, 其中18.45%序列与欧洲扇贝(Pecten maximus)同源、16.30%序列与虾夷扇贝(Mizuhopecten yessoensis)同源、10.67%序列与太平洋牡蛎(Crassostrea gigas)同源(图 2), 89%序列相似度高于60%, 其中49.68%序列相似度在80%~100%, 40.99%序列相似度在60%~80%。
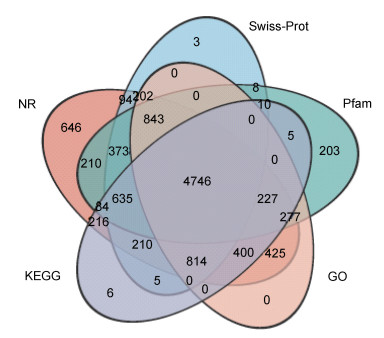 |
| 图 1 Unigenes注释信息 Fig. 1 The Venn diagram of the Unigenes annotated in five databases |
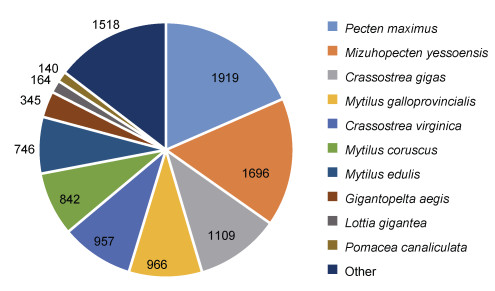 |
| 图 2 Unigenes同源性分析 Fig. 2 The homology analysis of Unigenes |
为了解泥蚶血细胞中表达基因和蛋白功能, 将24 456个Unigenes在GO数据库中进一步比对分析, 7 934个Unigenes在GO数据库中获得注释, 这些基因被归为“生物学过程”、“细胞成分”和“分子功能”三类, 细胞过程(3 129个Unigenes)、细胞组分(3 517个Unigenes)和结合(3 972个Unigenes)是三大类中包含Unigenes最多的次级GO类别(图 3)。
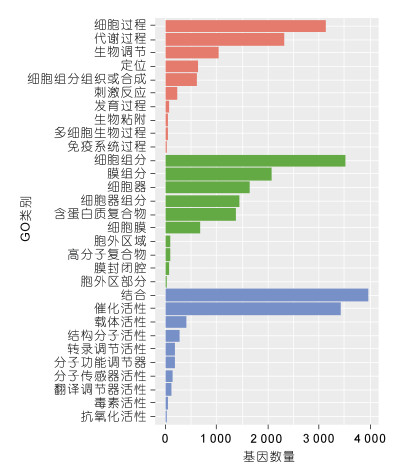 |
| 图 3 基因GO功能注释 Fig. 3 The GO functional classification of Unigenes in hemocyte 注: 红色为生物学过程类别, 绿色为细胞成分类别, 蓝色为分子功能类别 |
根据KEGG数据库比对结果, 可将7 358个Unigenes分为5个分支33个二级通路, 包含Unigenes最多的二级通路是信号转导(942个Unigenes), 其次是运输和分解代谢(640个Unigenes)。
2.3 差异表达基因分析基因表达丰度按照TPM来计算, 获得表达丰度后, 采用DEGseq软件进行差异表达分析, 差异表达基因筛选标准为P-adjust < 0.001且|log2(FoldChange)| > 1。溶藻弧菌和泥蚶血细胞孵育3 h, 1 790个基因表达发生显著改变, 包括1 319个上调基因和471个下调基因; 孵育6 h (与0 h相比), 3 183个基因表达发生显著改变, 包括2 629个上调基因和554个下调基因(图 4)。
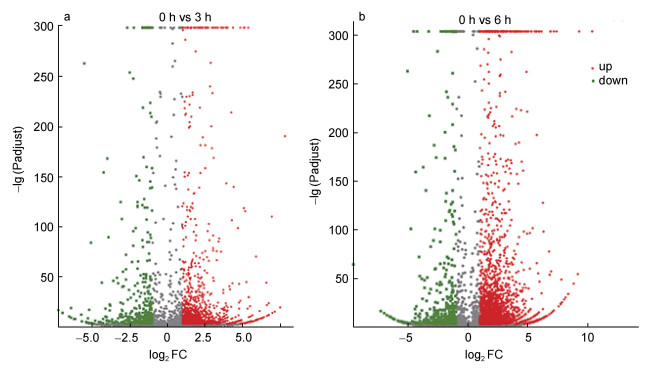 |
| 图 4 溶藻弧菌刺激后泥蚶血细胞中差异表达基因火山图 Fig. 4 Volcano plot of DEGs identified from 3 h and 6 h in hemocyte after V. alginolyticus challenge 注: a. 刺激3 h和0 h相比差异表达基因火山图; b. 刺激6 h和0 h相比差异表达基因火山图 |
与0 h相比, 1 113个基因在3 h和6 h时均上调, 其中254个基因3 h表达量显著高于0 h且6 h表达量显著高于3 h, 表达量持续上调; 205个基因在3 h时上调6 h无显著变化, 1 516个基因在3 h无显著变化但在6 h时上调。与0 h相比, 267个基因在3 h和6 h时均下调, 其中8个基因表达量持续下调, 204个基因在3 h时下调6 h无变化, 286个基因在3 h时无变化6 h时发生下调; 另有1个基因3 h时上调而6 h时下, 部分差异表达基因列于表 1。
| 基因ID | NR描述 | log2FC (3 h/0 h) |
log2FC (6 h/0 h) |
log2FC (6 h/3 h) |
| TRINITY_DN389_c0_g1 | Vitrin-like | 5.14 | 7.44 | 2.99 |
| TRINITY_DN2700_c0_g1 | Immediate early response gene 5-like protein | 1.75 | 2.84 | 1.01 |
| TRINITY_DN37_c0_g1 | Myophilin | 3.08 | 4.36 | 1.28 |
| TRINITY_DN473_c0_g1 | Ras-related protein Rab-7a | 2.07 | 3.59 | 1.52 |
| TRINITY_DN834_c0_g1 | Matrix metalloproteinase | 2.62 | 4.44 | 1.82 |
| TRINITY_DN395_c0_g3 | Heat shock protein 70 B2-like | 1.13 | 1.31 | –0.02 |
| TRINITY_DN8111_c0_g3 | Cell growth-regulating nucleolar protein-like | 1.16 | 1.23 | 0.08 |
| TRINITY_DN22632_c0_g1 | Elongation factor 1 alpha | –1.04 | –1.66 | 0.63 |
| TRINITY_DN6184_c0_g1 | Apoptosis-inducing factor 1 | –2.05 | –3.42 | –1.37 |
| TRINITY_DN805_c0_g1 | AIF1 | –2.51 | –4.52 | –2.02 |
根据KEGG数据库注释信息, 进一步分析了差异表达基因通路富集, 通路显著富集的标准为矫正后的P值(P-adjust) < 0.05, P-adjust越小, 富集越显著。结果显示, 3 h时1 790个差异表达基因共富集到226条通路上, 其中25条KEGG通路显著富集, 富集程度最高的三条通路为吞噬体、细胞凋亡和局部黏附(图 5)。富集到吞噬体通路的25个差异表达基因中13个基因上调12个基因下调, 在吞噬过程中发挥重要作用的丝状肌动蛋白、Ras相关蛋白Rab-5B、Syntaxin7/13/18在3 h样本中表达丰度升高5倍以上, 囊泡转运蛋白SEC22和钙网蛋白等基因上调, 微管蛋白α和β下调。富集到细胞凋亡通路的31个基因中25个上调6个下调, 细胞凋亡通路关键基因肿瘤坏死因子超家族成员10、组织蛋白酶Z、Fas相关死亡结构域蛋白、凋亡调控蛋白Bcl-2、半胱氨酸蛋白酶7等均上调, 凋亡诱导因子1等下调。局部黏附通路中有32个基因上调5个基因下调, 基质蛋白2、Vitrin蛋白、Ras基因家族成员Q、局部黏附激酶1等基因均上调, β-连环蛋白等下调。胞吞通路中有33个基因上调4个基因下调, 低密度脂蛋白受体结合蛋白、囊泡蛋白分类相关蛋白37、带电多泡体蛋白1/2/4、热休克蛋白70等基因均上调。
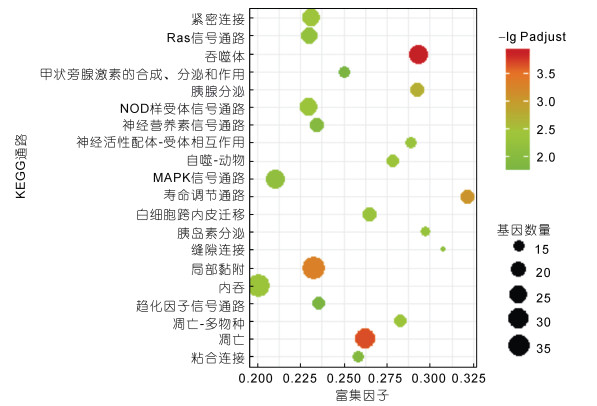 |
| 图 5 溶藻弧菌刺激3h时差异基因KEGG富集图(仅示前20条富集通路) Fig. 5 KEGG enrichment for the DEGs at 3h after V. alginolyticus challenge (top 20 pathways) |
3 183个在6 h时差异表达基因共富集到245条KEGG通路, 差异显著的富集通路有34条, 富集程度最高的三条通路为蛋白酶体、细胞凋亡和内质网蛋白加工(图 6)。富集到蛋白酶体通路的上调基因有25个, 无下调基因, 蛋白酶活化剂700 (PA700)的多个亚基均上调, 20S蛋白酶体α1、α2、α3、α4、α5、α6、α7、β1、β2、β4、β6和β7亚基均上调。富集到细胞凋亡通路的基因有52个, 上调基因45个, 下调基因7个, Caspase蛋白2在6 h时上调, 肿瘤坏死因子超家族成员10和组织蛋白酶Z表达丰度显著高于3 h, 凋亡诱导因子1下调但与3 h时相比无显著差异。29个上调基因和8个下调基因富集到吞噬体通路, 囊泡相关膜蛋白3、溶酶体相关膜蛋白1/2、组织蛋白酶L1等在6 h时上调, 微管蛋白α和β表达丰度与3 h时无差异。51个上调基因和5个下调基因富集到内质网蛋白加工通路, 其中内质网相关降解途径中的多个蛋白如Derlin-1等上调。52个上调基因和4个下调基因富集到胞吞通路, 部分上调基因与3 h时无差别, 但表皮生长因子受体、吞蛋白A3、囊泡蛋白分类相关蛋白22/25/28/36/、带电多泡体蛋白5等在6 h时发生上调。
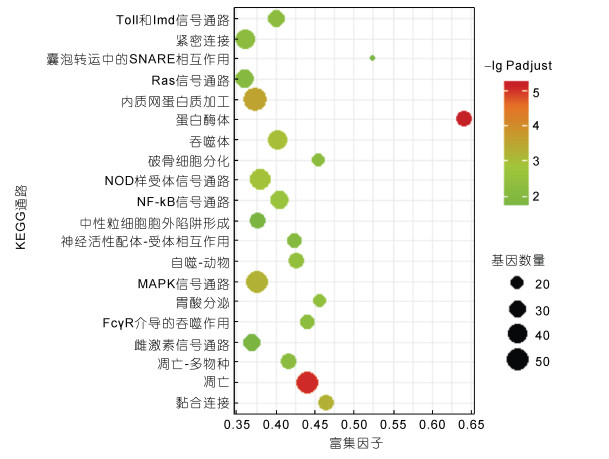 |
| 图 6 溶藻弧菌刺激6h时差异基因KEGG富集图(仅示前20条富集通路) Fig. 6 KEGG enrichment for the DEGs at 6h after V. alginolyticus challenge (top 20 pathways) |
另外, 溶酶体水解酶α-N-乙酰半乳糖胺酶、α-半乳糖苷酶和抗酒石酸酸性磷酸酶5表达丰度在3 h时和6 h时持续上调, 6 h时β-半乳糖苷酶、α-葡萄糖苷酶、α-l-岩藻糖苷酶、N-乙酰氨基半乳糖-6-硫酸酯酶、N-巯基葡萄糖胺巯基水解酶和酸性神经酰胺酶等上调; Sialin在3 h和6 h下调, 但3 h和6 h时表达丰度变化不显著。MAPK通路中重要基因丝裂原活化蛋白激酶激酶4持续上调, 6 h时丝裂原活化蛋白激酶激酶3/6均上调。
2.5 血细胞染色观察泥蚶血细胞主要由红色颗粒细胞、嗜碱性颗粒细胞和无色透明细胞组成, 红色颗粒细胞数量最多且具有吞噬活性, 嗜碱性颗粒细胞较少也能吞噬溶藻弧菌。1 h时, 两种具有吞噬活性的细胞(后文统一称为吞噬细胞)胞浆中有大量被吞噬的溶藻弧菌, 被吞噬的溶藻弧菌染色后呈小颗粒状, 显微镜下观察呈蓝紫色(图 7a); 3 h时吞噬细胞中能观察到被吞噬的小颗粒状溶藻弧菌、中等大小的颗粒以及少量大颗粒(图 7b); 6 h时吞噬细胞中大颗粒数量较3 h时增多(图 7c); 24 h时, 血涂片中观察到部分细胞破裂后的细胞核, 吞噬细胞中仍能观察到被吞噬的溶藻弧菌、中等大小的颗粒以及大颗粒, 部分细胞中溶藻弧菌数量较少(图 7d, 7e, 7f, 7g)。部分细胞有大量的伪足伸出(图 7h)。
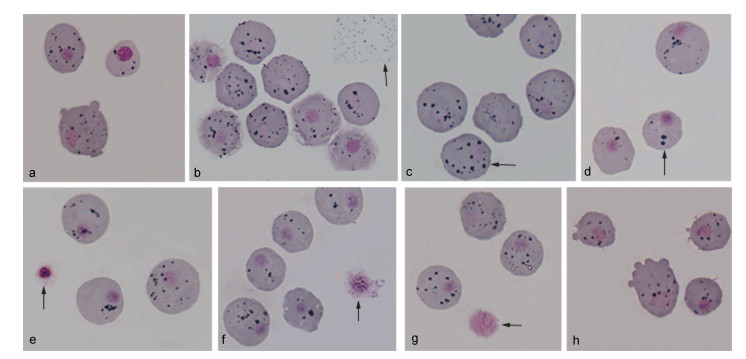 |
| 图 7 泥蚶血细胞染色结果 Fig. 7 The staining results of hemocytes after V. alginolyticus challenge 注: a. 溶藻弧菌和血细胞孵育1 h; b. 溶藻弧菌和血细胞孵育3 h, 箭头所示为溶藻弧菌; c. 溶藻弧菌和血细胞孵育3 h, 箭头所示为中等大小颗粒和大颗粒; d. 溶藻弧菌和血细胞孵育6 h; e, f, g. 溶藻弧菌和血细胞孵育24 h, 箭头所示为细胞核; h. 具伪足的红色颗粒细胞 |
细菌入侵后, 宿主免疫系统会启动一系列防御机制以应对细菌感染。血细胞是泥蚶免疫防御的重要执行者, 血细胞的免疫防御反应包括吞噬、呼吸暴发以及形成结节和包囊等, 在免疫防御过程中, 血细胞内许多基因表达会发生改变以响应细菌入侵。溶藻弧菌是海洋中优势菌和条件致病菌, 溶藻弧菌感染后泥蚶免疫细胞早期响应特征还不是很清楚, 本文采用体外实验, 研究了溶藻弧菌刺激后泥蚶血细胞转录组早期动态变化特点。通过转录组测序, 共获得24 456个Unigenes, 溶藻弧菌刺激3 h时鉴定出1 790个差异表达基因, 刺激6 h时鉴定出3 183个差异表达基因, 随着时间延长, 差异表达基因增加, 这种表达模式表明免疫反应是一个不断变化、动态发展的多基因参与过程, 副溶血弧菌感染早期中华长文蛤(Meretrix petechialis)肝脏中基因表达也呈现出相似规律(Yu et al, 2019)。通过基因功能分析发现, 这些差异基因涉及吞噬体、溶酶体、蛋白酶体、内吞、剪接体、MAPK信号通路、细胞凋亡等, 表明泥蚶血细胞响应涉及众多基因和多个生物学过程, 溶藻弧菌刺激后厚壳贻贝(Mytilus coruscus)血细胞也有类似响应特征(Dong et al, 2017)。
吞噬体是一种囊泡, 在吞噬微生物或微生物蛋白质的过程中, 通过质膜及其相关脂质和蛋白质的内陷形成。泥蚶属低等无脊椎动物, 没有淋巴细胞介导的体液免疫和细胞免疫, 血细胞的吞噬作用是抵抗细菌感染的重要途径(孙敬锋等, 2006; Casem, 2016; Burgos-Aceves et al, 2017)。泥蚶吞噬体相关基因序列多数还不是很清楚, 本研究通过转录组测序获得了多个泥蚶吞噬体通路相关基因, 如丝状肌动蛋白、Ras相关蛋白Rab-5B、囊泡转运蛋白SEC22、钙网蛋白等序列及表达量, 丝状肌动蛋白在伪足和吞噬小泡形成中发挥重要作用, 吞噬小泡形成后立即与内体融合, 吞噬体和内体之间的膜融合需要Rab5 (Gorvel et al, 1991; Rybin et al, 1996), 溶藻弧菌刺激3 h, 丝状肌动蛋白、RAB5等基因的表达量显著增加, 表明刺激早期, 吞噬发挥重要的免疫作用, 6 h时这些基因依然高表达, 暗示6 h血细胞依然能吞噬溶藻弧菌, 这与形态学观察相一致。
从吞噬细胞质膜上断裂后, 新生的吞噬体最终会与溶酶体融合(Desjardins et al, 1994; Flannagan et al, 2012)。本研究通过转录组测序获得多种泥蚶溶酶体酶编码基因, 包括蛋白酶5种[组织蛋白酶(Cathepsin A/C/L/Z) 4种, 内肽酶(Legumain) 1种], 糖苷酶12种(如β-半乳糖苷酶, α-葡萄糖苷酶, α-l-岩藻糖苷酶), 硫酸酯酶2种, 脂肪酶2种, 核酸酶1种, 磷酸酶1种, 神经酰胺酶1种, 天冬氨酰氨基葡糖苷酶1种, 棕榈酰蛋白硫酯酶1种, 共计26种水解酶的编码基因, 这些溶酶体酶的水解作用是杀伤和清除病原微生物重要方式。溶藻弧菌和血细胞孵育3 h时, 3种水解酶表达量增加, 6 h时13种水解酶表达量增加, 表明早期主要是免疫细胞吞噬阶段, 随着吞噬体与溶酶体融合, 溶酶体水解酶开始发挥水解作用, 以杀伤和清除吞噬细胞吞噬的溶藻弧菌, 太平洋牡蛎中也有相似发现, 弧菌感染后血细胞溶酶体酶活力增加(Wang et al, 2017)。研究还发现部分水解酶还能释放到血淋巴中, 水解改变病原表面的分子结构, 有利于免疫细胞识别病原微生物(Cheng, 1983; Xue et al, 2000), 这些水解酶的发现有助于泥蚶以及其他双壳贝类免疫机制研究。
蛋白酶体是一种多亚单位蛋白水解复合物, 中心是具有催化作用的20s蛋白酶体, 两个末端由调控亚复合物组成的PA700, 蛋白酶体是细胞质和细胞核中非溶酶体蛋白质降解的中心酶, 具有多种蛋白水解酶活性, 参与各种生物过程, 如错误折叠蛋白质和短命调节蛋白质的降解(Coux et al, 1996; DeMartino et al, 1999; Unno et al, 2002)。本研究获得了泥蚶PA700多个亚基和20S蛋白酶体多个亚基, 3 h时部分蛋白酶体亚基表达量上调, 6 h大多蛋白酶体亚基表达量上调, 表明随着时间推移蛋白酶体活性不断增加, 也暗示泛素-蛋白质酶体通路在泥蚶免疫反应中发挥重要作用。
丝裂原活化蛋白激酶(MAPK)信号通路是真核生物中高度保守的信号转导通路, 该信号转导通路能将不同的细胞外刺激与广泛的细胞内反应联系起来, 从而在细胞的生长、分化、应激、炎症反应等多种生理过程中发挥作用, MAPK通路有3种主要的分支路线: ERK、JNK和p38 MAPK (Roberts et al, 2000; Roux et al, 2004)。Zhang等(2019)研究发现弧菌刺激后中华长文蛤(Meretrix petechialis) p38 MAPK持续磷酸化, 表明MAPK信号通路在贝类免疫防御中发挥作用。本研究发现溶藻弧菌刺激后, 3 h、6 h丝裂原活化蛋白激酶激酶4 (MKK4)持续上调, MKK4能激活c-Jun氨基末端激酶(JNK), 暗示JNK信号通路在泥蚶血细胞免疫反应中发挥生理作用(Roberts et al, 2000; Chen et al, 2021); 6 h时丝裂原活化蛋白激酶激酶3和6 (MKK3, MKK6)均上调, MKK3和MKK6能激活p38 MAPK (Roberts et al, 2000; Chen et al, 2021), 结果表明p38 MAPK途径在泥蚶血细胞抗溶藻弧菌感染中发挥防御作用; MKK4早于MKK3和MKK6上调暗示c-Jun氨基末端激酶信号通路早于p38 MAPK途径发挥生理作用。
细胞凋亡(Apoptosis)是由基因控制的细胞自主的、有序的死亡, 这是一种可以清除受损细胞或感染病原体细胞的机制, 细胞凋亡在后生动物中普遍存在(Cohen et al, 1992; Bertheloot et al, 2021)。本研究通过转录组测序发现细胞凋亡通路的多个重要基因在3 h和6 h时均上调, 如半胱氨酸蛋白酶2和7, 包拉米虫感染后扁牡蛎血细胞也发生凋亡(Gervais et al, 2016), 表明凋亡也是一种清除细菌感染的方式。
4 结论本文通过体外实验, 研究了溶藻弧菌刺激早期泥蚶血细胞转录谱, 分析了刺激3 h和6 h血细胞中差异表达基因, 3 h时1 790个基因表达发生改变, 6 h时鉴定出3 183个差异表达基因, 表明免疫反应是一个不断变化、动态发展的多基因参与过程。差异表达基因富集到多条KEGG信号通路, 3 h时富集程度最高的通路有吞噬体、细胞凋亡和局部黏附, 6 h时富集程度最高的三条通路有蛋白酶体、细胞凋亡和内质网蛋白加工, 表明这些通路在免疫反应中发挥重要作用。通过转录组测序获得了多种溶酶体酶编码基因、蛋白酶体亚基编码基因, 这些免疫相关基因的发现有助于早期免疫反应标志物的发现。本文结果可为研究泥蚶血细胞免疫反应以及抗病机理提供有效资料, 为泥蚶绿色健康养殖提供新的思路。
朱泽闻, 徐立蒲, 吴信忠, 等, 2011. 泥蚶血细胞的形态结构特征及部分免疫功能. 水产学报, 35(10): 1494-1504 |
许家辉, 陈世雄, 俞兴发, 等, 2018. 投喂海水小球藻和三角褐指藻对泥蚶成贝镉排出的影响. 海洋与湖沼, 49(3): 624-629 |
孙敬锋, 吴信忠, 2006. 贝类血细胞及其免疫功能研究进展. 水生生物学报, 30(5): 601-607 |
李太武, 李成华, 宋林生, 等, 2003. 5个泥蚶群体遗传多样性的RAPD分析. 生物多样性, 11(2): 118-124 |
BERTHELOOT D, LATZ E, FRANKLIN B S, 2021. Necroptosis, pyroptosis and apoptosis: an intricate game of cell death. Cellular & Molecular Immunology, 18(5): 1106-1121 |
BUCHFINK B, XIE C, HUSON D H, 2015. Fast and sensitive protein alignment using DIAMOND. Nature Methods, 12(1): 59-60 DOI:10.1038/nmeth.3176 |
BURGOS-ACEVES M A, FAGGIO C, 2017. An approach to the study of the immunity functions of bivalve haemocytes: physiology and molecular aspects. Fish & Shellfish Immunology, 67: 513-517 |
CASEM M L, 2016. Case Studies in Cell Biology. San Diego: Academic Press, 217-240
|
CHEN J, WANG L H, YUAN M, 2021. Update on the roles of rice MAPK cascades. International Journal of Molecular Sciences, 22(4): 1679 DOI:10.3390/ijms22041679 |
CHENG T C, 1983. The role of lysosomes in molluscan inflammation. American Zoologist, 23(1): 129-144 DOI:10.1093/icb/23.1.129 |
COHEN J J, DUKE R C, FADOK V A, et al, 1992. Apoptosis and programmed cell death in immunity. Annual Review of Immunology, 10: 267-293 DOI:10.1146/annurev.iy.10.040192.001411 |
COUX O, TANAKA K, GOLDBERG A L, 1996. Structure and functions of the 20S and 26S proteasomes. Annual Review of Biochemistry, 65: 801-847 DOI:10.1146/annurev.bi.65.070196.004101 |
DEMARTINO G N, SLAUGHTER C A, 1999. The proteasome, a novel protease regulated by multiple mechanisms. Journal of Biological Chemistry, 274(32): 22123-22126 DOI:10.1074/jbc.274.32.22123 |
DESJARDINS M, CELIS J E, VAN MEER G, et al, 1994. Molecular characterization of phagosomes. Journal of Biological Chemistry, 269(51): 32194-32200 DOI:10.1016/S0021-9258(18)31620-X |
DONG W Q, CHEN Y X, LU W X, et al, 2017. Transcriptome analysis of Mytilus coruscus hemocytes in response to Vibrio alginnolyficus infection. Fish & Shellfish Immunology, 70: 560-557 |
FLANNAGAN R S, JAUMOUILLÉ V, GRINSTEIN S, 2012. The cell biology of phagocytosis. Annual Review of Pathology: Mechanisms of Disease, 7: 61-98 DOI:10.1146/annurev-pathol-011811-132445 |
GERVAIS O, CHOLLET B, RENAULT T, et al, 2016. Flat oyster follows the apoptosis pathway to defend against the protozoan parasite Bonamia ostreae. Fish & Shellfish Immunology, 56: 322-329 |
GORVEL J P, CHAVRIER P, ZERIAL M, et al, 1991. Rab5 controls early endosome fusion in vitro. Cell, 64(5): 915-925 DOI:10.1016/0092-8674(91)90316-Q |
HU Z, FENG J, SONG H, et al, 2022. Mechanisms of heat and hypoxia defense in hard clam: insights from transcriptome analysis. Aquaculture, 549: 737792 |
REN Y P, LIU H X, FU S Y, et al, 2021. Transcriptome-wide identification and characterization of toll-like receptors response to Vibrio anguillarum infection in Manila clam (Ruditapes philippinarum). Fish & Shellfish Immunology, 111: 49-58 |
ROBERTS C J, NELSON B, MARTON M J, et al, 2000. Signaling and circuitry of multiple MAPK pathways revealed by a matrix of global gene expression profiles. Science, 287(5454): 873-880 DOI:10.1126/science.287.5454.873 |
ROUX P P, BLENIS J, 2004. ERK and p38 MAPK-activated protein kinases: a family of protein kinases with diverse biological functions. Microbiology and Molecular Biology Reviews, 68(2): 320-344 |
RYBIN V, ULLRICH O, RUBINO M, et al, 1996. GTPase activity of Rab5 acts as a timer for endocytic membrane fusion. Nature, 383(6597): 266-269 |
UNNO M, MIZUSHIMA T, MORIMOTO Y, et al, 2002. The structure of the mammalian 20S proteasome at 2.75 Å resolution. Structure, 10(5): 609-618 |
WANG W L, LI M J, WANG L L, et al, 2017. The granulocytes are the main immunocompetent hemocytes in Crassostrea gigas. Developmental & Comparative Immunology, 67: 221-228 |
XUE Q G, RENAULT T, 2000. Enzymatic activities in European flat oyster, Ostrea edulis, and pacific oyster, Crassostrea gigas, hemolymph. Journal of Invertebrate Pathology, 76(3): 155-163 |
YU J J, WANG H X, YUE X, et al, 2019. Dynamic immune and metabolism response of clam Meretrix petechialis to Vibrio challenge revealed by a time series of transcriptome analysis. Fish & Shellfish Immunology, 94: 17-26 |
ZHANG S J, YU J J, WANG H X, et al, 2019. p38 MAPK is involved in the immune response to pathogenic Vibrio in the clam Meretrix petechialis. Fish & Shellfish Immunology, 95: 456-463 |
ZHAO Q, PAN L Q, REN Q, et al, 2015. Digital gene expression analysis in hemocytes of the white shrimp Litopenaeus vannamei in response to low salinity stress. Fish & Shellfish Immunology, 42(2): 400-407 |
 2023, Vol. 54
2023, Vol. 54

