中国海洋湖沼学会主办。
文章信息
- 孙玲玲, 宋金明, 李宁, 孙萱, 刘瑶, 于颖. 2023.
- SUN Ling-Ling, SONG Jin-Ming, LI Ning, SUN Xuan, LIU Yao, YU Ying. 2023.
- 海水中三价与六价铬高效液相色谱-三重四级杆电感耦合等离子体质谱法(HPLC-TQ-ICP-MS)的联用测定
- JOINT DETERMINATION OF TRIVALENT CHROMIUM AND HEXAVALENT CHROMIUM IN SEAWATER BY HPLC-TQ-ICP-MS
- 海洋与湖沼, 54(2): 436-443
- Oceanologia et Limnologia Sinica, 54(2): 436-443.
- http://dx.doi.org/10.11693/hyhz20220600150
文章历史
-
收稿日期:2022-06-06
收修改稿日期:2022-09-16
2. 中国科学院海洋研究所 海洋生态与环境科学重点实验室 山东青岛 266071;
3. 青岛海洋科学与技术试点国家实验室 海洋生态与环境科学功能实验室 山东青岛 266237;
4. 中国科学院海洋大科学中心 山东青岛 266071
2. CAS Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
3. Functional Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266237, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
铬是第六副族(VIB族)元素, 在地壳中的平均含量为0.010%~0.011%。铬作为备受关注的重金属元素, 在生物地球化学循环研究中占有重要地位, 同时与海洋生物有着密切的关系, 是生物体兼顾必需和有害的微量元素之一(宋金明等, 2017)。铬可以形成+2、+3、+4、+6等多种价态化合物, 在海水中, 铬主要以三价、六价和有机结合态等形式存在, 其中三价铬Cr(Ⅲ)和六价铬Cr(Ⅵ)的溶解性、迁移能力、生物效应等物理化学性质截然不同(Elderfield, 1970; Mugo et al, 1993; 杨逸萍等, 1994)。元素在海洋环境中的环境生物地球化学行为不仅与其含量有关, 还与其化学形态密切相关。研究表明, 不同价态的铬具有不同的毒性和生物活性, Cr(Ⅲ)参与机体的代谢, 是生物必需元素之一, Cr(Ⅵ)的毒性比Cr(Ⅲ)强100倍, 且易被生物体吸收, 在体内蓄积产生毒害作用(Barnowski et al, 1997; Gwizdala Ⅲ et al, 1997; 邰玲等, 2007; 李静等, 2010)。由此可见, 传统的总量分析往往难以表征该元素的真实生物活性与危害, 因此, 对元素不同形态进行深入研究显得尤为重要。
海水中铬形态传统的分析方法有分光光度法(何书海等, 2021)、极谱法(蓝伟光等, 1991; 曹雷等, 2009)、原子吸收分光光度法(黄华瑞等, 1989; Boughriet et al, 1994; Leśniewska et al, 2012; 王增焕等, 2014)、石墨炉原子吸收光谱法(Gardner et al, 1996; Chang et al, 2012)、原子发射光谱法(Sumida et al, 2006)等。但这些方法存在操作繁杂、加入试剂较多、易引入污染、检出限高等缺点, 并且Cr(Ⅲ)的测定大都运用总铬与Cr(Ⅵ)的差值获得, 单一的仪器或技术很难实现对Cr(Ⅲ)和Cr(Ⅵ)的同时准确测定。现用于铬元素形态分析的主要方法是联用技术, 即先用有效的在线分离技术将铬的不同化学形态进行选择性分离, 再用高灵敏度的元素检测技术进行测定。液相色谱-电感耦合等离子体质谱法(Chang et al, 2001; Martínez-bravo et al, 2001), 以及离子色谱-电感耦合等离子体质谱法(Pantsar-Kallio et al, 1997; Hirata et al, 2000)等联用技术是非常有效的形态分析技术, 具有操作简单、检出限低、灵敏度高、线性范围宽、分析时间短、前处理简便等优点(Rekhi et al, 2017; 黄键等, 2020), 近年来已成为形态分析中最具应用前景的技术。
本文构建了高效液相色谱与三重四级杆电感耦合等离子体质谱联用技术(HPLC-TQ-ICP-MS)同时测定海水中Cr(Ⅲ)和Cr(Ⅵ)的分析方法。采用三重四级杆碰撞反应池(Kinetic Energy Discrimination, KED) 技术, 消除多原子离子对52Cr同位素测定可能存在的质谱干扰。通过优化影响Cr(Ⅲ)和Cr(Ⅵ)分离效果的色谱条件: 色谱柱、流动相、pH值等, 总结出最佳的色谱分离条件。同时对络合剂EDTA的络合浓度、pH值、温度和时间进行了深入研究。在最优实验条件下, 对方法的线性范围、检出限、加标回收率、精密度等进行了实验评定, 这将为海水及其他高盐样品中铬形态的准确分析提供科学参考。
1 材料与方法 1.1 仪器与试剂iCAP TQ ICP-MS电感耦合等离子体质谱仪(美国ThermoFisher公司); UlltiMate3000高效液相色谱(美国ThermoFisher公司); Dionex IonPac AG 7 (4 mm×50 mm, 10 μm)阴离子交换柱(美国戴安公司); Dionex IonPac AS 7 (4 mm×250 mm, 10 μm) 阴离子交换柱(美国戴安公司); Hamilton PRP X-100 (4.1 mm × 250 mm, 10 μm) (瑞士哈美顿公司); Milli-Q Direct 8超纯水系统(美国Millipore公司); 水浴恒温振荡器(苏州培英实验设备有限公司); BS110电子天平(德国Sartorius公司); S479型多参数测量仪(梅特勒-托利多仪器有限公司); 移液枪(5~20 μL、20~200 μL、100~1 000 μL、0.5~5 mL, 德国Eppendorf公司); 0.22 μm微孔滤膜。
69% HNO3 (UPS级高纯, 上海傲班科技有限公司); 25%氨水(色谱纯, 德国Merck公司); NH4NO3由硝酸和氨水混合配制; 乙二胺四乙酸二钠(EDTA-2Na, 优级纯, 天津市科密欧化学试剂有限公司); Cr(Ⅲ)单元素标准溶液(1 000 μg/mL, 国家有色金属及电子材料分析测试中心); Cr(Ⅵ)单元素标准溶液(1 000 μg/mL, 国家有色金属及电子材料分析测试中心); 用于配制标准溶液与样品溶液的超纯水(电阻率18.2 MΩ∙cm), 实验中所有器皿均用20% HNO3浸泡24 h后, 用超纯水冲洗3次, 晾干备用。
1.2 方法 1.2.1 三重四级杆电感耦合等离子体质谱仪工作条件KED测定模式下, 射频功率1 550 W, 雾化气流量1.03 L/min, 辅助气流量0.80 L/min, 等离子体气流量14.0 L/min, 氦气碰撞气流量4.90 mL/min, 采集质量数52Cr, 采样深度5.0 mm。
1.2.2 高效液相色谱仪工作条件色谱柱Dionex IonPac AG 7 (4 mm×50 mm, 10 μm), 流动相由洗脱剂(0.08 mol/L NH4NO3)和pH值缓冲剂(0.6 mmol/L EDTA, pH=7.5)组成, 流速1.0 mL/min, 进样体积100 μL, 等度洗脱, 分析时间2 min。
1.2.3 络合剂储备液的配制称取3.72 g EDTA溶于1 L超纯水中, 得到10 mmol/L EDTA, 用10%氨水溶液调节pH 7.5。
1.2.4 工作曲线的配制分别移取一定体积的Cr(Ⅲ)和Cr(Ⅵ)标准溶液置于100 mL容量瓶中, 用EDTA络合剂储备液定容至刻度, 在50 ℃水浴中加热振荡2 h, 得到1.0 mg/L Cr(Ⅲ)-EDTA和Cr(Ⅵ)混合标准储备液。
系列混合标准工作溶液的配制: 分别移取一定体积的上述混合标准储备液, 用流动相定容至刻度, 得到浓度分别为0、0.1、0.5、1.0、5.0、10.0及50.0 μg/L的系列混合标准工作溶液。
1.3 样品预处理取过滤后海水样品25 mL于50 mL离心管中, 加入1mL 0.5 mol/L的EDTA进行络合, 用超纯水定容至刻度, EDTA的最终浓度为10 mmol/L, 用缓冲溶液调pH值7.5, 50 ℃水浴络合2 h, 冷却后上机测定。同法做试剂空白实验。
2 结果与讨论 2.1 质谱条件的优化自然界中, 铬有4种稳定同位素, 分别为50Cr (4.35%)、52Cr (83.8%)、53Cr (9.50%)和54Cr (2.36%) (Rosman et al, 1998)。ICP-MS分析铬元素大多采用52Cr和53Cr两种同位素进行数据采集。在标准测试模式(STD)下, 52Cr可能会受35Cl16O1H+、40Ar12C等多原子离子的干扰, 而53Cr可能会受37Cl16O等多原子离子的干扰。为消除测定时可能存在的质谱干扰, 并提高灵敏度, 本文采用动能歧视模式(KED)。实验结果表明, 当仪器的灵敏度和稳定性调至最优状态, 并选择碰撞反应气流速为4.90 mL/min时, 52Cr和53Cr具有最佳的信噪比, 且52Cr进行瞬间数据采集时的灵敏度比53Cr高, 本文选择52Cr做为铬形态分析的同位素。
2.2 色谱条件的优化 2.2.1 色谱柱的选择色谱条件的选择主要包括色谱柱选择和流动相选择。Cr(Ⅲ)和Cr(Ⅵ)的存在形态大多为离子形态, 常采用阴离子交换色谱柱进行分离。本实验分别采用Dionex IonPac AG7 (4 mm × 50 mm, 10 μm)阴离子交换柱、Dionex IonPac AS 7 (4 mm×250 mm, 10 μm)阴离子交换柱和Hamilton PRP X-100 (4.1 mm × 250 mm, 10 μm)阴离子交换柱对10 μg/L Cr(Ⅲ)和Cr(Ⅵ)混合标准溶液进行分离。结果显示, Dionex IonPac AS 7色谱柱虽然可以实现对Cr(Ⅲ)和Cr(Ⅵ)很好的分离, 但需300 s才能完成全部分离, 所需时间相对较长, 目标物响应值低(图 1a); 采用Hamilton PRP X-100进行分离发现, 在相同的实验条件下, 对Cr(Ⅲ)和Cr(Ⅵ)不能实现色谱峰的完全分离, 且分析时间较长, 目标物响应值较低(图 1b); Dionex IonPac AG7色谱柱不仅能够在80 s内快速实现Cr(Ⅲ)和Cr(Ⅵ)基线完全分离, 且峰形尖锐, 响应值高, 用时短且分离效果好(图 1c)。综合考虑, 选择Dionex IonPac AG7阴离子交换柱对Cr(Ⅲ)和Cr(Ⅵ)进行分离。
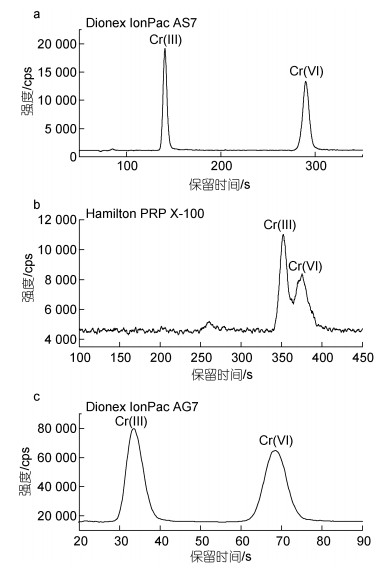 |
| 图 1 3种阴离子交换柱分离Cr(Ⅲ)和Cr(Ⅵ) 色谱图 Fig. 1 Chromatograms of Cr(Ⅲ) and Cr(Ⅵ) obtained from three anion exchange columns 注: a. Dionex IonPac AS 7; b. Hamilton PRP X-100; c. Dionex IonPac AG 7 |
为考察流动相浓度对Cr(Ⅲ)和Cr(Ⅵ)保留时间和峰面积的影响, 分别配置0.05、0.06、0.07、0.08、0.09和0.10 mol/L NH4NO3水溶液(pH值7.5)作为流动相进行实验, 实验结果见图 2和图 3。
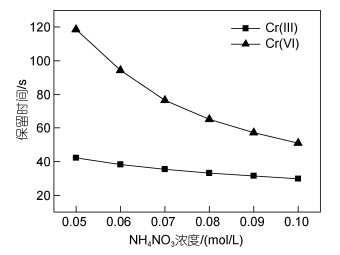 |
| 图 2 流动相浓度对10 μg/L Cr(Ⅲ)和Cr(Ⅵ)保留时间的影响 Fig. 2 Effect of mobile phase concentration on retention time of 10 μg/L Cr(Ⅲ) and Cr(Ⅵ) |
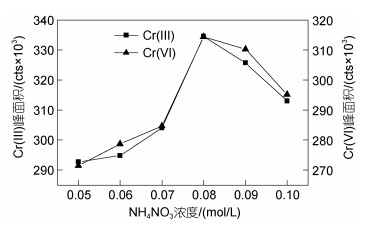 |
| 图 3 流动相浓度对10 μg/L Cr(Ⅲ)和Cr(Ⅵ)峰面积的影响 Fig. 3 Effect of mobile phase concentration on peak area of 10 μg/L Cr(Ⅲ) and Cr(Ⅵ) |
由图 2可见, Cr(Ⅲ)和Cr(Ⅵ)的保留时间均随流动相浓度的增加而缩短, 但流动相浓度对Cr(Ⅵ)的保留时间影响较大, 对Cr(Ⅲ)的保留时间影响相对较小。在不同的流动相浓度下, Cr(Ⅲ)和Cr(Ⅵ)均有较好的分离度, 当NH4NO3浓度为0.08 mol/L时, Cr(Ⅲ)的保留时间为33.2 s, Cr(Ⅵ)的保留时间为65.2 s, 分离度为1.67, 两者均具有较好的保留时间和理想分离度。
由图 3可知, 随着流动相浓度的增加, Cr(Ⅲ)和Cr(Ⅵ)的峰面积均是先增加后减少, 当浓度为0.08 mol/L时, 两者的峰面积均达到最高值。综上所述, 选择流动相的浓度为0.08 mol/L (pH值7.5)。
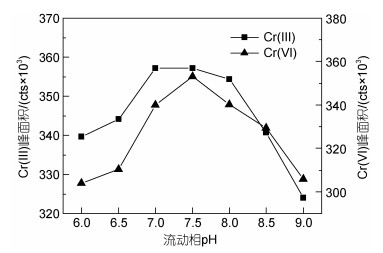
2.2.3 流动相pH值为考察流动相pH值对Cr(Ⅲ)和Cr(Ⅵ)保留时间和峰面积的影响, 分别配置pH 6.0、6.5、7.0、7.5、8.0、8.5和9.0的NH4NO3水溶液(浓度0.08 mol/L)作为流动相进行实验, 实验结果见图 4和图 5。
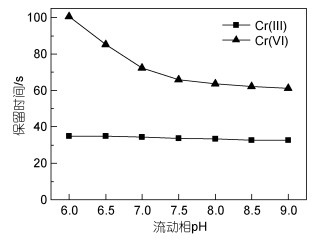 |
| 图 4 流动相pH值对10 μg/L Cr(Ⅲ)和Cr(Ⅵ)保留时间的影响 Fig. 4 Effect of pH value of mobile phase on the retention time of 10 μg/L Cr(Ⅲ) and Cr(Ⅵ) |
 |
| 图 5 流动相pH值对10 μg/L Cr(Ⅲ)和Cr(Ⅵ)峰面积的影响 Fig. 5 Effect of pH value of mobile phase on peak area of 10 μg/L Cr(Ⅲ) and Cr(Ⅵ) |
由图 4可见, Cr(Ⅲ)和Cr(Ⅵ)的保留时间均随流动相pH值的增大而缩短, 但流动相pH值对Cr(Ⅵ)的保留时间影响显著, 对Cr(Ⅲ)的保留时间影响甚微。在不同的流动相pH值下, Cr(Ⅲ)和Cr(Ⅵ)均有较好的分离度, 当pH值为7.5时, Cr(Ⅲ)的保留时间为33.8 s, Cr(Ⅵ)的保留时间为65.8 s, 分离度为1.77, 两者均具有较好的保留时间和理想的分离度。
由图 5可知, 随着流动相pH值的增加, Cr(Ⅲ)和Cr(Ⅵ)的峰面积均是先增加后减少, 当pH值为7.5时, 两者的峰面积均达到最高值。综上所述, 选择流动相pH值为7.5 (浓度0.08 mol/L)。
2.3 Cr(Ⅲ)络合条件的优化在样品水溶液中, 铬元素主要以Cr(Ⅲ)和Cr(Ⅵ)的形态存在。在中性条件下, Cr(Ⅲ)以Cr3+、Cr(OH)2+、Cr(OH)2+、Cr(OH)3等阳离子形态存在; Cr(Ⅵ)主要以铬酸根CrO42-阴离子形态存在(刘二保等, 2003)。可见, 在相同条件下, 采用AG7阴离子交换柱无法对Cr(Ⅲ)和Cr(Ⅵ)同时分离, 水样中的Cr(Ⅲ)需要经过络合才能在阴离子色谱柱上产生保留, 从而进行测定, 未经络合的Cr(Ⅲ)几乎没有色谱峰出现(图 6)。EDTA是一种常用的络合剂, 它能与Cr(Ⅲ)形成稳定的Cr(Ⅲ)-EDTA络合物(阴离子状态), 溶于缓冲液中。Cr(Ⅵ)不与EDTA络合, 直接溶于缓冲液中。这样, Cr(Ⅲ)和Cr(Ⅵ)就分别以Cr(Ⅲ)-EDTA和CrO42-形态在AG7阴离子交换柱中分离。
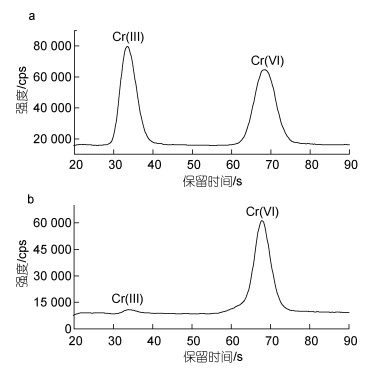 |
| 图 6 10 μg/L Cr(Ⅲ)和Cr(Ⅵ)标准溶液对比图 Fig. 6 Comparison in standard 10 μg/L Cr(Ⅲ) and Cr(Ⅵ) solutions 注: a. 经络合的Cr(Ⅲ)和Cr(Ⅵ); b. 未经络合的Cr(Ⅲ)和Cr(Ⅵ) |
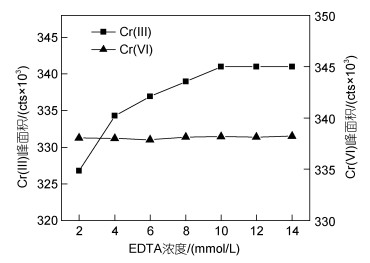
分别用2.0、4.0、6.0、8.0、10.0、12.0和14.0 mmol/L的EDTA (pH值7.5)对Cr(Ⅲ)和Cr(Ⅵ)进行络合, 络合温度50 ℃, 络合时间2 h, 考察EDTA浓度对络合效果的影响(图 7)。由图 7可知, 随着EDTA浓度的增加, Cr(Ⅲ)的峰面积逐渐增大至稳定, 当EDTA浓度为10 mmol/L时, Cr(Ⅲ)的峰面积达到最大, 继续增加EDTA的浓度, Cr(Ⅲ)的峰面积基本维持稳定, 说明此时络合已基本完成。因Cr(Ⅵ)不与EDTA发生络合, 所以Cr(Ⅵ)的峰面积不受EDTA浓度的影响, 基本维持稳定。故选择EDTA的最佳浓度为10 mmol/L。
 |
| 图 7 EDTA浓度对10 μg/L Cr(Ⅲ)和Cr(Ⅵ)络合效果的影响 Fig. 7 Effect of EDTA concentration on the complexation of 10 μg/L Cr(Ⅲ) and Cr(Ⅵ) with EDTA |
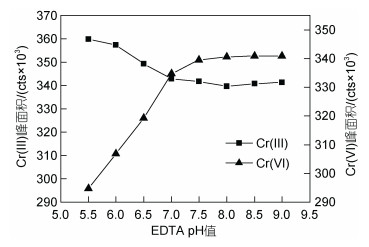
分别用pH值为5.5、6.0、6.5、7.0、7.5、8.0、8.5和9.0的EDTA (浓度10 mmol/L)对Cr(Ⅲ)和Cr(Ⅵ)进行络合, 络合温度50 ℃, 络合时间2 h, 考察络合pH值对Cr(Ⅲ)和Cr(Ⅵ)络合效果的影响(图 8)。由图 8可知, 随着络合pH值的增加, Cr(Ⅲ)的峰面积先减少后稳定。当pH<7.0时, Cr(Ⅵ)易被还原成Cr(Ⅲ), Cr(Ⅲ)峰面积一部分来源于被还原的Cr(Ⅵ), 故此时峰面积较大。当pH>8.0时, Cr(Ⅵ)因氧化能力降低而稳定。当pH值在7.5左右时, Cr(Ⅲ)和Cr(Ⅵ) 最稳定, 这也与文献的报道一致(邵宏宏等, 2015; 陈绍占等, 2018), 综合考虑分析过程的稳定性, 选择络合pH值为7.5。
 |
| 图 8 EDTA pH值对10 μg/L Cr(Ⅲ)和Cr(Ⅵ)络合效果的影响 Fig. 8 Effect of pH value on the complexation of 10 μg/L Cr(Ⅲ) and Cr(Ⅵ) with EDTA |
Cr(Ⅲ)与EDTA在常温下络合缓慢, 需数十小时才能络合完全, 升高温度可加快络合速度。以10 mmol/L EDTA (pH值7.5)对Cr(Ⅲ)进行络合, 分别置于30、40、50、60、70、80 ℃的水浴, 络合时间2 h, 考察温度对Cr(Ⅲ)络合效果的影响。结果表明(图 9), 随着温度的升高, Cr(Ⅲ)的峰面积逐渐增加, 温度达到50 ℃后峰面积基本不变, 说明此时络合已基本完成。综合考虑, 选择最佳络合温度为50 ℃。
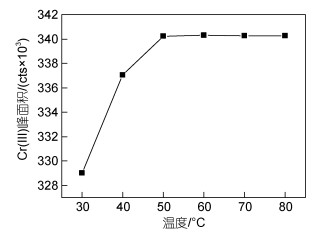 |
| 图 9 温度对10 μg/L Cr(Ⅲ)络合效果的影响 Fig. 9 Effect of temperature on the complexation of 10 μg/L Cr(Ⅲ) with EDTA |
用10 mmol/L EDTA (pH值7.5)对Cr(Ⅲ) 进行络合, 置于50 ℃水浴中分别络合0.5、1、2、3、4 h, 考察时间对Cr(Ⅲ)络合效果的影响。结果表明(图 10), 随着络合时间的延长, Cr(Ⅲ)的峰面积逐渐增大, 2 h后峰面积趋于稳定, 表明此时络合已基本完成。因此选择最佳络合时间为2 h。
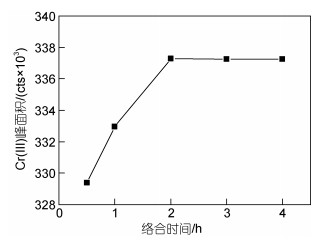 |
| 图 10 络合时间对10 μg/L Cr(Ⅲ) 与EDTA络合效果的影响 Fig. 10 Effect of reaction time on the complexation of 10 μg/L Cr(Ⅲ) with EDTA |
对方法线性范围进行实验, 实验结果表明, 在优化的实验条件下, 在0.1~50.0 μg/L浓度内, Cr(Ⅲ)和Cr(Ⅵ)的线性相关系数R均大于0.999 9, 结果见表 1。将空白溶液重复测试12次, 计算方法的标准偏差, 定义3倍标准偏差为方法检出限, Cr(Ⅲ)和Cr(Ⅵ)的检出限分别为0.010和0.015 μg/L(表 1)。
| 铬形态 | 线性范围/(μg/L) | 线性方程 | 相关系数R | 检出限/(μg/L) |
| Cr(Ⅲ) | 0.100~50.000 | y=32 569.4x−11 614.6 | 1.000 | 0.010 |
| Cr(Ⅵ) | 0.100~50.000 | y=32 326.3x+5 449.9 | 1.000 | 0.015 |
选取一个海水样品, 对实验方法的准确度和精密度进行评价。量取25 mL的海水样品两份, 一份加标, 另一份不加标, 按1.3预处理方法进行处理。在最佳色谱和质谱工作条件下, 对样品分别平行测定6次, 计算回收率和相对标准偏差(RSD)(表 2)。由表 2可以看出, 方法的回收率为90.4%~107.9%, RSD在1.66%~3.71%之间, 本方法的精密度、准确性能够满足海水及其他高盐样品中铬形态检测的要求。
| 元素 | 测定平均值/(μg/L) | 加标量/(μg/L) | 加标后测定值/(μg/L) | 加标回收率/% | RSD/% (n=6) |
| Cr(Ⅲ) | 0.351 | 0.500 | 0.803 | 90.4 | 3.02 |
| 1.00 | 1.257 | 90.6 | 2.98 | ||
| 5.00 | 5.260 | 98.2 | 1.66 | ||
| Cr(Ⅵ) | 0.087 | 0.500 | 0.545 | 91.6 | 3.71 |
| 1.00 | 1.166 | 107.9 | 3.69 | ||
| 5.00 | 5.196 | 102.2 | 2.71 |
在最优的色谱和质谱工作条件下, 运用本方法对采自南海海域的10个海水样品(编号1~10)中Cr(Ⅲ)和Cr(Ⅵ)进行测定, 根据标准曲线的线性回归方程计算其含量(表 3)。结果显示, 10个海水样品中Cr(Ⅲ)含量为0.169~0.373 μg/L, Cr(Ⅵ)含量为0.064 ~ 0.143 μg/L, 含量均低于我国《海水水质标准》GB 3097-1997中第一类海水的限量标准(总铬50 μg/L, 六价铬5 μg/L), 说明受测试的海水水质良好。
 |
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Cr(Ⅲ)/(μg/L) | 0.284 | 0.271 | 0.223 | 0.194 | 0.203 | 0.232 | 0.169 | 0.214 | 0.373 | 0.222 |
| Cr(Ⅵ)/(μg/L) | 0.097 | 0.106 | 0.076 | 0.064 | 0.086 | 0.077 | 0.067 | 0.101 | 0.143 | 0.093 |
本文建立了高效液相色谱-电感耦合等离子体质谱联用技术在线测定海水中三价铬和六价铬的分析方法。采用三重四级杆碰撞反应池(KED)技术消除多原子离子对52Cr形态测定可能存在的质谱干扰, 选用Dionex IonPac AG 7阴离子交换柱为分析柱, 对流动相浓度及pH值进行优化, 同时对络合剂EDTA的络合浓度、pH、温度及时间进行了进一步研究。在0.1~50.0 μg/L标准浓度范围内, Cr(Ⅲ)和Cr(Ⅵ)的线性相关系数均大于0.999 9, 检出限分别为0.010和0.015 μg/L, 方法的回收率90.4%~107.9%, 相对标准偏差RSD为1.66%~3.71% (n=6)。该方法灵敏度高, 分离度高, 分析时间短, 准确性和精密度好, 可作为海水及其他高盐样品中铬形态分析的理想方法, 并可为海水质量评价提供切实可行的检测依据。
王增焕, 王许诺, 2014. 螯合萃取分离富集原子吸收法测定海水中Cr(Ⅲ)、Cr(Ⅵ)和总铬. 上海环境科学, 33(2): 65-72 |
刘二保, 梁建功, 韩素琴, 等, 2003. 铬的形态分析研究与进展. 理化检验(化学分册), 39(6): 368-371 DOI:10.3321/j.issn:1001-4020.2003.06.024 |
李静, 王雨, 陈华宝, 等, 2010. 牛奶中三价铬和六价铬的同时提取和检测方法. 食品科学, 31(10): 250-253 |
杨逸萍, 胡明辉, 王培新, 1994. 海洋细菌作用下海水中铬化学形态的转化. 海洋学报, 16(6): 72-79 DOI:10.3321/j.issn:0253-4193.1994.06.006 |
何书海, 周女琬, 吴小龙, 等, 2021. 超痕量六价铬分析仪快速测定海水中六价铬. 应用化学, 38(8): 1025-1026 |
宋金明, 段丽琴, 2017. 渤黄东海微/痕量元素的环境生物地球化学. 北京: 科学出版社, 1-465
|
陈绍占, 张妮娜, 刘丽萍, 等, 2018. 离子色谱-电感耦合等离子体质谱法快速测定饮用水中铬形态. 中国卫生检验杂志, 28(5): 524-527 |
邵宏宏, 周秀锦, 王琦, 等, 2015. 在线络合IC-ICP-MS法测定海产品及制品中铬形态. 现代科学仪器, (3): 103-107 |
邰玲, 张稳婵, 李华静, 2007. 水样中六价铬的测定方法研究. 计量与测试技术, 34(7): 54-55 |
黄华瑞, 庞学忠, 1989. 海水中不同价态铬的测定. 海洋科学, (2): 53-57 |
黄键, 张文国, 施锦辉, 等, 2020. 高效液相色谱–电感耦合等离子体质谱法同步测定海水中的无机砷与六价铬. 化学分析计量, 29(5): 72-75 |
曹雷, 曹舟艳, 2009. 海水中不同价态铬的极谱法分析. 污染防治技术, 22(2): 22-24 |
蓝伟光, 杨勇, 陈霓, 等, 1991. 海水中铬的化学形态分析. 厦门水产学院学报, 13(1): 70-78 |
BARNOWSKI C, JAKUBOWSKI N, STUEWER D, et al, 1997. Speciation of chromium by direct coupling of ion exchange chromatography with inductively coupled plasma mass spectrometry. Journal of Analytical Atomic Spectrometry, 12(10): 1155-1161 |
BOUGHRIET A, DERAM L, WARTEL M, 1994. Determination of dissolved chromium (Ⅲ) and chromium (Ⅵ) in sea-water by electrothermal atomic absorption spectrometry. Journal of Analytical Atomic Spectrometry, 9(10): 1135-1142 |
CHANG Y L, JIANG S J, 2001. Determination of chromium species in water samples by liquid chromatography-inductively coupled plasma-dynamic reaction cell-mass spectrometry. Journal of Analytical Atomic Spectrometry, 16(8): 858-862 |
CHANG Q Y, SONG S J, WANG Y K, et al, 2012. Application of graphene as a sorbent for preconcentration and determination of trace amounts of chromium (Ⅲ) in water samples by flame atomic absorption spectrometry. Analytical Methods, 4(4): 1110-1116 |
ELDERFIELD H, 1970. Chromium speciation in sea water. Earth and Planetary Science Letters, 9(1): 10-16 |
GARDNER M J, RAVENSCROFT J E, 1996. Determination of chromium (Ⅲ) and total chromium in marine waters. Fresenius Journal of Analytical Chemistry, 354(5/6): 602-605 |
GWIZDALA Ⅲ A B, JOHNSON S K, MOLLAH S, et al, 1997. Speciation of chromium (Ⅵ) and chromium (Ⅲ) using pneumatically assisted electrospray mass spectrometry. Journal of Analytical Atomic Spectrometry, 12(5): 503-506 |
HIRATA S, HONDA K, SHIKINO O, et al, 2000. Determination of chromium (Ⅲ) and total chromium in seawater by on-line column preconcentration inductively coupled plasma mass spectrometry. Spectrochimica Acta Part B: Atomic Spectroscopy, 55(7): l089-1099 |
LEŚNIEWSKA B, GODLEWSKA-ŻYŁKIEWICZ B, WILCZEWSKA A Z, 2012. Separation and preconcentration of trace amounts of Cr(Ⅲ) ions on ion imprinted polymer for atomic absorption determinations in surface water and sewage samples. Microchemical Journal, 105(1): 88-93 |
MARTÍNEZ-BRAVO Y, ROIG-NAVARRO A F, LÓPEZ F J, et al, 2001. Multielemental determination of arsenic, selenium and chromium(Ⅵ) species in water by high-performance liquid chromatography–inductively coupled plasma mass spectrometry. Journal of Chromatography A, 926(2): 265-274 |
MUGO R K, ORIANS K J, 1993. Seagoing method for the determination of chromium(Ⅲ) and total chromium in sea water by electron-capture detection gas chromatography. Analytica Chimica Acta, 271(1): 1-9 |
PANTSAR-KALLIO M, MANNINEN P K G, 1997. Simultaneous determination of toxic arsenic and chromium species in water samples by ion chromatography-inductively coupled plasma mass spectrometry. Journal of Chromatography A, 779(1/2): 139-146 |
REKHI H, RANI S, SHARMA N, et al, 2017. A review on recent applications of high-performance liquid chromatography in metal determination and speciation analysis. Critical Reviews in Analytical Chemistry, 47(6): 524-537 |
ROSMAN K J R, TAYLOR P D P, 1998. Isotopic compositions of the elements 1997 (Technical Report). Pure and Applied Chemistry, 70(1): 217-235 |
SUMIDA T, SABARUDIN A, OSHIMA M, et al, 2006. Speciation of chromium in seawater by ICP-AES with dual mini-columns containing chelating resin. Analytical Sciences, 22(1): 161-164 |
 2023, Vol. 54
2023, Vol. 54


