
中国海洋湖沼学会主办。
文章信息
- 胡希源, 周丽, 李超伦. 2023.
- HU Xi-Yuan, ZHOU Li, LI Chao-Lun. 2023.
- 基于贝壳生长轮方法的平端深海偏顶蛤的生长和年龄结构研究
- GROWTH AND AGE STRUCTURE OF GIGANTIDAS PLATIFRONS POPULATION BASED ON THE SHELL GROWTH RING METHOD
- 海洋与湖沼, 54(2): 465-471
- Oceanologia et Limnologia Sinica, 54(2): 465-471.
- http://dx.doi.org/10.11693/hyhz20220700193
文章历史
-
收稿日期:2022-07-23
收修改稿日期:2022-08-25
2. 中国科学院海洋生态与环境科学重点实验室 山东青岛 266071;
3. 中国科学院大学 北京 100049
2. Key Laboratory of Marine Ecology & Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China;
3. University of Chinese Academy of Science, Beijing 100049, China
深海曾被认为是生命的“荒漠”。然而热液、冷泉等化能生态系统的发现, 打破了这一认知, 深海也存在着生命的“绿洲”。自1977年首次发现热液喷口(Corliss et al, 1979)和1983年首次发现冷泉(Brooks et al, 1984)以来, 国内外对热液和冷泉生态系统的研究急剧增加。目前已在热液和冷泉生物群落结构(Cordes et al, 2007; 陈忠等, 2007; Yorisue et al, 2012)和物种组成(Sibuet et al, 1998; 程娇等, 2021)等方面取得了丰硕的研究成果。
平端深海偏顶蛤(Gigantidas platifrons)是一种广泛分布于西太平洋热液和冷泉生态系统中的无脊椎动物, 通常在热液/冷泉溢流口周边形成巨大的生物量, 是这些深海化能生态系统的主要优势种之一(Xu et al, 2019)。同时, 平端深海偏顶蛤在热液/冷泉区形成大规模的贻贝床, 可为其他底表生物提供附着基, 并能够改变海底溢出流体的扩散过程, 形成了深海化能生态系统中具有代表性的生境之一。由此可见, 平端深海偏顶蛤无论在深海化能生态系统的物质循环和能量流动, 还是生境营造和群落演替过程中都发挥着重要的作用。
目前, 围绕平端深海偏顶蛤的环境适应性(Miyazaki et al, 2013; 郑平, 2018)、繁殖策略和共生互作(王敏晓等, 2021)等方面已经开展了较为深入的研究。然而, 受制于深海调查和研究技术的限制, 对于表征其种群基本特征、预测种群动态变化的重要指标——种群年龄结构和生长速率的认知仍比较匮乏。已有的针对深海贻贝年龄结构的研究主要集中在热液区域(Rhoads et al, 1981; Nedoncelle et al, 2013), 对冷泉区域贻贝年龄结构的研究则鲜有报道。
浅海光照、温度、饵料供给等因素的周期性变化, 使得双壳类动物的贝壳生长速率呈现周期性变化, 进而在贝壳内部形成生长线, 例如贝壳年轮。目前, 贝壳年轮已成为定量研究双壳类动物年龄的有效指标之一(Macdonald et al, 1980)。然而, 深海环境相对稳定, 季节性变化十分微弱, 深海双壳类的贝壳年轮特征并不显著。深海贻贝主要依靠其鳃丝细胞中的化能合成共生菌提供能量, 其生长受到周边海水中还原性物质浓度的影响。已有研究表明, 深海贻贝栖息地海水中的还原性物质浓度呈现周期性变化, 潮汐引起的流向改变以及大潮-小潮的潮汐循环是其中原因之一(Chevaldonné et al, 1991; Johnson et al, 1994)。Schöne等(2005a)发现, 北斐济盆地热液贻贝Bathymodiolus brevior的贝壳结构显示出典型的受潮汐控制的微生长模式, 贝壳日生长率以两周为周期波动。Nedoncelle等(2013)在东太平洋热液口对Bathymodiolus thermophilus进行的标志重捕实验发现, 每一个全日潮周期, 贝壳可以形成一条生长线, 即每天形成一条生长线, 并且据此估算B. thermophilus最大年龄为19龄。因此, 基于深海双壳类贝壳的微生长线, 研究其生长速率以及年龄结构成为可能。
位于我国台湾西南海域的F冷泉是一个活动的冷泉区, 发育有成片的主要由平端深海偏顶蛤形成的贻贝床, 甲壳类、多毛类以及腹足类等随处可见, 生物量巨大, 共同形成了一个庞大的冷泉生态系统。本文利用在F冷泉区采集的平端深海偏顶蛤标本, 基于贝壳微生长线方法研究了平端深海偏顶蛤种群的年龄结构, 以期为了解冷泉环境下其种群动态变化规律提供基础数据。
1 材料与方法 1.1 实验材料本研究所使用的平端深海偏顶蛤样品来自于2020年的“科学号”南海冷泉航次, 采样区域(119.2856°E, 22.1154°N)位于我国台湾西南海域F冷泉区, 平端深海偏顶蛤通过电视抓斗采集。样品采集点水深1 171 m, 甲烷浓度4~8 μmol/L, 溶解氧浓度3.093 mg/L。
1.2 实验方法 1.2.1 贝壳长度测量用游标卡尺沿贝壳最大生长轴(maximum growth axis)测量贝壳从壳顶(umbo)到壳边缘(ventral margin)的长度, 并统计平端深海偏顶蛤壳长的频数分布。
1.2.2 贝壳切片将平端深海偏顶蛤样品按照10 mm一组从0到120 mm分为12组, 每组取1~3个贻贝用于实验, 使用解剖刀去除贝壳软组织, 用清水将贝壳清洗干净, 使用NaClO溶液浸泡6 h去除贝壳表面的角质层。将去除角质层的贝壳用环氧树脂包埋, 以防切割时贝壳碎裂。使用电锯沿着贝壳的最大生长轴两侧切割获得贝壳的中间部分。对于切割获得的中间部分, 使用电动研磨机、砂纸将贝壳切片研磨至1 mm左右, 最后使用Al2O3粉末对切片进行抛光, 为下一步蚀刻染色做准备。
 |
| 图 1 平端深海偏顶蛤贝壳示意图 Fig. 1 Schematic diagram of Gigantidas platifrons shell |
根据Schöne等(2005b)的方法, 配置Mutvei’s溶液[1 L的Mutvei’s溶液含有500 mL 3%的醋酸, 500 mL 25%的戊二醛和5 g的阿尔新蓝(alcian blue)粉末]。Mutvei’s溶液可以通过对生长线中的糖进行染色以及蚀刻生长线之间的生长增量来增强生长线的能见度。将抛光好的贝壳切片浸入37~40 ℃的Mutvei’s溶液中, 并持续搅拌, 浸泡2 h。
1.2.4 估算平端深海偏顶蛤年龄贝壳切片经蚀刻染色处理后, 用去离子水冲洗干净, 置于空气中干燥。在10倍光学显微镜下观察, 计数切片截面的生长线数量。F冷泉位于我国南海北部地区, 以全日潮为主(赵玖强等, 2019), 根据Nedoncelle等(2013)的结论, 可以认为平端深海偏顶蛤每天形成一条生长线。据此, 可通过生长线数量, 来估计贻贝个体的年龄, 并对贻贝的年龄和贝壳的长度进行指数拟合。在获得平端深海偏顶蛤的生长曲线后, 需要对生长模型的准确度进行验证, 随机取7个平端深海偏顶蛤的贝壳, 测量长度并制片蚀刻后, 将7个平端深海偏顶蛤的实际年龄和根据公式计算的年龄在固定斜率为1的情况下进行线性拟合。
1.2.5 平端深海偏顶蛤生长速率随机取9个平端深海偏顶蛤的贝壳切片, 测量每30条生长线之间的距离, 计算贻贝的生长速率, 并对贻贝的年龄和生长速率进行线性拟合。
1.2.6 统计学分析由于潮汐的大潮-小潮循环是按月变化的, 所以我们以月为周期研究平端深海偏顶蛤生长线间距的变化。取8个贝壳切片, 分别记为ABCDEFGH, 按照从贝壳边缘到贝壳顶端的方向, 从第一条生长线开始, 测量每30条生长线之间的距离(以30条生长线为一个月的周期)。使用SPSS, 按照AB, AC, ……, BC, ……, GH的分组, 对每组两个贝壳的生长线月间距进行独立样本T检验, P < 0.05视为差异显著。
2 结果 2.1 采样区域平端深海偏顶蛤的贝壳长度分布采样区域共获得348只平端深海偏顶蛤, 其贝壳长度分布如图 2所示。
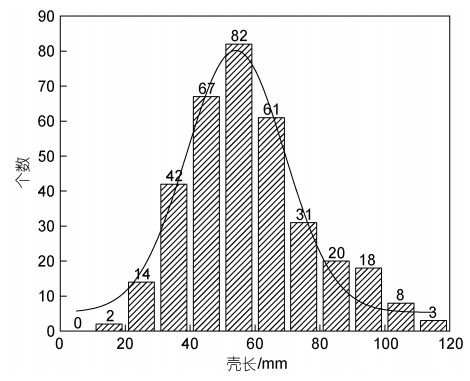 |
| 图 2 平端深海偏顶蛤的壳长分布 Fig. 2 The distribution in shell length of Gigantidas platifrons |
结果表明, 采样点所获得的平端深海偏顶蛤样品的平均壳长为58 mm, 最小壳长为18.7 mm, 最大壳长为110.7 mm, 优势壳长组集中在40~70 mm, 占群体总数的60%。壳长40 mm以下和70 mm以上的个体分别占16.7%和23%。因此, 该采样区域的平端深海偏顶蛤种群的壳长以40~70 mm为主, 壳长40 mm以下和70 mm以上的个体数量较少。
2.2 平端深海偏顶蛤的贝壳微结构冷泉平端深海偏顶蛤贝壳沿最大生长轴的切面示意图以及贝壳的微结构照片见图 3。
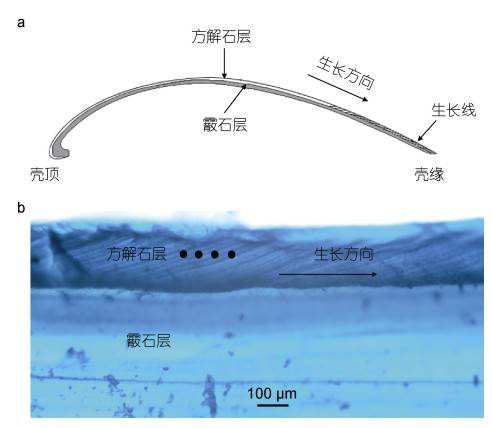 |
| 图 3 冷泉平端深海偏顶蛤贝壳沿最大生长轴的切面示意图(a)以及贝壳的微结构照片(b) Fig. 3 Schematic diagram of the shell section along the maximum growth axis (a) and the shell microstructure of the cold seep Gigantidas platifrons (b) |
贝壳由两种不同的碳酸盐矿物组成: 外层的方解石层和内层的霰石层。贝壳的生长线存在于贝壳的方解石层中。由于生长线中的有机物含量较多, 因此在酸的浸泡下生长线比周围的生长增量更加耐蚀, 能更加清晰的凸显出来。图 3中点标记的位置就是贝壳的生长线。
不同平端深海偏顶蛤贝壳之间对生长线月间距的差异性分析结果见表 1。
| A(78 mm) | B(75 mm) | C(57 mm) | D(55 mm) | E(86 mm) | F(45 mm) | G(35 mm) | H(67 mm) | |
| A | 0.581 | 0.120 | 0.842 | 0.005* | 0.000* | 0.000* | 0.000* | |
| B | 0.216 | 0.825 | 0.000* | 0.000* | 0.000* | 0.000* | ||
| C | 0.228 | 0.001* | 0.000* | 0.036* | 0.006* | |||
| D | 0.018* | 0.000* | 0.001* | 0.000* | ||||
| E | 0.000* | 0.000* | 0.000* | |||||
| F | 0.002* | 0.083 | ||||||
| G | 0.294 | |||||||
| 注: 表中字母代表不同的平端深海偏顶蛤个体, 括号中数值代表贝壳的长度, 中间的数字代表独立样本T检验的P值, 其中*代表显著性差异(P < 0.05) | ||||||||
结果表明, 长度相近的贝壳在最近一年的生长线月间距变化方面无显著性差异, 长度不同的贝壳在最近一年的生长线月间距变化方面存在显著性差异, 这说明贝壳的生长线宽度差异与贝壳的长度差异有关, 而贝壳的长度与贻贝的年龄之间有相关关系, 由此说明贝壳生长线间距的变化可以反映平端深海偏顶蛤随着时间的生长状况。
贝壳的生长速率见图 3。结果表明, 南海冷泉平端深海偏顶蛤的生长速率(y)和年龄(x)呈负相关关系(y=−0.856x+12.108), 该物种的最大生长速率为15 mm/年。尽管所有贝壳的生长周期相似, 但是个体间的生长速率差异很大, 相同贝壳大小的个体在其各自的生长模式上可能会随着时间的推移而表现出显著差异。如图 4中所示, 同样是1龄的情况下, 贝壳的生长速率在7~15 mm/年之间变化。
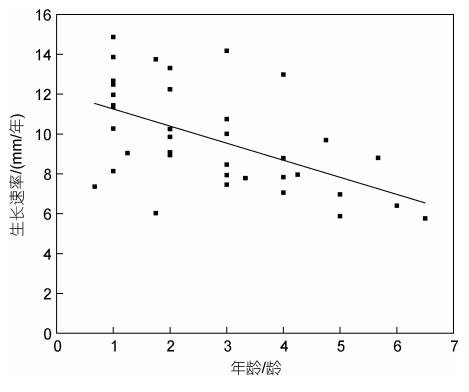 |
| 图 4 南海冷泉区平端深海偏顶蛤的生长速率变化 Fig. 4 Changes in growth rate of Gigantidas platifrons in cold seep of South China Sea |
经包埋、切割和蚀刻染色处理后, 获得32只平端深海偏顶蛤的贝壳切片。指数拟合获得的平端深海偏顶蛤的生长曲线如图 5所示。
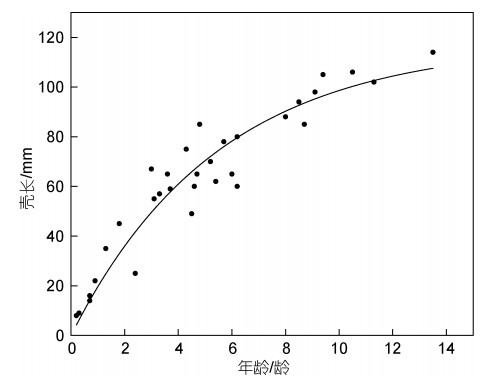 |
| 图 5 南海冷泉平端深海偏顶蛤的生长曲线(R2=0.90) Fig. 5 The growth line of SCS cold seep Gigantidas platifrons (R2=0.90) |
通过拟合2020年在南海F冷泉收集的32只平端深海偏顶蛤的壳长(L)和年龄(t), 获得采样位置平端深海偏顶蛤的生长方程为L=117×(1−e−0.184t)。本研究中分析的最大贝壳(L=114 mm)的年龄为13.5龄, 分析的最小贝壳(L=8 mm)的年龄为0.2龄。平端深海偏顶蛤在幼年时期生长速率较快, 随着年龄的逐渐增长, 生长速率逐渐降低。根据生长曲线可计算, 平端深海偏顶蛤在16龄时壳长达到最大。
2.4 平端深海偏顶蛤生长曲线模型的准确性检验将7个平端深海偏顶蛤的实际年龄和根据公式计算的年龄在固定斜率为1的情况下进行线性拟合, 获得的结果如图 6所示。
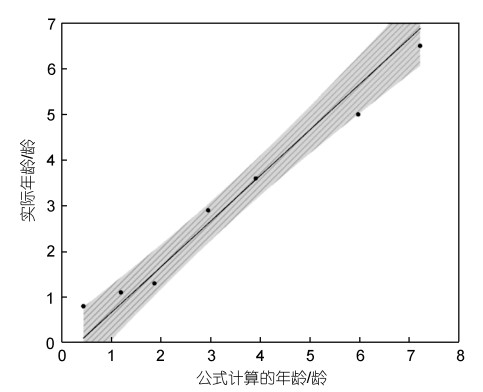 |
| 图 6 随机选取的样品的实际年龄和公式计算的年龄之间的线性拟合 Fig. 6 Linear fitting between the actual age and the age calculated by the formula of randomly selected samples 注: R2=0.96, 阴影部分代表 95%的置信区间 |
随机取的7个平端深海偏顶蛤的实际年龄和公式计算的年龄进行线性拟合后, R2=0.95, 可以认为实际年龄和公式计算的年龄之间的相关度较高, 进一步可以确定实验获得的平端深海偏顶蛤的生长曲线模型准确度较高。
2.5 采样区域平端深海偏顶蛤的年龄分布基于平端深海偏顶蛤的贝壳长度以及获得的生长曲线公式, 推算出采样区域平端深海偏顶蛤种群的年龄分布, 如图 7所示。
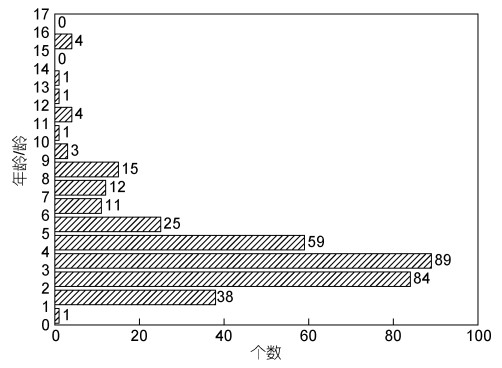 |
| 图 7 采样区域平端深海偏顶蛤种群的年龄结构 Fig. 7 The age structure of Gigantidas platifrons population in the sampling area 注: 图中数字代表各个年龄段的个体数 |
结果表明, 采样区域平端深海偏顶蛤种群的平均年龄4.1龄, 优势年龄组为2~3龄和3~4龄。其中, 3~4龄占比最高, 为总数的25.6%, 2~4龄占比24.1%; 1龄以下和9龄以上个体数量较少, 分别占总数的0.003%和0.04%。因此, 该采样区域的平端深海偏顶蛤种群以低龄个体为主, 老年个体占比很少, 是一个生命活力旺盛的区域, 在年龄结构上属于增长型。
3 讨论 3.1 Mutvei’s溶液蚀刻染色的优点传统的测量贝类生长速率的标志重捕法操作简单, 但对于深海环境而言, 标记个体的再捕获率很低; 同时, 该方法的主要标记方式为刻痕和粘贴标签, 在深海环境下由于技术条件的限制难以操作, 因此不适用于本研究。同样, 常用的钙黄绿素标记法由于需要对活体贝进行处理, 受平端深海偏顶蛤难以室内培养等技术条件的限制, 导致该方法也不适合应用在本次研究中。使用Mutvei’s溶液蚀刻染色的方法研究贝壳的生长线, 不需要使用活体贝, 且操作较为简单、成本低, 能够清晰地显现贝壳生长线, 适合用于冷泉平端深海偏顶蛤的生长速率和年龄研究。
3.2 F冷泉平端深海偏顶蛤的生长速率基于微生长线的结果显示, 南海F冷泉平端深海偏顶蛤的贝壳生长率在6~15 mm/年, 总体上看, 随着年龄增长, 其生长速率逐渐减小(图 4)。本研究的平端深海偏顶蛤取自同一区域, 相近壳长的平端深海偏顶蛤贝壳生长线月间距无显著性差异, 而不同壳长的贝壳生长线月间距具有显著性差异(表 1)。因此, 在相同的生长环境下, 年龄是影响平端深海偏顶蛤生长速率的因素之一。
Rhoads等(1981)为加拉帕戈斯山脊的B.thermophilus建立的生长模型表明, 该物种的最大贝壳长度能够达到18.4 cm, 估算的贻贝最大年龄为19龄, 成熟贻贝的生长速率在1 cm/年, 该物种位于热液区域, 以化学合成细菌的浓稠悬浮液为食, 这些细菌通过氧化热液喷口中释放的金属硫化物来获取能量。Schöne等(2005b)为北斐济盆地的热液贻贝B.brevior建立的生长模型展示了该物种所能达到的最大贝壳长度为14 cm, 最大年龄为18龄。Nedoncelle等(2013)针对东太平洋海隆V型热液喷口的B. thermophilus物种的研究表明, 在该热液区域收集到的贻贝最大贝壳长度能够达到20.5 cm, 与之对应的年龄为10龄, 根据生长线的趋势, 该物种可以达到最大贝壳长度21.45 cm。
我们的研究对象南海冷泉平端深海偏顶蛤能够达到的最大贝壳长度均不如上述三种热液双壳类物种, 最大年龄与东太平洋海隆的B. thermophilus相近, 小于加拉帕戈斯的B. thermophilus和北斐济盆地的B.brevior。冷泉平端深海偏顶蛤、B.brevior和加拉帕戈斯热液区的B. thermophilus在6龄之前的生长趋势基本一致; 在6龄之后, 南海冷泉平端深海偏顶蛤和东太平洋海隆的B. thermophilus的生长趋势仍基本一致, 生长速率迅速下降, 而加拉帕戈斯热液区的B. thermophilus仍保持较高的生长速率, 直到15龄后生长速率才显著下降(图 8)。生长速率的不同进一步解释了冷泉平端深海偏顶蛤和热液区贻贝在最大长度上的差异。冷泉平端深海偏顶蛤的生长速率远低于热液区域贻贝的生长速率, 可能是由于热液区域的金属硫化物含量比较充分, 与贻贝共生的硫氧化菌能够提供充足的能量供给生长。
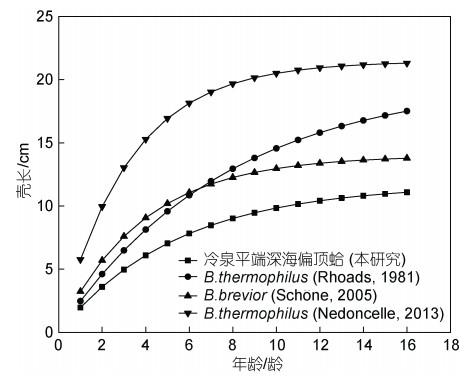 |
| 图 8 四种贻贝的生长曲线模型 Fig. 8 Growth curve models of four mussels |
采样区域的平端深海偏顶蛤贝壳长度集中在40~70 mm, 年龄集中在2~4龄, 说明该采样区域的平端深海偏顶蛤种群以低龄的贻贝为主。F冷泉是目前南海北部少有的几个活跃冷泉之一(Feng et al, 2018)。自从2002年F冷泉被发现以来, 后续的调查显示该冷泉一直处于活跃的喷涌状态, 虽然该区域的平端深海偏顶蛤已经发育了大片的贻贝床, 由于有充足的冷泉流体供给, 该种群依然处于旺盛的生长状态, 种群的年龄结构呈现正金字塔型(图 6)。1龄以下的贝所占比例很低, 可能是由于幼年贝刚刚脱离浮游状态进入定殖状态, 个体小, 加上附着区域被岩石阻挡不容易被抓斗捕获, 从而使幼年个体的捕获率较低造成的。
4 结论本文采用Mutvei’s溶液蚀刻染色的技术手段, 通过研究贝壳生长线, 分析了南海F冷泉区其中一个采样点的平端深海偏顶蛤年龄和壳长之间的关系, 建立了平端深海偏顶蛤的生长曲线模型L=117× (1−e−0.184t), 并依据这一模型确定了该区域贻贝的年龄结构, 揭示F冷泉贻贝种群依然处于增长的状态。本文的研究结果对于了解冷泉环境中这种贻贝的生长速率提供了基本资料, 为进一步研究深海贻贝的生活史奠定了基础。
王敏晓, 李超伦, 李梦娜, 等, 2021. 深海化能生态系统双壳纲共生体系互作机制研究进展. 海洋与湖沼, 52(2): 522-536 |
陈忠, 杨华平, 黄奇瑜, 等, 2007. 海底甲烷冷泉特征与冷泉生态系统的群落结构. 热带海洋学报, 26(6): 73-82 DOI:10.3969/j.issn.1009-5470.2007.06.013 |
郑平, 2018. 深海偏顶蛤(Bathymodiolus platifrons)对深海环境的适应性机制[D]. 青岛: 中国科学院大学(中国科学院海洋研究所).
|
赵玖强, 张艳伟, 刘志飞, 等, 2019. 南海北部深海潮汐的季节性变化特征. 中国科学: 地球科学, 49(4): 717-730 |
程娇, 沙忠利, 孙邵娥, 等, 2021. 深海化能生态系统大型生物多样性分布格局及其起源演化研究进展. 海洋与湖沼, 52(2): 508-521 |
BROOKS J M, KENNICUTT II M C, FAY R R, et al, 1984. Thermogenic gas hydrates in the gulf of Mexico. Science, 225(4660): 409-411 DOI:10.1126/science.225.4660.409 |
CHEVALDONNÉ P, DESBRUYÈRES D, LE HAÎTRE M, 1991. Time-series of temperature from three deep-sea hydrothermal vent sites. Deep Sea Research Part A. Oceanographic Research Papers, 38(11): 1417-1430 DOI:10.1016/0198-0149(91)90014-7 |
CORDES E E, CARNEY S L, HOURDEZ S, et al, 2007. Cold seeps of the deep Gulf of Mexico: community structure and biogeographic comparisons to Atlantic equatorial belt seep communities. Deep Sea Research Part I: Oceanographic Research Papers, 54(4): 637-653 DOI:10.1016/j.dsr.2007.01.001 |
CORLISS J B, DYMOND J, GORDON L I, et al, 1979. Submarine thermal springs on the galápagos rift. Science, 203(4385): 1073-1083 DOI:10.1126/science.203.4385.1073 |
FENG D, QIU J W, HU Y, et al, 2018. Cold seep systems in the South China Sea: an overview. Journal of Asian Earth Sciences, 168: 3-16 DOI:10.1016/j.jseaes.2018.09.021 |
JOHNSON K S, CHILDRESS J J, BEEHLER C L, et al, 1994. Biogeochemistry of hydrothermal vent mussel communities: the deep-sea analogue to the intertidal zone. Deep Sea Research Part I: Oceanographic Research Papers, 41(7): 993-1011 DOI:10.1016/0967-0637(94)90015-9 |
MACDONALD B A, THOMAS M L H, 1980. Age determination of the soft-shell clam Mya arenaria using shell internal growth lines. Marine Biology, 58(2): 105-109 DOI:10.1007/BF00396121 |
MIYAZAKI J I, BEPPU S, KAJIO S, et al, 2013. Dispersal ability and environmental adaptability of deep-sea mussels Bathymodiolus (mytilidae: bathymodiolinae). Open Journal of Marine Science, 3(1): 31-39 DOI:10.4236/ojms.2013.31003 |
NEDONCELLE K, LARTAUD F, D RAFELIS M, et al, 2013. A new method for high-resolution bivalve growth rate studies in hydrothermal environments. Marine Biology, 160(6): 1427-1439 DOI:10.1007/s00227-013-2195-7 |
RHOADS D C, LUTZ R A, REVELAS E C, et al, 1981. Growth of bivalves at deep-sea hydrothermal vents along the galápagos rift. Science, 214(4523): 911-913 DOI:10.1126/science.214.4523.911 |
SCHÖNE B R, DUNCA E, FIEBIG J, et al, 2005b. Mutvei's solution: an ideal agent for resolving microgrowth structures of biogenic carbonates. Palaeogeography, Palaeoclimatology, Palaeoecology, 228(1/2): 149-166 |
SCHÖNE B R, GIERE O, 2005a. Growth increments and stable isotope variation in shells of the deep-sea hydrothermal vent bivalve mollusk Bathymodiolus brevior from the North Fiji Basin, Pacific Ocean. Deep Sea Research Part I: Oceanographic Research Papers, 52(10): 1896-1910 |
SIBUET M, OLU K, 1998. Biogeography, biodiversity and fluid dependence of deep-sea cold-seep communities at active and passive margins. Deep Sea Research Part II: Topical Studies in Oceanography, 45(1/2/3): 517-567 |
XU T, FENG D, TAO J, et al, 2019. A new species of deep-sea mussel (Bivalvia: Mytilidae: Gigantidas) from the South China Sea: morphology, phylogenetic position, and gill-associated microbes. Deep Sea Research Part I: Oceanographic Research Papers, 146: 79-90 |
YORISUE T, INOUE K, MIYAKE H, et al, 2012. Trophic structure of hydrothermal vent communities at Myojin Knoll and Nikko Seamount in the northwestern Pacific: implications for photosynthesis-derived food supply. Plankton and Benthos Research, 7(2): 35-40 |
 2023, Vol. 54
2023, Vol. 54


