中国海洋湖沼学会主办。
文章信息
- 张玉敏, 王玉萌, 宫相忠. 2023.
- ZHANG Yu-Min, WANG Yu-Meng, GONG Xiang-Zhong. 2023.
- 应用响应曲面法优化萱藻丝状体单室孢子囊发育条件
- OPTIMIZATION OF DEVELOPMENTAL CONDITIONS OF UNICELLULAR SPORANGIA OF FILAMENTS OF SCYTOSIPHON LOMENTARIA BY RESPONSE SURFACE METHODOLOGY (RSM)
- 海洋与湖沼, 54(2): 483-492
- Oceanologia et Limnologia Sinica, 54(2): 483-492.
- http://dx.doi.org/10.11693/hyhz20220600167
文章历史
-
收稿日期:2022-06-24
收修改稿日期:2022-09-12
萱藻(Scytosiphon lomentaria)隶属于褐藻门(Phaeophyta), 褐藻纲(Phaeosporeae), 萱藻科(Scytosiphonaceae), 系泛温带性海藻。萱藻在世界范围内分布广泛, 主要分布于北美洲及南美洲东西两岸(Contreras et al, 2009; Saunders et al, 2013; Ponce et al, 2019)、亚洲的鄂霍次克海及日本海沿岸(Kuda et al, 2005)以及南极洲南设得兰群岛的沿海海域(Pellizzari et al, 2017), 在中国主要分布于辽东半岛至广东省海陵岛之间的沿海海域(庄琰等, 2014)。萱藻具有异形世代交替的生活史, 孢子体包括三种存在形式: 丝状体、垫状体和类垫状体(邢永泽等, 2010), 其中丝状体作为萱藻工厂化育苗的种质, 是产生单室孢子囊释放游孢子的主要形式。丝状体的营养藻丝细胞多呈现直筒状, 由营养生长向生殖生长转化时, 细胞体积膨大形成单室孢子囊, 孢子囊多呈现念珠状。该过程需要改变环境条件进行诱导, 若环境条件的设置不合适, 丝状体的发育将趋于“停滞”状态, 形成的孢子囊比例低且发育质量差, 释放的游孢子数量也难以满足采苗需求。因此, 在掌握了萱藻丝状体最佳扩增条件的基础上, 探索孢子囊发育的最佳环境条件成为实现萱藻工厂化育苗的关键环节之一。目前对萱藻丝状体孢子囊发育条件的研究主要应用单因素试验方法, 单因素试验中孢子囊发育的最佳条件为温度20 ℃、光照强度28.8 μmol/(m2·s)、外加氮浓度24.00 mg/L, 外加磷浓度5.28 mg/L (高伟, 2012; 洪丽珍, 2015)。单因素试验方法虽然具有简单直观等优点, 但是默认因素之间无相关性, 试验所获得结论并非最优方案。因此, 为确定萱藻丝状体孢子囊发育的最佳条件, 进一步提高丝状体孢子囊比例和发育质量, 不仅需要选择合适的因素, 还要考虑多个因素间的交互作用。
常用的优化试验的设计方法主要有正交设计、均匀设计和析因设计, 然而这些方法在实际应用过程中存在诸多不足, 例如试验次数多、试验结果有局限性、精确性差并且未考虑因素之间的交互作用等。响应曲面法(RSM)是一种以回归方程作为函数估算的优化试验方法, 运用多元二次回归数学模型拟合影响因子和响应值之间的函数关系, 通过试验设计、数学建模和模型检验对各因素及其交互作用进行评价, 最终得出预测的响应最优值及相应试验条件。相比于其他几种优化试验的设计方法, RSM具有精确度高、预测结果可靠、分析维度多等优点。随着生物统计学的发展, RSM的应用领域不再仅仅局限于化学工业, 在生物学、医学以及制药领域也获得了广泛应用(Bezerra et al, 2008; Li et al, 2009; Arokiadass et al, 2012; Gopalakannan et al, 2013; Joardar et al, 2014; Chelladurai et al, 2021), 例如在海藻养殖领域, Changpasert等(2020)应用响应曲面法优化蛋白核小球藻(Chlorella pyrenoidosa)的培养条件, 经优化后其生物量和含脂量均比单因素试验结果提高了98.28%和59.11%。谢丽丹等(2017)应用Box-Behnken中心组合原理建立数学模型, 确定了螺旋藻培养基的最佳配方, 使藻蓝蛋白含量比室外养殖采用的半合成培养基提高了23.00%。
本研究在单因素试验的基础上, 选取了影响萱藻丝状体孢子囊诱导的关键环境因素——温度、光照强度、外加氮浓度和外加磷浓度, 为进一步优化孢子囊的发育条件, 应用响应曲面法中的Box-Behnken设计对丝状体单室孢子囊诱导条件进行了优化试验, 并对该条件下单位鲜重丝状体所放散的游孢子数量进行了比较, 旨在进一步提高丝状体的孢子囊比例以及促进孢子囊发育和游孢子放散的同步性, 为实现萱藻工厂化育苗和规模化养殖提供理论依据。
1 材料与方法 1.1 材料试验所用萱藻丝状体取自本实验室萱藻种质库。用加有F1培养液(毕萌等, 2022)的天然灭菌海水在充气扩增培养条件下获取足量的丝状体, 扩增条件为温度(22±0.5) ℃, 光周期L︰D = 14︰10, 光照强度(57.6±3.6) μmol/(m2·s), 充气流量3 L/min, 天然灭菌海水盐度32 (陈立彪等, 2020)。
1.2 单因素试验在确定最佳温度时, 取生长状态良好的萱藻丝状体, 用组织匀浆机打碎、镜检, 获得平均长度为250~300 µm的丝状体藻段, 加入F1培养液配成密度为(2±0.05) mg/mL的丝状体藻液, 取200 mL藻液放入250 mL锥形瓶。温度梯度设置为11.0、14.0、17.0、20.0、23.0 ℃。其他培养条件为: 光周期为10L︰14D, 光照强度为43.2 μmol/(m2·s), 静置培养。每天定时摇瓶3次, 每7 d全量更换培养液, 试验周期为20 d。
在确定最佳光照强度时, 光照强度梯度设置为14.4、28.8、43.2、57.6、72.0 (±3.6) μmol/(m2·s)。其他培养条件为: 温度17 ℃, 光周期10L︰14D, 静置培养。每天定时摇瓶3次, 每7 d全量更换培养液, 试验周期为20 d。
在确定最佳外加氮浓度时, 设置外加氮浓度梯度为10、20、30、40、50 mg/L。其他培养条件为: 温度17 ℃, 光照强度43.2 μmol/(m2·s), 光周期为10L︰14D, 以去氮F1培养液为基础, 分别配置NaNO3浓度梯度为10、20、30、40、50 mg/L的培养液, 静置培养。每天定时摇瓶3次, 每7 d全量更换培养液, 试验周期为20 d。
在确定最佳外加磷浓度时, 设置外加磷浓度梯度为2、7、12、17、22 mg/L。其他培养条件为: 温度为17 ℃, 光照强度为43.2 μmol/(m2·s), 光周期为10L︰14D, 以去磷F1培养液为基础, 分别配置NaH2PO4浓度梯度为2、7、12、17、22 mg/L的培养液, 静置培养。每天定时摇瓶3次, 每7 d全量更换培养液, 试验周期为20 d。
以萱藻丝状体孢子囊比例作为孢子囊发育质量的评价指标。试验20 d时, 以滴管吸取萱藻孢子体藻液, 在10×40倍镜下, 随机观察10个视野并记录相应孢子囊的数量, 孢子囊比例的计算公式如下:

取1 g诱导结束后的丝状体进行阴干放散操作, 用血球计数板计算游孢子数量。
1.3 响应曲面优化试验在单因素试验的基础上, 应用以RSM为依据的Box-Behnken设计, 进行四因素三水平试验设计, 以温度、光照强度、外加氮浓度和外加磷浓度为自变量, 分别用X1、X2、X3和X4表示, 并以−1、0、1代表自变量的低、中、高水平, 以孢子囊比例为响应量, 试验因素及水平见表 1。
| 因素 | 符号 | 水平 | ||
| −1 | 0 | 1 | ||
| 温度/℃ | X1 | 17 | 20 | 23 |
| 光照强度/[μmol/(m2·s)] | X2 | 14.4 | 28.8 | 43.2 |
| 外加氮浓度/(mg/L) | X3 | 20 | 30 | 40 |
| 外加磷浓度/(mg/L) | X4 | 2 | 7 | 12 |
将萱藻丝状体置于RSM模型预测的优化条件下进行孢子囊诱导试验, 并与对照组的萱藻丝状体发育状况进行比较。优化诱导条件为温度17.7 ℃, 光照强度30.3 μmol/(m2·s), 外加氮浓度37.4 mg/L, 外加磷浓度10.6 mg/L, L︰D=10︰14, 所用培养液为去氮去磷F1培养液; 对照组条件为温度20 ℃, 光照强度28.8 μmol/(m2·s), 外加氮浓度40 mg/L, 外加磷浓度为7 mg/L, L︰D=10︰14, 所用培养液为去氮去磷F1培养液。当萱藻丝状体生物量达到试验要求时, 各取1g (湿重)萱藻丝状体分别对其进行游孢子放散。游孢子放散条件为温度12 ℃, 光照强度72 μmol/(m2·s), L︰D=10︰14。放散30 min后, 以血球计数板分别计算两组单位质量萱藻丝状体的游孢子放散量。
1.5 数据分析采用数据统计软件Excel 2019和Sigmaplot 14.0软件对试验结果进行分析和制图。试验设计应用Design Expert 10.0.7软件进行Box-Behnken方法的响应曲面优化试验设计, 并对数据进行相关线性拟合, 通过拟合后线性关系制作预测结果等高线和响应曲面图(孙双等, 2021)。
2 结果 2.1 单因素试验如图 1a所示, 以F1培养液为基础, 在光照强度为43.2 μmol/(m2·s)时, 随着温度的升高, 丝状体孢子囊比例呈现先上升后下降的趋势。温度过高, 丝状体生长发育受到限制, 当温度为20 ℃时, 其孢子囊比例达到最大值31.60%±0.88%。
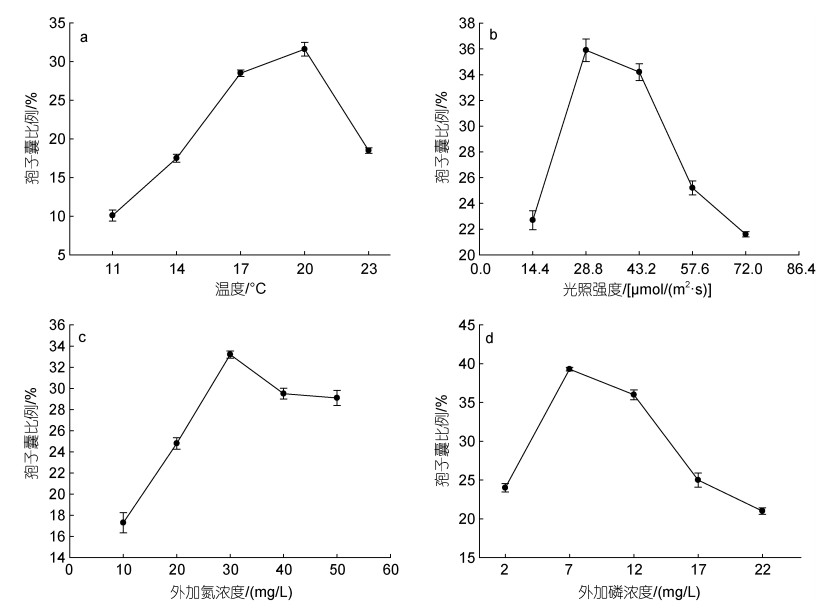 |
| 图 1 温度(a)、光照强度(b)、外加氮浓度(c)和外加磷浓度(d)对萱藻丝状体孢子囊比例影响 Fig. 1 Effects of temperature (a), light intensity (b), added nitrogen concentration (c), and added phosphorus concentration(d) on the sporangium ratio of filaments of S. lomentaria |
如图 1b所示, 以F1培养液为基础, 在温度为17 ℃时, 随着光照强度的增强, 丝状体孢子囊比例呈现先上升后下降的趋势。在光照强度为28.8 μmol/(m2·s)时, 其孢子囊比例达到最大值35.90%±0.87%。
如图 1c所示, 以去氮F1培养液为基础, 在温度为17 ℃、光照强度为43.2 μmol/(m2·s)的条件下, 随着外加氮浓度的增大, 丝状体孢子囊比例呈现先上升后下降的趋势。在外加氮浓度为30 mg/L时, 其孢子囊比例达到最大值33.20%±0.33%。
如图 1d所示, 以去磷F1培养液为基础, 在温度为17 ℃、光照强度为43.2 μmol/(m2·s)的条件下, 随着外加磷浓度的增大, 丝状体孢子囊比例呈现先上升后下降再趋于平稳的趋势。在外加磷浓度为7 mg/L时, 其孢子囊比例达到最大值39.30%±0.23%。
2.2 响应曲面优化试验依据单因素试验结果, 选择温度(X1)、光照强度(X2)、外加氮浓度(X3)、和外加磷浓度(X4)为自变量, 丝状体孢子囊比例为响应值, 应用Box-Behnken试验设计优化萱藻丝状体孢子囊的发育条件, 结果见表 2。
| 试验编号 | X1 | X2 | X3 | X4 | 孢子囊比例/% |
| 1 | 0 | 0 | 0 | 0 | 19.75 |
| 2 | 1 | 0 | 0 | −1 | 10.57 |
| 3 | –1 | 0 | 1 | 0 | 31.70 |
| 4 | 0 | 0 | 0 | 0 | 23.99 |
| 5 | 1 | 0 | 0 | 1 | 24.70 |
| 6 | −1 | 0 | −1 | 0 | 14.55 |
| 7 | 0 | 1 | 0 | 1 | 28.71 |
| 8 | −1 | 0 | 0 | −1 | 21.09 |
| 9 | 1 | 0 | 1 | 0 | 15.02 |
| 10 | 1 | 0 | −1 | 0 | 18.67 |
| 11 | 0 | 0 | 1 | −1 | 14.01 |
| 12 | 0 | 0 | −1 | 1 | 14.54 |
| 13 | −1 | 0 | 0 | 1 | 23.51 |
| 14 | 0 | 0 | −1 | −1 | 17.95 |
| 15 | −1 | −1 | 0 | 0 | 39.25 |
| 16 | 1 | −1 | 0 | 0 | 28.48 |
| 17 | 0 | −1 | 0 | 1 | 34.98 |
| 18 | 0 | 0 | 0 | 0 | 24.19 |
| 19 | 0 | 1 | 0 | −1 | 18.37 |
| 20 | 0 | −1 | 0 | −1 | 31.02 |
| 21 | 1 | 1 | 0 | 0 | 19.66 |
| 22 | −1 | 1 | 0 | 0 | 28.50 |
| 23 | 0 | −1 | 1 | 0 | 37.88 |
| 24 | 0 | 0 | 1 | 1 | 28.20 |
| 25 | 0 | −1 | −1 | 0 | 20.41 |
| 26 | 0 | 0 | 0 | 0 | 23.28 |
| 27 | 0 | 1 | −1 | 0 | 28.53 |
| 28 | 0 | 1 | 1 | 0 | 19.28 |
| 29 | 0 | 0 | 0 | 0 | 25.43 |
应用响应曲面软件Design Expert 10.0.7进行多元回归拟合, 建立了目标函数孢子囊比例与温度、光照强度、外加氮浓度和外加磷浓度的回归模型方程式:
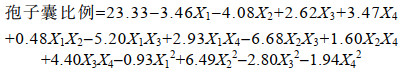
对这个模型进行回归与方差分析, 结果见表 3。
| 方差来源 | 平方和 | 自由度 | 均方 | F值 | P值 | 显著性 |
| X1 | 143.52 | 1 | 143.52 | 35.74 | < 0.001 | ** |
| X2 | 199.84 | 1 | 199.84 | 49.77 | < 0.001 | ** |
| X3 | 82.37 | 1 | 82.37 | 20.51 | < 0.001 | ** |
| X4 | 144.42 | 1 | 144.42 | 35.97 | < 0.001 | ** |
| X1X2 | 0.93 | 1 | 0.93 | 0.23 | 0.64 | |
| X1X3 | 108.16 | 1 | 108.16 | 26.94 | < 0.001 | ** |
| X1X4 | 34.28 | 1 | 34.28 | 8.54 | 0.01 | * |
| X2X3 | 178.49 | 1 | 178.49 | 44.45 | < 0.001 | ** |
| X2X4 | 10.18 | 1 | 10.18 | 2.53 | 0.13 | |
| X3X4 | 77.44 | 1 | 77.44 | 19.29 | < 0.001 | ** |
| X12 | 5.66 | 1 | 5.66 | 1.41 | 0.25 | |
| X22 | 272.98 | 1 | 272.98 | 67.98 | < 0.001 | ** |
| X32 | 51.00 | 1 | 51.00 | 12.70 | < 0.01 | ** |
| X42 | 24.42 | 1 | 24.42 | 6.08 | 0.03 | * |
| 模型 | 1 415.67 | 14 | 101.12 | 25.18 | < 0.001 | ** |
| 残差 | 56.22 | 14 | 4.02 | |||
| 失拟项 | 37.81 | 10 | 3.78 | 0.82 | 0.64 | 不显著 |
| 纯误差 | 18.40 | 4 | 4.60 | |||
| 注: **差异极显著(P < 0.01), *差异显著(P < 0.05) | ||||||
由表 3可知, 模型极显著(P < 0.01), 失拟项不显著(P > 0.05), 表明该模型可靠。经计算回归方程相关系数R2为0.96, 意味着该模型可以很好地解释96%的实验结果, 校正相关系数Adj-R2为0.92, 说明模型拟合度高。由F值可知, 各因素对丝状体孢子囊比例的影响程度从强到弱依次为: 光照强度 > 外加磷浓度 > 温度 > 外加氮浓度, 且结合表中P值可知, 温度和外加氮浓度的交互项(X1X3)、温度和外加磷浓度的交互项(X1X4)、光照强度和外加氮浓度的交互项(X2X3)、外加氮浓度和外加磷浓度的交互项(X3X4)、光照强度的二次项(X22)、外加氮浓度的二次项(X32)、外加磷浓度的二次项(X42)为显著影响因素(P < 0.05), 其他因素影响较小。
根据回归方程作各因素对孢子囊比例影响的响应曲面图, 结果见图 2。
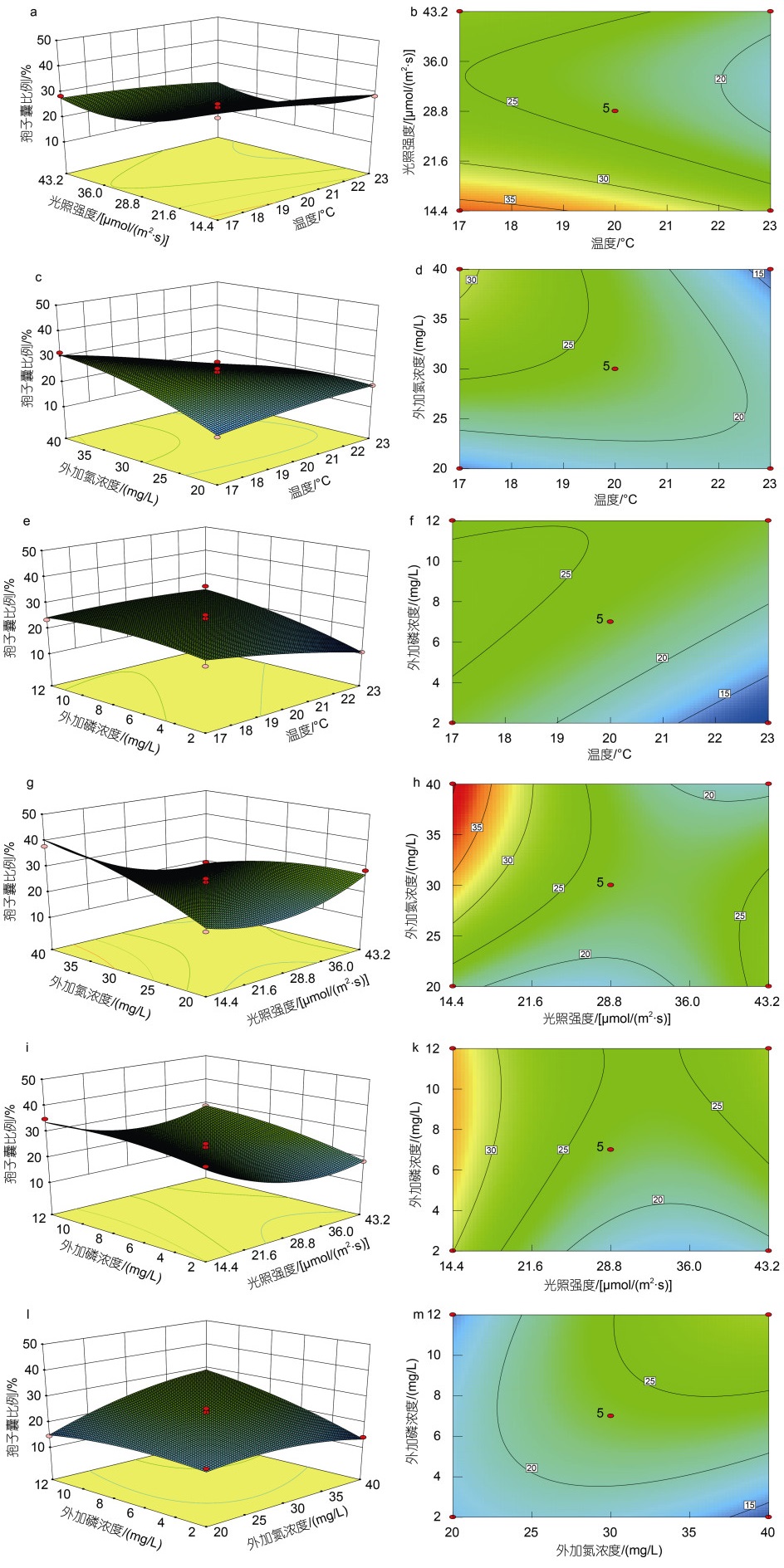 |
| 图 2 各因素两两交互作用对萱藻丝状体孢子囊比例影响的响应曲面图 Fig. 2 The response surface of pair-to-pair interaction of different factors on the sporangium ratio of filaments of S. lomentaria. 注: 等高线图为响应曲面底部放大图 |
为进一步分析温度、光照强度、外加氮浓度和外加磷浓度对丝状体孢子囊发育的影响, 将其中任一因素固定为0水平, 可得到另外两个因素交互作用的响应曲面图和等高线, 如图 2所示。其中, 温度和外加氮浓度的交互项(X1X3)、温度和外加磷浓度的交互项(X1X4)、光照强度和外加氮浓度的交互项(X2X3)、外加氮浓度和外加磷浓度的交互项(X3X4)的等高线形状趋向于椭圆形, 等高线密度大, 响应曲面图坡度陡, 表明因素间交互作用显著。该结果与表 3回归方程方差分析结果一致, 即X1X3、X1X4、X2X3、X3X4的P值均小于0.05。
2.3 模型验证通过模型预测分析, 丝状体孢子囊诱导的最佳条件为温度17.67 ℃, 光照强度30.32 μmol/(m2·s), 外加氮浓度37.37 mg/L, 外加磷浓度10.63 mg/L。此时模型预测丝状体孢子囊比例为44.60%。为检验模型预测的可靠性, 采用上述条件进行丝状体孢子囊诱导试验。通过三组平行试验得到丝状体孢子囊比例为(48.92%±5.58%), 与预测值差异不显著, 表明通过响应曲面法优化得到的最佳条件准确可靠, 具有实用价值。该试验结果显著高于单因子试验中萱藻丝状体孢子囊比例, 分别提高了54.81%、36.27%、47.35%和24.48%, 同时均高于Box-Behnken中心组合方法测定29种组合方式的孢子囊比例。
2.4 优化诱导后萱藻丝状体发育质量评价优化诱导前后丝状体发育比较结果表 4所示。优化诱导条件为温度17.67 ℃, 光照强度30.32 μmol/(m2·s), 外加氮浓度37.37 mg/L, 外加磷浓度10.63 mg/L, L︰D=10︰14, 所用培养液为去氮去磷F1培养液, 在此条件下诱导20 d, 丝状体孢子囊比例为48.92%± 5.58%。对照组的丝状体孢子囊比例为34.80%± 4.29%。优化诱导后的萱藻丝状体孢子囊比例约为对照组的1.41倍, 孢子囊细胞呈深褐色, 细胞质充盈, 放散后的单室孢子囊呈空泡状, 孢子囊发育程度佳(图 3b), 而对照组的孢子囊细胞呈浅褐色, 细胞质部分中空, 孢子囊发育程度欠佳(图 3a)。为评价优化诱导后萱藻丝状体游孢子放散量, 在相同条件下对丝状体进行游孢子放散, 结果表明: 优化诱导后的丝状体游孢子放散量(3.33×106 ind./g FW)约为对照组(1.67×106 ind./g FW)的1.99倍, 因此优化后的游孢子放散密度显著高于优化前的密度, 优化条件下的孢子囊直径(23.48 μm± 0.15 μm)高于对照组(20.17 μm±0.23 μm)(P < 0.05)。
 |
孢子囊比例/% | 孢子囊直径/μm | 游孢子放散量/(×106 ind./g FW) |
| 优化培养前 | 34.80±4.29 | 20.17±0.23 | 1.67 |
| 优化培养后 | 48.92±5.58 | 23.48±0.15 | 3.33 |
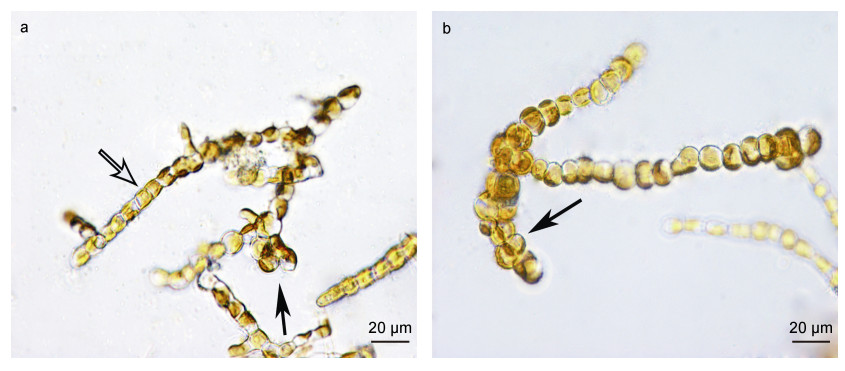 |
| 图 3 优化诱导前后萱藻丝状体发育的比较 Fig. 3 Comparison in the development filaments of S. lomentaria before and after optimized culture 注: a. 优化诱导前萱藻丝状体; b. 优化诱导后萱藻丝状体; 实心箭头指示成熟孢子囊, 空心箭头指示营养藻丝 |
萱藻丝状体只有在适宜的环境条件下才会由营养生长向生殖生长转化, 若不改变环境条件, 孢子囊发育将进入“停滞”状态, 导致丝状体的念珠状孢子囊细胞比例低且发育不同步, 游孢子释放同步性差, 造成育苗的丝状体利用率低, 游孢子放散密度达不到采苗要求, 进而出现苗种发育不同步现象, 最终不利于萱藻苗种繁育的规模化生产。因此, 确定萱藻丝状体孢子囊诱导的最佳条件对于提高孢子囊发育和游孢子放散的同步性, 进一步提高萱藻工厂化苗种繁育水平具有重要意义。温度、光照强度、营养盐等因素对萱藻孢子囊发育具有重要影响, 本研究通过单因素试验确定的最佳诱导条件为温度20.00 ℃、光照强度28.80 μmol/(m2·s)、外加氮浓度30.00 mg/L、外加磷浓度7.00 mg/L。单因素试验方法设计简单明了, 试验针对性强, 所得结果直观, 但是默认各因素对结果影响的地位相同, 无法区分各因素的重要程度, 因此需要对单因素试验法所获得的结果进一步优化。Ahuja等(2020)应用响应曲面法优化杜氏盐藻Dunaliella salina生长发育条件, 优化条件下的生物量比单因素试验结果提高了2.17倍。赵鹏等(2015)应用响应曲面法优化小球藻Chlorella sp.U4341的培养条件, 优化条件下油脂产率比单因素试验结果提高了54%。罗龙皂等(2019)应用响应曲面法优化近具刺链带藻(Desmodesmus sp. CHXl)的生长条件, 优化条件下的生物量比单因素试验结果最大提高了32%。本研究在单因素试验的基础上, 应用响应曲面法优化萱藻丝状体单室孢子囊的发育条件, 优化后的最佳诱导条件是温度17.67 ℃, 光照强度30.32 μmol/(m2·s), 外加氮浓度37.37 mg/L, 外加磷浓度10.63 mg/L。各因素对孢子囊比例的影响大小为: 光照强度>外加磷浓度>温度>外加氮浓度。光照强度是影响孢子囊形成的关键环境因子之一, 在紫菜壳斑藻的培养中, 最高光强在7月初至8月初应调节为30.00 μmol/(m2·s)左右, 8月初到9月初应调节为15.00 μmol/(m2·s)左右, 这样可以保证8月中下旬形成大量的壳孢子囊进而获得足量的壳孢子, 在光强低于2.00 μmol/(m2·s)或者高于20.00 μmol/(m2·s)条件下壳孢子囊形成均很少, 在本试验中发现, 在光照强度超过57.60 μmol/(m2·s)的条件下, 丝状体更倾向于营养生长(何培民等, 2018), 产生大量直筒状细胞。另外, 与外加磷浓度为2.00 mg/L的条件相比, 外加磷浓度超过7.00 mg/L的丝状体念珠状细胞比例高, 原生质体浓厚。
萱藻丝状体生殖生长阶段的最佳环境条件与营养生长阶段相比有所差异, 王玉萌等(2022)利用响应面法优化得到丝状体扩增的最佳条件为温度20.45 ℃, 光照强度78.13 μmol/(m2·s), 外加氮磷比16.19。试验结果显示丝状体孢子囊发育的最佳温度(17.67 ℃)低于其营养生长阶段(20.45 ℃), 这一规律与萱藻丝状体在自然条件下的生长发育环境相适应。丝状体孢子囊发育的最佳外加氮浓度(37.37 mg/L)低于其营养生长阶段(48.57 mg/L), 当外加氮浓度超过40 mg/L时, 不利于萱藻丝状体孢子囊形成与发育, 这是由于氮浓度过高将会影响丝状体的碳代谢, 造成碳水化合物合成减少, 进而影响其生殖生长(韩宝芹等, 2000)。因此要使丝状体由营养生长向生殖生长转化, 需要对环境条件进行精确调控, 在最佳条件范围内设置营养盐浓度。
4 结论应用响应曲面法优化萱藻丝状体单室孢子囊的发育条件, 优化后的最佳诱导条件为温度17.67 ℃, 光照强度30.32 μmol/(m2·s), 外加氮浓度37.37 mg/L, 外加磷浓度10.63 mg/L。在该条件下诱导培养20 d, 萱藻丝状体孢子囊比例为48.92%±5.58%, 约为对照组的1.41倍, 孢子囊直径(23.48 μm±0.15 μm)显著高于对照组(20.17 μm±0.23 μm)(P < 0.05)。对丝状体进行阴干刺激(17 ℃, 2 h)后结果显示: 优化培养后的丝状体游孢子放散量(3.33×106 ind./g FW)约为对照组(1.67×106 ind./g FW)的1.99倍。研究表明, 利用响应曲面法对萱藻丝状体单室孢子囊的发育条件进行优化, 不仅可以提高孢子囊比例, 还可以促进孢子囊发育和游孢子放散的同步性。
王玉萌, 刘德举, 张玉敏, 等, 2022. 应用响应曲面法优化萱藻丝状体扩增条件. 水产学报, 46(9): 1646-1655 |
邢永泽, 宫相忠, 尹宝树, 2010. 萱藻不同发育阶段形态学及生活史的研究. 中国海洋大学学报, 40(8): 98-102 |
毕萌, 宫相忠, 庄英瑞, 等, 2022. 温度对不同地理种群萱藻孢子附着、萌发及幼配子体早期发育的影响. 海洋湖沼通报, 44(3): 71-77 |
庄琰, 宫相忠, 张文健, 等, 2014. 萱藻丝状体的种质保存技术. 水产学报, 38(7): 1026-1033 |
孙双, 张婷, 方琰, 等, 2021. 雨生红球藻高产虾青素的培养条件优化. 现代食品科技, 37(6): 98-107 DOI:10.13982/j.mfst.1673-9078.2021.6.1000 |
何培民, 张泽宇, 张学成, 等, 2018. 海藻栽培学. 北京: 科学出版社, 2-3
|
陈立彪, 朱凤妹, 李军, 2020. 响应面法优化黑参中类黑精的提取工艺. 食品工业, 41(10): 66-70 |
罗龙皂, 曾凡健, 田光明, 2019. 藻-菌系统中微藻生长条件的响应面法优化. 浙江大学学报(农业与生命科学版), 45(1): 95-101 |
赵鹏, 徐军伟, 余旭亚, 2015. 响应面法优化混合培养微藻Chlorella sp.U4341油脂产率的研究. 食品工业科技, 36(19): 207-212 |
洪丽珍, 2015. 培养液对萱藻(Scytosiphon lomentaria)丝状体生长与孢子囊发育的影响[D]. 青岛: 中国海洋大学: 63-64.
|
高伟, 2012. 环境因子对萱藻(Scytosiphon lomentaria)丝状体扩增及孢子囊发育的影响[D]. 青岛: 中国海洋大学: 64.
|
韩宝芹, 崔竞进, 刘涛, 等, 2000. 植物激素对海带配子体克隆附着的影响. 青岛海洋大学学报, 30(4): 627-630 |
曾呈奎, 吴超元, 任国忠, 1962. 温度对海带配子体生长发育的影响. 海洋与湖沼, 4(1/2): 22-28 |
谢丽丹, 王素英, 2017. 响应面法优化螺旋藻培养基. 浙江农业学报, 29(2): 307-314 |
AHUJA S, ROY A, KUMAR L, et al, 2020. Media optimization using Box Behnken design for enhanced production of biomass, beta-carotene and lipid from Dunaliella salina. Vegetos, 33(1): 31-39 |
AROKIADASS R, PALANIRADJA K, ALAGUMOORTHI N, 2012. Prediction and optimization of end milling process parameters of cast aluminium based MMC. Transactions of Nonferrous Metals Society of China, 22(7): 1568-1574 |
BEZERRA M A, SANTELLI R E, OLIVEIRA E P, et al, 2008. Response surface methodology (RSM) as a tool for optimization in analytical chemistry. Talanta, 76(5): 965-977 |
CHANGPASERT W, WONG S L, 2020. Optimized process parameters for production of Chlorella pyrenoidosa biomass and lipids using response surface methodology. Aquaculture International, 28(3): 1213-1226 |
CHELLADURAI S J S, MURUGAN K, RAY A P, et al, 2021. Optimization of process parameters using response surface methodology: a review. Materials Today: Proceedings, 37: 1301-1304 |
CONTRERAS L, MELLA D, MOENNE A, et al, 2009. Differential responses to copper-induced oxidative stress in the marine macroalgae Lessonia nigrescens and Scytosiphon lomentaria (Phaeophyceae). Aquatic Toxicology, 94(2): 94-102 |
GOPALAKANNAN S, SENTHILVELAN T, 2013. Application of response surface method on machining of Al–SiC nano-composites. Measurement, 46(8): 2705-2715 |
JOARDAR H, DAS N S, SUTRADHAR G, et al, 2014. Application of response surface methodology for determining cutting force model in turning of LM6/SiCP metal matrix composite. Measurement, 47: 452-464 |
KUDA T, TSUNEKAWA M, HISHI T, et al, 2005. Antioxidant properties of dried 'kayamo-nori', a brown alga Scytosiphon lomentaria (Scytosiphonales, Phaeophyceae). Food Chemistry, 89(4): 617-622 |
LI X, OUYANG J, XU Y, et al, 2009. Optimization of culture conditions for production of yeast biomass using bamboo wastewater by response surface methodology. Bioresource Technology, 100(14): 3613-3617 |
PELLIZZARI F, SILVA M C, SILVA E M, et al, 2017. Diversity and spatial distribution of seaweeds in the South Shetland Islands, Antarctica: an updated database for environmental monitoring under climate change scenarios. Polar Biology, 40(8): 1671-1685 |
PONCE N M A, FLORES M L, PUJOL C A, et al, 2019. Fucoidans from the phaeophyta Scytosiphon lomentaria: chemical analysis and antiviral activity of the galactofucan component. Carbohydrate Research, 478: 18-24 |
SAUNDERS G W, MCDEVIT D C, 2013. DNA barcoding unmasks overlooked diversity improving knowledge on the composition and origins of the Churchill algal flora. BMC Ecology, 13: 9 |
 2023, Vol. 54
2023, Vol. 54


