
中国海洋湖沼学会主办。
文章信息
- 裴文豪, 胡成业, 张秀梅, 刘永钿, 陈屹洋. 2023.
- PEI Wen-Hao, HU Cheng-Ye, ZHANG Xiu-Mei, LIU Yong-Tian, CHEN Yi-Yang. 2023.
- 枸杞岛贻贝养殖区大型底栖动物群落结构及与环境因子的关系
- STUDY ON THE COMMUNITY STRUCTURE OF MACROBENTHOS IN THE MUSSEL BREEDING AREA OF GOUQI ISLAND
- 海洋与湖沼, 54(2): 526-536
- Oceanologia et Limnologia Sinica, 54(2): 526-536.
- http://dx.doi.org/10.11693/hyhz20220600156
文章历史
-
收稿日期:2022-06-14
收修改稿日期:2022-07-24
大型底栖动物是指生活史的全部或大部分时间生活于水域沉积物底内或表层的生物类群, 是海洋生态系统中物质循环和能量流动的重要消费者和转移者(Carvalho et al, 2007; 李新正, 2011)。由于大型底栖动物的迁移能力有限, 对栖息地环境变化比较敏感, 能够反映沉积物的状况, 因此可作为海洋生态系统生物完整性的可靠指标(Blanchet et al, 2008)。大型底栖动物应对人为干扰的变化通常通过群落的丰度、生物量和多样性的变化来衡量(Ryu et al, 2011), 研究表明群落结构是检验贻贝养殖对底栖生境影响的有效指标(Callier et al, 2008)。目前双壳类养殖区大型底栖动物群落结构的研究较为有限, 因此了解枸杞岛贻贝养殖区大型底栖动物的群落结构特征及其主要影响因子, 对区域内生物多样性保护和近海渔业资源修复都具有重要意义。
双壳类的养殖优点是不依赖于人工营养源投入即能获得较好的生长效果和收益, 因此成为水产养殖的优选对象(Da Costa et al, 2006)。然而, 当养殖面积和密度达到一定程度时, 养殖设施及对象对水体流动的影响被累积放大, 进而影响底栖生态系统, 因此越来越多的研究关注到双壳类养殖引起的生态和环境效应(Borja et al, 2009; Cranford et al, 2009; Fabi et al, 2009)。研究表明, 贻贝养殖对大型底栖生物群落产生显著但截然不同的影响(Suplicy, 2020)。在水动力较低的浅海或潟湖入海口, 贻贝滤食后产生的假粪会沉降到海底(Gilbert et al, 1997), 造成沉积物有机质积累(Mirto et al, 2000; Grant et al, 2012)、缺氧和硫化物水平较高(Carlsson et al, 2012), 从而对大型底栖动物多样性产生不利影响(Chamberlain et al, 2001); 而在局部水动力较强、生物沉积物扩散较快的区域, 贻贝养殖对大型底栖动物群落几乎没有负面影响(Chamberlain et al, 2001; Crawford et al, 2003; Da Costa et al, 2006)。
浙江舟山枸杞岛地理位置特殊, 近岸海域开阔、营养盐丰富, 岛礁遍布且生物资源丰富。枸杞岛周边是浙江省筏式贻贝养殖的主要海域, 养殖面积自2003年起至2016年扩增近一倍(邓明星, 2016), 截至2019年已经达到10 km2, 产量超过20万t, 位居全国第三。国内关于双壳类养殖区大型底栖动物的研究主要集中在象山港(陈晨等, 2016; 刘颖等, 2021)、桑沟湾(王宗兴等, 2011; 杨艳云等, 2018)、乳山湾(赵宁等, 2013; 杨传平等, 2014)三个区域。象山港与乳山湾的调查区域仅有少量站位是贝类养殖区。桑沟湾针对贝类单养区、藻类单养区、贝藻混合养殖区, 比较研究了大型底栖动物生物多样性、群落结构特征以及不同养殖区的底栖生境健康状况。由于海中养殖设施的布设不利于开展底栖生物的采样调查, 使得贻贝养殖区大型底栖动物的相关研究稀少。本研究对枸杞岛贻贝养殖区进行春夏季调查采样, 探究大型底栖动物的种类组成、生物多样性、群落结构以及与环境之间的关系, 探讨高密度贻贝筏式养殖的生态效应, 以期为海洋大型底栖动物多样性保护和可持续贝类增养殖提供基础理论依据。
1 材料与方法 1.1 研究区域概况枸杞岛位于浙江省舟山市东北方向, 处于长江与东海交汇的入海口。研究站位水深范围为8.5~ 25.5 m, 盐度稳定维持在30.02~32.84。当地海流畅通, 水域平均富营养化指数E约为6.77, 整体处于轻度至重度富营养化程度(刘媛媛, 2016)。
枸杞岛厚壳贻贝(Mytilus coruscus)从1973年开始引进并进行人工试养, 1975年开始大规模养殖(付英杰, 2014)。本研究分别于2021年的4月(春季)和8月(夏季)在筏式贻贝养殖区进行了大型底栖动物调查, 依据实际养殖面积布设了12个采样站位(图 1)。
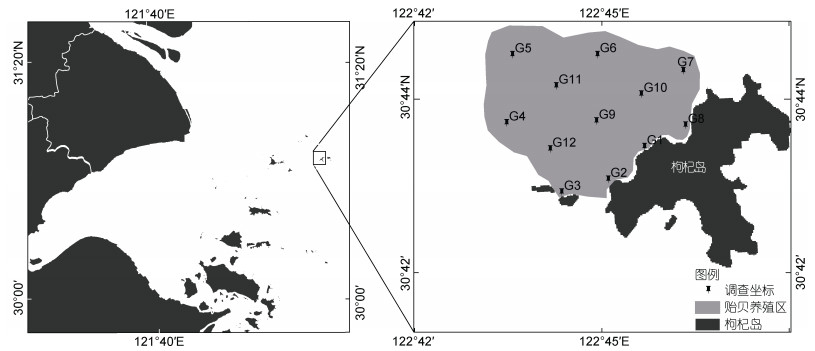 |
| 图 1 枸杞岛贻贝养殖区采样站位分布图 Fig. 1 Distribution of sampling stations in the mussel farm near Gouqi Island |
每个调查站位采用0.045 m2 Van Veen型抓斗式采泥器(PSC-300)采集3个表层沉积物, 将沉积物子样品装入铝箔袋密封保存, 以备实验室分析理化指标。剩余沉积物经0.5 mm孔径的筛网冲洗, 将截留在筛网的大型底栖动物用浓度为95%的酒精固定保存后带回实验室, 在解剖镜下进行鉴定、计数、称重(精度: 0.000 1 g)。将大型底栖动物鉴定到种, 部分未定物种鉴定至属或科的水平。为避免大型底栖动物的丰度被高估, 软体动物在有软体部分时才被计入, 节肢动物、寡毛类、多毛类和星虫只有在保留头部时才被计数(Yu et al, 2020)。根据《中国海洋生物名录》和世界海洋物种名录(World Register of Marine Species, WoRMS)对拉丁名进行校对、复核。
采用CTD (Sea-bird Costal Hydrocat型)对底层盐度、温度、溶氧、深度等水质因子进行原位测定。采用分光光度法测定海水中氨氮、亚硝酸盐、硝酸盐的含量, 具体方法严格按照《海洋监测规范》(GB17378.7- 2007) (国家质量技术监督局, 2007)执行。使用激光粒度分布仪(Bettersize 2600)测定沉积物的粒径, 采用重铬酸钾氧化-分光光度法测定沉积物中总有机碳(TOC)含量, 分析方法参考生态环境部发布的国标(HJ 615-2011); 沉积物中有机质采用灼烧减量法测定, 参考国标(HJ 761-2015)。
1.3 单变量评价物种丰富度采用物种数(S)、Chao1、Shannon- Wiener (H′)和Margalef (d)指数表示, 应用Pielou (J′)指数、Simpson指数和Hill (N10′)指数表示群落的均匀度。本研究依据吕巍巍等(2013)研究定义, 将大型底栖动物摄食功能群简化为4个类群, 分别为浮游生物食者、植食者、肉食者、沉积碎屑食者。采用丰度等级(Rank abundance)曲线表征各季节物种的丰富度和均匀度。
Simpson指数(D)采用种间相遇概率的公式计算, 计算公式如下
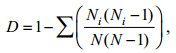 (1)
(1)式中, Ni为种i的个体数, N为所在群落的所有物种的个体数之和。
物种更替率(R)根据杜飞雁等(2011)的定义, 计算公式为:
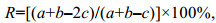 (2)
(2)式中, a与b分别为相邻2个季节的种数, c为相邻2个季节共同的种数。
1.4 多元分析应用相似性百分比(SIMPER)分析构成聚类分组以及季节分组各组内群落结构相似的典型种以及造成不同组之间群落结构差异的分歧种。上述α多样性指数及SIMPER分析的运算均在生物多元统计软件PRIMER 7.0中完成。在方差分析前对生物指数以及环境因子进行Shapiro-Wilks正态性和Levene方差齐性检验, 部分指数不符合正态分布和方差齐性, 故采用非参数(Mann-Whitney U)的渐进法检验生物指数和环境因子的季节差异。大型底栖动物生物指数与环境因子的Spearman相关性分析采用SPSS 25.0完成。
在多元分析前将大型底栖动物丰度数据进行ln(x+1)的标准化处理, 采用基于Bray-Curtis系数的层次聚类(Cluster)和非度量多维尺度(NMDS)分析大型底栖动物群落分布格局。同时, 采用ANOSIM相似性分析(999次置换检验), 检验大型底栖动物群落聚类分组间及季节是否存在显著差异。
在对大型底栖动物丰度数据进行除趋势对应分析(DCA)后, 采用典范对应分析(CCA)探究驱动大型底栖动物群落结构的环境因子。调查区域分布图及多样性指数分布图采用ArcGIS 10.7软件绘制, 其余分析均在软件Rstudio上分析并绘图。
2 结果 2.1 物种组成春季和夏季, 贻贝养殖区共鉴定出大型底栖动物172种, 隶属14纲40目84科, 其中春季为8纲26目52科共90种, 夏季为9纲31目60科共111种。物种丰度组成上, 春季以多毛纲(66.49%)、软甲纲(11.78%)和蛇尾纲(10.47%)占优势, 夏季以多毛纲(68.12%)、蛇尾纲(9.84%)、海参纲(6.01%)占优势。夏季生物量(1 417.84 g/m2)显著大于春季生物量(987.55 g/m2)。物种季节更替率为83.14%, 更替率水平较高。
春季沉积碎屑食者丰富度占比58.62%, 肉食者丰富度占比30.50%, 植食者丰富度占比7.43%, 浮游生物食者丰富度占比3.45%。夏季沉积碎屑食者丰富度占比70.75%, 肉食者丰富度占比23.95%, 植食者丰富度占比2.38%, 浮游生物食者丰富度占比2.92%。
2.2 单变量评价两个季节的Shannon-Wiener指数介于1.61~2.95之间, 且夏季平均值略高于春季平均值。空间上, 春季最高值为2.95, 位于西北部的G6站位; 最低值为1.61, 位于离岸较近的G1站位。夏季最高值为2.86, 位于G9站位, 最低值为2.14, 位于G10站位。Margalef指数春季和夏季最高值和最低值所在站位的时空分布与Shannon-Wiener指数基本相同, 夏季最低值除外, 位于G3站位。
两个季节的Pielou指数介于0.62~1.00之间, 春季最高值为1.00, 位于G1站位; 最低值为0.62, 位于G7站位。夏季最高值为0.93, 位于G12站位; 最低值为0.76, 位于G6站位(图 2)。
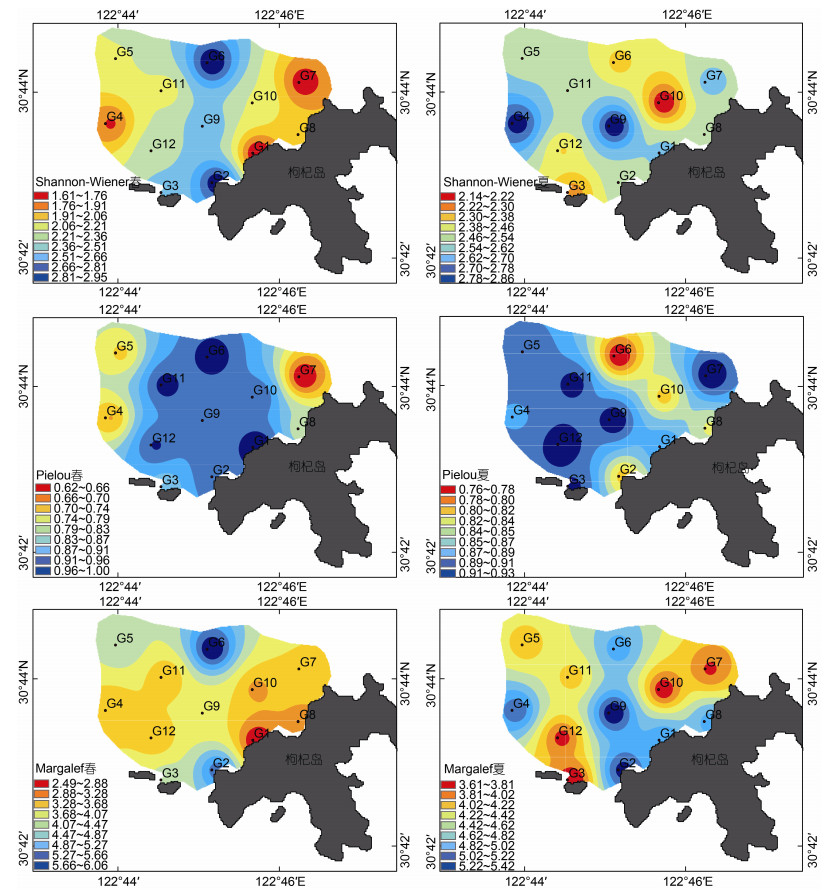 |
| 图 2 贻贝养殖区大型底栖动物Shannon-Wiener、Margalef、Pielou指数时空分布图 Fig. 2 Spatial and temporal distributions of Shannon-Wiener, Margalef, and Pielou indices of macrobenthos in the mussel farm |
丰度等级分布(Rank abundance)曲线图的x轴曲线越长物种越丰富, x轴曲线终点即为样本的物种数。曲线形状表示物种组成的均匀度, 曲线越平缓均匀度越高。图 3所示, 夏季物种更丰富, 但均匀度较低。
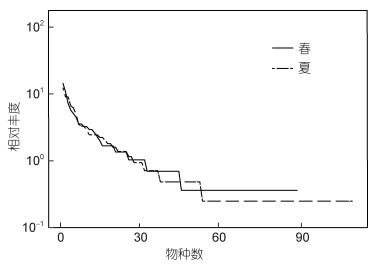 |
| 图 3 枸杞岛贻贝养殖区大型底栖动物丰度等级分布曲线 Fig. 3 Rank abundance curve of macrobenthos in the mussel farm near Gouqi Island in spring and summer |
季节间多样性指数的方差分析(Mann-Whitney U)表明, 夏季Shannon-Wiener指数、物种数显著高于春季(P < 0.05), 其余指数差异不显著(表 1)。
| 多样性指数 | Shannon-Wiener (H′) | Hill (N10′) | Simpson (D) | Pielou (J′) | 物种数(S) | Chao1 | Margalef (d) |
| Mann-Whitney U检验 | 3.85 | 1.33 | 0.40 | 0.96 | 4.71 | 3.00 | 3.41 |
| Sig | 0.05* | 0.25 | 0.53 | 0.33 | 0.03* | 0.08 | 0.07 |
| 注: *为显著性差异(P<0.05); **为极显著性差异(P<0.01) | |||||||
生物指数与环境因子间的Spearman相关性分析结果如图 4所示。Chao1指数与水温显著正相关, 与有机碳显著负相关; Simpson指数与盐度、沉积物中值粒径(D50)存在显著正相关关系; 生物量与沉积物中值粒径(D50)、有机碳存在显著负相关关系; 物种数、Chao1指数、生物量、丰富度(abundance)均与TOC显著负相关。
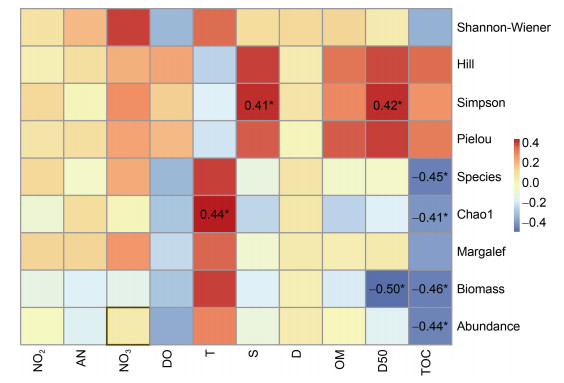 |
| 图 4 贻贝养殖区生物指数与环境因子间Spearman相关性热图 Fig. 4 The heatmap of Spearman correlation between the biological indices and environmental factors in the mussel farm 注: 亚硝酸盐(NO2); 氨氮(AN); 硝酸盐(NO3); 溶解氧(DO); 温度(T); 盐度(S); 水深(D); 有机质(OM); 中值粒径(D50); 有机碳(TOC) |
贻贝养殖区环境因子的非参数(Mann-Whitney U)检验如表 2所示。亚硝酸盐季节间差异显著(P < 0.05), 夏季亚硝酸盐含量整体高于春季。硝酸盐、溶解氧、水温季节间差异极显著(P < 0.01), 夏季硝酸盐含量整体高于春季, 夏季溶解氧整体低于春季。沉积物中值粒径属于粉砂中的细粉砂(8~16 μm)。
| 环境因子 | 春季 | 夏季 | 显著性 |
| 亚硝酸盐/(mg/L) | 2.50±2.10 | 2.50±2.50 | 0.04* |
| 氨氮/(mg/L) | 1.20±1.20 | 1.50±2.20 | 0.91 |
| 硝酸盐/(mg/L) | 6.06±5.44 | 16.00±4.63 | 0.00** |
| 溶氧/(mg/L) | 5.70±0.20 | 4.89±0.01 | 0.00** |
| 水温/℃ | 16.49±0.14 | 24.30±0.38 | 0.00** |
| 盐度 | 31.86±0.68 | 31.41± 0.38 | 0.27 |
| 水深/m | 17.75±5.73 | 18.63±5.75 | 0.39 |
| 有机质/(mg/kg) | 8.29±2.01 | 8.48±2.60 | 0.54 |
| 有机碳/(mg/kg) | 1.52±0.35 | 0.79±0.22 | 0.00** |
| 粒径中值/μm | 8.38±1.00 | 7.77±1.34 | 0.15 |
| 注: *为显著性差异(P<0.05); **为极显著性差异(P<0.01) | |||
春季层次聚类分析将大型底栖动物群落分成四个组别, G10单独分为K1组, G5单独分为K2组, G3、G4、G7、G9站位分为K3组, 其余站位分为K4组。NMDS分析结果表明(图 5), 不同分组间的物种排序分离不明显, 基于春季聚类分组的单因素相似性分析(ANOSIM)印证了差异不显著(R=0.02, P= 0.45 > 0.05)。
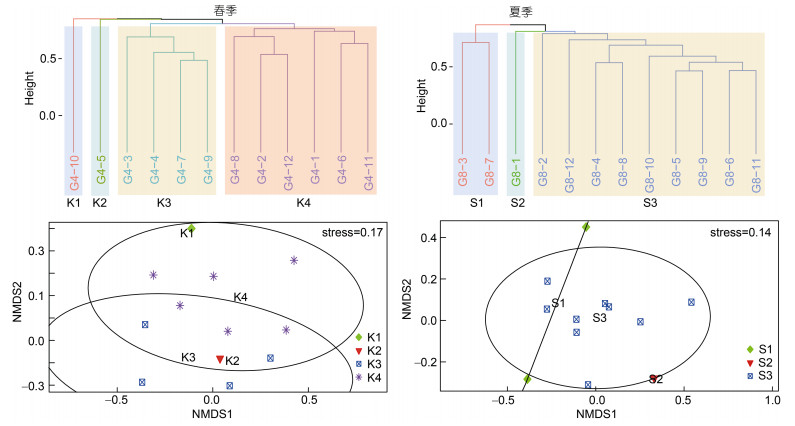 |
| 图 5 贻贝养殖区春、夏季大型底栖动物层次聚类及非度量多维尺度(NMDS)分析 Fig. 5 Hierarchical clustering and non-metric multidimensional scaling (NMDS) analysis of macrobenthos in spring and summer in the mussel farm |
春季相似百分比(SIMPER)分析结果见表 3, 本文将贡献率大于5%的物种定义为主要贡献种。K1、K2组仅有一个站位无法进行组内分析, K3组组内平均相似性22.58%, 典型种有5种, 累计贡献率为80.21%; K4组内平均组内相似性19.49%, 典型种有5种, 累计贡献率为84.78%。K1/K2组间平均相异性为93.33%, 分歧种有2种, 累计贡献率为47.62%; K3/K4组间平均相异性88.67%, 分歧种有2种, 累计贡献30.26%。K1/K4平均相异性88.22%, 分歧种有6种, 累计贡献44.18%。K1/K3平均相异性为90.23%, 分歧种有3种, 累计贡献36.71%。K2/K4的组间相异性为91.55%, 分歧种有2种, 累计贡献率为47.25%。K2/K3组间相异性93.31%, 有3个分歧种, 累计贡献48.22%。
| 种名 | 典型种 | 分歧种 | |||||||
| K3 | K4 | K1/K2 | K1/K3 | K1/K4 | K2/K3 | K2/K4 | K3/K4 | ||
| 细丝鳃虫Aphelochaeta filiformis | 32.03 | 5.27 | |||||||
| 不倒翁虫Sternaspis sp. | 21.41 | ||||||||
| 日本倍棘蛇尾Amphioplus japonicus | 11.35 | 16.43 | 8.21 | ||||||
| 多鳃齿吻沙蚕Nephtys polybranchia | 9.57 | ||||||||
| 日本角吻沙蚕Goniada japonica | 5.34 | ||||||||
| 梳鳃虫Terebellides stroemii | 43.32 | 20.79 | 10.58 | 20.40 | |||||
| 朝鲜阳遂足Amphiura koreae | 11.35 | 8.27 | |||||||
| 异足索沙蚕Lumbrineris heteropoda | 8.22 | ||||||||
| 寡鳃齿吻沙蚕Micronephthys oligobranchia | 5.98 | ||||||||
| 棘刺锚参Protankyra bidentata | 9.88 | 9.86 | |||||||
| 丝异须虫Heteromastus filiformis | 36.90 | 29.03 | 36.57 | ||||||
| 沙枝软鳃海蛹Euzonus dillonensis | 10.71 | 8.61 | 10.67 | ||||||
| 皱皮蛇尾Ophiomyxa neglecta | 6.04 | 9.95 | |||||||
| 豪猪杂毛虫Poecilochaetus hystricosus | 6.30 | ||||||||
| 后稚虫Laonice cirrata | 6.19 | ||||||||
夏季层次聚类分析将大型底栖动物群落分成三个组别, G3、G7站位分为S1组, G1站位分为S2组, 其余站位分为S3组。NMDS分析结果显示, 不同分组间的物种排序分离较为明显, 基于夏季聚类分组的单因素相似性分析(ANOSIM)结果印证了差异显著性(R=0.5, P=0.03 < 0.05)。
夏季相似百分比(SIMPER)分析结果见表 4, S2组仅有一个站位无法进行组内分析。夏季S3的组内平均相似性为22.57%, 典型种有7种, 累计贡献率为78.63%。S1的组内平均相似性为21.62%, 典型种为4种, 累计贡献率为100%。S1/S2组的组间平均相异率为95.18%, 分歧种有5种, 累计贡献率为35.95%; S1/S3组的组间平均相异率为87.49%, 分歧种有3种, 累计贡献率为18.36%; S2/S3组的组间平均相异率为82.05%, 分歧种有3种, 累计贡献率为24.07%。
| 种名 | 典型种 | 分歧种 | ||||
| S1 | S3 | S1/S2 | S1/S3 | S2/S3 | ||
| 日本倍棘蛇尾Amphioplus japonicus | 16.07 | 5.15 | 5.77 | 6.84 | ||
| 丝异须虫Heteromastus filiformis | 14.43 | 11.40 | 7.11 | 11.72 | ||
| 须鳃虫Cirriformia tentaculata | 13.73 | 6.65 | 5.48 | 5.51 | ||
| 长锥虫Leitoscoloplos pugettensis | 12.04 | |||||
| 粘海蛹Ophelia limacina | 9.43 | |||||
| 不倒翁虫Sternaspis sp. | 50.00 | 7.82 | 7.28 | |||
| 日本角吻沙蚕Goniada japonica | 5.11 | |||||
| 粘细锚参Leptosynapta inhaerens | 25.00 | |||||
| 滩栖阳遂足Amphiura vadicola | 12.50 | |||||
| 棘刺锚参Protankyra bidentata | 12.50 | 5.46 | ||||
聚类分析结果表明春季与夏季群落格局相似性较低, 基于季度分组的单因素相似性分析(ANOSIM)结果加以证明, 春季与夏季的大型底栖动物群落差异极显著(R=0.46, P=0.001)。春、夏季相似百分比(SIMPER)分析结果见表 5, 春季大型底栖动物的组内平均相似性为17.44%, 典型种有7种, 累计贡献率为75.83%。夏季大型底栖动物的组内平均相似性为21.91%, 典型种为6种, 累计贡献率为67.47%。春季与夏季的平均相异率为87.57%, 分歧种为丝异须虫(Heteromastus filiformis), 累计贡献率为4.61%。
| 种名 | 春季 | 夏季 | 分歧种 |
| 典型种 | |||
| 不倒翁虫Sternaspis sp. | 19.43 | 12.66 | |
| 日本倍棘蛇尾Amphioplus japonicus | 15.33 | 14.34 | |
| 细丝鳃虫Aphelochaeta filiformis | 11.60 | ||
| 朝鲜阳遂足Amphiura koreae | 10.48 | ||
| 寡鳃齿吻沙蚕Micronephthys oligobranchia | 8.34 | ||
| 梳鳃虫Terebellides stroemii | 5.80 | ||
| 异足索沙蚕Lumbrineris heteropoda | 4.84 | ||
| 丝异须虫Heteromastus filiformis | 15.60 | 4.61 | |
| 须鳃虫Cirriformia tentaculata | 11.40 | ||
| 长锥虫Leitoscoloplos pugettensis | 8.65 | ||
| 粘海蛹Ophelia limacina | 4.82 | ||
在排除掉膨胀因子大于10的环境因子后, 共10个因子进入最终的典范对应分析(CCA)。CCA排序图的前两轴对群落结构变异的解释率为12.73%, 第一轴解释了6.89%的变异性, 第二轴解释了5.84%的变异性(图 6)。溶氧、硝酸盐和TOC是驱动大型底栖动物群落结构的主要因子, 其中溶氧是影响该区域的最显著因子; 春季大型底栖动物群落主要受溶氧和TOC的影响, 夏季主要受硝酸盐的影响。
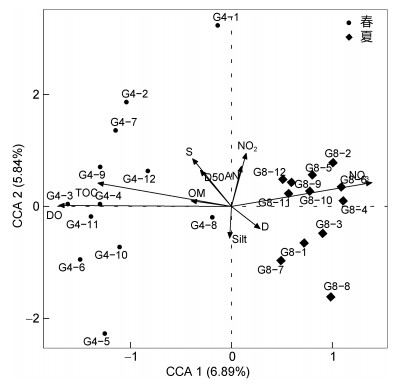 |
| 图 6 贻贝养殖区大型底栖动物群落与环境因子关系的CCA排序图 Fig. 6 CCA ranking of the relationship between macrobenthos community and environmental factors in the mussel farm 注: 亚硝酸盐(NO2); 氨氮(AN); 硝酸盐(NO3); 溶氧(DO); 温度(T); 盐度(S); 水深(D); 有机质(OM); 中值粒径(D50); 有机碳(TOC); 粉砂(Silt) |
贻贝养殖区共鉴定出大型底栖动物172种, 物种数较多, 枸杞岛地处长江口南部锋面, 印证了大型底栖动物种类高值区一直在长江口锋面附近的结果(寿鹿, 2013)。另外, 贻贝养殖区较高的次级生产力丰富了该区域的物种多样性(周曦杰, 2018), 同时, 贻贝定期采收带来的沉降作用导致贻贝串上附着生物脱落并重新定居, 也是该区域物种资源丰富的原因之一。比较发现, 本研究的物种数大于Crawford等(2003)、Fabi等(2009)早期在澳大利亚塔斯马尼亚州、意大利亚德里亚湾筏式贻贝养殖区的研究, 但其调查面积0.06 km2、2 km2小于本研究区域6 km2; 而小于葡萄牙近海筏式贻贝15 km2养殖区的底栖动物物种数(Lacson et al, 2019), 由此推测, 大型底栖动物的物种数有随着贻贝养殖面积的扩大而趋于丰富的现象。
摄食类群组成沉积碎屑食者丰富度占主导地位, 其次分别是肉食者、植食者、浮游生物食者。肉食者丰富度在营养类群上仅次于沉积碎屑食者, 研究表明齿吻沙蚕属Nephtys hombergii的密度与优势被捕食者丝异须虫密切相关(Dubois et al, 2007), 故枸杞岛底栖动物食物网存在上行控制效应, 即丝异须虫等被捕食者维持肉食者的多样性。研究发现, 植食者丰富度在夏季急剧性减少, Fabi等(2009)的研究亦存在相同情况, 主要是因为夏季水温升高藻类开始进入衰退期。而底栖浮游生物食者很少出现的原因是上层养殖的双壳类与底层浮游生物食者产生竞争关系, 将能量从底栖浮游生物食者中转移(Gibbs, 2007), 从而限制了浮游生物食者的生存, 其次Stenton-Dozey等(1999)关于南非贻贝养殖区的研究发现底层有机碎屑会对浮游生物食者产生窒息性影响。
枸杞岛大型底栖动物春季至夏季的物种季节更替率为83.14%, 与中国近海相关底栖动物研究相比水平较高(田伟等, 2013; 陈梓林等, 2020)。这可能是受到2021年夏季强台风“烟花”的影响, 养殖设施对水流产生锋面效应(邓明星, 2016)导致底部水流加快, 强烈改变了底层沉积物的再悬浮和再分布过程(Wang et al, 2020)。同时夏季水温升高, 暖温性物种的复苏, 生态幅较窄的物种死亡, 因此导致春、夏季研究区域大型底栖动物的季节更替显著。
3.2 群落物种多样性及与环境因子的关系Shannon-Wiener、Pielou、Margalef平均值与我国其他养殖海域相比处于中等水平(王宗兴等, 2011)。养殖设施的存在阻止了拖网扰动对大型底栖动物的强烈影响, 从而保护了大型底栖动物的多样性(韩庆喜等, 2014)。同时, 养殖脱落的贻贝壳在海底堆积塑造了较高的底质结构复杂性, 导致海底生物多样性增加(Hartstein et al, 2004)。枸杞岛贻贝养殖区大型底栖动物的Shannon-Wiener、Margalef多样性指数在空间上分布较为不均匀, 是各样点间生境特征差异较大的反映(陈静等, 2021)。Shannon-Wiener、Margalef多样性指数高值区主要出现在枸杞岛近岸与左边两个岛礁中间的G2、G6、G9站位, 上述站位正好位于南北流向潮流通畅的海域。丰度等级曲线表明夏季均匀度低于春季, 主要是由于夏季典型种的优势度增加导致物种均匀度降低。
生物指数与环境因子之间的相关性分析, Chao1指数与温度呈显著正相关关系。Chao1指数是指在群落中随机抽样, 当不断有稀有物种被发现时表明群落尚存稀有物种未被观测到, 继续抽样至所有物种至少被抽到两次时的理论物种数(Chao, 1984); 体现在物种数水平的多样性, 因此本研究区域的物种数随着温度升高而增加。物种数、Chao1指数、生物量、丰度均与TOC显著负相关, 表明TOC是限制上述指标的重要环境因子。盐度和中值粒径(D50)与Simpson指数存在显著正相关关系, 表明种间相遇概率随着盐度和中值粒径的增加而增加。
3.3 大型底栖动物群落结构层次聚类将春季分成4组、夏季分成3组, 非度量多维尺度排序(NMDS)和ANOSIM分析从群落层面印证了两次调查期间底栖动物群落结构的差异性。ANOSIM分析表明季节间差异极显著, 印证了贻贝养殖区季节间NMDS和层次聚类分析结构相异的结果。春季不同聚类分组间差异不显著, 而夏季聚类分组间差异显著, 主要是夏季优势种的优势度增加组间差异性升高所致。
SIMPER分析表明, 春季典型种主要由肉食者(如异足索沙蚕、寡鳃齿吻沙蚕)和沉积碎屑食者组成, 而夏季则皆为沉积碎屑食者。春季和夏季共有的典型种为不倒翁虫和日本倍棘蛇尾, 不倒翁虫是我国近岸海域广温广布的常见优势种, 不倒翁虫在长江口的舟山海区研究中出现频率为27.3% (刘录三等, 2008)。日本倍棘蛇尾也是广温广布性物种, 具有群居、怕光、喜欢隐藏在海藻或碎贝壳间的特性, 北至宁津海域(甘志彬等, 2012)南至湛江(孙洁, 2020)均有出现。春、夏季分歧种为丝异须虫, 研究发现丝异须虫随着有机质的增加而增加(Callier et al, 2008), 枸杞岛贻贝养殖区大型底栖动物群落结构趋于有机富集和小型化。
3.4 环境因子及大型底栖动物群落驱动因素方差分析表明, 夏季硝酸盐、亚硝酸盐含量显著高于春季, 整体处于富营养化状态。王旭等(2019)研究发现枸杞岛夏季成熟期的贻贝养殖是造成海域氮、磷营养盐浓度升高的原因之一, 并且无机氮浓度显著高于非养殖区, 造成这种情况的原因是夏季成熟期的贻贝呼吸排泄率升高, 同时筏架上附着的海藻在夏季凋落, 缺少了吸收营养盐的藻体, 从而形成明显的季节差异。吕旭宁(2017)关于桑沟湾贝类养殖区的研究也发现了类似的结果, 7月份紫贻贝硝酸盐、亚硝酸盐、氨氮的释放速率分别是4月份的2.18、9.75、2.94倍, 本研究区域夏季氨氮含量未显著高于春季, 可能是由于硝化细菌的硝化作用将氨氮转化为亚硝酸盐和硝酸盐。
CCA分析结果显示溶氧、TOC和硝酸盐是驱动枸杞岛贻贝养殖区大型底栖动物群落结构的主要因子, 其中溶氧是影响该区域的最显著因子。低氧的夏季多毛纲物种数、丰富度和生物量明显高于非低氧的春季, 与寿鹿(2013)关于长江口及临近海域的研究结果相符, 表明溶氧是影响大型底栖动物群落结构的主要环境因子。底层水域中氧气的减少可能对体型较小的物种影响较小, 因为其比表面积较大从而有利于扩散吸收氧气(Weston, 1990), 所以体型较小的多毛纲物种, 在夏季的物种数和生物量均高于春季。结合上述相关性分析, 物种数、Chao1指数、生物量、丰富度(abundance)均与TOC显著负相关, 表明本研究区域的大型底栖动物群落结构受有机碳的限制。硝酸盐位于CCA轴一右侧, 表明贻贝养殖区的大型底栖动物群落结构与硝酸盐正相关。
4 结论与国内最相似的桑沟湾双壳类养殖相比, 枸杞岛贻贝养殖区大型底栖动物群落状况维持较好, 主要是由于养殖区域处于半开阔水域, 相对于桑沟湾内养殖水交换更加通畅。贻贝养殖区沉积物有一定的有机富集, 大部分站位的大型底栖动物群落受到轻度扰动。夏季贻贝的成熟及筏架附着海藻的衰退导致海域处于富营养化状态和底层缺氧, 水体健康状况不容乐观。建议增加筏架的间距, 延绳的布设尽量平行于海流, 以增加水体流通性和交换能力。
王旭, 赵旭, 章守宇, 等, 2015. 枸杞岛贻贝养殖水域碳氮磷分布格局. 水产学报, 39(11): 1650-1664 |
王宗兴, 孙丕喜, 刘彩霞, 等, 2011. 桑沟湾大型底栖动物生物多样性研究. 中国海洋大学学报, 41(7/8): 79-84 |
邓明星, 2016. 贻贝筏式养殖对海域水动力及浮游植物生态系统影响[D]. 上海: 上海海洋大学.
|
甘志彬, 李新正, 王洪法, 等, 2012. 宁津近岸海域大型底栖动物生态学特征和季节变化. 应用生态学报, 23(11): 3123-3132 |
田伟, 徐兆礼, 周进, 等, 2013. 椒江口海域大型底栖动物群落结构的研究. 复旦学报(自然科学版), 52(2): 271-277 |
付英杰, 2014. 两种养殖模式下枸杞岛紫贻贝的生长特征及其对水域水质的影响[D]. 舟山: 浙江海洋学院.
|
吕旭宁, 2017. 滤食性贝类规模化养殖的环境效应及可持续生产模式探索[D]. 上海: 上海海洋大学.
|
吕巍巍, 马长安, 余骥, 等, 2013. 长江口横沙东滩围垦潮滩内外大型底栖动物功能群研究. 生态学报, 33(21): 6825-6833 |
刘录三, 孟伟, 田自强, 等, 2008. 长江口及毗邻海域大型底栖动物的空间分布与历史演变. 生态学报, 28(7): 3027-3034 |
刘媛媛, 2016. 枸杞岛贻贝养殖区生态效应及修复策略研究[D]. 上海: 上海海洋大学.
|
刘颖, 李进京, 陈晨, 等, 2021. 浙江象山港岛屿春、夏季潮间带大型底栖生物的群落结构特征. 海洋与湖沼, 52(3): 685-696 |
孙洁, 2020. 湛江博赊港岩礁区全缘马尾藻栽培及底栖生物多样性演替研究[D]. 湛江: 广东海洋大学.
|
寿鹿, 2013. 长江口及邻近海域大型底栖生物群落生态学研究[D]. 南京: 南京师范大学.
|
杜飞雁, 王雪辉, 贾晓平, 等, 2011. 大亚湾海域大型底栖生物种类组成及特征种. 中国水产科学, 18(4): 877-892 |
李新正, 2011. 我国海洋大型底栖生物多样性研究及展望: 以黄海为例. 生物多样性, 19(6): 676-684 |
杨传平, 赵宁, 季相星, 等, 2014. 秋季乳山湾潮间带大型底栖动物的群落结构特征. 海洋湖沼通报, 36(2): 89-95 |
杨艳云, 张继红, 吴文广, 等, 2018. 桑沟湾不同养殖区大型底栖动物的群落结构特征. 水产学报, 42(6): 922-931 |
陈梓林, 李纯厚, 肖雅元, 等, 2020. 江门近岸海域大型底栖动物群落结构的分布特征. 南方水产科学, 16(4): 18-27 |
陈晨, 焦海峰, 王一农, 等, 2016. 象山港海洋牧场示范区大型底栖生物的时空变化. 海洋与湖沼, 47(1): 130-139 |
陈静, 申恒伦, 朱天顺, 等, 2021. 高邮湖大型底栖动物群落结构及影响因素. 生态学报, 41(16): 6486-6493 |
国家质量技术监督局, 2007. 海洋监测规范第7部分: 近海污染生态调查和生物监测: GB 17378.7-1998[S]. 北京: 中国标准出版社: 104.
|
周曦杰, 2018. 藻场碎屑产生机制及岛礁生态养护功能实现途径研究[D]. 上海: 上海海洋大学.
|
赵宁, 季相星, 王振钟, 等, 2013. 乳山湾春秋季大型底栖动物生态学特征. 海洋湖沼通报, 35(4): 80-88 |
韩庆喜, 刘东艳, 2014. 近海双壳类筏式养殖对大型底栖动物群落影响综述. 海洋通报, 33(3): 352-359 |
BLANCHET H, LAVESQUE N, RUELLET T, et al, 2008. Use of biotic indices in semi-enclosed coastal ecosystems and transitional waters habitats-implications for the implementation of the European Water Framework Directive. Ecological Indicators, 8(4): 360-372 |
BORJA Á, RODRÍGUEZ J G, BLACK K, et al, 2009. Assessing the suitability of a range of benthic indices in the evaluation of environmental impact of fin and shellfish aquaculture located in sites across Europe. Aquaculture, 293(3/4): 231-240 |
CALLIER M D, MCKINDSEY C W, DESROSIERS G, 2008. Evaluation of indicators used to detect mussel farm influence on the benthos: two case studies in the Magdalen Islands, Eastern Canada. Aquaculture, 278(1/2/3/4): 77-88 |
CARLSSON M S, ENGSTRÖM P, LINDAHL O, et al, 2012. Effects of mussel farms on the benthic nitrogen cycle on the Swedish west coast. Aquaculture Environment Interactions, 2(2): 177-191 |
CARVALHO S, BARATA M, GASPAR M B, et al, 2007. Enrichment of aquaculture earthen ponds with Hediste diversicolor: consequences for benthic dynamics and natural productivity. Aquaculture, 262(2/3/4): 227-236 |
CHAMBERLAIN J, FERNANDES T F, READ P, et al, 2001. Impacts of biodeposits from suspended mussel (Mytilus edulis L.) culture on the surrounding surficial sediments. ICES Journal of Marine Science, 58(2): 411-416 |
CHAO A N, 1984. Nonparametric estimation of the number of classes in a population. Scandinavian Journal of Statistics, 11(4): 265-270 |
CRANFORD P J, HARGRAVE B T, DOUCETTE L I, 2009. Benthic organic enrichment from suspended mussel (Mytilus edulis) culture in Prince Edward Island, Canada. Aquaculture, 292(3/4): 189-196 |
CRAWFORD C M, MACLEOD C K A, MITCHELL I M, 2003. Effects of shellfish farming on the benthic environment. Aquaculture, 224(1/2/3/4): 117-140 |
DA COSTA K G, NALESSO R C, 2006. Effects of mussel farming on macrobenthic community structure in Southeastern Brazil. Aquaculture, 258(1/2/3/4): 655-663 |
DUBOIS S, MARIN-LÉAL J C, ROPERT M, et al, 2007. Effects of oyster farming on macrofaunal assemblages associated with Lanice conchilega tubeworm populations: a trophic analysis using natural stable isotopes. Aquaculture, 271(1/2/3/4): 336-349 |
FABI G, MANOUKIAN S, SPAGNOLO A, 2009. Impact of an open-sea suspended mussel culture on macrobenthic community (Western Adriatic Sea). Aquaculture, 289(1/2): 54-63 |
GIBBS M T, 2007. Sustainability performance indicators for suspended bivalve aquaculture activities. Ecological Indicators, 7(1): 94-107 |
GILBERT F, SOUCHU P, BIANCHI M, et al, 1997. Influence of shellfish farming activities on nitrification, nitrate reduction to ammonium and denitrification at the water-sediment interface of the Thau lagoon, France. Marine Ecology Progress Series, 151(1/2/3): 143-153 |
GRANT C, ARCHAMBAULT P, OLIVIER F, et al, 2012. Influence of 'bouchot' mussel culture on the benthic environment in a dynamic intertidal system. Aquaculture Environment Interactions, 2(2): 117-131 |
HARTSTEIN N D, ROWDEN A A, 2004. Effect of biodeposits from mussel culture on macroinvertebrate assemblages at sites of different hydrodynamic regime. Marine Environmental Research, 57(5): 339-357 |
LACSON A Z, PILÓ D, PEREIRA F, et al, 2019. A multimetric approach to evaluate offshore mussel aquaculture effects on the taxonomical and functional diversity of macrobenthic communities. Marine Environmental Research, 151: 104774 |
MIRTO S, LA ROSA T, DANOVARO R, et al, 2000. Microbial and meiofaunal response to intensive mussel-farm biodeposition in coastal sediments of the western mediterranean. Marine Pollution Bulletin, 40(3): 244-252 |
RYU J, KHIM J S, KANG S G, et al, 2011. The impact of heavy metal pollution gradients in sediments on benthic macrofauna at population and community levels. Environmental Pollution, 159(10): 2622-2629 |
STENTON-DOZEY J M E, JACKSON L F, BUSBY A J, 1999. Impact of mussel culture on macrobenthic community structure in Saldanha Bay, South Africa. Marine Pollution Bulletin, 39(1/2/3/4/5/6/7/8/9/10/11/12): 357-366 |
SUPLICY F M, 2020. A review of the multiple benefits of mussel farming. Reviews in Aquaculture, 12(1): 204-223 |
WANG R, ZHANG C, HUANG X T, et al, 2020. Distribution and source of heavy metals in the sediments of the coastal East China sea: geochemical controls and typhoon impact. Environmental Pollution, 260: 113936 |
WESTON D P, 1990. Quantitative examination of macrobenthic community changes along an organic enrichment gradient. Marine Ecology Progress Series, 61(3): 233-244 |
YU H Y, HUANG S C, LIN H J, 2020. Factors structuring the macrobenthos community in tidal algal reefs. Marine Environmental Research, 161: 105119 |
 2023, Vol. 54
2023, Vol. 54


