
中国海洋湖沼学会主办。
文章信息
- 陈楠生, 张梦佳, 刘淑雅, 崔宗梅. 2023.
- CHEN Nan-Sheng, ZHANG Meng-Jia, LIU Shu-Ya, CUI Zong-Mei. 2023.
- 中国海域赤潮物种多样性
- DIVERSITY OF HAB SPECIES IN COASTAL REGIONS OF CHINA
- 海洋与湖沼, 54(3): 599-624
- Oceanologia et Limnologia Sinica, 54(3): 599-624.
- http://dx.doi.org/10.11693/hyhz20221000274
文章历史
-
收稿日期:2022-10-24
收修改稿日期:2023-02-05
2. 崂山实验室 海洋生态与环境科学功能实验室 山东青岛 266237;
3. 中国科学院海洋大科学研究中心 山东青岛 266071;
4. 中国科学院大学 北京 100049
2. Laboratory for Marine Ecology and Environmental Science, Laoshan Laboratory, Qingdao 266237, China;
3. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China
赤潮(red tides)泛指海洋中微型浮游生物快速增殖、聚集, 导致生态系统结构与功能破坏的一种生态异常现象, 也被称为有害藻华(harmful algal blooms, HABs), 包括海水、淡水、大型藻、微型藻、浮游藻和底栖藻等各种藻华现象(俞志明等, 2019; Wang, 2022)。自20世纪70年代以来, 随着全球气候变化、人类活动影响等, 赤潮问题遍布全球, 并且愈演愈烈, 成为我国海域最突出的生态灾害之一(俞志明等, 2019; 于仁成等, 2020)。面对赤潮暴发频率的提高、规模的增加以及危害的加剧, 联合国教科文组织(UNESCO)和海洋研究科学委员会(SCOR)共同先后发起了“全球有害藻华生态学与海洋学研究计划(GEOHAB)”和“全球变化下有害藻华研究计划(GlobalHAB)”, 促进了国内外赤潮研究的快速发展, 对有毒有害致灾赤潮物种的多样性认识获得了重要进展(Berdalet et al, 2017; 俞志明等, 2019)。
我国科学家最早鉴定的赤潮物种包括在我国广泛海域引发赤潮事件的原因种夜光藻(Noctiluca scintillans)、东海原甲藻(Prorocentrum donghaiense)和中肋骨条藻(Skeletonema costatum)(吴瑞贞等, 2007; Lu et al, 2014)。近年来, 随着赤潮暴发频率和规模的双重增加, 赤潮鉴定方法的逐步提升, 以及鉴定赤潮物种力度的不断增加, 更多的赤潮物种得到鉴定, 包括红色赤潮藻(Akashiwo sanguinea)、塔玛亚历山大藻复合体(Alexandrium tamarense species complex)、海洋卡盾藻(Chattonella marina)、米氏凯伦藻(Karenia mikimotoi)、剧毒卡罗藻(Karlodinium veneficum)、多环马格里夫藻(Margalefidinium polykrikoides)、Tripos furca和浮动弯角藻(Eucampia zodiacus)(Gu et al, 2022)。值得关注的是, 很多赤潮事件在我国海域暴发时, 其致灾物种在我国海域鲜为人知, 包括球形棕囊藻(Phaeocystis globosa)赤潮(陈菊芳等, 1999)、抑食金球藻(Aureococcus anophagefferens)褐潮(brown tides)(Zhang et al, 2012)以及浒苔(Ulva prolifera)绿潮(green tides)(刘峰等, 2012; 王宗灵等, 2020)等。另外, 本实验室在对2019年渤海航次样本进行宏条形码分析时发现赤潮物种Vicicitus globosus在黄河口附近的多个采样站位相对丰度超过80%, 表明该海域可能暴发了该物种引发的赤潮(Huang et al, 2021)。由此可见, 我国海域的赤潮物种多样性尚未得到全面解析, 有待进一步阐明。
分子分析方法的引入和日渐成熟极大地提高了对赤潮物种的鉴定能力, 从而促进了分类学的发展, 让我们逐渐认识到对中国海域赤潮物种认知的缺失和错误, 大大加强了我们对赤潮物种多样性的理解(陈楠生, 2020)。例如, 胶州湾的一种优势骨条藻赤潮物种在航次调查中一直被鉴定为中肋骨条藻, 而宏条形码分析结合藻细胞株系的比较分析表明该骨条藻为玛氏骨条藻(Skeletonema marinoi)(Liu et al, 2020)。除此之外, 胶州湾还存在其他骨条藻物种, 包括夏季出现的热带骨条藻(Skeletonema tropicum)(Liu et al, 2022)。John等(2014)发现塔玛亚历山大藻“复合体”(Alexandrium tamarense species complex)根据分子标记信息可被区分为5种藻: A. fundyense、A. mediterraneum、A. tamarense、A. australiense和A. pacificum。利用通用分子标记宏条形码分析可以成为航次调查中用于分析赤潮物种组成及其时空动态变化的新一代分析方法(陈楠生, 2020)。该分析方法目前已被广泛应用于海域生态调查研究, 国内也曾应用于渤海(Xu et al, 2017; Chen et al, 2019c; Huang et al, 2021)、黄海(Kong et al, 2019)、东海(Shih et al, 2019; Chen et al, 2021)、南海(Chen et al, 2019b; Qin et al, 2019)、胶州湾(Liu et al, 2020, 2022)和长江口(Cui et al, 2021)等海域, 推动了中国海域赤潮物种的研究。
综上所述, 赤潮灾害形势严峻, 国内外对赤潮物种的研究进展快速而丰富。随着研究的深入, 我国海域越来越多的赤潮物种得到鉴定, 很多赤潮物种的分类地位被修订, 还有很多赤潮物种隐存种被逐步发现并得到鉴定。由于这些赤潮物种的信息散落在数以百计的研究论文和众多的数据库中, 并与修订前的历史信息共存, 使得赤潮物种信息显得很凌乱, 不利于研究者和读者系统认识和跟踪研究我国海洋赤潮物种。现在, 赤潮物种的航次调查研究逐步从基于形态鉴定的分析方法向基于分子标记比较分析的宏条形码分析过渡, 本文系统梳理并汇总了我国海域的赤潮物种多样性, 并以18S rDNA为例统计并评估了赤潮物种通用分子标记的现状, 发现大量赤潮物种的分子标记缺失。希望本论文的分析与总结能够引起广大赤潮研究者和相关部门的关注, 积极构建所有赤潮物种的相关分子标记, 促进宏条形码分析方法和数据库的完善, 从而更好地解析我国海域赤潮物种的多样性及时空动态特征。
1 全球赤潮物种名录及其分子标记本文以国内外文献为基础, 共整理出341个赤潮物种(附表 1, 2, 3)。根据Algaebase (https://www.algaebase.org/)的最新分类信息, 这341个赤潮物种隶属9个门, 19个纲, 48个目, 76个科和111个属, 包括Miozoa门(主要包括甲藻纲Dinophyceae)的180种(包含3纲10目26科47属)(表 1)、硅藻门(Bacillariophyta)的120种(包含3纲17目23科36属)(表 2), 另外还有41种隶属其他门类, 分别是Cercozoa门1种, Chlorophyta门5种, Ciliophora门1种, Cryptista门4种, Euglenozoa门5种, Haptophyta门11种和Ochrophyta门14种(表 3)。部分属中出现多种赤潮物种, 比如伪菱形藻属(Pseudo-nitzschia)有29种赤潮物种, 角毛藻属(Chaetoceros)23种, 原甲藻属(Prorocentrum)22种, 亚历山大藻属(Alexandrium)18种, 以及原多甲藻属(Protoperidinium)17种(图 1a)。
| 序号 | 中文名 | 拉丁名 | 18S rDNA收录号 |
| 1 | 红色赤潮藻 | Akashiwo sanguinea | AY831412 |
| 2 | 相关亚历山大藻 | Alexandrium affine | AY831409 |
| 3 | — | Alexandrium andersonii | JF521621 |
| 4 | 澳大利亚亚历山大藻 | Alexandrium australiense | KF908802 |
| 5 | — | Alexandrium balechii | — |
| 6 | 链状亚历山大藻 | Alexandrium catenella | DQ785887 |
| 7 | 股状亚历山大藻 | Alexandrium cohorticula | AF113935 |
| 8 | — | Alexandrium fragae | — |
| 9 | — | Alexandrium fraterculus | AB088290 |
| 10 | 广野亚历山大藻 | Alexandrium hiranoi | AY641564 |
| 11 | 微小亚历山大藻 | Alexandrium minutum | AY831408 |
| 12 | 项圈亚历山大藻 | Alexandrium monilatum | AY883005 |
| 13 | — | Alexandrium ostenfeldii | LC433647 |
| 14 | 太平洋亚历山大藻 | Alexandrium pacificum | KF908801 |
| 15 | 拟膝沟亚历山大藻 | Alexandrium pseudogonyaulax | AB088302 |
| 16 | 塔玛亚历山大藻 | Alexandrium tamarense | AY831406 |
| 17 | — | Alexandrium tamiyavanichii | AB088318 |
| 18 | — | Alexandrium taylorii | AJ535385 |
| 19 | — | Alexandrium tropicale | — |
| 20 | 强壮前沟藻 | Amphidinium carterae | EF057407 |
| 21 | — | Amphidinium gibbosum | AB863027 |
| 22 | 克氏前沟藻 | Amphidinium klebsii | KF733541 |
| 23 | — | Amphidinium operculatum | AB704006 |
| 24 | — | Amphidoma languida | KR362880 |
| 25 | 二齿双管藻 | Amphisolenia bidentata | GU196150 |
| 26 | — | Azadinium dexteroporum | KR362889 |
| 27 | 腹孔环胺藻 | Azadinium poporum | HQ324898 |
| 28 | 具刺环胺藻 | Azadinium spinosum | JX559885 |
| 29 | 闪光环沟藻 | Barrufeta resplendens | — |
| 30 | — | Centrodinium punctatum | MK714082 |
| 31 | 盘绕旋沟藻 | Cochlodinium helicoides | — |
| 32 | 库里亚藻 | Coolia monotis | FR847217 |
| 33 | — | Coolia tropicalis | — |
| 34 | 渐尖鳍藻 | Dinophysis acuminata | AJ506972 |
| 35 | 尖头鳍藻 | Dinophysis acuta | AJ506973 |
| 36 | 具尾鳍藻 | Dinophysis caudata | EU780644 |
| 37 | 倒卵形鳍藻 | Dinophysis fortii | AB073118 |
| 38 | — | Dinophysis infundibulum | AB366002 |
| 39 | 勇士鳍藻 | Dinophysis miles | JN982970 |
| 40 | — | Dinophysis norvegica | AJ506974 |
| 41 | — | Dinophysis ovata | — |
| 42 | — | Dinophysis ovum | KJ513128 |
| 43 | 球囊鳍藻 | Dinophysis sacculus | AJ304807 |
| 44 | 三角鳍藻 | Dinophysis tripos | HM853816 |
| 45 | 微细双盾藻 | Diplopelta parva | — |
| 46 | — | Durinskia dybowskii | AF231803 |
| 47 | — | Fukuyoa paulensis | MW046230 |
| 48 | — | Fukuyoa ruetzleri | KX424850 |
| 49 | — | Fukuyoa yasumotoi | KM272972 |
| 50 | — | Gambierdiscus australes | AB764308 |
| 51 | — | Gambierdiscus balechii | KY235239 |
| 52 | — | Gambierdiscus belizeanus | EF202866 |
| 53 | 加勒比冈比亚藻 | Gambierdiscus caribaeus | HE775087 |
| 54 | — | Gambierdiscus carolinianus | EU770644 |
| 55 | — | Gambierdiscus carpenteri | KM272970 |
| 56 | — | Gambierdiscus cheloniae | KU674341 |
| 57 | — | Gambierdiscus excentricus | — |
| 58 | — | Gambierdiscus jejuensis | MH827559 |
| 59 | — | Gambierdiscus lapillus | KU558932 |
| 60 | 太平洋冈比亚藻 | Gambierdiscus pacificus | KY235242 |
| 61 | — | Gambierdiscus polynesiensis | EF202907 |
| 62 | — | Gambierdiscus scabrosus | AB764235 |
| 63 | — | Gambierdiscus silvae | — |
| 64 | 有毒冈比亚藻 | Gambierdiscus toxicus | EF202890 |
| 65 | 双刺膝沟藻 | Gonyaulax diegensis | — |
| 66 | 具指膝沟藻 | Gonyaulax digitale | MW795366 |
| 67 | 多纹膝沟藻 | Gonyaulax polygramma | AJ833631 |
| 68 | 斯氏膝沟藻 | Gonyaulax scrippsae | — |
| 69 | 具刺膝沟藻 | Gonyaulax spinifera | AF022155 |
| 70 | — | Gonyaulax taylorii | — |
| 71 | — | Gymnodinium aureolum | DQ779991 |
| 72 | 链状裸甲藻 | Gymnodinium catenatum | DQ785882 |
| 73 | 伊姆裸甲藻 | Gymnodinium impudicum | DQ779993 |
| 74 | 多米尼环沟藻 | Gyrodinium dominans | — |
| 75 | 螺旋环沟藻 | Gyrodinium spirale | AB120001 |
| 76 | 环状异帽藻 | Heterocapsa circularisquama | LC054932 |
| 77 | — | Heterocapsa rotundata | AF274267 |
| 78 | 星状凯伦藻 | Karenia asterichroma | — |
| 79 | 双揳凯伦藻 | Karenia bicuneiformis | HM067002 |
| 80 | 短凯伦藻 | Karenia brevis | AF172714 |
| 81 | 短沟凯伦藻 | Karenia brevisulcata | — |
| 82 | 协和凯伦藻 | Karenia concordia | — |
| 83 | 冠状凯伦藻 | Karenia cristata | — |
| 84 | 长沟凯伦藻 | Karenia longicanalis | — |
| 85 | 米氏凯伦藻 | Karenia mikimotoi | AF022195 |
| 86 | 碟形凯伦藻 | Karenia papilionacea | HM067005 |
| 87 | 鞍形凯伦藻 | Karenia selliformis | HM067007 |
| 88 | — | Karlodinium armiger | — |
| 89 | — | Karlodinium conicum | — |
| 90 | — | Karlodinium corsicum | — |
| 91 | 指沟凯伦藻 | Karlodinium digitatum | — |
| 92 | — | Karlodinium gentienii | — |
| 93 | 剧毒卡尔藻 | Karlodinium veneficum | JN986577 |
| 94 | 三角异帽藻 | Kryptoperidinium triquetrum | AF022198 |
| 95 | 灰白下沟藻 | Lebouridinium glaucum | KP790161 |
| 96 | 条纹环沟藻 | Levanderina fissa | KP790163 |
| 97 | 多边舌甲藻 | Lingulodinium polyedra | AY421788 |
| 98 | — | Luciella masanensis | AM050344 |
| 99 | 褐色马格里夫藻 | Margalefidinium fulvescens | AB288380 |
| 100 | 多环马格里夫藻 | Margalefidinium polykrikoides | DQ779986 |
| 101 | 夜光藻 | Noctiluca scintillans | AF022200 |
| 102 | 法托鲁索蛎甲藻 | Ostreopsis fattorussoi | — |
| 103 | 七角蛎甲藻 | Ostreopsis heptagona | — |
| 104 | 凸透蛎甲藻 | Ostreopsis lenticularis | MK227248 |
| 105 | 马斯克林蛎甲藻 | Ostreopsis mascarenensis | — |
| 106 | 卵圆蛎甲藻 | Ostreopsis ovata | — |
| 107 | — | Ostreopsis rhodesiae | KX055855 |
| 108 | 暹罗砺甲藻 | Ostreopsis siamensis | — |
| 109 | 海洋尖尾藻 | Oxyrrhis marina | AF280077 |
| 110 | — | Pfiesteria piscicida | FJ600090 |
| 111 | — | Pfiesteria shumwayae | AY245694 |
| 112 | 帽状秃顶藻 | Phalacroma mitra | AB551248 |
| 113 | 圆秃顶藻 | Phalacroma rotundatum | AJ506975 |
| 114 | 双胞旋沟藻 | Polykrikos geminatus | — |
| 115 | 哈曼褐多沟藻 | Polykrikos hartmannii | AY421789 |
| 116 | 科夫多沟藻 | Polykrikos kofoidii | DQ371292 |
| 117 | 波罗的海原甲藻 | Prorocentrum balticum | — |
| 118 | — | Prorocentrum borbonicum | — |
| 119 | — | Prorocentrum caipirignum | KY039500 |
| 120 | — | Prorocentrum cassubicum | DQ388460 |
| 121 | — | Prorocentrum concavum | Y16237 |
| 122 | — | Prorocentrum cordatum | JF715165 |
| 123 | 具齿原甲藻 | Prorocentrum dentatum | DQ336057 |
| 124 | 东海原甲藻 | Prorocentrum donghaiense | MH729037 |
| 125 | — | Prorocentrum emarginatum | Y16239 |
| 126 | — | Prorocentrum faustiae | — |
| 127 | 细长原甲藻 | Prorocentrum gracile | AY443019 |
| 128 | — | Prorocentrum hoffmannianum | KF885226 |
| 129 | — | Prorocentrum leve | DQ238043 |
| 130 | 利马原甲藻 | Prorocentrum lima | Y16235 |
| 131 | — | Prorocentrum maculosum | Y16236 |
| 132 | 墨西哥原甲藻 | Prorocentrum mexicanum | Y16232 |
| 133 | 海洋原甲藻 | Prorocentrum micans | AY803739 |
| 134 | 慢原甲藻 | Prorocentrum rhathymum | FJ842096 |
| 135 | 四国原甲藻 | Prorocentrum shikokuensis | — |
| 136 | — | Prorocentrum steidingerae | — |
| 137 | — | Prorocentrum texanum | JQ390504 |
| 138 | 三叶原甲藻 | Prorocentrum triestinum | KX786249 |
| 139 | 网状原角藻 | Protoceratium reticulatum | AY421790 |
| 140 | — | Protodinium simplex | U41086 |
| 141 | 李氏亚历山大藻 | Protogonyaulax leei | AY641565 |
| 142 | 美国原多甲藻 | Protoperidinium americanum | — |
| 143 | — | Protoperidinium avellana | — |
| 144 | 二角原多甲藻 | Protoperidinium bipes | AB284159 |
| 145 | 窄角原多甲藻 | Protoperidinium claudicans | — |
| 146 | 锥形原多甲藻 | Protoperidinium conicoides | — |
| 147 | 锥形原多甲藻 | Protoperidinium conicum | AY443020 |
| 148 | 扁形原多甲藻 | Protoperidinium depressum | AB255834 |
| 149 | 歧散原多甲藻 | Protoperidinium divergens | AB181893 |
| 150 | 优美原多甲藻 | Protoperidinium elegans | AB255836 |
| 151 | 里昂原多甲藻 | Protoperidinium leonis | AB181898 |
| 152 | 长形原多甲藻 | Protoperidinium oblongum | MG720551 |
| 153 | 海洋原多甲藻 | Protoperidinium oceanicum | — |
| 154 | 透明原多甲藻 | Protoperidinium pellucidum | AY443022 |
| 155 | 五边原多甲藻 | Protoperidinium pentagonum | AB255838 |
| 156 | 五角原多甲藻 | Protoperidinium quadridentatum | — |
| 157 | 赛裸原多甲藻 | Protoperidinium subinerme | — |
| 158 | — | Protoperidinium triquetrum | — |
| 159 | 镰状环沟藻 | Pseliodinium fusus | OL439714 |
| 160 | 纺锤梨甲藻 | Pyrocystis fusiformis | — |
| 161 | 巴哈马盾甲藻 | Pyrodinium bahamense | AY456115 |
| 162 | — | Pyrodinium compressum | DQ500120 |
| 163 | 钟扁甲藻 | Pyrophacus horologium | — |
| 164 | 斯氏扁甲藻 | Pyrophacus steinii | AY443024 |
| 165 | 尖顶斯氏藻 | Scrippsiella acuminata | HM483396 |
| 166 | 稀见斯氏藻 | Scrippsiella precaria | MT039423 |
| 167 | 春膝沟藻 | Sourniaea diacantha | — |
| 168 | 绕顶塔卡藻 | Takayama acrotrocha | HM067010 |
| 169 | — | Takayama cladochroma | — |
| 170 | 美丽裸甲藻 | Takayama pulchella | — |
| 171 | — | Tripos brevis | — |
| 172 | — | Tripos deflexus | — |
| 173 | — | Tripos furca | AJ276699 |
| 174 | — | Tripos fusus | AF022153 |
| 175 | — | Tripos humilis | — |
| 176 | — | Tripos macroceros | MF927988 |
| 177 | — | Tripos massiliensis | FJ402942 |
| 178 | — | Tripos muelleri | MF927990 |
| 179 | — | Tripos trichoceros | — |
| 180 | — | Vulcanodinium rugosum | MG826114 |
| 序号 | 中文名 | 拉丁名 | 18S rDNA收录号 |
| 1 | 冰河拟星杆藻 | Asterionellopsis glacialis | AY216904 |
| 2 | 加拉拟星杆藻 | Asteroplanus karianus | Y10568 |
| 3 | — | Bacillaria paxillifera | KY054943 |
| 4 | 锤状中鼓藻 | Bellerochea malleus | AF525671 |
| 5 | 双角角管藻 | Cerataulina bicornis | — |
| 6 | 大洋角管藻 | Cerataulina pelagica | HQ912669 |
| 7 | 窄隙角毛藻 | Chaetoceros affinis | MG972331 |
| 8 | 大西洋角毛藻 | Chaetoceros atlanticus | MG972211 |
| 9 | 扁面角毛藻 | Chaetoceros compressus | — |
| 10 | 凹角角刺藻 | Chaetoceros concavicornis | — |
| 11 | 扁面角毛藻 | Chaetoceros contortus | MG972222 |
| 12 | 扭曲角刺藻 | Chaetoceros convolutus | — |
| 13 | 旋链角毛藻 | Chaetoceros curvisetus | MG972241 |
| 14 | 丹麦角毛藻 | Chaetoceros danicus | MG972244 |
| 15 | 柔弱角毛藻 | Chaetoceros debilis | AB847419 |
| 16 | 细齿角毛藻 | Chaetoceros denticulatus | — |
| 17 | 并基角毛藻 | Chaetoceros diadema | MG972258 |
| 18 | 双突角毛藻 | Chaetoceros didymus | MG972272 |
| 19 | 垂缘角毛藻 | Chaetoceros laciniosus | — |
| 20 | 罗氏角毛藻 | Chaetoceros lauderi | — |
| 21 | 洛氏角毛藻 | Chaetoceros lorenzianus | MG972289 |
| 22 | 窄面角毛藻 | Chaetoceros paradoxus | — |
| 23 | 秘鲁角毛藻 | Chaetoceros peruvianus | MG972297 |
| 24 | 拟弯角毛藻 | Chaetoceros pseudocurvisetus | MG972305 |
| 25 | 喜盐角毛藻 | Chaetoceros salsugineus | — |
| 26 | 暹罗角毛藻 | Chaetoceros siamensis | — |
| 27 | 聚生角毛藻 | Chaetoceros socialis | KY852277 |
| 28 | 冕孢角毛藻 | Chaetoceros subsecundus | — |
| 29 | — | Chaetoceros tenuissimus | MZ169559 |
| 30 | 琼氏圆筛藻 | Coscinodiscopsis jonesiana | KJ577852 |
| 31 | 星脐圆筛藻 | Coscinodiscus asteromphalus | — |
| 32 | 中心圆筛藻 | Coscinodiscus centralis | — |
| 33 | 巨形圆筛藻 | Coscinodiscus gigas | — |
| 34 | 格氏圆筛藻 | Coscinodiscus granii | AY485495 |
| 35 | 孔圆筛藻 | Coscinodiscus perforatus | — |
| 36 | 辐射圆筛藻 | Coscinodiscus radiatus | X77705 |
| 37 | 威氏圆筛藻 | Coscinodiscus wailesii | HQ912668 |
| 38 | 隐秘小环藻 | Cyclotella cryptica | AY485499 |
| 39 | 新月筒柱藻 | Cylindrotheca closterium | LC054954 |
| 40 | 脆指管藻 | Dactyliosolen fragilissimus | — |
| 41 | 地中海娄氏藻 | Dactyliosolen mediterraneus | KU577433 |
| 42 | 布氏双尾藻 | Ditylum brightwellii | AY485444 |
| 43 | 浮动弯角藻 | Eucampia zodiacus | EF585584 |
| 44 | 柔弱几内亚藻 | Guinardia delicatula | AJ535192 |
| 45 | 萎软几内亚藻 | Guinardia flaccida | AJ535191 |
| 46 | 斯氏几内亚藻 | Guinardia striata | KJ577857 |
| 47 | 咖啡形双眉藻 | Halamphora coffeiformis | KX120664 |
| 48 | — | Hobaniella longicruris | JX413553 |
| 49 | 环纹娄氏藻 | Lauderia annulata | DQ514849 |
| 50 | 丹麦细柱藻 | Leptocylindrus danicus | AJ535175 |
| 51 | 小细柱藻 | Leptocylindrus minimus | AJ535176 |
| 52 | 易变石丝藻 | Lithodesmium variabile | KJ671699 |
| 53 | 拟货币直链藻 | Melosira discigera | HQ912566 |
| 54 | 朱吉直链藻 | Melosira lineata | — |
| 55 | 念珠直链藻 | Melosira moniliformis | KM592935 |
| 56 | 大洋新具槽藻 | Neodelphineis pelagica | — |
| 57 | — | Neomoelleria cornuta | KJ577856 |
| 58 | — | Nitzschia bizertensis | KF955285 |
| 59 | — | Nitzschia hybrida | — |
| 60 | 长菱形藻 | Nitzschia longissima | AY881968 |
| 61 | — | Nitzschia navis-varingica | — |
| 62 | 长耳齿状藻 | Odontella aurita | HQ912687 |
| 63 | 具槽帕拉藻 | Paralia sulcata | HQ912573 |
| 64 | 翼鼻状藻 | Proboscia alata | AJ535181 |
| 65 | 印度翼根管藻 | Proboscia indica | — |
| 66 | — | Pseudo-nitzschia abrensis | KC409109 |
| 67 | 澳洲伪菱形藻 | Pseudo-nitzschia australis | GU373961 |
| 68 | — | Pseudo-nitzschia batesiana | KP708989 |
| 69 | — | Pseudo-nitzschia bipertita | — |
| 70 | 巴西伪菱形藻 | Pseudo-nitzschia brasiliana | KP708990 |
| 71 | 花形伪菱形藻 | Pseudo-nitzschia caciantha | KP708992 |
| 72 | 靓纹伪菱形藻 | Pseudo-nitzschia calliantha | AY257857 |
| 73 | 细弱伪菱形藻 | Pseudo-nitzschia cuspidata | KP708995 |
| 74 | 柔弱伪菱形藻 | Pseudo-nitzschia delicatissima | DQ336150 |
| 75 | 伪善伪菱形藻 | Pseudo-nitzschia fraudulenta | KX229690 |
| 76 | 福氏伪菱形藻 | Pseudo-nitzschia fukuyoi | KP708999 |
| 77 | 银河伪菱形藻 | Pseudo-nitzschia galaxiae | AY257850 |
| 78 | — | Pseudo-nitzschia granii | — |
| 79 | — | Pseudo-nitzschia hasleana | KC017468 |
| 80 | — | Pseudo-nitzschia kodamae | KP709000 |
| 81 | 隆氏伪菱形藻 | Pseudo-nitzschia lundholmiae | KP709002 |
| 82 | 多列伪菱形藻 | Pseudo-nitzschia multiseries | U18241 |
| 83 | 多纹拟菱形藻 | Pseudo-nitzschia multistriata | — |
| 84 | — | Pseudo-nitzschia obtusa | — |
| 85 | — | Pseudo-nitzschia plurisecta | MH376351 |
| 86 | 伪柔弱伪菱形藻 | Pseudo-nitzschia pseudodelicatissima | GU373965 |
| 87 | 尖刺伪菱形藻 | Pseudo-nitzschia pungens | U18240 |
| 88 | 成列伪菱形藻 | Pseudo-nitzschia seriata | GU373969 |
| 89 | 伪装拟菱形藻 | Pseudo-nitzschia simulans | — |
| 90 | 中华拟菱形藻 | Pseudo-nitzschia sinica | — |
| 91 | — | Pseudo-nitzschia subcurvata | KX253952 |
| 92 | 亚伪善拟菱形藻 | Pseudo-nitzschia subfraudulenta | — |
| 93 | 亚太平洋拟菱形藻 | Pseudo-nitzschia subpacifica | — |
| 94 | — | Pseudo-nitzschia turgidula | — |
| 95 | — | Pseudosolenia calcar-avis | KJ577871 |
| 96 | 细长翼根管藻 | Rhizosolenia gracillima | — |
| 97 | 半棘钝根管藻 | Rhizosolenia semispina | — |
| 98 | 斯氏根管藻 | Rhizosolenia stolterfothii | — |
| 99 | 笔尖根管藻 | Rhizosolenia styliformis | — |
| 100 | 宽笔尖形根管藻 | Rhizosolenia styliformis var. latissima | — |
| 101 | 中肋骨条藻 | Skeletonema costatum | DQ396524 |
| 102 | 玛氏骨条藻 | Skeletonema marinoi | HM236348 |
| 103 | 掌状冠盖藻 | Stephanopyxis palmeriana | AY485527 |
| 104 | 刚毛根管藻 | Sundstroemia setigera | AY485461 |
| 105 | 佛氏海线藻 | Thalassionema frauenfeldii | JX401233 |
| 106 | 菱形海线藻 | Thalassionema nitzschioides | X77702 |
| 107 | 并基海链藻 | Thalassiosira decipiens | — |
| 108 | 双环海链藻 | Thalassiosira diporocyclus | MF405351 |
| 109 | 离心列海链藻 | Thalassiosira eccentrica | — |
| 110 | 圆海链藻 | Thalassiosira gravida | AF374480 |
| 111 | 透明海链藻 | Thalassiosira hyalina | JX437383 |
| 112 | 萎软海链藻 | Thalassiosira mala | — |
| 113 | 诺氏海链藻 | Thalassiosira nordenskioeldii | DQ093365 |
| 114 | 太平洋海链藻 | Thalassiosira pacifica | DQ514888 |
| 115 | 细弱海链藻 | Thalassiosira subtilis | — |
| 116 | 威氏海链藻 | Thalassiosira weissflogii | AF374477 |
| 117 | 中华盒形藻 | Trieres chinensis | HQ912564 |
| 118 | 活动盒形藻 | Trieres mobiliensis | KC309500 |
| 119 | 高齿盒形藻 | Trieres regia | KC309502 |
| 120 | — | Tryblionella compressa | — |
| 序号 | 中文名 | 拉丁名 | 门 | 18S rDNA收录号 |
| 1 | 三深裂醉藻 | Ebria tripartita | Cercozoa | DQ303923 |
| 2 | — | Nephroselmis pyriformis | Chlorophyta | KF615768 |
| 3 | — | Polyblepharides amylifera | Chlorophyta | KF615764 |
| 4 | — | Pyramimonas parkeae | Chlorophyta | KX611141 |
| 5 | 孔石莼 | Ulva australis | Chlorophyta | AB425961 |
| 6 | 浒苔 | Ulva prolifera | Chlorophyta | AF499654 |
| 7 | 红色中缢虫 | Mesodinium rubrum | Ciliophora | — |
| 8 | 波罗的海隐藻 | Cryptomonas baltica | Cryptista | DQ228118 |
| 9 | — | Cryptomonas kielensis | Cryptista | HF952610 |
| 10 | 盐水隐藻 | Rhodomonas salina | Cryptista | HM126532 |
| 11 | 尖尾全沟藻 | Teleaulax acuta | Cryptista | HM126531 |
| 12 | 纤细裸藻 | Euglena gracilis | Euglenozoa | — |
| 13 | — | Euglena pascheri | Euglenozoa | — |
| 14 | 绿裸藻 | Euglena viridis | Euglenozoa | AJ532415 |
| 15 | — | Eutreptia lanowii | Euglenozoa | — |
| 16 | — | Eutreptiella gymnastica | Euglenozoa | FJ719618 |
| 17 | 里氏金色藻 | Chrysochromulina leadbeateri | Haptophyta | AM491017 |
| 18 | 海洋球石藻 | Emiliania huxleyi | Haptophyta | KX229688 |
| 19 | 大洋桥石藻 | Gephyrocapsa oceanica | Haptophyta | AJ246276 |
| 20 | 球等鞭金藻 | Isochrysis galbana | Haptophyta | KX980524 |
| 21 | 球形棕囊藻 | Phaeocystis globosa | Haptophyta | AF182110 |
| 22 | 普氏棕囊藻 | Phaeocystis pouchetii | Haptophyta | AJ278036 |
| 23 | — | Prymnesium calathiferum | Haptophyta | AM491008 |
| 24 | — | Prymnesium faveolatum | Haptophyta | AM491005 |
| 25 | — | Prymnesium parvum | Haptophyta | KU900224 |
| 26 | — | Prymnesium polylepis | Haptophyta | AJ004866 |
| 27 | — | Prymnesium zebrinum | Haptophyta | AM491001 |
| 28 | 抑食金球藻 | Aureococcus anophagefferens | Ochrophyta | AF117777 |
| 29 | — | Aureoumbra lagunensis | Ochrophyta | U40258 |
| 30 | 古老卡盾藻 | Chattonella antiqua | Ochrophyta | AY788920 |
| 31 | 海洋卡盾藻 | Chattonella marina | Ochrophyta | AY788925 |
| 32 | — | Chattonella ovata | Ochrophyta | AY788923 |
| 33 | 盐生卡盾藻 | Chattonella subsalsa | Ochrophyta | U41649 |
| 34 | 小等刺硅鞭藻 | Dictyocha fibula | Ochrophyta | AB096710 |
| 35 | 波罗的海钟罩藻 | Dinobryon balticum | Ochrophyta | — |
| 36 | — | Fibrocapsa japonica | Ochrophyta | AY788931 |
| 37 | 赤潮异弯藻 | Heterosigma akashiwo | Ochrophyta | DQ191681 |
| 38 | 六异刺硅鞭藻 | Octactis speculum | Ochrophyta | U14385 |
| 39 | — | Pseudochattonella farcimen | Ochrophyta | AM075624 |
| 40 | — | Pseudochattonella verruculosa | Ochrophyta | AM075625 |
| 41 | — | Vicicitus globosus | Ochrophyta | HQ646558 |
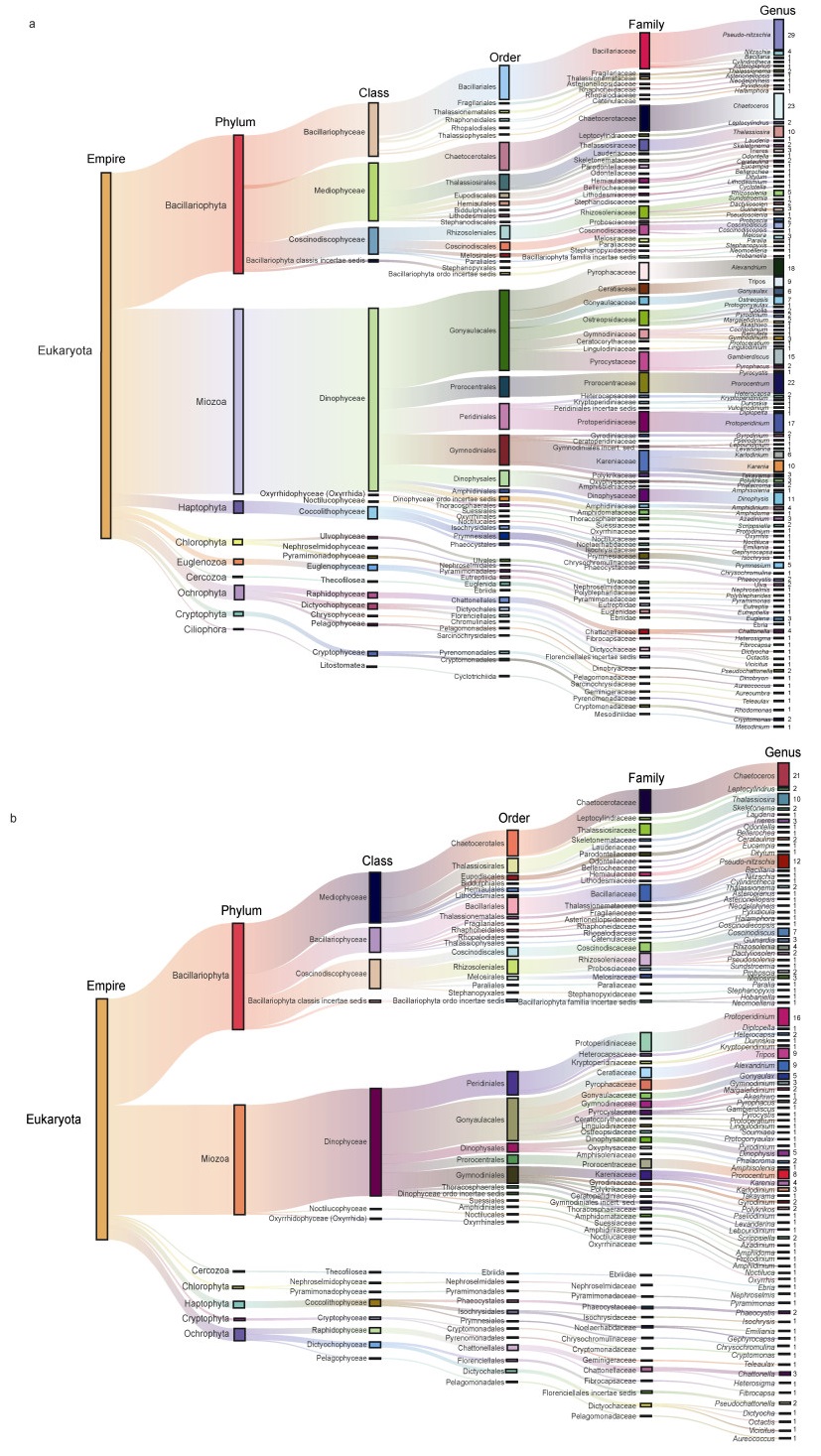 |
| 图 1 赤潮物种的分类地位 Fig. 1 Taxonomic positions of HAB species 注: a. 全球统计到的341个赤潮物种及分类地位; b. 中国海域记录到过的215个赤潮物种及分类地位 |
本文梳理和统计的341个赤潮物种还包括了联合国教科文组织全球有害藻华物种分类参考名单(IOC-UNESCO Taxonomic Reference List of Harmful Micro Algae) (https://www.marinespecies.org/hab/index.php)列举的全部157种有毒真核赤潮物种, 包括106种甲藻、30种硅藻, 以及21个其他门类的物种。联合国教科文组织全球有害藻华物种分类参考名单中尚未完成无毒赤潮物种的统计, 因此没有提供无毒赤潮物种名单。本文梳理和统计的341个赤潮物种包括了基于文献报道整理的无毒赤潮物种, 是对联合国教科文组织全球有害藻华物种分类参考名单的一个重要补充。另外, Jeong等(2021)学者统计了1990~2019年世界海洋中的37 911种微藻和蓝藻, 发现其中有365种引发过赤潮(Jeong et al, 2021), 与本文统计的赤潮物种数据相近。
赤潮物种的准确鉴定是研究海洋生态系统中赤潮物种的组成及其时空动态变化规律的基础。近年来, 基于分子标记扩增和测序的宏条形码分析方法正在逐步发展, 与形态学方法相辅相成, 成为新一代海洋生态调查和赤潮研究的方法。宏条形码分析的成功很大程度上取决于分子标记的选择和分子标记数据库的完善。为此, 我们以最常用分子标记18S rDNA为例, 检索并比较分析了赤潮物种分子标记序列。在NCBI数据库(https://www.ncbi.nlm.nih.gov/)中, 我们检索到341个赤潮物种中的244种(约占71.6%, 甲藻128/180, 硅藻80/120, 其他物种36/41)的18S rDNA序列。这些18S rDNA序列是全长或者接近全长(1 000~1 800 bp), 且有正式发表的文献支持(表 1~3)。由此可见, 接近100个赤潮物种(~30%)缺乏18S rDNA信息, 从而导致宏条形码分析方法不能被用于跟踪分析这些赤潮物种的组成。与18S rDNA序列相比, 其他分子标记比如28S rDNA、ITS、rbcL和CO1序列的完善程度更低。由此可见, 赤潮物种的分子标记数据库还需要进一步补充完善, 才能有效支撑宏条形码分析。
2 中国海域的赤潮物种比较分析 2.1 中国海域赤潮物种及其分布几十年以来, 国内专家学者通过航次调查获取样本对我国海域进行了长期系统的采样, 并利用显微镜进行形态学分类鉴定, 为赤潮物种的研究积累了宝贵的数据资料。各海域航次调查最短的也有近30年, 最长的达到83年, 在时空上的覆盖度均很高。本实验室针对中国渤海、黄海、东海、南海四大海域, 以及重要河口长江口、珠江口, 重要海湾胶州湾的历史独立航次进行了文献整理, 统计了这些航次鉴定到的所有浮游植物及赤潮物种(刘淑雅等, 2021; 陈楠生等, 2021a, 2021b, 2021c, 2021d; 姚艳欣等, 2021; 陈楠生等, 2023)。本文对这些海域鉴定到的赤潮物种, 包括已在中国海域引发过赤潮和未引发过但存在的物种, 都进行了比较分析。结果显示, 黄海在历史上的调查数目和记录到的赤潮物种数都最多, 东海次之, 渤海和南海数目相近。胶州湾和长江口虽然范围小, 但由于调查频繁, 鉴定到的赤潮物种数也比较高(表 4)。综合各海域的统计结果, 在我国海域鉴定到的赤潮物种为215种, 涉及7门14纲39目61科90属, 其中4个属有10种以上的赤潮物种, 包括角毛藻属(Chaetoceros) 21种, 原多甲藻属(Protoperidinium) 16种, 伪菱形藻属(Pseudo-nitzschia) 12种, 以及海链藻属(Thalassiosira) 10种(图 1b)。这215个赤潮物种中, 只有162种(约占75.3%)的18S rDNA序列(> 1 000 bp)得到可靠解析, 53个赤潮物种的18S rDNA序列尚未得到解析, 限制了针对这些赤潮物种的宏条形码分析。
| 航次数 | 航次时间 | 甲藻 | 硅藻 | 其他 | 总计 | 参考文献 | |
| 渤海 | 46 | 1957~2019 | 53 | 69 | 12 | 134 | 陈楠生等, 2021c |
| 黄海 | 122 | 1936~2019 | 82 | 86 | 16 | 184 | 陈楠生等, 2023 |
| 东海 | 67 | 1958~2019 | 58 | 71 | 7 | 136 | 陈楠生等, 2021b |
| 南海 | 44 | 1987~2018 | 58 | 67 | 8 | 133 | 陈楠生等, 2021a |
| 长江口 | 52 | 1977~2016 | 58 | 69 | 5 | 132 | 陈楠生等, 2021d |
| 珠江口 | 22 | 1985~2014 | 42 | 54 | 6 | 102 | 姚艳欣等, 2021 |
| 胶州湾 | 84 | 1936~2019 | 57 | 70 | 9 | 136 | 刘淑雅等, 2021 |
| 至少一个海域有记录 | — | — | 99 | 95 | 21 | 215 | — |
| 所有海域均有记录 | — | — | 26 | 48 | 2 | 76 | — |
比较分析我国各海域鉴定到的赤潮物种发现有76种出现在所有统计海域, 有35种仅在黄海海域内(包括胶州湾)记录到过, 在渤海、东海和南海等海域调查中没有鉴定到。从南北海域来看, 有53种仅在北方海域出现(渤海和黄海), 有8种仅在南方海域发现(东海和南海)(图 2)。另外, 根据物种在历史航次调查(表 4)中出现的频率, 即使是所有海域普遍存在的76个赤潮物种, 也有部分具有明显的海域偏好性, 比如中肋骨条藻在长江口尤为占优势, 旋链角毛藻(Chaetoceros curvisetus)更多地分布在黄海, 而南海海域则更适合菱形海线藻(Thalassionema nitzschioides)的生长繁殖(图 3)。
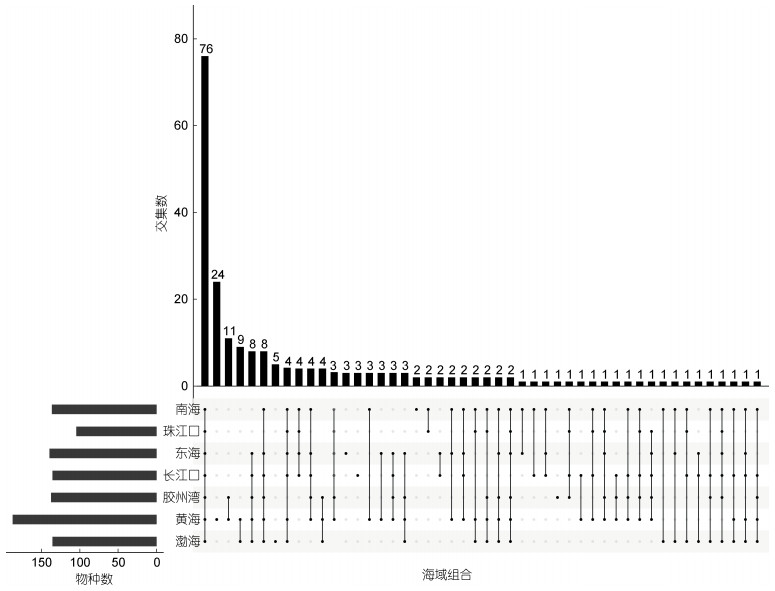 |
| 图 2 中国海域赤潮物种的分布 Fig. 2 Distribution of HAB species in the China seas |
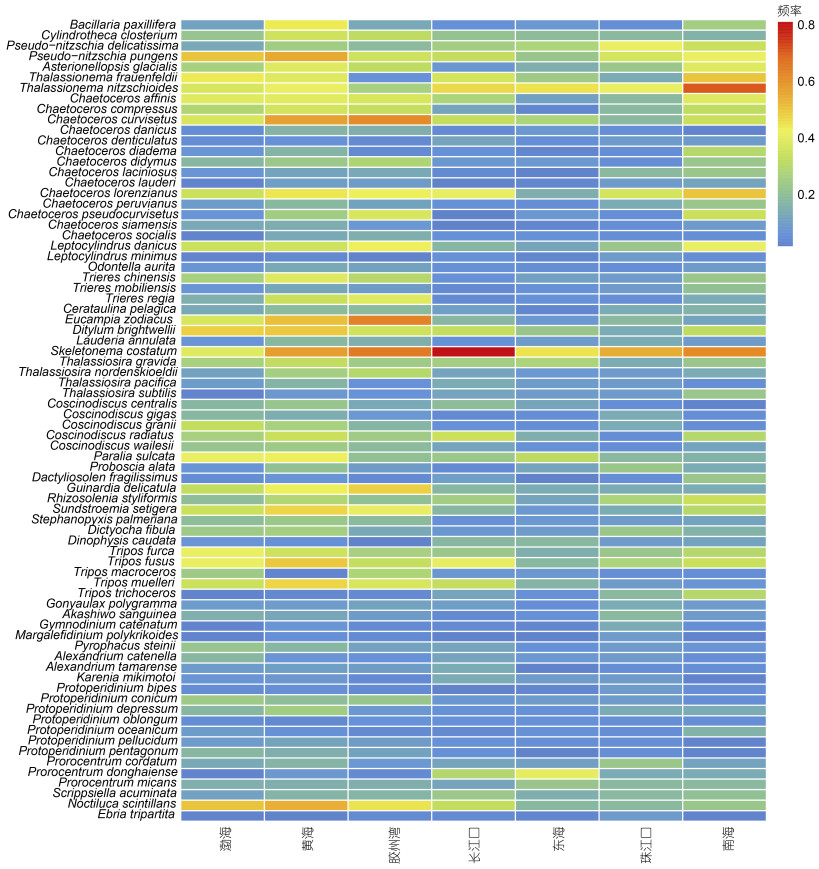 |
| 图 3 中国海域普遍存在的76个赤潮物种在历史航次中于各海域检出的频率(蓝-红: 低-高) Fig. 3 Frequency of occurrence of 76 HAB species shared in all China seas (blue to red: low to high) |
传统形态学方法在航次样本的分析上沿用至今, 可以帮助积累宝贵数据, 揭示重要规律的同时, 但也显示出其局限性, 比如对细胞尺寸小和形态特征少的物种的分辨率低, 严重依赖研究者的经验等, 这使得我们对中国海域的赤潮物种的认知还有很多缺失和错误(陈楠生, 2020)。随着分子技术的发展, 宏条形码分析方法崛起, 可以被有效应用于赤潮物种的鉴定和分析。研究人员基于4个航次的宏条形码分析(Chen et al, 2021; Cui et al, 2021; Huang et al, 2021; Liu et al, 2022)鉴定出了131个赤潮物种。尽管这4个航次只代表有限的海域、有限的季节及有限的年份(2019年), 但鉴定出来的赤潮物种数已经达到了几十年来数以百计的基于形态鉴定的航次调查分析鉴定出的赤潮物种数(215个)的一半以上, 并且发现了10种以前未曾报道的赤潮物种(Alexandrium hiranoi, Azadinium poporum, Dinophysis acuta, Dinophysis infundibulum, Dinophysis norvegica, Dinophysis tripos, Prorocentrum rhathymum, Prorocentrum texanum, Pseudo-nitzschia batesiana, Rhodomonas salina)(图 4), 显示了宏条形码分析的准确性和灵敏性。不仅如此, 在时间投入和人力成本方面, 宏条形码分析方法更为高效, 可以支撑规模化和系统化的赤潮物种多样性的生态调查。宏条形码分析鉴定到的10种赤潮物种在前期的基于形态特征的生态调查研究中被忽视, 部分是由于它们的细胞较小, 部分由于近缘物种形态难以准确区分, 还有部分在固定过程中不稳定而干扰准确的形态鉴定。随着分子标记数据库的日益完善, 宏条形码分析方法在逐步成为新一代赤潮物种多样性生态调查研究方法, 是对形态学分析很好的补充与完善。
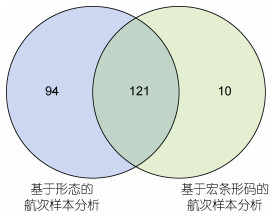 |
| 图 4 基于形态和基于宏条形码的航次样本分析结果比较 Fig. 4 Comparison of analysis results based on morphology and metabarcoding |
赤潮物种众多, 均可以对海洋生态系统造成灾害, 带来诸多负面影响。然而, 有些赤潮物种引发的赤潮面积尤其宽广, 造成的灾害尤其严重, 值得重点关注。本文选取了20种我国海域典型的赤潮物种(包括13种甲藻, 4种硅藻, 1种定鞭藻和2种棕鞭藻)进行重点描述(图 5)。
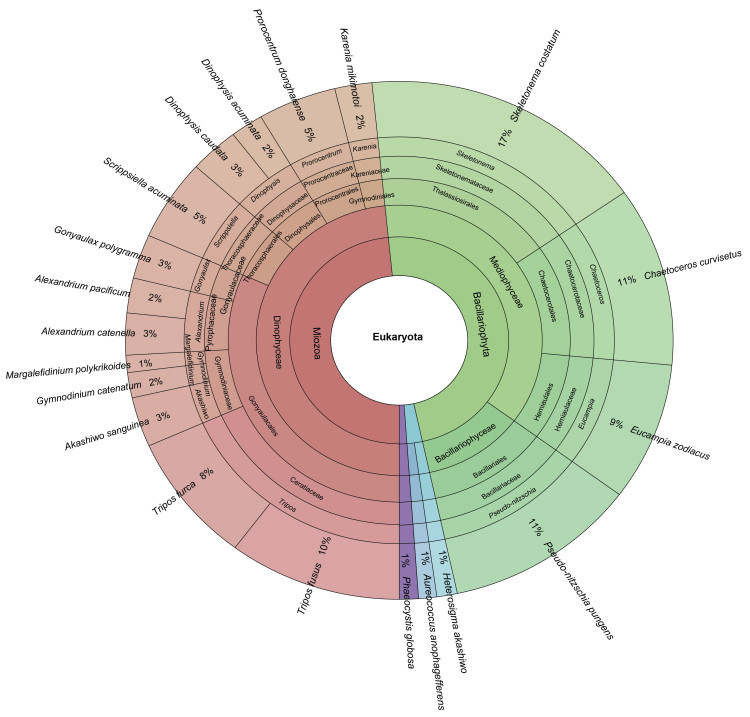 |
| 图 5 中国海域20种典型赤潮物种 Fig. 5 Twenty typical HAB species in the China sea 注: %表示物种在历史航次中(表 4)出现的百分比。Phaeocystis globosa的分类信息(紫色区块文字内容)由内到外分别是: Haptophyta门、Coccolithophyceae纲、Phaeocystales目、Phaeocystaceae科、Phaeocystis属; Aureococcus anophagefferens的分类信息(湖蓝色区块文字内容)由内到外分别是: Ochrophyta门、Pelagophyceae纲、Pelagomonadales目、Pelagomonadaceae科、Aureococcus属; Heterosigma akashiwo的分类信息(天蓝色区块文字内容)由内到外分别是: Ochrophyta门、Raphidophyceae纲、Chattonellales目、Chattonellaceae科、Heterosigma属 |
渐尖鳍藻(Dinophysis acuminata)属于Miozoa门, 甲藻纲(Dinophyceae), 鳍藻目(Dinophysales), 鳍藻科(Dinophysaceae), 鳍藻属(Dinophysis)。该藻能够产生贝类毒素, 包括软海绵酸(Okadaic acid, OA)和其衍生物鳍藻毒素(Dinophysistoxins, DTX)。渐尖鳍藻属于兼性营养型生物, 不能直接吸收海水中的无机营养盐进行细胞生长, 需要摄食红色中缢虫获得“质体”维持生存和生长, 并进行两次传递, 将隐藻的质体保存在自己体内(Park et al, 2006; Sun et al, 2007; Riisgaard et al, 2009)。渐尖鳍藻遍布全世界, 主要分布于包括我国海域的温带与寒带浅海海域(Burkholder et al, 2008; Hansen et al, 2013)。渐尖鳍藻形成的赤潮藻浓度一般较低, 不会引起海水变色。
3.2 具尾鳍藻具尾鳍藻(Dinophysis caudata)属于Miozoa门, 甲藻纲(Dinophyceae), 鳍藻目(Dinophysales), 鳍藻科(Dinophysaceae), 鳍藻属(Dinophysis)。具尾鳍藻也是世界性种, 在热带和亚热带分布较多, 极少情况下也能到达更高纬度的地区, 如挪威北部(高寒, 2015)。在欧洲南部、非洲西北部、北美洲西部、南美洲、东南亚以及澳大利亚东南部都报道过具尾鳍藻赤潮, 其毒素种类和含量也随着地理分布不同而异(Reguera et al, 2014)。日本曾报道具尾鳍藻赤潮发生前后, 有鱼类大量死亡(郭皓, 2004)。
3.3 Tripos furcaTripos furca属于Miozoa门, 甲藻纲(Dinophyceae), 膝沟藻目(Gonyaulacales), 角藻科(Ceratiaceae), Tripos属, 该属很多物种曾属于Ceratium属。Tripos furca是典型的沿岸表层性种, 世界性分布, 在我国渤海、东海和南海较为常见(郭皓, 2004)。1998~2008年, 我国沿岸海域发生了12次Tripos furca赤潮, 累计面积超过6500 km2。其中渤海5次, 东海4次, 南海3次。1998年累计发生面积和频次最大, 分别为2次和3 812 km2。据统计, Tripos furca赤潮6~7、9月发生频次最高(梁玉波, 2012)。该物种虽不具毒性, 但其引发的赤潮可能对海洋无脊椎动物幼虫造成伤害(郭皓, 2004)。
3.4 Tripos fususTripos fusus属于Miozoa门, 甲藻纲(Dinophyceae), 膝沟藻目(Gonyaulacales), 角藻科(Ceratiaceae), Tripos属。Tripos fusus也是世界性分布种, 热带和寒带海洋均有分布, 在我各大海域广泛分布(郭皓, 2004)。Tripos fusus常在内湾形成赤潮, 比如, 2007年9月27~29日, 在舟山桃花岛海域发生Tripos fusus和丹麦细柱藻共同引发的赤潮, 面积为500 km2 (梁玉波, 2012)。该种同样不具毒性, 但其引发的赤潮对牡蛎幼虫具有致死作用(郭皓, 2004)。
3.5 多纹膝沟藻多纹膝沟藻(Gonyaulax polygramma)属于Miozoa门, 甲藻纲(Dinophyceae), 膝沟藻目(Gonyaulacales), 膝沟藻科(Gonyaulacaceae), 膝沟藻属(Gonyaulax)。多纹膝沟藻营混合营养, 是温带到热带的大洋性种, 是我国南海北部主要的赤潮生物, 发生赤潮时水温约为17~20 ℃ (郭皓, 2004)。多纹膝沟藻曾在许多国家的沿海水域引发赤潮, 如韩国、日本、中国、美国、墨西哥、伯利兹、南非和阿尔及利亚等, 会导致鳍鱼和贝类因缺氧而大量死亡(Jeong et al, 2005b)。我国近岸海域1933~2009年共发生多纹膝沟藻赤潮6次, 黄海1次, 东海2次, 南海3次(梁玉波, 2012)。
3.6 红色赤潮藻红色赤潮藻(Akashiwo sanguinea)又称血红哈卡藻、红色裸甲藻, 属于Miozoa门, 甲藻纲(Dinophyceae), 裸甲藻目(Gymnodiniales), 裸甲藻科(Gymnodiniaceae), Akashiwo属。红色赤潮藻是一种广温广盐的裸甲藻, 藻体营单细胞游泳生活, 混合营养, 并能在不利条件下产生休眠孢囊, 能进行有性生殖。细胞内极高的脲酶活性暗示其在氮素吸收方面比其他浮游植物更具优势(Jeong et al, 2005a; Tang et al, 2015; 马方方等, 2018)。红色赤潮藻赤潮能导致贝类、鱼类和海鸟死亡, 对水生生态系统、渔业和旅游业都造成巨大影响(Jessup et al, 2009; Du et al, 2011), 但是其毒性尚无定论。1922年日本第一次报道了红色赤潮藻赤潮, 随后, 该藻在亚洲、欧洲、北美、南美以及澳大利亚都暴发了赤潮(Hallegraeff, 1992; Gómez et al, 2008; Yang et al, 2012; Koening et al, 2014; O’Boyle et al, 2014; White et al, 2014)。在中国, 关于红色赤潮藻赤潮的最早记录在1998年烟台的四十里湾海域, 此次赤潮导致170 hm2的扇贝绝产(吴玉霖等, 2001)。1998~2017年, 我国沿海共记录了31次红色赤潮藻赤潮, 其最常发生在春季(2、3、4月), 然后是夏季(8、9月), 持续时间大多在50天以内。此外, 调查发现, 红色赤潮藻赤潮在广东地区发生次数最多, 达到13次, 共持续167天(Chen et al, 2019a)。
3.7 链状裸甲藻链状裸甲藻(Gymnodinium catenatum)属于Miozoa门, 甲藻纲(Dinophyceae), 裸甲藻目(Gymnodiniales), 裸甲藻科(Gymnodiniaceae), 裸甲藻属(Gymnodinium)。有游泳单细胞和链状群体两种生活史状态, 能产生休眠孢囊。链状裸甲藻属于广温广盐种, 主要分布于西欧、西非、印度洋、东南亚、中国、日本、澳大利亚、新西兰、美国西海岸、哥伦比亚、巴西南部等, 我国在珠江口海域和东南沿海比较常见, 其孢囊在我国沿岸海域广泛分布(王朝晖, 2007a; 李光毅等, 2022)。链状裸甲藻是产生麻痹性贝毒(Paralytic shellfish poisoning, PSP)的主要生物之一, 严重危害水产养殖业和人类健康。1979年太平洋墨西哥沿岸暴发的赤潮首次将链状裸甲藻和PSP联系在一起, 随后该藻被证明与之前利比里亚沿海的PSP事件密切相关(Mee et al, 1986; Hallegraeff, 1993)。迄今为止, 我国已多次发生面积达400 km2的链状裸甲藻赤潮, 2017年, 福建漳州、泉州发生的链状裸甲藻赤潮导致了严重的PSP中毒事件, 造成了大量的经济损失(陈火荣, 2018)。
3.8 多环马格里夫藻多环马格里夫藻(Margalefidinium polykrikoides)曾叫多环旋沟藻(Cochlodinium polykrikoides), 属于Miozoa门, 甲藻纲(Dinophyceae), 裸甲藻目(Gymnodiniales), 裸甲藻科(Gymnodiniaceae), 马格里夫藻属(Margalefidinium)。该属5个物种曾归于旋沟藻属(Cochlodinium), 后基于形态特征及分子系统发育信息而独立出来形成新属(Gómez et al, 2017)。多环马格里夫藻分布广泛, 在世界各地的热带和暖温带水域都有记录(Richlen et al, 2010)。它生活史复杂, 能产生休眠孢囊, 具有鱼类毒素(Kudela et al, 2012; Tang et al, 2012b), 在我国胶州湾的分布具有明显的夏季偏好性(Liu et al, 2021)。1990年前, 东南亚和北美东海岸最早发生多环马格里夫藻赤潮(Tomas et al, 2008; Reñé et al, 2013), 此后, 逐渐扩散到中国东海、菲律宾、马来西亚、澳大利亚等地(Richlen et al, 2010; Kudela et al, 2012; López-Cortés et al, 2019)。多环马格里夫藻赤潮能导致野生和养殖鱼类大量死亡, 对当地渔业、旅游业和经济造成灾难性影响(Kudela et al, 2012; López-Cortés et al, 2019)。马格里夫藻在数据库中有可靠的18S rDNA、28S rDNA、ITS (Qiu et al, 2013)和COI (Park et al, 2018)序列信息, 并且根据核糖体大亚基基因(28S rDNA)序列的差异, 被分为4种不同核糖体型: 东亚型、菲律宾型、美国/马来西亚型和地中海型(Iwataki et al, 2008; Richlen et al, 2010)。
3.9 链状亚历山大藻链状亚历山大藻(Alexandrium catenella)属于Miozoa门, 甲藻纲(Dinophyceae), 膝沟藻目(Gonyaulacales), 梨甲藻科(Pyrocystaceae), 亚历山大藻属(Alexandrium)。该属有33个物种被Algaebase正式接受, 其中很多曾被归为其他属(Anderson et al, 2012)。中国沿海有13种亚历山大藻在分类学研究中被确认(Gu, 2011; Gu et al, 2013; Huang et al, 2021)。相比之下, 在生态考察研究中只发现了6种亚历山大藻(Zhu et al, 2009; 潘俊等, 2010; 李影等, 2017; Huang et al, 2018), 表明许多亚历山大藻的生态重要性还未知。亚历山大藻属中有约50%的物种被认为能产生PSP。链状亚历山大藻广泛分布于欧洲、北美、南非、智利、阿根廷及亚洲海域, 可产生PSP, 导致鱼类大量死亡(郭皓, 2004)。1993~2009年, 我国近岸海域发生了4次链状亚历山大藻赤潮, 2004年发生2次, 2005年和2007年各一次, 黄海2次, 东海2次。其中, 2006年发生在朱家尖东南海域(舟山外海域)的赤潮面积最大, 达到1 000 km2, 并发种为中肋骨条藻、东海原甲藻和米氏凯伦藻(梁玉波, 2012)。
3.10 太平洋亚历山大藻太平洋亚历山大藻(Alexandrium pacificum)属于Miozoa门, 甲藻纲(Dinophyceae), 膝沟藻目(Gonyaulacales), 梨甲藻科(Pyrocystaceae), 亚历山大藻属(Alexandrium), 属于塔玛亚历山大藻复合种(朱兴彪等, 2014)。早期基于形态特征, 塔玛亚历山大藻复合种被分为3种: A. tamarense、A. fundyense和A. catenella, 且每种各有许多株系能产生PSP。John等(2014)根据分子标记信息, 将塔玛亚历山大藻复合种分为5种: A. fundyense、A. mediterraneum、A. tamarense、A. australiense和A. pacificum(John et al, 2014)。在过去三十年间, 几乎全球范围都报道过太平洋亚历山大藻赤潮及相关的PSP中毒事件(Hallegraeff, 1993; Sellner et al, 2003; Anderson et al, 2012)。我国大部分海域皆有太平洋亚历山大藻, 其赤潮多发于较暖的海域, 如广东、香港沿海、东海舟山和长江口等(尹娟, 2011)。太平洋亚历山大藻即使在低密度时也能引起生物中毒, 并影响其生长繁殖。毒素还能通过食物链积累到人体, 危害生命健康。另外, 太平洋亚历山大藻能释放溶血毒素, 不仅危害海洋鱼类, 而且使自身在缺乏营养缺乏时具有竞争优势, 抑制其他藻类生长, 降低水体中藻类的多样性水平(刘洁生等, 2007)。
3.11 米氏凯伦藻米氏凯伦藻(Karenia mikimotoi)属于Miozoa门, 甲藻纲(Dinophyceae), 裸甲藻目(Gymnodiniales), 凯伦藻科(Kareniaceae), 凯伦藻属(Karenia)。米氏凯伦藻是世界性广布种, 藻体为单细胞, 营游泳生活, 主要消化吸收无机营养盐, 同时也可吸收有机营养盐和进行吞噬营养, 具备种群竞争优势(刘洁生等, 2007)。1998年, 香港海域首次暴发了米氏凯伦藻赤潮, 同年的4月15日, 广东珠江口万山群岛桂山岛网箱养殖区也暴发了米氏凯伦藻赤潮, 大约持续了30天, 造成了鱼类和贝类的大规模死亡。2003~2009年, 我国近岸海域每年均发生米氏凯伦藻赤潮, 共记录到87次, 除1998年发生了一次, 其余每年不少于5次, 累计发生面积超过36 300 km2。其中, 2005年累计发生频次和面积最大, 分别是23次和17 112 km2。2005年后, 米氏凯伦藻赤潮发生程度有所下降, 在2008年最低, 但2009年又有所上升。米氏凯伦藻赤潮的频发区在东海(占总发生次数的89.6%), 频发时间在3~8月, 6月最高, 5月次之。米氏凯伦藻赤潮是我国近海典型的鱼毒性赤潮, 产生的细胞毒素和溶血性毒素等不仅影响浮游动物的各项生命活动, 还会导致鱼类和海洋无脊椎动物的死亡(梁玉波, 2012; 吕颂辉等, 2019)。
3.12 东海原甲藻东海原甲藻(Prorocentrum donghaiense)属于Miozoa门, 甲藻纲(Dinophyceae), 原甲藻目(Prorocentrales), 原甲藻科(Prorocentraceae), 原甲藻属(Prorocentrum)。关于东海原甲藻的定种尚有争议, 一种观点认为它是独立的种(Lu et al, 2001; Guiry et al, 2022), 而另一方面, 学者通过光镜、电镜、分子标记鉴定等多种途径比较其与已有藻株, 认为东海原甲藻就是具齿原甲藻(P. dentatum)(吕颂辉等, 2003; 罗立明等, 2006)。东海原甲藻是大洋性或近岸浮游性种, 主要生活在海水表层和次表层, 在世界水域广布, 我国主要分布在广东的大亚湾、大鹏湾以及香港水域(郭皓, 2004)。东海原甲藻主营单细胞生活, 有时形成短链, 鞭毛使其具有较强的运动能力, 呈现明显的昼夜垂直移动现象, 并在获得光能和营养盐方面更具优势(Lu et al, 2001; 陆斗定等, 2003)。2000~2009年, 我国沿海共发生东海原甲藻赤潮155次, 累计面积约67 600 km2, 均发生在东海, 发生月份为4~6月份, 其中5月109次, 6月36次, 4月10次。其中, 单相赤潮77次, 多相78次, 东海原甲藻为第一优势物种出现133次, 累计面积46 914 km2 (梁玉波, 2012)。研究发现东海原甲藻虽不具急性毒性, 但其赤潮会对中华哲水蚤(Calanus sinicus)的产卵率产生显著的抑制效应, 影响其种群丰度, 进而危及渔业资源(陆斗定等, 2003; 于仁成等, 2017)。除了养殖业和捕捞业, 东海原甲藻赤潮对海域生态系统也有较大影响(陆斗定等, 2003; Li et al, 2010)。
3.13 锥状斯氏藻锥状斯氏藻(Scrippsiella acuminata)又译为锥状斯克里普藻, 属于Miozoa门, 甲藻纲(Dinophyceae), Thoracosphaerales目, Thoracosphaeraceae科, Scrippsiella属。锥状斯氏藻在世界范围的近岸海域均有分布, 在我国四大海域广泛分布, 其孢囊在近海沉积物中最为常见且丰度较高(肖咏之等, 2001; 王朝晖, 2007b)。锥状斯氏藻虽不产毒素, 但是其种群的大量增殖和聚集会通过黏附、堵塞或寄生在海洋生物的鳃部、消耗海水中大量的营养物质、遮盖海面影响光照的摄入、降低食物供给和海水中溶解氧的含量、同其他海洋生物争夺营养成分、氧气、生存空间等方式威胁海洋环境和生态安全(Tang et al, 2012a; 杨傲傲, 2017)。锥状斯氏藻引发的赤潮屡见不鲜, 例如, 在墨西哥的加利福尼亚湾, 养殖虾会因锥状斯氏藻赤潮而死亡(Gárate-Lizárraga et al, 2004); 在日本东北部的女川湾, 锥状斯氏藻引发的赤潮对当地经济产生了重要影响(Ishikawa et al, 1996)。锥状斯氏藻虽无毒, 但实验室研究发现其对牡蛎(Crassostrea virginica)和帘蛤(Mercenaria mercenaria)幼体有致死作用(Tang et al, 2012a)。我国在1998年首次发生锥状斯氏藻赤潮, 之后其发生频次和面积总体呈上升趋势, 至2009年, 共有30次记录, 累计面积超过5 466 km2 (梁玉波, 2012)。其中, 大亚湾和大鹏湾海域是锥状斯氏藻赤潮的重灾区(王朝晖, 2007b; 常虹等, 2014; 窦勇等, 2015), 近海养殖业和生态系统受到严重危害, 如2000年8~9月, 大亚湾的锥状斯氏藻赤潮导致大量养殖鱼死亡, 经济损失达700, 000元(肖咏之等, 2001, 2003)。
3.14 尖刺伪菱形藻尖刺伪菱形藻(Pseudo-nitzschia pungens)属于硅藻门(Bacillariophyta), 硅藻纲(Bacillariophyceae), 硅藻目(Bacillariales), 硅藻科(Bacillariaceae), 伪菱形藻属(Pseudo-nitzschia)(Lelong et al, 2012)。我国在1965年首次有近岸海域尖刺伪菱形藻的形态描述(李扬等, 2010), 后借助内转录间隔区(internal transcribed spacers, ITS)序列和系统进化分析, 将尖刺伪菱形藻从一个物种细分为三个变种: 尖刺伪菱形藻原变种(P. pungens var. pungens)、尖刺伪菱形藻环带变种(P. pungens var. cingulata)和尖刺伪菱形藻阿维罗变种(P. pungens var. aveirensis)(Casteleyn et al, 2008; Kim et al, 2015)。尖刺伪菱形藻是典型的贫氮贫磷、高温低盐性种类, 广泛分布于世界海域, 是我国常见的赤潮物种, 在近海均有报道(何瑞等, 2018)。尖刺伪菱形藻能产生软骨藻酸(Domoic acid)(失忆性贝毒), 毒素会在贝类中富集, 到达人体后会让人产生头晕、呕吐和健忘等症状, 严重时可致死(吕颂辉等, 2003)。我国各大海域均发生过尖刺伪菱形藻赤潮(吕颂辉等, 1992; Zou et al, 1993; Qi et al, 1994), 1933~2009年共记录到7次, 1次发生在黄海, 其余6次均发生在东海, 主要在5~9月。其中, 2008年宁波油菜屿以东海域发生的东海原甲藻和尖刺伪菱形藻双相赤潮, 最大面积达500 km2(梁玉波, 2012)。
3.15 旋链角毛藻旋链角毛藻(Chaetoceros curvisetus)属于硅藻门(Bacillariophyta), 中型硅藻纲(Mediophyceae), 角毛藻目(Chaetocerotales), 角毛藻科(Chaetocerotaceae), 角毛藻属(Chaetoceros)。旋链角毛藻是广温性沿岸种类, 暖季分布较广, 在我国东海、黄海、渤海均有分布(郭皓, 2004)。2004~2008年, 中国海域发生23次旋链角毛藻赤潮, 其中单相7次, 多相16次。旋链角毛藻作为第一优势种12次, 累计面积约3 146 km2。5~8月均有该赤潮发生, 6~7月为高发期, 占总发生频次的82%, 主要发生在东海厦门海域(梁玉波, 2012)。
3.16 浮动弯角藻浮动弯角藻(Eucampia zodiacus)又称短角弯角藻, 属于硅藻门(Bacillariophyta), 中型硅藻纲(Mediophyceae), 半管藻目(Hemiaulales), 半管藻科(Hemiaulaceae), 弯角藻属(Eucampia)。浮动弯角藻是世界广布广温种, 几乎全年都能在水体中被检测到(Horner, 2002; Ito et al, 2013; Nishikawa et al, 2013)。由于它能够在低营养、低温情况下同样消耗氮元素, 实现生长, 所以竞争力强, 可通过大规模繁殖造成藻华(Nishikawa et al, 2009; Ito et al, 2013)。在日本的东京湾(Nishikawa et al, 2011)、播磨滩(Nishikawa et al, 2007)、有明海(Yamaguchi et al, 2012), 加拿大的芬迪湾(Martin et al, 2007), 中国的胶州湾(霍文毅等, 2001; 张永山等, 2002)、海州湾和象山港(梁玉波, 2012)都记录到过浮动弯角藻藻华, 并证实其导致了养殖紫菜白化, 带来了巨大的经济损失(Nishikawa et al, 2009; Ito et al, 2013)。浮动弯角藻的通用分子标记均有可靠序列发表, 如18S rDNA(Sorhannus, 2007)、28S rDNA(Hamsher et al, 2013)、ITS、rbcL和CO1 (Guo et al, 2015)。除此之外, 浮动弯角藻的细胞器基因组也得到构建, 用于区分种内遗传多样性的高分辨率分子标记也得到构建(Zhang et al, 2021a, 2021b)。
3.17 中肋骨条藻中肋骨条藻(Skeletonema costatum)属于硅藻门(Bacillariophyta), 中型硅藻纲(Mediophyceae), 海链藻目(Thalassiosirales), 骨条藻科(Skeletonemataceae), 骨条藻属(Skeletonema)。该属物种早期未得到准确区分, 直到2005年Sarno等(2005)发现, 一直被鉴定为中肋骨条藻的种类实际上包括了8种骨条藻。我国学者也随之重新对中国海域的骨条藻进行了详细的鉴定和区分, 发现了5种骨条藻(Cheng et al, 2008)。另外, 本实验室通过兼用宏条形码方法和单株系分子方法分析胶州湾冬季的优势物种, 发现一直被报道的优势物种中肋骨条藻实际上是玛氏骨条藻(Liu et al, 2020)。中肋骨条藻是典型的广温广盐性种类, 在全球近岸海域广泛分布, 在中国海域均有报道(杨世民等, 2006)。中肋骨条藻是中国沿海主要的赤潮物种之一, 1933年首次在我国海域暴发赤潮, 1998~2009年每年都有中肋骨条藻赤潮发生, 截至2009年, 共统计到142次, 累积面积超过26 350 km2。在2005~2007年间, 中肋骨条藻赤潮达到暴发的最高峰, 之后呈下降趋势, 但是每年仍有发生(杨世民等, 2006)。中肋骨条藻虽不产毒, 但是增殖速度很快, 形成高生物量, 一方面消耗水体溶解氧, 引起海水变色并产生反应性醛, 严重威胁海洋生物, 破坏生态系统稳定性; 另一方面与养殖海带、紫菜等争夺营养, 给水产养殖业带来巨大经济损失(Ou et al, 2008)。另外, 中肋骨条藻可在细胞体内合成二甲基巯基丙酸内盐(Dimethylsulphoniopropionate, DMSP), 其转化成的二甲基硫(Dimethyl sulfide, DMS)从海洋排向大气, 能降低使雨水的pH值, 是酸雨的重要贡献者, 与气候变化问题密切相关(李涛等, 2010)。不过, 其他种类的骨条藻(比如玛氏骨条藻)也常被错误地鉴定为中肋骨条藻(Liu et al, 2020)。
3.18 抑食金球藻抑食金球藻(Aureococcus anophagefferens)属于棕鞭藻门(Ochrophyta), 海金藻纲(Pelagophyceae), 海胞藻目(Pelagomonadales), 海胞藻科(Pelagomonadaceae), 金球藻属(Aureococcus)。抑食金球藻是一种微微型单细胞藻类, 无鞭毛, 无细胞壁(Sieburth et al, 1988)。抑食金球藻在全球海域呈离散型分布, 并具有明显的地理扩散趋势, 但在中国海域的地理分布以及来源尚无定论。前人猜测抑食金球藻可能通过压舱水传入我国海域(Trice et al, 2004; Zhang et al, 2012), 而Tang等(2019)通过对沉积物样本进行18S rDNA V9区扩增测序, 证明抑食金球藻在我国海域是长期存在的(Tang et al, 2019)。抑食金球藻最早在1985年夏季, 在美国的纳拉甘塞特湾和罗德岛海域引发褐潮, 海水呈现大面积的褐色(Cosper et al, 1987)。之后到1995年, 几乎每年长岛湾都有抑食金球藻褐潮发生。2000年后, 褐潮从美国东海岸向南海岸扩张, 在新泽西州(Gastrich et al, 2004)、特拉华州(Golijow et al, 2003)、马里兰州和弗吉尼亚州的海湾陆续暴发(Glibert et al, 2007)。1997年, 南非萨尔达尼亚湾也暴发了抑食金球藻褐潮(Probyn et al, 2010), 且一直到2005年, 该海域均有褐潮记录。中国是继美国、南非后第三个发生抑食金球藻褐潮的国家, 首次是2009年5月发生在秦皇岛沿岸海域, 持续了40天左右, 海水呈现褐色, 大量贝类死亡(Zhang et al, 2012)。之后, 褐潮在渤海海域频发, 比如, 2010年, 秦皇岛昌黎褐潮造成约2.05亿元的直接经济损失; 同年7月下旬, 北戴河沿岸海域的褐潮持续约19天, 影响3 350 km2的海域, 造成近500万元的经济损失; 2012年6~8月, 河北省唐山市至辽宁省绥中近岸海域发生的约为3 400 km2的超大面积褐潮, 直接影响了当地2/3的海水养殖区(约26 000 hm2), 造成了巨大经济损失(Zhang et al, 2012; 贺凡, 2019)。研究显示, 抑食金球藻既有有毒株(CCMP 1708), 也有无毒株(CCMP 1784)(Bricelj et al, 2001), 其溶血毒素可能为2种糖脂类化合物, 未发现对人类身体健康有明显影响(谢磊等, 2018; 贺凡, 2019)。
3.19 赤潮异弯藻赤潮异弯藻(Heterosigma akashiwo)属于棕鞭藻门(Ochrophyta), 针胞藻纲(Raphidophyceae), 卡盾藻目(Chattonellales), 卡盾藻科(Chattonellaceae), 异弯藻属(Heterosigma)。赤潮异弯藻细胞较小, 因富含岩藻黄素和紫黄质而在显微镜下呈金褐色(Eberlein et al, 2016)。赤潮异弯藻广泛分布于世界近海和河口海域, 在许多地方暴发过赤潮, 包括我国的黄海和东海海域(Kok et al, 2015; 姬南京等, 2021)。赤潮异弯藻可产生鱼毒素, 在暴发赤潮时会造成鱼类的大量死亡, 造成生态和经济损失, 例如, 1997年在加拿大英属哥伦比亚地区, 赤潮异弯藻赤潮导致该地4个月内损失了2 000万美元(Allaf et al, 2019)。在美国华盛顿州, 每一次暴发异弯藻赤潮大概要损失200~600万美元(姬南京等, 2021; 杨安强, 2021)。此外, 藻类毒素还可以通过食物链富集和累积作用威胁人类健康。赤潮异弯藻对渔业和生态安全存在重大的威胁。当环境变化不适宜其生长和繁殖时, 赤潮异弯藻会产生休眠孢子, 待到环境适宜其生长时, 休眠孢子会快速萌发增殖并可能会形成赤潮(杨安强, 2021)。在中国, 1985~2009年间, 沿岸海域发生了26次异弯藻赤潮, 累计面积达5 049 km2。其中, 2009年5~6月, 渤海湾附近海域发生的一次大规模异弯藻赤潮, 面积达到4 460 km2。从时间上看, 2~8月均有异弯藻赤潮发生, 6~7月频次最高, 5月次之(梁玉波, 2012)。
3.20 球形棕囊藻球形棕囊藻(Phaeocystis globosa)属于定鞭藻门(Haptophyta), 颗石藻纲(Coccolithophyceae), 棕囊藻目(Phaeocystales), 棕囊藻科(Phaeocystaceae), 棕囊藻属(Phaeocystis)。球形棕囊藻生活史复杂, 能进行有性生殖, 兼有单细胞和胶质囊体两种可以相互转换的形态。球形棕囊藻是一种全球广布性种, 经常在南北极、大西洋温带沿海及港湾、北部湾沿岸等地引发赤潮, 发生记录随着全球气候异常和水域富营养化的加剧而不断扩展, 频率逐年增加、危害日趋严重(黄长江等, 1999; 沈萍萍等, 2018)。中国沿海球形棕囊藻赤潮具有暴发规模大、持续时间长、发生频率高且危害大的显著特点。中国首次大规模球形棕囊藻赤潮发生在1997年10月至1998年2月, 面积逾3 000 km2, 覆盖了从福建泉州厦门以南至广东汕尾海域。其后在多省市沿海陆续暴发(沈萍萍等, 2018)。据不完全统计, 在1997~2017年间, 南海北部共发生球形棕囊藻赤潮50余起, 面积超过10 000 km2, 对生态环境、水产养殖以及旅游观光都造成了巨大的影响(陈菊芳等, 1999; 沈萍萍等, 2018)。另外, 球形棕囊藻还于2021年冬季(11~12月)在青岛西海岸首次暴发大规模赤潮(Li et al, 2022; Song et al, 2022)。球形棕囊藻具有溶血毒素, 比如1992年挪威暴发的棕囊藻赤潮对鳕鱼幼体产生了毒害效应(郭皓, 2004; 何瑞等, 2018)。据研究, 球形棕囊藻的胶质囊一方面能向外释放可溶性有机碳, 在水面形成泡沫, 导致海洋生物窒息而亡; 另一方面内部有机物衰败, 遗留下来大量营养盐, 改变生态系统原有的能流和物流, 长时间影响生物群落。另外, 球形棕囊藻死亡后能产生大量DMS, 降低使雨水的pH值, 是酸雨的重要影响因素之一(黄长江等, 1999; 沈萍萍等, 2018)。球形棕囊藻还可以形成较大的具有黏性的囊体, 从而堵塞核电冷源系统(Yu et al, 2017)。
4 结论与展望本文通过系统整理全球赤潮物种、梳理并比较我国各海域历史上据形态鉴定到的赤潮物种, 以及比较基于形态学和宏条形码方法的航次分析结果, 主要得到以下结论:
(1) 全球范围内共统计到341个赤潮物种, 它们有的有毒, 有的无毒, 或直接或间接地造成生态灾害。这341种覆盖了9个门, 多样性水平较高, 其中, Miozoa门物种最多, 占总数的一半以上(52.8%), 硅藻门(Bacillariophyta)次之, 占35.2%。在属水平, 111个属中, 有63个属(占56.8%)仅包含1个赤潮物种, 但也有的属内集中出现多种赤潮物种, 如伪菱形藻属(Pseudo-nitzschia) 29种, 角毛藻属(Chaetoceros) 23种, 原甲藻属(Prorocentrum) 22种, 亚历山大藻属(Alexandrium) 18种, 以及原多甲藻属(Protoperidinium) 17种等。
(2) 我国历史上通过对各海域生态调查类航次(表 4)样本进行形态学鉴定, 共记录到名录中的215个赤潮物种(约63.0%), 涉及7个门。这些赤潮物种都存在于中国海域但并非都在本地引发过赤潮。其中, 引发过赤潮的物种中也有很多是随着环境变化, 不断涌现出来, 后被关注的。真正引发赤潮的赤潮物种的多样性在不断增加, 甚至目前可能还并不全面, 这215个物种都有造成赤潮的风险。海域间赤潮物种多样性的比较分析发现, 黄海在历史上的调查数目和记录到的赤潮物种数都最多, 东海次之, 渤海、南海、胶州湾和长江口数目相近。另外, 所有海域普遍存在的有76个赤潮物种, 部分赤潮物种的分布存在明显的海域偏好性。
(3) 对比基于形态学方法和基于宏条形码方法的航次分析发现, 两者分析结果重叠度高, 都有较高的可信度, 而宏条形码分析方法更高效、更灵敏, 有望成为下一代航次分析的主流方法, 弥补传统形态学分析的弊端。但同时, 统计发现可用于宏条形码分析的分子标记数据库很不完善, 国内外赤潮物种还需要得到更全面的分子分析。目前, 宏条形码分析方法目前还面临两方面挑战, 一是分子标及数据库的完整性, 一是高分辨率分子标记(即条形码)的选择和PCR扩增引物的设计(陈楠生, 2020)。
因此, 在今后的生态调查研究中, 一方面需要开展时空覆盖度更高的航次调查, 进行标准化的采样, 将形态学鉴定和宏条形码方法结合起来开展样本分析, 探究中国海域赤潮物种的多样性; 另一方面需要对赤潮物种进行更全面的分子解析, 完善分子标记数据库, 开发有针对性的分子标记, 从而促进宏条形码研究的标准化, 帮助后续解读宏条形码分析结果, 解析我国海域赤潮物种的多样性及时空动态特征。
电子附件材料:
马方方, 郭翔宇, 徐丽君, 等, 2018. 深圳海域红色赤潮藻赤潮在线监测数据变化及其成因分析. 海洋技术学报, 37(04): 54-61 |
于仁成, 吕颂辉, 齐雨藻, 等, 2020. 中国近海有害藻华研究现状与展望. 海洋与湖沼, 51(4): 768-788 |
于仁成, 张清春, 孔凡洲, 等, 2017. 长江口及其邻近海域有害藻华的发生情况、危害效应与演变趋势. 海洋与湖沼, 48(6): 1178-1186 |
王宗灵, 傅明珠, 周健, 等, 2020. 黄海浒苔绿潮防灾减灾现状与早期防控展望. 海洋学报, 42(8): 1-11 |
王朝晖, 2007a. 中国沿海甲藻孢囊与赤潮研究. 北京: 海洋出版社
|
王朝晖, 2007b. 中国典型近海海域甲藻孢囊分布及其与富营养化和赤潮生消关系研究[D]. 广州: 暨南大学.
|
尹娟, 2011. 中国沿海塔玛亚历山大藻遗传多样性分析[D]. 广州: 暨南大学.
|
吕颂辉, 齐雨藻, 1992. 南海大鹏湾的主要赤潮生物. 暨南大学学报(自然科学与医学版), 13(3): 130-133 |
吕颂辉, 岑竞仪, 王建艳, 等, 2019. 我国近海米氏凯伦藻(Karenia Mikimotoi)藻华发生概况、危害及其生态学机制. 海洋与湖沼, 50(3): 487-494 |
吕颂辉, 张玉宇, 陈菊芳, 2003. 东海具齿原甲藻的扫描电子显微结构. 应用生态学报, 14(7): 1070-1072 |
朱兴彪, 郑玉忠, 谢丽玲, 等, 2014. 有害赤潮藻种塔玛亚历山大藻的研究进展. 生物技术进展, 4(6): 421-428 |
刘洁生, 谢瑾, 杨维东, 2007. 塔玛亚历山大藻溶血毒素对东海原甲藻的化感作用. 暨南大学学报(自然科学与医学版), 28(1): 105-107 |
刘峰, 逄少军, 2012. 黄海浒苔绿潮及其溯源研究进展. 海洋科学进展, 30(3): 441-449 |
刘淑雅, 陈楠生, 2021. 胶州湾海域浮游植物和赤潮物种的生物多样性研究进展. 海洋科学, 45(4): 170-188 |
李扬, 马艳艳, 吕颂辉, 2010. 大亚湾美洲拟菱形藻复合群的形态学观察. 水生生物学报, 34(4): 851-855 |
李光毅, 刘保清, 邱勇, 等, 2022. 链状裸甲藻赤潮消亡过程及其与休眠包囊关系的初步研究. 海洋学报(中文版), 44(8): 123-132 |
李涛, 刘胜, 王桂芬, 等, 2010. 2004年秋季南海北部浮游植物组成及其数量分布特征. 热带海洋学报, 29(2): 65-73 |
李影, 汤亚楠, 沈萍萍, 等, 2017. 胶州湾表层沉积物中甲藻孢囊的分布. 海洋与湖沼, 48(4): 760-766 |
杨世民, 董树刚, 2006. 中国海域常见浮游硅藻图谱. 青岛: 中国海洋大学出版社
|
杨安强, 2021. 多重环境因子变化对赤潮异弯藻生长的影响[D]. 上海: 华东师范大学.
|
杨傲傲, 2017. 锥状斯氏藻休眠孢囊差异表达基因的筛选及能量代谢相关基因在不同休眠条件下的表达研究[D]. 青岛: 中国科学院大学(中国科学院海洋研究所).
|
肖咏之, 王朝晖, 陈菊芳, 等, 2003. 广东大亚湾甲藻孢囊及其与锥状斯氏藻赤潮的关系. 水生生物学报, 27(4): 372-377 |
肖咏之, 齐雨藻, 王朝晖, 等, 2001. 大亚湾海域锥状斯氏藻赤潮及其与孢囊的关系. 海洋科学, 25(9): 50-54 |
吴玉霖, 周成旭, 张永山, 等, 2001. 烟台四十里湾海域红色裸甲藻赤潮发展过程及其成因. 海洋与湖沼, 32(2): 159-167 |
吴瑞贞, 林端, 马毅, 2007. 南海夜光藻赤潮概况及其对水文气象的适应条件. 台湾海峡, 26(4): 590-595 |
何瑞, 蒋然, 朱小平, 等, 2018. 台山附近海域浮游植物的季节变化及其与环境因子的关系. 生态学杂志, 37(9): 2727-2736 |
沈萍萍, 齐雨藻, 欧林坚, 2018. 中国沿海球形棕囊藻(Phaeocystis Globosa)的分类、分布及其藻华. 海洋科学, 42(10): 146-162 |
张永山, 吴玉霖, 邹景忠, 等, 2002. 胶州湾浮动弯角藻赤潮生消过程. 海洋与湖沼, 33(1): 55-61 |
陆斗定, 齐雨藻, Goebel J, 等, 2003. 东海原甲藻修订及与相关原甲藻的分类学比较. 应用生态学报, 14(7): 1060-1064 |
陈火荣, 2018. 2017年福建海域链状裸甲藻赤潮事件应急处置与思考. 渔业研究, 40(4): 308-314 |
陈菊芳, 徐宁, 江天久, 等, 1999. 中国赤潮新记录种──球形棕囊藻(Phaeocystis Globosa). 暨南大学学报(自然科学与医学版), 20(3): 124-129 |
陈楠生, 2020. 有害藻华的宏条形码分析: 机会与挑战. 海洋科学, 44(7): 116-134 |
陈楠生, 丁翔翔, 崔宗梅, 2023. 山东近海赤潮物种多样性研究进展. 海洋与湖沼(审稿中).
|
陈楠生, 张梦佳, 2021a. 中国海洋浮游植物和赤潮物种的生物多样性研究进展(三): 南海. 海洋与湖沼, 52(2): 385-401 |
陈楠生, 陈阳, 2021b. 中国海洋浮游植物和赤潮物种的生物多样性研究进展(二): 东海. 海洋与湖沼, 52(2): 363-384 |
陈楠生, 黄海龙, 2021c. 中国海洋浮游植物和赤潮物种的生物多样性研究进展(一): 渤海. 海洋与湖沼, 52(2): 346-362 |
陈楠生, 崔宗梅, 徐青, 2021d. 中国海洋浮游植物和赤潮物种的生物多样性研究进展(四): 长江口. 海洋与湖沼, 52(2): 402-417 |
罗立明, 胡鸿钧, 李夜光, 等, 2006. 东海原甲藻的分子鉴定. 海洋学报, 28(1): 127-131 |
俞志明, 陈楠生, 2019. 国内外赤潮的发展趋势与研究热点. 海洋与湖沼, 50(3): 474-486 |
姚艳欣, 陈楠生, 2021. 珠江口及其邻近海域赤潮物种的生物多样性研究进展. 海洋科学, 45(9): 75-90 |
贺凡, 2019. 环境和营养因子对抑食金球藻(Aureococcus Anophagefferens)生长及溶血活性的影响[D]. 广州: 暨南大学.
|
高寒, 2015. 渐尖鳍藻(Dinophysis Acuminata)生长和产毒特征研究[D]. 保定: 河北农业大学.
|
郭皓, 2004. 中国近海赤潮生物图谱. 北京: 海洋出版社
|
姬南京, 张珍珍, 黄金旺, 等, 2021. 有害赤潮藻赤潮异弯藻Heterosigma Akashiwo研究进展. 海洋科学, 45(2): 127-136 |
黄长江, 董巧香, 郑磊, 1999. 1997年底中国东南沿海大规模赤潮原因生物的形态分类与生态学特征. 海洋与湖沼, 30(6): 581-590 |
常虹, 王博, 姚蜜蜜, 等, 2014. 深圳大鹏湾海域锥状斯氏藻赤潮期间细菌群落结构变化研究. 现代生物医学进展, 14(10): 1801-1807 |
梁玉波, 2012. 中国赤潮灾害调查与评价(1933-2009). 北京: 海洋出版社
|
谢磊, 徐晓娇, 江天久, 2018. 抑食金球藻对翡翠贻贝抗氧化酶系统的影响. 水产学报, 42(6): 846-853 |
窦勇, 高金伟, 时晓婷, 等, 2015. 2000-2013年中国南部近海赤潮发生规律及影响因素研究. 水生态学杂志, 36(3): 31-37 |
潘俊, 李瑞香, 李艳, 等, 2010. 秋季南黄海表层沉积物中甲藻孢囊分布. 海洋科学进展, 28(1): 41-49 |
霍文毅, 俞志明, 邹景忠, 等, 2001. 胶州湾浮动弯角藻赤潮生消动态过程及其成因分析. 水产学报, 25(3): 222-226 |
ALLAF M M, TRICK C G, 2019. Multiple-stressor design-of- experiment (DOE) and one-factor-at-a-time (OFAT) observations defining Heterosigma akashiwo growth and cell permeability. Journal of Applied Phycology, 31(6): 3515-3526 DOI:10.1007/s10811-019-01833-6 |
ANDERSON D M, ALPERMANN T J, CEMBELLA A D, et al, 2012. The globally distributed genus Alexandrium: multifaceted roles in marine ecosystems and impacts on human health. Harmful Algae, 14: 10-35 |
BERDALET E, KUDELA R, URBAN E, et al, 2017. GlobalHAB: a new program to promote international research, observations, and modeling of harmful algal blooms in aquatic systems. Oceanography, 30(1): 70-81 |
BRICELJ V, MACQUARRIE S, SCHAFFNER R, 2001. Differential effects of Aureococcus anophagefferens isolates ("brown tide") in unialgal and mixed suspensions on bivalve feeding. Marine Biology, 139(4): 605-616 |
BURKHOLDER J M, GLIBERT P M, SKELTON H M, 2008. Mixotrophy, a major mode of nutrition for harmful algal species in eutrophic waters. Harmful Algae, 8(1): 77-93 |
CASTELEYN G, CHEPURNOV V A, LELIAERT F, et al, 2008. Pseudo-nitzschia pungens (Bacillariophyceae): a cosmopolitan diatom species?. Harmful Algae, 7(2): 241-257 |
CHEN B H, KANG W, HUI L, 2019a. Akashiwo sanguinea blooms in Chinese waters in 1998-2017. Marine Pollution Bulletin, 149: 110652 |
CHEN Y, XU Q, GIBSON K, et al, 2021. Metabarcoding dissection of harmful algal bloom species in the East China Sea off Southern Zhejiang Province in late spring. Marine Pollution Bulletin, 169: 112586 |
CHEN B, YU K F, LIANG J Y, et al, 2019b. Latitudinal variation in the molecular diversity and community composition of symbiodiniaceae in coral from the South China Sea. Frontiers in Microbiology, 10: 1278 |
CHEN Z F, ZHANG Q C, KONG F Z, et al, 2019c. Resolving phytoplankton taxa based on high-throughput sequencing during brown tides in the Bohai Sea, China. Harmful Algae, 84: 127-138 |
CHENG J F, LI Y, LIANG J R, et al, 2008. Morphological variability and genetic diversity in five species of Skeletonema (Bacillariophyta). Progress in Natural Science, 18(11): 1345-1355 |
COSPER E M, DENNISON W C, CARPENTER E J, 1987. Recurrent and persistent brown tide blooms perturb coastal marine ecosystem. Estuaries, 10(4): 284-290 |
CUI Z M, XU Q, GIBSON K, et al, 2021. Metabarcoding analysis of harmful algal bloom species in the Changjiang Estuary, China. Science of the Total Environment, 782: 146823 |
DU X N, PETERSON W, MCCULLOCH A, et al, 2011. An unusual bloom of the dinoflagellate Akashiwo sanguinea off the central Oregon, USA, coast in autumn 2009. Harmful Algae, 10(6): 784-793 |
EBERLEIN T, VAN DE WAAL D B, BRANDENBURG K M, et al, 2016. Interactive effects of ocean acidification and nitrogen limitation on two bloom-forming dinoflagellate species. Marine Ecology Progress Series, 543: 127-140 |
GÁRATE-LIZÁRRAGA I, BUSTILLOS-GUZMÁN J J, ALONSO-RODRÍGUEZ R, et al, 2004. Comparative paralytic shellfish toxin profiles in two marine bivalves during outbreaks of Gymnodinium catenatum (Dinophyceae) in the Gulf of California. Marine Pollution Bulletin, 48(3/4): 397-402 |
GASTRICH M D, LATHROP R, HAAG S, et al, 2004. Assessment of brown tide blooms, caused by Aureococcus anophagefferens, and contributing factors in New Jersey coastal bays: 2000-2002. Harmful Algae, 3(4): 305-320 |
GLIBERT P M, WAZNIAK W E, HALL M R, 2007. Seasonal and interannual trends in nitrogen and brown tide in maryland's coastal bays. Ecological Applications, 17(sp5): S79-S87 |
GOLIJOW C D, ABBA M C, COLLURA J, et al, 2003. Use of the polymerase chain reaction for the detection and genotyping of Helicobacter pylori in paraffin-embedded gastric biopsy: a retrospective study. Acta gastroenterologica Latinoamericana, 33(4): 193-198 |
GÓMEZ F, RICHLEN M L, ANDERSON D M, 2017. Molecular characterization and morphology of Cochlodinium strangulatum, the type species of Cochlodinium, and Margalefidinium gen. nov. for C. polykrikoides and allied species (Gymnodiniales, Dinophyceae). Harmful Algae, 63: 32-44 |
GÓMEZ F, SOUISSI S, 2008. The impact of the 2003 summer heat wave and the 2005 late cold wave on the phytoplankton in the north-eastern English Channel. Comptes Rendus Biologies, 331(9): 678-685 |
GU H F, 2011. Morphology, phylogenetic position, and ecophysiology of Alexandrium ostenfeldii (Dinophyceae) from the Bohai Sea, China. Journal of Systematics and Evolution, 49(6): 606-616 |
GU H F, WU Y R, LÜ S H, et al, 2022. Emerging harmful algal bloom species over the last four decades in China. Harmful Algae, 111: 102059 |
GU H F, ZENG N, LIU T T, et al, 2013. Morphology, toxicity, and phylogeny of Alexandrium (Dinophyceae) species along the coast of China. Harmful Algae, 27: 68-81 |
GUIRY M D, GUIRY G M, 2022. AlgaeBase [EB/OL]. World-wide electronic publication, National University of Ireland, Galway. [2022-09-17]. https://www.algaebase.org.
|
GUO L L, SUI Z H, ZHANG S, et al, 2015. Comparison of potential diatom 'barcode' genes (the 18S rRNA gene and ITS, COI, rbcL) and their effectiveness in discriminating and determining species taxonomy in the Bacillariophyta. International Journal of Systematic and Evolutionary Microbiology, 65(Pt 4): 1369-1380 |
HALLEGRAEFF G M, 1992. Harmful algal blooms in the Australian region. Marine Pollution Bulletin, 25(5/6/7/8): 186-190 |
HALLEGRAEFF G M, 1993. A review of harmful algal blooms and their apparent global increase. Phycologia, 32(2): 79-99 |
HAMSHER S E, LEGRESLEY M M, MARTIN J L, et al, 2013. A comparison of morphological and molecular-based surveys to estimate the species richness of Chaetoceros and Thalassiosira (bacillariophyta), in the Bay of Fundy. PLoS One, 8(10): e73521 |
HANSEN P J, NIELSEN L T, JOHNSON M, et al, 2013. Acquired phototrophy in Mesodinium and Dinophysis - a review of cellular organization, prey selectivity, nutrient uptake and bioenergetics. Harmful Algae, 28: 126-139 |
HORNER R A, 2002. A Taxonomic Guide to Some Common Marine Phytoplankton. Bristol: Biopress, 195
|
HUANG H L, XU Q, GIBSON K, et al, 2021. Molecular characterization of harmful algal blooms in the Bohai Sea using metabarcoding analysis. Harmful Algae, 106: 102066 |
ISHIKAWA A, TANIGUCHI A, 1996. Contribution of benthic cysts to the population dynamics of Scrippsiella spp. (Dinophyceae) in Onagawa bay, northeast Japan. Marine Ecology Progress Series, 140(1/2/3): 169-178 |
ITO Y, KATANO T, FUJII N, et al, 2013. Decreases in turbidity during neap tides initiate late winter blooms of Eucampia zodiacus in a macrotidal embayment. Journal of Oceanography, 69(4): 467-479 |
IWATAKI M, KAWAMI H, MIZUSHIMA K, et al, 2008. Phylogenetic relationships in the harmful dinoflagellate Cochlodinium polykrikoides (Gymnodiniales, Dinophyceae) inferred from LSU rDNA sequences. Harmful Algae, 7(3): 271-277 |
JEONG H J, DU YOO Y, PARK J Y, et al, 2005a. Feeding by phototrophic red-tide dinoflagellates: five species newly revealed and six species previously known to be mixotrophic. Aquatic Microbial Ecology, 40(2): 133-150 |
JEONG H J, DU YOO Y, SEONG K A, et al, 2005b. Feeding by the mixotrophic red-tide dinoflagellate Gonyaulax polygramma: mechanisms, prey species, effects of prey concentration, and grazing impact. Aquatic Microbial Ecology, 38(3): 249-257 |
JEONG H J, KANG H C, LIM A S, et al, 2021. Feeding diverse prey as an excellent strategy of mixotrophic dinoflagellates for global dominance. Science Advances, 7(2): eabe4214 |
JESSUP D A, MILLER M A, RYAN J P, et al, 2009. Mass stranding of marine birds caused by a surfactant-producing red tide. PLoS One, 4(2): e4550 |
JOHN U, LITAKER R W, MONTRESOR M, et al, 2014. Formal revision of the Alexandrium tamarense species complex (Dinophyceae) taxonomy: the introduction of five species with emphasis on molecular-based (rDNA) classification. Protist, 165(6): 779-804 |
KIM J H, PARK B S, KIM J H, et al, 2015. Intraspecific diversity and distribution of the cosmopolitan species Pseudo-nitzschia pungens (Bacillariophyceae): morphology, genetics, and ecophysiology of the three clades. Journal of Phycology, 51(1): 159-172 |
KOENING M L, MONTES M J F, LEÇA E E, et al, 2014. New record of Akashiwo sanguinea (Dinophyta) in the tropical estuarine waters of Northeastern Brazil (Western Atlantic). Brazilian Journal of Biology, 74(1): 191-198 |
KOK J W K, YEO D C J, LEONG S C Y, 2015. Growth and physiological responses of a tropical toxic marine microgalga Heterosigma akashiwo (Heterokontophyta: Raphidophyceae) from Singapore waters to varying nitrogen sources and light conditions. Ocean Science Journal, 50(3): 491-508 DOI:10.1007/s12601-015-0045-x |
KONG J, WANG Y, WARREN A, et al, 2019. Diversity distribution and assembly mechanisms of planktonic and benthic microeukaryote communities in intertidal zones of southeast Fujian, China. Frontiers in Microbiology, 10: 2640 |
KUDELA R M, GOBLER C J, 2012. Harmful dinoflagellate blooms caused by Cochlodinium sp. : global expansion and ecological strategies facilitating bloom formation. Harmful Algae, 14: 71-86 |
LELONG A, HÉGARET H, SOUDANT P, et al, 2012. Pseudo-nitzschia (Bacillariophyceae) species, domoic acid and amnesic shellfish poisoning: revisiting previous paradigms. Phycologia, 51(2): 168-216 |
LI J, GLIBERT P M, ZHOU M J, 2010. Temporal and spatial variability in nitrogen uptake kinetics during harmful dinoflagellate blooms in the East China Sea. Harmful Algae, 9(6): 531-539 |
LI D M, XUE Y, SONG Q S, et al, 2022. First report on large-scale Phaeocystis globosa bloom in the southern Yellow Sea, China. Frontiers in Marine Science, 9: 880984 |
LIU S Y, CUI Z M, ZHAO Y F, et al, 2022. Composition and spatial-temporal dynamics of phytoplankton community shaped by environmental selection and interactions in the Jiaozhou Bay. Water Research, 218: 118488 |
LIU S Y, GIBSON K, CUI Z M, et al, 2020. Metabarcoding analysis of harmful algal species in Jiaozhou Bay. Harmful Algae, 92: 101772 |
LIU S Y, ZHANG M J, ZHAO Y F, et al, 2021. Biodiversity and spatial-temporal dynamics of Margalefidinium species in Jiaozhou Bay, China. International Journal of Environmental Research and Public Health, 18(21): 11637 |
LÓPEZ-CORTÉS D J, VÁZQUEZ E J N, DORANTES- ARANDA J J, et al, 2019. The state of knowledge of harmful algal blooms of Margalefidinium polykrikoides (a. k. a. Cochlodinium polykrikoides) in Latin America. Frontiers in Marine Science, 6: 463 |
LU D D, GOEBEL J, 2001. Five red tide species in genus Prorocentrum including the description of Prorocentrum donghaiense lu sp. nov. from the east China Sea. Chinese Journal of Oceanology and Limnology, 19(4): 337-344 |
LU D D, QI Y Z, GU H F, et al, 2014. Causative species of harmful algal blooms in Chinese coastal waters. Algological Studies, 145/146: 145-168 |
MARTIN J L, HASTEY C D, LEGRESLEY M M, et al, 2007. Temporal and spatial characteristics of the diatom Eucampia zodiacus in the Western Isles region of the Bay of Fundy [R]. Canadian Technical Report of Fisheries and Aquatic Sciences, 2705: 1-22.
|
MEE L D, ESPINOSA M, DIAZ G, 1986. Paralytic shellfish poisoning with a Gymnodinium catenatum red tide on the pacific coast of Mexico. Marine Environmental Research, 19(1): 77-92 |
NISHIKAWA T, HORI Y, HARADA K, et al, 2013. Annual regularity of reduction and restoration of cell size in the harmful diatom Eucampia zodiacus, and its application to the occurrence prediction of nori bleaching. Plankton and Benthos Research, 8(4): 166-170 |
NISHIKAWA T, HORI Y, NAGAI S, et al, 2011. Long time-series observations in population dynamics of the harmful diatom Eucampia zodiacus and environmental factors in Harima-Nada, eastern Seto Inland Sea, Japan during 1974–2008. Plankton and Benthos Research, 6(1): 26-34 |
NISHIKAWA T, HORI Y, TANIDA K, et al, 2007. Population dynamics of the harmful diatom Eucampia zodiacus Ehrenberg causing bleachings of Porphyra thalli in aquaculture in Harima-Nada, the Seto Inland Sea, Japan. Harmful Algae, 6(6): 763-773 |
NISHIKAWA T, TARUTANI K, YAMAMOTO T, 2009. Nitrate and phosphate uptake kinetics of the harmful diatom Eucampia zodiacus Ehrenberg, a causative organism in the bleaching of aquacultured Porphyra thalli. Harmful Algae, 8(3): 513-517 |
O'BOYLE S, MCDERMOTT G, 2014. Observations of a thin near surface layer in an estuarine environment: an exceptional bloom of the dinoflagellate Akashiwo sanguinea in the Lee estuary (Lough Mahon), Co. Cork, in September 2010. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 101: 244-248 |
OU L J, WANG D, HUANG B Q, et al, 2008. Comparative study of phosphorus strategies of three typical harmful algae in Chinese coastal waters. Journal of Plankton Research, 30(9): 1007-1017 |
PARK M G, KIM S, KIM H S, et al, 2006. First successful culture of the marine dinoflagellate Dinophysis acuminata. Aquatic Microbial Ecology, 45(2): 101-106 |
PARK B S, KIM J H, KIM J H, et al, 2018. Intraspecific bloom succession in the harmful dinoflagellate Cochlodinium polykrikoides (Dinophyceae) extended the blooming period in Korean coastal waters in 2009. Harmful Algae, 71: 78-88 |
PROBYN T A, BERNARD S, PITCHER G C, et al, 2010. Ecophysiological studies on Aureococcus anophagefferens blooms in Saldanha Bay, South Africa. Harmful Algae, 9(2): 123-133 |
QI Y Z, WANG J, ZHENG L, 1994. The taxonomy and bloom ecology of Pseudo-nitzschia on the coasts of China [C] // Proceedings IOC-WESTPAC Third International Scientific Symposium. Bali: Indonesia Institute of Sciences.
|
QIN Z J, YU K F, CHEN B, et al, 2019. Diversity of symbiodiniaceae in 15 coral species from the southern south China sea: potential relationship with coral thermal adaptability. Frontiers in Microbiology, 10: 2343 |
QIU D J, HUANG L M, LIU S, et al, 2013. Apical groove type and molecular phylogeny suggests reclassification of Cochlodinium geminatum as Polykrikos geminatum. PLoS One, 8(8): e71346 |
REGUERA B, RIOBÓ P, RODRIGUEZ F, et al, 2014. Dinophysis toxins: causative organisms, distribution and fate in shellfish. Marine Drugs, 12(1): 394-461 |
REÑÉ A, GARCÉS E, CAMP J, 2013. Phylogenetic relationships of Cochlodinium polykrikoides Margalef (Gymnodiniales, Dinophyceae) from the Mediterranean sea and the implications of its global biogeography. Harmful Algae, 25: 39-46 |
RICHLEN M L, MORTON S L, JAMALI E A, et al, 2010. The catastrophic 2008–2009 red tide in the Arabian gulf region, with observations on the identification and phylogeny of the fish-killing dinoflagellate Cochlodinium polykrikoides. Harmful Algae, 9(2): 163-172 |
RIISGAARD K, HANSEN P J, 2009. Role of food uptake for photosynthesis, growth and survival of the mixotrophic dinoflagellate Dinophysis acuminata. Marine Ecology Progress Series, 381: 51-62 |
SARNO D, KOOISTRA W H C F, MEDLIN L K, et al, 2005. Diversity in the genus Skeletonema (Bacillariophyceae). Ⅱ. An assessment of the taxonomy of S. costatum-like species with the description of four new species. Journal of Phycology, 41(1): 151-176 |
SELLNER K G, DOUCETTE G J, KIRKPATRICK G J, 2003. Harmful algal blooms: causes, impacts and detection. Journal of Industrial Microbiology and Biotechnology, 30(7): 383-406 |
SHIH C Y, LU H M, GONG G C, et al, 2019. High diversity of haptophytes in the East China Sea revealed by next-generation sequencing and scanning electron microscopy. Journal of Oceanography, 75(4): 305-317 |
SONG H Y, WANG Y Q, DING X X, et al, 2022. Genetic analysis of a large-scale Phaeocystis globosa bloom offshore Qingdao, China. Microorganisms, 10(9): 1723 |
SORHANNUS U, 2007. A nuclear-encoded small-subunit ribosomal RNA timescale for diatom evolution. Marine Micropaleontology, 65(1/2): 1-12 |
SUN F H, ZHOU Q X, 2007. Metal accumulation in the polychaete Hediste japonica with emphasis on interaction between heavy metals and petroleum hydrocarbons. Environmental Pollution, 149(1): 92-98 |
TANG Y Z, GOBLER C J, 2012a. Lethal effects of Northwest Atlantic Ocean isolates of the dinoflagellate, Scrippsiella trochoidea, on Eastern oyster (Crassostrea virginica) and Northern quahog (Mercenaria mercenaria) larvae. Marine Biology, 159(1): 199-210 |
TANG Y Z, GOBLER C J, 2012b. The toxic dinoflagellate Cochlodinium polykrikoides (Dinophyceae) produces resting cysts. Harmful Algae, 20: 71-80 |
TANG Y Z, GOBLER C J, 2015. Sexual resting cyst production by the dinoflagellate Akashiwo sanguinea: a potential mechanism contributing to the ubiquitous distribution of a harmful alga. Journal of Phycology, 51(2): 298-309 |
TANG Y Z, MA Z P, HU Z X, et al, 2019. 3, 000 km and 1, 500-year presence of Aureococcus anophagefferens reveals indigenous origin of brown tides in China. Molecular Ecology, 28(17): 4065-4076 |
TOMAS C R, SMAYDA T J, 2008. Red tide blooms of Cochlodinium polykrikoides in a coastal cove. Harmful Algae, 7(3): 308-317 |
TRICE T M, GLIBERT P M, LEA C, et al, 2004. HPLC pigment records provide evidence of past blooms of Aureococcus anophagefferens in the Coastal Bays of Maryland and Virginia, USA. Harmful Algae, 3(4): 295-304 |
WANG P B, 2022. Harmful algal blooms [M] // CUI W C, FU S X, HU Z Q. Encyclopedia of Ocean Engineering. Singapore: Springer: 687-693.
|
WHITE A E, WATKINS-BRANDT K S, MCKIBBEN S M, et al, 2014. Large-scale bloom of Akashiwo sanguinea in the Northern California current system in 2009. Harmful Algae, 37: 38-46 |
XU X, YU Z M, CHENG F J, et al, 2017. Molecular diversity and ecological characteristics of the eukaryotic phytoplankton community in the coastal waters of the Bohai Sea, China. Harmful Algae, 61: 13-22 |
YAMAGUCHI A, FURUMITSU K, KUME G, 2012. Fish fauna, fisheries biology and ecology [M] // OSHIMA Y. Current Status and Issues of the Ariake Bay, a Potentially Highly Productive Coastal Sea. Tokyo: Kouseisyakouseikaku: 76-87.
|
YANG C Y, LI Y, ZHOU Y Y, et al, 2012. Bacterial community dynamics during a bloom caused by Akashiwo sanguinea in the Xiamen sea area, China. Harmful Algae, 20: 132-141 |
YU Z M, SONG X X, CAO X H, et al, 2017. Mitigation of harmful algal blooms using modified clays: theory, mechanisms, and applications. Harmful Algae, 69: 48-64 |
ZHANG M J, CUI Z M, LIU F, et al, 2021a. Definition of a high-resolution molecular marker for tracking the genetic diversity of the harmful algal species Eucampia zodiacus through comparative analysis of mitochondrial genomes. Frontiers in Microbiology, 12: 631144 |
ZHANG M J, CUI Z M, LIU F, et al, 2021b. Complete chloroplast genome of Eucampia zodiacus (Mediophyceae, Bacillariophyta). Mitochondrial DNA Part B, 6(8): 2194-2197 |
ZHANG Q C, QIU L M, YU R C, et al, 2012. Emergence of brown tides caused by Aureococcus anophagefferens Hargraves et Sieburth in China. Harmful Algae, 19: 117-124 |
ZHU G H, SHI Q S, ZHANG J, et al, 2009. Studies on phytoplankton and water environmental quality in sea area near Qiqu Archipelago. Acta Oceanologica Sinica, 31(4): 149-158 |
ZOU J Z, ZHOU M J, ZHANG C, 1993. Ecological features of toxic Nitzschia pungens Grunow in Chinese coastal waters [M] // SMAYDA T J, SHIMIZU Y. Toxic Phytoplankton Blooms in the Sea. Amsterdam: Elsevier: 651-657.
|
 2023, Vol. 54
2023, Vol. 54

