中国海洋湖沼学会主办。
文章信息
- 王琦, 孙萍, 辛明, 张学雷, 李艳. 2023.
- WANG Qi, SUN Ping, XIN Ming, ZHANG Xue-Lei, LI Yan. 2023.
- 东印度洋冬季印尼贯穿流影响区浮游植物群落结构特征
- STRUCTURE OF PHYTOPLANKTON COMMUNITIES IN WINTER INDONESIAN THROUGHFLOW AFFECTED AREAS IN THE EASTERN INDIAN OCEAN
- 海洋与湖沼, 54(3): 732-746
- Oceanologia et Limnologia Sinica, 54(3): 732-746.
- http://dx.doi.org/10.11693/hyhz20221000265
文章历史
-
收稿日期:2022-10-18
收修改稿日期:2023-02-01
2. 崂山实验室 海洋生态与环境科学功能实验室 山东青岛 266237
2. Laboratory for Marine Ecology and Environmental Science, Laoshan Laboratory, Qingdao 266237, China
浮游植物是海洋初级生产的主要贡献者, 提供了海洋生态系统中90%以上的初级生产力(Field et al, 1998), 是整个海洋生态系统食物网的营养基础, 成为海洋各级消费者最重要的物质和能量来源(Poulton et al, 2007)。浮游植物的群落结构在与之相关的生物地球化学循环和食物网动力过程中起着重要作用(Cloern, 1996)。
印度洋是世界第三大洋, 三面环陆, 南面是开阔大洋, 海陆热力差异大, 具有独特的季风气候(徐建军等, 2000), 是全球热量、盐度、碳和营养物质运输的重要组成部分(Bates et al, 2006)。东印度洋是地球上最大暖池——印太暖池的重要组成部分, 在全球气候变化方面发挥着重要作用(Wiggert et al, 2009)。东印度洋上层水团主要有印尼贯穿流、孟加拉湾水和印度洋赤道水等。起源于北太平洋温跃层的印尼贯穿流穿过印度尼西亚群岛从太平洋进入印度洋, 是太平洋-印度洋在低纬度唯一通道, 在全球水体输运、能量平衡方面有至关重要的作用(袁东亮等, 2017)。在东南印度洋, 印尼贯穿流的2个中心分别位于温跃层和中层, 后者所占据的区域大于前者(Wijffels et al, 2002)。具有高温低盐特性的印尼贯穿流温跃层水经帝汶海进入印度洋, 在10°~20°S之间, 随着南赤道洋流(SEC)向西移动(Gordon, 1986)。在该水团向西运移的过程中, 为经过区域输送了营养盐和淡水, 可能是受到侧向水团和印度洋高盐温跃层水卷入混合的影响导致其盐度有所增加(杜岩等, 2011)。研究海区由于受印尼贯穿流、南赤道流和南爪哇流的共同影响, 渔业资源丰富。
国际上对印度洋的研究, 始于第一次国际印度洋科学考察计划(IIOE-1, 1957~1965), 共有23个国家参与了该计划的现场考察工作, 涉及海洋生物、海洋化学、物理海洋、海洋气象、海洋地质和地球科学物理等学科(于卫东等, 2017)。2015年顺利启动了第二次国际印度洋科学考察计划(Second International Indian Ocean Expedition, IIOE-2, 2015~2020)。近些年, 我国科学家在积极发起和参与印度洋相关的研究计划, 如全球气候变化专项、大洋专项、国家自然科学基金委开放共享航次等, 取得了丰硕成果, 但主要集中于物理海洋过程和动力环境的调查研究(Li et al, 2019; 魏泽勋等, 2019; 杨延召等, 2020; 李淑江等, 2021)。针对印尼贯穿流的来源、特征及变异, 国际上在104°~125°E, 6°~25°S范围内布设了经典的IX1断面, 布放了大量的重复式消耗深海温度记录仪(XBT)进行长期观测(Vranes et al, 2005), 但仅有环境数据, 缺乏海洋生物数据, 尤其是浮游植物的数据少之又少。最新研究仅有对孟加拉湾、赤道东印度洋及其邻近海域浮游植物群落结构及空间特征的研究(薛冰等, 2016; 张艳华, 2018; 李艳等, 2019; 孙萍等, 2020), 上述研究大多集中在赤道及其邻近海域, 且春、夏季较多, 对秋冬季节浮游植物的研究鲜少, 更是缺乏印尼贯穿流影响区浮游植物群落结构的数据。
基于此, 本研究以2020年1~2月在热带东印度洋印尼贯穿流影响区获得的浮游植物网采数据及其同步环境数据, 讨论了浮游植物种类组成、优势类群、丰度的分布特征, 并与近十年来相邻海域的浮游植物结构进行了比较, 丰富了研究海区浮游植物的数据, 阐释了影响浮游植物丰度的主要环境因子, 为深入研究该海区地球生物化学循环和生态系统奠定基础, 为印度洋海洋生物资源的开发及利用提供数据支撑。
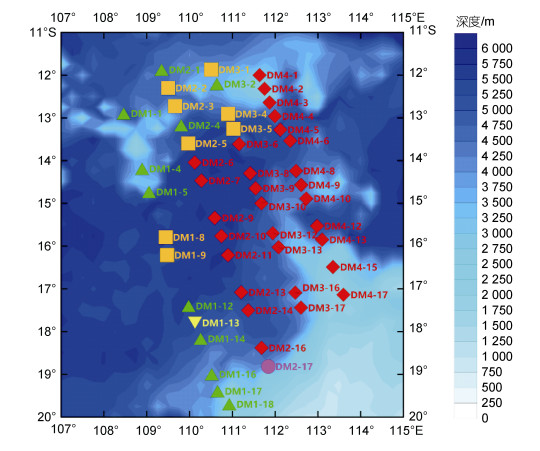
1 材料与方法 1.1 调查站位本研究依托“全球变化与海气相互作用(二期)”专项东印度洋水体综合调查冬季航次, 现场观测于2020年1~2月进行, 调查船为“向阳红01”号科学考察船。调查海域经纬度范围为107°~115°E, 20°~11°S, 沿西北-东南走向共布设4条断面, 自西向东分别为DM1、DM2、DM3和DM4, 共计70个站位。浮游生物拖网站位有50站, 大致均匀分布在整个研究海区(图 1)。
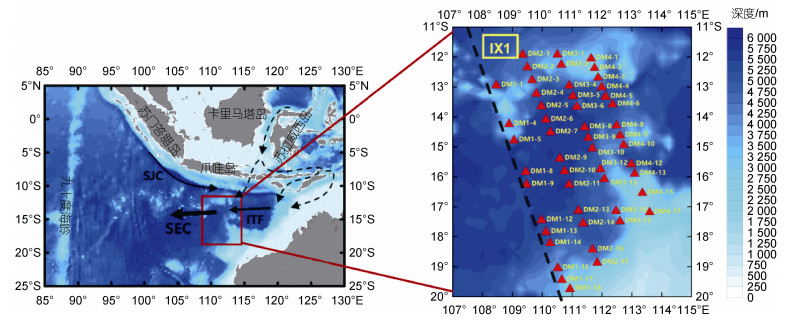 |
| 图 1 2020年冬季东印度洋调查站位 Fig. 1 Location of survey stations in the Eastern Indian Ocean in winter 2020 注: ITF: Indonesian Throughflow, 印尼贯穿流; SEC: South Equatorial Current, 南赤道洋流; 洋流方向改编自Wijffels等(1996); 右图中红色三角表示站点位置, 黑色虚线为IX1断面位置 |
样品采集所用器具和操作程序均按照《海洋调查规范第6部分: 海洋生物调查GB/T12763.6-2007》和《“全球气候变化与海气相互作用(二)”专项海洋生物资料整编技术规格》执行。海水温度和盐度采用“SBE-911-Plus-0699 (Sea Bird, America)仪器现场测定, 采用SBE Data Processing-Win32软件(Sea Bird, America)对数据进行处理。海水用Niskin采水器采集, 营养盐按照《海洋调查规范》规定的方法, 通过0.45 μm的混合纤维素酯微孔滤膜过滤, 收集冷冻避光保存。浮游植物样品以拖网方式获取, 采样网具为小型浮游生物网(筛绢孔径为77 μm, 网口面积0.1 m2, 网衣长2.8 m), 在每个观测站位自200 m至表层垂直拖曳, 拖网所获浮游生物样品立即用缓冲甲醛溶液固定, 终浓度为5%, 带回陆地实验室分析。在实验室内使样品静置24 h以上, 用虹吸法顺着液面除去上清液, 将样品保存在120 mL样品瓶中。用0.5 mL计数框在NikonTE2000-U型荧光倒置显微镜下进行物种鉴定和计数。由于束毛藻单个细胞个体小且排列紧密, 多呈链状群体出现, 因此, 该类群按藻丝体计数。浮游植物拉丁文名及中文名参照孙军等(2002)。
1.3 数据处理与统计方法浮游植物群落的香农-威纳多样性指数(H′, Shannon-Wiener index), 物种均匀度Pielou指数(J)计算公式如下。
物种多样性指数H′的计算公式为:
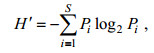 (1)
(1)式中Pi=ni/Ni为第i种在样品中的细胞丰度概率; S为总物种数。
物种均匀度指数(J)采用Pielou的计算公式:
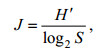 (2)
(2) (3)
(3)式中: J为均匀度; H′为物种多样性指数; Hmax为log2S, 表示多样性指数的最大值, S为样品中的物种数。
浮游植物优势种根据优势度的值(Y)来确定, 一般将浮游植物优势度≥0.02的种类定义为优势种(孙儒泳, 1992),
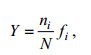 (4)
(4)式中, ni为第i种的细胞个数; N为所采集的样品中所有种的总细胞个数; fi 为第i种在各样品中出现的频率。
环境因子参数的水柱加权平均计算是利用各站位不同水层间环境因子参数数值通过梯形积分法计算得到的, 计算如下:
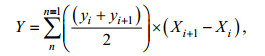 (5)
(5) (6)
(6)其中, Y表示水柱中环境因子参数Y值表示环境因子参数的水柱平均值; 表示该站位水层深度为Xi时的环境因子参数数值; Xi表示环境因子参数测定时的水层深度, 1≤i≤n−1; Xmax为该水柱的最大深度差。
用Surfer13软件(Golden Software, America)绘制浮游植物细胞丰度、硅藻和甲藻种类数及其不同比例的平面分布图; 用ODV4.7.10软件(Alfred Wegener Institute, Germany)绘制研究海区海水温度和盐度的平面分布图; 利用PRIMER6.0软件(Premier, Canada)计算物种Bray-Curtis相似性系数, 作相似性矩阵聚类(Cluster)和非参数多维尺度转换标序图(MDS)。采用Canoco5.0软件(Petr Smilauer, Czech Republic)对浮游植物丰度和环境因子进行冗余分析(RDA), 根据以下两个原则筛选物种: 一是物种的站位出现率大于70%; 二是物种优势度大于0.02。本文共选取8种浮游植物优势种类进行RDA分析, 物种与环境矩阵经lg(x+1)转换。
2 结果 2.1 物种组成和生态类型2020年冬季, 在研究海域共鉴定浮游植物4门57属268种(含变种、变型)。其中, 硅藻38属129种, 甲藻17属136种, 金藻1属2种, 蓝藻1属1种, 占总种类数的百分比分别为48.0%、50.6%、1.1%和0.4%。硅藻以角毛藻属(Chaetoceros spp.)的种类最多, 共37种, 占硅藻总种类数的28.7%, 其次是根管藻(Rhizosolenia spp.)和圆筛藻(Coscinodiscus spp.), 分别有17种和13种类, 辐杆藻(Bacteriastrum spp.)和星脐藻(Asteromphalus spp.)各为5种和4种, 其他属包含的种类均少于4种。甲藻中角藻种类有63种, 该属包含的种类多是大洋中的常见种类, 占甲藻总种类数的46.3%, 其次是原多甲藻(Protoperidinium spp.) 14种, 鳍藻(Dinophysis spp.) 11种, 梨甲藻(Pyrocystis spp.) 9种, 鸟尾藻(Ornithocercus spp.) 7种, 角甲藻(Ceratocorys spp.) 5种, 双管藻(Amphisolenia spp.)、异甲藻(Heterodinium spp.)和足甲藻(Podolampas spp.)均为4种, 其他属包含的种类均小于4种。生态类群方面, 调查海区浮游植物主要以热带大洋性种类、大洋暖水种和热带近岸种为主, 浮游植物区系属于热带-亚热带生物区系。
2.2 细胞丰度和物种多样性指数的平面分布网采浮游植物细胞丰度的变化范围为1.28×103~ 7.84×104 cells/m3, 平均丰度值为1.55×104 cells/m3, 最高值是最低值的60倍。平面分布上呈明显的斑块状分布特征, 在研究海区的北部和中西部出现了最高值和次高值, 东部和南部有大面积低值区。最高值出现在北部DM2-3站位(109.66°E, 12.73°S), 丰度为7.84×104 cells/m3, 次高值出现在中部的DM1-8站位(109.45°E, 15.79°S), 丰度高达6.41×104 cells/m3。相对于调查海区中、北部, 南部海区细胞丰度分布较为均匀且普遍较低(图 2)。由此可见, 冬季小型浮游生物分布具有相对复杂的分布特征。研究海区浮游植物种类多样性和均匀度指数均处于高值, 多样性指数在3.41~5.22, 平均4.66, 多样性指数的高值在DM1断面17°~20°S范围, 而低值是在DM2断面中部15°S海域。均匀度指数在0.55~0.89, 平均0.66, 与多样性指数分布趋势基本一致。细胞丰度较高的站位多样性指数和均匀度指数相对偏低(图 3)。
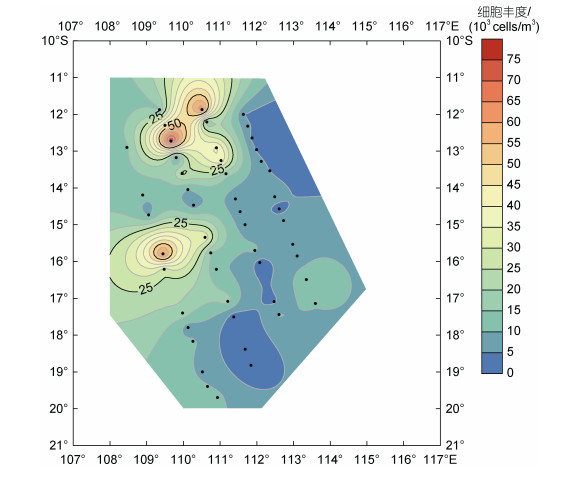 |
| 图 2 2020年冬季东印度洋浮游植物细胞丰度平面分布 Fig. 2 The distribution of phytoplankton cell abundance in the Eastern Indian Ocean in winter 2020 |
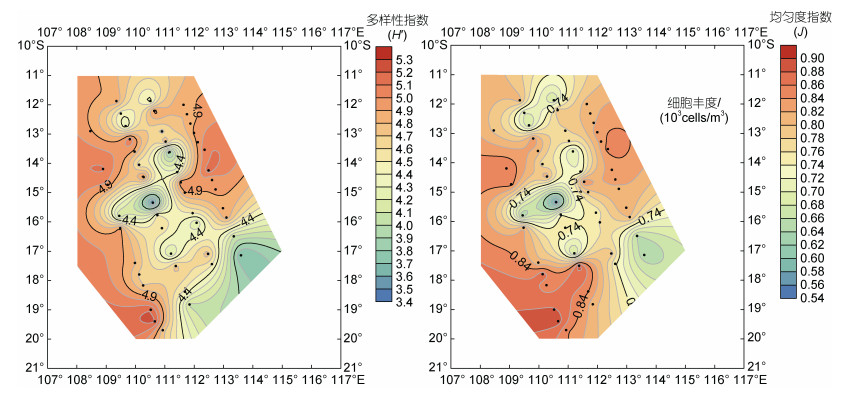 |
| 图 3 浮游植物群落Shannon-Wiener多样性指数(H′)和Pielou均匀度指数(J)平面分布 Fig. 3 The distribution of Shannon-Wiener index and Pielou's evenness index of phytoplankton |
冬季浮游植物优势种主要是硅藻集群, 具体有短叉角毛藻(Chaetoceros messanensis)、伏氏海毛藻(Thalassiothrix frauenfeldii)、角毛藻(Chaetoceros spp.)、地中海细柱藻(Leptocylindrus mediterraneus)、丛毛辐杆藻(Bacteriastrum comosum)、长海毛藻(Thalassiothrix longissima), 蓝藻有束毛藻(Trichodesmium spp.), 甲藻仅有夜光梨甲藻(Pyrocystis noctiluca), 各种类的平均细胞丰度、出现频率和优势度等信息见表 1。短叉角毛藻为研究海区绝对优势种, 优势度高达0.089, 出现频率为96%, 平均细胞丰度为7.18×104 cells/m3, 其细胞丰度贡献了冬季浮游植物总细胞丰度的9.23%。伏氏海毛藻是该海域第二优势种, 优势度为0.073, 出现频率高达98%, 平均细胞丰度为5.80×104 cells/m3, 其丰度所占比例为7.47%。地中海细柱藻出现频率也较高, 平均细胞丰度为3.90× 104 cells/m3, 对总细胞丰度贡献为3.90%。长海毛藻广泛分布整个研究海区, 丰度占比为3.37%, 优势度为0.033。此外, 笔尖形根管藻、密聚角毛藻对总细胞丰度贡献分别为2.83%和2.75%, 美丽漂流藻、透明辐杆藻对总细胞丰度贡献分别为2.35%和3.59%。蓝藻中束毛藻为优势种, 该种出现频率高达94%, 平均藻丝体丰度为2.42×104 trichomes/m3, 其藻丝体丰度占冬季浮游植物总丰度的3.11%。甲藻中仅夜光梨甲藻成为优势种, 其细胞丰度所占比例为3.71%, 但该种出现频率极高, 在每个站位均有检出。
| 优势种 | 类群 | 平均细胞丰度/(×104 cells/m3) | 占总细胞丰度百分比例 | 出现频率(fi) | 优势度(Y) |
| 短叉角毛藻Ch messanensis | 硅藻 | 7.18 | 9.24 | 96% | 0.089 |
| 伏氏海毛藻Th frauenfeldii | 硅藻 | 5.80 | 7.47 | 98% | 0.073 |
| 角毛藻Chaetoceros spp. | 硅藻 | 6.64 | 8.55 | 70% | 0.060 |
| 地中海细柱藻Lep mediterraneus | 硅藻 | 3.90 | 5.02 | 78% | 0.039 |
| 丛毛辐杆藻Bac comosum | 硅藻 | 3.36 | 4.33 | 90% | 0.038 |
| 夜光梨甲藻Py noctiluca | 甲藻 | 2.88 | 3.71 | 100% | 0.037 |
| 长海毛藻Th longissima | 硅藻 | 2.62 | 3.37 | 100% | 0.033 |
| 束毛藻Trichodesmium spp. | 蓝藻 | 2.42 | 3.11 | 94% | 0.029 |
对浮游植物物种进行了聚类分析(图 4, 5), 结果显示, 在45%相似水平上, 大致分为5个群落。群落a位于研究海域西部和北部, 主要集中在DM1断面上, 具体有DM1-1、DM1-4、DM1-5、DM1-12、DM1-14、DM1-16、DM1-17、DM1-18, 此外有DM2断面北部两站(DM2-1、DM2-4)和DM3断面北部一站(DM3-2), 站位之间平均相似性为52.53%, 该群落代表物种为角毛藻、伏氏海毛藻、地中海细柱藻、夜光梨甲藻、短叉角毛藻、密聚角毛藻、美丽漂流藻和长海毛藻, 8个种的总贡献率为41.15%。群落b和群落d仅各包含1个站位, 分别为DM1-13和DM2-17, 均位于研究海区西南部, 靠近澳大利亚一侧, 代表物种分别为笔尖形根管藻和夜光梨甲藻, 与群落a的优势种类明显不同。群落c包含的站位最多, 有29个站, 主要分布在研究海区的东部与南部, 各站位平均相似性为54.20%, 该群落代表物种为夜光梨甲藻, 其贡献率为6.46%, 与群落a、b明显不同。群落e主要分布在研究海域的中北部, 包含DM1-8、DM1-9、DM2-2、DM2-3、DM2-5、DM3-1、DM3-4、DM3-5站位, 站位之间平均相似性为53.29%, 该群落代表物种为角毛藻、密聚角毛藻、伏氏海线藻、地中海细柱藻、透明辐杆藻, 5个种的总贡献率为30.81%, 与群落a有部分相似性。聚类分析结果显示, 造成群落间差异的主要物种有角毛藻、地中海细柱藻、短叉角毛藻和伏氏海毛藻。
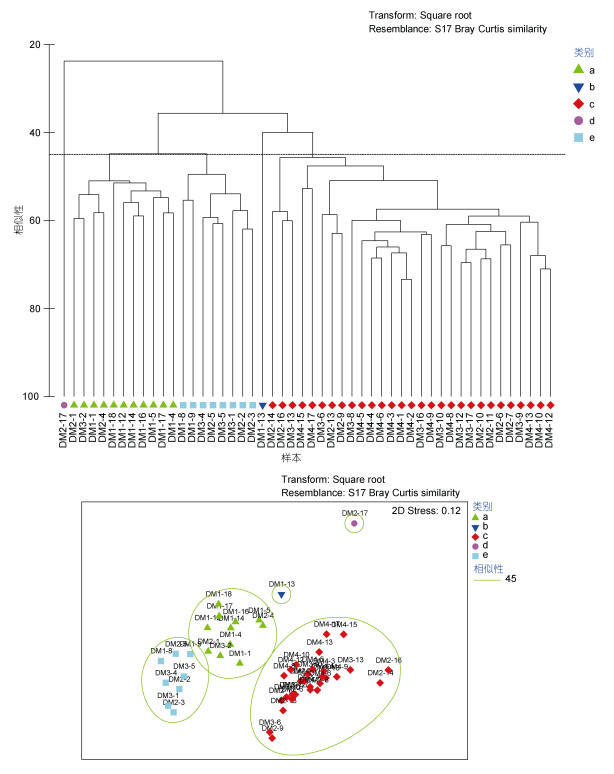 |
| 图 4 2020冬季东印度洋各站位浮游植物聚类树状图和多维尺度转换排序 Fig. 4 Cluster and MDS of phytoplankton in survey stations in the Eastern Indian Ocean in winter 2020 注: MDS, non-metric Multidimensional Scaling |
 |
| 图 5 浮游植物聚类分组及其水平分布 Fig. 5 Cluster analysis grouping and horizontal distribution of phytoplankton |
研究海区鉴定出的浮游植物种类, 硅藻和甲藻占比达到了98%以上, 因此, 对于浮游植物结构的水平分布, 着重分析了硅、甲藻种类数及其细胞丰度占总种类数和总细胞丰度的比例(图 6)。从物种数上来看, 硅藻物种数有129种, 占总种类数的比例为48%, 甲藻有136种, 占比为51%, 硅藻物种数及其比例均低于甲藻。硅藻种类数占总种类数的比例有数个斑块状分布的高值区, 在60%~70%变化, 主要分布在研究海区的北部和中西部(图 6a, 6c)。甲藻种类数占比的高值区分布与硅藻相反, 主要在研究海区的东、南部(图 6b, 6d)。细胞丰度方面, 硅藻细胞丰度介于6.30×102~ 7.62×104 cells/m3, 平均值为1.35×104 cells/m3, 丰度占比平均为76%; 甲藻细胞丰度介于2.70×103~9.40× 103 cells/m3, 平均值为1.57×103 cells/m3, 丰度占比平均仅为18%, 硅藻占总细胞丰度的比例远高于甲藻。硅藻的密集中心出现在调查海区西部, 丰度比变化范围为80%~90% (图 6e, 6g), 与研究海区浮游植物总细胞丰度的高值区一致。甲藻与硅藻相反, 甲藻丰度及占总丰度比例的高值区与硅藻低值区重合, 其丰度比为40%~50%, 而其低值区与硅藻的高值区重合, 丰度比仅为10%~20% (图 6f, 6h)。由此可知, 东印度洋印尼贯穿流影响区浮游植物种类主要由硅藻和甲藻贡献, 但其细胞丰度的高值则主要由硅藻贡献, 两者呈现相反的水平分布态势, 与东印度洋寡营养海域浮游植物结构不同, 后者主要是甲藻贡献了浮游植物的多样性(李艳等, 2019)。
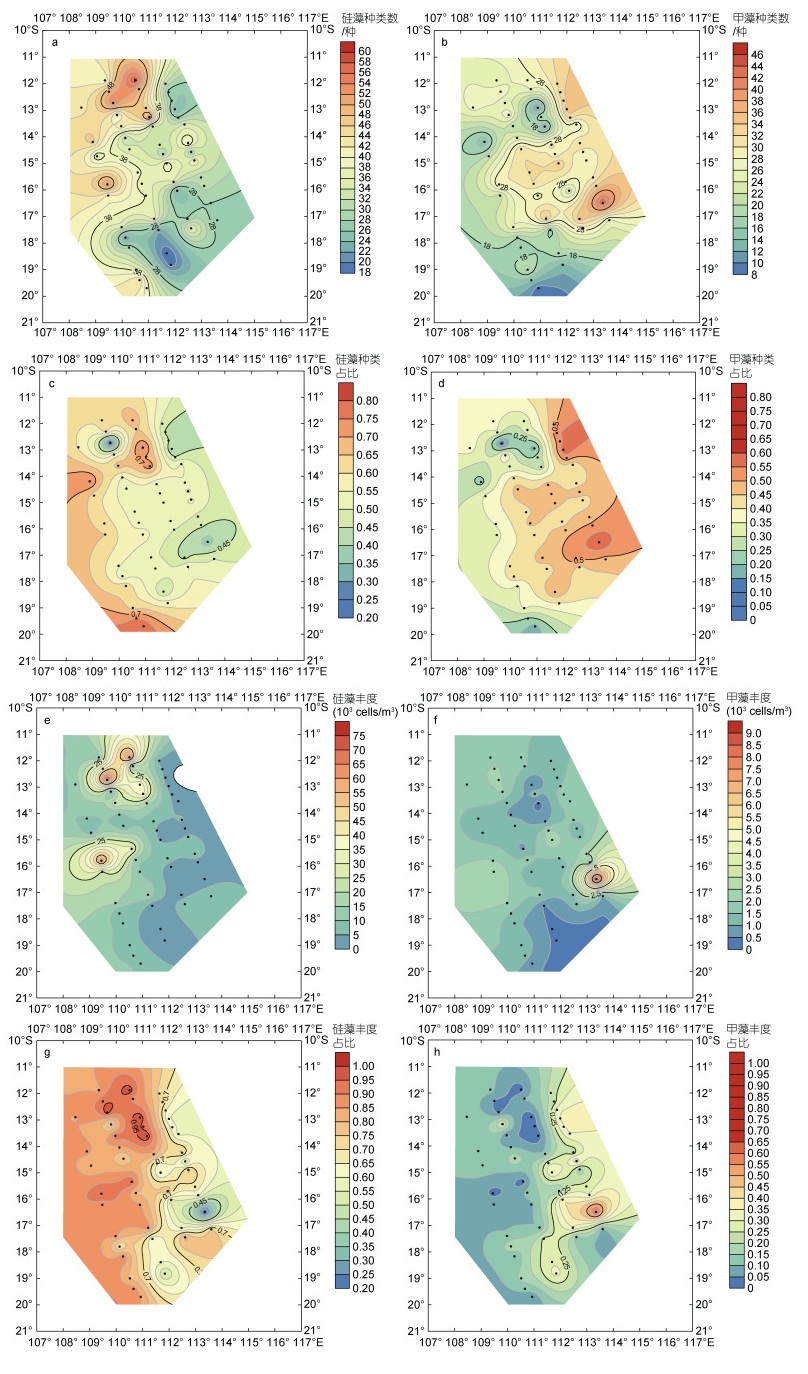 |
| 图 6 2020冬季东印度洋浮游植物硅甲藻种类和丰度所占比例 Fig. 6 The percentage of abundance and species of phytoplankton in the Eastern Indian Ocean in winter 2020 |
研究海区0、30、75、100、150和200 m各水层海水温度、盐度平面分布如图 7所示。表层海水温度变化范围为27.4~30.3 ℃, 平均为29.3 ℃, 除海区中部和北部出现局部高温外, 表层水温基本呈现由北向南逐渐降低的趋势。30 m水层温度为26.2~30.2 ℃, 平均水温28.8 ℃, 北部高温范围收缩, 整体态势与表层相似。随着水深增加, 水温快速下降, 75 m水深温度变化范围为20.0~26.8 ℃, 平均为22.9 ℃, 到了200 m, 平均值已下降到16.3 ℃, 范围在12.9~18.5 ℃。平面分布上, 跃层及以下水体与上混合层(0、30 m)明显不同, 基本呈现由北向南升高的趋势。调查海区表层盐度高值为35.2, 低值为34.0, 平均值为34.6, 低值区位于DM3断面上14°S附近海域。100m水层变化范围为34.5~35.3, 平均为34.8; 200 m水深, 其盐度变化范围为34.6~35.6, 平均为35.0。平面分布上, 除表层盐度整体分布较为均匀外, 其余各层盐度均呈现出北部低南部高的特征。
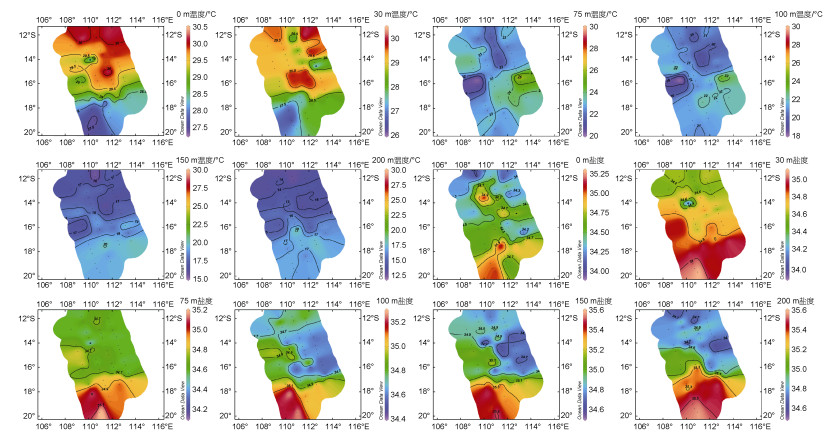 |
| 图 7 调查海域不同水层温度和盐度的平面分布 Fig. 7 Horizontal distributions of temperature and salinity in different layers in the survey area |
浮游植物总丰度及各优势种细胞丰度与环境因子的RDA排序结果见图 8, 环境因子箭头的长度、夹角余弦值反映了其与浮游植物各参数的相关性大小。RDA分析的前两轴特征值分别为0.299和0.024, 解释了浮游植物群落总变异的32.3%。第1和第2轴物种与环境因子的相关系数分别为0.573和0.563, 前2轴属种与环境因子关系的方差累计百分比为98.9%, 说明此排序图较好地反映了浮游植物与环境因子的关系。因为浮游植物是从200 m至表层垂直拖取, 细胞总丰度和各优势种的丰度均是整个水柱的平均值, 因此, 营养盐进行了各水层的加权平均, 以便更好分析其与浮游植物的相关性。结果表明, 浮游植物总丰度和大部分优势种类与海水温度和盐度表现出负相关性, 尤其是丛毛辐杆藻, 该种类从生态类型上属于暖海性种, 但研究海域较高的表层海水温度(范围27.4~30.3 ℃, 平均29.3 ℃)可能抑制其生长。束毛藻耐高温高盐, 其与海水温度和盐度呈正相关。浮游植物总丰度、角毛藻集群(短叉角毛藻、角毛藻属)和丛毛辐杆藻等优势种类与三项常量营养盐(溶解态无机氮、磷、硅)均表现出正相关, 说明溶解态无机氮、磷和硅等是研究海区浮游植物生长的物质基础, 不断补充的营养盐可促进其快速生长。
 |
| 图 8 主要浮游植物种类丰度与环境因子的RDA排序 Fig. 8 RDA biplot of main phytoplankton species and environmental variables |
浮游植物多样性是地球生物多样性的重要组成部分, 其种群的多样性也被视为生物学的一个重要特征, 除此之外, 群落中不同种群的组成和分布对系统中物质和能量的变化起着重要作用(Timonin, 1971)。因此, 对浮游植物群落组成的研究有助于深入研究海洋中的生物学过程。东印度洋浮游植物研究资料鲜少, 尤其是对浮游植物群落结构组成的研究更少。本研究欲通过对比2020年东印度洋冬季印尼贯穿流影响海域网采浮游植物与邻近海域网采浮游植物的历史资料, 分析浮游植物群落的种类数、结构组成和优势种的变化。本研究海域范围为东印度洋107°~115°E, 20°~11°S, 1960年Wood(1963)选取的海域主要在澳大利亚北部域105°~120°E, 20°~10°S, 2013年和2017年范围为东印度洋83°~97.5°E, 10°S~4°N, 2015年范围为东印度洋80.00°~96.10°E, 10.08°N~ 6.00°S, 均属于毗邻海域。由表 2可知, 2013春季总种类数最多, 达到350种, 其次是2015年春季, 有340种。2017年冬季有290种, 多于2020年数量(268种), 1960年种类数最少(226种)。浮游植物甲藻种类数占比最高值出现在2017年, 为63.5%, 其次是2020年(50.7%), 2015年最低(35.3%)。浮游植物硅藻种类数占比与甲藻相反, 最高出现在2015年, 为61.5%, 其次是2013年(52.3%), 最低出现在2017年(35.9%)。研究海域鉴定出的总种类数的多少与布设站位数量关系密切相关, 2013、2017和2020年三航次的网采浮游植物样品分析鉴定者一致, 而2013和2017年站位数均在100站左右, 而本研究仅有50站位, 可能影响了鉴定出的总种类数。研究海区鉴定出的浮游植物物种数跟显微镜等鉴定条件亦有关。从不同季节和航次的网采浮游植物细胞丰度上来看, 2020年冬季印尼贯穿流影响区平均细胞丰度为1.55×104 cells/m3, 低于2013年春季(2.30×104 cells/m3), 高于2017年冬季(9.11× 103 cells/m3)。由于2013年和2017年研究海域完全相同, 因此, 寡营养大洋海域浮游植物丰度存在明显的年份和季节差异。通过种类数和细胞丰度的比较分析, 不难发现, 对于东印度洋浮游植物群落与结构, 硅藻是细胞总丰度的主要贡献者, 2013年总细胞丰度最高, 硅藻种类占比亦最大, 2017年总细胞丰度最低, 硅藻种类占比亦最小, 这点与近海表现的规律是一致的。
| 研究海区 | 调查时间 | 平均细胞丰度/(×103 cells/m3) | 方法 | 浮游植物种类数 | 甲藻种类数占比/% | 硅藻种类数占比/% | 主要优势种 | 参考文献 |
| 东印度洋南部 | 1960年 | — | 网采 | 226 | 48.7 | 51.3 | 均等角毛藻、宽梯形藻、太阳漂流藻、菱形海线藻、长海毛藻、佛氏海线藻、波状角藻、掌状足甲藻、多边屋甲藻 | Wood, 1963 |
| 东印度洋南部 | 2013年3~5月 | 23.03 | 网采 | 350 | 46.3 | 52.3 | 美丽漂流藻、菱形藻、宽梯形藻、角毛藻、距端根管藻、地中海细柱藻、大西洋角毛藻那不勒斯变种、丛毛辐杆藻、多瘤面角毛藻、短刺角毛藻、夜光梨甲藻、波状新角藻 | 李艳等, 2019 |
| 东印度洋南部 | 2015年3~4月 | — | 网采 | 340 | 35.3 | 61.5 | 柔弱伪菱形藻、鼓形拟脆杆藻、菱形海线藻、佛氏梯形藻、美丽漂流藻、离心列海链藻、地中海细柱藻、大西洋角毛藻那不勒斯种 | 薛冰, 2016 |
| 东印度洋南部 | 2017年12月至2018年1月 | 9.11 | 网采 | 290 | 63.5 | 35.9 | 束毛藻、佛朗梯形藻、美丽漂流藻、伯氏根管藻、夜光梨甲藻、距端根管藻、翼根管藻纤维变型、三叉角藻、笔尖形根管藻、长海毛藻、密聚角毛藻 | 数据未发表 |
| 东印度洋印尼贯穿流影响区 | 2020年1~2月 | 15.53 | 网采 | 268 | 50.7 | 48.1 | 短叉角毛藻、伏氏海毛藻、角毛藻、地中海细柱藻、丛毛辐杆藻、夜光梨甲藻、长海毛藻、束毛藻、笔尖形根管藻、密聚角毛藻、美丽漂流藻、透明辐杆藻 | 本研究 |
优势种变化方面, 硅藻中的角毛藻和漂流藻一直是热带东印度洋的优势种类, 甲藻主要是夜光梨甲藻。与1960年研究对比发现, 甲藻优势种类数量明显减少, 菱形藻、根管藻、细柱藻、辐杆藻和美丽漂流藻等在之后出现并成为优势种类; 与李艳等(2019)对热带东印度洋2013年春季研究对比发现, 菱形藻、宽梯形藻在2013年春季较多, 到2017年和2020年冬季却较少出现, 而束毛藻、密聚角毛藻和笔尖形根管藻广泛出现。束毛藻主要分布在贫营养的热带及亚热带大洋水体中, 耐高温且适应盐度能力较高, 是开阔大洋中高丰度固氮生物, 约能固定全球80 Tg的氮(Capone et al, 2005); 与2015年春季研究相比, 海毛藻优势种数量增加, 柔弱伪菱形藻、鼓形拟脆杆藻、离心海链藻等优势种类在2017年和2020年冬季出现较少; 与2017年相比, 2020年角毛藻属种类有所增加, 2017年仅有密聚角毛藻一种, 2020年新增了短叉角毛藻和角毛藻属的种类。此外, 伏氏海毛藻和透明辐杆藻在2020年也成为了新的优势种。值得注意的是, 像地中海细柱藻、伏氏海毛藻、短叉角毛藻等2020年新出现的优势种类, 大多属于广温广盐性种, 能适应由印尼贯穿流带来的大量热量和淡水所引起的区域内海水温盐的改变。上述种类细胞个体较小, 是相邻细胞通过毛刺相连的集群体, 其丰度和优势地位上升, 可引起浮游植物结构存在小型化趋势, 这可能与浮游植物通过自身演替调节其细胞生理机能和形态变化来适应复杂环境有关(Thingstad et al, 2005), 较小的个体通过角毛或刚毛相连增大表面积和体积更利于营养盐的获取(Litchman et al, 2007), 但对于是否确认出现浮游植物小型化趋势还需要长期调查数据进行佐证。
3.2 影响浮游植物丰度的主要环境因子根据RDA分析结果显示, 影响研究海区浮游植物群落结构的主要因素是水温, 其次是溶解无机氮、溶解无机磷和溶解硅。根据浮游植物对外界温度的适应范围分为广温性(eurythermic)和狭温性(stenothermic)种类。广温性种类多分布在近岸海区, 狭温性种类又分为喜冷性和喜热性种类。海水温度对海洋浮游植物的地理分布有直接关系, 按生物对分布区水温的适应能力, 可分为暖水种(warm-water species)、温水种(temperate-water species)和冷水种(cold-water species)。温度对浮游植物的光合作用和呼吸作用均有重要影响(Winder et al, 2012; Mousing et al, 2014; 谢艳辉等, 2015), 其通常情况下会通过影响细胞代谢相关酶的效率来影响浮游植物光合作用和呼吸作用效率(Chen et al, 2009)。本研究结果显示调查海域多数浮游植物优势种丰度与温度呈负相关关系, 该结果与Petchey等(2008)在东印度洋研究基本一致。在开阔的低纬度大洋, 由于太阳常年辐射强度大, 日光充足, 所以表层水温常年偏高(27.4℃~30.3℃), 印尼贯穿流所携带的高温低盐水亦可影响研究海区上层海水温度, 海区内浮游植物优势种多为个体较小的广温广盐性种可能跟上述原因有关。浮游植物种类大小受温度影响的结果在全球大洋基本相同, 无论营养盐是否充足, 随着温度升高将导致细胞大型的浮游植物种类在群落里的贡献较低(Petchey et al, 2008)。浮游植物个体大小是一个重要的生物学特性, 不但影响群落结构, 而且在个体、种群和群落尺度上影响着许多的生理和生态学过程, 尤其是新陈代谢速率、营养物质吸收、沉降速率、摄食等(Petchey et al, 2008)。
营养盐是浮游植物生长、增殖最基本的物质基础, 营养盐的分布和含量直接影响着海区的初级生产力、浮游植物的群落结构和多样性(Margalef, 1978)。有研究表明, NO3–是短期限制性营养盐, 主要调控表层浮游植物的生长, 氮加富后能在几天内实现初级生产力的快速增加, 而磷酸盐是最终限制营养盐, 表层海水中的磷酸盐可以调节整个海洋的生产力(Moore et al, 2002)。唐松(2006)研究显示在印度洋海区, 氮对浮游植物生长的作用明显大于磷, 氮的添加会引起浮游植物的生长, Ke (2014)认为在东印度洋Si含量非常低, 限制了该海域浮游植物的生长。李艳等(2019)研究表明在东印度洋春季0、30 m水体中, 存在氮和磷潜在性限制, 到75 m仅存在极低的氮限制, 热带东印度洋营养盐浓度比其结构更易限制浮游植物的生长。
营养盐的限制作用主要体现在绝对性(浓度)和相对性(结构)两个方面(Justić et al, 1995)。根据营养盐吸收动力学, 一般认为溶解硅(dissolved silicate, DSi)为2 μmol/L, 溶解无机氮(dissolved inorganic nitrogen, DIN)为1 μmol/L, 溶解无机磷(dissolved inorganic phosphate, DIP)为0.1μmol/L可作为浮游植物生长的最低阈值。基于Justić等(1995)和Dortch等(1992)建立的评估海水营养盐化学计量的限制标准, 即: 若DSi: DIP > 22且DIN: DIP > 22则会出现磷相对限制; 若DIN: DIP < 10和DIN: DSi < 1则会出现氮相对限制; 若DSi: DIP < 10和DSi: DIN < 1则会出现硅相对限制。基于上述评判标准, 对各站位营养盐浓度和结构进行了比较分析, 结果发现, 各站位DSi、DIN和DIP浓度均高于绝对限制的阈值, 也就是说, 研究海区不存在营养盐对浮游植物生长的绝对性限制。相对性限制方面, 调查海区中仅有3%的站位受到氮限制, 6%站位受到磷限制, 未出现硅元素限制(图 9)。综合分析, 未有哪种营养盐作为关键性或主要因子对浮游植物群落结构产生显著影响, 更偏向于多种营养盐共同影响。研究海区位于澳大利亚西北部的印澳海盆地区, 区域内水文现象复杂, 一方面起源于北太平洋温跃层的印尼贯穿流穿过印度尼西亚群岛复杂水道从太平洋进入印度洋, 携带着具有高温低盐特性的温跃层水在10°~20°S海域随着南赤道洋流向西移动(Gordon, 1986), 在横穿研究海域期间, 为上层水体带来了丰富的营养盐; 另一方面在研究海区北部, 西北-东南流向的南爪哇流与部分印尼贯穿流交汇, 亦为研究区域输送营养盐, 致使浮游植物丰度出现局部高值。
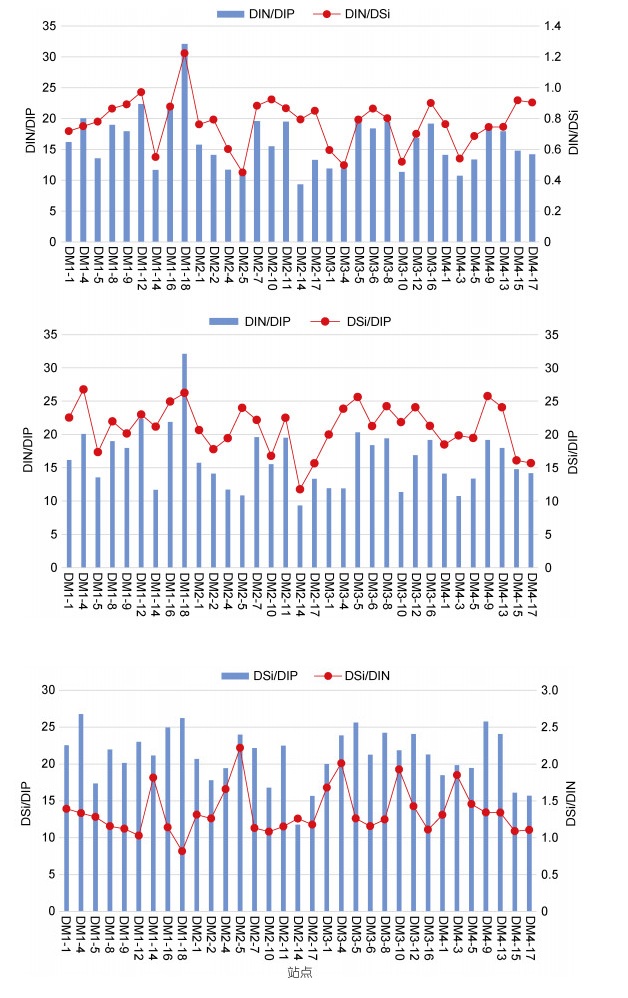 |
| 图 9 调查区域营养盐限制的站点比例 Fig. 9 Proportion of sampling site with nutrients limitation in the survey area |
2020年冬季东印度洋印尼贯穿流影响海域共鉴定浮游植物4门57属268种(含变种、变型), 其中, 硅藻38属129种, 甲藻17属136种, 金藻1属2种, 蓝藻1属1种。生态类型以大洋暖水种、热带近岸种和热带外洋性种类为主。硅藻和甲藻是优势类群, 优势种类主要为角毛藻、伏氏海毛藻、地中海细柱藻、丛毛辐杆藻、夜光梨甲藻、长海毛藻和束毛藻。研究海区浮游植物平均细胞丰度为1.55×104 cells/m3, 北部和中西部海区为浮游植物细胞丰度的高值区。浮游植物多样性指数的高值出现在研究海区南部, 细胞丰度的低值区。细胞丰度较高的站位多样性指数和均匀度指数相对偏低。聚类分析结果显示, 角毛藻、地中海细柱藻、短叉角毛藻和伏氏海毛藻是造成群落间差异的主要物种; 多元统计分析表明, 浮游植物丰度与上层海水温度和盐度呈负相关, 与DIN、DSi、DIP等呈正相关。由于印尼贯穿流在横穿研究海域期间, 为上层水体带来了丰富的营养盐, 因此, 研究海区未出现营养盐对浮游植物生长的绝对性限制, 仅有3%的站位受到氮限制, 6%站位受到磷限制, 未出现硅限制作用。
致谢 感谢“向阳红01船”参与现场调查采样的全体科研人员和全体船员, 以及自然资源部第一海洋研究所海气室团队提供的部分现场调查数据。
于卫东, 方越, 刘琳, 等, 2017. 第二次国际印度洋科学考察计划(IIOE-2)介绍. 海洋科学进展, 35(1): 1-7 DOI:10.3969/j.issn.1671-6647.2017.01.001 |
王磊, 冷晓云, 孙庆杨, 等, 2015. 春季季风间期巽他陆架和马六甲海峡表层海水浮游植物群落结构研究. 海洋学报, 37(2): 120-129 DOI:10.3969/j.issn.0253-4193.2015.02.013 |
孙军, 刘东艳, 2002. 中国海区常见浮游植物种名更改初步意见. 海洋与湖沼, 33(3): 271-286 DOI:10.3321/j.issn:0029-814X.2002.03.008 |
孙萍, 李艳, 潘玉龙, 等, 2020. 热带东印度洋春季浮游植物群落结构空间特征分析. 海洋学报, 42(8): 76-88 DOI:10.3969/j.issn.0253-4193.2020.08.009 |
孙儒泳, 1992. 动物生态学原理. 2版. 北京: 北京师范大学出版社, 356-357
|
杜岩, 方国洪, 2011. 印度尼西亚海与印度尼西亚贯穿流研究概述. 地球科学进展, 26(11): 1131-1142 |
李艳, 孙萍, 袁超, 等, 2019. 东印度洋南部春季网采浮游植物群落特征及长期变化. 海洋环境科学, 38(6): 825-832 DOI:10.13634/j.cnki.mes.2019.06.002 |
李淑江, 徐腾飞, 孙俊川, 等, 2021. 卡里马塔海峡贯穿流与印尼贯穿流的相互作用. 海洋科学进展, 39(2): 197-209 DOI:10.3969/j.issn.1671-6647.2021.02.004 |
杨延召, 王立伟, 徐腾飞, 等, 2020. 考虑摩擦的绕岛理论及在印尼贯穿流流量估算中的应用. 海洋科学进展, 38(1): 28-37 DOI:10.3969/j.issn.1671-6647.2020.01.004 |
张艳华, 2018. 孟加拉弯与赤道东印度洋浮游植物群落的研究[D]. 济南: 山东大学.
|
袁东亮, 周慧, 王铮, 等, 2017. 印尼贯穿流源区环流的多尺度变异及其科学重要性. 海洋与湖沼, 48(6): 1156-1168 |
徐建军, 王东晓, 2000. 印度洋-太平洋海温的年际、年代际异常及其对亚洲季风的影响. 海洋学报, 22(3): 34-43 DOI:10.3321/j.issn:0253-4193.2000.03.005 |
唐松, 2006. 大洋浮游植物生长过程中的营养盐限制作用及碳循环研究[D]. 广州: 中国科学院研究生院(广州地球化学研究所).
|
谢艳辉, 李涛, 简伟军, 等, 2015. 海水升温对大亚湾浮游植物群落结构和光合活性的影响. 热带海洋学报, 34(2): 24-31 DOI:10.3969/j.issn.1009-5470.2015.02.004 |
薛冰, 孙军, 丁昌玲, 等, 2016. 2014年春季季风间期东印度洋赤道及其邻近海域硅藻群落. 海洋学报, 38(2): 112-120 DOI:10.3969/j.issn.0253-4193.2016.02.011 |
魏泽勋, 徐腾飞, 王永刚, 等, 2021. 印度尼西亚海潮致混合研究现状与展望. 海洋科学进展, 39(1): 1-8 DOI:10.3969/j.issn.1671-6647.2021.01.001 |
BATES N R, PEQUIGNET A C, SABINE C L, 2006. Ocean carbon cycling in the Indian Ocean: 1. Spatiotemporal variability of inorganic carbon and air-sea CO2 gas exchange. Global Biogeochemical Cycles, 20(3): GB3020 |
CAPONE D G, BURNS J A, MONTOYA J P, et al, 2005. Nitrogen fixation by Trichodesmium spp.: an important source of new nitrogen to the tropical and subtropical North Atlantic Ocean. Global Biogeochemical Cycles, 19(2): GB2024 |
CHEN Y L L, CHEN H Y, JAN S, et al, 2009. Phytoplankton productivity enhancement and assemblage change in the upstream Kuroshio after typhoons. Marine Ecology Progress Series, 385: 111-126 DOI:10.3354/meps08053 |
CLOERN J E, 1996. Phytoplankton bloom dynamics in coastal ecosystems: a review with some general lessons from sustained investigation of San Francisco Bay, California. Reviews of Geophysics, 34(2): 127-168 |
DORTCH Q, WHITLEDGE T E, 1992. Does nitrogen or silicon limit phytoplankton production in the Mississippi River plume and nearby regions?. Continental Shelf Research, 12(11): 1293-1309 DOI:10.1016/0278-4343(92)90065-R |
FIELD C B, BEHRENFELD M J, RANDERSON J T, et al, 1998. Primary production of the biosphere: integrating terrestrial and oceanic components. Science, 281(5374): 237-240 DOI:10.1126/science.281.5374.237 |
GORDON A L, 1986. Interocean exchange of thermocline water. Journal of Geophysical Research: Oceans, 91(C4): 5037-5047 |
JUSTIĆ D, RABALAIS N N, TURNER R E, et al, 1995. Changes in nutrient structure of river-dominated coastal waters: stoichiometric nutrient balance and its consequences. Estuarine, Coastal and Shelf Science, 40(3): 339-356 |
Ke Z, Tan Y, Ma Y, et al, 2014. Effects of surface current patterns on spatial variations of phytoplankton community and environmental factors in Sunda shelf. Continental Shelf Research, 82: 119 |
LI M T, WEI J, WANG D X, et al, 2019. Exploring the importance of the Mindoro-Sibutu pathway to the upper- layer circulation of the South China Sea and the Indonesian Throughflow. Journal of Geophysical Research: Oceans, 124(7): 5054-5066 |
LITCHMAN E, KLAUSMEIER C A, SCHOFIELD O M, et al, 2007. The role of functional traits and trade-offs in structuring phytoplankton communities: scaling from cellular to ecosystem level. Ecology Letters, 10(12): 1170-1181 |
MARGALEF R, 1978. Life-forms of phytoplankton as survival alternatives in an unstable environment. Oceanologica Acta, 1(4): 493-509 |
MOORE J K, ABBOTT M R, 2002. Surface chlorophyll concentrations in relation to the Antarctic Polar Front: seasonal and spatial patterns from satellite observations. Journal of Marine Systems, 37(1/2/3): 69-86 |
MOUSING E A, ELLEGAARD M, RICHARDSON K, 2014. Global patterns in phytoplankton community size structure- evidence for a direct temperature effect. Marine Ecology Progress Series, 497: 25-38 |
PETCHEY F, ANDERSON A, ZONDERVAN A, et al, 2008. New marine ΔR values for the south Pacific subtropical gyre region. Radiocarbon, 50(3): 373-397 |
POULTON A J, ADEY T R, BALCH W M, et al, 2007. Relating coccolithophore calcification rates to phytoplankton community dynamics: regional differences and implications for carbon export. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 54(5/6/7): 538-557 |
THINGSTAD, 2005. Simulating the response to phosphate additions in the oligotrophic eastern Mediterranean using an idealized four-member microbial food web model. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 52(22-23): 3074-3089 |
TIMONIN A G, 1971. The structure of plankton communities of the Indian Ocean. Marine Biology, 9(4): 281-289 |
VRANES K, GORDON A L, 2005. Comparison of Indonesian throughflow transport observations, Makassar Strait to eastern Indian Ocean. Geophysical Research Letters, 32(10): L10606 |
WIGGERT J D, HOOD R R, NAQVI S W A, et al, 2009. Introduction to Indian Ocean biogeochemical processes and ecological variability: current understanding and emerging perspectives [M] // WIGGERT J D, HOOD R R, NAQVI S W A, et al. Indian Ocean Biogeochemical Processes and Ecological Variability. Washington: American Geophysical Union: 1-7.
|
WIJFFELS S, HAUTALA S, MEYERS G, et al, 1996. The WOCE Indonesian throughflow repeat hydrography sections: I10 and IR6. International WOCE Newsletters, 24: 25-28 |
WIJFFELS S, SPRINTALL J, FIEUX M, et al, 2002. The JADE and WOCE I10/IR6 throughflow sections in the southeast Indian Ocean. Part 1: water mass distribution and variability. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 49(7/8): 1341-1362 |
WINDER M, SOMMER U, 2012. Phytoplankton response to a changing climate. Hydrobiologia, 698(1): 5-16 |
WOOD E J F, 1963. Dinoflagellates in the Australian Region. Ⅱ. Recent Collections. Melbourne, Australia: Commonwealth Scientific and Industrial Research Organization, 55
|
 2023, Vol. 54
2023, Vol. 54


