
中国海洋湖沼学会主办。
文章信息
- 李向阳, 王亚洲, 张会会, 王楠, 李玉, 江涛. 2023.
- LI Xiang-Yang, WANG Ya-Zhou, ZHANG Hui-Hui, WANG Nan, LI Yu, JIANG Tao. 2023.
- 基于光合色素化学分类和流式细胞术结合的珠江口自养微微型浮游生物种群时空分布特征
- TEMPORAL AND SPATIAL DISTRIBUTION OF AUTOTROPHIC PICOPLANKTON IN THE ZHUJIANG RIVER ESTUARY BASED ON HPLC PIGMENT METHOD AND FLOW CYTOMETRY
- 海洋与湖沼, 54(3): 747-762
- Oceanologia et Limnologia Sinica, 54(3): 747-762.
- http://dx.doi.org/10.11693/hyhz20220900242
文章历史
-
收稿日期:2022-09-22
收修改稿日期:2022-11-04
2. 烟台大学海洋学院 山东烟台 264005
2. School of Marine, Yantai University, Yantai 264005, China
自养微微型浮游植物(autotrophic picoplankton, APP, < 2~3 μm)主要由蓝藻(Cyanobacteria)和微微型真核浮游生物(Picoeukaryotes)组成, 其中蓝藻包括聚球藻(Synechococcus)和原绿球藻(Prochlorococcus) (Huang et al, 2002)。APP是上层海洋中最丰富和普遍的初级浮游生物(乐凤凤等, 2015), 对全球海洋初级生产力做出了重大贡献, 并影响了海洋环境中碳、氮、磷等物质的生物地球化学循环(Bell et al, 2001; Liu et al, 2007)。与小型和微型浮游植物(> 3 μm)相比, APP细胞具有较大的比表面积和生长速度, 能够更有效地获取养分和光照(Peltomaa et al, 2012)。研究表明, APP贡献了贫营养海域90%的总光合生物量和碳产量(Zhang et al, 2008)。相比之下, 在富营养化近岸海域, 它们对总叶绿素的贡献通常低于贫营养海域(Søndergaard, 1991)。但在某些季节, 微微型浮游植物可能会达到极高的丰度, 成为近岸海域总叶绿素a (chl a)的主体(Gaulke et al, 2010; Qiu et al, 2010)。
显微镜镜检法通常是小型和微型浮游植物鉴定的主要方法, 然而难以实现对微微型浮游植物进行定性定量分析(Yan et al, 2020)。20世纪80代以来, 流式细胞术以其高效率、高灵敏度、高精度等优点广泛应用于APP的研究, 但其分类分辨率仍然不足, 仅能将APP分为聚球藻、原绿球藻和微微型真核浮游生物(王斌等, 1998; Yang et al, 2019)。近年来, 高液相色谱(HPLC)法被广泛应用于浮游植物的定量和定性分析, 其可以识别超过50种浮游植物色素(翟红昌等, 2010; Chai et al, 2016)。HPLC光合色素化学分类法是基于某些光合色素仅主要存在于特定门类的浮游植物中, 例如岩藻黄素(fucoxanthin)、多甲藻素(peridinin)、别藻黄素(alloxanthin)、玉米黄素(zeaxanthin)、叶绿素b (chl b)、19'-乙酰基氧化岩藻黄素(19'-hex-fucoxanthin)和19'-丁酰基氧化岩藻黄素(19'-but-fucoxanthin)可作为硅藻、甲藻、隐藻、蓝藻、绿藻、定鞭藻等类群的标记色素(Paerl et al, 2003; Barlow et al, 2008)。光合色素化学分类法在微微型浮游植物的定性和定量分析中显示出了强大的应用潜力, 例如Chisholm等(1988, 1992)发现在大洋中大量存在的一种新型微微型浮游生物, 根据其特有的色素成分(二乙烯基叶绿素a), 判定为原绿球藻。基于矩阵因子分析的光合色素化学分类软件(Chemotaxonomy, CHEMTAX)被认为是最适合处理色素数据的手段(Latasa, 2007; 李明等, 2017)。该方法通过使用特征色素与叶绿素a的比率来区分不同类群藻类, 能够有效解决色素重叠问题, 并将浮游植物分为八类: 硅藻(Diatoms)、定鞭藻(Haptophytes)、绿藻(Chlorophytes)、青绿藻(Prasinophytes)、金藻(Pelagophytes)、隐藻(Cryptophytes)、蓝藻(Cyanobacteria)和甲藻(Dinoflagellates)(Xu et al, 2019)。总体来讲, 流式细胞术是进行微微型浮游植物细胞定量的有效方法, HPLC色素法可以提供微微型浮游植物群落结构的全面信息。因此, 两种方法相结合对海洋中APP生物量和群落组成开展研究, 能够有效取长补短, 并在世界多个海域开展了成功应用(Eker-Develi et al, 2008; Miranda-Alvarez et al, 2020; Anil et al, 2022)。
珠江是中国第二大河流, 珠江流域是中国最发达的地区之一。近几十年来, 珠江口及邻近海域受到各种人类活动(如施肥、灌溉、污水排放、大坝建设等)的严重影响, 海洋生态系统发生了快速变化(Mai et al, 2002)。自20世纪70年代以来, 珠江口海域水体中无机氮(DIN)、无机磷(DIP)以及氮磷比(N/P)均显著增加, 目前水体富营养化程度较高, 且浮游植物生长受到一定程度的磷限制(党二莎等, 2019; Niu et al, 2020; Zhong et al, 2021)。近几十年来, 该海域浮游植物群落发生了变化。在20世纪70~80年代, 硅藻[例如角毛藻属(Chaetoceros spp.)和中肋骨条藻(Skeletonema costatum)]在浮游植物类群中占优势, 而到了21世纪10年代, 硅藻与非硅藻[例如中肋骨条藻(Skeletonema costatum)、异弯藻属(Heterosigma sp.)和夜光藻属(Noctiluca sp.)]共同占主导地位(Huang et al, 2004; Zhu et al, 2018)。此外, 无机氮和无机磷浓度的增加导致珠江口多次发生藻华事件(HABs)(尤其是甲藻和硅藻)(姚艳欣等, 2021)。Li等(2019)在珠江口雨季发现聚球藻水华暴发。在整个河口, APP贡献了30%的浮游植物总生物量, 表明这些生物量(尤其是聚球藻)是浮游植物的重要组成部分。先前研究主要集中在基于流式细胞技术分析微微型浮游植物的时空分布特征(Huang et al, 2004; Gui et al, 2020), 而有关珠江口海域微微型浮游植物群落结构及其对环境变化响应的研究非常有限。本文采用HPLC色素法结合流式细胞术, 分析了珠江口不同门类APP的时空分布, 探索了不同环境因子对APP分布的影响, 并且讨论了流式细胞术与CHEMTAX在微微型浮游生物研究中的差异性和优缺点, 以期为珠江口APP的研究提供借鉴。
1 材料与方法 1.1 研究地点和采样本研究在2013年春季(5月29日至31日)、夏季(8月4日至6日)和秋季(11月23日至25日)在珠江口及其邻近海域进行了调查采样, 共布设17个站位, 调查船系当地渔船(图 1)。温度、盐度和溶解氧通过YSI 556多参数仪(YSI, 美国)进行现场测量。用5 L Niskon采水器采集表层0.5 m深度海水, 经200 μm的筛绢预过滤后, 在弱真空条件下(< 0.03 MPa)依次使用孔径为20 μm尼龙滤膜、2.7 μm玻璃纤维膜(GF/D)、0.7 μm玻璃纤维膜(GF/F)进行分级过滤3 L海水。过滤后, 将滤膜包裹在锡箔纸中, 并投入液氮中冷冻以进行后续色素分析。本文将GF/F结果(粒径为0.7~2.7 μm)定义为“Pico级”色素进行研究。在每个采样站位, 将100 mL过滤后的海水放入塑料瓶中, 并储存在–20 ℃冰箱中用于后续的营养盐分析。经20 μm筛绢预过滤后, 将三份样品(1.3 mL)用甲醛(2%最终浓度)在2 mL冷冻管中在黑暗中固定15 min, 并置于液氮中用于流式细胞术分析。
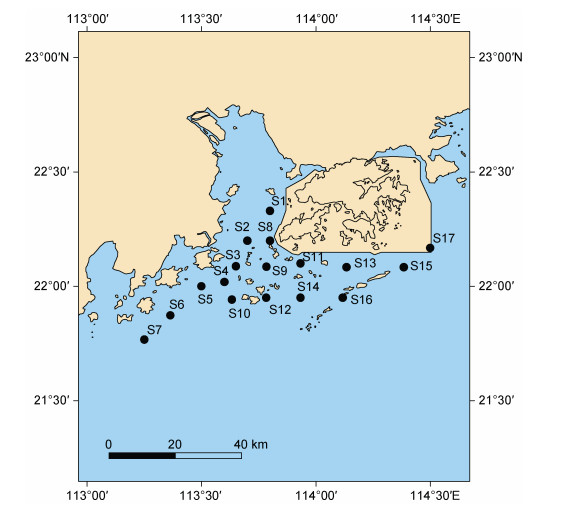 |
| 图 1 珠江口及邻近海域采样站位 Fig. 1 Sampling stations in the Zhujiang (Pearl) River Estuary and adjacent waters |
在实验室使用Skalar San++连续流动分析仪分析硝酸盐(NO3–)、亚硝酸盐(NO2–)、铵盐(NH)、磷酸盐(DIP)。DIN包括硝酸盐(NO3–)、亚硝酸盐(NO2–)、铵盐(NH)(Strickland et al, 1972)。其中, 硝酸盐(NO3–)、亚硝酸盐(NO2–)、铵盐(NH)和磷酸盐(DIP)测试最小值分别为0.02、0.02、0.03和0.013 μmol/L。
1.3 光合色素提取和HPLC分析光合色素提取和HPLC分析程序根据Zapata等(2000)进行。将冷冻后的滤膜剪碎, 放入装满3 mL 95%甲醇的离心管中, 然后将离心管在冰水浴中超声处理5 min, 在4 ℃下以1 500 g离心3 min。随后用0.22 μm PTFE膜过滤上清液, 以去除细胞和膜碎片。所有步骤均在弱光或无光条件下进行, 以防止光线造成色素分解。
HPLC分析采用Agilent 1200系列, 配置1315C二极管阵列检测器, 色谱柱为Waters Symmetry C8 (Eclipse XDB, 150×4.6 nm, 粒径3.5 μm), 于440 nm波长条件下检出色谱峰。所采用的22种色素标准品从丹麦DHI购买, 包括Mg DVP、二乙烯基叶绿素a (DV chl a)、脱镁叶绿酸a (Pheide a)、脱镁叶绿素a (Phe a)、叶绿素类a (chl a)、chl b、chl c2、chl c3、岩藻黄素(Fuco)、19′-己酰基氧化岩藻黄素(Hex- Fuco)、β-胡萝卜素(β, β-Car)、多甲藻素(Peri)、19′-丁酰基氧化岩藻黄素(But-Fuco)、硅甲藻黄素(Diadino)、别藻黄素(Allo)、硅藻黄素(Diato)、叶黄素(Lut)、甲藻黄素(Dino)、紫黄素(Viola)、新黄素(Neo)、玉米黄素(Zea)和青绿黄素(Pras)。
1.4 流式细胞分析APP细胞丰度分析使用FACSCalibur流式细胞仪(Becton Dickinson公司), 参数设置如下: FL1 (530/30 BP)、FL2 (585/42 BP)、FL3 (670 LP)和FL4 (661/16 BP)。本研究未发现原绿球藻的存在。聚球藻包含两个亚组, 即富含藻红蛋白的聚球藻(PE-rich Syn)和富含藻蓝蛋白的聚球藻(PC-rich Syn)(Jiang et al, 2016)。由于两个聚球藻亚组都含有玉米黄素, 因此本研究使用了其丰度的总和。
1.5 CHEMTAX分析本研究使用CHEMTAX软件来计算不同微微型浮游生物对叶绿素a的贡献(Mackey et al, 1996; Wright et al, 2009)。初始色素比值矩阵参考相关文献(Schlüter et al, 2000; Henriksen et al, 2002)(表 1)。将初始矩阵的每个比率乘以随机函数, 以获得一系列60个色素比值以优化矩阵。本文对3次航行分别进行CHEMTAX分析。
| 浮游植物类群 | chl c3 | chl c2 | But-Fuco | Fuco | Hex-Fuco | Pras | Allo | Zea | chl b | Peri | chl a |
| 硅藻 | 0.115 | 0.299 | 0.78 | 1 | |||||||
| 定鞭藻 | 0.152 | 0.139 | 0.008 | 0.073 | 0.685 | 1 | |||||
| 绿藻 | 0.063 | 0.311 | 1 | ||||||||
| 青绿藻 | 0.439 | 1.157 | 0.568 | 1 | |||||||
| 金藻 | 0.197 | 0.414 | 0.702 | 0.317 | 1 | ||||||
| 隐藻 | 0.053 | 0.339 | 1 | ||||||||
| 蓝藻 | 0.939 | 1 | |||||||||
| 甲藻 | 0.093 | 0.375 | 1 |
本文使用SPSS软件(IBM SPSS Statistics 23)进行数据分析; 通过单因素方差分析(LSD)评估了三次航行期间环境参数的差异(以P < 0.05作为显著性差异); 通过线性拟合分析评估盐度、温度、营养盐与微微型浮游植物丰度之间的关系; 通过线性拟合分析评估细胞丰度(流式细胞计数)与chl a含量(CHEMTAX计算)之间的相关性。
通过CANOCO 5软件对环境变量、物种数据进行冗余分析(RDA): 采用两个数据矩阵, 第1个矩阵包括CHEMTAX和流式细胞术分析的浮游植物类群组成, 第2个矩阵由环境变量组成。
2 结果与分析 2.1 水体环境与生物因素水文、化学和生物参数的平均值和范围如表 2所示。调查期间, 表层水体平均温度在8月(夏季)显著高于5月和11月(春、秋季) (表 2)。除11月外, 温度高值区出现调查区域西南部(图 2)。平均盐度从春季到秋季逐渐增加(表 2), 高盐度区域主要出现在调查区域东部, 西南区域盐度则表现出季节性变化, 在秋季显著高于春夏两季(图 2)。平均透明度在夏季达到最大值(表 2); 在空间上, 低透明度(< 1 m)更多出现在低盐度的海域(图 2)。DIN平均浓度的变化与盐度的变化相反, 最大值出现在5月(表 2), 在研究区域西部通常出现高浓度(图 2)。平均DIP浓度在夏季最高, 其次是春季, 3次航行的平均DIP浓度没有显著差异(表 2), 高浓度DIP出现在研究区域西部(图 2)。此外, 平均氮磷比(N/P)波动较大, 在夏季最高(表 2)。
| 理化指标 | 5月 | 8月 | 11月 |
| 物理和化学指标 | |||
| 温度/℃ | 27.52 (25.40~30.04) a | 29.85 (28.30~32.10) b | 22.19 (20.15~23.5) c |
| 盐度 | 16.45 (8.80~20.00) a | 21.01 (9.14~31.09) b | 29.85 (19.35~35.70) c |
| 透明度/m | 1.09 (0.50~1.80) a | 2.84 (0.50~5.00) b | 1.01 (0.50~1.80) a |
| 悬浮颗粒物/(mg/L) | 10.67 (6.37~16.34) a | 12.72 (3.99~30.87) a | 21.43 (6.54~82.72) b |
| DIN浓度/(μmol/L) | 86.28 (68.98~103.18) a | 66.08 (23.42~105.69) b | 14.06 (3.67~33.79) c |
| DIP浓度/(μmol/L) | 0.28 (0.24~0.33) a | 0.19 (0.10~0.54) a | 0.29 (0.03~0.96) a |
| DIN/DIP | 312.80(239.82~384.97) a | 387.39 (172.78~778.55) b | 60.86 (21.66~177.59) c |
| 流式细胞术计数 | |||
| 聚球藻丰度(103 cells/mL) | 252.91 (3.26~716.33) a | 146.54 (6.60~715.36) a | 10.44 (2.67~22.56) b |
| 微微型真核生物(103 cells/mL) | 26.04 (4.48~72.28) a | 3.63 (0.34~10.64) b | 1.40 (0.18~5.21) b |
| 色素浓度 | |||
| chl a浓度/(ng/L) | 47.56 (2.18~179.82) a | 39.57(1.81~335.53) a | 8.34 (0.48~20.44) a |
| Fuco浓度/(ng/L) | 144.35 (6.24~458.39) a | 33.43 (0~101.94) b | 17.26 (8.09~33.11) b |
| Zea浓度/(ng/L) | 69.50 (3.79~244.28) a | 62.26 (6.41~419.60) a | 6.65 (0.41~12.86) b |
| Pras浓度/(ng/L) | 49.34 (3.41~156.91) a | 7.55 (0~29.24) a | 7.33 (1.76~10.88) b |
| But-Fuco浓度/(ng/L) | 3.72 (0.86~7.91) a | 0.38 (0~2.65) b | 0.23 (0~1.81) b |
| Peri浓度/(ng/L) | 5.36 (0~14.66) a | 4.54 (0~21.21) a | 0.13 (0~2.28) b |
| Allo浓度/(ng/L) | 5.98 (1.08~16.64) a | 1.22 (0~6.44) b | 1.00 (0~2.55) b |
| CHEMTAX计算 | |||
| 硅藻/(ng/L) | 0.19 (0~2.18) a | 0.10 (0~1.09) b | 0.02 (0~0.27) c |
| 甲藻/(ng/L) | 1.39 (0.12~3.60) a | 1.00 (0~6.68) a | 0.04 (0~0.61) b |
| 青绿藻/(ng/L) | 16.23 (0.08~51.84) a | 6.17 (0.06~36.94) b | 3.71 (0.21~8.38) b |
| 隐藻/(ng/L) | 5.89 (0.46~18.16) a | 2.29 (0~16.20) b | 1.06 (0~3.36) b |
| 定鞭藻/(ng/L) | 4.24 (0~17.72) a | 1.22 (0~3.26) b | 0.46 (0~1.63) b |
| 绿藻/(ng/L) | 1.06 (0~17.16) a | 10.38 (0~130.02) b | 0.33 (0~4.31) c |
| 金藻/(ng/L) | 1.17 (0.18~2.64) a | 0.15 (0~1.01) b | 0.08 (0~0.68) b |
| 聚球藻/(ng/L) | 20.06 (0.32~72.57) a | 18.27 (0~150.37) a | 2.64 (0.14~6.02) b |
| 注: 同一行中具有不同上标字母的值表示显著差异(LSD检验, P < 0.05) | |||
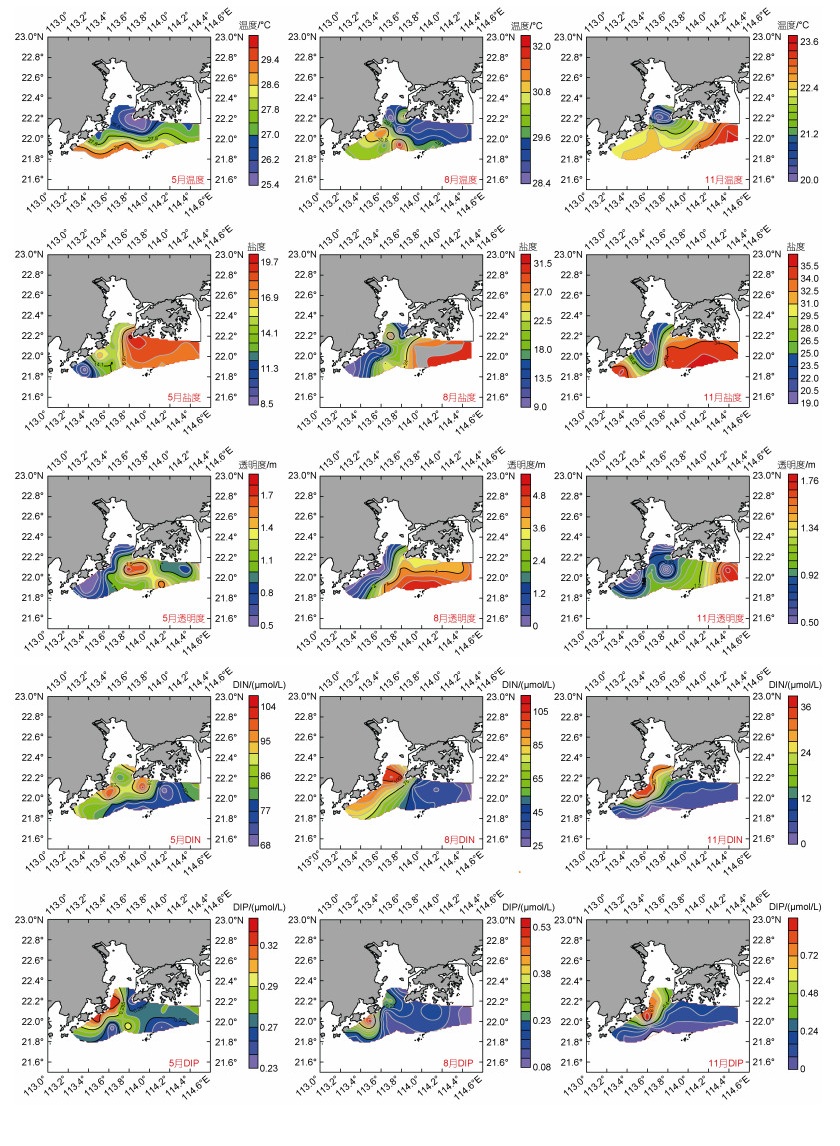 |
| 图 2 珠江口表层海水中温度、盐度、透明度、DIN和DIP的季节分布 Fig. 2 Seasonal distribution of temperature, salinity, Secchi depth, DIN and DIP in surface seawater of the Zhujiang River estuary |
流式细胞分析结果表明, APP包含Syn和微微型真核浮游生物(PEUKs), 未观察到原绿球藻(Prochlorococcus) (表 2)。Syn和PEUKs的平均丰度在5月最高, 在8~11月逐渐下降; Syn细胞丰度明显高于PEUKs (表 2)。Syn平均丰度在5月和8月显著高于11月(P < 0.05), 最高丰度出现在5月S4站位(716.33×103 cells/mL; 图 3)。PEUK平均丰度在春季最高(26.04×103 cells/mL), 显著高于8和11月(P < 0.05)。PEUK最高丰度也出现在5月S4站位(72.28×103 cells/mL; 图 3)。在整个调查期间, Syn高丰度出现在研究区域西南部, 而PEUK丰度未显示出明显的空间分布规律(图 3)。
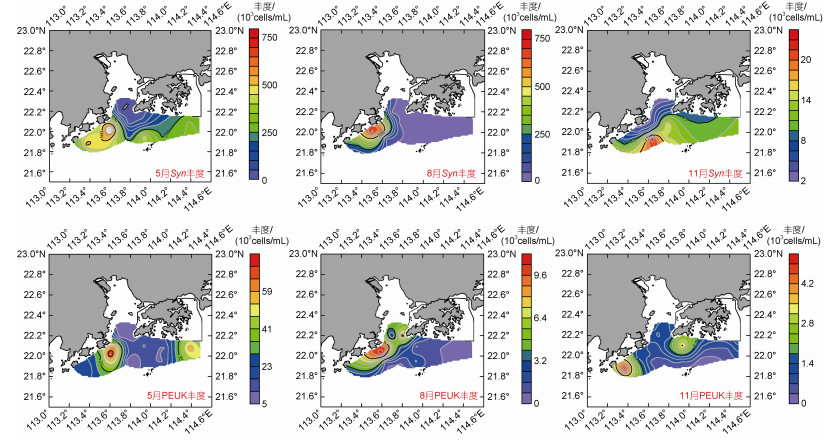 |
| 图 3 珠江口自养微微型浮游植物丰度的季节分布 Fig. 3 Seasonal distribution of autotrophic picoplankton abundance in the Zhujiang River estuary |
整个调查期间, APP细胞丰度与温度、盐度的变化关系如图 4所示。Syn丰度与温度呈现显著正相关(P < 0.05), 但与盐度呈负相关(P > 0.05)。Syn丰度高值主要出现在温度26~32℃、盐度8~20范围内。与此相似, PEUKs丰度高值主要出现在温度26~30℃、盐度12~20范围内。DIN浓度在随盐度变化呈显著性负相关(P < 0.05), DIP浓度在随盐度变化呈负相关, 但并不显著(P > 0.05)。
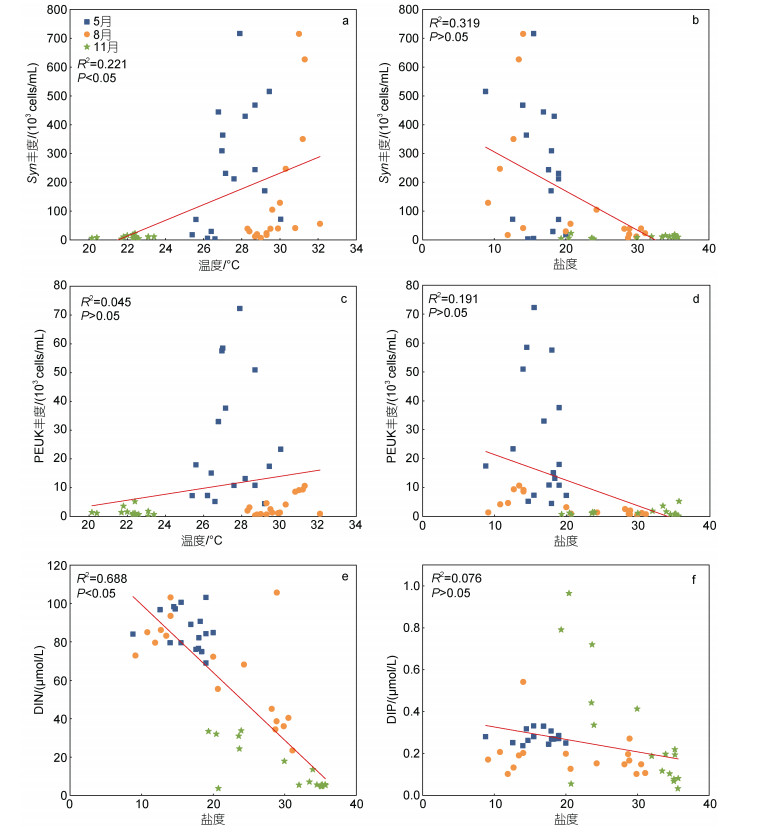 |
| 图 4 三个航次中不同温度和盐度条件下的微微型浮游植物密度和营养盐浓度的变化 Fig. 4 Changes of picoplankton density and nutrient concentration under different temperature and salinity in three voyages 注: 线性拟合是基于全部月份数据 |
Chl a平均浓度在春季最高(47.56 ng/L), 秋季最低(8.34 ng/L), 但三个季节并没有显著差异(P > 0.05; 表 2)。与叶绿素a类似, Fuco、Zea、Pras、But-fuco、Peri和Allo等色素浓度均呈现从春季到秋季下降的趋势(表 2)。CHEMTAX分析表明, 该海域APP包括8个主要类群, 包括硅藻、定鞭藻、绿藻、青绿藻、金藻、隐藻、聚球藻和甲藻(表 2)。基于CHEMTAX估算的Syn生物量(即Chl a, 简称CHEMTAX生物量, 下文相同)在调查期间为优势种群, 尤其是在春季和夏季, 但秋季显著下降(表 2; 图 5)。在春季, Syn高CHEMTAX生物量主要集中在调查海域的中东部(站位S3、S4、S14、S15、S17), 在夏季则主要集中在中西部(站位S3~S7; 图 5)。在春季, 青绿藻对总叶绿素a的贡献仅次于Syn, 而其在秋季贡献率超过了Syn。其他浮游植物类群, 包括甲藻、隐藻、青绿藻、定鞭藻和金藻, 从春季到秋季均有不同程度的贡献(图 5)。
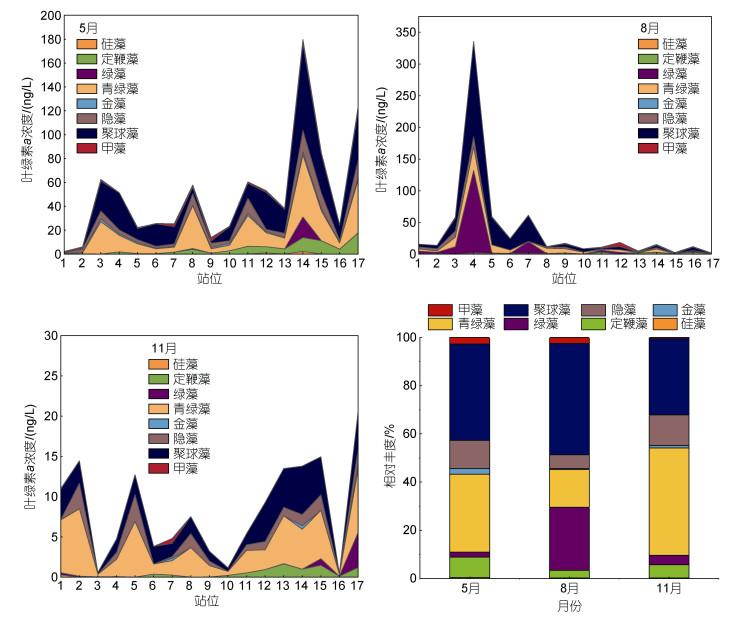 |
| 图 5 珠江口不同季节各浮游植物功能类群对叶绿素a含量的贡献 Fig. 5 Contribution of picoplankton functional groups to chlorophyll a content in different seasons in the Zhujiang River estuary |
微微型浮游植物与环境因子相关性冗余分析表明, 温度(Temp)、盐度(Sal)、DIN、DIP、悬浮颗粒物(SPM)、透明度(SeccDept)、N/P与APP的时空分布显著相关(图 6)。从整个调查期间来看, RDA两轴共计解释91.69%的物种变化。Syn (细胞丰度与CHEMTAX生物量)、绿藻、硅藻和甲藻CHEMTAX生物量聚集在一起, 与温度、N/P比成正相关。PEUKs细胞丰度及青绿藻、隐藻、定鞭藻、金藻的CHEMTAX生物量则受温度影响很小, 但与DIN呈一定正相关关系。
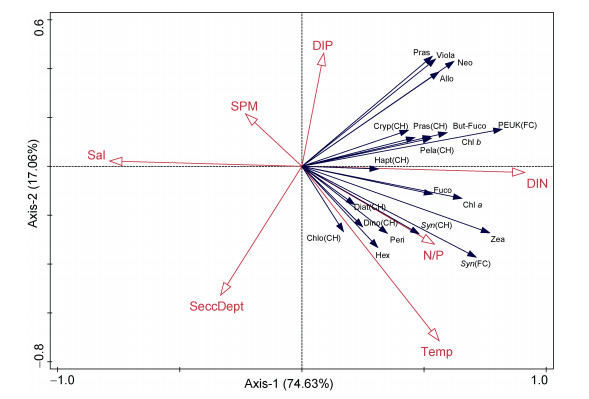 |
| 图 6 环境因子与微微型浮游植物的RDA排序 Fig. 6 RDA ranking of environmental factors and picoplankton 注: Diat: 硅藻; Hapt: 定鞭藻; Chlo: 绿藻; Pras: 青绿藻; Pela: 金藻; Cryp: 隐藻; Syn: 聚球藻; Dino: 甲藻; CH: CHEMTAX; FC: 流式细胞术; Seccdept: 透明度; Temp: 温度; Sal: 盐度 |
本研究使用线性拟合分析来评估HPLC色素法和流式细胞术之间的一致性。分析结果表明, 整个调查期间, Zea浓度与Syn丰度之间均存在正相关关系, 但仅在春季和夏季达到显著水平(P < 0.01; 图 7)。与此相似, Syn细胞丰度与CHEMTAX生物量之间也呈现正相关, 同样仅在春季和夏季达到显著水平(P < 0.01; 图 8)。PEUK细胞丰度与CHEMTAX生物量之间虽然存在正相关关系, 但春季和夏季显著性水平低于Syn (P < 0.05; 图 9)。
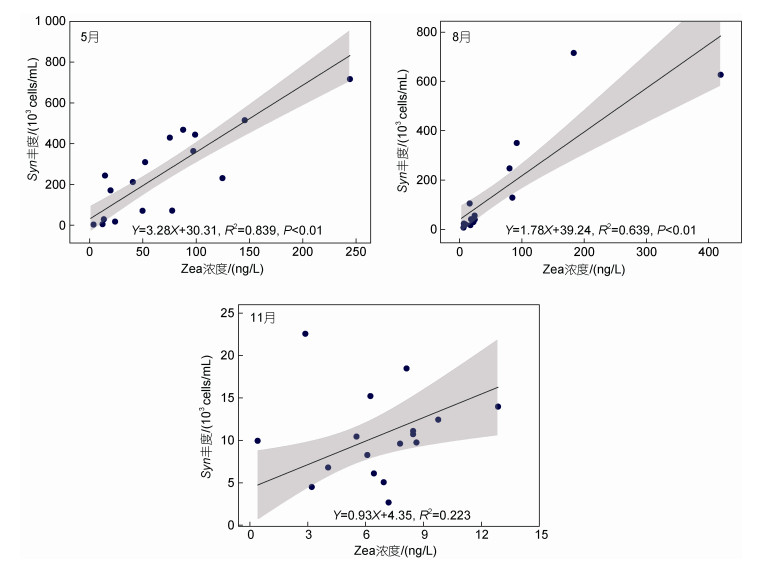 |
| 图 7 Syn丰度与Zea浓度的线性关系 Fig. 7 Linear relationship between Syn abundance and Zea concentration |
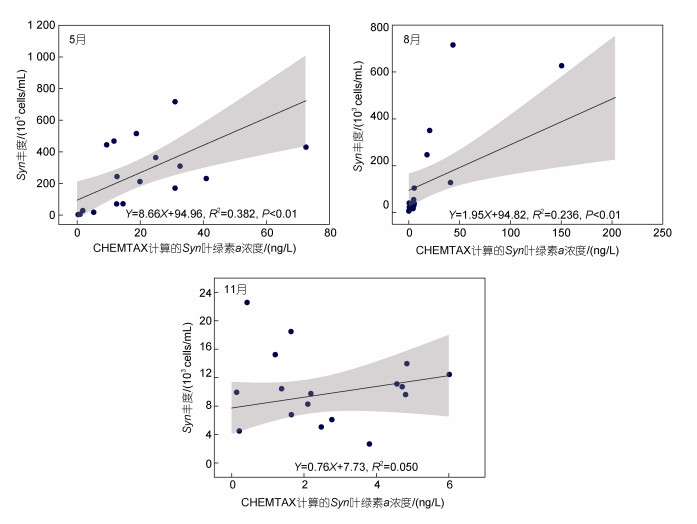 |
| 图 8 Syn丰度与Syn叶绿素a浓度(CHEMTAX计算)的线性关系 Fig. 8 Linear relationship between Syn abundance and Syn chlorophyll a concentration (calculated by CHEMTAX) |
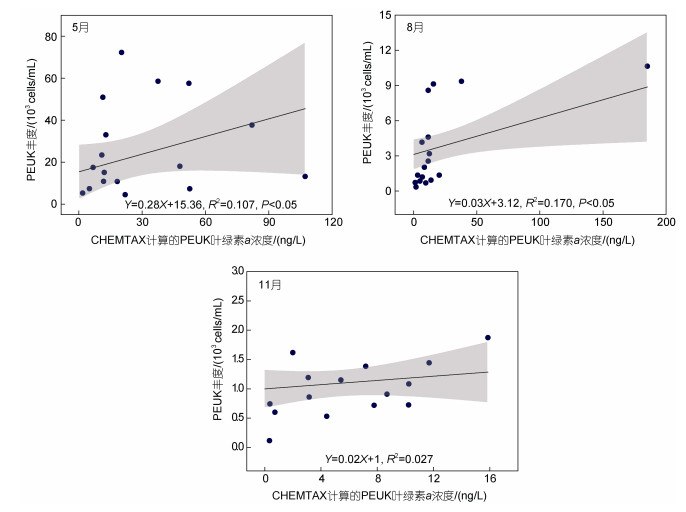 |
| 图 9 PEUK丰度与PEUK叶绿素a浓度(CHEMTAX计算)的线性关系 Fig. 9 Linear relationship between PEUK abundance and PEUK chlorophyll a concentration (calculated by CHEMTAX) |
在珠江口水域, 有关APP丰度时空分布已有诸多报道, 但以往研究主要是采用流式细胞技术对APP进行分析(Ni et al, 2015; 张渊洲等, 2015), 有关其种群结构分布及影响因素的研究尚比较少见。基于流式细胞分析结果表明, 在珠江口水域APP主要包括了Syn和PEUKs两大类群(表 2), 这与先前研究结果相一致(张霞等, 2013)。光合色素化学分类分析显示, APP包括了硅藻、定鞭藻、绿藻、青绿藻、金藻、隐藻、聚球藻和甲藻8个类群, 该法能够解析珠江口APP的种群结构的组成特征。流式细胞分析和光合色素化学分类方法的联合应用, 进一步丰富了我们对该海域APP生物种群的深入认识。
本文研究表明, 珠江口水域APP组成的重要特征是Syn呈现出较高的生物量和比重, Syn最高丰度达到0.72×106 cells/mL (出现在5月S4站位)(表 2; 图 3, 5)。与此相似, Li等(2019)在2015年6月在该海域观测到Syn最高丰度0.70×106 cells/mL; Xia等(2020)在2014年7月观测到的最高丰度为1.0×106 cells/mL。以上结果表明, 该海域在春夏季存在Syn高丰度暴发的可能性。相对于渤海海域(Yan et al, 2020), 珠江口水域聚球藻高发时间较长(即5~8月; 表 2)。从全球海洋范围来看, 在佛罗里达湾和Comacchio潟湖(亚得里亚海)等海域均发生过Syn藻华暴发的现象(表 3)。海洋聚球藻可产生微囊藻毒素(microcystin)、β-甲氨基-L-丙氨酸(BMAA)、脂多糖(LPS)和磺酸脂(sulfonolipid)等次生代谢物质, 这些有毒物质能够沿着食物链传递, 对海洋动物及人类造成威胁(Śliwińska et al, 2018)。Syn水华对生态系统具有较大破坏性, 能够导致海绵动物大规模死亡、龙虾栖息地丧失甚至破坏改变食物网结构, 进而对生态系统造成危害(Sunda et al, 2006)。总体来讲, 珠江口海域Syn在春夏季能够达到较高密度, 虽然与国内外多个藻华海域相比尚处于较低水平(表 3), 但这种现象依然值得关注, 其对生态系统的影响有待深入研究。
| 地点 | 时间 | 聚球藻最高丰度/(106 cells/mL) | 参考文献 |
| 佛罗里达湾 | 1993.8~1997.10 | 5.0 | Phlips等(1999) |
| 佛罗里达湾 | 2006.7~2007.12 | 3.2 | Berry等(2015) |
| 纽斯河河口 | 2017.7~2018.12 | < 2.1 | Paerl等(2020) |
| 波罗的海 | 1986.1~1986.12 | 1.7 | Kuosa (1991) |
| 切萨皮克湾 | 2002.9~2007.2 | 3.3 | Wang等(2011) |
| Comacchio潟湖(亚得里亚海) | 2001 | 52.0 | Sorokin等(2010) |
| 彭萨科拉湾 | 1999.6~2001.11 | 3 000 | Murrell等(2004) |
| 珠江口 | 2015.6 | 0.7 | Li等(2019) |
| 珠江口 | 2014.7 | 1.0 | Xia等(2020) |
| 珠江口 | 2013.5 | 0.7 | 本研究 |
| 渤海中部 | 2015.8 | 2.9 | Yan等(2020) |
先前研究表明, 温度是影响聚球藻繁殖和生长的关键因素之一(Wang et al, 2018)。Rajaneesh等(2015)研究表明, 处于热带的科钦河口(印度西南海岸) Syn生长的最适温度范围为27~30 ℃。与此相似, 在本研究中珠江口水域Syn丰度高值主要出现在温度26~ 32 ℃范围内(图 4)。相比之下, 处于温带的渤海中部海域, Syn丰度高峰期水体温度在23.0~26.1 ℃范围内(8月), 低于Rajaneesh等(2015)和本研究中聚球藻高发时的温度范围。Paerl等(2009)指出, 气候变化是蓝细菌水华进一步扩大的潜在催化剂, 蓝藻通常在较高的温度下(> 25 ℃)比其他浮游植物如硅藻和绿藻等生长速度更快。在21世纪末, 全球气温预计将再上升1.5~5 ℃。据预测, 近岸海域尤其是河口海域受气候变化的影响最大。温度升高可能将导致Syn等微微型蓝细菌生长速度加快和生态位扩展, 进而有益于其藻华的发生(Murrell et al, 2004; Flombaum et al, 2013)。
与先前研究相同(Eker-Develi et al, 2008; Wang et al, 2018; Yan et al, 2020), CHEMTAX分析得出了珠江口海域APP种群结构包括硅藻、定鞭藻、绿藻、青绿藻、金藻、隐藻、聚球藻和甲藻8个门类, 其中Syn是第一大优势种。APP种群结构具有明显的季节变化, 主要表现在Syn在春季和夏季占主导地位, 但在秋季显著下降(表 2; 图 5)。已有的研究显示, 除温度外, 营养盐也是影响APP种群结构时空变化的关键因素(吴文广等, 2018), 这在RDA分析中得到进一步证实(图 6)。本研究显示, 珠江口水域Syn丰度和生物量均与温度和DIN/DIP成正比, 这表明水体营养盐结构(高N/P比)可能是导致Syn高丰度的重要原因。全球高丰度聚球藻发生海区(表 3), 如美国佛罗里达湾、切萨皮克湾、亚得里亚海、中国珠江口和渤海海域, 都是典型的磷限制海域。相比真核浮游植物, 聚球藻(原核生物)具有较高的细胞表面积与体积比、较薄的表面扩散边界层, 单位生物量有更高的营养物质吸收效率, 在低浓度营养盐环境下能够获得较高的生长率, 从而在磷限制海域具有更高的竞争优势(Riegman et al, 1998)。另外, 在无机营养物胁迫环境中, 有机营养物质的相对浓度很高, 而聚球藻具有利用这些有机营养物的能力, 例如聚球藻能够通过活性磷酸酶将磷酸酯分解为磷酸盐从而得以利用(Glibert et al, 2004); 聚球藻(PCC 7942)还具有通过膜脂重构来适应磷限制的能力(Peng et al, 2019)。
已有的研究表明PEUKs具有丰富的物种多样性, 可以占据不同的生态位, 因此其能够全年存在, 且具有季节性演替(Jiao et al, 2005; 杨琳等, 2012)。本研究中青绿藻是最重要的PEUKs类群, 尤其在秋季成为APP生物量的第一优势种。先前研究证实, 青绿藻广泛存在于中国沿海(Yu et al, 2007; Wu et al, 2014; Yan et al, 2020)。Yu等(2007)使用HPLC色素法在胶州湾水域首次发现青绿藻大量存在。Wu等(2014)利用18S rDNA测序发现青绿藻在南海珠江口附近沿海地区的PEUKs总量中占了很大比例。以往的研究认为, 青绿藻在水域中普遍存在是由于其能够适应不同的光照和营养条件, 受环境变化影响较小(Not et al, 2004)。本研究显示, 青绿藻与DIN呈正相关关系, 表明营养盐是影响其时空分布的重要因素之一(图 6)。此外, Lan等(2013)报告青绿藻的丰度随着盐度的增加而减少, 青绿藻更适应低盐度环境, 这在本研究中得到进一步证实(图 6)。珠江口水域三个航次均发现少量硅藻的存在。硅藻的生物量虽然与温度呈正相关, 但是其生长仍然受到透明度的限制, 营养盐对其分布的影响较为有限(图 5, 6)。一般来说, 硅藻通常在低温和低光强度下生长旺盛, 且已被证明在低温下具有更高的DIN吸收速率(Lomas et al, 2000)。值得注意的是, 在调查期间, 甲藻贡献了一部分生物量, 但其存在受到怀疑(图 5)。已有的研究表明, 已知甲藻的最小粒径为5 μm (Massana, 2011; 白美娜, 2019)。因此本研究存在甲藻最可能的原因是在分级过滤过程中较大细胞的甲藻细胞破裂造成的(Tamm et al, 2018)。
为了比较流式细胞术和HPLC色素法的一致性, 本文进行了相关分析(图 7~9)。已有的研究表明Zea主要是由蓝藻产生, 但也存在于其他藻类(如青绿藻、绿藻)(Mackey et al, 1998)。本研究显示, Zea并不总是代表Syn的生物量。在春季和夏季, Syn在APP总生物量所占比例较高时, 其丰度与Zea浓度之间呈极显著相关性(P < 0.01)。然而, 随着秋季Syn在APP总生物量占比降低, Syn丰度与Zea浓度之间无显著相关性(图 5, 7)。与此相似, 当春季和夏季Syn贡献了大部分生物量时, Syn的CHEMTAX生物量与Syn丰度之间存在极显著正相关(P < 0.01; 图 8)。此外, 本研究显示PEUK的CHEMTAX生物量与PEUKs细胞数量之间存在正相关关系, 仅在春季和夏季呈显著水平(P < 0.05; 图 9)。上述结果表明, 流式细胞术与CHEMTAX在春季和夏季计算的结果相关性显著, 而在秋季生物量水平较低时存在一些差异。造成这一问题的原因可能有多种。首先, 初始色素比例的选择将导致计算结果的差异(邓春梅等, 2010), 这将导致在计算CHEMTAX生物量时产生误差, 尤其在细胞丰度较低时影响更大。此外, 特征色素与浮游植物种群之间的关系并非是唯一的, 不同的藻类可能具有相同的色素组合并进行色素叠加, 特别是对于PEUKs尤为显著(Mackey et al, 1998; 姚鹏等, 2003)。
4 结论本研究结合HPLC色素法和流式细胞术的结果, 揭示了珠江口三个航次APP群落结构的变化。珠江口海域APP由聚球藻(Syn)和微微型真核生物(PEUKs)组成, Syn丰度在所有航次APP丰度中占据主导地位。CHEMTAX确定了八个APP类群, 结果表明APP具有显著的季节演替。在春季和夏季, APP的CHEMTAX生物量以Syn为主, 而秋季生物量以青绿藻(Pras)为主。环境因素(特别是温度和营养盐)影响APP群落的组成与分布。此外, 在APP研究中, HPLC色素法和流式细胞术的结果在春季和夏季高生物量时期相关性显著, 而在秋季生物量水平较低时存在一些差异, 需要进一步研究。与传统的显微鉴定方法相比, 本文的研究结果表明流式细胞术和HPLC色素法组合使用的结果可靠, 流式细胞术是一种有效的细胞计数方法, HPLC色素法可以提供相对完整的群落结构信息, 特别是HPLC色素法在鉴定微小或破碎细胞方面发挥了重要作用。本研究也为未来珠江口APP的研究提供了参考。
王斌, 薛玮珏, 1998. 流式细胞术在海洋浮游植物研究中的应用. 海洋科学, (2): 21-23 |
邓春梅, 姚鹏, 刘淑霞, 等, 2010. 海洋浮游藻色素分析和化学分类研究进展. 中国海洋大学学报(自然科学版), 40(4): 91-98, 104 |
白美娜, 江涛, 陈飞羽, 等, 2019. 大亚湾大鹏澳牡蛎养殖临近海域自养微微型浮游生物种群分布特征. 海洋与湖沼, 50(1): 129-138 |
乐凤凤, 蔡昱明, 孙军, 等, 2015. 2009年冬、夏季南海北部超微型浮游生物的分布特征及其环境相关分析. 海洋学报, 37(12): 41-55 |
李明, 王焱, 胡俊, 等, 2017. 基于光合色素的海南八门湾及其毗邻水域浮游植物生物量及类群组成研究. 海洋环境科学, 36(3): 449-455, 467 |
杨琳, 汪岷, 刘冠群, 等, 2012. 胶州湾微微型浮游植物丰度及其与环境因子的相关性分析. 海洋与湖沼, 43(5): 967-975 |
吴文广, 张继红, 刘毅, 等, 2018. 獐子岛及邻近海域秋季浮游植物的粒级结构及其影响因素. 生态学报, 38(4): 1418-1426 |
张渊洲, 张健林, 杨清松, 等, 2015. 南海北部春季微微型浮游植物丰度的分布. 生物学杂志, 32(5): 58-62 DOI:10.3969/j.issn.2095-1736.2015.05.058 |
张霞, 黄小平, 施震, 等, 2013. 珠江口超微型浮游植物时空分布及其与环境因子的关系. 生态学报, 33(7): 2200-2211 |
姚艳欣, 陈楠生, 2021. 珠江口及其邻近海域赤潮物种的生物多样性研究进展. 海洋科学, 45(9): 75-90 |
姚鹏, 于志刚, 米铁柱, 2003. 海洋浮游藻类的化学分类法. 海洋环境科学, 22(1): 75-80 DOI:10.3969/j.issn.1007-6336.2003.01.016 |
党二莎, 唐俊逸, 周连宁, 等, 2019. 珠江口近岸海域水质状况评价及富营养化分析. 大连海洋大学学报, 34(4): 580-587 |
翟红昌, 宁修仁, 唐学玺, 等, 2010. HPLC色素分析技术在海洋浮游植物群落结构研究中的应用. 中国海洋大学学报(自然科学版), 40(11): 71-78 |
ANIL P, MADHU N V, 2022. Comparative account on phytoplankton functional community dynamics in the Alappuzha mud bank region (southwest coast of India) by HPLC-CHEMTAX and microscopy approaches. Continental Shelf Research, 236: 104669 DOI:10.1016/j.csr.2022.104669 |
BARLOW R, KYEWALYANGA M, SESSIONS H, et al, 2008. Phytoplankton pigments, functional types, and absorption properties in the Delagoa and Natal Bights of the Agulhas ecosystem. Estuarine, Coastal and Shelf Science, 80(2): 201-211 DOI:10.1016/j.ecss.2008.07.022 |
BELL T, KALFF J, 2001. The contribution of picophytoplankton in marine and freshwater systems of different trophic status and depth. Limnology and Oceanography, 46(5): 1243-1248 DOI:10.4319/lo.2001.46.5.1243 |
BERRY D L, GOLESKI J A, KOCH F, et al, 2015. Shifts in cyanobacterial strain dominance during the onset of harmful algal blooms in Florida Bay, USA. Microbial Ecology, 70(2): 361-371 DOI:10.1007/s00248-014-0564-5 |
CHAI C, JIANG T, CEN J Y, et al, 2016. Phytoplankton pigments and functional community structure in relation to environmental factors in the pearl river estuary. Oceanologia, 58(3): 201-211 DOI:10.1016/j.oceano.2016.03.001 |
CHISHOLM S W, FRANKEL S L, GOERICKE R, et al, 1992. Prochlorococcus marinus nov. gen. nov. sp.: an oxyphototrophic marine prokaryote containing divinyl chlorophyll a and b. Archives of Microbiology, 157(3): 297-300 DOI:10.1007/BF00245165 |
CHISHOLM S W, OLSON R J, ZETTLER E R, et al, 1988. A novel free-living prochlorophyte abundant in the oceanic euphotic zone. Nature, 334(6180): 340-343 DOI:10.1038/334340a0 |
EKER-DEVELI E, BERTHON J F, VAN DER LINDE D, 2008. Phytoplankton class determination by microscopic and HPLC-CHEMTAX analyses in the southern Baltic Sea. Marine Ecology Progress Series, 359: 69-87 DOI:10.3354/meps07319 |
FLOMBAUM P, GALLEGOS J L, GORDILLO R A, et al, 2013. Present and future global distributions of the marine Cyanobacteria Prochlorococcus and Synechococcus. Proceedings of the National Academy of Sciences of the United States of America, 110(24): 9824-9829 DOI:10.1073/pnas.1307701110 |
GAULKE A K, WETZ M S, PAERL H W, 2010. Picophytoplankton: a major contributor to planktonic biomass and primary production in a eutrophic, river-dominated estuary. Estuarine, Coastal and Shelf Science, 90(1): 45-54 DOI:10.1016/j.ecss.2010.08.006 |
GLIBERT P M, HEIL C A, HOLLANDER D, et al, 2004. Evidence for dissolved organic nitrogen and phosphorus uptake during a cyanobacterial bloom in Florida Bay. Marine Ecology Progress Series, 280: 73-83 DOI:10.3354/meps280073 |
GUI J, WEI Y Q, SUN J, et al, 2020. Summer phytoplankton assemblages and carbon biomass in the northern south China sea. Continental Shelf Research, 210: 104276 DOI:10.1016/j.csr.2020.104276 |
HENRIKSEN P, RIEMANN B, KAAS H, et al, 2002. Effects of nutrient-limitation and irradiance on marine phytoplankton pigments. Journal of Plankton Research, 24(9): 835-858 DOI:10.1093/plankt/24.9.835 |
HUANG L M, JIAN W J, SONG X Y, et al, 2004. Species diversity and distribution for phytoplankton of the Pearl River estuary during rainy and dry seasons. Marine Pollution Bulletin, 49(7/8): 588-596 |
HUANG B Q, LIN X J, LIU Y, et al, 2002. Ecological study of picoplankton in northern south China sea. Chinese Journal of Oceanology and Limnology, 20(S1): 22-32 |
JIANG T, CHAI C, WANG J F, et al, 2016. Temporal and spatial variations of abundance of phycocyanin- and phycoerythrin- rich Synechococcus in Pearl River Estuary and adjacent coastal area. Journal of Ocean University of China, 15(5): 897-904 DOI:10.1007/s11802-016-3011-z |
JIAO N Z, YANG Y H, HONG N, et al, 2005. Dynamics of autotrophic picoplankton and heterotrophic bacteria in the East China Sea. Continental Shelf Research, 25(10): 1265-1279 DOI:10.1016/j.csr.2005.01.002 |
KUOSA H, 1991. Picoplanktonic algae in the northern Baltic Sea: seasonal dynamics and flagellate grazing. Marine Ecology Progress Series, 73: 269-276 DOI:10.3354/meps073269 |
LAN W L, LI M M, LI T S, 2013. Phytoplankton community structure based on pigment composition in Qinzhou bay during average water period. Acta Ecologica Sinica, 33(20): 6595-6603 DOI:10.5846/stxb201302260301 |
LATASA M, 2007. Improving estimations of phytoplankton class abundances using CHEMTAX. Marine Ecology Progress Series, 329: 13-21 DOI:10.3354/meps329013 |
LI J J, CHEN Z Z, JING Z Y, et al, 2019. Synechococcus bloom in the Pearl River Estuary and adjacent coastal area-with special focus on flooding during wet seasons. Science of the Total Environment, 692: 769-783 DOI:10.1016/j.scitotenv.2019.07.088 |
LIU H B, CHANG J, TSENG C M, et al, 2007. Seasonal variability of picoplankton in the Northern South China Sea at the SEATS station. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 54(14/15): 1602-1616 |
LOMAS M W, GLIBERT P M, 2000. Comparisons of nitrate uptake, storage, and reduction in marine diatoms and flagellates. Journal of Phycology, 36(5): 903-913 DOI:10.1046/j.1529-8817.2000.99029.x |
MACKEY D J, HIGGINS H W, MACKEY M D, et al, 1998. Algal class abundances in the western equatorial Pacific: estimation from HPLC measurements of chloroplast pigments using CHEMTAX. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 45(9): 1441-1468 |
MACKEY M D, MACKEY D J, HIGGINS H W, et al, 1996. CHEMTAX-a program for estimating class abundances from chemical markers: Application to HPLC measurements of phytoplankton. Marine Ecology Progress Series, 144: 265-283 |
MAI B X, FU J M, SHENG G Y, et al, 2002. Chlorinated and polycyclic aromatic hydrocarbons in riverine and estuarine sediments from Pearl River Delta, China. Environmental Pollution, 117(3): 457-474 |
MASSANA R, 2011. Eukaryotic picoplankton in surface oceans. Annual Review of Microbiology, 65: 91-110 |
MIRANDA-ALVAREZ C, GONZÁLEZ-SILVERA A, SANTAMARÍA- DEL-ANGEL E, et al, 2020. Phytoplankton pigments and community structure in the northeastern tropical pacific using HPLC-CHEMTAX analysis. Journal of Oceanography, 76(2): 91-108 |
MURRELL M C, LORES E M, 2004. Phytoplankton and zooplankton seasonal dynamics in a subtropical estuary: importance of cyanobacteria. Journal of Plankton Research, 26(3): 371-382 |
NI Z X, HUANG X P, ZHANG X, 2015. Picoplankton and virioplankton abundance and community structure in Pearl River Estuary and Daya Bay, South China. Journal of Environmental Sciences, 32: 146-154 |
NIU L X, LUO X X, HU S, et al, 2020. Impact of anthropogenic forcing on the environmental controls of phytoplankton dynamics between 1974 and 2017 in the Pearl River estuary, China. Ecological Indicators, 116: 106484 |
NOT F, LATASA M, MARIE D, et al, 2004. A single species, Micromonas pusilla (Prasinophyceae), dominates the eukaryotic picoplankton in the western English channel. Applied and Environmental Microbiology, 70(7): 4064-4072 |
PAERL H W, HUISMAN J, 2009. Climate change: a catalyst for global expansion of harmful cyanobacterial blooms. Environmental Microbiology Reports, 1(1): 27-37 |
PAERL H W, VALDES L M, PINCKNEY J L, et al, 2003. Phytoplankton photopigments as indicators of estuarine and coastal eutrophication. BioScience, 53(10): 953-964 |
PAERL R W, VENEZIA R E, SANCHEZ J J, et al, 2020. Picophytoplankton dynamics in a large temperate estuary and impacts of extreme storm events. Scientific Reports, 10(1): 22026 |
PELTOMAA E, OJALA A, 2012. Meteorological drivers of the dynamics of autotrophic picoplankton. Freshwater Biology, 57(5): 1005-1016 |
PENG Z, FENG L, WANG X X, et al, 2019. Adaptation of Synechococcus sp. PCC 7942 to phosphate starvation by glycolipid accumulation and membrane lipid remodeling. Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids, 1864(12): 158522 |
PHLIPS E J, BADYLAK S, LYNCH T C, 1999. Blooms of the picoplanktonic cyanobacterium Synechococcus in Florida Bay, a subtropical inner-shelf lagoon. Limnology and Oceanography, 44(4): 1166-1175 |
QIU D J, HUANG L M, ZHANG J L, et al, 2010. Phytoplankton dynamics in and near the highly eutrophic Pearl River Estuary, South China Sea. Continental Shelf Research, 30(2): 177-186 |
RAJANEESH K M, MITBAVKAR S, ANIL A C, et al, 2015. Synechococcus as an indicator of trophic status in the Cochin backwaters, west coast of India. Ecological Indicators, 55: 118-130 |
RIEGMAN R, FLAMELING I A, NOORDELOOS A A M, 1998. Size-fractionated uptake of ammonium, nitrate and urea and phytoplankton growth in the North Sea during spring 1994. Marine Ecology Progress Series, 173: 85-94 |
SCHLÜTER L, MØHLENBERG F, HAVSKUM H, et al, 2000. The use of phytoplankton pigments for identifying and quantifying phytoplankton groups in coastal areas: testing the influence of light and nutrients on pigment/chlorophyll a ratios. Marine Ecology Progress Series, 192: 49-63 |
ŚLIWIŃSKA-WILCZEWSKA S, MACULEWICZ J, BARREIRO FELPETO A, et al, 2018. Allelopathic and bloom-forming picocyanobacteria in a changing world. Toxins, 10(1): 48 |
SØNDERGAARD M, 1991. Phototrophic picoplankton in temperate lakes: seasonal abundance and importance along a trophic gradient. Internationale Revue der Gesamten Hydrobiologie und Hydrographie, 76(4): 505-522 |
SOROKIN Y I, ZAKUSKINA O Y, 2010. Features of the Comacchio ecosystem transformed during persistent bloom of picocyanobacteria. Journal of Oceanography, 66(3): 373-387 |
STRICKLAND J D H, PARSONS T R, 1972. A practical handbook of seawater analysis. 2nd ed. Ottawa: Fisheries Research Board of Canada, 167
|
SUNDA W G, GRANELI E, GOBLER C J, 2006. Positive feedback and the development and persistence of ecosystem disruptive algal blooms. Journal of Phycology, 42(5): 963-974 |
TAMM M, LAAS P, FREIBERG R, et al, 2018. Parallel assessment of marine autotrophic picoplankton using flow cytometry and chemotaxonomy. Science of the Total Environment, 625: 185-193 |
WANG L H, OU L J, HUANG K X, et al, 2018. Determination of the spatial and temporal variability of phytoplankton community structure in Daya Bay via HPLC-CHEMTAX pigment analysis. Journal of Oceanology and Limnology, 36(3): 750-760 |
WANG K, WOMMACK K E, CHEN F, 2011. Abundance and distribution of Synechococcus spp. and cyanophages in the Chesapeake Bay. Applied and Environmental Microbiology, 77(21): 7459-7468 |
WRIGHT S W, ISHIKAWA A, MARCHANT H J, et al, 2009. Composition and significance of picophytoplankton in Antarctic waters. Polar Biology, 32(5): 797-808 |
WU W X, HUANG B Q, ZHONG C, 2014. Photosynthetic picoeukaryote assemblages in the South China Sea from the Pearl River estuary to the SEATS station. Aquatic Microbial Ecology, 71(3): 271-284 |
XIA X M, LEE P, CHEUNG S, et al, 2020. Discovery of euryhaline phycoerythrobilin-containing Synechococcus and its mechanisms for adaptation to estuarine environments. mSystems, 5(6): e00842-20 |
XU Q, SUKIGARA C, GOES J I, et al, 2019. Interannual changes in summer phytoplankton community composition in relation to water mass variability in the East China Sea. Journal of Oceanography, 75(1): 61-79 |
YAN G W, JIANG T, ZHANG Y Y, et al, 2020. Determining temporal and spatial distribution of autotrophic picoplankton community composition through HPLC-pigment method and flow cytometry in the central Bohai Sea (China). Marine Pollution Bulletin, 157: 111261 |
YANG Y, GU X Q, TE S H, et al, 2019. Occurrence and distribution of viruses and picoplankton in tropical freshwater bodies determined by flow cytometry. Water Research, 149: 342-350 |
YU Z G, DENG C M, YAO P, et al, 2007. Prasinoxanthin- constaining prasinophyceae discovered in Jiaozhou Bay, China. Journal of Integrative Plant Biology, 49(4): 497-506 |
ZAPATA M, RODRÍGUEZ F, GARRIDO J L, 2000. Separation of chlorophylls and carotenoids from marine phytoplankton: a new HPLC method using a reversed phase C8 column and pyridine-containing mobile phases. Marine Ecology Progress Series, 195: 29-45 |
ZHANG Y, JIAO N Z, HONG N, 2008. Comparative study of picoplankton biomass and community structure in different provinces from subarctic to subtropical oceans. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 55(14/15): 1605-1614 |
ZHONG Q, XUE B, NOMAN M A, et al, 2021. Effect of river plume on phytoplankton community structure in Zhujiang River estuary. Journal of Oceanology and Limnology, 39(2): 550-565 |
ZHU J M, HONG Y G, ZADA S, et al, 2018. Spatial variability and co-acclimation of phytoplankton and bacterioplankton communities in the Pearl River Estuary, China. Frontiers in Microbiology, 9: 2503 |
 2023, Vol. 54
2023, Vol. 54


