
中国海洋湖沼学会主办。
文章信息
- 时静, 左亚强, 曹萍麟, 樊英萍, 曲武, 王健鑫. 2023.
- SHI Jing, ZUO Ya-Qiang, CAO Ping-Lin, FAN Ying-Ping, QU Wu, WANG Jian-Xin. 2023.
- 夏季长江口海水中自由生活和颗粒附着古菌群落的组装过程研究
- THE ASSEMBLING OF FREE-LIVING AND PARTICLE-ATTACHED ARCHAEA COMMUNITIES IN THE CHANGJIANG RIVER ESTUARY IN SUMMER
- 海洋与湖沼, 54(3): 773-785
- Oceanologia et Limnologia Sinica, 54(3): 773-785.
- http://dx.doi.org/10.11693/hyhz20220800216
文章历史
-
收稿日期:2022-08-17
收修改稿日期:2022-11-09
河口处于海洋和陆地河流相互交汇的区域, 是海陆相互作用最为活跃、对流域自然变化和人为活动响应最为敏感、与近岸环境变化最为密切的海域, 具有极其重要的生态学功能, 同时也是全球变化的重点研究对象(Hewson et al, 2004)。长江是中国第一大河, 平均年入海径流量占输入东海总径流量的84.4%, 在陆源物质向东海的输送中起着重要作用(张东声, 2011)。大量营养盐的输入, 对长江口和东海海域的生态系统产生重要影响, 同时长江口受到台湾暖流、浙闽沿岸流和黄海沿岸流等水系的共同作用, 使得长江口形成错综复杂的河口环境和特殊的生态条件; 另外强烈的季风气候通过海气相互作用也影响长江口及邻近海域的环流和温盐结构, 使得该区域又是中国海岸带陆-海相互作用研究的关键水域(宁修仁等, 2004), 因此, 长江口是中国乃至世界重要而典型的河口生态系统。
古菌在各种海洋生态环境中广泛存在, 是海洋微型生物的重要组成成分。研究海洋古菌的多样性和生态过程, 对认识海洋生物资源、保护生态环境、可持续性开发利用海洋资源具有重要的理论和现实意义。河口的古菌群落组成已被证明受到不同环境条件的影响, 包括物理、化学以及生物因素(Zeng et al, 2007; Crump et al, 2000; Huang et al, 2022b), 其分布、组成及多样性与盐度、pH值、海拔、气候和C/N比等环境因子相关(Tripathi et al, 2013)。研究发现, 海洋浮游古菌在海洋水域表层相对广泛存在, 而在中层海域浮游古菌处于原核细胞群体的优势地位, 在不同海域中古菌的分布也有变化(闫慧贞等, 2021)。海洋浮游微生物可以根据生活方式分为两种类群: 自由生活型(free-living, FL)和颗粒附着型(particle-attached, PA) (DeLong et al, 1993)。颗粒附着古菌定殖颗粒有机物并将其分解为溶解有机物, 颗粒附着古菌可以通过密集的定殖和代谢活动对海水中的有机颗粒产生反应(Ganesh et al, 2014), 从而形成微生物生长和碳循环的热点; 而自由生活古菌能够在颗粒附着微生物释放的溶解有机物中茁壮成长(Kiørboe et al, 2001; Allen et al, 2013)。这两种类群在海洋生态系统中都发挥着重要作用(Azam et al, 2001)。颗粒附着古菌在许多方面与自由生活类群完全不同, 包括丰度、形态、多样性和代谢活动(Pulido-Villena et al, 2014), 并且在组成和功能方面也都存在显著差异(Suter et al, 2018)。
确定性过程(或生态位驱动)和随机性过程控制微生物类群的组装(Vellend et al, 2015)。确定性过程强调生态选择的作用, 通过同质选择(即跨地域相似的环境条件引起的群落趋同)和异质选择(即跨地域异质的环境条件引起的群落分歧)可以导致空间组成周转率的变化(Vellend, 2010; Stegen et al, 2015)。随机过程强调扩散和生态漂移在古菌组合形成中的作用, 与确定性生态选择无关(Zhou et al, 2017)。然而, 普遍的共识是确定性和随机性过程都可以同时促进群落的聚集, 尽管它们的相对重要性可能取决于生态系统和环境条件(Leibold et al, 2006; Guo et al, 2018)。对于确定性过程和随机性过程如何调控古菌群落的组装, 已在沿海海湾(Chen et al, 2016)和湖泊(Yan et al, 2017)等水生环境中开展探究两种过程的相对重要性。然而, 关于长江口海水中自由生活和附着颗粒的古菌群落组装过程, 相关研究还比较欠缺, 其组装过程的影响因素尚不清楚。
在本项研究中, 我们对夏季长江口海水中不同生活方式的古菌多样性、群落分布、环境驱动因素和组装过程进行调查。本研究的目标是: (1) 识别长江口中不同生活方式的古菌群落组成; (2) 探究自由生活和颗粒附着古菌的环境驱动因素; (3) 理解自由生活和颗粒附着的古菌组装生态过程(确定性和随机性过程)。我们的目标是提供一个生态视角, 以帮助了解控制河口自由生活和颗粒附着古菌组装过程的影响因素。
1 材料与方法 1.1 采样地点和样品采集2019年7月, 项目组成员搭载浙江海洋大学“浙渔科2号”科学考察船, 在长江口及其邻近海域选择五个站位进行样品采集(站点设置如图 1所示)。利用SBE32采样器(Washington Seabird Company, Washington, USA), 在每个位点分别采集表层(深度0~2 m)和底层(深度约20 m) 海水。每层采水6 L (分3个重复样, 每个样品2 L), 依次通过3 µm孔径滤膜(polycarbonate, Millipore, USA)和0.22 µm孔径滤膜(polycarbonate, Millipore, USA)进行过滤。过滤后, 将滤膜(3 μm和0.22 μm)分别转移到5 mL冻存管中, 立即放入–20 ℃冰箱中短期保存。航次结束后将样品立即储存在–80 ℃的低温冰箱中长期保存, 以待后续分析。3 µm孔径滤膜上的微生物被作为附着颗粒生活的微生物群落, 而0.22 µm孔径滤膜上的微生物被作为自由生活的微生物群落(LaMontagne et al, 2003; Liu et al, 2019; Zhao et al, 2021)。
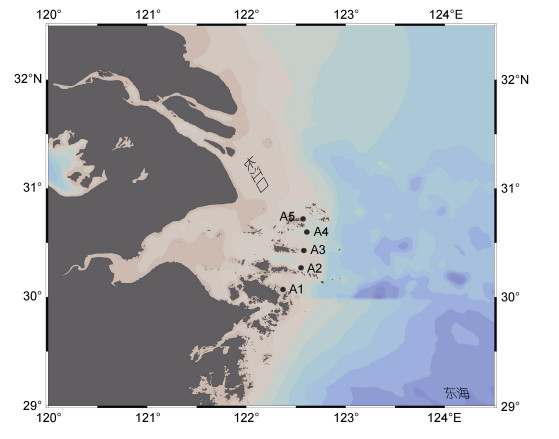 |
| 图 1 长江口采样站点示意图 Fig. 1 The sampling stations in the Changjiang (Yangtze) River estuary |
每个采样点现场海水的温度、盐度、pH和溶解氧(DO)等环境参数由温盐深仪(CTD, SBE 32型)直接测得。根据国家标准——海洋监测规范进行海水理化性质测定(中华人民共和国国家质量监督检验检疫总局等, 2007), 设定3个平行样, 其中NO3–浓度测定采用铜镉柱还原法, NO2–浓度测定采用重氮偶联法, COD浓度测定采用高锰酸钾滴定法, SiO42–浓度测定采用硅钼蓝法, PO43–浓度测定采用磷钼蓝法, 总碱度TA浓度测定采用pH电位滴定法, chl a浓度测定采用荧光光度法。
1.3 DNA提取、PCR扩增和测序使用Fast DNA SPIN Kit for Soil试剂盒(Q-BIOgene)提取滤膜的微生物总DNA, 使用NanoDrop 2000分光光度计(Thermo Scientific)检测DNA浓度。使用引物515F (5′-GTGCCAGCMGCCGC GG-3′)和907R (5′-CCGTCAATTCMTTTRAGTTT-3′)对16S rRNA基因的V4-V5区进行PCR扩增。PCR反应体系为: 5×TransStart FastPfu Buffer 4 μL, 2.5 mmol/L dNTPs 2 μL, 上游引物(5 μmol/L) 0.8 μL, 下游引物(5 μmol/L) 0.8 μL, TransStart FastPfu DNA聚合酶0.4 μL, 模板DNA 10 ng, 补足至20 μL, 每个样本3个重复。PCR产物混合后使用2%琼脂糖凝胶回收, 送至上海元莘生物有限公司使用Illumina公司的HiSeq2500平台进行扩增子测序。原始数据上传至NCBI数据库, 序列号为PRJNA754510。
1.4 数据分析原始数据序列采用Fastp (https://github.com/OpenGene/fastp, 0.20.0版)软件进行质控, 过滤长度小于200 bp和质量差(读码质量分数 < 25)的原始序列(Chen et al, 2018); 利用FLASH (http://www.cbcb.umd.edu/software/flash, 1.2.7版)软件对序列进行拼接(Magoč et al, 2011); 利用USEARCH筛选、去除标签和引物, 并用unoise3方法进行ASV聚类(Alloui et al, 2015); 利用SILVA classifier对每条序列进行物种分类注释, 比对Silva 16S rRNA数据库(v138), 设置比对阈值为70% (Pruesse et al, 2012), 将注释得到的“叶绿体” “真核生物”和“线粒体”的分类单元进行过滤。
使用R软件的vegan (Oksanen et al, 2013)程序包计算α-多样性指数, 包括ACE、Chao 1、Observed和Shannon指数等。使用显著性差异检验(Tukey’s HSD)比较自由生活和颗粒附着两组微生物之间的α-多样性差异。β-多样性基于Bray-Curtis距离的主坐标分析(PCoA), 进行不同生活方式古菌群落组成差异的可视化分析。利用相似性分析(ANOSIM)进行显著性检验。使用fastTree软件将过滤比对后的序列生成系统进化发育树(Price et al, 2010)。运用冗余分析(RDA)探究环境因子与古菌群落之间的相关性(Ter Braak et al, 2002), 同时结合permutation (1000次)测试, 对排序结果进行生物统计学检验。
1.5 古菌群落组装过程的量化采用Sloan的中性群落模型评估随机扩散和生态漂移对长江口海水中自由生活和附着颗粒微生物群落聚集的影响(Sloan et al, 2006)。同时采用零模型对微生物不同组装过程进行区分(Stegen et al, 2013)。使用R软件中的microeco程序包计算自由生活和附着颗粒群落的组装过程(Liu et al, 2021)。利用β-平均最近分类单元距离(βMNTD)来描述群落之间的成对系统发育周转, 使用β-最近分类单元指数(βNTI)来表示环境影响, 并使用观察到的βMNTD和βMNTD零模型之间的标准差进行计算。确定性过程包括同质选择(βNTI的值< –2)和异质选择(βNTI的值> 2); βNTI的值范围从–2到2被归类为随机过程。然后我们计算了基于Bray-Curtis的Raup-Crick度量(RCbray), RCbray的值< –0.95, –0.95~+0.95, > +0.95分别代表均质扩散、生态漂移和扩散限制。
2 结果与分析 2.1 海水理化参数分析各采样点的环境指标测定结果见表 1所示。COD在不同采样点之间的变化范围是0.948~3.358 mg/L; DO值的范围是3.756~5.381 μmol/L; 温度在23.37~ 26.63 ℃之间变化; 盐度的变化范围在17.75~29.71之间; pH值在7.91~8.21范围内变化; chl a在0.41~ 6.82 μg/L范围内变化。SiO42–在样本之间的变化范围是22.853~57.498 mg/L; PO43–的值在0.48~1.55 mg/L之间变化; NO3–的浓度在29.832~191.699 mg/L范围内变化; NO2–浓度的变化范围是0.254~ 1.315 mg/L; TA在2.24~2.69 mg/L范围内波动。
| 采样点 | 盐度 | 温度/℃ | pH | DO/(μmol/L) | NO3–/(mg/L) | PO43–/(mg/L) | SiO42–/(mg/L) | COD/(mg/L) | NO2–/(mg/L) | TA/(mg/L) | chl a/(μg/L) |
| A1BF | 22.581 | 25.29 | 7.9 | 4.536 | 37.910 | 1.546 | 43.275 | 3.194 | 0.254 | 2.630 | 0.406 |
| A1BP | 22.587 | 25.29 | 7.9 | 4.536 | 37.910 | 1.546 | 43.275 | 3.194 | 0.254 | 2.630 | 0.406 |
| A1SF | 22.312 | 25.43 | 7.9 | 4.567 | 40.483 | 1.087 | 48.502 | 3.358 | 0.196 | 2.686 | 0.812 |
| A1SP | 22.315 | 25.43 | 7.9 | 4.567 | 40.483 | 1.087 | 48.502 | 3.358 | 0.196 | 2.686 | 0.812 |
| A2BF | 29.706 | 23.37 | 8.0 | 3.923 | 190.442 | 0.759 | 22.853 | 1.193 | 0.929 | 2.512 | 2.445 |
| A2BP | 29.706 | 23.37 | 8.0 | 3.923 | 190.442 | 0.759 | 22.853 | 1.193 | 0.929 | 2.512 | 2.445 |
| A2SF | 20.936 | 26.09 | 8.0 | 5.047 | 191.699 | 0.731 | 48.138 | 1.337 | 0.679 | 2.415 | 1.387 |
| A2SP | 20.936 | 26.09 | 8.0 | 5.047 | 191.699 | 0.731 | 48.138 | 1.337 | 0.679 | 2.415 | 1.387 |
| A3BF | 26.979 | 24.29 | 8.0 | 5.214 | 49.134 | 0.478 | 30.512 | 1.450 | 1.315 | 2.572 | 1.786 |
| A3BP | 26.979 | 24.29 | 8.0 | 5.214 | 34.306 | 0.478 | 30.512 | 1.450 | 1.315 | 2.572 | 1.786 |
| A3SF | 17.875 | 26.63 | 8.1 | 4.319 | 93.421 | 0.834 | 57.498 | 1.009 | 0.717 | 2.542 | 3.517 |
| A3SP | 17.877 | 26.63 | 8.1 | 4.319 | 93.421 | 0.834 | 57.498 | 1.009 | 0.717 | 2.542 | 3.517 |
| A4BF | 23.743 | 24.53 | 8.0 | 5.381 | 29.832 | 0.562 | 39.629 | 2.150 | 0.910 | 2.448 | 0.851 |
| A4BP | 23.743 | 24.53 | 8.0 | 5.381 | 29.832 | 0.562 | 39.629 | 2.150 | 0.910 | 2.448 | 0.851 |
| A4SF | 19.279 | 25.97 | 8.2 | 4.005 | 84.191 | 0.525 | 54.945 | 1.812 | 0.891 | 2.312 | 6.820 |
| A4SP | 19.279 | 25.97 | 8.2 | 4.005 | 84.191 | 0.525 | 54.945 | 1.812 | 0.891 | 2.312 | 6.820 |
| A5BF | 20.865 | 25.00 | 8.0 | 4.608 | 33.383 | 0.825 | 55.431 | 1.302 | 0.756 | 2.382 | 0.843 |
| A5BP | 20.760 | 25.03 | 8.0 | 5.460 | 33.383 | 0.825 | 55.431 | 1.302 | 0.756 | 2.382 | 0.843 |
| A5SF | 17.760 | 25.67 | 8.0 | 3.756 | 48.719 | 0.712 | 45.220 | 0.948 | 0.640 | 2.239 | 1.594 |
| A5SP | 17.760 | 25.67 | 8.0 | 3.756 | 48.719 | 0.712 | 45.220 | 0.948 | 0.640 | 2.239 | 1.594 |
| 注: A1, A2, A3, A4, A5分别代表不同的采样点; B代表底层, S代表表层; F代表自由生活方式, P代表颗粒附着生活方式 | |||||||||||
基于Pearson方法显示各采样点环境因子之间的相关性, 如图 2所示。温度与硅酸盐浓度呈显著正相关(P < 0.01), 与盐度呈显著负相关关系(P < 0.01)。硅酸盐与盐度呈负相关关系。叶绿素a和pH呈显著正相关(P < 0.01)。亚硝酸盐分别和磷酸盐、化学需氧量呈正相关关系(P < 0.05)。
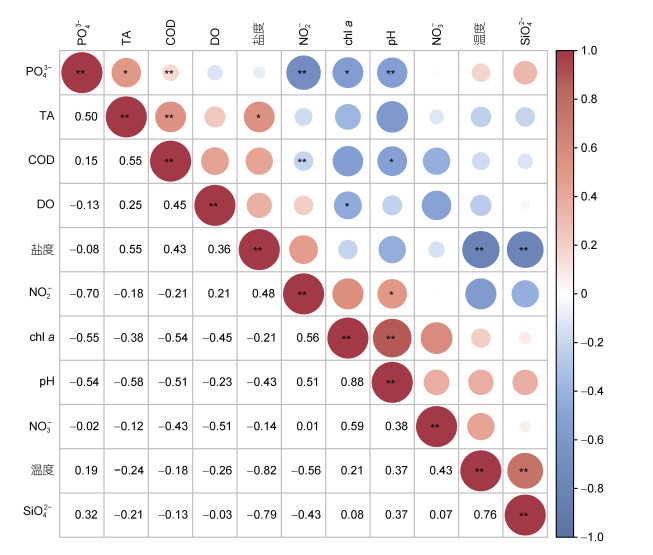 |
| 图 2 长江口海水中基于Pearson显示各环境因子间相关性的热图 Fig. 2 The Pearson-based heatmap showing the correlation among environmental factors in the seawater of the Changjiang River estuary 注: 相关性系数显示左下方矩形框中。红色表示正相关, 蓝色表示负相关; **表示P < 0.01, *表示P < 0.05 |
经过质控和序列优化, 在所有自由生活和颗粒附着的古菌样本中得到1 812 712条高质量序列, 并且将序列聚类划分为个897个ASVs。我们基于Chao 1、ACE、Coverage和Shannon指数比较了自由生活(FL)和颗粒附着(PA)古菌群落的α多样性指数。自由生活群落的Chao 1、ACE、Coverage指数的平均值都显著低于附着颗粒古菌(P < 0.01), 如图 3所示。反映自由生活古菌多样性的Shannon指数平均为2.988, 而颗粒附着古菌的Shannon指数平均为3.238, 在颗粒附着组中的Shannon平均多样性指数高于自由生活组, 但它们之间没有显著差异。
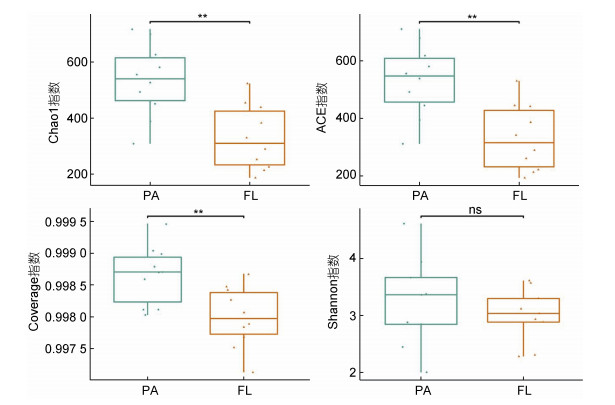 |
| 图 3 自由生活和附着颗粒古菌群落的多样性指数 Fig. 3 Diversity indices of free-living and particle-attached archaeal communities 注: 箱线图上方的**表示差异显著, ns表示无显著差异 |
基于Bray-Curtis距离建立的PCoA分析显示样本按照古菌的不同生活方式分离不明显, 附着颗粒群落的置信区间包含了自由生活古菌样本, 结果如图 4所示。同时用ANOSIM方法检验, 得到的R值为0.057 44, P值是0.15, 结果显示自由生活和颗粒附着样本之间十分相似, 没有明显的分离。
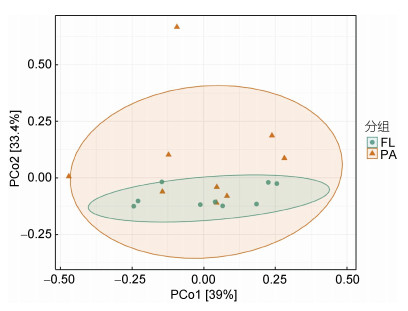 |
| 图 4 自由生活和附着颗粒古菌群落结构的主坐标分析 Fig. 4 The principal co-ordinates analysis of free-living and particle-attached archaeal communities |
本研究在长江口及其邻近海域海水样品中鉴定得到古菌共41门250科442属。从门水平上看(图 5), 泉古菌门(Crenarchaeota)在自由生活和附着颗粒古菌群落中均表现出明显优势, 其相对丰度占总数的56%。其他较为丰富的门类包括Thermoplasmatota、Hydrothermarchaeota和盐杆菌门(Halobacterota)。从科水平的物种组成上来看(图 6), 长江口及其邻近海域中的优势古菌是Nitrosopumilaceae, 在两种不同生活方式之间都较为丰富(FL: 53%, PA: 52%), 其他主要的古菌类别还有Marine GroupⅡ和Bathyarchaeia等。Marine GroupⅡ在自由生活类群中的相对丰度较高(39%), Bathyarchaeia在颗粒附着类群中的相对丰度较高(8%)。
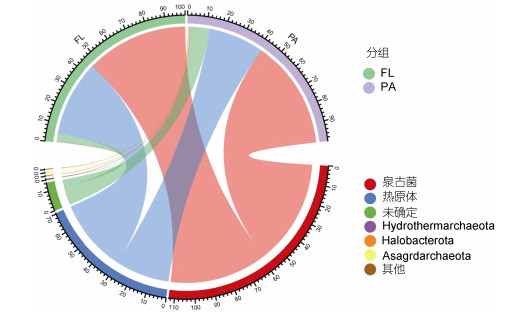 |
| 图 5 自由生活和附着颗粒古菌群落的物种组成(门水平) Fig. 5 Species composition of free-living and particle-attached archaeal communities (at phylum level) |
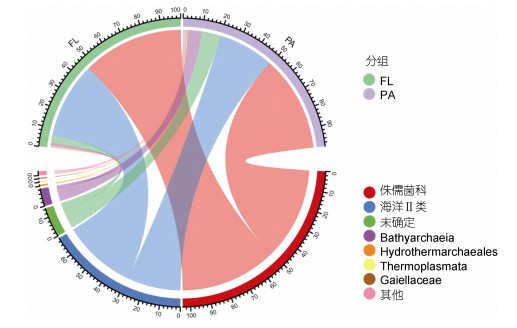 |
| 图 6 自由生活和附着颗粒古菌群落的物种组成(科水平) Fig. 6 Species composition of free-living and particle-attached archaeal communities (at family level) |
对古菌样本、古菌群落与环境因子间相关性进行分析发现, 自由生活的古菌群落第一轴和第二轴分别解释了总变异的98.4%和1.6%; 而附着颗粒的古菌群落第一轴和第二轴分别解释了总变异的72.2%和27.7% (图 7), 这表明环境因子在很大程度上能够解释长江口及其邻近海域海水古菌群落的变异。从图 7中可知, 温度、硅酸盐和盐度是影响自由生活和颗粒附着古菌群落的主要环境因子。Marine GroupⅡ与亚硝酸盐、盐度、DO环境因子之间呈正相关关系; Nitrosopumilaceae与温度、硅酸盐之间呈正相关关系。
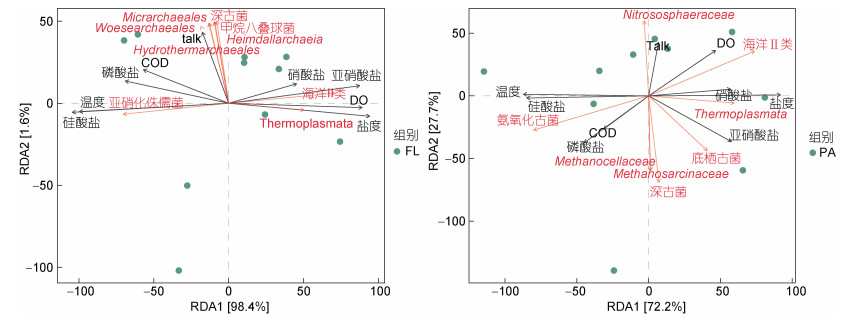 |
| 图 7 自由生活和附着颗粒古菌群落的RDA分析(科水平) Fig. 7 Species composition of free-living and particle-attached archaeal communities (at family level) 注: 图中圆点代表样品, 黑色射线代表环境因子, 红色射线代表古菌的科水平; 射线越长代表着该因素对研究对象的影响程度越大; 黑色射线与红色射线之间的夹角代表某类古菌与环境因子之间的相关性 |
Mantel-test分析表明, 自由生活和颗粒附着古菌群落与不同的环境变量显著相关, 具体如表 2所示。自由生活和附着颗粒群落都主要受到温度, 盐度和硅酸盐的影响。自由生活类群还受到亚硝酸盐的影响; 而附着颗粒古菌中受叶绿素a的影响。
| 因子 | FL | PA |
| 相关性 | 相关性 | |
| 盐度 | 0.547 7** | 0.482 5* |
| 温度 | 0.628 2** | 0.562 4** |
| DO | 0.092 5 | 0.000 9 |
| NO3– | 0.130 5 | 0.127 6 |
| PO43– | 0.130 5 | –0.039 9 |
| SiO42– | 0.581 4** | 0.440 8* |
| COD | 0.115 3 | –0.157 0 |
| TA | –0.028 5 | –0.118 2 |
| NO2– | 0.353 0* | 0.116 5 |
| chl a | 0.224 5 | 0.484 1* |
| pH | 0.200 2 | 0.348 2 |
| 注: *表示显著相关性(P < 0.05); **表示极显著相关性(P < 0.01) | ||
中性群落模型用于评估随机扩散和生态漂变对长江口自由生活(FL)和颗粒附着(PA)古菌群落组装过程的影响, 如图 8所示。总的来说, ASV的发生频率与中性群落模型表现出中等程度的吻合(R2=0.562)。然而, 该模型的拟合度在不同生活方式之间的顺序为: 附着颗粒生活方式(PA: R2=0.562) > 自由生活方式(FL: R2=0.551)。估计的迁移率(m)中, 自由生活古菌群落(Nm=113 21) > 颗粒附着古菌群落(Nm=797 9), 表示物种迁移与古菌群落的不同生活方式有关, 且自由生活古菌群落比颗粒附着古菌群落的扩散程度更高。
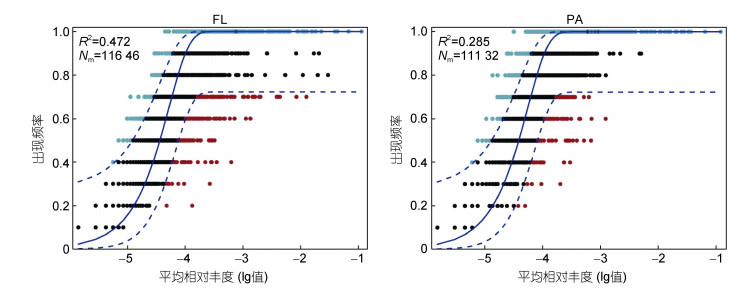 |
| 图 8 中性群落模型评估长江口自由生活(FL)和附着颗粒(PA)古菌群落中随机性过程 Fig. 8 Assessment of the effects of random dispersal and ecological drift on the assembly of free-living (FL) and particle-attached (PA) archaeal communities in the Changjiang River estuary in neutral community models 注: R2表示中性模型的拟合度, Nm是元群落规模(N)与迁移率(m)的乘积, 量化了对群落之间扩散的估计。蓝色实线表示最适合中性模型, 蓝色虚线表示模型预测的95%置信区间 |
我们基于最近种间平均进化距离(MNTD)的系统发育分析, 以验证古菌群落中观察到的差异与随机群落的预期差异之间的一致性, 探究古菌群落的构建机制。随机过程包括扩散限制、同质扩散和漂变, 是构建古菌群落的最重要过程, 在自由生活和附着颗粒群落构建中的贡献率都为100% (图 9)。相比之下, 生态漂变是形成附着颗粒群落的最重要过程(76%的贡献率), 扩散对附着颗粒古菌群落结构的影响较小。然而, 在自由生活古菌群落的数据集中, 扩散限制、均匀化扩散和生态漂移分别占38%、27%和35%, 表明各生态过程在推动长江口海水样本中自由生活古菌群落聚集方面发挥相同重要性的作用。
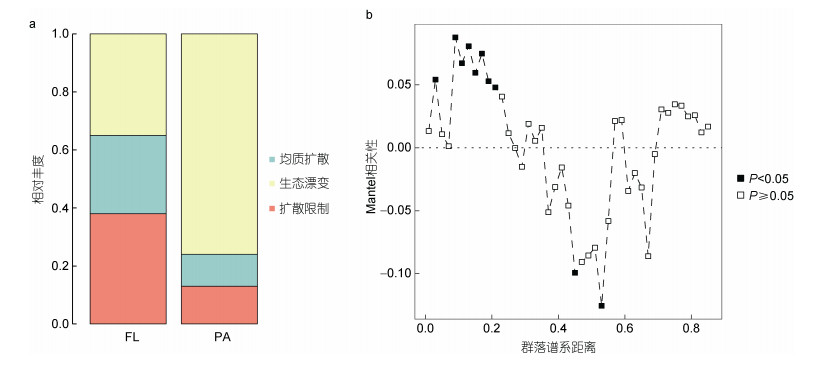 |
| 图 9 (a) 自由生活和附着颗粒群落随机性和确定性过程的相对贡献; (b)随机和确定性过程的发育信号 Fig. 9 Relative contributions of stochastic and deterministic processes in free-living and particle-attached archaeal communities (a) and developmental signaling of stochastic and deterministic processes (b) |
古菌群落组成的结果表明, 长江口及其邻近海域中的优势菌是Nitrosopumilaceae, 在两种不同生活方式之间都较为丰富。Marine GroupⅡ在自由生活组中更加丰富, 而Bathyarchaeia在附着颗粒组中拥有更高的相对丰度。有研究表明, 自由生活的Marine GroupⅡ的基因组构成(Orsi et al, 2015)和多样性不同于颗粒附着组(Galand et al, 2009), Marine GroupⅡ被确定为自由生活组中的主要成分(Li et al, 2020)。Marine GroupⅡ在咸淡水交互区域的丰度较高, 具有异养代谢特征, 该类群在河口区域有机质转化过程中发挥重要作用(Xie et al, 2018)。Bathyarchaeia代谢多样性高, 具有丰富的碳代谢潜能, 可能会附着在富含碳的颗粒上, 受到富含碳营养颗粒的选择。本研究发现, 泉古菌门(Crenarchaeota)是长江口古菌群落中的优势菌群。而在中国北方边缘海域(Li et al, 2022)和韩国西海岸潮滩中(Kim et al, 2008), 广古菌门(Euryarchaeota)是最主要的门, 这与我们的研究结果不一致, 可能是潮汐和沿海沉积物的理化性质带来的差异, 另外, 研究发现广古菌门在富含海洋沉积物的区域丰度较高, 与它们执行蛋白质再矿化作用有关(Li et al, 2022)。
基于Bray-Curtis的主成分分析显示自由生活古菌群落和附着颗粒古菌群落之间没有显著的差异性, 类似研究结果也出现在其他海洋环境, 在对北极峡湾古菌群落和多样性的研究中发现, 自由生活和附着颗粒古细菌群落之间未存在明显的生态位划分(Jain et al, 2021)。本研究表明Shannon多样性指数在颗粒附着组分中更高, 没有表现出显著差异, 但是不同生活方式古菌群落又显示它们之间丰富度具有显著差异。通常河口颗粒附着微生物多样性程度会较高(Crump et al, 1999), 因为河口是海水和淡水的混合, 多种来源的沉积物和颗粒物在此发生再悬浮。可能的原因是在长江口环境中, 系统的流体动力学极大地延长颗粒附着细菌的停留时间, 而自由生活的微生物被冲刷得更快(Crump et al, 2000; Smith et al, 2013)。自由生活古菌在与颗粒之间发生频繁的附着和被冲刷过程, 导致自由生活古菌和附着颗粒古菌之间的主坐标存在明显的重叠。古菌群落很大程度上在自由生活与颗粒附着两种生活方式之间转化流通。河口的微生物群落也影响陆地、淡水和海洋生物群落之间的营养物质交换(Cole et al, 2001; Bauer et al, 2013)。
3.2 驱动不同生活方式古菌群落的环境因素我们的冗余分析和Mantel分析结果表明, 温度、盐度和硅酸盐对长江口及邻近海域海水中古菌群落有显著影响。相关研究中也证实了温度、盐度是影响古菌群落聚集的重要因子(Kellogg et al, 2009; Li et al, 2021), 而盐度对微生物的群落成分和多样性具有非常重要的影响(Liu et al, 2013)。另外, 硅酸盐与古菌分布也表现出统计学上的显著相关性。海水中硅的主要来源是陆地上的硅酸盐矿物风化, 由径流输入海洋, 长江径流每年为长江入海口输送大量的硅酸盐(崔彦萍等, 2013)。有研究显示河流筑坝等人类活动对长江口物质循环的影响较为明显, 并可能改变河口区域硅循环的原有规律, 在三峡大坝建成后硅酸盐成为了对长江口以及东海区域微生物群落具有显著影响的环境因素(刘敏, 2011), 这与本研究结果一致。而在黄河口的研究显示, Na、Ca含量和水深对微生物群落影响较大, 可能的原因是Na含量的改变会间接改变Ca的含量(Yin et al, 2022)。
对于不同生活方式的古菌, 亚硝酸盐对自由生活类群有显著影响, 而叶绿素a对颗粒附着古菌有显著影响。环境因子亚硝酸盐与Nitrosopumilacea呈负相关关系, 在长江口自由生活组中相对丰度较高Nitrosopumilaceae是氨氧化古菌, 是黑暗海洋中已知最丰富的化能自养菌(Pachiadaki et al, 2017), 它们将氨氧化成亚硝酸盐, 因此它们之间具有负相关性。同时, 亚硝酸盐作为氮循环的中间产物, 能够同化亚硝酸盐还原为氨, 或是同化硝酸盐为亚硝酸盐, 而有研究表明, 随机性过程对同化硝酸盐还原和氨氧化具有影响(Su et al, 2022), 这可能是由于微生物的群落组装如随机性能够通过影响微生物间的群落关系如氮循环进而影响微生物的群落结构。叶绿素a含量与藻类息息相关, 是反映海洋生态系统中富营养化的有效指标(周艳蕾等, 2017)。颗粒附着细菌是河口颗粒有机物的主要降解者, 也是河口食物链的重要部分(Crump et al, 1998)。有研究结果认为颗粒附着微生物组分的变化可能由死亡或衰老藻类的特定栖息地决定, 其组成影响当地的碎屑食物网以及随后颗粒附着古菌的异养生长和活动(Ploug et al, 2008)。海水中藻类衰老或死亡的碎屑颗粒提供了可附着的底物, 显著影响颗粒附着古菌组分。
3.3 不同生活方式古菌组装过程对古菌在确定性与随机性模式及其季节性方面的组装机制的相关研究表明, 环境因素的季节性变化调节了细菌群落组装的确定性、随机性平衡, 然而对于自由生活和颗粒附着古菌群落在河口的群落组成差异尚不清楚。本研究通过中性模型和零模型评估了长江口及邻近海域海水环境中不同生活方式古菌群落组装过程的差异, 结果显示古菌群落的聚集由随机性过程主导。长江口的古菌群落受到环境扰动的影响, 环境异质性大。长江口盐度的较大变化反映该区域受到明显的潮汐作用, 多重水团和径流汇聚, 水动力过程强烈。这种复杂的河口生态环境和剧烈的水动力变化影响了古菌群落的组装过程。强烈的水动力过程干扰强度超过了生态环境过滤, 致使随机性过程主导了长江口中古菌群落的聚集。对黄河口的研究表明, 细菌组装会受到同质扩散和扩散限制的影响, 而真菌会受到生态漂变的影响(Huang et al, 2022a)。而在九龙江河口和台湾海峡附近的微生物群落, 包括细菌和古菌, 都会受到异质选择和扩散限制的影响(Yue et al, 2022)。Wu等(2021)在研究珠江口微生物群落时, 发现自由生活群落和颗粒附着微生物群落都会受到同质选择作用的影响, 这说明微生物群落会受到随机性组装的影响。不同河口生态系统环境的微生物群落组装机制存在差异, 其中开放流域系统由于不断地生态漂变或者水文混合, 这种现象会更加明显(Bracken et al, 2013; Meyerhof et al, 2016)。
本研究结果显示, 在不同生活方式古菌群落的聚集过程中, 颗粒附着古菌群落的组装过程以生态漂变为主, 而自由生活古菌群落中, 扩散限制、均质扩散和生态漂变都很重要。河口环境中, 颗粒有机物质和浮游植物会形成富含有机物的颗粒(Prahl et al, 1997), 被大量微生物定殖, 导致河口通常有大量颗粒附着古菌, 有时占总群落的45%, 比在其他海洋系统中丰度更高(Kirchman, 1993; Simon et al, 2002)。可供古菌定殖的颗粒有浮游植物和有机物碎屑等, 这些颗粒的分布通常不是均匀的, 例如浮游植物在海水表层富集, 有机物颗粒发生沉降在海水底层富集。可供古菌附着的底物颗粒的局部集中会增加颗粒附着古菌的相对丰度, 从而导致颗粒附着古菌的群落结构不平衡, 这种不平衡极容易引起生态漂变(Xun et al, 2019)。河口和沿岸海水中富含有机颗粒, 相比于自由生活古菌群落, 颗粒附着古菌群落容易与这些底物颗粒结合从而导致局部古菌群落丰度的增加, 产生更多生态漂变过程。自由生活古菌群落直接生活在海水环境中, 而颗粒附着细菌随着颗粒可以扩展其生活环境, 因而颗粒附着古菌群落相比于自由生活群落, 受到更小的扩散限制。
4 结论长江口自由生活和颗粒附着古菌群落的α多样性指数差异显著, β多样性显示它们之间高度相似, 这意味着古菌群落在自由生活和颗粒附着之间发生频繁转换, 具有多种代谢灵活性。古菌群落组成以泉古菌门为主, 在科水平显示出显著差异。RDA分析显示温度、盐度和硅酸盐是显著影响古菌群落的环境因子, 亚硝酸盐和叶绿素a分别显著影响自由生活和颗粒附着古菌群落结构。长江口古菌群落组装以随机性过程为主, 强烈的水动力干扰影响主导长江口中古菌群落的聚集。这拓展了人们对河口环境自由生活和颗粒附着古菌群落特征、环境驱动因子及组装机制的认识。
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会, 2007. 海洋监测规范第4部分: 海水分析: GB 17378.4-2007[S]. 北京: 中国标准出版社: 1-18.
|
宁修仁, 史君贤, 蔡昱明, 等, 2004. 长江口和杭州湾海域生物生产力锋面及其生态学效应. 海洋学报, 26(6): 96-106 DOI:10.3321/j.issn:0253-4193.2004.06.011 |
刘敏, 2011. 我国黄、东海典型生态过程中的微生物群落结构[D]. 北京: 中国科学院研究生院(海洋研究所): 1-2.
|
闫慧贞, 徐邹洋, 陈文杰, 等, 2021. 环梅山岛海域春季浮游古菌群落空间分布特征研究. 微生物学报, 61(9): 2709-2725 |
张东声, 2011. 长江口及其邻近海域微生物的多样性和生态分布特征研究[D]. 杭州: 浙江大学: 1-3.
|
周艳蕾, 张传松, 石晓勇, 等, 2017. 黄渤海海水中叶绿素a的分布特征及其环境影响因素. 中国环境科学, 37(11): 4259-4265 DOI:10.3969/j.issn.1000-6923.2017.11.031 |
崔彦萍, 王保栋, 陈求稳, 等, 2013. 三峡水库三期蓄水前后长江口硅酸盐分布及其比值变化. 环境科学学报, 33(7): 1974-1979 |
ALLEN A E, ALLEN L Z, MCCROW J P, 2013. Lineage specific gene family enrichment at the microscale in marine systems. Current Opinion in Microbiology, 16(5): 605-617 DOI:10.1016/j.mib.2013.10.001 |
ALLOUI T, BOUSSEBOUGH I, CHAOUI A, et al, 2015. Usearch: A Meta Search Engine based on a New Result Merging Strategy. Journal of South-central College For Nationalities(Natural Sciences), 2015: 269-272 |
AZAM F, LONG R A, 2001. Sea snow microcosms. Nature, 414(6863): 495-498 DOI:10.1038/35107174 |
BAUER J E, CAI W J, RAYMOND P A, et al, 2013. The changing carbon cycle of the coastal ocean. Nature, 504(7478): 61-70 DOI:10.1038/nature12857 |
BRACKEN L J, WAINWRIGHT J, ALI G A, et al, 2013. Concepts of hydrological connectivity: research approaches, pathways and future agendas. Earth-Science Reviews, 119: 17-34 DOI:10.1016/j.earscirev.2013.02.001 |
CHEN H, ZHANG H, XIONG J, et al, 2016. Successional trajectories of bacterioplankton community over the complete cycle of a sudden phytoplankton bloom in the Xiangshan Bay, East China Sea. Environmental Pollution, 219: 750-759 DOI:10.1016/j.envpol.2016.07.035 |
CHEN S F, ZHOU Y Q, CHEN Y R, et al, 2018. Fastp: an ultra-fast all-in-one FASTQ preprocessor. Bioinformatics, 34(17): i884-i890 DOI:10.1093/bioinformatics/bty560 |
COLE J J, CARACO N F, 2001. Carbon in catchments: connecting terrestrial carbon losses with aquatic metabolism. Marine and Freshwater Research, 52(1): 101-110 DOI:10.1071/MF00084 |
CRUMP B C, ARMBRUST E V, BAROSS J A, 1999. Phylogenetic analysis of particle-attached and free-living bacterial communities in the Columbia River, its estuary, and the adjacent coastal ocean. Applied and Environmental Microbiology, 65(7): 3192-3204 DOI:10.1128/AEM.65.7.3192-3204.1999 |
CRUMP B C, BAROSS J A, 2000. Archaeaplankton in the Columbia River, its estuary and the adjacent coastal ocean, USA. FEMS Microbiology Ecology, 31(3): 231-239 DOI:10.1111/j.1574-6941.2000.tb00688.x |
CRUMP B C, BAROSS J A, SIMENSTAD C A, 1998. Dominance of particle-attached bacteria in the Columbia River estuary, USA. Aquatic Microbial Ecology, 14: 7-18 DOI:10.3354/ame014007 |
DELONG E F, FRANKS D G, ALLDREDGE A L, 1993. Phylogenetic diversity of aggregate-attached vs. free-living marine bacterial assemblages. Limnology and Oceanography, 38(5): 924-934 DOI:10.4319/lo.1993.38.5.0924 |
GALAND P E, CASAMAYOR E O, KIRCHMAN D L, et al, 2009. Unique archaeal assemblages in the Arctic Ocean unveiled by massively parallel tag sequencing. The ISME Journal, 3(7): 860-869 DOI:10.1038/ismej.2009.23 |
GANESH S, PARRIS D J, DELONG E F, et al, 2014. Metagenomic analysis of size-fractionated picoplankton in a marine oxygen minimum zone. The ISME Journal, 8(1): 187-211 DOI:10.1038/ismej.2013.144 |
GUO X, FENG J, SHI Z, et al, 2018. Climate warming leads to divergent succession of grassland microbial communities. Nature Climate Change, 8(9): 813-818 DOI:10.1038/s41558-018-0254-2 |
HEWSON I, FUHRMAN J A, 2004. Bacterioplankton species richness and diversity along an estuarine gradient in Moreton Bay, Australia. Appl Environ Microbiol, 70: 3425-3433 DOI:10.1128/AEM.70.6.3425-3433.2004 |
HUANG L B, BAI J H, WANG J J, et al, 2022a. Different stochastic processes regulate bacterial and fungal community assembly in estuarine wetland soils. Soil Biology and Biochemistry, 167: 108586 DOI:10.1016/j.soilbio.2022.108586 |
HUANG Y, QU W, FAN Y P, et al, 2022b. Archaeal diversity in the seawater of Changjiang River estuary reveals its adaptability to bottom seawaters. Journal of Oceanology and Limnology, 003: 040 |
JAIN A, KRISHNAN K P, 2021. Marine Group-Ⅱ archaea dominate particle-attached as well as free-living archaeal assemblages in the surface waters of Kongsfjorden, Svalbard, Arctic Ocean. Antonie van Leeuwenhoek, 114(5): 633-647 DOI:10.1007/s10482-021-01547-1 |
KELLOGG C T E, DEMING J W, 2009. Comparison of free-living, suspended particle, and aggregate-associated bacterial and archaeal communities in the Laptev Sea. Aquatic Microbial Ecology, 57(1): 1-18 DOI:10.1007/s00248-008-9465-9 |
KIM B S, KIM B K, LEE J H, et al, 2008. Rapid phylogenetic dissection of prokaryotic community structure in tidal flat using pyrosequencing. The Journal of Microbiology, 46(4): 357-363 DOI:10.1007/s12275-008-0071-9 |
KIØRBOE T, JACKSON G A, 2001. Marine snow, organic solute plumes, and optimal chemosensory behavior of bacteria. Limnology and Oceanography, 46(6): 1309-1318 DOI:10.4319/lo.2001.46.6.1309 |
KIRCHMAN D L, 1993. Particulate detritus and bacteria in marine environments. Aquatic Microbiology: an Ecological Approach. Oxford: Blackwell Scientific Publishing, 321-341
|
LAMONTAGNE M, HOLDEN P, 2003. Comparison of free-living and particle-associated bacterial communities in a coastal lagoon. Microbial Ecology, 46(2): 228-237 DOI:10.1007/s00248-001-1072-y |
LEIBOLD M A, MCPEEK M A, 2006. Coexistence of the niche and neutral perspectives in community ecology. Ecology, 87(6): 1399-1410 DOI:10.1890/0012-9658(2006)87[1399:COTNAN]2.0.CO;2 |
LI J T, GU L Y, BAI S J, et al, 2021. Characterization of particle-associated and free-living bacterial and archaeal communities along the water columns of the South China Sea. Biogeosciences, 18(1): 113-133 DOI:10.5194/bg-18-113-2021 |
LI J, GU L, BAI S, et al, 2020. Characterization of particle- associated and free-living bacterial and archaeal communities along the water columns of the South China Sea. Biogeosciences, 18(1): 113-133 |
LI M Y, HE H, MI T Z, et al, 2022. Spatiotemporal dynamics of ammonia-oxidizing archaea and bacteria contributing to nitrification in sediments from Bohai Sea and South Yellow Sea, China. Science of the Total Environment, 825: 153972 DOI:10.1016/j.scitotenv.2022.153972 |
LIU C, CUI Y, LI X, et al, 2021. Microeco: an R package for data mining in microbial community ecology. FEMS Microbiology Ecology, 97(2): fiaa255 DOI:10.1093/femsec/fiaa255 |
LIU K, HOU J, LIU Y, et al, 2019. Biogeography of the free-living and particle-attached bacteria in Tibetan lakes. FEMS Microbiology Ecology, 95(7): fiz088 DOI:10.1093/femsec/fiz088 |
LIU Y Q, YAO T D, JIAO N Z, et al, 2013. Salinity impact on bacterial community composition in five high-altitude lakes from the Tibetan Plateau, Western China. Geomicrobiology Journal, 30(5): 462-469 DOI:10.1080/01490451.2012.710709 |
MAGOČ T, SALZBERG S L, 2011. FLASH: fast length adjustment of short reads to improve genome assemblies. Bioinformatics, 27(21): 2957-2963 DOI:10.1093/bioinformatics/btr507 |
MEYERHOF M S, WILSON J M, DAWSON M N, et al, 2016. Microbial community diversity, structure and assembly across oxygen gradients in meromictic marine lakes, Palau. Environmental Microbiology, 18(12): 4907-4919 DOI:10.1111/1462-2920.13416 |
OKSANEN J, BLANCHET F G, KINDT R, et al, 2013. Package 'vegan'. Community Ecology Package, Version, 2(9): 1-295 |
ORSI W D, SMITH J M, WILCOX H M, et al, 2015. Ecophysiology of uncultivated marine euryarchaea is linked to particulate organic matter. The ISME Journal, 9(8): 1747-1763 DOI:10.1038/ismej.2014.260 |
PACHIADAKI M G, SINTES E, BERGAUER K, et al, 2017. Major role of nitrite-oxidizing bacteria in dark ocean carbon fixation. Science, 358(6366): 1046-1051 DOI:10.1126/science.aan8260 |
PLOUG H, IVERSEN M H, FISCHER G, 2008. Ballast, sinking velocity, and apparent diffusivity within marine snow and zooplankton fecal pellets: implications for substrate turnover by attached bacteria. Limnology and Oceanography, 53(5): 1878-1886 DOI:10.4319/lo.2008.53.5.1878 |
PRAHL F G, SMALL L F, EVERSMEYER B, 1997. Biogeochemical characterization of suspended particulate matter in the Columbia River estuary. Marine Ecology Progress Series, 160: 173-184 DOI:10.3354/meps160173 |
PRICE M N, DEHAL P S, ARKIN A P, 2010. FastTree 2-approximately maximum-likelihood trees for large alignments. PLoS One, 5(3): e9490 DOI:10.1371/journal.pone.0009490 |
PRUESSE E, PEPLIES J, GLÖCKNER F O, 2012. SINA: accurate high-throughput multiple sequence alignment of ribosomal RNA genes. Bioinformatics, 28(14): 1823-1829 DOI:10.1093/bioinformatics/bts252 |
PULIDO-VILLENA E, BAUDOUX A C, OBERNOSTERER I, et al, 2014. Microbial food web dynamics in response to a Saharan dust event: results from a mesocosm study in the oligotrophic Mediterranean Sea. Biogeosciences, 11(19): 5607-5619 DOI:10.5194/bg-11-5607-2014 |
SIMON M, GROSSART H P, SCHWEITZER B, et al, 2002. Microbial ecology of organic aggregates in aquatic ecosystems. Aquatic Microbial Ecology, 28(2): 175-211 |
SLOAN W T, LUNN M, WOODCOCK S, et al, 2006. Quantifying the roles of immigration and chance in shaping prokaryote community structure. Environmental Microbiology, 8(4): 732-740 DOI:10.1111/j.1462-2920.2005.00956.x |
SMITH M W, ZEIGLER ALLEN L, ALLEN A E, et al, 2013. Contrasting genomic properties of free-living and particle-attached microbial assemblages within a coastal ecosystem. Frontiers in Microbiology, 4: 120 |
STEGEN J C, LIN X J, FREDRICKSON J K, et al, 2013. Quantifying community assembly processes and identifying features that impose them. The ISME Journal, 7(11): 2069-2079 DOI:10.1038/ismej.2013.93 |
STEGEN J C, LIN X, FREDRICKSON J K, et al, 2015. Estimating and mapping ecological processes influencing microbial community assembly. Frontiers in Microbiology, 6: 370 |
SU H L, WU C C, HAN P Y, et al, 2022. The microbiome and its association with antibiotic resistance genes in the hadal biosphere at the Yap Trench. Journal of Hazardous Materials, 439: 129543 DOI:10.1016/j.jhazmat.2022.129543 |
SUTER E A, PACHIADAKI M, TAYLOR G T, et al, 2018. Free- living chemoautotrophic and particle-attached heterotrophic prokaryotes dominate microbial assemblages along a pelagic redox gradient. Environmental Microbiology, 20(2): 693-712 DOI:10.1111/1462-2920.13997 |
TER BRAAK C J, SMILAUER P, 2002. CANOCO reference manual and CanoDraw for Windows user's guide: software for canonical community ordination (version 4.5) [EB/OL]. https://www.wur.nl/en/research-results/research-institutes/show/canoco-for-visualization-of-multivariate-data.htm.
|
TRIPATHI B M, KIM M, LAI-HOE A, et al, 2013. pH dominates variation in tropical soil archaeal diversity and community structure. FEMS Microbiology Ecology, 86(2): 303-311 DOI:10.1111/1574-6941.12163 |
VELLEND M, 2010. Conceptual synthesis in community ecology. Quarterly Review of Biology, 85(2): 183-206 DOI:10.1086/652373 |
VELLEND M, SRIVASTAVA D S, ANDERSON K M, et al, 2015. Assessing the relative importance of neutral stochasticity in ecological communities. Oikos, 123(12): 1420-1430 |
WU W X, XU Z M, DAI M H, et al, 2021. Homogeneous selection shapes free-living and particle-associated bacterial communities in subtropical coastal waters. Diversity and Distributions, 27(10): 1904-1917 DOI:10.1111/ddi.13193 |
XIE M W, CHEN M, WANG W X, 2018. Spatial and temporal variations of bulk and colloidal dissolved organic matter in a large anthropogenically perturbed estuary. Environmental Pollution, 243: 1528-1538 DOI:10.1016/j.envpol.2018.09.119 |
XUN W B, LI W, XIONG W, et al, 2019. Diversity-triggered deterministic bacterial assembly constrains community functions. Nature Communications, 10(1): 3833 DOI:10.1038/s41467-019-11787-5 |
YAN Q, STEGEN J C, YU Y, et al, 2017. Nearly a decade-long repeatable seasonal diversity patterns of bacterioplankton communities in the eutrophic Lake Donghu (Wuhan, China). Molecular Ecology, 26(14): 3839-3850 DOI:10.1111/mec.14151 |
YIN X B, WANG W T, WANG A H, et al, 2022. Microbial community structure and metabolic potential in the coastal sediments around the Yellow River Estuary. Science of the Total Environment, 816: 151582 DOI:10.1016/j.scitotenv.2021.151582 |
YUE Y H, TANG Y, CAI L, et al, 2022. Co-occurrence relationship and stochastic processes affect sedimentary archaeal and bacterial community assembly in estuarine- coastal margins. Microorganisms, 10(7): 1339 DOI:10.3390/microorganisms10071339 |
ZENG Y H, LI H Y, JIAO N Z, 2007. Phylogenetic diversity of planktonic archaea in the estuarine region of East China Sea. Microbiological Research, 162(1): 26-36 DOI:10.1016/j.micres.2006.03.007 |
ZHAO D, GAO P, XU L, et al, 2021. Disproportionate responses between free-living and particle-attached bacteria during the transition to oxygen-deficient zones in the Bohai Seawater. Science of the Total Environment, 791: 1480-1497 |
ZHOU J Z, NING D L, 2017. Stochastic community assembly: does it matter in microbial ecology?. Microbiology and Molecular Biology Reviews, 81(4): e00002-17 |
 2023, Vol. 54
2023, Vol. 54


