中国海洋湖沼学会主办。
文章信息
- 霍润明, 尹恒, 柴若愚, 王涵颖, 黄玲, 王萍. 2023.
- HUO Run-Ming, YIN Heng, CHAI Ruo-Yu, WANG Han-Ying, HUANG Ling, WANG Ping. 2023.
- 蝉花菌质(Isaria cicadae)对大黄鱼(Larimichthys crocea)幼鱼生长、免疫和肠道菌群的影响
- EFFECTS OF ISARIA CICADAE ON GROWTH, IMMUNITY, AND INTESTINAL FLORA OF JUVENILE LARGE YELLOW CROAKER (LARIMICHTHYS CROCEA)
- 海洋与湖沼, 54(3): 811-820
- Oceanologia et Limnologia Sinica, 54(3): 811-820.
- http://dx.doi.org/10.11693/hyhz20220900244
文章历史
-
收稿日期:2022-09-26
收修改稿日期:2023-01-19
2. 浙江海洋大学海洋科学与技术学院 浙江舟山 316022
2. College of Marine Science and Technology, Zhejiang Ocean University, Zhoushan 316022, China
大黄鱼(Larimichthys crocea)属鲈形目(Perciformes)、石首鱼科(Sciaenidae), 主要分布在中国沿海、朝鲜半岛西海岸和越南沿海, 是我国重要的传统捕捞鱼类(韩坤煌等, 2011)。大黄鱼繁殖能力强、味道鲜美, 经济价值高, 因此成为中国近海地区主要的经济鱼类(李磊等, 2019)。养殖规模的不断扩大和抗生素的滥用导致大黄鱼病害问题日趋严峻, 已成为制约大黄鱼产业健康发展的主要因素(王凡等, 2019), 以哈维氏弧菌(Vibrio harveyi)病等为代表的疾病严重威胁着大黄鱼养殖业的健康发展(徐晓津等, 2010)。因此, 寻找无害且不污染环境的绿色抗生素成为水产养殖研究的热点(赵红霞等, 2020)。
蝉花(Cordyceps sobolifera)是一种虫草属(Cordyceps)真菌, 可以提高机体的免疫调节功能(王砚等, 2001)。蝉花中的胞外多糖, 是一类能够促进体细胞新陈代谢和再生的自然产物, 它既可以降低病毒对人体细胞的影响, 又可以增强体内吞噬细胞的活力, 人们长期服用之后会使人体抗病能力明显提高; 蝉花对人体的神经系统影响很显著, 能产生镇定安神的作用, 对人体的失眠也有非常明显的调理效果(Yang et al, 2010; 孙长胜, 2020)。蝉花菌质(Isaria cicadae)为含有部分蝉花菌丝体的人工蝉花培养基残留物。因此, 为减少动物养殖中抗生素的使用和提高蝉花菌质的利用价值, 在养殖动物饲料中添加蝉花菌质的相关研究相继展开。
目前, 蝉花菌质已经应用在一些养殖动物中。李冲等(2021)在饲料中添加2%的蝉花菌丝体饲喂雁荡麻鸡(Gallus gallus domesticus) 40 d, 发现添加蝉花菌丝可以改变肌肉的风味品质。喀伊热·热合木江等(2021)将精日粮中的精料部分按比例替换为蝉花基质饲料进行体外消化试验, 结果表明, 添加蝉花菌质可以改善绵羊(Ovis aries)的采食量和消化率, 对肉质无明显的影响(喀伊热·热合木江, 2021)。本研究通过在饲料中添加蝉花菌质来探究其对大黄鱼幼鱼的生长、先天性免疫功能、肠道组织结构和肠道菌群的影响, 以期为大黄鱼新配合饲料的开发利用和人工绿色养殖提供新的理论依据。
1 材料与方法 1.1 试验动物及饲料制备试验所需的大黄鱼幼鱼购于舟山市半岛水产养殖有限公司。先将大黄鱼幼鱼暂养14 d。暂养结束后, 挑选360尾体格相当、健康无伤的大黄鱼幼鱼开展试验, 鱼的平均质量为(16.50±1.10) g, 平均体长为(12.68±2.09) cm。随后进行随机分组, 每个处理组分三个网箱, 每个网箱30尾, 养殖周期为8周。
蝉花菌质从浙江东珍海洋科技有限公司购买, 干燥后用粉碎机进行粉碎, 粉碎后过60目筛, 制成备用蝉花菌质粉, 对其进行营养成分分析, 粗蛋白、粗脂肪、粗灰分、水分含量分别为17.03%、2.43%、1.59%、4.92%。以无添加蝉花菌质的饲料作为对照组(IC0), 3个试验组分别添加1% (IC1)、3% (IC3)和5% (IC5)的蝉花菌质(表 1)。饲料制作所需原料有鱼粉、豆粕、小麦淀粉、豆油、鱼油、复核预混料、大豆卵磷脂、纤维素、氯化胆碱和谷朊粉(浙江汉贝生物科技有限公司)。首先, 饲料原料和蝉花按照逐级扩大法倒入饲料制粒机中制成颗粒直径为3 mm的饲料, 然后, 饲料在45 ℃的烘箱中烘干至水分低于10%, 装入自封袋中放入4 ℃冰箱冷藏保存。
| 原料成分 | 饲料组 | |||
| IC0 | IC1 | IC3 | IC5 | |
| 鱼粉1 | 40.00 | 40.00 | 40.00 | 40.00 |
| 豆粕1 | 15.00 | 15.00 | 15.00 | 15.00 |
| 小麦淀粉1 | 13.00 | 13.00 | 13.00 | 13.00 |
| 谷朊粉1 | 12.00 | 12.00 | 12.00 | 12.00 |
| 蝉花菌质2 | 0.00 | 1.00 | 3.00 | 5.00 |
| 鱼油 | 2.43 | 2.42 | 2.39 | 2.37 |
| 大豆油 | 2.43 | 2.42 | 2.39 | 2.37 |
| 纤维素 | 6.84 | 5.87 | 3.92 | 1.96 |
| 大豆卵磷脂3 | 1.50 | 1.50 | 1.50 | 1.50 |
| 磷酸二氢钙 | 1.50 | 1.50 | 1.50 | 1.50 |
| 氯化胆碱 | 0.30 | 0.30 | 0.30 | 0.30 |
| 复合矿物质4 | 2.00 | 2.00 | 2.00 | 2.00 |
| 复合维生素5 | 3.00 | 3.00 | 3.00 | 3.00 |
| 总计 | 100.00 | 100.00 | 100.00 | 100.00 |
| 营养成分(%干物质) | ||||
| 粗蛋白 | 45.41 | 45.85 | 45.29 | 45.41 |
| 粗脂肪 | 10.24 | 13.42 | 9.93 | 10.17 |
| 灰分 | 12.48 | 10.94 | 10.92 | 10.76 |
| 注: 1 鱼粉: 73.15%粗蛋白, 8.12%粗脂肪, 16.93%粗灰分, 11.47%水分; 谷朊粉: 75.72%粗蛋白, 1.20%粗脂肪, 1.27%粗灰分, 6.10%水分; 豆粕: 45.35%粗蛋白, 1.66%粗脂肪, 6.23%粗灰分, 7.13%水分; 谷朊粉购自浙江自贸区宏泰生物科技有限公司, 其余均购自浙江汉贝生物科技有限公司。 2 蝉花菌质: 虫草属真菌占95.57%, 浙江东珍生物科技有限公司。 3 大豆卵磷脂: 50%卵磷脂, 浙江汉贝生物科技有限公司。 4 复合矿物质(mg或g/kg): 甘氨酸铜络合物: 0.2 mg, 一水硫酸亚铁: 1.8 mg, 一水硫酸锰: 0.55 mg, 一水硫酸锌: 4.5 mg, 碘酸钙: 0.1 mg, 一水硫酸钴: 0.05 mg, 亚硒酸钠: 0.015 mg, 沸石粉: 8.45 g。 5 复合维生素(mg或g/kg): 维生素A乙酸酯: 4.5 mg, 维生素D3: 1.875 mg, d1-α-生育酚乙酸酯: 3.8 mg、亚硫酸氢烟酰胺甲萘醌: 0.25 mg, 维生素B1: 0.38 mg, 维生素B2: 0.7 mg, 维生素B6: 0.5 mg, 维生素B12: 0.004 mg, 肌醇: 4 mg, L-抗坏血酸-2-磷酸酯: 5.5 mg, 烟酰胺: 3.7 mg, 泛酸钙: 1.6 mg, 叶酸: 0.08 mg, 生物素: 0.04 mg, 乙氧基喹啉: 2.3 mg, 二丁基羟基甲苯: 0.75 mg。 |
||||
养殖试验在舟山市半岛水产养殖有限公司进行, 试验前先将大黄鱼幼鱼放进网箱中暂养2周, 暂养期间用对照组饲料进行投喂, 使之适应饲料和进食时间, 暂养期间水温为25.8~27.3 ℃, 盐度为26~28, 溶解氧含量为6.2~7.5 mg/L。暂养结束后挑选体格健壮、大小均匀的大黄鱼幼鱼随机分组, 每天投喂两次(5:00和17:00), 投喂量为鱼体重的4%左右, 养殖周期为56 d。养殖期间海水水温为17.8~ 25.8 ℃, 盐度为26~30, 溶解氧含量为6.2~7.5 mg/L, 亚硝酸盐含量<0.005 g/mL, 氨氮含量<0.2 g/mL。
1.2.2 样品采集养殖试验结束时, 鱼饥饿处理24 h。取样前用60 mg/L丁香酚对鱼进行麻醉。对鱼称重, 并测量体长、体宽和体高。解剖取其内脏和肝脏, 分别称重, 用于计算脏体比和肝体比。解剖取背部肌肉并放入–20 ℃冷藏保存用于测肌肉常规体成分。每个网箱随机选取5条鱼用来检测全鱼的常规体成分。用一次性采血盛血器自尾部静脉取血, 将血液移入采血管中, 放至冰上静置4 h, 离心(3 000 r/min) 10 min, 取上清液保存至–80 ℃冰箱, 用于血清免疫指标的测定。取血后将鱼解剖取其肝脏, 保存至–80 ℃冰箱, 用于肝脏抗氧化酶活性的测定。每个网箱取4条鱼的后肠, 2条经4%多聚甲醛固定, 严格按照本单位病理实验检查SOP程序进行修剪、脱水、包埋、切片、染色、封片最后镜检合格的样片; 2条送检测肠道菌群(北京百迈克生物科技有限公司)。
1.2.3 常规成分和酶活的测定饲料原料、饲料以及鱼体常规成分测定采用AOAC的方法。其中水分测定是用105 ℃烘箱, 烘至恒重。采用凯氏定氮法测定粗蛋白。索氏抽提法(乙醚为抽提液)测定粗脂肪。灰分的测定是在马福炉中(550 ℃)灼烧12 h之后称其重量所得。
抗氧化和免疫能力的指标超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)和溶菌酶(LZM)补体C3、补体C4、谷丙转氨酶和谷草转氨酶均采用南京建成科技有限公司生产的剂盒进行测定, 测定方法参考说明书进行。
1.2.4 肠道组织结构和肠道菌群的测定使用EcLipse Ci-L (Nikon, 日本)正置式白光摄影显微镜在组织的条目范围内进行40倍成像, 在成像时确保每个图像的背景光相同。成像结束后, 通过Image-Pro Plus 6.0分析软件系统(Media Cybemetics, 美国)统一以μm为标准单位, 分别测定了每张切片中的5根完整绒毛长度; 5个单根绒毛杯状细胞数量; 5处隐窝深度和5处黏膜厚度并计算出平均值。
前处理获得样本的DNA后, 再通过保守区选择获得引物, 然后在引物尾部添加系列检测接头, 再通过PCR扩增对其产品经过纯化、定量分析和均一化后建立系列检测文库, 对已建成的文库要通过文库质量检验, 质检符合要求的文库用Illumina Novaseq 6000完成检测, 16S V3-V4区扩增的引物一般是U338F (5′-ACTCCTACGGGAGGCAGCAG-3′)和U806R (5′-GGACTACHVGGGTWTCTAAT-3′)。高通量测序(如Illumina Novaseq等测序平台)获得的原始图像数据资料, 经碱基辨识(Base Calling)解析转换为原始检测序列(Sequenced Reads), 最终成果以FASTQ (简写为fq)文档形式保存, 当中含有检测序列(Reads)的顺序内容和其他相应的序列测定质量内容。
肠道菌群的数据处理方法, 首先通过Trimmomatic v0.33软件, 对检测得出的Raw Reads内容实施质量筛选; 接着再通过cutadapt1.9.1软件实现了引物序列的鉴别和消除, 从而获得了不含有引物序列的Clean Reads; 使用Usearch v10软件, 通过overlap对每个样品的Clean Reads进行拼接, 然后根据不同区域的长度范围对拼接后数据进行长度过滤; 通过UCHIME v4.2程序, 识别和消除嵌合子序列, 获取最终的数据(Effective Reads)。信息分析内容: 划分Feature (OTUs, ASVs)、多样性分析、差异分析、关联分析和功能预测分析方法(具体见分析结果)。
1.3 统计分析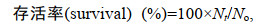 (1)
(1)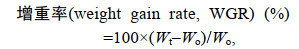 (2)
(2)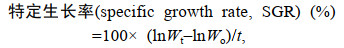 (3)
(3)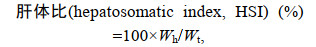 (4)
(4)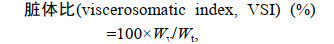 (5)
(5)式中, Wo和Wt分别代表试验鱼初始体重和末体重的质量; No和Nt分别代养殖试验开始时和结束时网箱中大黄鱼的尾数; Wh和Wv分别代表大黄鱼的肝脏总重和大黄鱼内脏团总重; t表示试验天数56 d。
采用SPSS 26.0软件对所得数据进行单因素方差分析(ANOVA), 差异显著后进行Tukey多重比较, 显著性水平设为P<0.05; 试验结果以平均值±标准差表示。
2 结果与分析 2.1 蝉花菌质对大黄鱼幼鱼生长性能和体成分的影响由表 2可以看出, 大黄鱼幼鱼试验组的增重率和特定生长率显著高于对照组(P<0.05), 但是试验组各组之间无显著性差异(P>0.05)。对照组的肝体比显著高于IC3和IC5组(P<0.05), 与IC1组差异不显著(P>0.05)。对照组脏体比显著大于IC5组且与其他试验组差异不显著(P<0.05), 各试验组之间差异不显著(P>0.05)。对照组和试验组之间存活率差异不显著(P>0.05)。
| 项目 | 饲料组 | |||
| IC0 | IC1 | IC3 | IC5 | |
| 存活率/% | 82.22±1.92 | 85.56±1.93 | 82.22±3.85 | 82.11±1.92 |
| 增重率/% | 138.54±23.45a | 170.71±6.29b | 166.67±7.21b | 178.48±8.05b |
| 特定生长率/(%/d) | 1.54±0.16a | 1.77±0.04b | 1.75±0.05b | 1.82±0.05b |
| 肝体比/% | 1.84±0.65a | 1.71±0.55ab | 1.26±0.66bc | 1.22±0.51bc |
| 脏体比/% | 9.68±2.73a | 8.84±2.55ab | 8.32±1.13ab | 7.38±1.62b |
| 注: 表中数据均为“平均值±标准差”, 每一行数据右上角字母不同表示差异显著(P<0.05); 字母相同或无字母表示差异不显著(P>0.05)。下同 | ||||
由表 3可以看出, 大黄鱼幼鱼肌肉和全鱼的水分、粗蛋白、粗脂肪和灰分含量对照组和试验组之间差异不显著(P>0.05)。
| 项目 | 饲料组 | |||
| IC0 | IC1 | IC3 | IC5 | |
| 肌肉组成 | ||||
| 水分/% | 76.49±0.03 | 77.76±0.10 | 79.83±0.03 | 78.49±3.51 |
| 粗蛋白/% | 12.94±0.38 | 13.42±0.12 | 12.91±0.30 | 13.24±0.80 |
| 粗脂肪/% | 5.81±0.42 | 5.75±0.14 | 6.15±0.34 | 6.16±0.57 |
| 灰分/% | 1.77±0.16 | 2.17±0.19 | 2.34±0.09 | 1.85±0.44 |
| 全鱼组成 | ||||
| 水分/% | 76.58±0.17 | 75.41±0.04 | 77.06±0.25 | 75.45±0.42 |
| 粗蛋白/% | 12.97±0.86 | 13.60±0.49 | 13.81±0.34 | 13.61±0.52 |
| 粗脂肪/% | 6.18±0.72 | 6.97±0.39 | 6.28±0.89 | 6.60±0.20 |
| 灰分/% | 3.51±0.37 | 3.55±0.22 | 3.57±0.61 | 3.31±0.32 |
由表 4可以看出, 大黄鱼幼鱼的肝脏总超氧化物歧化酶(T-SOD)、谷胱甘肽过氧化物酶(GSH-Px)和丙二醛(MDA)的活性对照组与试验组之间均无显著性差异(P>0.05), 但试验组的总超氧化物歧化酶(T-SOD)的活性相对高于对照组。肝脏过氧化氢酶(CAT)的活性试验组显著高于对照组(P<0.05)。
| 项目 | 饲料组 | |||
| IC0 | IC1 | IC3 | IC5 | |
| T-SOD/(U/mL) | 1.48±0.01 | 2.48±0.02 | 1.80±0.21 | 2.66±1.52 |
| CAT/(U/mL) | 5.94±0.68a | 9.86±0.11b | 9.05±1.63b | 9.10±0.15b |
| GSH-Px/(U/mL) | 18.02±8.30 | 14.33±7.39 | 16.93±8.52 | 10.29±7.96 |
| MDA/(nmol/mL) | 4.41±1.55 | 4.34±1.48 | 4.27±1.04 | 3.65±1.54 |
由表 5可以看出, 大黄鱼幼鱼的血清补体C3、补体C4、谷丙转氨酶(ALT)和谷草转氨酶(AST)活性对照组与试验组之间均无显著性差异(P>0.05)。溶菌酶(LZM)活性试验组显著高于对照组(P<0.05), 各试验组之间无显著性差异(P>0.05)。
| 项目 | 饲料组 | |||
| IC0 | IC1 | IC3 | IC5 | |
| LZM/(U/mL) | 35.17±18.74b | 57.62±12.17ab | 50.03±10.16ab | 60.94±14.57a |
| 补体C3/(g/L) | 0.02±0.01 | 0.02±0.01 | 0.02±0.01 | 0.02±0.01 |
| 补体C4/(g/L) | 0.05±0.00 | 0.05±0.00 | 0.05±0.01 | 0.051±0.01 |
| ALT/(U/L) | 16.69±5.21 | 15.31±1.85 | 19.86±4.41 | 18.64±6.78 |
| AST/(U/L) | 67.40±11.91 | 48.86±9.17 | 55.76±14.69 | 59.11±8.14 |
如图 1和表 6所示, 大黄鱼幼鱼后肠的组织切片可以看出, 对照组和试验组的肠黏膜厚度、褶皱高度以及固有膜宽度等均无显著性差异(P>0.05)。对照组肠道单根绒毛杯状细胞数量显著少于试验组(P<0.05), 试验组之间均无显著性差异(P>0.05)。
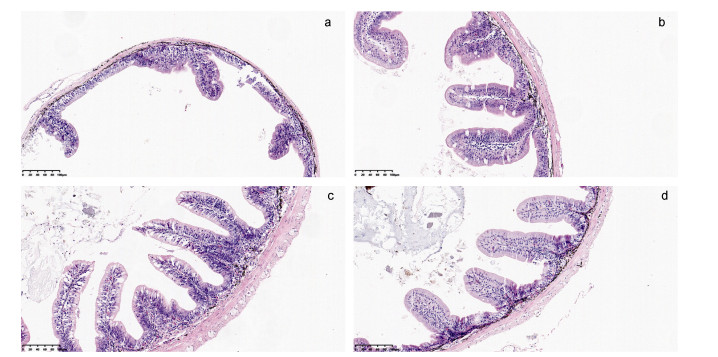 |
| 图 1 蝉花菌质对大黄鱼幼鱼后肠组织结构的影响 Fig. 1 Observation on the structure of hindgut tissue of juvenile large yellow croaker fed with I. cicadae 注: a. IC0组的后肠组织切片; b. IC1组的后肠组织切片; c. IC3组的后肠组织切片; d. IC5组的后肠组织切片 |
| 项目 | 饲料组 | |||
| IC0 | IC1 | IC3 | IC5 | |
| 单根绒毛杯状细胞数量/个 | 5.07±1.34a | 10.67±6.72b | 10.93±3.39b | 11.55±2.21b |
| 黏膜厚度/μm | 8.15±3.25 | 12.60±4.95 | 12.65±6.81 | 16.80±11.36 |
| 皱褶高度/μm | 156.88±35.04 | 248.38±101.98 | 221.90±123.79 | 268.56±169.10 |
| 固有膜宽度/μm | 34.98±5.63 | 36.53±5.60 | 31.50±5.23 | 34.39±1.86 |
微生物群落的丰度和多样性可以用Alpha多样性反应分析。如表 7所示, 各处理组的覆盖率接近为1, 表示样本中几乎所有的序列都已经被检测到。通过试验组和对照组的Chao指数、Simpson指数和Shannon指数的平均值进行显著性分析发现, 各处理组的Simpson指数和Shannon指数差异不显著(P>0.05), IC0和IC1组的Chao指数显著高于IC3和IC5试验组(P<0.05), 表明IC0和IC1组的肠道菌群丰度高于IC3和IC5组。
| 项目 | 饲料组 | |||
| IC0 | IC1 | IC3 | IC5 | |
| Chao1指数 | 1 044.43±35.55a | 1 019.98±30.07a | 968.62±11.68b | 978.07±4.72b |
| Simpson指数 | 0.99±0.01 | 0.99±0.00 | 0.93±0.07 | 0.99±0.04 |
| Shannon指数 | 8.02±0.69 | 8.45±0.04 | 7.31±1.11 | 8.41±0.05 |
| Coverage指数 | 0.998 8 | 0.999 5 | 0.999 6 | 0.999 5 |
使用Usearch软件(Edgar, 2013)对Reads在97.0%的相似度水平下进行聚类、获得OTU。将各样品中的OTU用Venn命令构建Venn图(Chen et al, 2011), 见图 2。Venn图显示IC0组、IC1组、IC3组和IC5组分别有1 238、1 236、1 260和1 237个聚类。经两两比较后, IC0和IC1组特有的OTU分别为58和62个, 共有的OTU为1 224个; IC0和IC3组特有的OTU分别为79和57个, 共有的OTU为1 203个; IC0和IC5组特有的OTU分别为88和55个, 共有的OTU为1 182个; IC1组和IC3组特有的OTU分别为75和49个, 共有的OTU为1 211个; IC1和IC5组特有的OTU分别为99和55个, 共有的OTU为1 187个; IC3和IC5的OTU分别为88和65个, 共有的OTU为1 172个。四组共有OTU数为1 092个。
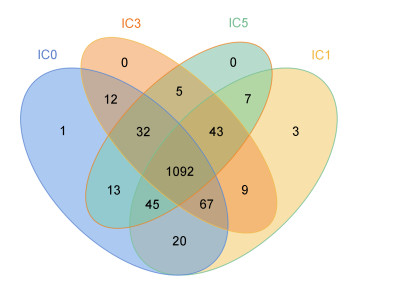 |
| 图 2 各处理组的Venn聚类图分析 Fig. 2 The Venn cluster diagram analysis of each treatment group |
在PCoA分析图中(principal coordinates analysis, PCoA), 试验组和对照组大部分样品聚集较密, 少部分聚集较稀疏, 说明样品成分越相似聚集越密, 其在PCoA图上的距离就越近。非度量多维标定法(Looft et al, 2012) (Non-MetricMulti-Dimensional Scaling, NMDS)一类通过把多维空间的样品或变数简单化, 在低维空间实现位置、解析和归属的分析方法。在坐标图上距离越近的样品, 相似性越高。根据图 3显示, 大部分点集中在一起, 表明大部分肠道菌群的样品差异较小。
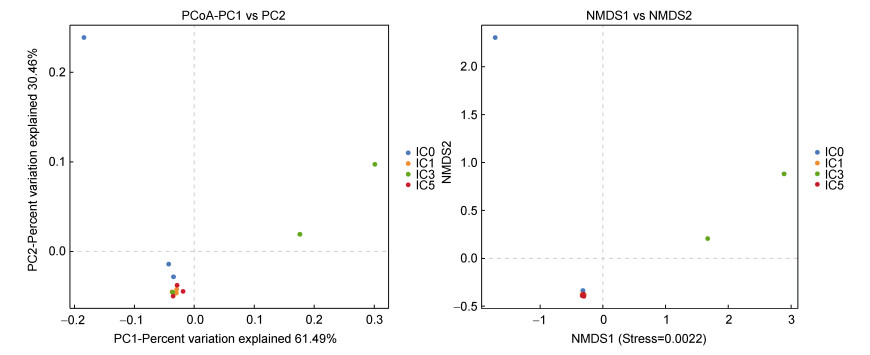 |
| 图 3 多样品PCoA分析(左)和NMDS分析(右) Fig. 3 Multi-sample PCoA analysis (left) and NMDS analysis (right) |
由图 4可见, 微生物的门类主要有10种, 其中厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)所占比例最高。属水平中, 一种未分类的毛螺菌属(unclassified_Lachnospiraceae)、芽孢杆菌属(Bacillus)和一种未分类的S24-7属(unclassified_Muribaculaceae)所占比例较高。试验组和对照组之间的芽孢杆菌属随着蝉花菌质的增加缓慢升高但差异不显著。
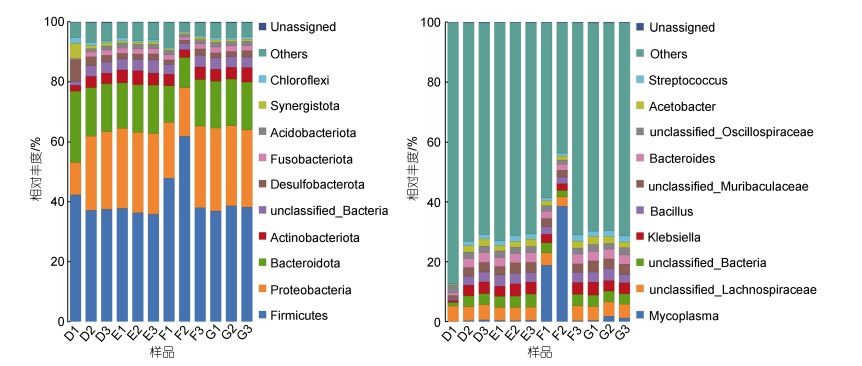 |
| 图 4 各处理组物种组成差异分析, 门水平(左)、属水平(右) Fig. 4 Analysis of differences in species composition of each treatment group at phylum (left) and genus (right) levels |
鱼类的营养物质主要来源于饲料中的蛋白质, 饲料中的蛋白质会在消化器官分解为氨基酸被鱼体吸收, 其营养物质供鱼体进行生长、发育和各项生命活动(李春梅等, 2022)。研究表明, 蝉花菌质可以促进三黄鸡(Gallus gallus domesticus)和罗氏沼虾(Macrobrachium rosenbergii)的生长(刘素贞等, 2012; Liu et al, 2020; Yan et al, 2021)。徐后国等(2011)的研究发现, 在饲料中添加枯草芽孢杆菌和寡糖可以显著提高大黄鱼幼鱼的生长率。该试验组大黄鱼幼鱼的特定生长率和增重率都显著高于对照组, 说明蝉花菌质能够提高大黄鱼幼鱼对饲料的利用率, 将饲料中的蛋白质转化为营养物质促进鱼体生长。添加3%和5%的蝉花菌质试验组的肝体比显著大于对照组, IC5组的脏体比显著大于其他组, 说明大黄鱼幼鱼的生长效果较好, 添加蝉花菌质比例越高, 内脏和肝脏占比越低。
研究表明, 脂肪和蛋白质的含量是鱼类肌肉营养组成的关键因素(王骥腾等, 2011)。饲料中的蛋白质在消化器官被各种消化酶消化并吸收。脂肪是鱼类在开展生存活动时最主要能量物质, 脂肪分解产生的能量也可以供鱼体进行各项生命活动, 也是判定鱼类生长情况的重要指标。李冲等(2021)研究发现, 蝉花菌丝体可以增加鸡肌肉的粗蛋白含量。王成强等02019)在饲料中添加枯草芽孢杆菌和酵母菌, 发现其对珍珠龙胆石斑鱼(Epinephelus Lanceolatus)幼鱼的体成分无显著影响, 与本试验结果相同。韩星星等(2020)也用黑水虻虫粉替代鱼粉饲养大黄鱼, 发现随着替代比例升高大黄鱼肌肉粗蛋白含量显著降低, 水分和粗灰分无显著差别。从大黄鱼幼鱼的体成分结果可知, 蝉花菌质没有显著改变大黄鱼幼鱼的肌肉和全鱼的体成分。
3.2 蝉花菌质对大黄鱼幼鱼抗氧化和免疫性能的影响鱼类先天性免疫系统的动态平衡需要抗氧化酶来维持(Helland et al, 2006)。超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)是抗氧化反应的重要检测指标, 对大黄鱼的抗氧化反应有着重要的影响(袁牧等, 2016; 翟晓虎等, 2018; 张军等, 2019; 黄俊, 2020)。非特异性免疫在鱼类免疫系统中具有重要的作用, 常见的免疫酶有溶菌酶(LZM)、补体C3和补体C4。谷草转氨酶(AST)主要分散在心肌, 可以作为检验心脏和肝脏是否受损的指标之一。谷丙转氨酶(ALT)的主要存在部位为肝脏, 当肝功能损伤时ALT会大量排放到血浆中, 检验肝脏是否受损的指标是检验血清中的ALT含量。
添加蝉花菌质可以提高凡纳滨对虾血淋巴的抗氧化能力(Yan et al, 2021)。王红涛等(2021)在鲤鱼(Cyprinus carpio)饲料中添加枯草芽孢杆菌和蒲公英提取物, 鲤鱼肝脏中的AST、GSH-Px、T-SOD和CAT均有不同程度提高, 说明枯草芽孢杆菌能够增强鲤肝中的抗氧化能力。胡海滨等(2014)饲料中添加大豆黄酮, 发现大豆黄酮显著降低了血清MDA的含量, 并显著提高了大菱鲆幼鱼血清SOD和GSH-Px的活性。Cai等(2019)通过在饲料中添加膳食铅和枯草芽孢杆菌发现, 添加膳食铅对吉贝利奥鲫鱼(C. gibelio)血清的AST、ALT的含量有显著性影响。Jiang等(2019)在饲料中添加蜡样芽胞杆菌QSI-1发现鲫鱼(Carassius auratus auratus)血清中的补体活性和溶菌酶(LZM)活性显著增加。
本试验研究结果发现, 添加蝉花菌质可以显著提升肝脏过氧化氢酶(CAT)的活力, 肝脏的T-SOD、MDA和GSH-Px的含量无显著性差异。对照组的LZM含量显著低于试验组, 三个试验组之前差异不显著。试验组和对照组之间补体C3、补体C4、ALT和AST含量均差异不显著, 表明大黄鱼体内的各项指标没有发生病变和炎症。
3.3 蝉花菌质对大黄鱼幼鱼肠道组织结构的影响肠道是鱼类进行消化和吸取营养的主要场所肠, 肠道的褶皱高度也能够反映肠道的吸收面积, 成为评价鱼小肠吸收能力的最主要指标(伍曦等, 2011; Khosravi et al, 2015)。李云兰等(2015)的研究发现, 发酵豆粕替代豆粕可以保证鲤鱼肠道结构的正常, 没有出现病理损伤。何娇娇等(2018)在用玉米蛋白粉替代鱼粉的研究中, 发现各组的黏膜厚度、褶皱高度和杯状细胞数均无显著性差异, 而本试验对照组杯状细胞个数显著少于试验组, 黏膜厚度与褶皱高度结果与本试验一致。张冬梅等(2022)研究表明, 大口黑鲈幼鱼的饲料中添加枯草芽孢杆菌可以显著增加肠绒毛高度和数量以及肌层厚度。张三珊等(2021)在草鱼饲料中添加大蒜和茯苓发现, 试验组的绒毛长度和杯状细胞个数显著多于对照组, 与本试验结果一致。杯状细胞还能够产生黏蛋白, 黏蛋白的主要功效是润滑胃肠, 并对小肠上皮黏膜产生保护的效果(Wattanaphansak et al, 2008; Hua et al, 2021)。本试验对照组的单根绒毛杯状细胞数量显著低于试验组, 肠道黏膜厚度、褶皱高度和固有膜宽度上均无显著性区别。该结果表明, 添加蝉花菌质通过提高大黄鱼幼鱼小肠结构的保护效果从而提高了小肠对饲料的消化吸收能力。
3.4 蝉花菌质对大黄鱼幼鱼肠道菌群的影响肠道菌群的结构和宿主的种类、体型大小和生活环境密切相关(Song et al, 2020)。汪磊等(2022)在对眼斑双锯鱼(Amphiprion ocellaris)饲料中添加复合益生菌后发现随着益生菌添加量的增加, 变形菌门胆固醇含量增加, 而拟杆菌门胆固醇含量则减少。黄河等(2022)的研究发现在门水平上, 大黑口鲈(Micropterus salmoides)优势菌群为软壁菌门(Phylum Tenericutes)、变形菌门和梭杆菌门(Fusobacteria)。林能锋等(2021)通过研究发现, 养殖花鲈(Lateolabrax japonicus)的主要优势菌群为花鲈肠道菌群以厚壁菌门、变形菌门、拟杆菌门和和梭杆菌门。本研究中, 肠道菌群的OTU数可以反映肠道菌群的多样性, Venn图显示对照组共有1 238个聚类, IC1组有1 236个聚类, IC3组有1 260个聚类, IC5组有1 237个聚类, 说明添加蝉花菌质对大黄鱼幼鱼肠道菌群多样性没有显著性影响。在门分类水平上, 占比最高的为厚壁菌门, 其次是变形菌门, IC3组的厚壁菌门占比显著大于其他组, 但IC3和IC5试验组的肠道菌群丰度低于IC0和IC1组, 该试验结果表明, 蝉花菌质可能抑制了其他病原菌的繁殖, 促进了有益细菌的生长, 导致肠道内菌群多样性下降, 添加3%的蝉花菌质可以提高厚壁菌门的比例。
从属的水平上分析, IC3组支原体比例最高, 其他处理组是一种未分类的毛螺菌属占比最高。毛螺菌属可以产生丁酸预防结肠癌(Meehan et al, 2014), 还可以促进大黄鱼的消化吸收并提高大黄鱼的免疫功能。枯草芽孢杆菌通过分泌挥发性代谢产物和抗生素, 进而维持肠道的酸性环境并抑制病原菌的生长(Zhou et al, 2020)。S24-7 (unclassified_Muribaculaceae)至今没有明确的分类, 但是有关研究表明, 其可以促进复杂的碳水化合物的降解(Lagkouvardos et al, 2019), 试验组的S24-7占比均高于IC0组, IC5试验组占比最高。结果表明, 饲料中添加蝉花菌质可以适当提高肠道中益生菌所占的比例。
4 结论饲料中添加蝉花菌质可以提高大黄鱼幼鱼的特定生长率并降低肝体比和脏体比, 不会改变全鱼和肌肉的组成成分。蝉花菌质可以提高大黄鱼幼鱼肝脏CAT和血清LZM的活性, 增强抗氧化和免疫能力。蝉花菌质还可以起到改善肠道结构的作用, 对大黄鱼幼鱼的肠道菌群丰度没有显著的影响, 但会提高有益菌的物种丰度。
王凡, 廖碧钗, 孙敏秋, 等, 2019. 福建大黄鱼产业发展形势分析. 中国水产, (3): 45-49 DOI:10.3969/j.issn.2095-1833.2019.03.006 |
王红涛, 冯颖, 明美玉, 等, 2021. 枯草芽孢杆菌和蒲公英提取物对鲤鱼生长性能、血清生化指标、免疫指标及抗氧化功能的影响. 中国畜牧杂志, 57(12): 234-239 |
王成强, 李宝山, 王际英, 等, 2019. 饲料中添加枯草芽孢杆菌和酵母培养物对珍珠龙胆石斑鱼幼鱼生长性能、体组成及养殖水质的影响. 浙江大学学报(农业与生命科学版), 45(4): 490-499 |
王砚, 赵小京, 唐法娣, 2001. 蝉花药理作用的初步探讨. 浙江中医杂志, (5): 37-38 |
王骥腾, 韩涛, 胡水鑫, 等, 2011. 豆粕替代鱼粉对日本黄姑鱼生长、饲料利用及体成分影响的研究. 浙江海洋学院学报(自然科学版), 30(4): 279-285 DOI:10.3969/j.issn.1008-830X.2011.04.001 |
伍曦, 罗辉, 冯琳, 等, 2011. 高水平维生素E对幼建鲤生长性能和消化吸收功能的影响. 动物营养学报, 23(11): 1938-1945 DOI:10.3969/j.issn.1006-267x.2011.11.014 |
刘素贞, 厉晓腊, 涂国众, 等, 2012. 虫草蝉花废弃培养基对肉鸡免疫因子及生长发育的影响. 中国家禽, 34(9): 64-65 |
孙长胜, 陈桃宝, 龙文君, 等, 2020. 蝉花子实体抗疲劳作用研究. 药物评价研究, 43(4): 642-647 |
李云兰, 高启平, 帅柯, 等, 2015. 发酵豆粕替代豆粕对鲤鱼生长性能和肠道组织结构的影响. 动物营养学报, 27(2): 469-475 DOI:10.3969/j.issn.1006-267x.2015.02.017 |
李冲, 方鸣, 魏彩霞, 等, 2021. 蝉花菌丝体和植物提取物对雁荡麻鸡生产性能和肌肉品质的影响. 中国家禽, 43(2): 50-54 |
李春梅, 林娟, 2022. 豆粕发酵工艺优化及发酵豆粕替代部分鱼粉对大黄鱼的饲喂效果. 动物营养学报, 34(1): 563-574 |
李磊, 蒋玫, 王云龙, 2019. 邻苯二甲酸二丁酯和邻苯二甲酸二辛酯对大黄鱼受精卵及仔鱼的急性毒性效应. 海洋渔业, 41(3): 346-353 |
何娇娇, 王萍, 冯建, 等, 2018. 玉米蛋白粉对大黄鱼生长、肠道组织结构及肠道菌群的影响. 中国水产科学, 25(2): 361-372 |
汪磊, 武琳, 曾范双, 等, 2022. 复合益生菌对眼斑双锯鱼(Amphiprion ocellaris)肠道消化酶、菌群结构以及形态的影响. 河北渔业, (2): 11-15, 23 |
张三珊, 刘海粟, 林妙华, 等, 2021. 大蒜和茯苓对草鱼幼鱼肠道结构、功能及肠道微生物群落的影响. 饲料工业, 42(22): 6-13 |
张冬梅, 颜浩骁, 罗茂林, 等, 2022. 饲料中添加枯草芽孢杆菌对大口黑鲈幼鱼生长、肠道组织结构、抗氧化能力、免疫能力和肠炎的影响. 动物营养学报, 34(1): 575-588 |
张军, 王硕, 孟繁杰, 等, 2019. 谷胱甘肽过氧化物酶在肿瘤中作用的研究进展. 癌症, 38(6): 282-287 |
林能锋, 潘滢, 许斌福, 等, 2021. 养殖花鲈(Lateolabrax maculatus)肠道菌群的多样性分析. 水产养殖, 42(6): 1-7 |
赵红霞, 王国霞, 孙育平, 等, 2020. 水产新型饲料添加剂的研发与应用. 广东农业科学, 47(11): 135-143 |
胡海滨, 刘金桃, 李彦先, 等, 2014. 饲料中大豆黄酮对大菱鲆生长、消化酶活力、抗氧化力及肠道结构的影响. 水产学报, 38(9): 1503-1513 |
袁牧, 王昌留, 王一斐, 等, 2016. 超氧化物歧化酶的研究进展. 与细胞化学杂志, 25(6): 550-558 |
徐后国, 艾庆辉, 麦康森, 等, 2011. 饲料中添加枯草芽孢杆菌和壳寡糖对大黄鱼幼鱼血清免疫指标的影响. 中国海洋大学学报, 41(7/8): 42-47 |
徐晓津, 徐斌, 王军, 等, 2010. 大黄鱼感染哈维氏弧菌后血液生化指标的变化及组织病理学观察. 水产学报, 34(4): 618-625 |
黄河, 田鑫鑫, 黄旭雄, 等, 2022. 发酵豆粕替代鱼粉对大口黑鲈幼鱼生长、脂质代谢、血清非特异性免疫及肠道菌群的影响. 水生生物学报, 46(4): 466-477 |
黄俊, 2020. 黄鲫蛋白肽对黄姑鱼生长、免疫及肠道菌群的影响[D]. 舟山: 浙江海洋大学: 20-30.
|
韩坤煌, 黄伟卿, 戴燕彬, 2011. 围网与普通网箱养殖大黄鱼营养成分的比较与分析. 河北渔业, (12): 24-28, 57 |
韩星星, 叶坤, 王志勇, 等, 2020. 脱脂黑水虻虫粉替代鱼粉对大黄鱼幼鱼生长、体成分、血清生化指标及抗氧化能力的影响. 中国水产科学, 27(5): 524-535 |
喀伊热·热合木江, 2021. 蝉花基质的饲料特性及绵羊日粮中添加饲喂效果的研究[D]. 乌鲁木齐: 新疆农业大学: 1-10.
|
喀伊热·热合木江, 闫文娟, 哈丽代·热合木江, 等, 2021. 蝉花基质的养分含量以及饲粮添加对绵羊瘤胃发酵和消化率的影响. 饲料研究, 44(9): 7-11 |
翟晓虎, 杨海锋, 陈慧英, 等, 2018. 丙二醛的毒性作用及检测技术研究进展. 上海农业学报, 34(1): 144-148 |
CAI Y N, YIN Y W, WANG L T, et al, 2019. Effect on serum parameters and immune responses of Carassius auratus gibelio exposed to dietary lead and Bacillus subtilis. Biological Trace Element Research, 190(1): 217-225 |
CHEN H B, BOUTROS P C, 2011. Venn Diagram: a package for the generation of highly-customizable Venn and Euler diagrams in R. BMC Bioinformatics, 12: 35 |
EDGAR R C, 2013. UPARSE: highly accurate OTU sequences from microbial amplicon reads. Nature Methods, 10(10): 996-998 |
HELLAND S J, GRISDALE-HELLAND B, 2006. Replacement of fish meal with wheat gluten in diets for Atlantic halibut (Hippoglossus hippoglossus): effect on whole-body amino acid concentrations. Aquaculture, 261(4): 1363-1370 |
HUA M, FAN M L, LI Z M, et al, 2021. Ginseng soluble dietary fiber can regulate the intestinal flora structure, promote colon health, affect appetite and glucolipid metabolism in rats. Journal of Functional Foods, 83: 104534 |
JIANG Y H, ZHOU S X, CHU W H, 2019. The effects of dietary Bacillus cereus QSI-1 on skin mucus proteins profile and immune response in Crucian Carp (Carassius auratus gibelio). Fish & Shellfish Immunology, 89: 319-325 |
KHOSRAVI S, RAHIMNEJAD S, HERAULT M, et al, 2015. Effects of protein hydrolysates supplementation in low fish meal diets on growth performance, innate immunity and disease resistance of red sea bream Pagrus major. Fish & Shellfish Immunology, 45(2): 858-868 |
LAGKOUVARDOS I, LESKER T R, HITCH T C A, et al, 2019. Sequence and cultivation study of Muribaculaceae reveals novel species, host preference, and functional potential of this yet undescribed family. Microbiome, 7(1): 28 |
LIU S S, YAN W J, MA C, et al, 2020. Effects of supplemented culture media from solid-state fermented Isaria cicadae on performance, serum biochemical parameters, serum immune indexes, antioxidant capacity and meat quality of broiler chickens. Asian-Australasian Journal of Animal Sciences, 33(4): 568-578 |
LOOFT T, JOHNSON T A, ALLEN H K, et al, 2012. In-feed antibiotic effects on the swine intestinal microbiome. Proceedings of the National Academy of Sciences of the United States of America, 109(5): 1691-1696 |
MEEHAN C J, BEIKO R G, 2014. A phylogenomic view of ecological specialization in the Lachnospiraceae, a family of digestive tract-associated bacteria. Genome Biology and Evolution, 6(3): 703-713 |
SONG P, YANG D L, WANG H P, et al, 2020. Relationship between intestinal flora structure and metabolite analysis and immunotherapy efficacy in Chinese NSCLC patients. Thoracic Cancer, 11(6): 1621-1632 |
WATTANAPHANSAK S, ASAWAKARN T, GEBHART C J, et al, 2008. Development and validation of an enzyme-linked immunosorbent assay for the diagnosis of porcine proliferative enteropathy. Journal of Veterinary Diagnostic Investigation, 20(2): 170-177 |
YAN W J, ZHOU Q L, LIU B, et al, 2021. Isaria cicadae Miquel improves the growth performance, physiological response and meat quality of giant freshwater prawn, Macrobrachium rosenbergii. Pakistan Journal of Zoology, 53(6): 2001-2521 |
YANG X X, CHEN X H, CHEN F J, et al, 2010. Protective effects of Cordyceps sinensis and mycelium of cultured sinensis on acute liver injury and expression of CYP450 induced by Carbon Tetrachloride. Chinese Journal of Primary Medicine and Pharmacy, 17(4): 457-459 |
ZHOU Y H, ZENG Z H, XU Y B, et al, 2020. Application of Bacillus coagulans in animal husbandry and its underlying mechanisms. Animals, 10(3): 454 |
 2023, Vol. 54
2023, Vol. 54


