中国海洋湖沼学会主办。
文章信息
- 陈睿毅, 刘明涛, 竺奇慧, 李海东, 胡伟华, 徐冬冬. 2023.
- CHEN Rui-Yi, LIU Ming-Tao, ZHU Qi-Hui, LI Hai-Dong, HU Wei-Hua, XU Dong-Dong. 2023.
- 条石鲷(Oplegnathus fasciatus)雌核发育的人工诱导与鉴定
- ARTIFICIAL INDUCTION AND IDENTIFICATION OF DIPLOID GYNOGENESIS IN OPLEGNATHUS FASCIATUS
- 海洋与湖沼, 54(3): 829-835
- Oceanologia et Limnologia Sinica, 54(3): 829-835.
- http://dx.doi.org/10.11693/hyhz20221100283
文章历史
-
收稿日期:2022-11-01
收修改稿日期:2022-12-10
2. 浙江省海水增养殖重点实验室 浙江舟山 316021;
3. 浙江海洋大学水产学院 浙江舟山 316022
2. Key Lab of Mariculture and Enhancement of Zhejiang Province, Zhoushan 316021, China;
3. School of Fishery, Zhejiang Ocean University, Zhoushan 316022, China
条石鲷(Oplegnathus fasciatus), 隶属鲈形目, 石鲷科, 石鲷属, 主要分布在我国、日本和韩国沿海, 素有“梦幻之鱼”和“矶钓之王”的美誉(肖志忠, 2014), 因其肉质细嫩, 味道鲜美, 深受消费者喜爱, 市场售价高达150~200元/kg。近年来, 随着条石鲷人工繁育的成熟, 其养殖规模逐渐扩大, 已经成为我国沿海重要的新兴养殖海水鱼类。不仅如此, 条石鲷具有特殊的性别决定类型, 即复性染色体决定型(X1X1X2X2/ X1X2Y) (Xu et al, 2012), 研究其性别决定机制的形成及进化途径具有非常重要的理论价值, 因此吸引了研究学者的广泛关注(Schembri et al, 2010; Xiao et al, 2020; Gong et al, 2022)。
雌核发育是鱼类中一种特殊的生殖方式, 已经成为鱼类遗传改良的重要技术手段。人工诱导雌核发育能够加速优良基因的纯合、迅速固定优良的遗传性状, 从而缩短育种进程; 同时也是进行鱼类遗传分析与性别控制的有效辅助手段。雌核发育技术已经被广泛应用于国内外多种鱼类遗传育种的研究与实践, 如大西洋鲑(Salmo salar) (Galbreath et al, 1994)、虹鳟(Oncorhynchus mykiss) (Lincoln et al, 1983)、牙鲆(Paralichthys olivaceus) (刘海金等, 2017)、翘嘴鲌(Culter alburnus Basilewsky) (贾永义, 2019)和黄颡鱼(Pelteobagurs fuluidraco) (Liu et al, 2013)等鱼类的选育均采用了雌核发育技术作为关键的育种技术手段。此外, 通过雌核发育技术培育出双单倍体群体, 其个体的基因组高度纯合, 且个体间又存在明显的性状差异, 可以作为高密度遗传连锁图谱构建和经济性状精细定位的良好作图材料(刘奕, 2013)。并且, 通过雌核发育后代的性别能够推断其性别决定类型, 如采用雌核发育技术推测半滑舌鳎(Cynoglossus semilaevis) (王美玉, 2013)和大西洋鳕鱼(Gadus morhua) (Whitehead et al, 2012)等鱼类的性别决定类型为雌性异配型, 高身丽脂鲤(Astyanax altiparanae) (Nascimento et al, 2020)和黄姑鱼(Nibea albiflora) (Chen et al, 2017)等鱼类为雄性异配型。
目前, 研究学者在很多海、淡水鱼类中建立了雌核发育诱导方法(Manan et al, 2022), 但不同鱼种的雌核发育诱导方法及参数等均有很大差异, 如精子灭活条件、诱导参数等, 而条石鲷的雌核发育诱导尚未见报道。本研究采用同源精子灭活结合冷休克的方法诱导条石鲷的雌核发育, 筛选同源精子的紫外灭活条件, 优化冷休克诱导的起始时间和持续时间等参数; 进一步采用形态学、流式细胞术、分子标记以及组织切片等方法对诱导的条石鲷进行鉴定, 并初步分析其生长情况。本研究结果不仅为条石鲷的单性苗种培育提供技术支撑, 也为其性别决定机制解析构建实验操作平台。
1 材料与方法 1.1 实验材料实验用条石鲷亲体来自浙江省海洋水产研究所西轩渔业科技岛, 2019年12月初从室外池塘转移至室内进行营养强化, 2020年5月初水温升至20 ℃后开始实验。从亲鱼群体中挑选雌雄鱼, 选择腹部膨大的雌鱼[(628.36±56.31) g], 注射促黄体素释放激素A2 (LHRH-A2), 剂量为2 μg/kg; 雄鱼则选择能够挤出精液的个体[(361.12±24.59) g], 不注射催产素。催产16~24 h后轻压雌鱼腹部收集卵子, 然后置于干燥烧杯中避光保存; 雄鱼则按压腹部采集精液, 采集后的精液置于冰盒内避水避光保存。
1.2 精子的紫外线灭活将条石鲷精液用Ringer氏液按1︰30稀释, 稀释后的精液均匀铺在培养皿中(厚度约0.8 mm), 置于2支15 W的紫外灯(Philips, G15T8)下进行照射, 用紫外辐照计[UV-B(254), 北京师范大学光电仪器厂]测量此位置的辐射强度为1 330~1 350 μW/cm2。为了筛选最佳的照射剂量, 分别设定照射持续时间为0 s (对照组)、10 s、20 s、30 s、60 s、90 s和120 s。稀释后的精液经紫外线照射处理后, 用吸管吸取1 mL与3 mL卵子混匀, 常温海水激活后置于1 L烧杯中孵化, 孵化温度为21~22 ℃。以上处理各设置3个平行, 统计孵化率和畸形率。
1.3 人工授精与冷休克根据紫外灭活条石鲷精子实验的结果, 设定紫外线照射时长。参考相关文献(Chen et al, 2017), 将冷休克温度设定为3~4 ℃, 分别对冷休克起始时间和冷休克持续时间等参数进行筛选。首先进行冷休克起始时间的梯度实验, 设置受精后0、2、3、4和5 min 5个起始时间, 冷休克持续时间设为10 min; 再进行冷休克持续时间梯度实验, 设置0、5、10、15和20 min 5个冷休克持续时间, 冷休克起始时间设为2 min。各处理组均设置3个平行, 受精卵孵化后统计各组的孵化率和单倍体率。
1.4 胚胎发育观察及倍性检测在受精卵孵化期间, 采用NIKON-MSZ800解剖镜观察胚胎发育并拍照。仔鱼出膜后, 从单倍体组、正常二倍体组和冷休克诱导组中分别随机选择30尾, 采用流式细胞仪Ploidy Analyzer (BD FACSCalibur, American)进行倍性分析。
1.5 雌核发育二倍体的培育和生长分析2020年共进行3批次雌核发育实验, 共培育出2个雌核发育家系和2个雌核发育群体。5月龄前, 雌核发育组和对照组苗种养殖于1 000 L桶中, 桶内苗种培育密度基本一致; 5月龄之后, 将雌核发育组和对照组分别采用不同颜色荧光染料进行标记, 置于10 m2水泥池(水位1.0~1.2 m)内混养, 定期进行取样, 测量全长、体长和体重。
1.6 微卫星分析冷休克处理组孵化2 d后, 分别从2个雌核发育家系(G1和G2)中随机采集30尾仔鱼, 保存于75%乙醇中, 同时剪取2个家系的父母本鳍条保存备用。参考Sun等(2013)报道的微卫星引物和PCR方法, 对父母本及60尾雌核发育个体的DNA进行PCR扩增。扩增产物送至杭州厚泽生物科技有限公司, 采用Qsep400全自动核酸分析仪对扩增片段进行测定, 并用Q-Analyzer for Qsep400对扩增片段长度进行判读。
1.7 雌核发育二倍体的性腺组织切片在11月龄时, 分别随机挑选雌核发育组和对照组条石鲷各30尾采用麻醉剂MS-222麻醉后解剖取性腺, 固定于波恩氏液中; 然后将样品进行石蜡包埋、组织切片和苏木素-伊红染色。采用Olympus MS800显微镜对组织切片进行观察, 分别统计性别比例。
1.8 数据统计分析统计各组的孵化率和畸形率, 统计方法如下: 孵化率=初孵仔鱼数/受精卵数; 畸形率=初孵仔鱼的畸形数/初孵仔鱼总数。本实验中数据采用单因素方差分析(One-way ANOVA)和Duncan氏多重比较进行统计分析。
2 结果 2.1 紫外线灭活实验条石鲷精子经紫外线照射后与卵子受精, 受精卵的孵化率显著低于正常对照组(P<0.05) (图 1)。随着紫外线照射时间延长, 受精卵的孵化率呈现先降低, 后升高, 最后再降低的趋势。紫外线照射时长在30 s时(累积辐射剂量为40 mJ/cm2), 受精卵的孵化率最高, 为44.67%±3.06%, 但是与60 s (80 mJ/cm2)照射时长无显著差异(P>0.05)。当照射时间延长至120 s (累积辐射剂量约为200 mJ/cm2)时, 孵化率降至7.33%±4.16%。紫外线照射时长超过60 s时, 各处理组的受精卵孵化后全部为畸形, 表现为躯体色素沉积、呈“S型”, 尾部短而弯(图 3c), 24 h内全部死亡, 表明60 s的紫外照射可以有效灭活条石鲷精子的遗传物质, 故后续的试验中采用60 s的紫外照射。
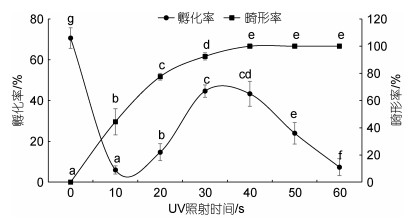 |
| 图 1 紫外线照射时间对条石鲷孵化率和畸形率的影响 Fig. 1 The influence of UV irradiation duration on the hatching and malformation rate of O. fasciatus 注: 图中标有不同字母表示差异显著(P<0.05), 下同 |
本研究中, 将冷休克水温设置为3~4 ℃, 冷休克持续时间设置为10 min, 受精卵孵化率随着冷休克起始时间的延后呈先升高后下降的趋势, 而畸形率则呈现先降低后升高的趋势(图 2a)。在冷休克起始时间为受精后2 min时, 孵化率最高, 为44.67%±4.12%; 但与3 min时无显著差异(42.44%±2.76%, P>0.05)。冷休克起始时间为2 min时, 其畸形率最低, 显著低于其他各实验组(P<0.05)。将冷休克起始时间设置为受精后2 min时, 各实验组的孵化率和畸形率随着冷休克持续时间的延长呈现降低的趋势(图 2b), 冷休克持续时间10 min时孵化率最高, 显著高于其他实验组(P<0.05); 此时畸形率为14.75%±5.32%, 但与15 min时无显著差异(14.05%±4.58%, P>0.05)。
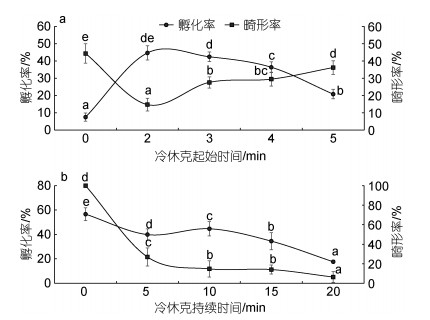 |
| 图 2 冷休克起始时间(a)和冷休克持续时间(b)对试验组孵化率和畸形率的影响 Fig. 2 Effect of different initial time (a) and duration time for cold shock (b) on hatching rate and malformation rate of experimental group |
观察对照组、冷休克处理组和单倍体组的胚胎发育, 冷休克处理组和对照组的胚胎发育及仔鱼均正常, 未经冷休克处理的单倍体组孵化后均为畸形, 仔鱼身体色素沉积严重, 表现出明显的“单倍体综合征”, 且出膜后24 h内全部死亡(图 3)。进一步的倍性检测显示, 冷休克诱导组与正常二倍体的DNA相对含量相当, 而单倍体组的DNA相对含量为正常二倍体组的一半(图 3)。
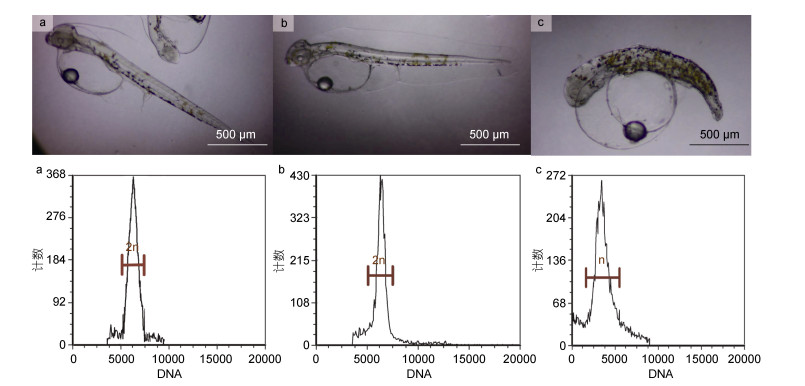 |
| 图 3 条石鲷雌核发育二倍体(a)、正常二倍体(b)和单倍体初孵仔鱼(c)外部形态及倍性检测图 Fig. 3 External morphologies and patterns of gynogenetic diploid (a), diploid control (b), and haploid larvae (c) of O. fasciatus |
采用15对微卫星引物对亲本和雌核发育二倍体进行遗传分析, 其中9对微卫星引物在父母本中基因型不同, 用于后续的检测(表 1)。微卫星结果显示, 2个雌核发育家系的所有子代的等位基因均来自母本, 未发现来自父本的等位基因, 表明雌核发育子代中未混入父本的遗传信息。所用的9个微卫星位点的平均杂合子比例为0.796, 60个子代在9个检测的微卫星位点上无全部纯合的基因型。
| 微卫星位点 | 家系(30尾) | 父本基因型/bp | 母本基因型/bp | 雌核发育子代基因型/bp |
| Opfa01 | G1 | 246/257 | 245/259 | 245/259(21)a、259/259(9) |
| G2 | 260/260 | 245/251 | 245/251(22)、251/251(8) | |
| Opfa02 | G1 | 176/176 | 166/173 | 166/173(30) |
| G2 | 173/181 | 169/177 | 169/177(16)、177/177(14) | |
| Opfa03 | G1 | 304/323 | 255/287 | 255/287 (30) |
| G2 | 307/323 | 315/333 | 315/315(11)、315/333(19) | |
| Opfa04 | G1 | 196/210 | 205/220 | 205/220(30) |
| G2 | 205/218 | 217/220 | 217/220(30) | |
| Opfa07 | G1 | 154/154 | 163/170 | 163/163(13)、163/170(15)、170/170(2) |
| G2 | 162/162 | 235/255 | 235/255(30) | |
| Opfa10 | G1 | 277/277 | 169/174 | 169/174(15)、174/174(15) |
| G2 | 275/278 | 277/287 | 277/277(7)、277/287(22)、287/287(1) | |
| Opfa11 | G1 | 234/240 | 231/238 | 231/231(13)、231/238(17) |
| G2 | 232/240 | 239/246 | 239/246(30) | |
| Opfa12 | G1 | 269/277 | 263/272 | 263/263(2)、263/272(28) |
| G2 | 255/267 | 257/277 | 257/277(30) | |
| Opfa14 | G1 | 337/355 | 354/360 | 354/360(25)、360/360(5) |
| G2 | 344/367 | 347/373 | 347/347(3)、347/373(20)、373/373(7) | |
| 注: a表示括号内为该基因型的个体数, 下同 | ||||
雌核发育组和对照组条石鲷同池混养的生长情况见表 2。在11月龄前雌核发育组和对照组生长无显著差异(P>0.05); 在15和18月龄时, 雌核发育条石鲷的体重显著高于正常二倍体(P<0.05)。采集11月龄的雌核发育组和对照组进行组织学观察, 性腺组织切片如图 4所示, 对照组雌雄比例接近1︰1 (13︰17), 其精巢处于Ⅲ期, 可以清晰观察到精母细胞, 卵巢处于Ⅱ期, 可以清晰地观察到卵巢腔和初级卵母细胞的存在。雌核发育条石鲷的性腺均为卵巢, 处于Ⅱ期。
| 组别 | 性状 | 5月龄 | 11月龄 | 15月龄 | 18月龄 |
| 对照组 | 体长/cm | 9.50±0.91 | 15.88±1.78 | 19.94±1.29 | 21.37±1.10a |
| 雌核发育组 | 10.05±0.98 | 17.26±1.68 | 20.92±0.89 | 22.93±0.56b | |
| 对照组 | 体重/g | 35.33±10.42 | 140.60±40.89 | 259.95±46.17a | 319.50±44.38a |
| 雌核发育组 | 39.12±9.80 | 163.25±42.56 | 298.05±30.04b | 378.33±32.63b | |
| 注: 同列数据右上方的不同字母表示差异显著(P<0.05) | |||||
 |
| 图 4 11月龄条石鲷性腺组织切片 Fig. 4 Gonadal histology of rock bream at 11 months of age 注: a. 雄性条石鲷; b. 雌性条石鲷; c, d. 雌核发育条石鲷; SS: 次级精母细胞; PO: 初级卵母细胞; OC: 卵巢腔 |
在人工诱导鱼类雌核发育的过程中, 精子灭活条件、诱导方法及相关参数是雌核发育能否成功的关键。本研究采用紫外灭活的条石鲷精子结合冷休克的方法, 首次成功建立了条石鲷雌核发育的诱导方法, 培育出雌核发育后代。研究结果不仅为条石鲷单性苗种的培育提供技术支撑, 也为其性别决定机制的解析提供新途径。
灭活后的精子能维持其受精能力是人工诱导雌核发育的前提。紫外线辐射是灭活精子遗传物质的常用方法, 通过调节紫外灯的功率、照射距离和照射时长可以控制紫外辐射量, 从而达到使精子“失活”的目的(Komen et al, 2007)。相关研究表明, 鱼类精子在紫外线灭活过程中存在哈迪-温伯格效应, 即随着辐射剂量增大其受精卵孵化率降低, 但超过某一剂量后孵化率反而上升的现象(刘海金等, 2010)。本研究中, 条石鲷精子在紫外辐射剂量13~200 mJ/cm2范围内也表现出这种趋势。在辐射剂量达到80 mJ/cm2时, 受精卵孵化后均为单倍体, 表明该辐射剂量可以完全灭活条石鲷精子的遗传物质。在鱼类雌核发育中, 精子紫外灭活剂量因种类不同而存在差异, 也与精子密度、环境温度等因素有关。Rahman等(2019)在银高体鲃(Barbonymus gonionotus)中研究发现, 同一辐射强度下, 精子密度不同会导致受精卵孵化率和单倍体率存在显著差异(P<0.05)。而在牙鲆中研究表明, 0~2 ℃和15 ℃下灭活牙鲆精子所需要的辐射剂量存在显著差异(尤锋等, 2008; 刘海金等, 2010)。此外, 作为同源或异源精子诱导雌核发育, 其灭活剂量也有差异。如作为同源精子诱导雌核发育时, 黄姑鱼精子最佳灭活剂量为420 mJ/cm2 (徐冬冬等, 2013), 而作为异源精子诱导大黄鱼雌核发育, 黄姑鱼精子灭活剂量仅为198 mJ/cm2 (汪倩凤等, 2017)。本研究中条石鲷精子紫外灭活的最佳剂量为80 mJ/cm2, 而作为异源精子诱导真鲷雌核发育的灭活剂量仅为30 mJ/cm2 (原文为3 000 erg/mm2) (Kato et al, 2001)。
在鱼类雌核发育诱导过程中, 可以通过抑制第二极体排放实现染色体加倍, 而冷休克是抑制第二极体排放的常用方法。影响冷休克能否成功诱导染色体加倍的关键参数包括冷休克水温、冷休克起始时间和持续时间等。已有研究表明, 冷休克水温一般在–2~5 ℃范围内就可以达到抑制受精卵第二极体排出的目的(Holmefjord et al, 1997; Pandian et al, 1998), 本研究中将条石鲷雌核发育诱导的冷休克温度设为3~4 ℃。Felip等(2001)认为, 冷休克起始时间对诱导效果的影响最大, 其次为水温和持续时间。不同鱼类第二极体的排放时间存在差异, 因此可能导致诱导雌核发育时冷休克起始时间不同(孟振等, 2013)。本研究中, 起始时间为受精后2 min和3 min时孵化率无显著差异, 但当起始时间延迟至5 min时, 孵化率仅为前者的50%左右, 且畸形率也远高于2 min, 这可能是由于条石鲷大部分卵子在受精后5 min时其第二极体已经排出, 此时进行冷休克已难以实现染色体加倍, 子代会产生大量的单倍体。此外, 诱导冷水性鱼类雌核发育比温水性鱼类可能需要更长的冷休克处理时间。比如, 银大马哈鱼(Oncorhynchus kisutch) (Refstie et al, 1982)和俄罗斯鲟(Acipenser gueldenstaedtii) (姜彦超等, 2012)等冷水性鱼类的冷休克持续时间显著高于欧洲舌齿鲈(Dicentrarchus labrax) (Felip et al, 1999)和大黄鱼(Larimichthys crocea) (李益云, 2007)等暖温性鱼类。条石鲷属于暖温性鱼类, 冷休克处理10 min时能成功诱导出雌核发育子代, 与其他暖温性鱼类相似(李益云, 2007; 徐冬冬等, 2013)。
本研究通过形态学、微卫星及组织切片等多种方法对诱导的雌核发育子代进行鉴定, 证明了检测的子代全部为雌核发育后代。其中, 采用微卫星分析鉴定的方法显示60尾仔鱼的基因型全部来自母本, 没有父本基因型的掺入, 表明所检测的子代全部为雌核发育个体。而微卫星所检测个体在9个位点均未完全纯合, 可能是由于第一次减数分裂时染色单体之间的联会和交换造成的(朱晓琛等, 2006)。对雌核发育和正常二倍体条石鲷的生长进行比较发现: 11月龄前两者生长并无显著差异, 而15月龄之后雌核发育个体的生长显著快于正常二倍体。因此, 培育全雌苗种可能成为条石鲷养殖增产的新途径。对雌核发育条石鲷的性别鉴定显示其均为雌性, 表明条石鲷为雌性同配型, 也从侧面验证了条石鲷的性别决定类型。
4 结论综上, 本研究利用冷休克的方法诱导了条石鲷雌核发育, 其同源精子紫外灭活的最适剂量为80 mJ/cm2, 雌核发育诱导的最适条件为授精2 min后、在3~4 ℃的水温冷休克处理10 min; 雌核发育条石鲷均为雌性, 在15月龄后具有明显的生长优势。
王美玉, 2013. 半滑舌鳎性别决定机制证明及生长相关微卫星标记筛选[D]. 哈尔滨: 东北农业大学: 20-34.
|
尤锋, 许建和, 倪静, 等, 2008. 牙鲆同质雌核发育人工诱导研究. 高技术通讯, 18(8): 874-880 DOI:10.3772/j.issn.1002-0470.2008.08.019 |
朱晓琛, 刘海金, 孙效文, 等, 2006. 微卫星评价牙鲆雌核发育二倍体纯合性. 动物学研究, 27(1): 63-67 |
刘奕, 2013. 基于牙鲆DH群体的遗传图谱构建及生长相关性状的QTL定位[D]. 哈尔滨: 东北农业大学: 3-4.
|
刘海金, 侯吉伦, 刘奕, 2017. 牙鲆雌核发育研究进展. 中国水产科学, 24(4): 902-912 |
刘海金, 侯吉伦, 常玉梅, 等, 2010. 真鲷精子诱导牙鲆减数分裂雌核发育. 水产学报, 34(4): 508-514 |
李益云, 2007. 大黄鱼雌核发育的诱导及遗传分析[D]. 厦门: 集美大学: 15-16.
|
肖志忠, 2014. 条石鲷种群遗传学及养殖生物学研究[D]. 青岛: 中国海洋大学: 20-24.
|
汪倩凤, 沈伟良, 刘成, 等, 2017. 紫外辐射灭活大黄鱼和黄姑鱼精子及其激活大黄鱼卵子发育为胚胎的效果. 中国水产科学, 24(6): 1203-1212 |
孟振, 刘新富, 雷霁霖, 等, 2013. 大菱鲆雌核发育二倍体的真鲷冷冻精子诱导及其生长评价. 武汉大学学报(理学版), 59(4): 343-350 |
姜彦超, 苏建通, 董颖, 等, 2012. 俄罗斯鲟雌核发育诱导及其后代的微卫星分析. 中山大学学报(自然科学版), 51(4): 106-111, 133 |
贾永义, 2019. 翘嘴鲌(Culter alburnus)全雌育种体系建立与评价[D]. 上海: 华东师范大学: 14-15.
|
徐冬冬, 楼宝, 薛宝贵, 等, 2013. 黄姑鱼(Nibea albiflora)雌核发育的人工诱导及鉴定. 海洋与湖沼, 44(2): 310-317 |
CHEN R Y, LOU B, XU D D, et al, 2017. Induction of meiotic gynogenesis in yellow drum (Nibea albiflora, Sciaenidae) using heterologous sperm and evidence for female homogametic sex determination. Aquaculture, 479: 667-674 |
FELIP A, PIFERRER F, CARRILLO M, et al, 1999. The relationship between the effects of UV light and thermal shock on gametes and the viability of early developmental stages in a marine teleost fish, the sea bass (Dicentrarchus labrax L.). Heredity, 83(4): 387-397 |
FELIP A, ZANUY S, CARRILLO M, et al, 2001. Induction of triploidy and gynogenesis in teleost fish with emphasis on marine species. Genetica, 111(1/2/3): 175-195 |
GALBREATH P F, JEAN W S, ANDERSON V, et al, 1994. Freshwater performance of all-female diploid and triploid Atlantic salmon. Aquaculture, 128(1/2): 41-49 |
GONG J, ZHAO J, KE Q Z, et al, 2022. First genomic prediction and genome-wide association for complex growth-related traits in Rock Bream (Oplegnathus fasciatus). Evolutionary Applications, 15(4): 523-536 |
HOLMEFJORD I, REFSTIE T, 1997. Induction of triploidy in Atlantic halibut by temperature shocks. Aquaculture International, 5(2): 168-173 |
KATO K, MURATA O, YAMAMOTO S, et al, 2001. Viability, growth and external morphology of meiotic- and mitotic-gynogenetic diploids in red sea bream, Pagrus major. Journal of Applied Ichthyology, 17(3): 97-103 |
KOMEN H, THORGAARD G H, 2007. Androgenesis, gynogenesis and the production of clones in fishes: a review. Aquaculture, 269(1/2/3/4): 150-173 |
LINCOLN R F, SCOTT A P, 1983. Production of all-female triploid rainbow trout. Aquaculture, 30(1/2/3/4): 375-380 |
LIU H Q, GUAN B, XU J, et al, 2013. Genetic manipulation of sex ratio for the large-scale breeding of YY Super-Male and XY All-Male Yellow Catfish (Pelteobagrus fulvidraco (Richardson)). Marine Biotechnology, 15(3): 321-328 |
MANAN H, HIDAYATI A B N, LYANA N A, et al, 2022. A review of gynogenesis manipulation in aquatic animals. Aquaculture and Fisheries, 7(1): 1-6 |
NASCIMENTO N F D, MONZANI P S, PEREIRA-SANTOS M P, et al, 2020. The first case of induced gynogenesis in Neotropical fishes using the yellowtail tetra (Astyanax altiparanae) as a model organism. Aquaculture, 514: 734432 |
PANDIAN T J, KOTEESWARAN R, 1998. Ploidy induction and sex control in fish. Hydrobiologia, 384(1/2/3): 167-243 |
RAHMAN M R, SARDER M R I, NISHAT A A, et al, 2019. Induction of diploid gynogenesis by heat shock treatment in silver barb (Barbonymus gonionotus). Aquaculture, 505: 297-305 |
REFSTIE T, STOSS J, DONALDSON E M, 1982. Production of all female coho salmon (Oncorhynchus kisutch) by diploid gynogenesis using irradiated sperm and cold shock. Aquaculture, 29(1/2): 67-82 |
SCHEMBRI P J, BODILIS P, EVANS J, et al, 2010. Occurrence of barred knifejaw, Oplegnathus fasciatus (Actinopterygii: Perciformes: Oplegnathidae), in Malta (central Mediterranean) with a discussion on possible modes of entry. Acta Ichthyologica et Piscatoria, 40(2): 101-104 |
SUN X X, XU D D, LOU B, et al, 2013. Development and characterization of novel microsatellite markers in the rock bream fish Oplegnathus fasciatus. Genetics and Molecular Research, 12(4): 6462-6465 |
WHITEHEAD J A, BENFEY T J, MARTIN-ROBICHAUD D J, et al, 2012. Ovarian development and sex ratio of gynogenetic Atlantic cod (Gadus morhua). Aquaculture, 324/325: 174-181 |
XIAO Y S, XIAO Z Z, MA D Y, et al, 2020. Chromosome-level genome reveals the origin of Neo-Y chromosome in the male barred Knifejaw Oplegnathus fasciatus. iScience, 23(4): 101039 |
XU D D, YOU F, LOU B, et al, 2012. Comparative analysis of karyotype and C-banding in female and male Oplegnathus fasciatus. Acta Hydrobiologica Sinica, 36(3): 552-557 |
 2023, Vol. 54
2023, Vol. 54


