
中国海洋湖沼学会主办。
文章信息
- 曹馨月, 黄嘉怡, 杜诗钰, 侯天牧, 项维, 郜卫华, 张付贤. 2023.
- CAO Xin-Yue, HUANG Jia-Yi, DU Shi-Yu, HOU Tian-Mu, XIANG Wei, GAO Wei-Hua, ZHANG Fu-Xian. 2023.
- 一株大口黑鲈源ST-873型肺炎克雷伯菌(Klebsiella pneumoniae)的分离鉴定及生物学特性研究
- ISOLATION AND CHARACTERIZATION OF KLEBSIELLA PNEUMONIAE TYPE ST-873 FROM MICROPTERUS SALMOIDES
- 海洋与湖沼, 54(3): 836-847
- Oceanologia et Limnologia Sinica, 54(3): 836-847.
- http://dx.doi.org/10.11693/hyhz20220900235
文章历史
-
收稿日期:2022-09-15
收修改稿日期:2022-11-21
2. 长江大学湿地生态与农业利用教育部工程研究中心 湖北荆州 434023;
3. 长江大学涝渍灾害与湿地农业湖北省重点实验室 湖北荆州 434023
2. Engineering Research Center for Wetland Ecology and Agricultural Utilization, Ministry of Education, Yangtze University, Jingzhou 434023, China;
3. Hubei Key Laboratory of Waterlogging Disaster and Agricultural Use of Wetland, Yangtze University, Jingzhou 434023, China
大口黑鲈(Micropterus salmoides)又称加州鲈, 隶属于鲈形目(Perciformes)、太阳鱼科(Cehtrachidae)、黑鲈属, 是一种名贵的肉食性鱼类。因其具有肉质鲜嫩、营养丰富、药用价值高、经济效益好等特点被广泛养殖(Bai et al, 2008); 大口黑鲈自1983年引进我国广东佛山, 目前已成为我国重要的淡水养殖品种, 至2019年全国大口黑鲈养殖总产量高达47.8万t (Alexander et al, 2012; 袁媛等, 2020)。但随着我国大口黑鲈养殖范围的扩大和养殖密度的增加, 细菌、病毒和寄生虫等病害问题日益凸显, 造成了重大的经济损失。目前, 已报道的大口黑鲈病原菌有爱德华氏菌(Edwardsiella) (Fogelson et al, 2016)、诺卡菌(Nocardia) (Yasuike et al, 2017)、沙门氏菌(Salmonella)、溶藻弧菌(Vibrio alginolyticus)、哈维弧菌(Vibrio harveyi) (Qiao et al, 2021)、嗜水气单胞菌(Aeromonas hydrophila) (Zhou et al, 2021)等, 但大口黑鲈鱼源肺炎克雷伯菌的分离、鉴定、分型及生物学特性研究尚未见报道。
肺炎克雷伯氏菌(Klebsiella pneumonia)属于肠杆菌科(Enterobacteriaceae)肺炎克雷伯氏菌属(Klebsiella), 广泛存在于人和动物肠道、呼吸道以及水、土壤、农产品和林产品中(Ronald, 2002; Rock et al, 2014)。正常情况下, 肺炎克雷伯菌不会引起动物发病, 但是当机体抵抗力下降或菌群大量增殖时, 就会引起动物发病甚至暴发流行性疾病(滕涛等, 2016)。研究表明, 肺炎克雷伯菌主要感染哺乳动物和家禽(Tansey et al, 2010; Ewers et al, 2014), 表现为呼吸困难、腹腔积液、肠道臌气、肺脏实变、肾脏出血等症状; 肺炎克雷伯菌也可感染海鱼, 导致肝脏、肾脏和脾脏发生明显组织病理性损伤(潘苑霞等, 2022)。肺炎克雷伯氏菌作为一种重要的人-畜-鱼共患传染病病原体, 其流行性、致病性和耐药性研究对于疫病防控和公共卫生安全十分重要。本研究从患腹水病大口黑鲈的组织中分离到一株优势菌, 通过形态、生理生化和16S rRNA基因序列分析等方法进行鉴定, 对分离菌株的毒力型、生物被膜形成能力、致病性和耐药性进行系统分析, 并筛选对分离菌株敏感的抗生素和中药, 旨在为大口黑鲈腹水病的诊断、精准施治和高效防控提供科学依据。
1 材料与方法 1.1 实验材料本实验患病大口黑鲈采集自湖北省荆州市某鱼场, 体长约10 cm。健康大口黑鲈购自荆州市某大口黑鲈养殖基地, 体重(22.6±1.8) g, 水缸内暂养10 d, 检测确认无特定病原后用于人工感染实验。
革兰氏染色剂购自北京索莱宝生物科技有限公司; Taq酶购自上海碧云天生物技术有限公司; 实验相关引物由生工生物工程(上海)股份有限公司合成; 药敏片购自杭州微生物试剂有限公司; 琼脂粉购自北京索莱宝科技有限公司; 磷酸盐缓冲液(Phosphate-buffered saline, PBS)、无水乙醇和DL2000 DNA Marker购自北京聚合美生物科技有限公司; 绵羊血平板购自青岛高科技工业园海博技术有限公司; 脱纤维绵羊血购自上海源叶生物科技有限公司。细菌基因组提取试剂盒和病毒基因组提取试剂盒购自天根生化科技(北京)有限公司。
43种中草药分别为: 黄芩、苏子、独活、麻黄、款冬花、桑皮、川贝母、天竹黄、大黄(熟)、白术、荆芥、半夏、黄连、僵蚕(炒)、白附子(炙)、茯苓、羌活、桔梗、明雄黄、朱砂、枳壳、连翘、板蓝根、鱼腥草、全蝎、朱砂、野菊花、薄荷、五味子, 金银花, 胖大海、五倍子、秦皮、石榴皮、首乌藤、肉桂、丁香、蒲公英、板蓝根、生地榆、槟榔、大青叶、乌梅。以上中药均购自同仁堂大药房。10 g中草药剪碎后置于20 mL ddH2O中浸泡1 h后, 大火煮沸转小火熬制2 h, 三层纱布滤过药液, 剩余药渣再加入20 mL ddH2O浸泡1 h, 重复第一次熬制过程, 合并两次滤过药液, 小火浓缩至50 mL, 使药液终浓度为1 g/mL (即1 000 mg/mL), 121 ℃灭菌20 min, 置于4 ℃备用。
1.2 病原检测采集具有典型腹水病的大口黑鲈, 检查记录外观症状; 体表消毒后无菌条件下解剖, 取肾、脾脏、肝脏等病变组织(约200 mg)放入RNase free的1.5 mL EP管中进行研磨, 分别按照细菌与病毒基因提取试剂盒说明书提取细菌基因组的DNA和病毒基因组DNA/RNA, 使用反转录试剂盒对提取的病毒基因组RNA进行反转录; 合成大口黑鲈常见病害特异性引物(见表 1), 以提取的细菌基因组、病毒基因组DNA及反转录产物作为病原检测的模板, 反应体系(20 μL): 模板1 μL、2×Taq PCR Master Mix酶10 μL、上下游引物(10 μmol/L)各1 μL、ddH2O 7 μL; 扩增条件: 预变性94 ℃ 5 min, 94 ℃变性45 s, 55 ℃退火45 s, 72 ℃延伸1 min, 34个循环, 72 ℃延伸10 min。
| 病原 | 引物序列(5′~3′) | 序列长度/bp |
| 嗜水气单胞菌Aeromonas hydrophila | F: CCTGTTCAGCCAGATAGTG | 202 |
| R: GGTGATCGGAGAGGACTT | ||
| 维氏气单胞菌Aeromonas veronii | F: GAGGAAAGGTTGGTAGCTAATAA | 688 |
| R: CGTGCTGGCAACAAAGGACAG | ||
| 肺炎克雷伯菌K. pneumoniae | F: ATGAAACGACCTGATTGCATTCGC | 489 |
| R: TTACTTTTTCCGCGGCTTACCGTC | ||
| 迟缓爱德华氏菌Edwardsiella tarda | F: CATCGTCACCATTCACAGT | 494 |
| R: CCTTAATCCCACCCTCATAGC | ||
| 柱状黄杆菌Flavobacterium columniformis | F: ACRGGRGATAAAGCAGAASA | 415 |
| R: GACTTTTGTGTTGAAACGG | ||
 诺卡氏菌Nocardia seriolae 诺卡氏菌Nocardia seriolae |
F: CCTGCACATGGCCTCGTTCT | 249 |
| R: AGCGACTGGGTGAGTTCCTG | ||
| 弹状病毒Rhabdoviridae | F: AATTTTGGCCAACTCGATTC | 400 |
| R: ACGAGAAAAAAGAAAAKAATATACAG | ||
| 虹彩病毒Iridoviridae | F1: ACCTGGTGGCTCCAGTGC | |
| R1: GAGAGACCCCAACACGAC | 1 828 | |
| F2: ATAACGACCAGT'TCAAAC | 1 220 | |
| R2: GGCGGCGACAATGCCGTG |
无菌条件下使用接种环蘸取PCR检测肺炎克雷伯菌阳性的大口黑鲈组织, 划线接种于LB琼脂培养基上, 37 ℃培养12~24 h, 观察菌落的形态特征。挑取纯化的菌落进行涂片和革兰氏染色(谭啸等, 2019), 在光学显微镜下观察菌体形态及染色特征。取分离菌株的纯培养物接种至LB液体培养基, 37 ℃、180 r/min振荡培养16 h, 取10 μL菌液加入细菌微量生化管中, 按照细菌微量生化反应管的说明书进行操作, 参考《伯杰氏鉴定细菌学手册》(Buchanan et al, 1994)和《常见细菌系统鉴定手册》(东秀珠等, 2001)等文献进行结果判定。
1.4 病原菌16S rRNA序列的PCR扩增和系统进化树构建参考文献(Greisen et al, 1994)合成通用引物: 27F: 5′-AGAGTTTGATYMTGGCTCAG-3′, 1492R: 5′-TA CCTTGTTACGACTT-3′, 以细菌基因组提取试剂盒提取的DNA为模板, PCR扩增分离菌的16S rRNA。PCR反应体系25 µL: 模板1 μL, 2×Taq PCR Master Mix酶12.5 μL, 上下游引物各0.5 μL, ddH2O 10.5 μL; PCR的扩增条件为: 95 ℃预变性7 min; 95 ℃变性40 s, 50 ℃退火1 min, 72 ℃延伸30 s, 34个循环; 72 ℃延伸10 min。PCR产物的测序结果利用NCBI BLAST工具进行比对分析, 通过ClustalX(1.81)软件对与该菌株同源性较高的同属其他菌株序列进行多重序列匹配排列, 使用MEGA7软件的邻接法(Neighbor-joining)构建其与相近种基因的系统进化树, 进行1 000次的Bootstrap检验置信度。
1.5 Multilocus sequence typing (MLST)分析依据MLST数据库网站(https://bigsdb.pasteur.fr/klebsiella/)提供的肺炎克雷伯菌7个管家基因gapA、infB、mdh、pgi、phoE、ropB和tonB的引物进行PCR扩增, 扩增产物测序后上传数据库获取等位基因的编号, 从而确定分离菌株的ST型别。采用PHYLOViZ软件BURST算法对MLST数据库中肺炎克雷伯菌的ST型进行分组和聚类, 通过相应的克隆谱系来分析分离菌株的进化关系。
1.6 致病性分析 1.6.1 毒力基因检测选取肺炎克雷伯菌的12个主要毒力基因: 铁载体(Sderophores)、荚膜多糖(Capsular Polysaccharide)、菌毛(Pilus)、脂多糖(Lipopolysaccharides)、黏附素(Adhesin)、耶尔森菌素(Esinomycin)和尿囊素(Allantoin), 合成特异性引物(Yu et al, 2006; Hsieh et al, 2008; Gunnarsson et al, 2009; Lin et al, 2010, 2014; 胡仁静等, 2018; 欧冠标等, 2021; 施瑜等, 2021) (表 2), 以提取的分离菌株的DNA作为模板, PCR检测肺炎克雷伯菌分离菌株的毒力基因。
| 毒力因子 | 毒力基因 | 引物序列(5'~3') | 序列长度/bp |
| 沙门菌素Salmochetin | iroNB-F | GGCTACTGATACTTGACTATTC | 992 |
| iroNB-R | CAGGATACAATAGCCCATAG | ||
| 气杆菌素Aerobactin | iucB-F | ATGTCTAAGGCAAACATCGT | 948 |
| iucB-R | TTACAGACCGACCTCCGTGA | ||
| aero-F | GCATAGGCGGATACGAACAT | 556 | |
| aero-R | CACAGGGCAATTGCTTACCT | ||
| 荚膜多糖Capsular Polysaccharide | rmpA-F | ACTGGGCTACCTCTGCTTCA | 535 |
| rmpA-R | CTTGCATGAGCCATCTTTCA | ||
| wcaG-F | GGTTGGKTCAGCAATCGTA | 169 | |
| wcaG-R | ACTATTCCGCCAACTTTTGC | ||
| 菌毛Pilus | fimH-F | ATGAACGCCTGGTCCTTTGC | 688 |
| fimH-R | GCTGAACGCCTATCCCCTGC | ||
| 脂多糖Lipopolysaccharides | uge-F | GATCATCCGGTCTCCCTGTA | 534 |
| uge-R | TCTTCACGCCTTCCTTCACT | ||
| wabG-F | CGGACTGGCAGATCCATATC | 683 | |
| wabG-R | ACCATCGGCCATTTGATAGA | ||
| 黏附素Adhesin | cf29a-F | GACTCTGATTGCACTGGCTGTG | 825 |
| cf29a-R | GTTATAAGTTACTGCCACGTTC | ||
| 耶尔森菌素Esinomycin | ybt-F | ATGACGGAGTCACCGCAAAC | 960 |
| ybt-R | TTACATCACGCGTTTAAAGG | ||
| kfuBC-F | GAAGTGACGCTGTTTCTGGC | 797 | |
| kfuBC-R | TTTCGTGTGGCCAGTGACTC | ||
| 尿囊素代谢相关因子Allantoin metabolism related factors | allS-F | GCATAGGCGGATACGAACAT | 508 |
| allS-R | CACAGGGCAATTGCTTACCT |
无菌条件下取分离菌株的纯培养物均匀涂布在含5%绵羊血的LB平板上, 平板密封后在37 ℃下孵育48 h, 观察溶血情况。分离菌株的绵羊红细胞溶血活性使用Das等(2019)描述的方法测定, 并进行了一些修改: 将红细胞和分离菌株的纯培养物分别用无菌PBS洗涤三次, 并以PBS进行稀释; 取等体积的细菌培养物和红细胞均匀混合在离心管中, 在37 ℃下分别孵育12、24、36、48、60和72 h, 1 500 g离心5 min后, 使用紫外分光光度计测量上清液在540 nm处的吸光度。
1.6.3 回归实验分离菌株经活化和鉴定后, 接种LB液体培养基中37 ℃、180 r/min培养至对数生长期(OD600 nm为0.6), 以12 000 r/min离心5 min收集菌体, 平板计数后以PBS将菌液分别调整至攻毒浓度。特定病原体检测为阴性的健康大口黑鲈幼鱼随机分成4组: 1.5×1010、1.5×109、1.5×108 CFU/mL和PBS组, 每组15尾, 采取腹腔注射的方式对大口黑鲈注射菌液, 每尾0.3 mL; 对照组腹腔注射同等体积的无菌PBS。攻毒后连续观察8 d, 并记录临床症状及死亡情况; 对死亡的大口黑鲈进行解剖, 无菌采集肠、肝、胃、脾、头肾等病变组织, 分别称重并统计脏器菌载量; 取病变组织制成石蜡切片, 在光学显微镜下观察组织病变情况。
1.7 药物敏感性分析 1.7.1 生物被膜形成能力测定采用结晶紫染色的方法测定分离菌株生物被膜形成能力的强弱。取分离菌株纯培养物以1︰100接种于LB液体培养基中, 37 ℃ 180 r/min振荡培养至OD600 nm约为0.4。在无菌96孔板的每孔中加入200 µL菌液, 37 ℃静置培养48 h; 以PBS洗涤、风干后以200 µL 4%多聚甲醛固定15 min; PBS洗涤3次, 待风干后以200 µL 0.1%结晶紫染色液室温染色10 min, 加入200 µL无水乙醇脱色, 酶标仪测定OD570 nm的值。依据临界的ODc值(ODc等于对照Control的平均值)判定结果: OD≤ODc为无成膜能力, ODc<OD≤2ODc为弱成膜能力, 2ODc<OD≤4ODc为中等成膜能力, OD>4ODc为强成膜能力。
1.7.2 耐药基因检测采用PCR方法筛查分离菌株的耐药基因, 20个耐药基因分为7类: 耐四环素类药物的tetA、tetC和tetM基因, 耐氟喹诺酮类药物的gyrA和gyrB基因, 耐红霉素类药物的erm(F)和ere(D)基因, 耐氨基糖苷类药物的aadA1和aadB基因, 耐磺胺类药物的sul1和sul2基因, 耐β-内酰胺类药物的bla-IMP、bla-TEM、bla-SHV、bla-CTX、bla-OXA、bla-DHA、β-KPC和β-HDM基因, 耐林可霉素类药物的lnuH基因(Dallenne et al, 2010; Poirel et al, 2011; 曹菲菲, 2020)。
1.7.3 药敏试验试验以金黄色葡萄球菌ATCC25923作为质控菌株验证药敏试验的有效性。取分离菌株的纯培养物均匀涂布在LB琼脂培养基上, 采用Kirb-Bauer (K-B)纸片扩散法, 将抗生素药物纸片贴在培养基上, 并置于37 ℃恒温培养箱中培养24 h, 每组做三个重复。根据杭州微生物试剂有限公司的药敏试验判断标准和美国临床实验室标准化委员会(CLSI)标准(Wang et al, 1998; 周清德等, 2000)判定分离菌株的耐药性。
1.7.4 中药体外抑菌试验将直径6 mm空白药敏纸片浸泡在1 g/mL中药提取液中, 待浸透后风干备用(李静等, 2020)。吸取分离菌株的菌液均匀涂布平板, 待菌液稍吸收后取含药纸片贴在平板上。每个平板贴1张对照药物药敏纸片(氨苄西林或头孢噻肟), 纸片间圆心距要大于3 cm, 每组设置3个平行; 37 ℃静置培养24 h后分别测量抑菌圈直径, 计算平均值和标准差。抑菌强度判断标准: 抑菌圈直径大于20 mm为极敏, 抑菌圈直径在15~19 mm为高敏, 抑菌圈直径在10~14 mm为中敏, 抑菌圈直径<10 mm为低敏, 无抑菌圈为耐药。二倍稀释法测定中药的最低抑菌浓度(minimum inhibitory concentration, MIC)和最低杀菌浓度(minimum bactericidal concentration, MBC) (陈秀枢等, 1994)。
2 结果 2.1 病原检测结果患病大口黑鲈的肛门周围红肿, 腹部隆起; 剖检可见其肝脏与脾脏显著肿大, 伴有腹水流出, 颜色浑浊。特定病原的PCR鉴定结果如图 1所示, PCR扩增出489 bp大小的条带, 与肺炎克雷伯阳性对照扩增的条带一致; 其他病原检测均为阴性, 推测该大口黑鲈养殖基地病鱼的腹水病疑似由肺炎克雷伯菌感染引起。
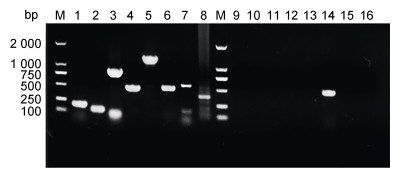 |
| 图 1 病鱼样品的特定病原检测 Fig. 1 Detection of specific pathogens in diseased M. salmoides samples 注: M: Marker; 1~8: 诺卡氏菌、嗜水气单胞菌、维氏气单胞菌、柱状黄杆菌、虹彩病毒、肺炎克雷伯菌、迟缓爱德华氏菌、弹状病毒阳性对照; 9~16: 病鱼样品 |
从患腹水病大口黑鲈组织中划线培养的菌株在LB固体培养基上长出灰白色圆形菌落, 在麦康凯培养基上长成红色菌落; 革兰氏染色结果表明, 分离菌为革兰氏阴性短杆菌, 卵圆形, 有荚膜, 单个或成双存在; 接种环挑取单菌落, 拉丝长度小于5 mm, 表明分离菌株为超黏性阴性菌株(图 2)。分离菌株的染色及菌落镜检形态皆符合肺炎克雷伯标准株生长特性。
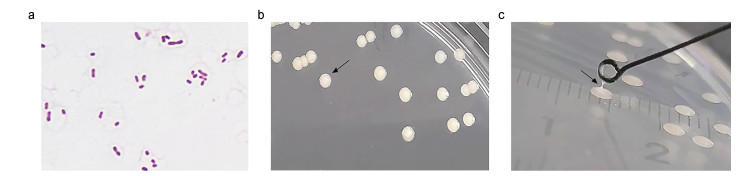 |
| 图 2 分离菌形态观察和革兰氏染色镜检 Fig. 2 Morphological observation and Gram staining microscopy 注: a. 革兰氏染色后的显微镜观察(1000×); b. 分离菌在LB培养基上的菌落形态; c. 拉丝实验(<5 mm, 阴性) |
生理生化鉴定结果显示, 分离菌株能够利用葡萄糖、乳糖、山梨糖、阿拉伯糖、棉子糖、蔗糖、果糖、蕈糖、木糖、血清菊糖和甘露醇产酸产气, 具有赖氨酸脱羧酶、脲酶活性, 不具有鸟氨酸脱羧酶活性; 西蒙氏柠檬酸盐利用试验、甲基红试验和乙酰甲基甲醇试验呈阳性; 靛基质试验和硫化氢试验呈阴性。
2.4 16S rRNA序列分析和系统进化树构建使用BLAST在线分析工具对该菌株的16S rRNA基因序列测序结果进行同源序列比对分析, 结果如图 3显示, 在系统发育树中分离菌株与肺炎克雷伯菌聚为一支, 与肺炎克雷伯菌NCCP-139株(AB558499.1)基因序列的同源性最高; 综合生理生化特性和系统进化树分析结果, 确定分离菌株为肺炎克雷伯菌, 命名为KP0123。
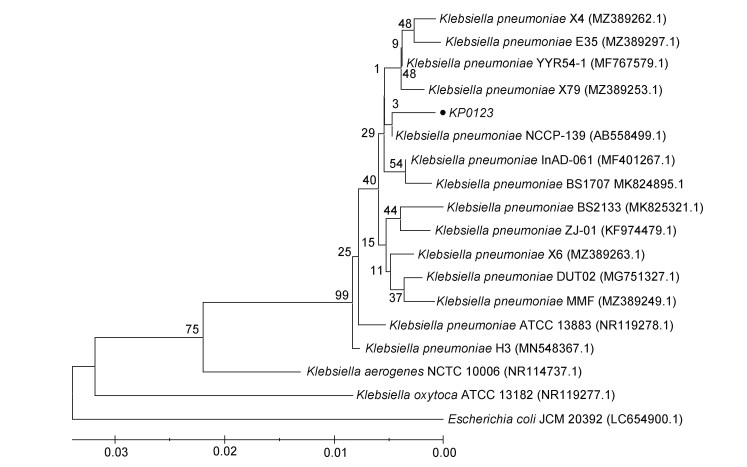 |
| 图 3 基于16S rRNA基因序列的系统进化树 Fig. 3 Phylogenetic tree based on 16S rRNA gene sequence |
对菌株KP0123管家基因(gapA、infB、mdh、pgi、phoE、rpoB、tonB)进行测序, 序列比对结果显示: KP0123的7个等位基因的编号分别为14、1、2、1、7、4、182, 属于ST-873型。数据库中北美洲的肺炎克雷伯菌分离株主要来源于海鸥和人, 来自非洲和欧洲分离株则主要来源于人(表 3)。使用PHYLOViZ软件对肺炎克雷伯菌的370个型进行分组聚类分析, 结果如图 4显示, 大口黑鲈源ST-873型肺炎克雷伯菌与ST-65型聚为一支, 二者之间有较近的亲缘关系。
| 分离株 | 地区 | 宿主 | 样品详情 | MLST | |||||||
| gapA | infB | Mdh | pgi | phoE | ropB | tonB | ST | ||||
| Kp59 | 北美洲 | 海鸥 | — | 14 | 1 | 2 | 1 | 7 | 4 | 182 | 873 |
| CAV1416 | 北美洲 | 人类 | 腹水 | 14 | 1 | 2 | 1 | 7 | 4 | 182 | 873 |
| SB5389 | 非洲 | 人类 | 粪便 | 14 | 1 | 2 | 1 | 7 | 4 | 182 | 873 |
| SB5393 | 非洲 | 人类 | 粪便 | 14 | 1 | 2 | 1 | 7 | 4 | 182 | 873 |
| SB5000 | 非洲 | 人类 | 粪便 | 14 | 1 | 2 | 1 | 7 | 4 | 182 | 873 |
| T7058 | 欧洲 | 人类 | 粪便 | 14 | 1 | 2 | 1 | 7 | 4 | 182 | 873 |
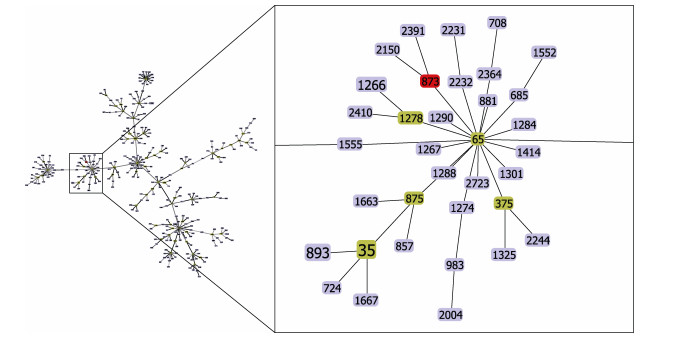 |
| 图 4 MLST分析 Fig. 4 MLST analysis |
分离菌株KP0123在血平板上培养48 h后, 菌落周围出现透明无色区域, 显示红细胞完全裂解, 呈现典型的β溶血(图 5a)。液体溶血素测定结果显示, 分离株KP0123的红细胞溶血活性在感染早期迅速增加, 在感染后36 h降低并随着感染时间的增加趋于稳定, 其最大溶血活性在12~24 h (图 5b), 表明分离菌株KP0123具有溶血活性。
 |
| 图 5 分离菌株的溶血活性(a)及其在细菌生长周期中的变化(b) Fig. 5 Hemolysis activity (a) of the isolated strain and the changes (b) during different phases of bacterial growth circle |
毒力基因PCR检测结果显示, 分离菌株KP0123携带aere、alls、wca、ybt四种毒力基因(图 6), 其毒力基因型为aero+alls+wca+ybt+。
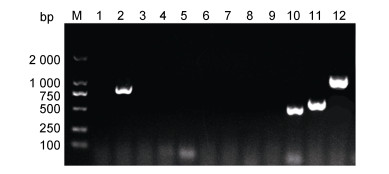 |
| 图 6 分离菌株的毒力基因检测 Fig. 6 Results of virulence gene detection of the isolated strain 注: M: Marker; 1~12: iucB、aero、rmpA、fim、Kfu、uge、iroNB、cf29a、wabG、wcaG、allS、ybt基因 |
分离菌株KP0123人工感染健康大口黑鲈, 最高浓度组(1.5×1010 CFU/mL组)的大口黑鲈在腹腔注射后4 h开始出现反应迟钝、摄食减少的现象; 感染24 h后, 1.5×1010 CFU/mL组大口黑鲈开始死亡, 并于72 h内全部死亡; 死亡的大口黑鲈体表无明显的溃疡(图 7a), 可见注射部位红肿(图 7d); 解剖发现病鱼腹水较多(图 7c), 肠道出血(图 7b), 与健康鱼相比, 脾脏明显肿大(图 7e, 7f); 感染组试验鱼出现与自然发病大口黑鲈类似的临床症状。
 |
| 图 7 分离菌株感染大口黑鲈的临床症状 Fig. 7 Clinical symptoms of M. salmoide infected by the isolated strain 注: a. 感染组; b. 肠道肿胀出血; c. 腹腔含有腹水; d. 体表泛红; e. 脾脏出血泛红; f. 脾脏对照组 |
感染后3 d, 1.5×109 CFU/mL组大口黑鲈死亡1尾, 并在之后3 d连续死亡; 1.5×108 CFU/mL组的实验鱼在感染后4 d后出现连续死亡的情况; 对照组大口黑鲈未见异常, 死亡率为0。从死亡大口黑鲈脾脏、胃、肠、肝脏、头肾等组织均可分离出圆形、光滑的菌株, 经PCR和测序分析鉴定与攻毒菌株一致, 对照组中未发现该菌。病理组织学观察发现, 与健康对照组相比, 感染组大口黑鲈的肾小球细胞水肿, 肾单位结构不清晰; 脾脏的红髓白髓界限不明显, 组织出现颗粒变性和空泡; 肝细胞水肿、排列紊乱, 细胞核出现溶解现象(图 8)。结果表明, 分离株KP0123感染可造成大口黑鲈严重的脏器损伤。经统计和计算, 分离株KP0123对大口黑鲈的半数致死量为3.4×107 CFU/mL (图 9a); PCR检测发现, 在病鱼的胃、肠、肝、脾、头肾组织中均可检测到分离株KP0123 (图 9b), 载菌量分别为4.4×105、1.0×105、4.2×105、9.6×108、1.64×109 CFU/mg, 其中头肾部位细菌载量最高(图 9c), 表明分离菌株具有一定的组织嗜性和致病性。
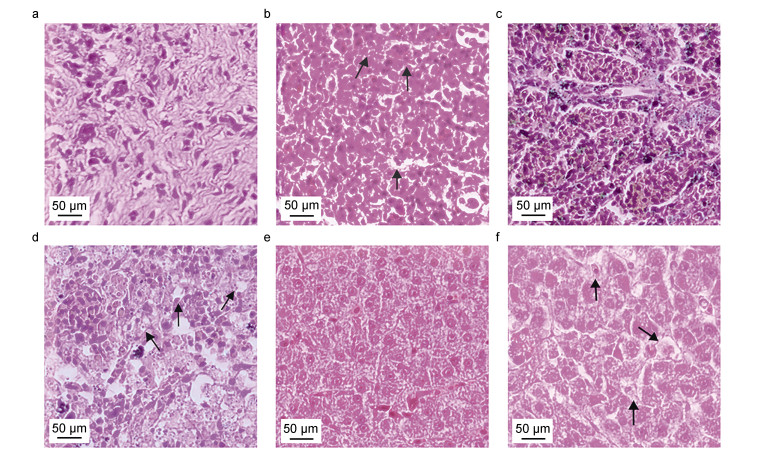 |
| 图 8 分离菌株感染大口黑鲈的组织损伤 Fig. 8 Tissue damages of M. salmoides infected by the isolated strain 注: a. 对照组肾脏; b. 感染组肾脏; c. 对照组脾脏; d. 感染组脾脏; e. 对照组肝脏; f. 感染组肝脏 |
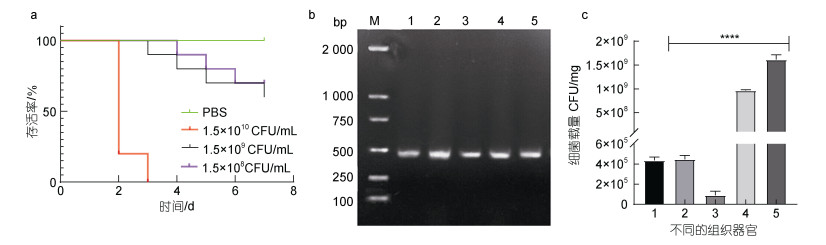 |
| 图 9 生存曲线(a)及分离菌株感染大口黑鲈的脏器分布(b)和组织载菌量(c) Fig. 9 Survival curve (a) and isolation and identification of pathogens (b) and bacterial loads in different organs and tissues (c) of M. salmoides infected by the isolated strain 注: b图中, M. Marker, 1. 肝脏, 2. 头肾, 3. 肠, 4. 脾, 5. 胃; c图中, 1. 胃, 2. 肝, 3. 肠, 4. 脾, 5. 头肾 |
分离菌株KP0123样品OD570 nm为0.176, 阴性对照均值为0.084 (图 10a), 由此可知分离菌株KP0123为中等被膜形成能力的菌株。
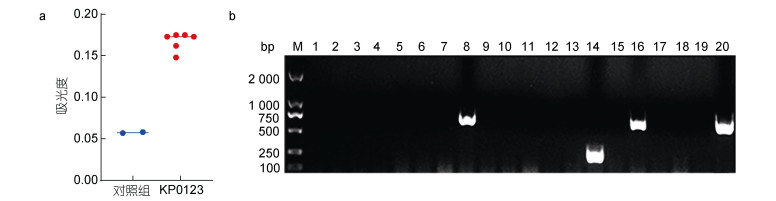 |
| 图 10 分离株的生物被膜形成能力(a)和耐药基因鉴定结果(b) Fig. 10 The biofilm capacity (a) and the identification of drug resistance genes (b) of the isolate strain 注: M: Marker; 1~20: bla-TEM、bla-IMP、bla-OXA、bla-DHA、sul1、ere(D)、erm(F)、aadA、aadB、tetA、tetC、tetM、β-NDM、bla-SHV、β-KPC、tetB、gyrA、gyrB、inu(H)、sul2 |
耐药基因PCR筛查结果显示, 分离菌株KP0123携带bla-SHV、sul2、aadA和tetB四种耐药基因(图 10b), 其余耐药基因检测为阴性, 表明分离菌株具有一定的耐药性。
2.7.3 药物敏感性结果以金黄色葡萄球菌(ATCC25923)为质控菌株进行药敏试验。结果显示, 分离菌株对氨苄西林、红霉素、四环素、多西环素、复方新诺明、克林霉素等7种药物耐药; 对头孢曲松、头孢美唑、丁胺卡那、氧氟沙星等5种药物敏感; 对万古霉素和呋喃唑酮为中介(表 4), 分离菌株表现为多重耐药。
| 药物类别 | 药物名称 | 临界范围/mm | 抑菌圈直径/mm | 敏感性 | ||
| β-内酰胺类 | 氨苄西林 | ≤13 | 14~16 | ≥17 | 0 | 耐药 |
| 头孢曲松 | ≤14 | 15~17 | ≥18 | 24 | 敏感 | |
| 头孢美唑 | ≤15 | 16~20 | ≥21 | 24 | 敏感 | |
| 大环内酯类 | 红霉素 | ≤13 | 14~22 | ≥23 | 0 | 耐药 |
| 氨基糖苷类 | 丁胺卡那 | ≤14 | 15~16 | ≥17 | 17 | 敏感 |
| 四环素类 | 四环素 | ≤14 | 15~18 | ≥19 | 0 | 耐药 |
| 多西环 | ≤14 | 15~18 | ≥19 | 10 | 耐药 | |
| 喹诺酮类 | 氧氟沙星 | ≤12 | 13~16 | ≥17 | 19 | 敏感 |
| 磺胺类 | 复方新诺明 | ≤13 | 14~17 | ≥18 | 0 | 耐药 |
| 黏菌素类 | 多黏菌素 | ≤8 | 8~11 | ≥12 | 13 | 敏感 |
| 林可酰胺类 | 克林霉素 | ≤14 | 15~16 | ≥17 | 0 | 耐药 |
| 利福霉素类 | 利福平类 | ≤13 | 14~16 | ≥17 | 0 | 耐药 |
| 硝基呋喃类 | 呋喃唑酮 | ≤12 | 13~17 | ≥18 | 17 | 中介 |
| 糖肽类 | 万古霉素 | ≤10 | 11~13 | ≥14 | 12 | 中介 |
体外抑菌结果如表 5所示, 中药水提取液中三七、款冬花的抑菌直径大于15 mm, 对KP0123抑菌作用较强, 属高度敏感; 全蝎、野菊花的抑菌直径在10~15 mm, 为中度敏感; 薄荷、乌梅、熟大黄3种中药的抑菌直径小于10 mm, 属于低度敏感; 而蒲公英和板蓝根无抗菌作用。进一步测定具有体外抑菌效果中药的MIC与MBC, 全蝎、三七和款冬对KP0123的抑菌效果最佳, 其MIC值均为62.5 mg/mL, MBC值在62.5~125 mg/mL; 野菊花的抑菌效果次之, MIC为250 mg/mL, MBC为500 mg/mL; 中药薄荷、熟大黄和乌梅的MIC, MBC均为500 mg/mL。
| 中药名称 | 抑菌圈直径/mm | 敏感性 | MIC/(mg/mL) | MBC/(mg/mL) |
| 全蝎 | 13 | ++ | 62.5 | 125 |
| 薄荷 | 9 | + | 500 | 500 |
| 三七 | 18 | ++ | 62.5 | 62.5 |
| 款冬花 | 16 | ++ | 62.5 | 125 |
| 野菊花 | 12 | ++ | 250 | 500 |
| 熟大黄 | 7 | + | 500 | 500 |
| 乌梅 | 9 | + | 500 | 500 |
| 蒲公英 | 0 | – | — | — |
| 板蓝根 | 0 | – | — | — |
| 注: 抑菌圈的直径>20 mm时为极敏, 用“+++”表示; 10~19 mm时为高敏, 用“++”表示; 10 mm以下为低敏, 用“+”表示; 无抑菌圈为耐药, 用“–”表示 | ||||
本研究从患腹水病大口黑鲈的病变组织中成功分离出一株肺炎克雷伯菌, 经MLST鉴定为ST-873型菌株。该型主要分布于非洲和欧洲, 来源于人和海鸥, 尚未见该型在亚洲区域出现。本研究首次分离到大口黑鲈源的肺炎克雷伯菌ST-873型菌株, 提示肺炎克雷伯菌作为一种人-兽-鱼共患病病原, 存在对公共卫生安全的潜在威胁。
本研究对分离的大口黑鲈源肺炎克雷伯菌ST-873型菌株的毒力基因筛查发现, 在12种常见毒力基因中分离菌株KP0123携带aero、alls、wca和ybt四种毒力基因; 回归试验证实分离菌株KP0123可致大口黑鲈出现腹水等与自然发病鲈鱼类似的临床症状, 高剂量感染可导致大口黑鲈死亡; 同时从试验组死亡大口黑鲈的病变组织中分离到攻毒菌株, 表明分离株KP0123具有一定的组织嗜性, 也印证了其与此次养殖企业大口黑鲈腹水病的相关性。研究发现, 分离菌株在与红细胞孵育时具有溶血活性, 人工感染试验病鱼的组织切片验证了分离菌株KP0123能够导致肾细胞水肿、脾脏出现变性和肝细胞核溶解等病理变化, 结合其携带的毒力基因aero、alls、wca和ybt与细菌的抗吞噬、黏附能力的密切关系, 进一步说明分离菌株对大口黑鲈具有一定的致病性。
细菌性疾病仍然是水产养殖中最常见、危害最大的一类疾病, 随着精养密度的增加和水体环境的恶化, 细菌性感染的抗生素治疗也面临多重耐药、效果不稳定、影响生态等诸多问题(Gwenzi et al, 2022)。传统的中草药应用于水产病害的治疗, 具有药源丰富、取材方便、毒副作用小、不易产生抗药性、不影响生态等方面的优势, 备受国内外水产专家的关注(Zhang et al, 2022)。分离菌株的耐药基因筛查发现, 其携带bla-SHV、sul2、aadA和tetB共4种耐药基因, 属于多重耐药菌株; 药敏试验结果发现, 分离株KP0123对氨苄西林、红霉素、四环素、多西环素等抗菌药物耐药, 对头孢曲松、头孢美唑、丁胺卡那、氧氟沙星等药物敏感, 分离菌株的药物敏感性与其他动物源分离株存在显著不同(刘海月等, 2020; 李双双, 2020; 郭蕊等, 2021), 与大黄鱼源肺炎克雷伯菌分离株的耐药菌谱也存在一定的差异(潘苑霞等, 2022), 这可能由药物的滥用以及不同地区用药习惯和时空上的差异造成的。在生物被膜形成能力方面, 分离株KP0123具有中等的生物被膜形成能力, 与其在药敏试验中表现的多重耐药情况相符, 也预示其可能对该菌感染的治疗带来一定的困扰。43味中药的体外抑菌试验发现, 三七、款冬花、全蝎、薄荷、野菊花对于肺炎克雷伯菌分离株的生长有显著的抑制作用, 因此在临床治疗时可以考虑使用中药复方或抗生素和中药联合用药, 以充分发挥中药提高动物机体免疫力和抗感染的作用。
结合分离株KP0123生物被膜形成能力、耐药基因以及药敏筛查结果, 在一定程度解释了该养殖基地前期抗生素治疗大口黑鲈腹水症时效果不理想的原因。该场利用敏感抗生物连续用药5 d后, 病情得到了有效控制。因此, 养殖生产上应兼顾多病原流行、耐药性和致病性的特点, 在提高水质环境的基础上, 通过敏感抗生素和中药联用, 为肺炎克雷伯感染的精准防控和综合施治奠定基础。
4 结论本试验分离并鉴定出一株大口黑鲈源ST-873型肺炎克雷伯菌, 并验证其可导致大口黑鲈的腹水症, 进一步拓宽了肺炎克雷伯菌的感染谱; 肺炎克雷伯菌分离株携带aere、alls、wca和ybt四种毒力基因, 可致大口黑鲈肾脏等器官严重的病理损伤, 甚至死亡; β-内酰胺类、氨基糖苷类等抗生素和中药三七、款冬花对肺炎克雷伯菌分离菌株具有良好的抑制作用, 对生产上联合用药和精准施治具有指导意义。本研究为揭示大口黑鲈腹水症的病因和鱼源ST-873型肺炎克雷伯菌的生物学特性提供了科学依据。
东秀珠, 蔡妙英, 2001. 常见细菌系统鉴定手册. 北京: 科学出版社, 114-116
|
刘海月, 齐丽娜, 孙弋雅, 等, 2020. 鹅源肺炎克雷伯菌分离鉴定及其致病性分析. 现代畜牧兽医, (4): 20-25 |
李双双, 2020. 吉林省部分地区猪源肺炎克雷伯菌分离鉴定及耐药性分析[D]. 长春: 吉林农业大学: 7-40.
|
李静, 韩燕雨, 2020. 忍冬非花蕾部位的研究进展. 中华中医药学刊, 38(4): 43-50 DOI:10.13193/j.issn.1673-7717.2020.04.010 |
陈秀枢, 屠湧涛, 1994. 微量肉汤稀释法测定MIC的评价. 中华医学检验杂志, 17(2): 95-98 |
欧冠标, 周雨晴, 彭昊, 等, 2021. 猪源肺炎克雷伯氏菌耐药性及毒力基因分析. 中国动物检疫, 38(6): 102-111 DOI:10.3969/j.issn.1005-944X.2021.06.021 |
周清德, 缪竞智, 张秀珍, 2000. 产ESBL肺炎克雷伯菌医院感染分子流行病学研究. 中华医院感染学杂志, 4(1): 10-12 DOI:10.3321/j.issn:1005-4529.2000.01.004 |
胡仁静, 汤怡颖, 胡锡池, 等, 2018. 肝脓肿相关肺炎克雷伯菌毒力基因检测及同源性分析. 临床检验杂志, 36(4): 263-266 |
施瑜, 王震, 张汉园, 等, 2021. 肺炎克雷伯菌荚膜血清型、毒力基因和耐药性研究. 国际检验医学杂志, 42(14): 1720-1725 DOI:10.3969/j.issn.1673-4130.2021.14.013 |
袁媛, 袁永明, 代云云, 等, 2020. 中国特色淡水鱼产业竞争优势研究. 中国农学通报, 36(35): 127-133 DOI:10.11924/j.issn.1000-6850.casb2020-0008 |
郭蕊, 张召兴, 曹丽辉, 等, 2021. 貂源肺炎克雷伯菌分离鉴定与耐药性检测. 野生动物学报, 42(4): 1187-1191 |
曹菲菲, 2020. 规模化牧场奶牛乳腺炎病原菌分离鉴定及肺炎克雷伯菌耐药性和致病力研究[D]. 扬州: 扬州大学: 25-26.
|
谭啸, 章熙东, 2019. 革兰氏染色法观察与区分细菌. 生物学教学, 44(7): 71-72 |
滕涛, 梁利国, 谢骏, 等, 2016. 团头鲂源肺炎克雷伯氏菌的分离鉴定. 水生态学杂志, 37(6): 95-100 |
潘苑霞, 王文基, 陈庆涛, 等, 2022. 一株大黄鱼源肺炎克雷伯菌的分离鉴定与致病性分析. 水产科学, 1(4): 1-15 |
ALEXANDER M E, DICK J T A, O'CONNOR N E, et al, 2012. Functional responses of the intertidal amphipod Echinogammarus marinus: effects of prey supply, model selection and habitat complexity. Marine Ecology Progress Series, 468: 191-202 |
BAI J J, LUTZ-CARRILLO D J, QUAN Y C, et al, 2008. Taxonomic status and genetic diversity of cultured largemouth bass Micropterus salmoides in China. Aquaculture, 278(1/2/3/4): 27-30 |
BUCHANAN B E, BERGEY N E, 1994. Manual of Common Determinative Bacteriology. 9th ed. USA Baltimore: Williams & Wilkins Co, 597-635
|
DALLENNE C, DA COSTA A, DECRÉ D, et al, 2010. Development of a set of multiplex PCR assays for the detection of genes encoding important β-lactamases in Enterobacteriaceae. Journal of Antimicrobial Chemotherapy, 65(3): 490-495 |
DAS A, BEHERA B K, ACHARYA S, et al, 2019. Genetic diversity and multiple antibiotic resistance index study of bacterial pathogen, Klebsiella pneumoniae strains isolated from diseased Indian major carps. Folia Microbiologica, 64(6): 875-887 DOI:10.1007/s12223-019-00701-7 |
EWERS C, STAMM I, PFEIFER Y, et al, 2014. Clonal spread of highly successful ST15-CTX-M-15 Klebsiella pneumoniae in companion animals and horses. Journal of Antimicrobial Chemotherapy, 69(10): 2676-2680 |
FOGELSON S B, PETTY B D, REICHLEY S R, et al, 2016. Histologic and molecular characterization of Edwardsiella piscicida infection in largemouth bass (Micropterus salmoides). Journal of Veterinary Diagnostic Investigation, 28(3): 338-344 |
GREISEN K, LOEFFELHOLZ M, PUROHIT A, et al, 1994. PCR primers and probes for the 16S rRNA gene of most species of pathogenic bacteria, including bacteria found in cerebrospinal fluid. Journal of Clinical Microbiology, 32(2): 335-351 |
GUNNARSSON G L, BRANDT P B, GAD D, et al, 2009. Monomicrobial necrotizing fasciitis in a white male caused by hypermucoviscous Klebsiella pneumoniae. Journal of Medical Microbiology, 58(11): 1519-1521 |
GWENZI W, DANA A, KAM K Y, et al, 2022. Ecological health risks of antibiotic resistance: a perspective on the evidence, challenges, and research needs[M] // GWENZI W. Emerging Contaminants in the Terrestrial-Aquatic-Atmosphere Continuum. Amsterdam: Elsevier: 195-213.
|
HSIEH P F, LIN T L, LEE C Z, et al, 2008. Serum-induced iron-acquisition systems and TonB contribute to virulence in Klebsiella pneumoniae causing primary pyogenic liver abscess. The Journal of Infectious Diseases, 197(12): 1717-1727 |
LIN Y T, CHEN T L, SIU L K, et al, 2010. Clinical and microbiological characteristics of community-acquired thoracic empyema or complicated parapneumonic effusion caused by Klebsiella pneumoniae in Taiwan. European Journal of Clinical Microbiology & Infectious Diseases, 29(8): 1003-1010 DOI:10.1007/s10096-010-0961-8 |
LIN J C, KOH T H, LEE N, et al, 2014. Genotypes and virulence in serotype K2 Klebsiella pneumoniae from liver abscess and non-infectious carriers in Hong Kong, Singapore and Taiwan. Gut Pathogens, 6(1): 21 |
POIREL L, WALSH T R, CUVILLIER V, et al, 2011. Multiplex PCR for detection of acquired carbapenemase genes. Diagnostic Microbiology and Infectious Disease, 70(1): 119-123 |
QIAO Y, MA X W, ZHONG S P, et al, 2021. Interaction analysis of miRNA and mRNA in the head kidney of black seabass (Centropristis striata) after Vibrio harveyi infection. Aquaculture, 542: 736886 |
ROCK C, THOM K A, MASNICK M, et al, 2014. Frequency of Klebsiella pneumoniae carbapenemase (KPC)-producing and non-KPC-producing Klebsiella species contamination of healthcare workers and the environment. Infection Control & Hospital Epidemiology, 35(4): 426-429 |
RONALD A, 2002. The etiology of urinary tract infection: traditional and emerging pathogens. The American Journal of Medicine, 113(1): 14-19 |
TANSEY F, GORMLEY R, BUTLER F, 2010. The effect of freezing compared with chilling on selected physico-chemical and sensory properties of sous vide cooked carrots. Innovative Food Science & Emerging Technologies, 11(1): 137-145 |
WANG J H, LIU Y C, LEE S S J, et al, 1998. Primary liver abscess due to Klebsiella pneumoniae in Taiwan. Clinical Infectious Diseases, 26(6): 1434-1438 |
YASUIKE M, NISHIKI I, IWASAKI Y, et al, 2017. Analysis of the complete genome sequence of Nocardia seriolae UTF1, the causative agent of fish nocardiosis: The first reference genome sequence of the fish pathogenic Nocardia species. PLoS One, 12(3): e0173198 |
YU W L, KO W C, CHENG K C, et al, 2006. Association between rmpA and magA genes and clinical syndromes caused by Klebsiella pneumoniae in Taiwan. Clinical Infectious Diseases, 42(10): 1351-1358 |
ZHANG W N, ZHAO J P, MA Y F, et al, 2022. The effective components of herbal medicines used for prevention and control of fish diseases. Fish & Shellfish Immunology, 126: 73-83 |
ZHOU J, ZHAO H, ZHANG L, et al, 2021. MiRNA-seq analysis of spleen and head kidney tissue from aquacultured largemouth bass (Micropterus salmoides) in response to Aeromonas hydrophila infection. Functional & Integrative Genomics, 21(1): 101-111 DOI:10.1007/s10142-020-00763-8 |
 2023, Vol. 54
2023, Vol. 54


