中国海洋湖沼学会主办。
文章信息
- 王雨辰, 雷宁, 郝贵杰, 周冬仁, 王锋, 黄爱霞, 崔雁娜, 孙博怿, 林锋. 2023.
- WANG Yu-Chen, LEI Ning, HAO Gui-Jie, ZHOU Dong-Ren, WANG Feng, HUANG Ai-Xia, CUI Yan-Na, SUN Bo-Yi, LIN Feng. 2023.
- 罗氏沼虾(Macrobrachium rosenbergii)致病性豚鼠气单胞菌(Aeromonas caviae)的分离鉴定及其特性分析
- ISOLATION, IDENTIFICATION, AND CHARACTERIZATION OF PATHOGENIC AEROMONAS CAVIAE IN MACROBRACHIUM ROSENBERGII
- 海洋与湖沼, 54(3): 866-874
- Oceanologia et Limnologia Sinica, 54(3): 866-874.
- http://dx.doi.org/10.11693/hyhz20220900247
文章历史
-
收稿日期:2022-09-28
收修改稿日期:2022-11-13
2. 上饶市农业农村产业发展服务中心 江西上饶 334000;
3. 上饶市农林水科学研究中心 江西上饶 334000
2. Shangrao City Agricultural and Rural Industry Development Service Center, Shangrao 334000, China;
3. Shangrao City Agriculture, Forestry and Water Science Research Center, Shangrao 334000, China
罗氏沼虾(Macrobrachium rosenbergii)属于甲壳纲、十足目、长臂虾科、沼虾属,肉质鲜美、养殖周期短、生长速度快,是国内重要经济性淡水虾养殖品种之一。国内罗氏沼虾育苗企业大多分布在浙江省湖州市,其年育苗量近达100亿(徐卫国等, 2018)。国内罗氏沼虾主要产区是广东、江苏以及浙江地区,其中广东省作为国内罗氏沼虾养殖大省,该省养殖面积达2.3万hm2 (罗红等, 2022)。据统计,2020年我国罗氏沼虾的养殖总产量达16万t以上(罗红等, 2022)。2021年,据FAO统计中国罗氏沼虾养殖总产量占全球养殖总产量的50%以上。随着罗氏沼虾产业的迅猛发展,种质退化、养殖模式落后、病害等因素已严重影响了罗氏沼虾养殖业的可持续发展(罗红等, 2022)。病害已成为制约我国水产养殖业可持续发展的重要因素之一。水产病害主要包括营养性疾病、病毒性疾病、真菌性疾病、寄生虫病以及细菌性疾病等多种类。细菌性疾病具有病原菌种类繁多、覆盖区域广、流行时间长、传染性强、控制难度大等特点,其造成的经济损失可占据当年疾病损失70%以上(王玉堂等, 2013)。引发罗氏沼虾细菌性疾病的主要病原菌包括了革兰氏阳性球菌、弧菌以及气单胞菌等(徐洋等, 2012)。
豚鼠气单胞菌(Aeromonas caviae)隶属弧菌科、气单胞菌属,是革兰氏阴性菌。豚鼠气单胞菌可存在于食物、饮用水、污水和环境水体中(Baldissera et al, 2017)。豚鼠气单胞菌是一种人畜共患病原体,易导致免疫力正常或低下的宿主出现感染并发症(Janda et al, 2010)。根据文献报道,豚鼠气单胞菌可以感染南方鲇(汪开毓等, 2012)、花鱼骨(Zhu et al, 2017)、草鱼(何永龙等, 2015)、鲈鱼(王海娟等, 2014)、中华绒螯蟹(周丽颖等, 2022)、克氏原螯虾(曹海鹏等, 2014)、南美白对虾(曾宪凯等, 2020)及罗氏沼虾(郭莹等, 2020)等多种水生动物。2021年9月湖州某养殖场的罗氏沼虾体表出现黑斑、肢体残损等症状,严重可导致死亡。为查明原因,本研究从感染症状明显的罗氏沼虾肝胰腺组织中分离纯化得到一株优势菌并对其进行分离鉴定,通过形态观察、生理生化鉴定、16S rDNA序列鉴定、药敏试验及毒力基因检测对分离菌株的生物学特性进行分析,以期为罗氏沼虾细菌性疾病的诊断和有效防治提供参考。
1 材料与方法 1.1 试验材料患病罗氏沼虾[体长(10±0.65) cm]采自浙江省湖州市某养殖场,健康罗氏沼虾[体重(7.00±0.65) g, 体长(7.9±0.42) cm]购自湖州某水产公司。胰蛋白胨大豆肉汤(TSB)和胰蛋白胨大豆琼脂(TSA)培养基均为青岛海博产品,革兰氏染色试剂盒为索莱宝产品,细菌生化微量鉴定管和药敏试纸为杭州滨和微生物产品,Premix Taq™ (TaKaRa Taq™ Version 2.0)为TaKaRa产品,细菌基因组DNA提取试剂盒为天根产品,其他试剂均为国产分析纯,所用引物均为生工生物工程(上海)有限公司合成。
1.2 病原菌的分离发病罗氏沼虾进行体表消毒,无菌条件下使用一次性接种环从其肝胰腺组织取样,于TSA固体培养基上划线进行培养,30 ℃培养过夜。次日,观察菌落形态并挑取优势菌株于TSB培养基中培养,将分离纯化后的菌株命名为MR-I。
1.3 细菌形态学观察根据索莱宝试剂盒染色说明对分离菌MR-I进行革兰氏染色。先挑取MR-I单菌落涂成薄片,火烤固定;使用草酸铵结晶紫进行初染(1 min),蒸馏水洗涤;再利用碘液进行媒染(1 min),蒸馏水洗涤;后通过95%酒精进行脱色(45 s),蒸馏水洗涤,吸干水分;最后滴加蕃红进行复染(1 min),蒸馏水洗涤;待自然晾干后于100倍油镜下观察,观察细菌形态特征并拍照保存。
将菌株MR-I接种于3 mL TSB培养基中,200 r/min培养过夜,5 000 r/min低温离心收集菌体,先利用PBS洗涤,后用无菌水重悬待用。将处理好的MR-I菌液与适量2%锇酸轻柔混匀,后将铜网覆盖其上,静置5 min;先将负染液磷钨酸溶液滴于封口膜上,后将处理后的铜网转至封口膜上,静置2 min左右;吸干铜网上的染液,室温自然晾干后,于透射电子显微镜下观察并拍照保存。
1.4 病原菌的致病性将分离菌株MR-I接种于TSB液体培养基中,30 ℃条件200 r/min培养12 h,5 000 r/min低温离心收集菌体,PBS洗涤3次后,菌液用生理盐水分别稀释至浓度为2.81×103、2.81×104、2.81×105、2.81×106和2.81×107 CFU/mL。健康罗氏沼虾随机分为6组,每组45只,试验组分别浸泡于不同浓度菌液中,对照组浸泡于生理盐水,试验期间水温控制在28~ 30 ℃。感染后每隔24 h观察罗氏沼虾临床表现并统计死亡情况,连续监测7 d,并根据改良寇氏法(李海丽等, 2013)计算半致死剂量(LD50)。从发病罗氏沼虾肝胰腺组织中再次分离病原菌,进行分离培养及鉴定,以确定是该分离菌株导致罗氏沼虾死亡。
1.5 病原菌的生理生化鉴定采用细菌微量生化鉴定管对待测菌株各项生化指标进行测定,各项指标重复测定3次。将分离菌株MR-I接种于TSA培养基,30 ℃培养过夜,次日挑取单菌落分别接种于不同种类的细菌微量生化鉴定管中,30 ℃培养24 h或48 h,后根据《常见细菌系统鉴定手册》(东秀珠等, 2001)中的鉴定方法对病原菌进行生理生化鉴定。
1.6 病原菌的分子生物学鉴定根据DNA提取试剂盒说明抽提菌株MR-I的DNA。利用细菌通用引物扩增MR-I菌株的16S rRNA基因序列,正向引物为27F:5'-AGAGTTTGATCCT GGCTCAG-3',反向引物为1492R:5'-TACGGTTACC TTGTTACGAC-3',扩增目的片段大小为1 470 bp。扩增反应体系(25 μL):Premix Taq™ 12.5 μL,DNA模板2 μL,引物27F和1492R各0.5 μL,DEPC水9.5 μL。PCR扩增条件:95 ℃/4 min;95 ℃/30 s,55 ℃/ 30 s,72 ℃/1 min,35个循环后72 ℃延伸10 min。PCR产物进行凝胶电泳检测。将扩增产物送至生工生物工程(上海)有限公司进行测序,通过Blast检索系统对MR-I核苷酸序列进行序列比对,利用MEGA 6.0中的邻接法建树并构建菌株MR-I系统进化发育树。
1.7 病原菌的药物敏感性利用KB纸片扩散法对病原菌进行耐药性分析,以涂布法将病原菌接种至TSA培养基,后将药敏纸片贴于TSA平板上,30 ℃培养24 h后测定抑菌圈直径,测定3次取平均值,根据杭州滨和微生物提供的判定标准对病原菌进行抗生素耐药性分析。检测的抗生素包含头孢曲松、氯霉素、氟苯尼考、新霉素、强力霉素、庆大霉素、链霉素、恩诺沙星、阿米卡星、复方新诺明、四环素、环丙沙星、诺氟沙星、乙酰螺旋霉素、羧苄西林、青霉素、头孢噻吩、红霉素、多粘菌素及利福平等20种。
1.8 病原菌的毒力基因检测根据已发表文献合成气溶素(aerolysin, aer)、细胞毒性肠毒素(cytotonic enterotoxin, act)、胆固醇酰基转移酶(glycerophospholipid: cholesterol acyltransferase, gcat)、脂肪酶(lipase, lip)、脱氧核糖核酸酶(DNases, exu)、丝氨酸蛋白酶(serine protease, ser)及外膜蛋白A (outer membrane proteins A, OMPA I)等毒力相关基因的特异性引物(见表 1),以分离菌MR-I的DNA为模板进行PCR扩增。扩增反应体系(25 μL):DNA模板1 μL,正向和反向引物各0.5 μL,Premix Taq™ 12.5 μL,DEPC水9.5 μL。PCR扩增条件:95 ℃/5 min;95 ℃/30 s,退火温度30 s,72 ℃/1 min,35个循环后72 ℃延伸10 min。取适量PCR产物进行琼脂糖凝胶电泳。
| 基因 | 引物序列(5'~3') | 产物大小/bp | 退火温度Tm/℃ | 参考文献 |
| aer-F | CCTATGGCCTGAGCGAGAAG | 431 | 63 | (Nawaz et al, 2010) |
| aer-F | CCAGTTCCAGTCCCACCACT | |||
| gcaT-F | CTCCTGGAATCCCAAGTATCAG | 237 | 65 | (Nawaz et al, 2010) |
| gcaT-R | GGCAGGTTGAACAGCAGTATCT | |||
| act-F | AGAAGGTGACCACCACCAAGAACA | 232 | 65 | (Nawaz et al, 2010) |
| act-R | AACTGACATCGGCCTTGAACTC | |||
| lip-F | ATCTTCTCCGACTGGTTCGG | 382 | 63 | (Nawaz et al, 2010) |
| lip-R | CCGTGCCAGGACTGGGTCTT | |||
| OMPA I-F | GACGATATCATGATGAAAATGGCTCT | 1026 | 58 | (张海月等, 2016) |
| OMPA I-R | GCGAAGCTTTTACTTCTGAACTTCTTG | |||
| exu-F | GGACATGCACAACCTCTTCC | 323 | 55 | (边宇等, 2013) |
| exu-R | GATTGGTATTGCCTTGCAAG | |||
| Ser | CACCGAAGTATTGGGTCAGG | — | 57 | (胡天野等, 2012) |
| Ser | GGCTCATGCGTAACTCTGGT |
根据观察结果,MR-I菌落具有菌落呈圆形、表面光滑、边缘整齐、呈现淡黄色。根据革兰氏染色结果(图 1a),该菌染色后呈红色,呈杆状,两端钝圆,初步判定为革兰氏阴性菌。经透射电镜观察发现该菌体两端钝圆,近似椭圆形,无侧向鞭毛,极端着生单鞭毛(图 1b)。
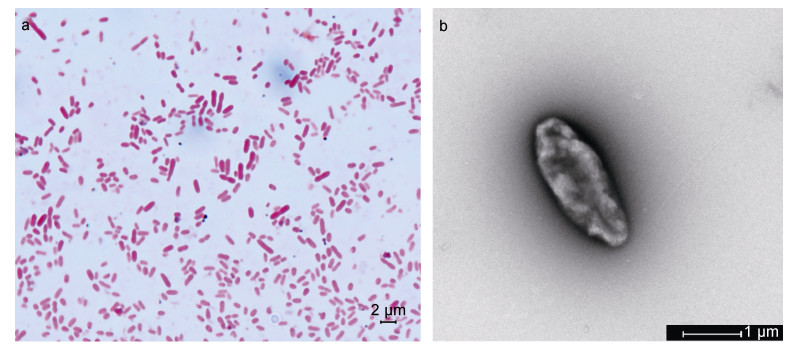 |
| 图 1 分离菌株MR-I的革兰氏染色形态(a)及透射电镜照片(b) Fig. 1 The Gram-staining micrograph (a) and transmission electron micrograph (b) of the isolated strain MR-I |
根据人工回归感染试验结果,试验期间对照组罗氏沼虾未见异常,试验组则出现不同程度死亡(详见表 2)。罗氏沼虾在病原菌感染后第2天开始出现死亡,2.81×107 CFU/mL浓度组48 h内死亡率达到100%,2.81×103 CFU/mL低浓度组并未发生死亡。根据改良寇氏法计算得到该分离菌对罗氏沼虾的半致死浓度为6.54×105 CFU/mL。感染后发病的罗氏沼虾在足部、尾部及体表出现黑斑,尾部肢体出现残损(图 2),与自然发病罗氏沼虾症状相似,且从发病罗氏沼虾肝胰腺组织中可再次分离得到该菌,表明MR-I分离株对罗氏沼虾具有较强的致病性。
| 分组 | 浓度(CFU/mL) | 试验鱼数量/尾 | 累计死亡量/尾 | 累计死亡率/% |
| A | 2.81×107 | 45 | 45 | 100 |
| B | 2.81×106 | 45 | 28 | 62.2 |
| C | 2.81×105 | 45 | 19 | 42.2 |
| D | 2.81×104 | 45 | 4 | 8.9 |
| E | 2.81×103 | 45 | 0 | 0 |
| 对照组 | PBS | 45 | 0 | 0 |
 |
| 图 2 患病罗氏沼虾的症状 Fig. 2 Pathological syndromes of M. rosenbergii 注: a为自然发病; b、c为人工感染; 垂直箭头指足部出现黑斑; 水平箭头指尾部残损、有黑斑, 斜箭头指体表有黑斑 |
分离菌株MR-I对精氨酸脱羧酶、葡萄糖、氧化酶试纸、蛋白胨水、葡萄糖产气、苯丙氨酸、明胶、甘露醇、棉子糖、蔗糖、3% NaCl胰胨水、木糖和水杨素等呈阳性;而对鸟氨酸脱羧酶、赖氨酸脱羧酶、氨基酸对照、葡磷胨水、葡萄糖酸盐、侧金盏花醇、山梨醇、硫化氢、尿素、枸橼酸盐和半固体琼脂等呈阴性反应(见表 3)。结合细菌生化鉴定结果并根据文献(东秀珠等, 2001)中的鉴定方法,初步推断分离菌株MR-I是豚鼠气单胞菌。
| 试验项目 | 结果 | 试验项目 | 结果 | |
| 鸟氨酸脱羧酶 | – | 侧金盏花醇 | – | |
| 赖氨酸脱羧酶 | – | 甘露醇 | + | |
| 精氨酸脱羧酶 | + | 山梨醇 | – | |
| 氨基酸对照 | – | 棉子糖 | + | |
| 葡萄糖 | + | 蔗糖 | + | |
| 氧化酶试纸 | + | 3% NaCl胰胨水 | + | |
| 蛋白胨水 | + | 硫化氢 | – | |
| 葡萄糖产气 | + | 木糖 | + | |
| 葡磷胨水 | – | 水杨素 | + | |
| 葡萄糖酸盐 | – | 尿素 | – | |
| 苯丙氨酸 | + | 枸橼酸盐 | – | |
| 明胶 | + | 半固体琼脂 | – | |
| 注:+表示阳性,-表示阴性 | ||||
利用引物27F和1492R进行PCR扩增,其琼脂糖凝胶电泳结果见图 3,在1 000~2 000 bp之间有一明亮的条带,与产物预期大小1 470 bp基本一致。Blast序列比对结果表明该菌株MR-I与豚鼠气单胞菌BTNGPSA4 (MK961218.1)同源性较高,两者同源性达98.41%;该菌株的系统发育树(图 4)显示分离菌MR-I与豚鼠气单胞菌BTNGPSA4聚为一个分支。综合菌株MR-I形态结构特点、生理生化特征及16S rRNA测序及系统发育树分析结果,可以判定菌株MR-I属于豚鼠气单胞菌(A. caviae)。
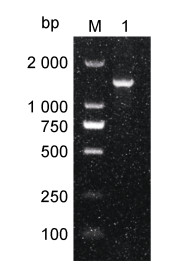 |
| 图 3 菌株MR-I 16S rRNA PCR电泳结果 Fig. 3 PCR amplification of the 16S rRNA gene of MR-I 注:M: DL2000 DNA Marker; 1: MR-I |
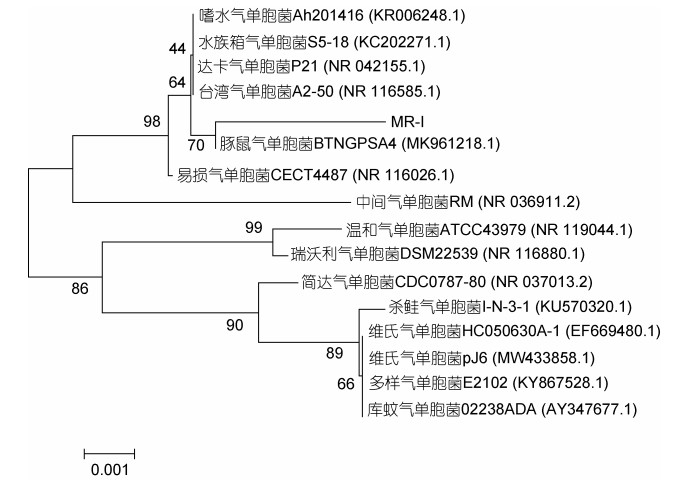 |
| 图 4 菌株MR-I 16S rRNA基因序列系统发育树 Fig. 4 The phylogenetic tree based on the 16S rRNA gene sequences of MR-I |
利用纸片扩散法进行药敏实验,结果见表 4:该分离菌株MR-I对头孢曲松、氯霉素、氟苯尼考、新霉素、强力霉素、庆大霉素及链霉素7种抗生素高度敏感,对恩诺沙星、阿米卡星及复方新诺明3种抗生素中度敏感,对四环素、环丙沙星、诺氟沙星、乙酰螺旋霉素、羧苄西林、青霉素、头孢噻吩、红霉素、多粘菌素及利福平10种抗生素具有耐药性。
| 抗菌药物 | 抑菌圈直径平均值/mm | 药物敏感性 | 抗菌药物 | 抑菌圈直径平均值/mm | 药物敏感性 | |
| 头孢曲松 | 32 | S | 四环素 | 11 | R | |
| 氯霉素 | 25 | S | 环丙沙星 | 15 | R | |
| 氟苯尼考 | 25 | S | 诺氟沙星 | 9 | R | |
| 新霉素 | 20 | S | 乙酰螺旋霉素 | 8 | R | |
| 恩诺沙星 | 18 | I | 羧苄西林 | 0 | R | |
| 强力霉素 | 18 | S | 青霉素 | 0 | R | |
| 庆大霉素 | 18 | S | 头孢噻吩 | 0 | R | |
| 链霉素 | 17 | S | 红霉素 | 0 | R | |
| 阿米卡星 | 15 | I | 多粘菌素 | 0 | R | |
| 复方新诺明 | 15 | I | 利福平 | 0 | R | |
| 注:S表示高度敏感, I表示中度敏感, R表示耐药 | ||||||
病原菌毒力基因检测结果见图 5,结果表明菌株MR-I含有气溶素aer、脂肪酶lip、胆固醇酰基转移酶gcat、丝氨酸蛋白酶ser和外膜蛋白OMPA I等毒力基因,但不具有细胞毒性肠毒素基因act和脱氧核糖核酸酶基因exu。
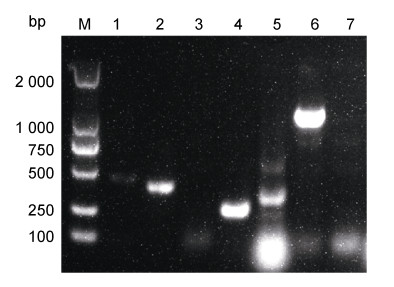 |
| 图 5 分离菌株毒力基因检测 Fig. 5 Virulence genes of the isolated strain detected by PCR 注:M: DL2000 DNA Marker, 1: aer, 2: lip, 3: act, 4: gcaT, 5: ser, 6: OMPA I, 7: exu |
豚鼠气单胞菌可通过形态学观察、生理生化鉴定、血清学、分子生物学等多种方法进行鉴定。利用电镜技术对病原菌进行形态学观察是最简单的鉴定方法,但气单胞菌属均为革兰氏阴性菌并具极端单鞭毛,该方法无法准确将病原菌鉴定到种。生理生化鉴定也是病原菌检测常用的方法之一,该法检测效率高,但易发生错检。因此,形态学观察和生理生化鉴定常做为病原菌分离鉴定的辅助手段,对病原菌进行初步的鉴定。血清学检测方法利用的是抗原与抗体能发生特异性结合的原理,该法灵敏度和特异性较高。针对豚鼠气单胞菌,吴斌(2006)和黄艺丹等(2010)分别构建了间接ELISA检测法和单克隆抗体-胶体金检测方法,此外辛志明等(2009)还研发出了用于检测豚鼠气单胞菌的胶体金免疫层析试纸条。分子生物学技术是病原检测的另一重要方法。16S rRNA基因检测被许多学者认为是细菌鉴定的有效方法,该法可将菌株鉴定到种水平,并且能应用于研究各类生物间的遗传进化关系(Kita-Tsukamoto et al, 1993; 宋路萍等, 2020; 孟令缘等, 2021)。本研究结合利用形态观察、生理生化鉴定及16S rRNA分子鉴定法对分离菌株MR-I进行鉴定,综合试验结果表明该分离菌株MR-I为豚鼠气单胞菌(A. caviae)。
3.2 豚鼠气单胞菌的毒力与致病性分析豚鼠气单胞菌属于气单胞菌属,该菌属致病性由水生态环境、菌株毒力因子表达等因素决定。刘小芳等(2021)和付乔芳等(2011)的研究表明气单胞菌的致病性与毒力基因密切相关。本研究对豚鼠气单胞菌MR-I进行毒力基因检测,结果表明该菌株含有气溶素(aer)、脂肪酶(lip)、胆固醇酰基转移酶(gcat)、丝氨酸蛋白酶(ser)和外膜蛋白(OMPA I) 5种毒力基因。周丽颖等(2022)的研究也表明了豚鼠气单胞菌SHZ1含有外膜蛋白OMPA和胆固醇酰基转移酶gcaT等多种毒力基因。气溶素与细菌致病性密切相关,其可作为判断菌株具有致病性的标志(吴同垒等, 2011)。气溶素具有溶血作用和细胞毒性,可改变宿主细胞膜通透性(Ran et al, 2018)。胞外蛋白酶也是重要的一类致病因子,脂肪酶、胆固醇酰基转移酶和丝氨酸蛋白酶均属于胞外蛋白酶。胞外蛋白酶可提高病原菌对宿主的侵染能力,或为细菌生长提供营养物质,使得菌株致病性增强(宋明芳等, 2018)。OmpA蛋白作为重要致病因子,具有增强细菌黏附和侵染的作用,可促进细菌在宿主细胞内存活以及逃避宿主免疫防御机制(Confer et al, 2013)。根据毒力基因检测与人工回归感染试验结果,该分离菌MR-I具有多种毒力基因,对导致罗氏沼虾具有较高致死率,患病沼虾出现肢体残损及有黑斑等症状,充分表明豚鼠气单胞菌MR-I对罗氏沼虾具有显著致病性。
3.3 豚鼠气单胞菌的药敏性分析根据本研究结果,豚鼠气单胞菌MR-I对头孢曲松、氯霉素、氟苯尼考、新霉素、强力霉素、庆大霉素、链霉素、恩诺沙星、阿米卡星及复方新诺明10种抗生素敏感,对四环素、环丙沙星、诺氟沙星、乙酰螺旋霉素、羧苄西林、青霉素、头孢噻吩、红霉素、多粘菌素及利福平10种抗生素具有耐药性。这与郭莹等(2020)的试验结果存在一定差异性,郭莹等(2020)的研究表明罗氏沼虾源豚鼠气单胞菌对四环素高度敏感,对新霉素、复方新诺明和链霉素具有耐药性。这可能是养殖地区及用药习惯不同产生不同养殖环境,从而导致不同菌株形成耐药性差异。多数研究证明,水产病原菌耐药性差异性与养殖苗种来源、物种养殖模式、菌株来源、养殖地区不同的用药习惯密切相关(胡大胜, 2010; 丁正峰等, 2011; 邓玉婷等, 2019)。
3.4 豚鼠气单胞菌的防治技术疫苗是治疗病害的有效手段,针对豚鼠气单胞菌的疫苗早有研究。早在1998年,邢维贤等(1998)就成功制备了豚鼠气单胞菌RXY-1灭活疫苗,研究结果表明该灭活疫苗无毒性,经口服和注射途径接种后对鲤鱼的免疫保护率均达到80%以上。魏代民等(2021)制备的豚鼠气单胞菌AC-CY株灭活疫苗,免疫接种后可提高锦鲫免疫力,其免疫保护效率达到77%。宋颖等(2010)以聚乙二醇(PEG)为载体制备的载体疫苗对锦鲫的免疫保护率为80%,比传统灭活疫苗高出26.7%。此外,唐旭等(2006)成功地制备了豚鼠气单胞菌单克隆抗体(AId mAb),这为豚鼠气单胞菌后续的疫苗研制及免疫防控研究奠定了基础。有研究表明,部分中草药和益生菌对豚鼠气单胞菌也具有抑制作用。凌空等(2015)经研究表明乌梅、五味子、五倍子、石榴皮、大黄及槐角等135中草药对豚鼠气单胞菌具有抑菌作用。罗璋等(2010)研究发现枯益生菌草芽孢杆菌对豚鼠气单胞菌具有拮抗作用,其对病原菌的抑制作用随着浓度的升高和培养周期的延长而增强。除此之外,部分抗生素对豚鼠气单胞菌也有着较强的抑菌效果。周冬仁等(2013)用强力霉素对感染豚鼠气单胞菌的泥鳅进行拌喂,并辅以聚维酮碘消毒,5 d后病情便得到有效控制。本研究结果也表明了强力霉素对豚鼠气单胞菌具有抑制作用。但抗生素滥用会导致水产养殖对象产生耐药性,从而引发水产品质量安全问题,并且多种抗生素已经列入禁用或限用范畴。因此,在实际生产中对于豚鼠气单胞菌的防治,建议选用具有抑菌效果的中草药、益生菌等绿色药物。
4 结论本实验通过形态学观察、生理生化特性鉴定、16S rRNA基因检测分析了从患病罗氏沼虾肝胰腺组织中分离得到的MR-I菌株为豚鼠气单胞菌(Aeromonas caviae)。经毒力基因检测检测和人工回归感染试验,豚鼠气单胞菌株MR-I含有aer、lip、gcat、ser和OMPA I等多种毒力基因,具有显著致病性。通过20种常用抗生素药敏性分析,该分离菌株MR-I显示其对头孢曲松等7种抗生素高度敏感,对恩诺沙星等3种抗生素中度敏感,对四环素等10种抗生素具有耐药性。研究结果为罗氏沼虾养殖过程中的病害防控提供了参考依据,并可丰富豚鼠气单胞菌属的基础数据。
丁正峰, 薛晖, 王晓丰, 等, 2011. 江苏主要水产病原菌耐药谱系监测. 江苏农业科学, 39(2): 344-347 DOI:10.3969/j.issn.1002-1302.2011.02.122 |
王玉堂, 陈昌福, 吕永辉, 2013. 水产养殖动物致病菌耐药性检测数据实际作用. 中国水产, (10): 57-61 DOI:10.3969/j.issn.1002-6681.2013.10.029 |
王海娟, 王利, 2014. 鲈鱼豚鼠气单胞菌的鉴定及其药敏试验. 动物医学进展, 35(9): 123-126 DOI:10.3969/j.issn.1007-5038.2014.09.030 |
邓玉婷, 谭爱萍, 张瑞泉, 等, 2019. 广东主要水产养殖地区气单胞菌耐药状况的调查分析. 南方农业学报, 50(11): 2375-2383 DOI:10.3969/j.issn.2095-1191.2019.11.01 |
东秀珠, 蔡妙英, 2001. 常见细菌系统鉴定手册. 北京: 科学出版社, 106-120
|
付乔芳, 邱军强, 胡鲲, 等, 2011. 嗜水气单胞菌国内分离株的毒力因子分布与致病性相关性分析. 生物学杂志, 28(6): 53-57 |
边宇, 钱宏伟, 孟庆峰, 等, 2013. 维氏气单胞菌RCR快速检测方法的建立及初步应用. 中国兽药杂志, 47(1): 1-3 |
邢维贤, 安利国, 傅荣恕, 等, 1998. 豚鼠气单胞菌灭活疫苗的安全性和免疫防治. 山东师大学报(自然科学版), 13(4): 424-427 |
刘小芳, 任燕, 张德锋, 等, 2021. 鱼源气单胞菌的毒力基因检测、分型及致病力. 水产学报, 45(3): 462-471 |
李海丽, 吴彤, 潘国庆, 2013. 赛北紫堇总生物碱LD50的测定. 湖北农业科学, 52(10): 2371-2372, 2379 DOI:10.3969/j.issn.0439-8114.2013.10.037 |
吴同垒, 单晓枫, 孟庆峰, 等, 2011. 维氏气单胞菌研究进展. 中国兽医杂志, 45(7): 41-44 DOI:10.3969/j.issn.0529-6005.2011.07.019 |
吴斌, 2006. 豚鼠气单胞菌快速检测间接ELISA法的建立. 福建水产, (4): 48-51 DOI:10.3969/j.issn.1006-5601.2006.04.012 |
何永龙, 黄锦炉, 乔晶鑫, 等, 2015. 草鱼致病性豚鼠气单胞菌的分离鉴定. 中国预防兽医学报, 37(12): 912-916 DOI:10.3969/j.issn.1008-0589.2015.12.04 |
辛志明, 樊海平, 吴斌, 等, 2009. 豚鼠气单胞菌胶体金免疫层析试纸条的研制. 水产学报, 33(4): 679-684 DOI:10.3321/j.issn:1000-0615.2009.04.020 |
汪开毓, 肖丹, 贺扬, 等, 2012. 南方鲇(Silurus meridionalis)豚鼠气单胞菌溶血素的分离、纯化与致病性研究. 海洋与湖沼, 43(6): 1122-1127 |
宋明芳, 张冬星, 张海鹏, 等, 2018. 维氏气单胞菌毒力因子的研究进展. 中国兽医科学, 48(8): 1038-1042 |
宋路萍, 杨振苹, 王斌, 等, 2020. 基于16S rDNA快速鉴定细菌的PCR测序方法的建立及其进化关系分析. 中国医药科学, 10(17): 86-91 |
宋颖, 关万春, 易鹏, 等, 2010. 豚鼠气单胞菌超声灭活PEG结合疫苗的制备及免疫效果. 浙江农业学报, 22(2): 177-182 |
张海月, 康元环, 陈龙, 等, 2016. 不同动物源性维氏气单胞菌OMPA Ⅰ基因的克隆及比较研究. 中国兽医科学, 46(5): 607-610 |
罗红, 赵永锋, 魏友海, 2022. 罗氏沼虾产业发展现状及面临的主要问题. 科学养鱼, (2): 20-23 |
罗璋, 贾文平, 白晓慧, 等, 2010. 枯草芽孢杆菌对三种水产动物病原菌体外拮抗作用的研究. 中国饲料, (14): 18-19 |
周冬仁, 叶雪平, 罗毅志, 等, 2013. 泥鳅豚鼠气单胞菌病的诊治. 科学养鱼, (9): 66 |
周丽颖, 姜姿妍, 钱且奇, 等, 2022. 中华绒螯蟹病原豚鼠气单胞菌的鉴定及其致病性分析. 淡水渔业, 52(1): 58-65 |
孟令缘, 牛沁雅, 廉鲁昕, 等, 2021. 基于16S rDNA序列、MALDI-TOF-MS和VITEK的沙门氏菌和金黄色葡萄球菌的鉴定. 中国食品学报, 21(10): 197-205 |
胡大胜, 2010. 广西水产养殖主要细菌病的监测与耐药性调查. 中国科技成果, 11(13): 49-51 |
胡天野, 吴同垒, 孟庆峰, 等, 2012. 框镜鲤维氏气单胞菌的生物学特性. 中国兽医杂志, 48(8): 18-21 |
徐卫国, 姚振海, 2018. 罗氏沼虾产业发展策略. 渔业致富指南, (10): 12-15 |
徐洋, 沈锦玉, 姚嘉赟, 等, 2012. 罗氏沼虾主要病害研究概况. 生物学杂志, 29(6): 74-76 |
凌空, 丁诗华, 吴兴镇, 等, 2015. 中草药体外抑杀大鲵致病性豚鼠气单胞菌的药效研究. 水产科学, 34(7): 405-412 |
郭莹, 周淼, 李艳和, 等, 2020. 罗氏沼虾豚鼠气单胞菌的分离鉴定. 中国农学通报, 36(33): 147-153 |
唐旭, 陈瑞, 于辉, 等, 2006. 豚鼠气单胞菌抗独特型单克隆抗体的制备和初步鉴定. 细胞与分子免疫学杂志, 22(5): 644-645 |
黄艺丹, 汪开毓, 郑建, 等, 2010. 鱼类致病性豚鼠气单胞菌单克隆抗体-胶体金检测方法的建立. 水生生物学报, 34(3): 509-516 |
曹海鹏, 温乐夫, 杨移斌, 等, 2014. 克氏原螯虾源致病性豚鼠气单胞菌的分离及其生物学特性. 水生生物学报, 38(6): 1047-1053 |
曾宪凯, 曹海鹏, 穆春华, 2020. 南美白对虾病原性豚鼠气单胞菌的分离与药敏特性. 水产养殖, 41(1): 28-33 |
魏代民, 刘长宇, 张伟, 等, 2021. 锦鲫源豚鼠气单胞菌灭活疫苗的制备及免疫效果评价. 特种经济动植物, 24(11): 3-10 |
BALDISSERA M D, SOUZA C F, JÚNIOR G B, et al, 2017. Aeromonas caviae alters the cytosolic and mitochondrial creatine kinase activities in experimentally infected silver catfish: impairment on renal bioenergetics. Microbial Pathogenesis, 110: 439-443 |
CONFER A W, AYALEW S, 2013. The OmpA family of proteins: roles in bacterial pathogenesis and immunity. Veterinary Microbiology, 163(3/4): 207-222 |
JANDA J M, ABBOTT S L, 2010. The genus Aeromonas: taxonomy, pathogenicity, and infection. Clinical Microbiology Reviews, 23(1): 35-73 |
KITA-TSUKAMOTO K, OYAIZU H, NANBA K, et al, 1993. Phylogenetic relationships of marine bacteria, mainly members of the family Vibrionaceae, determined on the basis of 16S rRNA sequences. International Journal of Systematic Bacteriology, 43(1): 8-19 |
NAWAZ M, KHAN S A, KHAN A A, et al, 2010. Detection and characterization of virulence genes and integrons in Aeromonas veronii isolated from catfish. Food Microbiology, 27(3): 327-331 |
RAN C, QIN C B, XIE M X, et al, 2018. Aeromonas veronii and aerolysin are important for the pathogenesis of motile aeromonad septicemia in cyprinid fish. Environmental Microbiology, 20(9): 3442-3456 |
ZHU Z X, XU T L, DENG S Z, et al, 2017. Isolation, identification and antimicrobial test in vitro of Aeromonas from Hemibarbus maculatus Bleeker. Agricultural Science & Technology, 18(1): 156-160 |
 2023, Vol. 54
2023, Vol. 54


