中国海洋湖沼学会主办。
文章信息
- 黄一倍, 杨求华, 李忠琴, 王丽莉, 李慧耀, 肖益群, 吴建绍, 林琪. 2023.
- HUANG Yi-Bei, YANG Qiu-Hua, LI Zhong-Qin, WANG Li-Li, LI Hui-Yao, XIAO Yi-Qun, WU Jian-Shao, LIN Qi. 2023.
- 仿刺参(Apostichopus japonicus)肠道源乳酸乳球菌(Lactococcus lactis)的分离鉴定及其益生特性分析
- ISOLATION AND IDENTIFICATION OF LACTOCOCCUS LACTIS FROM THE INTESTINAL TRACT OF SEA CUCUMBER (APOSTICHOPUS JAPONICUS) AND ITS PROBIOTIC PROPERTIES IN VITRO
- 海洋与湖沼, 54(3): 875-884
- Oceanologia et Limnologia Sinica, 54(3): 875-884.
- http://dx.doi.org/10.11693/hyhz20221000260
文章历史
-
收稿日期:2022-10-14
收修改稿日期:2022-12-04
2. 福建省水产研究所 福建省海洋生物增养殖与高值化利用重点实验室 福建厦门 361013;
3. 集美大学水产学院 福建厦门 361021
2. Fisheries Research Institute of Fujian Province, Key Laboratory of Cultivation and High-value Utilization of Marine Organisms in Fujian, Xiamen 361013, China;
3. Fisheries College of Jimei University, Xiamen 361021, China
仿刺参(Apostichopus japonicus), 又名刺参, 隶属于棘皮动物门、海参纲、辛那参目、刺参科、仿刺参属, 因其含有较高的营养和食用价值, 深受广大消费者的喜爱(Xu et al, 2018; Liu et al, 2022)。仿刺参是我国重要的经济海水品种, 自2003年开展“北参南养”试验以来, 海参(仿刺参)养殖在南方取得蓬勃发展, 福建省已成为我国南方重要的海参养殖产区, 但北参南养过程中的海参疾病也时常困扰其养殖业的发展。研究表明, 灿烂弧菌(Vibrio splendidus)、假交替单胞菌(Pseudomonas sp.)、塔式弧菌(V. tubiashii)、哈维氏弧菌(V. harveyi)和伯麦罗氏弧菌(V. pomeroyi)等细菌是南移仿刺参养殖过程中的常见病原菌(葛辉等, 2012; 方旅平等, 2014; 杨求华等, 2014)。在传统的细菌性疾病防治中, 常采用化学类药物和抗生素类药物治疗, 但药物的频繁使用所带来的负面影响已引起众多学者的关注, 如抗生素的过度使用不仅破坏水体环境、造成宿主肠道菌群紊乱, 而且容易产生耐药菌(方旅平等, 2014)。随着食品质量安全越来越受关注, 研发人员纷纷致力于抗生素替代物的开发, 其中益生菌制剂因其副作用少、无残留等特点而成为研究热点(Subedi et al, 2020; Wang et al, 2021)。研究发现, 从健康宿主体内分离的宿主源益生菌, 能够调节宿主肠道内菌群平衡, 促进宿主生长, 提高宿主免疫力, 从而达到预防相关疾病的效果, 在水产养殖中备受重视(刘敏等, 2003)。
乳酸菌(lactic acid bacteria, LAB), 是一类能够利用碳水化合物发酵, 且代谢产物主要为乳酸的一类革兰氏阳性菌统称(Yang et al, 2019), 其广泛存在于健康的鱼类和虾蟹类肠道中(Mohapatra et al, 2012; Nordin et al, 2013)。乳酸菌不仅可以调节动物肠道菌群平衡、改善肠道功能, 促进动物健康生长, 同时能降低动物肠道pH, 提升消化酶活性, 从而提高饲料利用率(王芳芳等, 2016)。此外, 乳酸菌代谢过程中产生的各种活性物质, 可以增强宿主免疫, 提高抗病能力(Yang et al, 2019)。目前, 水产养殖中常见的乳酸菌包括有: 肠膜明串珠菌(Leuconostoc mesenteroides)、鼠李糖乳杆菌(Lactobacillus rhamnosus)、粪肠球菌(Enterococcus faecalis)、植物乳杆菌(L. plantarum)、戊糖片球菌(Pediococcus pentosaceus)和乳酸乳球菌(Lactococcus lactis)等(Huang et al, 2013; 刘君等, 2015; Alonso et al, 2019; 徐国辉等, 2020; 李祎等, 2021)。
本研究利用选择性培养基从健康的养殖仿刺参肠道中分离乳酸菌, 采用病原拮抗法获得对仿刺参病原菌具有拮抗作用的候选益生菌株, 综合形态特征、生理生化和16S rRNA序列分析特征进行鉴定, 并探索其培养条件, 以及对模拟人工胃液和肠液的耐受性、药物敏感性、抑菌特性、菌株表面疏水性与自聚率和体外抗氧化能力等益生特性, 以期为仿刺参源肠道益生菌的开发应用提供理论依据。
1 材料与方法 1.1 实验材料实验用仿刺参取自福建霞浦海上吊笼养殖基地, 选择体色正常、体质健壮、体表无损伤, 平均体质量(171.6±16.6) g的个体用于肠道菌株的培养分离。
1.2 乳酸菌的分离纯化无菌条件下取出仿刺参肠道, 去除肠道内容物, 将肠壁置于无菌试管中, 加入无菌生理盐水, 充分研磨, 用无菌生理盐水对样品按10–1~10–5梯度稀释, 每个梯度取100 μL研磨液在选择性培养基(MRS)上涂布, 置于生化培养箱30 ℃培养48 h, 观察菌落形态, 挑取典型优势菌落纯化培养2~3次, 将纯化后的菌落接种于LB培养基上, 挑选单菌落用30%甘油生理盐水保存于–80 ℃冰箱, 备用。
1.3 分离菌株对病原菌的拮抗性分析为了评价筛选菌株对病原菌是否具有拮抗作用, 以仿刺参病原菌灿烂弧菌(Vibrio splendidus)、副溶血弧菌、塔氏弧菌、哈维氏弧菌、伯麦罗氏弧菌(V. pomeroyi), 以及水产病原菌迟缓爱德华氏菌(Edwardsiella tarda, Et)、嗜水气单胞菌、溶藻弧菌(V. alginolyticus)、创伤弧菌(V. vulnificus)等为指示菌, 采用牛津杯法筛选分离菌株对病原菌的拮抗性(杜佗等, 2017)。指示菌采用LB肉汤在30 ℃条件下培养16 h后, 取100 μL均匀涂布于LB固体平板上, 随后插入牛津杯, 待30 ℃培养2 h后, 往牛津杯孔中加入100 μL用MRS液体培养基在30 ℃条件下培养16 h的候选菌株菌液, 以无菌MRS培养基作为对照, 30 ℃培养24 h后观察抑菌圈, 并测量抑菌圈的直径。
1.4 菌株鉴定 1.4.1 菌株和菌落形态观察将1.3中保存的候选菌株分别接种于MRS和LB平板上, 30 ℃恒温培养24 h后, 观察菌落形态, 采用扫描电子显微镜观察菌株个体形态。
1.4.2 菌株生理生化特性分析参考《伯杰氏鉴定细菌学手册》(Buchanan et al, 1994)和《常见细菌系统鉴定手册》(东秀珠等, 2001)等文献, 并结合梅里埃VITEK 2 Compact全自动细菌鉴定及药敏分析系统分析候选菌株的生理生化特性。
1.4.3 16S rRNA序列分析以候选菌株DNA为模板, 参考文献(Lane, 1991)设计16S rRNA通用引物27F (5′-AGAGTTTGATCCTGGCTCAG-3′), 1492R (5′-ACGGCTACCTTGTT ACGACTT-3′)进行PCR扩增。PCR扩增产物经1%琼脂糖凝胶电泳检测后, 送至厦门铂瑞生物科技有限公司测序, 采用BLAST在NCBI数据库中在线比对, 下载相似序列采用MEGA 5.0软件Neighbour-Joining方法构建系统进化树(bootstrap=1000)。
1.5 候选菌株培养条件优化 1.5.1 菌株生长曲线绘制取活化后的菌株按5%的接种量接种至50 mL的LB肉汤中, 30 ℃ 180 r/min摇床培养, 每隔8 h取样测定OD600值, 每次3个生物学重复, 绘制生长曲线图。
1.5.2 不同温度对菌株生长的影响用生理盐水将菌液稀释成浓度为1×108 CFU/mL, 分别以2%的接种量接种于LB液体培养基后分别置于18 ℃、25 ℃、30 ℃、37 ℃, 恒温培养24 h, 随后测定菌液OD600值。
1.5.3 不同pH对菌株生长的影响用无菌HCl和NaOH调节LB液体培养基pH至pH 5.5、pH 6.0、pH 6.5、pH 7.0、pH 7.5、pH 8.0, 接种培养24 h, 测定各组菌液的OD600值。
1.5.4 对人工胃、肠液的耐受性参照文献(丁诗瑶等, 2021)配置人工胃液和人工肠液, 将浓度为1×108 CFU/mL的菌悬液按照10%的接种量接种于模拟胃液培养基中, 设置0.9%生理盐水为对照组, 30 ℃摇床培养(180 r/min), 在培养0 h、1 h、2 h、3 h后以无菌生理盐水按1︰9梯度稀释, 进行平板菌落计数, 每个稀释度3个重复。以0 h的活菌数作对照, 计算每个处理条件下的存活率。
1.6 药物敏感性参照文献(李忠琴等, 2017)采用纸片扩散法检测候选菌株对10种常用抗菌药物的敏感性。采用微量肉汤稀释法测定候选菌株对8种可用药物的最小抑菌浓度(MIC)值。
1.7 候选菌株益生特性分析 1.7.1 表面疏水性和自聚率疏水性: 将过夜培养的菌悬液用无菌PBS洗涤两次, 调节OD600值为0.5±0.02, 加入2 mL二甲苯或氯仿, 涡旋混匀1 min; 37 ℃静置共培养2 h; 两相分层后取水相, 于600 nm处测定吸光度值并计算菌株疏水率。
自聚率: 将过夜培养的菌悬液用无菌PBS洗涤两次, 调节OD600值为0.5±0.02, 取4 mL菌悬液于37 ℃静置放置2 h; 取上层液体于600 nm处测定吸光度值并计算菌株自聚率。
1.7.2 体外抗氧化能力分析DPPH自由基清除能力检测: 参照文献(黄元霞等, 2020)取益生菌细胞悬浮液2 mL (无细胞提取物2 mL), 加入1 mL 0.2 mmol/L的DPPH·无水乙醇溶液, 摇匀, 避光反应30 min, 9 000 r/min离心10 min, 取上清液于517 nm处测定吸光度值并计算DPPH自由基清除率。
羟基自由基清除能力的检测: 参照文献(黄元霞等, 2020)在2 mL待测菌液中加入1 mL 5 mmol/L硫酸亚铁(FeSO4)溶液, 1 mL 5 mmol/L水杨酸乙醇液, 1 mL 3 mmol/L过氧化氢溶液, 用超纯水补至10 mL, 37 ℃, 水浴15 min, 9 000 r/min, 离心10 min, 取上清在510 nm处测定吸光度值并计算羟基自由基清除率。
超氧阴离子清除能力的检测: 参照文献(黄元霞等, 2020)取待测菌液1 mL, 加入pH 8.0的Tris-HCl缓冲液4.5 mL, 邻苯三酚0.4 mL, 混匀后在25 ℃水浴中静置10 min, 并用1滴盐酸终止反应, 之后在325 nm处测定吸光度值, 并计算超氧阴离子清除率。
1.8 数据统计与分析实验数据用SPSS软件进行差异显著性分析, 用Microsoft Excel软件和Origin 8.0软件作图并进行分析。
2 结果 2.1 菌株AJC-XP-15的分离与鉴定 2.1.1 菌落及菌株形态采用MRS选择性培养基从南移养殖的仿刺参肠道壁中分离得到1株优势菌株, 命名为AJC-XP-15。经30 ℃恒温培养24 h后, 菌株AJC-XP-15在MRS培养基上形成表面光滑、边缘整齐的微黄色圆形菌落, 单菌落直径1~2 mm; 在LB培养基上形成中央隆起、表面光滑、湿润、边缘整齐的白色圆形不透明菌落, 菌落直径1~2 mm (图 1a)。扫描电镜观察显示, 该菌株呈多个排布, 近圆球状, 菌体大小约为(1.7~1.9)×(1.4~1.8) μm (图 1b)。
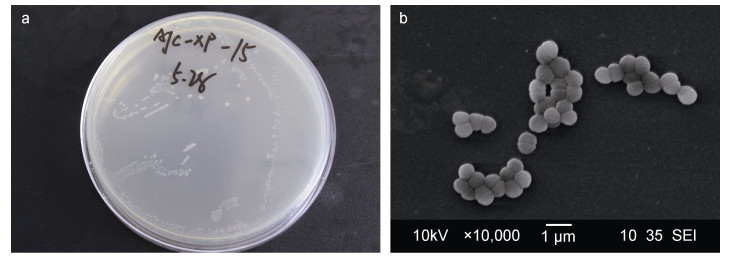 |
| 图 1 菌株AJC-XP-15的菌落形态(a)和扫描电镜图(b) Fig. 1 The colony morphology of pathogenic strain AJC-XP-15 (a) and the image of scanning electron microscopy (b) |
菌株AJC-XP-15在D-苦杏仁甙、亮氨酸芳胺酶、丙氨酸芳胺酶、D-核糖、新生霉素耐药、奥普托欣耐药、6.5% NaCl中生长、D-海藻糖、多粘菌素B耐药、杆菌肽耐药试验等指标中呈现为阳性, 在D-棉子糖、L-乳酸盐碱化、磷脂酰肌醇磷脂酶C、β-半乳糖苷酶、乳糖、D-甘露醇、尿素酶、磷酸酶、支链淀粉试验等指标中呈现为阴性(表 1)。采用梅里埃VITEK 2 Compact全自动细菌鉴定系统分析, 鉴定菌株AJC-XP-15为乳酸乳球菌(Lactococcus lactis), 鉴定可能性为86%。
| 指标 | 结果 | 指标 | 结果 | |
| D-苦杏仁甙 | + | D-甘露醇 | - | |
| 亮氨酸芳胺酶 | + | 水杨素 | + | |
| 丙氨酸芳胺酶 | + | α-半乳糖苷酶 | - | |
| D-核糖 | + | 尿素酶 | - | |
| 新生霉素耐药 | + | D-甘露糖 | + | |
| D-棉子糖 | - | 蔗糖 | + | |
| 奥普托欣耐药 | + | α-甘露糖苷酶 | - | |
| 环糊精 | + | D-麦芽糖 | + | |
| L-脯氨酸芳胺酶 | - | D-海藻糖 | + | |
| 酪氨酸芳胺酶 | (-) | α-葡糖苷酶 | - | |
| L-乳酸盐碱化 | - | 磷酸酶 | - | |
| D-木糖 | + | β-葡萄糖醛酸酶 | - | |
| D-山梨醇 | + | D-半乳糖 | + | |
| 乳糖 | - | 支链淀粉 | - | |
| L-天冬氨酸芳胺酶 | - | L-吡咯烷酮芳胺酶 | - | |
| 在6.5% NaCl中生长 | + | N-乙酰-D-氨基葡萄糖 | + | |
| 磷脂酰肌醇磷脂酶C | - | 甲基-B-D-吡喃葡萄糖苷 | + | |
| 精氨酸双水解酶2 | + | 精氨酸双水解酶1 | + | |
| 多粘菌素B耐药 | + | β-半乳糖吡喃糖苷酶 | - | |
| 丙氨酸-苯丙氨酸-脯氨酸芳胺酶 | + | 杆菌肽耐药 | + | |
| 注: 结果中“+”表示反应为阳性, “-”表示反应为阴性, “(-)”表示反应为弱阴性 | ||||
经PCR扩增获得片段长度为1 452 bp的菌株AJC-XP-15 16S rRNA序列, 通过GenBank数据库比对分析, 菌株AJC-XP-15与乳酸乳球菌Lactococcus lactis NBRC 100933 (序列登录号NR 113960.1)的相似度最高, 为98.8%。从GenBank数据库中下载其他菌株16S rRNA相关序列, 利用MEGA 5.0软件采用N-J法构建系统发育进化树, 菌株AJC-XP-15与同为乳球菌属的乳酸乳球菌聚为一支(图 2)。
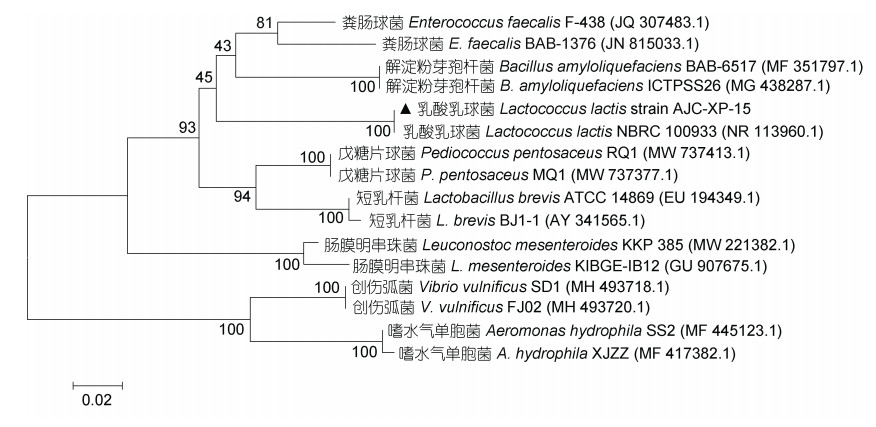 |
| 图 2 NJ法构建菌株AJC-XP-15的16S rRNA序列系统发育树 Fig. 2 Phylogenetic tree of 16S rRNA gene sequence of strain AJC-XP-15 constructed by neighbor-joining method 注: 图中线段0.02代表进化距离, 括号中序号为GenBank登录号 |
菌株AJC-XP-15对仿刺参病原菌哈维氏弧菌和塔氏弧菌具有较好的拮抗作用, 其抑菌圈直径大小分别为(19.67±0.57) mm和(17.67±1.15) mm (图 3)。菌株AJC-XP-15对常见病原菌无乳链球菌(Streptococcus agalactiae)、大肠杆菌(Escherichia coli)、嗜水气单胞菌、金黄色葡萄球菌(Staphylococcus aureus)、副溶血弧菌和河流弧菌(V. fluvialis)等均有拮抗抑制作用, 其中对副溶血弧菌的抑制作用最明显; 菌株AJC-XP-15发酵上清液对大肠杆菌、嗜水气单胞菌、金黄色葡萄球菌、副溶血弧菌等病原菌具有抑制性, 其中对副溶血弧菌的抑制作用最明显(表 2)。
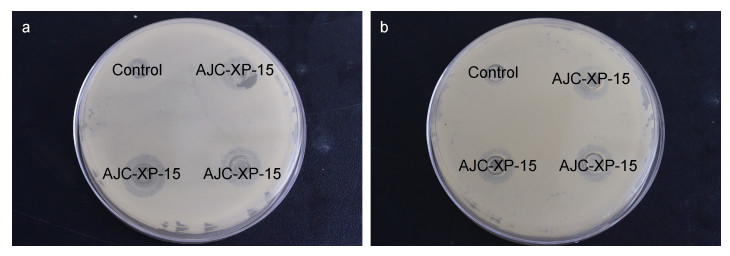 |
| 图 3 菌株AJC-XP-15对哈维氏弧菌(a)和塔氏弧菌(b)的拮抗效果 Fig. 3 The antagonistic effect of strain AJC-XP-15 on pathogenic bacteria V. harveyi (a) and V. tubiashii (b) |
| 病原菌 | 菌体抑菌性 | 发酵上清液 |
| 无乳链球菌S. agalactiae | + | ND |
| 大肠杆菌E. coli | ++ | ++ |
| 迟缓爱德华氏菌E. tarda | ND | ND |
| 嗜水气单胞菌A. hydrophila | ++ | ++ |
| 金黄色葡萄球菌S. aureus | ++ | ++ |
| 溶藻弧菌V. alginolyticus | ND | ND |
| 副溶血弧菌V. parahaemolyticus | +++ | ++ |
| 河流弧菌V. fluvialis | ++ | ND |
| 创伤弧菌V. vulnificus | ND | ND |
| 铜绿假单胞菌P. aeruginosa | ND | ND |
| 注: ND: 没有拮抗性; +: 抑菌圈< 10 mm; ++: 抑菌圈10~14 mm; +++: 抑菌圈> 15 mm | ||
菌株AJC-XP-15的生长曲线如图 3所示, 在0~8 h菌体缓慢生长, 为迟缓期; 8 h后可以看到菌液OD值迅速上升, 进入对数生长期; 接种后0~24 h时迅速生长, 菌体浓度迅速升高, 24~32 h增长逐渐变缓, 进入稳定期, 32 h后OD值逐渐减小, 进入衰退期(图 4)。
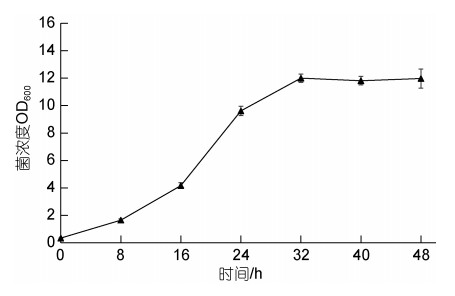 |
| 图 4 菌株AJC-XP-15生长曲线 Fig. 4 The growth curve of strain AJC-XP-15 |
在不同温度(18 ℃、25 ℃、30 ℃、37 ℃)条件下, 随着温度的上升, 菌株AJC-XP-15的菌体生物量呈先上升后下降的趋势, 其中在温度为30 ℃时, 菌株生长量最大, 此时菌株OD600值为14.14 (图 5)。
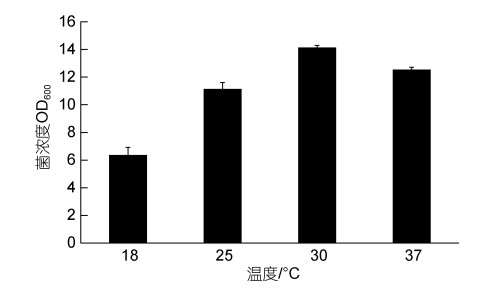 |
| 图 5 不同温度对菌株AJC-XP-15生长的影响 Fig. 5 Effect of temperature on the growth of strain AJC-XP-15 |
在不同pH (5.5、6.0、6.5、7.0、7.5、8.0)条件下, 随着pH的上升, 菌株AJC-XP-15的菌体生物量也呈先上升后下降趋势, 在pH 7时, 菌株生长量最大, 此时菌株OD600值为14.66 (图 6)。因此, 菌株AJC-XP-15在温度为30 ℃、pH 6.5条件下的生长情况较好。
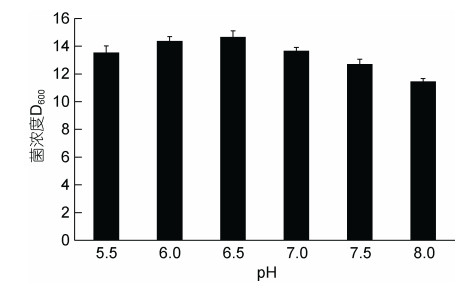 |
| 图 6 不同pH对菌株AJC-XP-15生长的影响 Fig. 6 Effect of pH on the growth of strain AJC-XP-15 |
模拟人工胃液、肠液的耐受性分析结果如表 3所示。在pH 3.0的模拟人工胃液环境下, 菌株AJC-XP-15的存活率随着处理时间的增加, 其存活率逐渐降低, 在处理3 h后, 存活率为71.43%, 显示出较强的耐受能力; 而在pH 6.8的模拟人工肠液环境下, 菌株AJC-XP-15在处理3 h后的存活率仍为92.1%, 耐受性强。
| 处理组 | 菌株AJC-XP-15在不同时间的存活率/% | ||
| 1 h | 2 h | 3 h | |
| 模拟人工胃液 | 98.1±0.39 | 95.7±0.78 | 71.4±1.25 |
| 模拟人工肠液 | 94.3±1.13 | 93.2±3.14 | 92.1±0.61 |
| 抗菌药物 | 药物含量/μg | 抑菌圈直径/mm | 最小抑菌浓度/(μg/mL) | 敏感性 |
| 四环素 | 30 | 28 | — | S |
| 红霉素 | 15 | 0 | — | R |
| 诺氟沙星 | 10 | 24 | — | S |
| 复方新诺明 | 23.75/1.25 | 0 | — | R |
| 呋喃唑酮 | 300 | 22 | — | S |
| 庆大霉素 | 10 | 6 | — | R |
| 青霉素G | 10 | 12 | — | R |
| 氯霉素 | 30 | 24 | — | S |
| 氨苄青霉素 | 100 | 12 | — | R |
| 链霉素 | 10 | 26 | — | S |
| 恩诺沙星 | — | — | 0.5 | S |
| 硫酸新霉素 | — | — | < 0.125 | ND |
| 甲砜霉素 | — | — | 4 | ND |
| 氟苯尼考 | — | — | 8 | R |
| 盐酸多西环素 | — | — | < 0.06 | S |
| 氟甲喹 | — | — | 64 | ND |
| 磺胺间甲氧嘧啶钠 | — | — | 64 | I |
| 磺胺甲恶唑+ 甲氧苄啶 | — | — | < 304/16 | R |
| 注: R: 耐药; I: 中度敏感; S: 敏感; ND: 无耐药临界值 | ||||
菌株AJC-XP-15对四环素、诺氟沙星、呋喃唑酮、链霉素、氯霉素等5种药物敏感, 对红霉素、复方新诺明、庆大霉素、青霉素G、氨苄青霉素等5种药物表现耐受; 最小抑菌浓度(MIC值)测定结果显示, 恩诺沙星、硫酸新霉素、甲砜霉素、氟苯尼考、盐酸多西环素、氟甲喹、磺胺间甲嘧啶钠、磺胺甲恶唑+甲氧苄啶等8种药物对菌株AJC-XP-15的MIC值分别为0.5、0.125、4、8、0.06、64、64、304/16 μg/mL。
2.5 菌株AJC-XP-15的益生特性分析 2.5.1 表面疏水率与自聚率菌株AJC-XP-15的表面疏水率为34.56%, 菌株自聚率为35.61%, 均高于其他测定菌株(表 5)。
| 指标 | AJC-XP-15 |
| 疏水率/% | 34.56±2.93 |
| 自聚率/% | 35.61±3.23 |
如图 7所示, 菌株AJC-XP-15三种处理方式后, 其无细胞提取物对DPPH的清除率最强、菌悬液次之, 而发酵上清液最低, 三者对DPPH的清除率分别为(82.67±6.92)%、(48.33±5.28)%、(18.33±4.32)%。
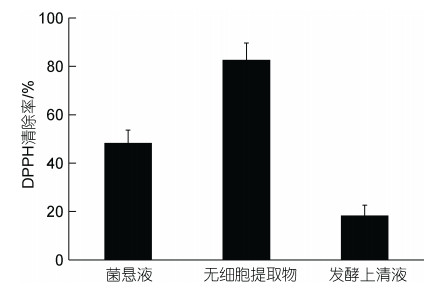 |
| 图 7 菌株AJC-XP-15对DPPH自由基的清除率 Fig. 7 The activity of DPPH radical scavenging of strain AJC-XP-15 |
如图 8所示, 菌株AJC-XP-15无细胞提取物对羟自由基的清除能力最强, 为(15.36±2.95)%, 其次为菌悬液的(12.82± 1.56)%, 最弱的是发酵上清液, 为(8.18±2.02)%。
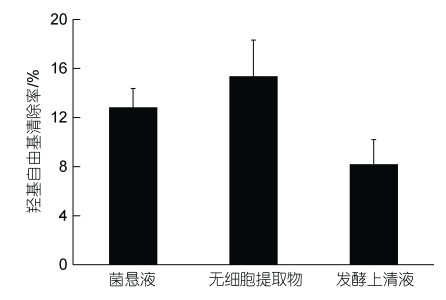 |
| 图 8 菌株AJC-XP-15对羟基自由基的清除率 Fig. 8 The activity of hydroxyl radical scavenging of strain AJC-XP-15 |
如图 9所示, 菌株AJC-XP-15的菌悬液(8.73±1.32)%、无细胞提取物(12.64±2.56)%、发酵上清液(26.36±2.58)%对超氧阴离子的清除能力依次增强, 其中发酵上清液表现出最强的超氧阴离子清除能力。
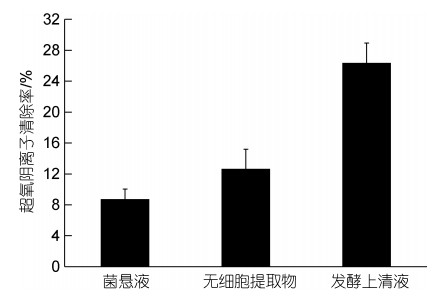 |
| 图 9 菌株AJC-XP-15对超氧阴离子的清除率 Fig. 9 The activity of superoxide anion scavenging of strain AJC-XP-15 |
乳酸菌是公认的益生菌, 不仅具有改善消化道微环境、提高宿主免疫力作用, 还能抑制病原微生物的生长。研究发现, 益生菌乳酸片球菌M7能够通过产生乳酸对铜绿假单胞菌产生抑制作用(Kiymaci et al, 2018)。乳酸乳球菌是乳酸菌中一个典型模式菌株, 在人和动物的肠道中发挥着重要的生理功能, 是公认的安全级微生物(generally recognized as safe, GRAS) (Liu et al, 2005; 刘淑杰等, 2021), 被广泛应用于水产养殖、畜牧养殖, 及食用制品的生产。乳酸菌通过分泌乳酸和乙酸等有机酸, 产生细菌素或者产生过氧化氢(H2O2)等物质来抑制病原菌的生长(Vázquez et al, 2005; Campos et al, 2006; Sugita et al, 2007)。刘君等(2015)采用病原拮抗筛选法, 以嗜水气单胞菌、副溶血弧菌、溶藻弧菌等水产常见病原菌为指示菌, 筛选得到包括乳酸乳球菌、戊糖片球菌和格氏乳球菌等11种不同的乳酸菌菌株。本研究发现, 采用MRS选择性培养基从健康仿刺参肠道分离获得的乳酸乳球菌AJC-XP-15对无乳链球菌、大肠杆菌、嗜水气单胞菌、金黄色葡萄球菌、副溶血弧菌、河流弧菌等几种条件病原菌均有一定的抑制作用, 菌株AJC-XP-15发酵上清液对大肠杆菌、嗜水气单胞菌、金黄色葡萄球菌、副溶血弧菌等病原菌具有抑制作用, 表明该菌株对能够针对性抑制导致仿刺参病害的主要病原菌, 具有作为仿刺参病害生态防控制剂的潜质。综合菌落形态、生理生化和16S rRNA序列分析特征鉴定菌株AJC-XP-15为乳酸乳球菌。
由于环境中的pH、温度和盐度对细菌生长具有显著影响, 乳酸菌在消化道中的生长也与菌株对温度、pH和盐度等环境因素的耐受能力有关。分离到的菌株AJC-XP-15的最适培养温度为30 ℃, 在15 ℃生长速率虽有所下降, 但仍可正常生长; 仿刺参为变温动物, 成年仿刺参生长的适宜水温在18~20 ℃, 分离菌株AJC-XP-15在20 ℃下仍能保持较好的生长, 因此适合在海参养殖中应用。研究表明, 仿刺参的适宜pH范围为7.8~8.7之间, 当pH值低于6.0或高于9.0时, 仿刺参收缩呈球状濒于死亡(郭成秀等, 2010; 李明等, 2016), 本研究表明, 菌株AJC-XP-15在pH为5.5~7.5的范围内, 均能保持较好的生长, 其中最适宜生长pH值为7.0, 因此可以在仿刺参健康养殖中应用。益生菌是否耐酸也是筛选标准之一, 筛选出的益生菌将用于动物体, 就要面临各种体内环境, 能否在肠道中存活也是筛选标准。菌株AJC-XP-15在pH 3.0的模拟人工胃液中存活率随处理时间增加而降低, 处理3 h后, 其存活率为71.43%; 而在pH 6.8的模拟人工肠液经过3 h, 菌株存活率仍达到92.10%, 表现出了较好的耐受性能。
研究表明, 细菌的表面疏水性会影响其与肠道粘膜表面受体结合, 疏水性高的菌株通常与黏膜细胞有较强的黏附性(Kwak et al, 2016; 于小番等, 2017)。乳酸菌的疏水性存在显著差异, 占萌等(2018)在15株受试乳酸菌中, 耐久肠球菌KLDS6.0933的表面疏水性最高, 为30.00%, 而嗜酸乳杆菌KLDS1.0902的疏水性仅为1.07%。在本研究中, 乳酸乳球菌AJC-XP-15的疏水性为34.56%, 略高于耐久肠球菌KLDS6.0933 (占萌等, 2018), 但低于保加利亚乳杆菌的43.57% (黄晓棠, 2020)。此外, 在本研究中乳酸乳球菌AJC-XP-15的自聚率为35.61%, 低于文献报道中植物乳杆菌72.04%的自凝率。
近年来, 随着耐药菌的出现, 对耐药菌的研究和解决方法受到越来越多的关注。长期以来细菌耐药性和耐药基因的研究多集中在病原菌上, 对益生菌的耐药性研究相对较少。本研究对菌株AJC-XP-15的药敏结果显示, 菌株AJC-XP-15对红霉素、复方新诺明、庆大霉素、青霉素G和氨苄青霉素等5种药物表现为耐药。草鱼源乳酸乳球菌CR1和CR2的药敏结果发现, CR1对四环素、氯霉素、青霉素、阿莫西林、哌拉西林、头孢他啶和头孢哌酮敏感, 对恩诺沙星中度敏感, 对丁胺卡那耐药; CR2对四环素、氯霉素、青霉素、哌拉西林和头孢哌酮敏感, 对阿莫西林中度敏感, 对恩诺沙星、头孢他啶和丁胺卡那耐药(肖俊等, 2022), 这可能与不同的养殖生长环境以及不同的抗生素使用等因素有关, 本研究结果反映了养殖仿刺参肠道中乳酸菌的药物耐受性情况, 也为乳酸菌应用于水产养殖提供理论参考。
DPPH是一种以氮为中心的稳定自由基, 能够吸引电子或氢自由基的单电子, 形成稳定的抗磁分子; 羟基自由基对机体有很强的损伤作用, 大量存在的情况下可对机体DNA、蛋白质和脂质发生损伤, 引发一系列疾病; 正常情况下的一定量的超氧阴离子不会对宿主造成损伤, 但一旦机体处于氧化应激状态时, 超氧阴离子会与羟基发生结合, 引发宿主出现DNA损伤, 并导致疾病的发生(Sridhar et al, 2019)。菌株清除羟基自由基的活性物质主要是菌体细胞及胞内物质, 而清除DPPH和超氧阴离子自由基主要是乳酸菌的代谢产物(张开屏等, 2021)。本研究中, 菌株AJC-XP-15对DPPH自由基清除能力最强, 其次是羟基自由基、超氧阴离子自由基; 菌株AJC-XP-15三种处理方式后的抗氧化活性, 无细胞提取物对DPPH自由基清除率(82.67±6.92)%最高, 菌悬液(48.33±5.28)%, 发酵上清液(18.33±4.32)%; 羟基自由基中, 无细胞提取物(15.36±2.95)%, 菌悬液(12.82±1.56)%, 发酵上清液(8.18±2.02)%; 而发酵上清液对超氧阴离子的清除能力最强, 最弱是菌悬液。益生菌的抗氧化能力差别较大, 既具有种属特异性, 又有菌株特异性; 在40株不同受试益生菌中, 乳酸乳球菌清除自由基能力最强, 其次是嗜热链球菌, 乳杆菌和双歧杆菌最弱(白明等, 2009)。
4 结论乳酸乳球菌AJC-XP-15是一株分离自仿刺参肠道的乳酸菌株, 具有较好的病原拮抗性、人工胃肠耐受性和抗氧化活性。其最适生长温度为30 ℃, 最适生长pH为6.5; 表面疏水性和自聚率分别为34.56%和35.61%; 在模拟人工胃液和模拟人工肠液处理3 h后的成活率分别为71.43%和92.1%; 是一种较好的候选益生菌种, 可用于益生菌制剂的研制应用于海参养殖。
丁诗瑶, 雷文平, 刘成国, 等, 2021. 不同来源植物乳杆菌的益生特性研究. 中国乳品工业, 49(1): 20-24 |
于小番, 陈忠琴, 党欣桐, 等, 2017. 3株乳杆菌表面疏水性及凝聚性研究. 安徽农业科学, 45(22): 55-57 DOI:10.3969/j.issn.0517-6611.2017.22.018 |
王芳芳, 刁华杰, 夏九龙, 等, 2016. 乳酸菌及其发酵饲料在动物生产中的应用. 饲料研究, (1): 15-19 |
方旅平, 周宸, 黄瑞芳, 等, 2014. 度夏仿刺参病原菌伯麦罗氏弧菌的分离鉴定和特征研究. 厦门大学学报(自然科学版), 53(2): 273-282 |
东秀珠, 蔡妙英, 2001. 常见细菌系统鉴定手册. 北京: 科学出版社, 114-116
|
占萌, 李柏良, 王成凤, 等, 2018. 15株乳酸菌的表面性质及其黏附能力. 食品工业科技, 39(24): 122-127 |
白明, 孟祥晨, 2009. 益生菌抗氧化活性及菌体抗氧化相关成分的分析. 食品与发酵工业, 35(5): 6-11 |
刘君, 林俊芳, 郭丽琼, 等, 2015. 水产源乳酸菌的多样性及抑菌活性研究. 水产科学, 34(6): 351-357 |
刘敏, 韩英, 马旭洲, 等, 2003. 益生菌制剂在水产动物疾病防治应用的研究进展. 水产学杂志, (1): 73-79 |
刘淑杰, 陶新, 邓波, 等, 2021. 表达猪表皮生长因子重组乳酸乳球菌的构建及其对结肠炎模型小鼠肠道损伤的修复作用. 动物营养学报, 33(4): 2253-2262 |
杜佗, 李彬, 王印庚, 等, 2017. 刺参(Apostichopus japonicus)大水面养殖池塘环境中优势益生菌筛选及其特性分析. 渔业科学进展, 38(3): 180-187 |
李明, 张思, 张建清, 等, 2016. 温度、盐度和pH对仿刺参体腔细胞活性氧产生的影响. 水产科学, 35(4): 346-351 |
李忠琴, 张坤, 林茂, 等, 2017. 大黄鱼(Pseudosciaena crocea)致病性维氏气单胞菌的分离鉴定与药敏特性研究. 海洋与湖沼, 48(1): 139-147 |
李祎, 吴晓敏, 杜航, 等, 2021. 一株肠膜明串珠菌的分离鉴定及其抑菌特性. 微生物学通报, 48(12): 4776-4788 |
杨求华, 葛辉, 方旅平, 等, 2014. 池塘养殖刺参病原菌塔式弧菌的分离与鉴定. 南方水产科学, 10(4): 45-51 |
肖俊, 张桂芳, 李艳芳, 等, 2022. 草鱼肠道乳酸菌的分离鉴定及适用性能评价. 湖南农业科学, (4): 65-69 |
张开屏, 赵艳红, 李权威, 等, 2021. 乳酸菌抗氧化特性及其KatA基因分析. 中国食品学报, 21(7): 37-43 |
徐国辉, 周顺, 郭广鑫, 等, 2020. 一株鱼源乳酸菌的分离鉴定及其生物学特性. 青岛农业大学学报(自然科学版), 37(3): 219-224 |
郭成秀, 张士华, 刘志国, 2010. 黄河三角洲地区刺参养殖池塘pH值的作用及调节措施. 齐鲁渔业, 27(1): 23 |
黄元霞, 彭传海, 丁宁, 等, 2020. 一种三联乳酸菌的体外降胆固醇和抗氧化能力研究. 生物技术通报, 36(12): 113-120 |
黄晓棠, 2020. 5株乳酸菌分离株的安全性及益生特性研究[D]. 保定: 河北农业大学: 38.
|
葛辉, 何丽斌, 林琪, 等, 2012. 福建海区网箱养殖刺参"腐皮综合症"病原分析与鉴定. 福建水产, 34(2): 105-110 |
ALONSO S, CASTRO M C, BERDASCO M, et al, 2019. Isolation and partial characterization of lactic acid bacteria from the gut microbiota of marine fishes for potential application as probiotics in aquaculture. Probiotics and Antimicrobial Proteins, 11(2): 569-579 |
BUCHANAN B E, BERGEY N E, 1994. Manual of Common Determinative Bacteriology. 9th ed. USA Baltimore: Williams & Wilkins Co, 597-635
|
CAMPOS C A, RODRÍGUEZ Ó, CALO-MATA P, et al, 2006. Preliminary characterization of bacteriocins from Lactococcus lactis, Enterococcus faecium and Enterococcus mundtii strains isolated from turbot (Psetta maxima). Food Research International, 39(3): 356-364 |
HUANG J B, CHI S C, 2013. Evaluation of Pediococcus pentosaceus strain 4012 as a probiotic in orange-spotted grouper (Epinephelus coioides) against Vibrio anguillarum. Fish & Shellfish Immunology, 34(6): 1712 |
KIYMACI M E, ALTANLAR N, GUMUSTAS M, et al, 2018. Quorum sensing signals and related virulence inhibition of Pseudomonas aeruginosa by a potential probiotic strain's organic acid. Microbial Pathogenesis, 121: 190-197 |
KWAK W, KIM K, LEE C, et al, 2016. Comparative analysis of the complete genome of Lactobacillus plantarum GB-LP2 and potential candidate genes for host immune system enhancement. Journal of Microbiology and Biotechnology, 26(4): 684-692 |
LANE D, 1991. 16S/23S rRNA sequencing [M] // STACKEBRANDT E, GOODFELLOW M. Nucleic Acid Techniques in Bacterial Systematics. New York: John Wiley & Sons: 115-175.
|
LIU C Q, SU P, KHUNAJAKR N, et al, 2005. Development of food-grade cloning and expression vectors for Lactococcus lactis. Journal of Applied Microbiology, 98(1): 127-135 |
LIU G Y, WANG X D, GE K, et al, 2022. Isolation, identification, and quantitative determination of saponin in Apostichopus japonicus by HPLC-DAD. Journal of Ocean University of China, 21(2): 473-478 DOI:10.1007/s11802-022-4854-0 |
MOHAPATRA S, CHAKRABORTY T, PRUSTY A K, et al, 2012. Use of different microbial probiotics in the diet of rohu, Labeo rohita fingerlings: effects on growth, nutrient digestibility and retention, digestive enzyme activities and intestinal microflora. Aquaculture Nutrition, 18(1): 1-11 |
NORDIN N, FATIMAH A B, MUN A S, 2013. Antibacterial agents produced by lactic acid bacteria isolated from Threadfin Salmon and Grass shrimp. International Food Research Journal, 20(1): 117-124 |
SRIDHAR K, CHARLES A L, 2019. In vitro antioxidant activity of Kyoho grape extracts in DPPH• and ABTS• assays: estimation methods for EC50 using advanced statistical programs. Food Chemistry, 275: 41-49 |
SUBEDI B, SHRESTHA A, 2020. A review: application of probiotics in aquaculture. International Journal of Forest, Animal and Fisheries Research, 4(5): 52-60 |
SUGITA H, OHTA K, KURUMA A, et al, 2007. An antibacterial effect of Lactococcus lactis isolated from the intestinal tract of the Amur catfish, Silurus asotus Linnaeus. Aquaculture Research, 38(9): 1002-1004 |
VÁZQUEZ J A, GONZÁLEZ M P, MURADO M A, 2005. Effects of lactic acid bacteria cultures on pathogenic microbiota from fish. Aquaculture, 245(1/4): 149-161 |
WANG G Y, JIANG Y X, JIANG J H, et al, 2021. Effects of feed supplemented with probiotics on the culture of sea cucumber Apostichopus japonicus. Aquaculture Nutrition, 27(6): 2703-2711 |
XU C, ZHANG R, WEN Z Y, 2018. Bioactive compounds and biological functions of sea cucumbers as potential functional foods. Journal of Functional Foods, 49: 73-84 |
YANG Q H, LÜ Y L, ZHANG M, et al, 2019. Lactic acid bacteria, Enterococcus faecalis Y17 and Pediococcus pentosaceus G11, improved growth performance, and immunity of mud crab (Scylla paramamosain). Fish & Shellfish Immunology, 93: 135-143 |
 2023, Vol. 54
2023, Vol. 54


