
中国海洋湖沼学会主办。
文章信息
- 孙丽慧, 李倩, 姜建湖, 陈建明, 高令梅, 郭建林. 2023.
- SUN Li-Hui, LI Qian, JIANG Jian-Hu, CHEN Jian-Ming, GAO Ling-Mei, GUO Jian-Lin. 2023.
- 淡水经济虾类红螯螯虾(Cherax quadricarinatus) 不同规格肌肉营养组成及表型性状分析
- ANALYSIS ON PHENOTYPIC TRAITS AND MUSCLE NUTRITIONAL COMPOSITION OF CHERAX QUADRICARINATUS IN DIFFERENT SPECIFICATIONS
- 海洋与湖沼, 54(3): 885-894
- Oceanologia et Limnologia Sinica, 54(3): 885-894.
- http://dx.doi.org/10.11693/hyhz20220800220
文章历史
-
收稿日期:2022-08-26
收修改稿日期:2022-11-02
红螯螯虾(Cherax quadricarinatus)在分类上属于甲壳纲(Crustacea)、十足目(Decapoda)、拟螯虾科(Parastacidae)、滑螯虾属(Cherax), 俗称澳洲淡水龙虾, 原产于澳大利亚北部热带和亚热带水域中, 目前在东南亚、非洲、南美洲等地均有集约化或半集约化养殖。该虾体色褐绿, 雄虾的螯外侧顶端有一膜质鲜红带, 故被称为红螯螯虾, 为澳大利亚规模养殖并出口的三种主要淡水螯虾之一(另两种为马龙螯虾Cherax tenuimanus和牙别螯虾Cherax destructor)。红螯螯虾攻击性较低, 生长速度快, 尤其当条件适宜时5月龄即可达到成熟商品虾规格; 而且对环境条件的耐受性较强, 出肉率明显高于克氏原螯虾(王广军等, 2019), 市场前景可观, 是目前世界上较名贵的淡水经济虾种之一。红螯螯虾相对克氏原螯虾来说, 具有个体大、不打洞和易于捕捞的优点, 且肉质具有弹性, 口感较好, 是克氏原螯虾的优质替代品种之一, 对于提高我国淡水虾养殖种类的多元化、降低养殖风险有着非常重要的意义。
我国自1992年由湖北省水产研究所引入红螯螯虾, 并在湖北和广东、福建试养成功, 逐步推广到国内其他省份, 养殖规模逐年扩大。目前, 有关红螯螯虾的营养需求(Cortés-jacinto et al, 2003)、抗病(Duan et al, 2014)和免疫(Gao et al, 2014)等方面的研究已经取得了一定的进展, 但关于红螯螯虾雌雄不同规格表型性状与营养组成的研究至今仍缺乏全面系统的报道, 安丽等(2012)研究了红螯螯虾出肉率与可量性状的相关性, 陈红林等(2020)研究了三个生长时期红螯螯虾表型性状差异, 秦高婵等(2021)分析了三个生长时期红螯螯虾肌肉氨基酸和脂肪酸变化, 李东宇等(2021)对红螯螯虾形态性状与其体质量、腹肉质量和腹肉率进行了通径分析, 而本研究通过对不同规格红螯螯虾雄虾和雌虾表型性状以及肌肉营养组成进行差异分析, 不仅可以为该优质经济品种的亲本择优选择和形态辅助育种提供理论依据, 还可以根据不同规格虾肌肉中营养组成变化规律, 为其繁殖期营养强化专用配合饲料的研发提供参考。
1 材料与方法 1.1 试验材料试验用红螯螯虾取自浙江省淡水水产研究所八里店综合试验基地, 分别随机选择健康、肢体完整的红螯螯虾357尾, 按照体重规格分为4组, 其中20~40 g为C1组, 40~60 g为C2组, 60~80 g为C3组, 80 g以上为C4组(此组均为雄虾), 具体见表 1。
| 组别 | C1 | C2 | C3 | C4 | |||
| 雄虾 | 雌虾 | 雄虾 | 雌虾 | 雄虾 | 雌虾 | 雄虾 | |
| 样本量 | 37 | 57 | 50 | 71 | 79 | 33 | 30 |
| 体重范围/g | 24.41~39.99 | 22.16~39.28 | 41.28~59.96 | 40.12~58.97 | 60.04~79.28 | 60.01~68.54 | 80.01~93.55 |
使用电子天平准确称量虾体重(精确到0.01 g); 使用游标卡尺准确测量虾表型性状(精度为0.01 mm), 包括全长(total length, TL)、体长(body length, BL)、头胸甲长(carapace length, CL)、头胸甲宽(carapace width, CW)、头胸甲高(carapace depth, CD)、腹长(abdominal length, AL)、腹宽(abdominal width, AW)、腹高(abdominal depth, AD)、第二步足长(length of second leg, LSL), 称量前用纱布吸干样本表面水分。头胸甲高、腹高和第二步足长测量方法参考潘家模(1994), 其余各性状参数测量标准如图 1所示。可量性状测量结束后, 用手工的方法去壳, 取出虾尾虾肉, 称重, 并计算出肉率, 见公式(1)。
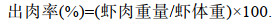 (1)
(1)
 |
| 图 1 红螯螯虾表型性状测量示意图 Fig. 1 Schematic illustration of the phenotypic traits of C. quadricarinatus 注: TL: 全长; BL: 体长; CL: 头胸甲长; CW: 头胸甲宽; AL: 腹长; AW: 腹宽 |
水分测定采用真空冷冻干燥法(吴燕燕等, 2019); 灰分测定采用马福炉灰化法(GB/T 6438-92); 粗蛋白质测定采用凯氏定氮法(GB/T 6432-94); 粗脂肪测定采用索氏抽提法(GB/T 6433-94)。除水分外, 其余指标具体测定步骤同AOAC(1984)。17种常见氨基酸测定采用盐酸水解法(GB/T 5009.124-2003), 经日立L8900氨基酸自动分析仪测定, 色氨酸在水解过程中被破坏而没有测定。脂肪酸含量采用(GB/T 5009. 168-2003)气相色谱法测定。
1.4 营养品质评价将已测得的虾肉氨基酸含量(单位: %DW)除以16即换算成每克氮中含氨基酸毫克数(单位: mg/g N), 与1973年WHO/FAO提出的必需氨基酸评分标准(FAO/WHO, 1973)和中国预防医学科学院、营养与食品卫生研究所提出的鸡蛋蛋白模式进行比较(王光亚, 1991), 氨基酸评分、化学评分和必需氨基酸指数分别按以下公式求得:
 (2)
(2) (3)
(3) (4)
(4)式中, n为比较的氨基酸数; t为试验蛋白质的氨基酸含量; s为鸡蛋蛋白质的氨基酸含量。
1.5 数据处理试验数据采用平均值±标准差表示, 用SPSS16.0统计软件进行单因子方差分析(One-way ANOVA), 如有显著差异(P < 0.05), 则做Duncan多重比较分析。
2 结果 2.1 红螯螯虾表型性状由表 2可知: 随着红螯螯虾规格从20 g增加到80 g, 全长和体长显著增加(P < 0.05), 而且在同规格中雌虾均高于雄虾, 尤其在C3组, 雌虾显著高于雄虾(P < 0.05), 并与C4组雄虾无显著性差异(P > 0.05); 头胸甲长和头胸甲宽也存在同样的趋势, 在C3组中雌虾也显著高于雄虾(P < 0.05), 而头胸甲高在规格60 g以上则不再有显著变化(P > 0.05); 在C2组与C3组雌虾腹长均显著高于雄虾(P < 0.05), 且C3组雌虾与C4组雄虾差异不显著(P > 0.05), 每组雌虾腹宽均显著高于雄虾(P < 0.05), 其中以C3组雌虾腹宽最大(P < 0.05), 红螯螯虾腹高同样在C3组达最大(P < 0.05); 雄虾第二步足长在规格40 g以上显著高于雌虾(P < 0.05), 其中以C4组雄虾最长(P < 0.05); 各组出肉率雌虾显著高于雄虾(P < 0.05), 其中以C1组雌虾最高(P < 0.05), 虽然C4组雄虾虾尾肌肉重最大(P < 0.05), 但其出肉率最低(P < 0.05)。
| 表型性状 | C1 | C2 | C3 | C4 | ||||||
| 雄虾 | 雌虾 | 雄虾 | 雌虾 | 雄虾 | 雌虾 | 雄虾 | ||||
| 体重/g | 33.22±4.93a | 31.96±5.52a | 51.54±5.35b | 48.73±5.67b | 67.62±5.27c | 64.12±2.97c | 84.87±6.42d | |||
| 全长/mm | 113.59±6.39a | 115.09±7.04a | 129.96±4.61b | 132.57±5.47b | 140.07±4.49c | 147.89±1.83d | 148.04±2.67d | |||
| 体长/mm | 97.38±6.45a | 99.66±5.96a | 112.50±4.19b | 114.33±4.93b | 121.17±3.97c | 128.98±3.11d | 127.29±2.52d | |||
| 头胸甲长/mm | 53.59±3.26a | 54.21±3.38a | 61.72±1.99b | 62.26±2.85b | 67.24±2.43c | 69.34±1.70d | 72.54±1.79e | |||
| 头胸甲宽/mm | 22.88±1.26a | 23.26±1.61a | 26.85±1.32b | 26.88±1.32b | 28.62±2.17c | 29.85±0.75d | 31.73±1.28e | |||
| 头胸甲高/mm | 25.82±1.46a | 26.03±1.54a | 29.90±1.40b | 29.55±1.65b | 33.11±5.24c | 32.72±0.48c | 34.58±0.58c | |||
| 腹长/mm | 61.12±3.13a | 62.37±4.18a | 69.72±3.02b | 72.65±3.52c | 75.36±2.84d | 80.23±2.55e | 79.47±0.98e | |||
| 腹宽/mm | 21.04±1.08a | 22.23±1.77b | 24.04±1.79c | 26.11±1.42d | 26.21±1.00d | 28.72±0.81f | 27.30±0.59e | |||
| 腹高/mm | 17.06±1.28a | 17.77±1.46a | 19.63±1.11b | 19.96±1.71b | 21.36±1.31c | 23.03±1.22d | 21.76±1.44c | |||
| 第二步足长/mm | 71.06±13.36a | 71.80±7.16a | 91.94±6.05c | 85.79±4.91b | 105.68±6.26d | 96.72±2.49c | 122.55±2.70e | |||
| 出肉率/% | 16.25±1.22cd | 17.70±1.65e | 15.44±1.53bc | 16.76±1.48de | 14.48±1.46b | 16.35±1.70cd | 12.78±1.10a | |||
| 注: 同行数据肩标无字母或相同字母表示差异不显著(P > 0.05), 不同小写字母表示差异显著(P < 0.05)。下同 | ||||||||||
由表 3可知: 红螯螯虾肌肉水分含量在规格40 g以上显著高于40 g以下(P < 0.05), 但规格继续增加水分含量则不再有显著变化(P > 0.05); 肌肉粗蛋白质含量表现出与水分含量相反的趋势(P < 0.05); C1组肌肉粗蛋白质含量显著高于其他组别(P < 0.05), 其他组别无显著差异(P > 0.05); 而肌肉粗脂肪含量以C4组雄虾最高(P < 0.05), C2组雄虾最低(P < 0.05); C1组雄虾肌肉灰分含量最高, 显著高于其他组别(P < 0.05), C2组雌虾最低, 显著低于C1和C4组(P < 0.05)。
| 营养成分 | C1 | C2 | C3 | C4 | ||||||
| 雄虾 | 雌虾 | 雄虾 | 雌虾 | 雄虾 | 雌虾 | 雄虾 | ||||
| 水分 | 77.79±0.40a | 78.02±0.08a | 80.84±0.22b | 80.47±0.82b | 80.78±0.07b | 80.66±0.54b | 80.33±0.44b | |||
| 粗蛋白质 | 20.28±0.03b | 19.96±0.21b | 17.77±0.19a | 17.99±0.10a | 17.88±0.18a | 17.77±0.08a | 17.94±0.28a | |||
| 粗脂肪 | 0.72±0.01bc | 0.68±0.01bc | 0.52±0.01a | 0.60±0.12ab | 0.61±0.02ab | 0.60±0.04ab | 0.78±0.02c | |||
| 灰分 | 1.39±0.01d | 1.34±0.01c | 1.28±0.01abc | 1.24±0.00a | 1.27±0.05ab | 1.29±0.01abc | 1.31±0.01bc | |||
红螯螯虾肌肉氨基酸组成见表 4, 主要测定了17种常见氨基酸, 其中人体必需氨基酸(EAA) 7种(苏氨酸、缬氨酸、甲硫氨酸、异亮氨酸、亮氨酸、苯丙氨酸和赖氨酸)、半必需氨基酸(HEAA) 2种(组氨酸和精氨酸)和非必需氨基酸(NEAA) 8种(谷氨酸、丙氨酸、甘氨酸、天门冬氨酸、胱氨酸、脯氨酸、丝氨酸和酪氨酸)。由表 4可知, 各组虾肉氨基酸以谷氨酸含量最高, 胱氨酸含量最低。虾肉各氨基酸(AA)、总氨基酸(TAA)、必需氨基酸(EAA)和呈味氨基酸(DAA)均随规格变大而逐渐降低(P < 0.05)。虾肉EAA/TAA为35.19%~35.88%, 以C3组雄虾最高(P < 0.05)。
| 氨基酸 | C1 | C2 | C3 | C4 | ||||||
| 雄虾 | 雌虾 | 雄虾 | 雌虾 | 雄虾 | 雌虾 | 雄虾 | ||||
| 天冬氨酸* Asp | 1.84±0.00c | 1.83±0.00c | 1.66±0.02b | 1.63±0.04b | 1.60±0.05ab | 1.59±0.02ab | 1.54±0.04a | |||
| 苏氨酸Thr | 0.72±0.00e | 0.73±0.01e | 0.66±0.01d | 0.63±0.00c | 0.61±0.01b | 0.60±0.01ab | 0.59±0.01a | |||
| 丝氨酸Ser | 0.75±0.00d | 0.77±0.01e | 0.69±0.01c | 0.65±0.01b | 0.65±0.01ab | 0.64±0.00ab | 0.64±0.01a | |||
| 谷氨酸* Glu | 2.82±0.00d | 2.84±0.01d | 2.55±0.02c | 2.47±0.03b | 2.44±0.05ab | 2.40±0.00a | 2.40±0.02a | |||
| 甘氨酸* Gly | 0.89±0.00d | 1.08±0.00g | 0.92±0.01e | 0.95±0.01f | 0.80±0.01a | 0.87±0.00c | 0.82±0.00b | |||
| 丙氨酸* Ala | 0.96±0.00e | 1.01±0.01f | 0.93±0.01d | 0.89±0.01c | 0.83±0.01a | 0.85±0.01b | 0.83±0.01a | |||
| 胱氨酸Cys | 0.16±0.00e | 0.17±0.00f | 0.15±0.00d | 0.15±0.00c | 0.14±0.00a | 0.14±0.00b | 0.14±0.00ab | |||
| 缬氨酸Val | 0.78±0.00d | 0.78±0.00d | 0.70±0.01c | 0.66±0.01a | 0.68±0.01b | 0.66±0.01a | 0.65±0.01a | |||
| 甲硫氨酸Met | 0.42±0.01d | 0.43±0.01d | 0.39±0.00c | 0.37±0.01b | 0.34±0.01a | 0.34±0.01a | 0.34±0.00a | |||
| 异亮氨酸Ile | 0.79±0.00d | 0.80±0.01d | 0.73±0.01c | 0.68±0.01b | 0.68±0.01b | 0.67±0.01ab | 0.66±0.01a | |||
| 亮氨酸Leu | 1.31±0.00d | 1.33±0.01d | 1.20±0.02c | 1.14±0.02b | 1.14±0.02b | 1.12±0.01ab | 1.10±0.01b | |||
| 酪氨酸* Tyr | 0.66±0.00c | 0.67±0.00c | 0.60±0.00b | 0.56±0.01a | 0.58±0.01b | 0.56±0.01a | 0.56±0.00a | |||
| 苯丙氨酸* Phe | 0.74±0.01c | 0.74±0.00c | 0.67±0.01b | 0.62±0.01a | 0.66±0.01ab | 0.65±0.04ab | 0.63±0.00ab | |||
| 组氨酸His | 0.52±0.00e | 0.52±0.01e | 0.47±0.01d | 0.45±0.00c | 0.43±0.00b | 0.41±0.01a | 0.40±0.00a | |||
| 赖氨酸Lys | 1.39±0.01d | 1.43±0.00d | 1.28±0.02c | 1.24±0.01b | 1.21±0.03ab | 1.20±0.00ab | 1.20±0.01a | |||
| 精氨酸Arg | 1.83±0.00e | 1.94±0.01f | 1.73±0.02d | 1.63±0.01c | 1.56±0.02a | 1.56±0.00a | 1.59±0.00b | |||
| 脯氨酸Pro | 0.59±0.01e | 0.54±0.01d | 0.51±0.01c | 0.47±0.01b | 0.50±0.00c | 0.45±0.01a | 0.45±0.00a | |||
| 总氨基酸TAA | 17.17±0.01d | 17.61±0.07e | 15.84±0.14c | 15.18±0.21b | 14.85±0.25ab | 14.73±0.16a | 14.53±0.13a | |||
| 必需氨基酸EAA | 6.15±0.01d | 6.25±0.04d | 5.63±0.08c | 5.34±0.07b | 5.33±0.09b | 5.25±0.08ab | 5.16±0.05a | |||
| 呈味氨基酸DAA | 6.51±0.01c | 6.75±0.00d | 6.06±0.05b | 5.93±0.10b | 5.66±0.12a | 5.71±0.04a | 5.59±0.06a | |||
| WEAA/WTAA (%) | 35.83±0.10cd | 35.47±0.08ab | 35.55±0.21bc | 35.19±0.03a | 35.88±0.02d | 35.66±0.20bcd | 35.53±0.01b | |||
| WEAA/WNEAA (%) | 72.31±0.32c | 71.49±0.33bc | 71.70±0.48bc | 70.16±0.26a | 72.02±0.07bc | 71.33±0.56b | 71.36±0.09b | |||
| 注: WEAA为必需氨基酸总量, WTAA为氨基酸总量, WNEAA为非必需氨基酸总量, *为鲜味氨基酸 | ||||||||||
氨基酸评分(AAS)、化学评分(CS)和必需氨基酸指数(EAAI)见表 5。在AAS模式下, 各组第一限制性氨基酸为缬氨酸(Val), 第二限制性氨基酸为甲硫氨酸+胱氨酸(Met+Cys)。在CS模式下, 各组第一限制性氨基酸为Met+Cys, 第二限制性氨基酸为Val。无论是AAS模式还是CS模式均以赖氨酸最高。随着红螯螯虾规格增大, 氨基酸评分和化学评分呈显著下降趋势(P < 0.05)。EAAI是衡量食品蛋白营养的重要指标(Rosa et al, 2005), 随红螯螯虾规格逐渐增大, 各组EAAI呈现先升高后显著降低的趋势(P < 0.05), 其中以C2组雄虾最高(P < 0.05)。
| 必需氨基酸 | FAO评分模式 | 鸡蛋蛋白 | C1 | C2 | C3 | C4 | ||||||||||||||||
| 雄虾 | 雌虾 | 雄虾 | 雌虾 | 雄虾 | 雌虾 | 雄虾 | ||||||||||||||||
| AAS | CS | AAS | CS | AAS | CS | AAS | CS | AAS | CS | AAS | CS | AAS | CS | |||||||||
| Ile | 250 | 331 | 0.90±0.00BC | 0.68±0.00bc | 0.90±0.01CD | 0.68±0.01cd | 0.93±0.02D | 0.70±0.01d | 0.89±0.01BC | 0.67±0.01bc | 0.88±0.01BC | 0.67±0.01bc | 0.87±0.01B | 0.66±0.01b | 0.83±0.01A | 0.63±0.01a | ||||||
| Leu | 440 | 534 | 0.85±0.00B | 0.70±0.00b | 0.85±0.01BC | 0.70±0.01bc | 0.88±0.01C | 0.72±0.01c | 0.84±0.01B | 0.70±0.01b | 0.83±0.01B | 0.69±0.01b | 0.83±0.01B | 0.68±0.01b | 0.79±0.01A | 0.65±0.01a | ||||||
| Lys | 340 | 441 | 1.17±0.01BCD | 0.90±0.00bcd | 1.18±0.00BCD | 0.91±0.00bcd | 1.20±0.02D | 0.93±0.01d | 1.19±0.01CD | 0.92±0.01cd | 1.15±0.03BC | 0.89±0.02bc | 1.15±0.00AB | 0.89±0.00ab | 1.12±0.01A | 0.86±0.01a | ||||||
| Met+Cys | 220 | 386 | **0.75±0.01B | *0.43±0.00b | **0.77±0.01B | *0.44±0.01bc | **0.79±0.01C | *0.45±0.00c | **0.76±0.01B | *0.44±0.01b | **0.71±0.01A | *0.41±0.01a | **0.72±0.02A | *0.41±0.01a | **0.70±0.01A | *0.40±0.00a | ||||||
| Phe+Tyr | 380 | 565 | 1.05±0.01AB | 0.71±0.01ab | 1.05±0.00AB | 0.70±0.00ab | 1.06±0.01B | 0.72±0.01b | 1.01±0.02AB | 0.68±0.01ab | 1.06±0.01B | 0.71±0.01b | 1.04±0.05AB | 0.70±0.03ab | 1.00±0.01A | 0.67±0.01a | ||||||
| Thr | 250 | 292 | 0.82±0.00C | 0.70±0.00c | 0.82±0.01C | 0.70±0.01c | 0.84±0.01D | 0.72±0.01d | 0.83±0.00CD | 0.71±0.00cd | 0.79±0.01B | 0.67±0.01b | 0.79±0.01B | 0.67±0.01b | 0.75±0.01A | 0.64±0.01a | ||||||
| Val | 310 | 410 | *0.71±0.00BC | **0.54±0.00bc | *0.71±0.01B | **0.53±0.00b | *0.73±0.01C | **0.55±0.01c | *0.70±0.01B | **0.53±0.01b | *0.71±0.01BC | **0.54±0.00bc | *0.70±0.01B | **0.53±0.00b | *0.67±0.01A | **0.50±0.00a | ||||||
| 必需氨基酸指数 | 64.92±0.16bc | 65.28±0.45cd | 66.88±0.88d | 64.71±0.82bc | 63.72±1.00bc | 63.18±1.00b | 60.78±0.54a | |||||||||||||||
| 注: *表示第一限制性氨基酸; **表示第二限制性氨基酸。在同一列中, 各组AAS有显著差异用上标字母A、B、C或D表示, 各组CS有显著差异用a、b、c或d表示(P < 0.05) | ||||||||||||||||||||||
红螯螯虾肌肉脂肪酸组成见表 6, 共测出脂肪酸37种, 其中含量大于1%的脂肪酸10种, 包括饱和脂肪酸(SFA) 3种(棕榈酸、硬脂酸和二十三烷酸), 单不饱和脂肪酸(MUFA) 2种(棕榈油酸和油酸甲酯)和多不饱和脂肪酸(PUFA) 5种(亚麻酸、二十碳五烯酸、二十二碳六烯酸、亚油酸和二十碳二烯酸)。从表 6可知, 红螯螯虾肌肉SFA含量随规格增大显著升高(P < 0.05), MUFA含量则随规格增大呈现先降低后升高的趋势(P < 0.05), PUFA含量C2组最高, 肌肉二十碳五烯酸(EPA)含量及二十碳五烯酸+二十二碳六烯酸(EPA+DHA)含量C1组最高, 肌肉二十二碳六烯酸(DHA)含量C3组雄虾最高, 肌肉PUFA、EPA、DHA及EPA+DHA含量均以C4组最低。
| 脂肪酸 | C1 | C2 | C3 | C4 | ||||||
| 雄虾 | 雌虾 | 雄虾 | 雌虾 | 雄虾 | 雌虾 | 雄虾 | ||||
| 肉豆蔻酸C14:0 | 0.55±0.07b | 1.08±0.04c | 0.42±0.03a | 0.42±0.02a | 0.41±0.01a | 0.39±0.02a | 0.59±0.01b | |||
| 十五烷酸C15:0 | 0.38±0.01a | 0.95±0.01c | 0.40±0.01a | 0.39±0.01a | 0.41±0.01a | 0.41±0.01a | 0.62±0.02b | |||
| 棕榈酸C16:0 | 16.69±0.01c | 16.23±0.04a | 16.81±0.01d | 16.48±0.03b | 16.88±0.03e | 16.82±0.02d | 18.81±0.01f | |||
| 十七烷酸C17:0 | 0.60±0.01a | 1.03±0.04d | 0.62±0.02a | 0.68±0.03b | 0.68±0.03b | 0.68±0.03b | 0.86±0.01c | |||
| 硬脂酸C18:0 | 7.79±0.01c | 7.38±0.03a | 7.72±0.03b | 8.29±0.02f | 8.20±0.01e | 8.00±0.01d | 8.76±0.01g | |||
| 花生酸C20:0 | 0.47±0.02a | 0.82±0.03d | 0.59±0.01d | 0.52±0.02b | 0.50±0.01ab | 0.59±0.01c | 0.60±0.01c | |||
| 二十一烷酸C21:0 | 0.17±0.01ab | 0.31±0.01c | 0.19±0.02b | 0.18±0.03b | 0.12±0.03a | 0.18±0.04ab | 0.21±0.01b | |||
| 山嵛酸C22:0 | 0.38±0.01a | 0.48±0.03bc | 0.50±0.01c | 0.48±0.03bc | 0.44±0.01b | 0.50±0.01c | 0.78±0.03d | |||
| 二十三烷酸C23:0 | 5.61±0.02b | 5.01±0.01a | 6.19±0.01e | 6.05±0.02d | 6.51±0.01f | 5.99±0.02c | 6.81±0.01g | |||
| 木蜡酸C24:0 | 0.13±0.01a | 0.14±0.01ab | 0.12±0.02a | 0.18±0.03b | 0.14±0.01a | 0.16±0.01ab | 0.32±0.02c | |||
| ∑SFA | 32.81±0.02a | 33.60±0.02b | 33.67±0.05bc | 33.72±0.12bc | 34.38±0.00c | 33.84±0.12c | 38.62±0.06e | |||
| 棕榈油酸C16:1n-7 | 1.41±0.01d | 1.19±0.01c | 0.79±0.01a | 1.05±0.07b | 0.74±0.02a | 1.05±0.07b | 0.81±0.01a | |||
| 十七碳烯酸C17:1n-7 | 0.27±0.01b | 0.21±0.01a | 0.21±0.01a | 0.29±0.02b | 0.21±0.01a | 0.22±0.03a | 0.21±0.01a | |||
| 反油酸C18:1n-9t | 0.10±0.01a | 0.19±0.02c | 0.11±0.01ab | 0.12±0.02ab | 0.14±0.01b | 0.12±0.02ab | 0.29±0.01d | |||
| 油酸甲酯C18:1n-9c | 19.17±0.01e | 19.02±0.03d | 18.85±0.07c | 18.49±0.01a | 19.01±0.01d | 18.72±0.02b | 19.49±0.02f | |||
| 二十碳烯酸C20:1n-9 | 0.46±0.01c | 0.58±0.03d | 0.41±0.01ab | 0.42±0.02abc | 0.45±0.01bc | 0.42±0.02abc | 0.40±0.01a | |||
| ∑MUFA | 21.50±0.01b | 21.37±0.03b | 20.49±0.06a | 20.49±0.09a | 20.65±0.03a | 20.68±0.17a | 21.46±0.01b | |||
| 亚麻酸C18:3n-3 | 2.10±0.02e | 1.69±0.02b | 1.80±0.01c | 2.01±0.01d | 1.67±0.02b | 1.80±0.01c | 1.28±0.04a | |||
| 二十碳三烯C20:3n-3 | 0.28±0.01b | 0.19±0.02a | 0.20±0.01a | 0.29±0.01b | 0.18±0.01a | 0.22±0.03a | 0.19±0.01a | |||
| 二十碳五烯酸C20:5n-3(EPA) | 11.06±0.01g | 10.96±0.06f | 9.89±0.02c | 10.60±0.01d | 9.82±0.03b | 10.74±0.01e | 7.90±0.01a | |||
| 二十二碳六烯酸C22:6n-3(DHA) | 3.24±0.04c | 3.04±0.05b | 3.42±0.03e | 3.34±0.01d | 3.82±0.03f | 2.98±0.04b | 2.08±0.02a | |||
| ∑ω3PUFA | 16.67±0.04g | 15.87±0.06e | 15.30±0.01b | 16.24±0.01f | 15.49±0.05c | 15.73±0.01d | 11.44±0.04a | |||
| 亚油酸C18:2n-6c | 26.30±0.02b | 26.36±0.06b | 27.79±0.01e | 26.78±0.04d | 26.58±0.03c | 26.78±0.04d | 25.69±0.01a | |||
| 二十碳二烯酸C20:2n-6 | 2.51±0.01a | 2.55±0.06a | 2.52±0.02a | 2.52±0.02a | 2.67±0.03b | 2.71±0.01b | 2.49±0.01a | |||
| 二十碳三烯酸C20:3n-6 | 0.10±0.01b | 0.10±0.00a | 0.11±0.01b | 0.11±0.01b | 0.11±0.01b | 0.11±0.01b | 0.19±0.01c | |||
| ∑ω6PUFA | 29.01±0.01b | 29.17±0.01c | 30.55±0.01g | 29.56±0.01e | 29.51±0.01d | 29.77±0.04f | 28.50±0.02a | |||
| ∑PUFA | 45.68±0.02d | 45.04±0.05b | 45.84±0.00e | 45.79±0.01e | 44.99±0.06b | 45.49±0.04c | 39.93±0.06a | |||
| EPA+DHA | 14.30±0.05e | 14.00±0.11d | 13.31±0.01b | 13.94±0.01d | 13.64±0.06c | 13.71±0.03c | 9.97±0.01a | |||
| ∑ω3/∑ω6 | 57.45±0.15g | 54.39±0.24e | 50.07±0.03b | 54.93±0.01f | 52.48±0.16c | 52.83±0.04d | 40.13±0.09a | |||
| ∑PUFA/∑SFA | 140.06±1.14e | 134.11±0.05c | 136.17±0.20d | 135.82±0.53d | 130.86±0.17b | 134.45±0.35c | 103.39±0.30a | |||
| 注: 数据的加粗字体表示其含量大于1%, 小于0.1%的数据则未列出 | ||||||||||
在种群或较大群体中雌雄个体生长存在显著性差异的现象即为性二态(Kokko, 2008), 性二态是由自然选择与性别选择相互作用的结果。有研究表明, 在生物生活史中, 某些发育阶段雌雄形态上无差异, 某些发育阶段雌雄群体则存在显著差异(Lalrinsanga et al, 2012)。如斑节对虾(Penaeus monodon) (Primavera et al, 1998)只有在人工饲养的亲虾阶段, 雌虾有较大增重时, 才会出现性二态现象, 凡纳滨对虾(P. vannamei) (Chow et al, 1991)在性成熟后, 雌虾才会比雄虾大且雌虾生长更快。本研究通过对不同规格红螯螯虾表型性状差异分析发现, 在规格20~40 g组, 雌虾腹宽显著高于雄虾, 这表明红螯螯虾第二性征初步显现, 随着规格增加到40~60 g, 雌虾腹宽及腹长显著高于雄虾, 在规格为60~80 g, 雌虾腹宽、腹长及腹高均显著高于雄虾, 雄虾第二步足长显著高于雌虾, 此时, 红螯螯虾第二性征完全显现, 表明该虾具有性二态现象。这与陈红林等(2020)研究结果相一致。60 g以上雌虾腹部性状显著高于雄虾, 这可能和雌虾在性成熟后便于抱卵提高繁殖能力有关。性二态在水产动物中具有普遍性, 并非虾类所特有, 这在胡子鲶(Hemigrapsus takanoi)雌鱼个体中也有所体现, 它通过局部特征的变化来增加腹腔容量, 提高雌鱼繁殖力(Miyajima et al, 2017)。同样现象在性成熟后的罗氏沼虾(Macrobrachium rosenbergii)出现, 其雌虾腹部性状显著大于雄虾, 也是为了增加腹部面积, 提高抱卵量(邢钱钱等, 2021)。60 g以上雄虾第二步足长显著大于雌虾, 这使得其具有更强的攻击能力, 以便于其侵占领域及获得更多与雌虾交配的机会, 还有利于在交配过程中对雌虾的控制(邢钱钱等, 2021)。本研究发现, 随规格增大, 雌虾数量减少, 这可能是因为红螯螯虾雌虾卵巢发育需要大量营养供给, 从而减少了其体质量的增长, 而雄虾性腺发育需要营养相对较少, 仍有较多营养用于体质量增长。
3.2 不同规格红螯螯虾肌肉常规营养组成差异分析肌肉中蛋白质和脂肪含量是评价水产品营养价值的重要指标(周凡等, 2013)。本研究中, 当红螯螯虾规格在40 g以下, 肌肉粗蛋白质含量较高, 随规格增大, 肌肉粗蛋白质含量显著下降并趋于稳定, 其肌肉粗蛋白质含量为17.77%~20.28%, 与克氏原螯虾(Procambarus clarkii) (18.67%) (封功能等, 2011)含量相当; 高于日本对虾(Marsupenaeus japonicas) (17.74%) (许星鸿等, 2011); 但低于凡纳滨对虾(21.57%) (陈晓汉等, 2001)。红螯螯虾肌肉粗脂肪含量为0.52%~0.78%, 与克氏原螯虾[0.77% (田娟等, 2017); 0.68% (王广军等, 2019); 0.65% (王广军等, 2019)]含量相当; 低于莫桑比克草虾(Mozambican Penaeus monodon) (1.45%~1.58%) (周凡等, 2013); 但高于凡纳滨对虾(0.29%) (庄健隆等, 1985)。可见, 红螯螯虾属于高蛋白、低脂肪的虾类, 非常符合当前消费者对高品质水产品的需求。
3.3 不同规格红螯螯虾肌肉氨基酸组成及含量变化分析水产动物体内氨基酸主要有非必需氨基酸、半必需氨基酸和必需氨基酸3类, 其中必需氨基酸既不能自身合成, 也不能通过其他氨基酸转化而来, 只能由食物中获得, 所以确定水产动物体内氨基酸组成, 对其配合饲料的研发有重要作用。另外, 氨基酸具有调节人体机能、维护心脑血管健康、增强免疫力和促进激素分泌等重要作用, 而了解不同规格红螯螯虾肌肉中氨基酸含量可以确定其最佳食用规格, 为人们合理食用提供参考。本研究中, 红螯螯虾从小规格到大规格生长过程中, 肌肉中总氨基酸含量逐渐降低, 各氨基酸含量变化表现出与总氨基酸相同的趋势, 表明红螯螯虾肌肉中各氨基酸组成在其生长过程中有较大保守性。不同规格的红螯螯虾肌肉氨基酸含量以谷氨酸最高, 这与克氏原螯虾(王广军等, 2019)、日本沼虾(唐金玉等, 2021)和瘤背石磺(Onchidium struma) (贺诗水等, 2012)等研究结果相一致。除谷氨酸外, 天冬氨酸含量也较高, 它们都属于呈味氨基酸, 占氨基酸总量的37.90%~39.06%, 高于细鳞鲑(Brachymystax lenok) (31.30%) (郑雪莉等, 2010), 且相同规格下, 雌虾呈味氨基酸占总氨基酸比重高于雄虾; 相同性别下, 大规格虾呈味氨基酸占总氨基酸比重高于小规格。其中, 以40~60 g及60~80 g雌虾最高。此外, 红螯螯虾肌肉中精氨酸、赖氨酸和亮氨酸含量也较高, 分别占肌肉的1.56%~1.94%、1.20%~1.43%和1.10%~1.33%, 占氨基酸总量的10.51%~11.02%、8.08%~8.26%和7.51%~7.68%。精氨酸在促进伤口愈合及促进儿童生长发育方面有非常重要的作用; 赖氨酸参与动物体内蛋白质合成, 决定其他氨基酸的利用程度, 同时还可以提高钙的吸收, 促进机体发育; 亮氨酸可促进骨骼肌蛋白的合成, 氧化供能、提高肉品质和机体免疫力。因此红螯螯虾肌肉可作为补充精氨酸、赖氨酸和亮氨酸的蛋白质源。
联合国粮农组织/世界卫生组织(FAO/WHO)规定的理想蛋白质源的氨基酸组成是EAA/TAA为40%左右, EAA/NEAA为60%以上。本研究中, 红螯螯虾肌肉中必需氨基酸含量为5.16%~6.25%, EAA/TAA为35.19%~35.88%, 接近40%, EAA/NEAA为70.16%~ 72.31%, 远大于60%, 这进一步说明红螯螯虾肌肉蛋白质营养价值较高, 是一种高品质蛋白食物。其中规格为20~40 g和40~60 g的EAA含量较高, 随规格增大, EAA含量逐渐降低, 这与Ghanawi等(2012)和秦高婵等(2021)研究结果一致, 可能是因为甲壳类动物随着规格增大, 蛋白质主要用于性腺组织结构发育, 且在蜕壳和性腺发育前期, 机体会储存一定的营养物质, 以保证生理活动的正常进行。
3.4 不同规格红螯螯虾肌肉蛋白营养价值评价优质蛋白质资源开发和居民膳食指导离不开蛋白质营养评价, 氨基酸是组成蛋白质的基本单位, 所以蛋白质营养价值的高低由氨基酸含量及比例决定, 尤其是必需氨基酸含量及比例(王婧文等, 2020)。而必需氨基酸评分则反映蛋白质构成与利用率的关系(唐金玉等, 2021)。本研究中, 对比AAS和CS模式, 各组限制性氨基酸均为Val及Met+Cys, 两种模式下, 均以赖氨酸评分最高, 故红螯螯虾肌肉蛋白质可弥补谷类食物中赖氨酸的不足。符合人体EAA含量及构成比例的蛋白质, 其氨基酸吸收最为完全, 营养价值最高。食物中任何一种EAA含量过高或过低, 均会影响人体所必需的氨基酸平衡, 并有可能造成机体的生理机能失常, 甚至导致代谢紊乱。EAAI可反映肌肉中必需氨基酸含量与标准蛋白质之间的接近程度, 是衡量食品蛋白营养的重要指标(Rosa et al, 2005), 数值越高, 越接近鸡蛋蛋白标准, 营养价值越高。本研究中, 随红螯螯虾规格逐渐增大, 各组EAAI呈现先升高后显著降低的趋势(P < 0.05), 以规格为40~60 g组的雄虾最高(P < 0.05), 这说明此规格的雄虾肌肉蛋白品质高。
3.5 不同规格红螯螯虾肌肉脂肪酸组成变化分析脂肪酸在食品风味和人类营养生理活动中起着十分重要的作用, 动物食品中高含量的PUFA, 能显著增加香味, 并在一定程度上反映肌肉的多汁性。本研究中, 肌肉PUFA含量以规格为40~60 g最高, 雄虾为45.84%, 雌虾为45.79%, 以规格80~100 g雄虾最低, 仅为39.93%。不同规格红螯螯虾肌肉脂肪酸组成存在显著差异, 规格大于80 g, 肌肉脂肪酸中SFA显著升高, PUFA则显著降低。各规格下, 红螯螯虾肌肉中脂肪酸均以棕榈酸、油酸甲酯和亚油酸含量较高, 其总量占总脂肪酸的50%以上, 这与罗钦(2021)、Thompson等(2010)研究结果一致。∑PUFA/∑SFA是判断肌肉营养品质优劣的重要指标之一, 红螯螯虾肌肉脂肪酸∑PUFA/∑SFA为1.03~1.40, 远大于世界卫生组织的建议值(0.4~0.5) (张东平等, 2012), 这说明该虾肌肉脂肪酸品质较高。∑ω3PUFA在改善血液循环、提高记忆力和思维能力及抗癌等方面起着重要作用(贺延苓等, 2018; 黄国欣等, 2019), 它可通过调节免疫细胞膜上受体和分子的表达, 影响细胞的免疫反应, 从而降低心血管和炎症疾病的发生率, ∑ω3PUFA中起主要作用的是EPA和DHA, 它们被认为是人和动物生长发育必需的高不饱和脂肪酸, 具有降低胆固醇、促进饱和脂肪酸代谢、改善血液循环等功能, 而DHA还参与胎儿脑细胞的形成和发育, 对神经细胞轴突的延伸和新突起的形成也有重要作用。本研究显示, 红螯螯虾肌肉脂肪酸EPA、DHA及EPA+DHA含量较高, 但80~100 g组含量则显著低于其余各组。Calder(1997)研究表明, 食物中∑ω3PUFA、∑ω6PUFA以及∑ω3PUFA/∑ω6PUFA均可不同程度地影响机体免疫功能。∑ω6PUFA摄食过量会引起肥胖症和心血管疾病, 甚至诱发肿瘤。Sugano等(2000)指出, 合理膳食结构的∑ω6PUFA/∑ω3PUFA值应低于4, 即∑ω3PUFA/∑ω6PUFA应高于25%。本研究中, 红螯螯虾肌肉脂肪酸∑ω3PUFA/∑ω6PUFA为40.13%~ 57.45%, 远高于推荐值。因此红螯螯虾是脂肪酸配比较优的高品质虾类, 尤其是40~60 g的规格。
4 结论综上所述, 红螯螯虾是一种高蛋白、低脂肪、营养价值高的优质虾类, 不同规格、不同性别红螯螯虾肌肉营养组成和品质存在一定的差异, 在规格40~ 60 g之间肌肉品质最好。因此以食用为目的, 建议选取40~60 g的规格。
王广军, 孙悦, 郁二蒙, 等, 2019. 澳洲淡水龙虾与克氏原螯虾肌肉营养成分分析与品质评价. 动物营养学报, 31(9): 4339-4348 |
王光亚, 1991. 食物成分表(全国代表值). 北京: 人民卫生出版社, 30-82, 92-104
|
王婧文, 王英俊, 刘天红, 等, 2020. 6个不同群体许氏平鲉肌肉氨基酸分析及评价. 中国渔业质量与标准, 10(2): 65-72 DOI:10.3969/j.issn.2095-1833.2020.02.009 |
田娟, 许巧情, 田罗, 等, 2017. 洞庭湖克氏原螯虾肌肉成分分析及品质特性分析. 水生生物学报, 41(4): 870-877 |
邢钱钱, 杨旻珉, 陈国柱, 等, 2021. 罗氏沼虾性成熟前后形态性状对体质量的通径分析. 水产学报, 46(9): 1632-1645 |
庄健隆, 李孟芳, 郑健雄, 1985. 台湾5种养殖虾的消化酵素活性比较. 台湾水产学会会刊, 12(2): 43-53 |
安丽, 孟庆磊, 董学飒, 等, 2012. 克氏原螯虾和红螯螯虾出肉率与可量性状的相关性. 农学学报, 2(12): 54-56, 61 DOI:10.3969/j.issn.1007-7774.2012.12.012 |
许星鸿, 刘翔, 阎斌伦, 等, 2011. 日本对虾肌肉营养成分分析与品质评价. 食品科学, 32(13): 297-301 |
李东宇, 潘志, 顾志峰, 等, 2021. 红螯螯虾形态性状与其体质量、腹肉质量和腹肉率的通径分析. 海南热带海洋学院学报, 28(5): 9-17 |
吴燕燕, 石慧, 李来好, 等, 2019. 水产品真空冷冻干燥技术的研究现状与展望. 水产学报, 43(1): 197-205 |
张东平, 张少欢, 余应新, 等, 2012. 太湖鱼中多不饱和脂肪酸及其与多氯联苯共摄入益害分析. 科学通报, 57(5): 324-331 |
陈红林, 秦高婵, 楼宝, 等, 2020. 不同生长时期红螯螯虾表型性状差异分析. 浙江农业学报, 32(12): 2154-2161 |
陈晓汉, 陈琴, 谢达祥, 2001. 南美白对虾含肉率及肌肉营养价值的评定. 水产科技情报, 28(4): 165-168 |
罗钦, 2021. 3种养殖模式下澳洲淡水龙虾肌肉脂肪酸品质比较. 西北农林科技大学学报(自然科学版), 49(9): 22-29 |
周凡, 肖金星, 何中央, 等, 2013. 不同规格莫桑比克草虾肌肉营养组成、消化酶及免疫酶活性分析. 水产科学, 32(11): 653-656 |
郑雪莉, 段敏, 卜书海, 等, 2010. 秦岭细鳞鲑肌肉营养成分的分析. 营养学报, 32(5): 516-520 |
封功能, 王爱民, 邵荣, 等, 2011. 克氏原螯虾不同生长阶段营养成分分析与评价. 江苏农业科学, 39(4): 383-385 |
贺延苓, 黄若安, 蔡昌兰, 2018. n-3多不饱和脂肪酸的抗癌功效及其生物学机制的研究进展. 现代肿瘤医学, 26(24): 4025-4028 |
贺诗水, 吴旭干, 滕炜鸣, 等, 2012. 不同规格瘤背石磺(Onchidium struma)肌肉的生化组成及营养价值评价. 海洋与湖沼, 43(4): 761-767 |
秦高婵, 陈红林, 储天琪, 等, 2021. 不同生长时期红螯螯虾肌肉和肝胰腺内氨基酸和脂肪酸变化分析. 渔业科学进展, 42(6): 84-92 |
唐金玉, 叶建勇, 戴杨鑫, 等, 2021. 江苏日本沼虾4个野生种群肌肉营养成分比较. 水生生物学报, 45(4): 801-808 |
黄国欣, 张养东, 郑楠, 等, 2019. ω-3多不饱和脂肪酸对奶牛生理功能的影响及其调控机制的研究进展. 动物营养学报, 31(1): 32-41 |
潘家模, 1994. 罗氏沼虾养殖新技术. 上海: 上海科学技术出版社, 1-40
|
AOAC (Association of Official Analytical Chemists), 1984. Official Methods of Analysis. 14th ed. Arlington: AOAC, 152-163
|
CALDER P C, 1997. N-3 polyunsaturated fatty acids and immune cell function. Advances in Enzyme Regulation, 37: 197-237 |
CHOW S, SANDIFER P A, 1991. Differences in growth, morphometric traits, and male sexual maturity among Pacific white shrimp, Penaeus vannamei, from different commercial hatcheries. Aquaculture, 92: 165-178 |
CORTÉS-JACINTO E, VILLARREAL-COLMENARES H, CIVERA-CERECEDO R, et al, 2003. Effect of dietary protein level on growth and survival of juvenile freshwater crayfish Cherax quadricarinatus (Decapoda: Parastacidae). Aquaculture Nutrition, 9(4): 207-213 |
DUAN H, JIN S J, ZHANG Y, et al, 2014. Granulocytes of the red claw crayfish Cherax quadricarinatus can endocytose beads, E. coli and WSSV, but in different ways. Developmental & Comparative Immunology, 46(2): 186-193 |
FAO/WHO, 1973. Energy and protein requirements [R]. FAO Nutrition Meeting Report Series, 52: 40-73.
|
GAO M L, LI F, XU L M, et al, 2014. White spot syndrome virus strains of different virulence induce distinct immune response in Cherax quadricarinatus. Fish & Shellfish Immunology, 39(1): 17-23 |
GHANAWI J, SAOUD I P, 2012. Molting, reproductive biology, and hatchery management of redclaw crayfish Cherax quadricarinatus (von Martens 1868). Aquaculture, 358-359: 183-195 |
KOKKO H, 2008. Sex, size and gender roles: evolutionary studies of sexual size dimorphism. Bioscience, 58(5): 460-461 |
LALRINSANGA P L, PILLAI B R, PATRA G, et al, 2012. Length weight relationship and condition factor of giant freshwater prawn Macrobrachium rosenbergii (De Man, 1879) based on developmental stages, culture stages and sex. Turkish Journal of Fisheries and Aquatic Sciences, 12(4): 917-924 |
MIYAJIMA A, WADA K, 2017. Relationships between life history traits and sexual dimorphisms in two varunid crabs, Hemigrapsus takanoi Asakura & Watanabe, 2005 and H. sinensis Rathbun, 1931 (Brachyura: Varunidae). Journal of Crustacean Biology, 37(1): 21-28 |
PRIMAVERA J H, PARADO-ESTEPA F D, LEBATA J L, 1998. Morphometric relationship of length and weight of giant tiger prawn Penaeus monodon according to life stage, sex and source. Aquaculture, 164(1/2/3/4): 67-75 |
ROSA R, CALADO R, ANDRADE A M, et al, 2005. Changes in amino acids and lipids during embryogenesis of European lobster, Homarus gammarus (Crustacea: Decapoda). Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 140(2): 241-249 |
SUGANO A M, HIRAHARA F, 2000. Polyunsaturated fatty acids in the food chain in Japan. The American Journal of Clinical Nutrition, 71(S1): 189S-196S |
THOMPSON K R, BAILEY T J, METTS L S, et al, 2010. Growth response and fatty acid composition of juvenile red claw crayfish (Cherax quadricarinatus) fed different sources of dietary lipid. Aquaculture Nutrition, 16(6): 604-615 |
 2023, Vol. 54
2023, Vol. 54


