
中国海洋湖沼学会主办。
文章信息
- 仝浩玉, 朱恺彧, 兰宇宇, 盛璨璨, 张大海, 袁红明, 赵广明, 李先国. 2023.
- TONG Hao-Yu, ZHU Kai-Yu, LAN Yu-Yu, SHENG Can-Can, ZHANG Da-Hai, YUAN Hong-Ming, ZHAO Guang-Ming, LI Xian-Guo. 2023.
- 黄河三角洲湿地表层沉积物中典型抗生素的分布特征和生态风险评估
- DISTRIBUTION CHARACTERISTICS AND ECOLOGICAL RISK ASSESSMENT OF TYPICAL ANTIBIOTICS IN SURFACE SEDIMENTS OF HUANGHE RIVER DELTA WETLAND
- 海洋与湖沼, 54(4): 1028-1038
- Oceanologia et Limnologia Sinica, 54(4): 1028-1038.
- http://dx.doi.org/10.11693/hyhz20221200333
文章历史
-
收稿日期:2022-12-17
收修改稿日期:2023-01-08
2. 中国海洋大学海洋化学理论与工程技术教育部重点实验室 山东青岛 266100;
3. 中国地质调查局青岛海洋地质研究所 山东青岛 266071
2. Key Laboratory of Marine Chemistry Theory and Technology (Ocean University of China), Ministry of Education, Qingdao 266100, China;
3. Qingdao Institute of Marine Geology, China Geological Survey, Qingdao 266071, China
抗生素(Antibiotics)是一种能够抑制各种有害微生物(细菌、原生动物、病毒、古菌、真菌和微藻等)活性或导致其死亡的有机化合物(Sarmah et al, 2006)。近几十年来许多类型的抗生素被生产并应用于人类和动物疾病的预防和治疗(Li et al, 2020)。大量抗生素及其代谢产物通过尿液和粪便(Hu et al, 2010)、废水(Watkinson et al, 2007)以及畜禽和农业废弃物等方式进入环境, 城市生活污水即便经过无害化处理后仍有一部分未改变活性形式并释放到自然环境中(Zhou et al, 2013)。环境中的抗生素残留除本身能够对生物体造成毒害作用外, 还会促进细菌种群中抗生素抗性基因(ARGs)的表达, 进而影响微生物群落结构, 并最终通过食物链对人类健康构成威胁。中国是全球最大的抗生素生产和使用国(Zhu et al, 2013)。尽管大多数抗生素在环境中的半衰期并不长(Dong et al, 2020), 在环境中的持久性、传播速度和累积能力也各不相同, 但由于长期的大量使用和累积, 环境中的抗生素种类和浓度在不断增长。
黄河三角洲[Huanghe (Yellow) River Delta, HRD]是地球上沉积速度最快、最为动态的生态系统之一, 是我国最完整、最年轻的湿地生态系统, 主要包括(低潮时水深不超过6 m)沿海水域、潮间淤泥海滩、沼泽和盐碱地等类型(Zhang et al, 2016)。HRD分为南北两个区域: 南部区域是现代黄河高泥沙含量的河水入海, 在河口地区由于盐度剧烈变化形成的沉积区; 北部区域最初是1855年(清咸丰年间)黄河改道渤海湾入海而形成的沉积区, 因而此处的黄河故道亦称“咸丰故道”; 在近170年的历史中, 该区域的沉积环境同时也会受到区域水文、气候和人文活动的影响。黄河三角洲资源丰富、水产养殖业繁荣并且工农业发达, 大量生活污水、水产养殖和工业废水使其成为了污染物包括抗生素的聚集地。同时, 由于海洋、河流和大气等系统的多重影响和相互作用, 物质交换频繁, 对污染物的发生、累积和转移的影响不可忽略。
近年来, 有关抗生素在河流以及沿海环境中的研究较多, 例如海河河水(Luo et al, 2010)、胶州湾沉积物(Liu et al, 2022)和珠江三角洲沉积物(Liang et al, 2013)等。沉积物是自然环境中抗生素的主要汇集地, 当水文条件发生改变时, 沉积物有可能作为抗生素的二次源向地表水释放(Cheng et al, 2014)。此外, 沉积物能够吸附抗生素, 一定程度上保持其稳定存在(Chen et al, 2014), 导致其在沉积物中的持久性和更长时间的降解周期。可以预期, HRD南北两个区域不同的形成机制、地理环境和人为活动不可避免会影响到抗生素的分布格局。但就我们所知, 常见抗生素在HRD表层沉积物中的分布特征、生态风险的研究较为有限, 尤其是不同区域浓度分布差异以及沉积物理化性质可能造成的影响尚不明确。有鉴于此, 本研究的主要目的是: (1) 探究黄河三角洲南北两个区域之间抗生素的空间分布特征及其差异; (2) 分析沉积物理化性质与抗生素之间的相关性, 探究其对抗生素的影响; (3) 利用风险熵值法分析抗生素的生态风险, 为抗生素污染防治提供理论依据。
1 材料与方法 1.1 研究区域与样品采集黄河三角洲位于山东省东营市黄河下游, 地处118°33′~119°27′E, 37°35′~38°12′N (Wang et al, 2022)。年平均气温为11.7~12.6 ℃, 年平均日照时长2 700 h, 年平均降水量和蒸发量分别为540~640和1 910~2 450 mm。主要土壤类型为沿海潮土和盐渍土(Zhang et al, 2009)。
本研究于2021年6月选择黄河三角洲南北两个区域, 用不锈钢抓斗(青岛奥尔森)采集表层(0~5 cm)沉积物样品。采样站位如图 1所示, 沿河流沿岸或潮滩采样。北部区域21个站位, 包括二河(TR)、三河(SR)和黄河故道(OW); 南部区域33个站位, 包括黄河下游(LYR)和黄河口(YRE)。样品收集到双层聚乙烯塑料袋中, 并置于冰块上及时运回实验室, 0~4 ℃下储存; 经冷冻干燥、去除砾石和植物根等杂质, 研磨和筛分后待分析。
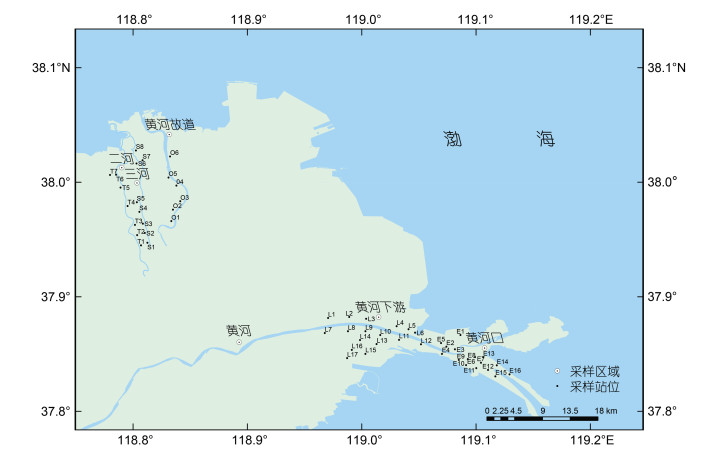 |
| 图 1 黄河三角洲表层沉积物采样站位分布 Fig. 1 The sampling sites of surface sediments in the Huanghe River deltaic regions |
本研究的目标抗生素有4类14种, 包括5种磺胺类(SAs)、3种喹诺酮类(QNs)、3种大环内酯类(MLs)和3种四环素类(TCs)。所有标准品均购自中国食品药品检定研究院, 用甲醇配制成各自浓度均为500 μg/L的混合标准溶液, 在−20 ℃条件下避光保存。目标抗生素基本信息见表 1 (数据来源: https://go.drugbank.com/)。
| 抗生素 | 缩写 | CAS编号 | 分子式 | 摩尔质量/(g/mol) | 辛醇-水分配系数 | 溶解度/(mg/L) | |
| 磺胺类SAs | 磺胺嘧啶 | SDZ | 68-35-9 | C10H9N4O2S | 250.28 | −0.09 | 77 |
| 磺胺甲基吡啶 | SMR | 127-79-7 | C11H12N4O2S | 264.30 | 0.14 | 202 | |
| 磺胺甲恶唑 | SMX | 723-46-6 | C10H11N3O3S | 253.28 | 0.89 | 610 | |
| 磺胺甲嘧啶 | SMZ | 57-68-1 | C11H12N4O2S | 264.30 | 0.89 | 1 500 | |
| 磺胺噻唑 | STZ | 72-14-0 | C9H9N3O2S2 | 255.32 | 0.05 | 373 | |
| 喹诺酮类QNs | 恩诺沙星 | ENR | 93106-60-6 | C19H22FN3O3 | 359.40 | 0.70 | 0.612 |
| 诺氟沙星 | NOR | 70458-96-7 | C16H18FN3O3 | 359.39 | −1.03 | 1.01 | |
| 氧氟沙星 | OFL | 82419-36-1 | C18H20FN3O4 | 361.37 | −0.39 | 28.3 | |
| 大环内酯类MLs | 克拉霉素 | CTM | 81103-11-9 | C38H69NO13 | 747.953 | 3.16 | 0.33 |
| 红霉素 | ERY | 114-07-8 | C37H67NO13 | 733.94 | 3.06 | 2 000 | |
| 脱水红霉素 | ERY-H2O | 23893-13-2 | C37H65NO12 | 715.91 | 2.60 | 459 | |
| 四环素类TCs | 金霉素 | CTC | 57-62-5 | C22H23ClN2O8 | 478.88 | −0.62 | 53 |
| 土霉素 | OTC | 79-57-2 | C22H24O9N2 | 460.434 | −0.90 | 313 | |
| 四环素 | TET | 60-54-8 | C22H24N2O8 | 444.45 | −1.30 | 231 | |
使用激光粒度分析仪(Mastersizer 3000, Malvern公司, 英国)测定沉积物粒径, 转换为用Φ值表示, 分辨率为0.01Φ。步骤如下: 将冷冻干燥过筛后的沉积物依次用10% H2O2和3 mol/L HCl去除有机质和碳酸盐, 然后用超纯水洗至pH=7, 加入1 g/L六偏磷酸钠溶液, 超声30 min后上机检测, 重复测定三次取平均值。使用自动元素分析仪(vario MACRO cube, Elementar公司, 德国)测定总有机碳(total organic carbon, TOC) (Li et al, 2022), 步骤如下: 取30 mg过筛后的沉积物样品, 用3 mol/L HCl去除无机碳, 使用超纯水洗至pH=7, 离心后将样品低温烘干至恒重后上机测试, 重复三次取平均值。
1.4 沉积物样品中抗生素的测定 1.4.1 样品前处理称取0.65 g草酸, 用甲醇溶解定容至500 mL得到0.01 mol/L草酸甲醇溶液; 称取12.9 g柠檬酸、27.5 g磷酸氢二钠和37.2 g EDTA二钠溶于1 L超纯水中, 并调节pH=4.00±0.05得到0.1 mol/L Na2EDTA-McIlvaine缓冲溶液。
称取5 g冷冻干燥过筛后的沉积物于离心管中, 加入2 mL草酸甲醇溶液、8 mL丙酮和10 mL缓冲溶液, 超声10 min (25 ℃), 离心分离出上清液。再加入上述一半体积溶液重复提取两次。合并上清液, 用超纯水稀释至500 mL进行固相萃取(SPE)。用甲醇和超纯水依次活化HLB SPE小柱(6 mL/500 mg, Waters Oasis, 美国), 以3~5 mL/min的流速上样, 结束后用超纯水淋洗柱子并抽干。用5 mL甲醇进行洗脱, 尽可能保持流速稳定, 确保将目标物全部从HLB小柱中洗脱。氮吹吹干后用甲醇定容至250 μL, 置于−20 ℃条件下保存。
1.4.2 抗生素测定使用高效液相色谱(HPLC)-TSQ Endura三重四极杆质谱联用仪(Vanquish, ThermoFisher Scientific, 美国)进行目标化合物的定性和定量分析。
采用Zorbax Eclipse plus C18色谱柱(2.1 mm× 50 mm, 1.8 μm)分离目标物, 流动相A为0.1%甲酸-水, 流动相B为含0.1%甲酸的甲醇-乙腈(1︰1)。流速: 0.4 mL/min, 柱温: 25 ℃, 进样量: 10 μL。梯度洗脱程序见表 2。
| 时间/min | 流动相A/% | 流动相B/% |
| 0.0 | 80.0 | 20.0 |
| 2.0 | 80.0 | 20.0 |
| 5.0 | 75.0 | 25.0 |
| 8.0 | 40.0 | 60.0 |
| 10.0 | 10.0 | 90.0 |
| 11.0 | 0.0 | 100.0 |
| 12.0 | 80.0 | 20.0 |
质谱采用电喷雾离子源, 正离子扫描方式, 多反应监测(MRM)模式进行检测。离子源温度: 120 ℃, 鞘气流速: 11 L/min, 鞘气温度: 350 ℃; 毛细管电压4 000 V, 雾化气压力: 241 316.5 Pa; 干燥气(氮气)温度: 300 ℃, 干燥气流速: 7 L/min。
将混合标准溶液稀释成1、2、5、8、10、50、100、250、500 μg/L的梯度混标溶液, 建立各抗生素的标准曲线, R2均大于0.995。每种目标抗生素选择1个对应母离子和2个分别用于定性和定量的子离子, 并按照文献(于婉柔, 2021)方法, 根据母离子和定性子离子对各目标抗生素进行定性, 根据定量子离子峰面积用外标法进行定量。
1.5 生态风险评估方法Hernando等(2006)提出风险熵值(RQ)法, 将污染物实测浓度(MECs)或模型计算出的预测浓度(PECs)与初级生产者或无脊椎动物的预测无效应浓度(PENCs)进行比较(Rico et al, 2014)得到RQ, 并根据RQ值将生态风险水平分为: 无风险(RQ<0.01)、低风险(0.01≤RQ<0.1)、中等风险(0.1≤RQ<1)和高风险(RQ≥1)。
沉积物中抗生素相关的生物毒性效应数据缺乏。我们根据文献方法(Zhao et al, 2010; Rico et al, 2014), 将沉积物中抗生素的浓度转化为孔隙水中的浓度, 再通过水生生物毒性数据进行评估。公式如下:
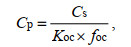 (1)
(1)式中: Cp为孔隙水中浓度(单位: ng/L); Cs为沉积物中浓度(ng/g); Koc为有机碳分配系数(单位: L/kg), 由辛醇-水分配系数推出(Song et al, 2022)(表 3); foc为沉积物中有机碳含量。得到Cp后, 采用风险熵值法评估, 公式如下:
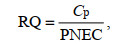 (2)
(2)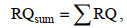 (3)
(3)| 抗生素 | Koc/(L/kg) | 毒性数据/(mg/L) | 毒性类型 | 评估因子 | 无效应浓度/(ng/L) | 参考文献 | |
| EC50 | NOEC | ||||||
| SDZ | 0.82 | 0.135 | 急性 | 1 000 | 135 | Ma et al, 2015 | |
| SMR | 0.96 | 0.460 | 急性 | 1 000 | 460 | Białk-Bielińska et al, 2011 | |
| SMX | 1.43 | 0.027 | 急性 | 1 000 | 27 | Ferrari et al, 2004 | |
| SMZ | 1.43 | 19.520 | 急性 | 1000 | 19 520 | Białk-Bielińska et al, 2011 | |
| STZ | 0.90 | 0.020 00 | 慢性 | 100 | 200 | Park et al, 2012 | |
| ENR | 1.31 | 0.049 | 急性 | 1 000 | 49 | Robinson et al, 2005 | |
| NOR | 0.23 | 0.010 38 | 慢性 | 100 | 103.8 | Backhaus et al, 2000 | |
| OFL | 0.63 | 0.001 13 | 慢性 | 100 | 11.3 | Kolar et al, 2014 | |
| CTM | 2.84 | 160.000 | 急性 | 1 000 | 16 000 | Lützhøft et al, 1999 | |
| ERY | 2.78 | 6.370 | 急性 | 1 000 | 6 370 | Li et al, 2018 | |
| ERY-H2O | 2.50 | 0.022 | 急性 | 1 000 | 22 | González-Pleiter et al, 2013 | |
| CTC | 0.49 | 0.050 | 急性 | 1 000 | 50 | Guo et al, 2012 | |
| OTC | 0.31 | 0.180 | 急性 | 1 000 | 180 | Isidori et al, 2005 | |
| TET | 0.06 | 0.090 | 急性 | 1 000 | 90 | Ma et al, 2015 | |
| 注: Koc为有机碳分配系数, EC50为半最大效应浓度, NOEC为最大无影响浓度 | |||||||
式中, RQ为风险熵; RQsum为联合风险熵; PNEC为预测的无效应浓度(单位: μg/L), 由水生生物急性毒性数据(半最大效应浓度EC50)或慢性毒性数据(最大无影响浓度NOEC)除以评估因子(AF)得到。AF的数值采用欧盟技术指导性文件(TGD)的推荐值(Scheringer et al, 2002), 使用急性毒性数据EC50时AF为1 000; 使用慢性毒性数据NOEC时AF为100。当只有急性毒性数据可用时, 利用EC50除以AF(1 000)得到; 若同时存在急性和慢性毒性数据可用, 则利用NOEC除以AF(100)得到PNEC(Isidori et al, 2005)。表 3为抗生素对应最敏感物种的毒性数据。
1.6 质量控制与保证(QC/QA)采用文献方法(王凤美等, 2014)对测试过程进行质控(QC/QA)。设置溶剂空白, 全过程程序空白, 加标回收实验以及平行样品测定用于排除样品前处理与仪器分析过程对测试结果可能带来的影响。所需溶液、标液等现配现用, 避免对实验结果造成影响。两类空白实验结果表明, 所用溶剂、样品前处理以及仪器分析过程均不存在对目标物测定的干扰; 方法加标回收率在70.39%~116.33%之间, 以连续测定空白溶液响应值的10倍标准偏差表示的定量限(LOQ)为0.03~1.67 ng/L; 平行样测定(n=3)的相对标准偏差RSD≤20%。
1.7 数据分析与统计采样站位图使用ArcGIS 10.2 (Esri公司)绘制, 采用Excel 2019 (Microsoft微软公司)和Origin 2018 (OriginLab公司)软件进行数据处理和图表绘制, 采用SPSS statistics版本25 (IBM公司)进行斯皮尔曼相关性分析。
2 结果与讨论 2.1 黄河三角洲表层沉积物抗生素空间分布特征 2.1.1 抗生素检出率与浓度水平黄河三角洲表层沉积物抗生素总体检出率为52.8%, 所有类型的抗生素都有一定程度的检出。检出率排序为: MLs (74.7%) > QNs (69.8%) > TCs (44.4%) > SAs (39.3%), 检出浓度范围为nd (未检出)~22.6 ng/g, 平均检出浓度为0.78 ng/g (表 4)。与其他地区相比, HRD表层沉积物抗生素的残留水平相对较低。例如, 珠三角地区的QNs、SAs和TCs的平均浓度分别为195.3、114.8和84.8 ng/g (Li et al, 2011); 长三角地区TCs浓度范围为nd~ 373.2 ng/g (Zhao et al, 2018); 京津冀城市群土壤抗生素平均浓度为21.79 ng/g (Li et al, 2023)。可能与人口密度、地区经济发展水平、产业结构, 以及环境和气候条件等有关。
| 抗生素 | 平均值/(ng/g) | 中位数/(ng/g) | 最大值/(ng/g) | 最小值/(ng/g) | 检出率/% | |
| SAs | SDZ | 0.3 | nd | 5.8 | nd | 31.5 |
| SMR | 0.4 | nd | 7.2 | nd | 35.2 | |
| SMX | 0.3 | nd | 8.1 | nd | 37.0 | |
| SMZ | 0.5 | 0.01 | 8.3 | nd | 72.2 | |
| STZ | 0.2 | nd | 3.9 | nd | 20.4 | |
| QNs | ENR | 0.4 | 0.04 | 7.0 | nd | 77.8 |
| NOR | 2.7 | 0.90 | 22.6 | nd | 59.3 | |
| OFL | 1.1 | 0.02 | 22.4 | nd | 72.2 | |
| MLs | CTM | 0.1 | 0.02 | 1.5 | nd | 70.4 |
| ENY | 0.1 | 0.02 | 1.0 | nd | 66.7 | |
| ENY-H2O | 0.2 | 0.05 | 4.1 | nd | 87.0 | |
| CTC | 0.4 | nd | 3.6 | nd | 22.2 | |
| TCs | OTC | 4.8 | 1.2 | 49.7 | nd | 53.7 |
| TET | 0.5 | 0.3 | 2.3 | nd | 57.4 | |
| 平均值/(%) | 中位数/(%) | 最大值/(%) | 最小值/(%) | |||
| 沉积物类型 | 砂土 | 18.91 | 14.63 | 71.08 | 1.01 | |
| 粉砂 | 69.20 | 72.24 | 83.42 | 24.22 | ||
| 黏土 | 11.89 | 9.69 | 35.06 | 2.61 | ||
| 注: nd表示未检出 | ||||||
磺胺类抗生素检出率最低, 浓度水平仅高于MLs, 可能与其吸附分配系数Kd (表征抗生素在沉积物-水体间的吸附交换能力)较小有关(Kemper, 2008)。QNs的浓度水平和检出率都处于较高水平, 是HRD最严重的抗生素污染。一方面是QNs在沉积物中不易分解, 容易被吸附固定; 另一方面是QNs具有抗菌谱广、作用强的特点, 使用频率和使用量较高。其中诺氟沙星(NOR)的浓度水平明显高于其他两种QNs, 主要原因是NOR在人类医疗和动物疾病治疗都有使用, 而氧氟沙星(OFL)和恩诺沙星(ENR)则相对应用单一(前者只用于人类疾病防治, 后者只用作动物用药)(Liang et al, 2013)。
大环内酯类抗生素的检出率虽高, 但其浓度水平是所有类型抗生素中最低的。红霉素(ERY)在H+的作用下能够脱水形成ERY-H2O(Schafhauser et al, 2018), ERY-H2O的检出率和浓度水平都高于ERY, 说明其主要以脱水形式赋存在沉积物中。TCs的浓度水平最高, 其中土霉素(OTC)尤为突出, 主要是因为OTC具有广谱抗菌活性, 成本低且应用范围广, 是人类疾病治疗、动物疫病控制和农业饲料添加剂的主要抗生素之一(Franklin et al, 2022)。
水环境中的抗生素绝大多数都是人工合成的, 它们首先主要通过生活污水、养殖污水排放等途径进入水体, 经过复杂的物理、化学和生物等过程在沉积物中积累。根据它们的辛醇-水分配系数(logKow, 表 1), 结合本研究测定的沉积物TOC含量, 计算得到抗生素在沉积物和水体之间的吸附分配系数(Kd)在6.36~3 819.81 L/kg之间, 其值越大表示抗生素在沉积物中的吸附能力越强。同时, 沉积物通常富含大量的有机残体等还原性物质, 这些还原性物质的分解会消耗其间隙水和上覆水的溶解氧, 导致沉积物处于相对厌氧环境中(贾滨洋等, 2013), 不利于抗生素的降解(赵方凯等, 2017), 这都会导致抗生素容易在沉积物中残留较长时间, 加上持续不断的输入, 使其在沉积物中经常表现出“假持久性”。
2.1.2 抗生素空间分布特征不同站位间的抗生素类型以及浓度水平见图 2。北部区域以QNs和TCs为主, 浓度水平呈现出从二河TR、三河SR到黄河故道OW (从西向东), 从上游到下游(从南到北)逐渐升高的趋势。TR与SR在下游交汇并汇入渤海, 河道较窄, 河流量小, 总体浓度水平明显低于OW; OW虽然不再承担入海口的功能, 但其河道较宽(700~1 500 m), 年均径流量(3.65亿m3)大于TR (1.23亿m3)与SR (2.33亿m3), 且OW沿岸主要为居民区, 上游输入以及本地的生活污水和养殖废水对其抗生素浓度的贡献不容忽视(Ji et al, 2020)。
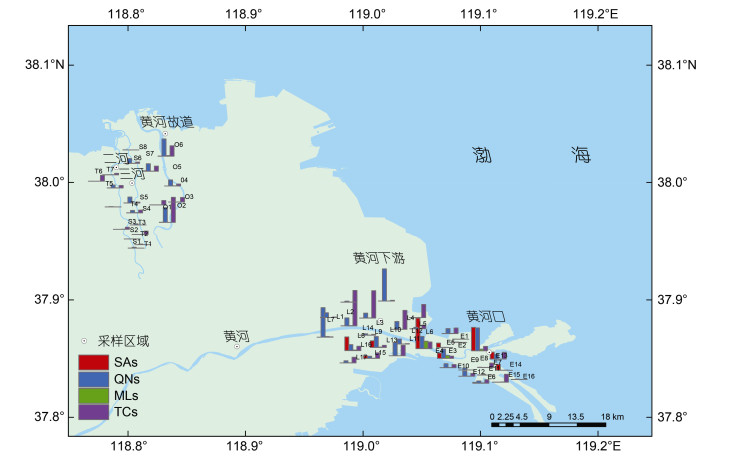 |
| 图 2 黄河三角洲抗生素浓度空间分布 Fig. 2 Spatial distribution of antibiotic concentrations |
南部区域也以QNs和TCs为主, 整体浓度水平以及站位间的差异明显高于北部区域, 主要原因是南部区域的人口密度高于北部区域, 并且还受到来自黄河上游人类活动的输入压力以及黄河入海口独特的水文条件影响, 使抗生素在该区域的累积较为严重。南部区域抗生素整体上并没有表现出明显的沿岸变化规律, 但LYR的抗生素平均浓度为3.7 ng/g, 高于YRE (1.7 ng/g)。LYR地处农作物种植区, 人口相对密集, 并且畜牧业和水产养殖业发达, 抗生素的用量更高; YRE地处自然保护区内, 受到的人类活动影响则相对较小, 因而本地的区域性输入较少, 整体浓度低于LYR。但YRE区域受河流输入和近海潮汐作用等多因素制衡, 抗生素类型和浓度分布更加多元化。
图 3反映了黄河三角洲表层沉积物抗生素含量的对比。很显然, QNs和TCs是HRD南北两个区域最主要的抗生素类型, 两者含量从西向东逐渐升高, 在LYR达到最高值, 然后在YRE降低。此外, YRE区域SAs的含量较高, 主要是因为其水溶性较大(表 1), 因而其赋存于河水中随水体迁移的能力高于其他种类的抗生素(卫承芳等, 2022); 黄河上游河水中的SAs被泥沙裹挟一同输入到YRE, 然后在河-海-陆相互作用下与沉积物不断进行物质交换的同时沉积在该区域, 导致该区域沉积物中SAs的含量相对较高。MLs检出率最高, 但整体含量较低且各区域浓度差异较小, 一种可能原因是其应用范围广但用量相对于QNs和TCs较少; 另一种可能原因是其在沉积物中的Kd较小但较稳定, 因而广泛分布于沉积物中。
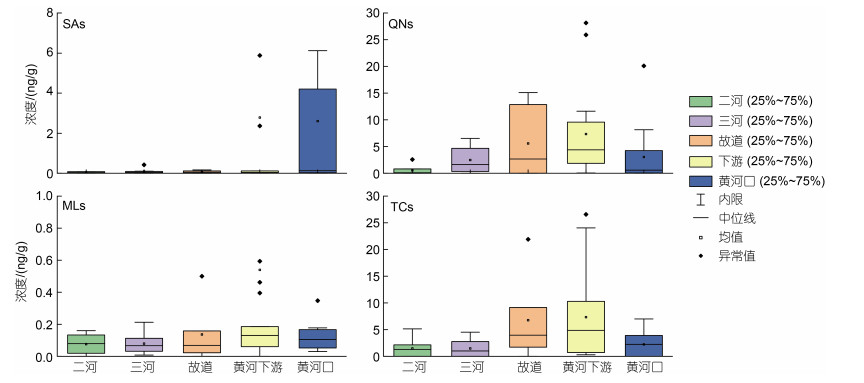 |
| 图 3 黄河三角洲不同区域表层沉积物中抗生素含量对比 Fig. 3 Comparison of antibiotic concentrations in surface sediments from different sampling plots 注: 四类抗生素含量的箱体长度以75%上四分位数(Q3)至25%下四分位数(Q1)表示; IQR表示四分位距; 内限设置为Q3+1.5 IQR~ Q1−1.5 IQR箱体上、下边缘之间; 不在内限范围的数值为异常值。 |
抗生素在沉积物中的吸附能力强弱顺序为: TCs > QNs > MLs > SAs (Chang et al, 2010), 吸附能力强弱对其能否赋存于沉积物中起到非常重要的作用。QNs和TCs含有较多的活性官能团, 能够通过离子交换等机制吸附于沉积物上, 而沉积物中的电荷主要来自于土壤中的黏土和有机质; 黏土和有机质的比表面积大, 官能团复杂, 含量升高会增加土壤表面的吸附位点, 对QNs和TCs起到更强的吸附作用(Zhang et al, 2008)。
为探究HRD表层沉积物中抗生素含量与沉积物的理化性质是否相关, 首先对沉积物有机质含量、粒径等理化性质, 以及沉积物中不同类型抗生素含量的数据进行正态分布检验(K-S检验), 表明绝大多数数据不服从正态分布, 因此选择斯皮尔曼相关性分析, 结果见表 5。其中QNs与TOC成显著性正相关(P<0.05), TCs与砂土含量呈显著性负相关(P<0.01), 与粉砂和黏土含量呈显著性正相关(P<0.05), SAs和MLs与沉积物类型和TOC没有显著相关性。以上结果表明, HRD表层沉积物中较高含量的有机质以及黏土是导致QNs和TCs成为HRD沉积物中赋存的主要抗生素类型的重要原因。
| 有机碳 | 砂土 | 粉砂 | 黏土 | |
| SAs | −0.114 | −0.114 | 0.202 | 0.072 |
| QNs | 0.263* | −0.217 | 0.232 | 0.137 |
| MLs | −0.096 | −0.083 | 0.230 | 0.065 |
| TCs | 0.095 | −0.359** | 0.329* | 0.279* |
| 注: *: P<0.05水平上显著性相关; **: P<0.01水平上显著性相关 | ||||
根据表 3和表 4, 计算得到HRD表层沉积物14种抗生素的生态风险分布图(图 4)。结果显示, 不同站位SAs和MLs的RQ值均小于0.01, 暂无生态风险。对于QNs, ENR不存在风险站位; NOR有11个低风险站位; OFL有10个低风险站位, 1个中风险站位和1个高风险站位。对于TCs, CTC无风险站位; OTC有5个低风险站位; TET有7个低风险站位。QNs抗生素中, OFL的浓度水平明显低于NOR, 但其生态风险水平略高于NOR, 这一特点在TCs中也有所体现, 说明抗生素的浓度水平低并不一定代表其生态风险低, 还与其对水生生物的毒性大小和沉积物的理化性质有关。
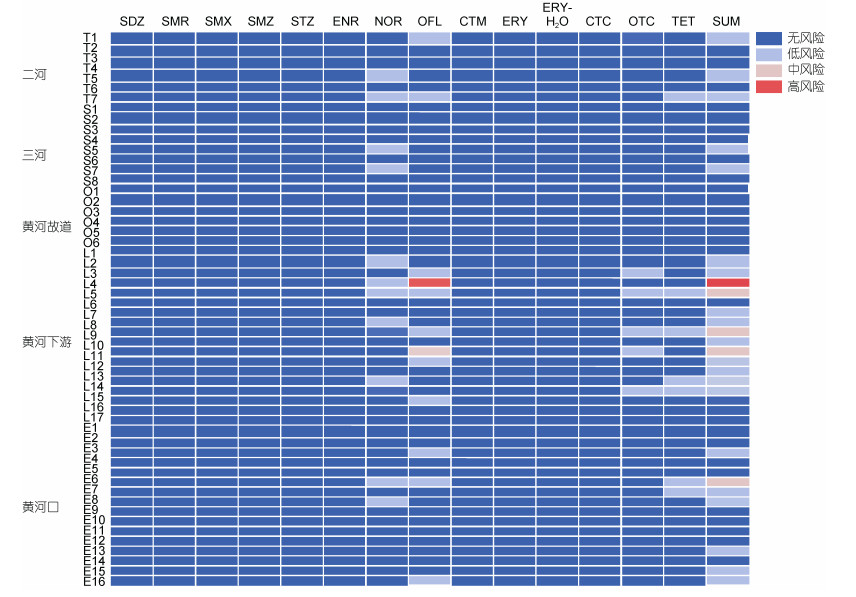 |
| 图 4 黄河三角洲表层沉积物中抗生素相关生态风险分布图 Fig. 4 Distribution of ecological risks related to antibiotics in the surface sediments |
不考虑抗生素之间可能产生的复合毒性, 对所有抗生素的RQ值进行加和得到不同站位的联合生态风险RQsum结果显示, 北部区域有5个低风险站位; 南部区域有15个低风险站位, 4个中风险站位和1个高风险站位, 其他均为无风险站位。说明南部区域具有生态风险的区域明显多于北部区域, 并主要集中在LYR, 这与抗生素浓度分布特征基本一致。
3 结论通过对2021年6月黄河三角洲南北两个区域沉积物中常见抗生素的浓度水平、空间分布特征和生态风险以及影响因素的探究, 得到如下主要结论:
(1) 黄河三角洲南部区域沉积物中抗生素的浓度水平高于北部区域, 主要类型是QNs和TCs。人口密度、农业畜牧业发展以及沉积物理化性质等都影响了抗生素空间分布特征。
(2) 黄河三角洲表层沉积物较高含量的有机质以及黏土是导致QNs和TCs成为HRD主要抗生素类型的重要影响因素。
(3) 黄河三角洲沉积物中抗生素的生态风险主要来源于QNs和TCs, SAs和MLs暂无生态风险; 抗生素的生态风险分布特征与其浓度分布特征并不完全一致, 不仅取决于其浓度, 还取决于其对非目标生物的毒性大小以及沉积物的理化性质。
致谢 感谢自然资源部第一海洋研究所陈军辉研究员在抗生素检测技术、仪器使用和数据分析等方面给予的大力支持与帮助。
于婉柔, 2021. 南水北调中线干渠抗生素污染分布特征及环境行为研究[D]. 北京: 北京交通大学.
|
卫承芳, 李佳乐, 孙占学, 等, 2022. 水-土壤环境中抗生素污染现状及吸附行为研究进展. 生态毒理学报, 17(3): 385-399 |
王凤美, 牛增元, 罗忻, 等, 2014. 超高效液相色谱-线性离子阱/静电场轨道阱质谱对化妆品中抗生素类成分的快速筛查和确证. 食品安全质量检测学报, 5(12): 3911-3921 DOI:10.19812/j.cnki.jfsq11-5956/ts.2014.12.027 |
赵方凯, 杨磊, 乔敏, 等, 2017. 土壤中抗生素的环境行为及分布特征研究进展. 土壤, 49(3): 428-436 DOI:10.13758/j.cnki.tr.2017.03.002 |
贾滨洋, 付文丽, 于静, 等, 2013. 三岔湖沉积物揭示的湖泊营养化进程与人类活动的关系. 中国环境科学, 33(9): 1638-1644 |
BACKHAUS T, SCHOLZE M, GRIMME L H, 2000. The single substance and mixture toxicity of quinolones to the bioluminescent bacterium Vibrio fischeri. Aquatic Toxicology, 49(1/2): 49-61 DOI:10.1016/S0166-445X(99)00069-7 |
BIAŁK-BIELIŃSKA A, STOLTE S, ARNING J, et al, 2011. Ecotoxicity evaluation of selected sulfonamides. Chemosphere, 85(6): 928-933 DOI:10.1016/j.chemosphere.2011.06.058 |
CHANG X S, MEYER M T, LIU X Y, et al, 2010. Determination of antibiotics in sewage from hospitals, nursery and slaughter house, wastewater treatment plant and source water in Chongqing region of Three Gorge Reservoir in China. Environmental Pollution, 158(5): 1444-1450 DOI:10.1016/j.envpol.2009.12.034 |
CHEN K, ZHOU J L, 2014. Occurrence and behavior of antibiotics in water and sediments from the Huangpu River, Shanghai, China. Chemosphere, 95: 604-612 DOI:10.1016/j.chemosphere.2013.09.119 |
CHENG D M, LIU X H, WANG L, et al, 2014. Seasonal variation and sediment–water exchange of antibiotics in a shallower large lake in North China. Science of the Total Environment, 476/477: 266-275 DOI:10.1016/j.scitotenv.2014.01.010 |
DONG Y C, LI F T, WANG Y, 2020. Low-dimension nanomaterial-based sensing matrices for antibiotics detection: a mini review. Frontiers in Chemistry, 8: 551 DOI:10.3389/fchem.2020.00551 |
FERRARI B, MONS R, VOLLAT B, et al, 2004. Environmental risk assessment of six human pharmaceuticals: are the current environmental risk assessment procedures sufficient for the protection of the aquatic environment?. Environmental Toxicology and Chemistry, 23(5): 1344-1354 DOI:10.1897/03-246 |
FRANKLIN A M, WILLIAMS C, ANDREWS D M, et al, 2022. Sorption and desorption behavior of four antibiotics at concentrations simulating wastewater reuse in agricultural and forested soils. Chemosphere, 289: 133038 DOI:10.1016/j.chemosphere.2021.133038 |
GONZÁLEZ-PLEITER M, GONZALO S, RODEA-PALOMARES I, et al, 2013. Toxicity of five antibiotics and their mixtures towards photosynthetic aquatic organisms: implications for environmental risk assessment. Water Research, 47(6): 2050-2064 DOI:10.1016/j.watres.2013.01.020 |
GUO R X, CHEN J Q, 2012. Phytoplankton toxicity of the antibiotic chlortetracycline and its UV light degradation products. Chemosphere, 87(11): 1254-1259 DOI:10.1016/j.chemosphere.2012.01.031 |
HERNANDO M D, MEZCUA M, FERNÁNDEZ-ALBA A R, et al, 2006. Environmental risk assessment of pharmaceutical residues in wastewater effluents, surface waters and sediments. Talanta, 69(2): 334-342 DOI:10.1016/j.talanta.2005.09.037 |
HU X G, ZHOU Q X, LUO Y, 2010. Occurrence and source analysis of typical veterinary antibiotics in manure, soil, vegetables and groundwater from organic vegetable bases, northern China. Environmental Pollution, 158(9): 2992-2998 DOI:10.1016/j.envpol.2010.05.023 |
ISIDORI M, LAVORGNA M, NARDELLI A, et al, 2005. Toxic and genotoxic evaluation of six antibiotics on non-target organisms. Science of the Total Environment, 346(1/2/3): 87-98 DOI:10.1016/j.scitotenv.2004.11.017 |
JI H Y, PAN S Q, CHEN S L, 2020. Impact of river discharge on hydrodynamics and sedimentary processes at Yellow River Delta. Marine Geology, 425: 106210 DOI:10.1016/j.margeo.2020.106210 |
KEMPER N, 2008. Veterinary antibiotics in the aquatic and terrestrial environment. Ecological Indicators, 8(1): 1-13 DOI:10.1016/j.ecolind.2007.06.002 |
KOLAR B, ARNUŠ L, JERETIN B, et al, 2014. The toxic effect of oxytetracycline and trimethoprim in the aquatic environment. Chemosphere, 115: 75-80 DOI:10.1016/j.chemosphere.2014.02.049 |
LI M, YANG L, YEN H, et al, 2023. Occurrence, spatial distribution and ecological risks of antibiotics in soil in urban agglomeration. Journal of Environmental Sciences, 125: 678-690 DOI:10.1016/j.jes.2022.03.029 |
LI S, SHI W Z, LI H M, et al, 2018. Antibiotics in water and sediments of rivers and coastal area of Zhuhai City, Pearl River estuary, south China. Science of the Total Environment, 636: 1009-1019 DOI:10.1016/j.scitotenv.2018.04.358 |
LI Y W, WU X L, MO C H, et al, 2011. Investigation of sulfonamide, tetracycline, and quinolone antibiotics in vegetable farmland soil in the pearl river delta area, Southern China. Journal of Agricultural and Food Chemistry, 59(13): 7268-7276 DOI:10.1021/jf1047578 |
LI Z, LI M, ZHANG Z Y, et al, 2020. Antibiotics in aquatic environments of China: A review and meta-analysis. Ecotoxicology and Environmental Safety, 199: 110668 DOI:10.1016/j.ecoenv.2020.110668 |
LI Z Z, LIU Y D, ZHANG D H, et al, 2022. Distribution and environmental risk assessment of microplastics in continental shelf sediments in the southern East China Sea: a high-spatial-resolution survey. Marine Pollution Bulletin, 177: 113548 DOI:10.1016/j.marpolbul.2022.113548 |
LIANG X M, CHEN B W, NIE X P, et al, 2013. The distribution and partitioning of common antibiotics in water and sediment of the Pearl River Estuary, South China. Chemosphere, 92(11): 1410-1416 DOI:10.1016/j.chemosphere.2013.03.044 |
LIU D, XU Y Y, JUNAID M, et al, 2022. Distribution, transfer, ecological and human health risks of antibiotics in bay ecosystems. Environment International, 158: 106949 DOI:10.1016/j.envint.2021.106949 |
LUO Y, MAO D Q, RYSZ M, et al, 2010. Trends in antibiotic resistance genes occurrence in the Haihe River, China. Environmental Science & Technology, 44(19): 7220-7225 DOI:10.1021/es100233w |
LÜTZHØFT H C H, HALLING-SØRENSEN B, JØRGENSEN S E, 1999. Algal toxicity of antibacterial agents applied in danish fish farming. Archives of Environmental Contamination and Toxicology, 36(1): 1-6 DOI:10.1007/s002449900435 |
MA Y P, LI M, WU M M, et al, 2015. Occurrences and regional distributions of 20 antibiotics in water bodies during groundwater recharge. Science of the Total Environment, 518/519: 498-506 DOI:10.1016/j.scitotenv.2015.02.100 |
PARK K, KWAK I S, 2012. Gene expression of ribosomal protein mRNA in Chironomus riparius: effects of endocrine disruptor chemicals and antibiotics. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 156(2): 113-120 DOI:10.1016/j.cbpc.2012.05.002 |
RICO A, OLIVEIRA R, MCDONOUGH S, et al, 2014. Use, fate and ecological risks of antibiotics applied in tilapia cage farming in Thailand. Environmental Pollution, 191: 8-16 DOI:10.1016/j.envpol.2014.04.002 |
ROBINSON A A, BELDEN J B, LYDY M J, 2005. Toxicity of fluoroquinolone antibiotics to aquatic organisms. Environmental Toxicology and Chemistry, 24(2): 423-430 DOI:10.1897/04-210r.1 |
SARMAH A K, MEYER M T, BOXALL A B A, 2006. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics (VAs) in the environment. Chemosphere, 65(5): 725-759 DOI:10.1016/j.chemosphere.2006.03.026 |
SCHAFHAUSER B H, KRISTOFCO L A, DE OLIVEIRA C M R, et al, 2018. Global review and analysis of erythromycin in the environment: occurrence, bioaccumulation and antibiotic resistance hazards. Environmental Pollution, 238: 440-451 DOI:10.1016/j.envpol.2018.03.052 |
SCHERINGER M, STEINBACH D, ESCHER B, et al, 2002. Probabilistic approaches in the effect assessment of toxic chemicals. Environmental Science and Pollution Research, 9(5): 307-314 DOI:10.1007/BF02987572 |
SONG W W, LIAO Z Y, WANG L F, et al, 2022. The distribution and ecological risks of antibiotics in the sediments from a diverging area of the bifurcated river: Effects of hydrological properties. Journal of Environmental Management, 320: 115787 DOI:10.1016/j.jenvman.2022.115787 |
WANG R J, ZHANG J F, ZHANG D S, et al, 2022. Impacts of climate change on forest growth in saline-alkali land of Yellow River Delta, North China. Dendrochronologia, 74: 125975 DOI:10.1016/j.dendro.2022.125975 |
WATKINSON A J, MURBY E J, COSTANZO S D, 2007. Removal of antibiotics in conventional and advanced wastewater treatment: implications for environmental discharge and wastewater recycling. Water Research, 41(18): 4164-4176 DOI:10.1016/j.watres.2007.04.005 |
ZHANG G L, BAI J H, ZHAO Q Q, et al, 2016. Heavy metals in wetland soils along a wetland-forming chronosequence in the Yellow River Delta of China: Levels, sources and toxic risks. Ecological Indicators, 69: 331-339 DOI:10.1016/j.ecolind.2016.04.042 |
ZHANG J Q, DONG Y H, 2008. Effect of low-molecular-weight organic acids on the adsorption of norfloxacin in typical variable charge soils of China. Journal of Hazardous Materials, 151(2): 833-839 DOI:10.1016/j.jhazmat.2007.11.046 |
ZHANG W G, FENG H, CHANG J N, et al, 2009. Heavy metal contamination in surface sediments of Yangtze River intertidal zone: an assessment from different indexes. Environmental Pollution, 157(5): 1533-1543 DOI:10.1016/j.envpol.2009.01.007 |
ZHAO F K, CHEN L D, YANG L, et al, 2018. Distribution, dynamics and determinants of antibiotics in soils in a peri-urban area of Yangtze River Delta, Eastern China. Chemosphere, 211: 261-270 DOI:10.1016/j.chemosphere.2018.07.162 |
ZHAO J L, YING G G, LIU Y S, et al, 2010. Occurrence and risks of triclosan and triclocarban in the Pearl River system, South China: from source to the receiving environment. Journal of Hazardous Materials, 179(1/2/3): 215-222 DOI:10.1016/j.jhazmat.2010.02.082 |
ZHOU L J, YING G G, LIU S, et al, 2013. Occurrence and fate of eleven classes of antibiotics in two typical wastewater treatment plants in South China. Science of the Total Environment, 452/453: 365-376 DOI:10.1016/j.scitotenv.2013.03.010 |
ZHU Y G, JOHNSON T A, SU J Q, et al, 2013. Diverse and abundant antibiotic resistance genes in Chinese swine farms. Proceedings of the National Academy of Sciences of the United States of America, 110(9): 3435-3440 |
 2023, Vol. 54
2023, Vol. 54


