中国海洋湖沼学会主办。
文章信息
- 尹丽菁, 杨斌, 于红, 杨桂朋, 何真. 2023.
- YIN Li-Jing, YANG Bin, YU Hong, YANG Gui-Peng, HE Zhen. 2023.
- 温度和pCO2对中肋骨条藻释放挥发性卤代烃的影响
- EFFECTS OF TEMPERATURE AND pCO2 CHANGES ON THE RELEASE OF VOLATILE HALOCARBON FROM SKELETONEMA COSTATUM
- 海洋与湖沼, 54(4): 1039-1047
- Oceanologia et Limnologia Sinica, 54(4): 1039-1047.
- http://dx.doi.org/10.11693/hyhz20221100304
文章历史
-
收稿日期:2022-11-19
收修改稿日期:2023-01-03
2. 北部湾大学 广西北部湾海洋环境变化与灾害研究重点实验室 广西钦州 535011
2. Guangxi Key Laboratory of Marine Disaster in the Beibu Gulf, Beibu Gulf University, Qinzhou 535011, China
自工业革命以来, 化石燃料的燃烧和城市化的加速发展造成人为二氧化碳(CO2)排放增加, 全球气候也因此发生了变化(Gu et al, 2017)。一方面, 大气中CO2分压(pCO2)的升高加剧了CO2在海洋中的溶解, 溶解性无机碳(DIC)体系变化导致海水pH值降低, 引起海洋酸化(ocean acidification, OA)(Wolf-Gladrow et al, 1999)。另一方面, 大气温室气体浓度的上升使全球平均气温每十年增加约0.2 ℃ (Hansen et al, 2006), 预计到2100年平均海面温度的上升幅度将在1.4~5.8 ℃ (Stocker et al, 2013)。受到OA和全球变暖等气候变化的影响, 海洋生态系统将发生一系列复杂变化。
挥发性卤代烃(volatile halocarbon, VHCs)是大气中一类重要的痕量温室气体, 其中包括短寿命挥发性溴代烃, 如一溴二氯甲烷(CHBrCl2)、二溴一氯甲烷(CHBr2Cl)、三溴甲烷(CHBr3)等(Jia et al, 2019)。VHCs在紫外线的照射下可以发生化学降解或者光降解产生卤素自由基(如Cl, Br等), 这些卤素自由基在对流层和平流层中参与化学反应, 不仅能够直接对大气臭氧造成破坏(Wayne et al, 1995), 而且也能影响大气中其他气体的浓度(如CH4, NO2), 从而影响全球气候变化(Cincinelli et al, 2012)。VHCs的来源主要包括海洋释放、工业释放和生物及煤燃烧, 其中海洋释放为主要来源, 占大气中短寿命挥发性溴代烃的90% (Carpenter et al, 2000; Abrahamsson et al, 2004)。研究表明海洋中VHCs由海洋大型藻类(Hughes et al, 2016)、浮游植物(Lim et al, 2017)、蓝藻及细菌产生释放(Hughes et al, 2013)。虽然大型藻类VHCs释放速率比浮游植物高1~2个数量级, 但是由于大型藻类仅在近岸海域分布, 而浮游植物在海洋中广泛分布, 因此, 浮游植物释放, 尤其是硅藻释放被认为是海洋VHCs的主要来源(Scarratt et al, 1996; Lim et al, 2018)。
海洋酸化和全球变暖可能会引发未来生态系统重组和海洋微藻群落组成的进一步变化(Brodie et al, 2014), 最终影响区域VHCs释放(Mtolera et al, 1996; Abrahamsson et al, 2003)。研究表明温度和pCO2作为外界环境胁迫使微藻细胞发生氧化应激产生更多的H2O2, 增加VHCs的释放以应对氧化应激(Abrahamsson et al, 2003)725。如Laturnus等(2000)研究了温度对南极微藻影响, 发现温度升高会增加CHBr3的产量。对南极赤潮藻的类似研究也表明, 将温度从12 ℃提高到23 ℃后, CHBr3的释放量增加了两倍左右(Abrahamsson et al, 2003)727。然而, 目前关于微藻释放VHCs对pCO2响应的研究还没有一致的结论。在对亚热带和热带海藻的研究中发现pCO2升高, VHCs释放量增加(Mithoo-Singh et al, 2017); Mtolera等(1996)93的研究指出当海水pH降低, CHBr3和CHBr2Cl的释放量减少。温度和pCO2的变化可以对海洋浮游植物的生长速率和光合作用产生交互作用(Feng et al, 2008), 但是现阶段关于温度和pCO2交互作用对海洋微藻VHCs释放的研究甚少。海洋硅藻是海洋中主要的生产者(Falkowski et al, 2004), 也是自然源VHCs的主要贡献者(倪洁等, 2020)。中肋骨条藻是我国近岸海域常见的浮游硅藻(霍文毅等, 2001)。因此, 本研究以赤潮藻中肋骨条藻为研究对象, 通过测定藻密度、叶绿素a浓度、活性氧(ROS)和最大光化学效率(Fv/Fm)等参数探究中肋骨条藻在全球变暖以及海洋酸化气候背景下CHBr3、CHBr2Cl和CHBrCl2释放情况。通过分析3种VHCs释放与生物量、ROS、Fv/Fm等与VHCs释放有关的生理参数之间的关系, 阐明温度及pCO2影响VHCs释放的作用机理。本研究将为评价全球气候变暖和海洋酸化对中肋骨条藻的生长及释放VHCs的影响提供科学依据。
1 材料与方法 1.1 藻类培养实验所用的中肋骨条藻取自中国海洋大学海洋污染生态化学实验室。所用海水取自我国东海, 分别用0.47和0.22 μm的醋酸纤维滤膜过滤。实验采用1 000 mL胶塞培养瓶, 培养瓶用10%的盐酸溶液浸泡24 h后用纯水冲洗3遍, 用Milli-Q水冲洗1遍, 最后将过滤海水与胶塞封口瓶一起放入高压灭菌锅经121 ℃高温灭菌20 min。
培养期间, 以现在大气中pCO2 (395 mg/L)以及环境温度(20 ℃)作为对照组(M1), 通过添加饱和CO2海水溶液(徐军田等, 2010), 达到现在大气pCO2的2倍(790 mg/L), 通过培养箱设置培养温度20和25 ℃, 设置实验组M2、M3和M4, 每组设置三个平行样。微藻初始藻密度为7.46×104 cells/mL, 培养期间需每天多次振荡培养瓶, 以防止藻类沉淀, 保证藻类生长状态良好及溶解气体保持稳定。接种后每隔2天上午9:00进行取样, 取样100 mL后, 补充相应海水并加饱和CO2培养液调节pCO2至设定值, 保持无顶空状态, 具体培养条件见表 1。
| 培养条件 | 对照组 | 实验组 | |||
| M1 | M2 | M3 | M4 | ||
| 环境因子 | T=20℃ pCO2=395 mg/L |
T=25℃ pCO2= 395 mg/L |
T=20℃ pCO2= 790 mg/L |
T=25 ℃ pCO2= 790 mg/L |
|
| 培养液 | f/2培养液(高温灭菌) | ||||
| 光暗周期 | 12 h︰12 h | ||||
| 光照强度 | 4 000 lux | ||||
| 光源 | 白色冷荧光灯管 | ||||
| 培养方式 | 半连续培养 | ||||
| 培养体积 | 1 000 mL, 无顶空 | ||||
藻细胞密度采用血细胞计数板在电子显微镜(CX31RTSF, 日本奥林巴斯)下计数; 叶绿素a浓度测定采用荧光分光光度计(日立F-4500)测定, 具体方法参照文献(Passow et al, 1994); Fv/Fm测定采用Aquapen AP110-C, 测定前进行15 min的暗处理; ROS的检测采用标准检测试剂盒(南京建成生物工程研究所), 具体方法参照文献(Lang et al, 2022)。
1.3 VHCs浓度的测定用气密性玻璃注射器(SGE, 澳大利亚)抽取30 mL藻液经0.45 μm聚醚砜滤膜过滤后注入吹扫捕集系统中的气提室, 采用流量为60 mL/min的高纯氮气吹扫14 min, 吹扫后的气体经高氯酸镁和载体氢氧化钠干燥后, 再用液氮(−176 ℃)冷阱捕集浓缩, 最后用沸水解吸4 min, 解吸后气体进入连接电子捕获检测器(ECD)的气相色谱仪(岛津GC2030)分析测定。使用VHCs液体混合标准样品(美国o2is公司; CHBrCl2, 2.019 mg/L; CHBr2Cl, 4.015 mg/L; CHBr3, 4.007 mg/L)和外标法对VHCs浓度进行定量分析, 该方法的检出限为0.01×10−12~0.22×10−12 mol/L, 相对标准偏差为1.83%~3.97%。具体方法见文献(Yuan et al, 2016)。
1.4 抑制率和促进率计算公式: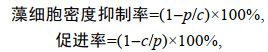 (1)
(1)其中, c和p分别为对照组和实验组的藻细胞密度。
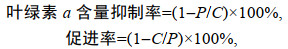 (2)
(2)其中, C和P分别为对照组和实验组的叶绿素a含量。
1.5 数据分析方法使用SPSS 22.0统计软件对本研究实验的结果进行了统计分析, 采用单因素方差分析, P<0.05表示有显著差异。
2 结果 2.1 微藻生物量和生理参数的变化 2.1.1 藻密度和叶绿素a浓度的变化在不同培养条件下, 中肋骨条藻在第1~5天处于快速增长期, 且均在第5天出现峰值, 在第5天进入稳定期后有所下降, 在7~11天内藻密度随培养时间变化不大, 在第13天, M3和M4组的藻密度明显降低(图 1a)。中肋骨条藻的叶绿素a浓度与藻密度的变化相似(图 1b)。与对照组M1相比, pCO2升高(M3)时叶绿素a浓度降低, 而温度升高(M2)时叶绿素a浓度增加。温度升高(M2)对藻密度的促进率在第7天达到最大值20.19%, 对叶绿素a的促进率在第5天达到最大值22.46% (图 1c)。pCO2升高(M3)对藻密度和叶绿素a的抑制率均在第13天达到最大值, 分别为58.87%和39.90% (图 1d)。
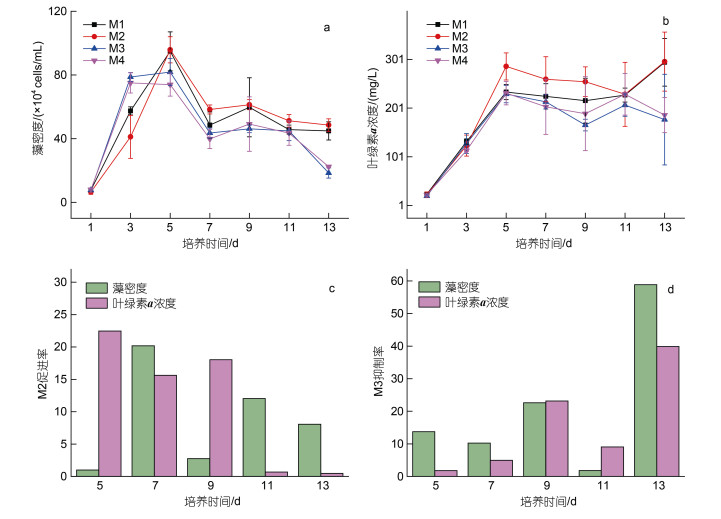 |
| 图 1 对照组(M1)以及实验组(M2~M4)中肋骨条藻藻密度(a)、叶绿素a浓度(b)、M2促进率(c)和M3抑制率(d)随培养时间的变化 Fig. 1 The change of density (a), chlorophyll a (b) in control group (M1) and experimental group (M2~M4), the promotion rate of M2 (c), the inhibition rate of M3 (d) with incubation time on Skeletonema costatum |
如图 2所示, 在不同培养条件下, 中肋骨条藻的初始Fv/Fm值相近(0.16~0.19), 在培养前3天迅速增加, 培养第3天出现Fv/Fm的峰值后开始降低, 至第9天出现Fv/Fm的最小值。温度升高时, Fv/Fm增加, 在第7天增加了37.86%。pCO2升高后, Fv/Fm降低, 在第11天降低了11.34%。由图 1d可知, pCO2升高后引起的海洋酸化会降低中肋骨条藻的藻密度, 由图 3可知, 不同处理组, Fv/Fm与藻密度之间存在显著正相关性(R=0.689, P<0.01), 表明pCO2升高对微藻的生长和光合作用均产生不利影响。
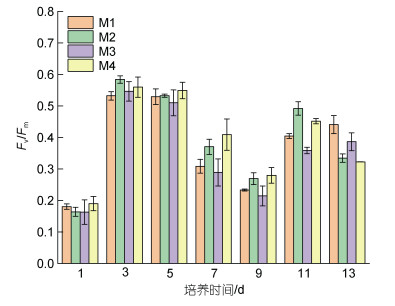 |
| 图 2 对照组(M1)以及实验组(M2~M4)中肋骨条藻的Fv/Fm随培养时间的变化 Fig. 2 The change of Fv/Fm in control group (M1) and experimental group (M2 ~ M4) with the incubation time on Skeletonema costatum |
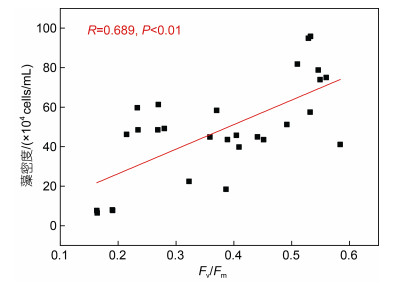 |
| 图 3 中肋骨条藻藻液藻密度与Fv/Fm的相关性 Fig. 3 Correlation between algal density and Fv/Fm on Skeletonema costatum |
如图 4所示, 培养第1天藻细胞内ROS值较高, 在第3~5天后有所降低, 在第7天和第11天出现ROS峰值。培养前3天, 与M1相比, M2组的ROS显著增加, 在第1天增加了70.64%, 在培养第5天后低于对照组M1; 而M3组ROS的产生降低, 在第11天降低了22.64%。上述结果表明温度和pCO2的改变均会影响藻细胞体内的ROS含量。
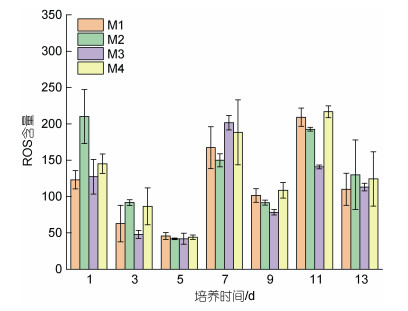 |
| 图 4 对照组(M1)以及实验组(M2~M4)中中肋骨条藻的ROS含量随培养时间的变化 Fig. 4 The change of ROS in control group (M1) and experimental group (M2~M4) with incubation time on Skeletonema costatum |
对照组M1在培养的前7天, CHBr3释放量缓慢增加(图 5a), M2组CHBr3释放量略有降低, 培养7天后, CHBr3释放量显著增加; M2组CHBr2Cl和CHBrCl2释放量前7天缓慢增加后降低, 均在第7天出现最小值(图 5b), 而对照组M1在第7天出现极大值。CHBrCl2的释放量显著高于CHBr3和CHBr2Cl, 且随培养时间变化呈现M形; 温度升高导致CHBr3和CHBr2Cl释放量峰值提前。通过比较3种三卤代甲烷的总释放量发现(图 5d, 5e, 5f), 高温组M2显著增加CHBr3、CHBr2Cl和CHBrCl2的总释放量, 分别增加了10.55%、9.45%和12.18%。
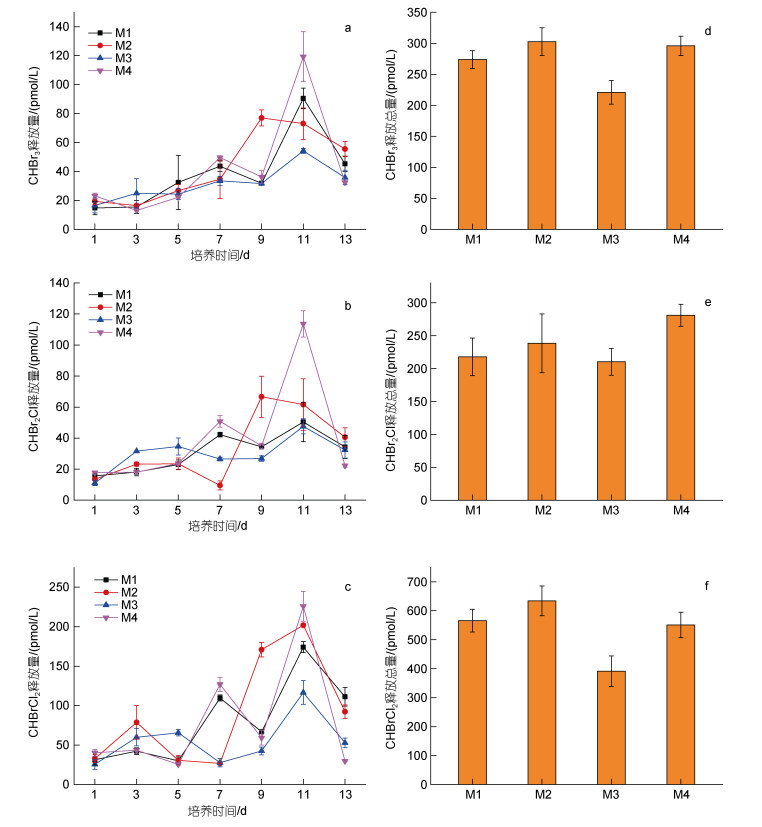 |
| 图 5 对照组(M1)以及实验组(M2~M4)中肋骨条藻CHBr3 (a)、CHBr2Cl (b)、CHBrCl2 (c)浓度随培养时间的变化及CHBr3、CHBr2Cl、CHBrCl2的释放总量(d, e, f) Fig. 5 Changes of CHBr3 (a), CHBr2Cl (b), and CHBrCl2 (c) released by Skeletonema costatum in the control group (M1) and experimental groups (M2~M4) with the incubation time and the total released amount of CHBr3 (d), CHBr2Cl (e), and CHBrCl2 (f) |
CHBr3、CHBr2Cl和CHBrCl2释放量在前5天缓慢增长(图 5a, 5b, 5c), 与对照组M1相比, M3组对CHBr3释放量的影响不明显, CHBr2Cl和CHBrCl2释放量显著升高; 培养5天后, M3组显著降低了CHBr3、CHBr2Cl和CHBrCl2的释放; 其释放量峰值均在第11天出现。CHBrCl2的释放量随培养时间变化为M形, 而CHBr3和CHBrCl2为单峰。通过比较3种三卤代甲烷的总释放量发现(图 5d, 5e, 5f), M3组显著降低了CHBr3和CHBrCl2的总释放量, 分别降低了19.29%和30.80%, 而对CHBr2Cl总释放量没有显著影响。
2.2.3 温度和pCO2的交互作用对VHCs释放的影响培养前5天, 与对照组M1相比, 温度和pCO2同时升高(M4)对CHBr3释放的影响并不明显(图 5a), 却显著促进了CHBr2Cl和CHBrCl2的释放(图 5b, 5c); 在培养后5天, M4组显著促进了3种三卤代甲烷的释放(图 5a, 5b, 5c), 且释放量峰值均出现在第11天, CHBr3、CHBr2Cl和CHBrCl2的总释放量分别增加了8.06%、29.02%和2.57%。
3 讨论 3.1 温度和pCO2对微藻生物量和生理参数的影响 3.1.1 温度和pCO2对藻密度和叶绿素a浓度的影响温度升高时, 中肋骨条藻的藻密度和叶绿素a均增加, 而pCO2升高时, 中肋骨条藻的藻密度和叶绿素a浓度均降低(图 1)。已有研究证实中肋骨条藻在温度由10 ℃升高到15 ℃后, 会导致叶绿素a浓度明显增加, 而不同pCO2在不同时期对叶绿素a浓度的影响并不显著(Bénard et al, 2019)。在pCO2升高时, 典型硅藻旋链角毛藻藻密度和叶绿素a浓度均会显著降低, 与本研究结论一致(于海潮等, 2020)。此外, 由于微藻生长对温度和pCO2等气候变化十分敏感, 其生长代谢酶的活性、碳吸收的光合作用和其他代谢过程均会受到温度和pCO2的影响(Li et al, 2020), 因此, 不同微藻的最佳生长温度和pCO2条件具有物种特异性, 也受不同培养条件的影响。
3.1.2 温度和pCO2对Fv/Fm的影响温度升高时, 中肋骨条藻Fv/Fm增加, 而pCO2升高时, 中肋骨条藻的Fv/Fm降低(图 2)。Fv/Fm是光反应中心(PSII)活性的重要指示, 能够反映温度和pCO2变化对中肋骨条藻光合作用的影响, 当微藻在适宜的环境中生长, Fv/Fm会逐渐达到最大值(Lang et al, 2022)。Keng等(2021)的研究发现, 4种热带海藻的Fv/Fm随着温度由20 ℃升高到25 ℃而增加, 并在适应生长条件后有所降低, 与本研究结果一致, 而在其温度升高到40 ℃后, Fv/Fm下降了90%, 表明光合作用严重受损。因此, 我们推测相较于20 ℃, 25 ℃时中肋骨条藻的光合作用增强。此外, Mithoo-Singh等(2017)的研究表明, pCO2升高会降低特定的褐藻的Fv/Fm, 与本文研究结果一致, 表明由pCO2升高引起的海水酸化对微藻的光合作用产生了不利影响。
3.1.3 温度和pCO2对ROS的影响温度升高会增加指数期中肋骨条藻藻细胞内的ROS (图 4)。随微藻生长逐步适应温度的升高, 其ROS水平降低。这些结果表明外界环境胁迫会促使藻细胞ROS的变化(Lang et al, 2022)。García-Gómez等(2014)的研究发现pCO2改变会影响微藻的ROS, 当pCO2升高, ROS降低。此外, 藻细胞内的ROS与Fv/Fm有关, Fv/Fm增加后微藻的光合活性增加, 进而产生更多的氧化应激(Dummermuth et al, 2003)。因此, 微藻生长对温度升高具有一个适应过程, 会通过增加微藻的Fv/Fm来增加微藻的光合作用, 进而在藻细胞内产生更多的ROS。
3.2 温度和pCO2对VHCs的影响 3.2.1 温度对VHCs的影响温度升高后, 3种VHCs释放量均增加且释放量峰值提前(图 5)。这与文献报道的结果类似, 已有研究证明CHBr3释放量随温度升高而增加(Borlongan et al, 2017)。温度升高会增加南极微藻CHBr3的产量(Laturnus et al, 2000)300。温度从12 ℃提高到17℃, 绿藻(Enteromorpha intestinalis) CHBr3的释放量增加了两倍左右(Abrahamsson et al, 2003)727。微藻VHCs释放量与藻细胞的生长阶段有关(Lim et al, 2018), 前5天微藻处于指数增长期时, 藻密度和叶绿素a浓度增加(图 1), 此时VHCs释放总量略有增加(图 5), 叶绿素a浓度与CHBr3、CHBr2Cl和CHBrCl2的释放量呈现显著正相关(R=0.396~0.507, P<0.05)(图 6)。此外, 温度的改变会诱导微藻细胞产生大量ROS, 其主成分之一的H2O2通过催化反应激活卤过氧化物酶的活性, 促进VHCs产生(Dietz, 2016)。在培养前5天, 温度升高会使藻细胞产生显著的氧化应激反应, 导致ROS在藻细胞中累积(图 4), 虽然这一时期藻密度不高(图 1a), 但VHCs释放量稍有增加。培养第7~11天, 微藻适应了温度的升高, 因此ROS值明显低于对照组。在培养的第11天, ROS出现峰值, 导致VHCs释放量出现峰值。总体而言, 温度可以通过影响藻细胞的生长、氧化应激、光合效能等影响VHCs的产生和释放。温度对海洋微藻产生VHCs的影响机制十分复杂, 有待进一步探究。
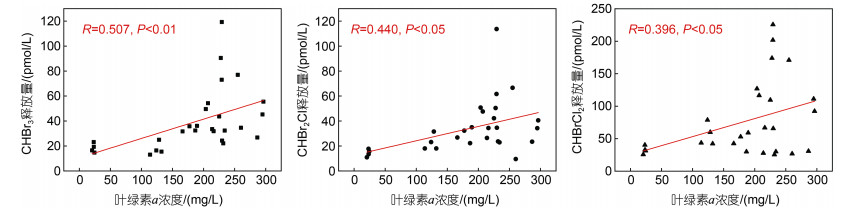 |
| 图 6 中肋骨条藻叶绿素a浓度与CHBr3、CHBr2Cl和CHBrCl2的相关性 Fig. 6 Correlation of chl a to CHBr3, CHBr2Cl, and CHBrCl2 on Skeletonema costatum |
pCO2升高促进微藻指数期的VHCs释放, 抑制微藻稳定期的VHCs释放, 对总释放量起抑制作用(图 5)。已有研究指出海水pH值由8.0降低到7.2, CHBr2Cl、CHBrCl2和CHBr3的释放量降低(Mithoo-Singh et al, 2017)。Mtolera等(1996)的研究指出, 海水pH值降低使CHBr2Cl和CHBrCl2的释放量减少; 此外, Hopkins等(2013)在北极地区进行的围隔实验指出, 升高pCO2对VHCs的影响不大, 但其室内培养实验结果表明, 升高pCO2, CHBr3释放量增加(Hopkins et al, 2013); Webb等(2016)在波罗的海的围隔实验也指出pCO2升高对CHBr3和CHBr2Cl的释放量没有影响。以上研究结果的不同, 可能由于研究不同海域、不同季节均会对实验结果产生不同的影响。另外, 不同藻类对环境变化和氧化应激的耐受和适应能力不同(Laturnus et al, 2000), 也会导致实验结果的差异。由图 1可知, 培养前5天, pCO2升高时, 藻密度略有升高, 此时VHCs释放量增加, 表明VHCs的释放量与生物量有关(倪洁等, 2020)122; 而培养5天后, pCO2升高时, 藻密度降低, 生物量减少, VHCs释放量减少。此外, pCO2升高会降低微藻的Fv/Fm (图 2), 同时结合Fv/Fm与藻密度之间的显著正相关性(图 3), 推测pCO2升高对微藻的生长和光合作用均产生不利影响, 进而抑制了VHCs的释放。已有研究表明, pCO2升高后, 会影响藻细胞对无机碳的获取, 进而改变其生长速率(Li et al, 2018)。此外, 细胞代谢酶的反应速率依赖于pH值, 因此偏离最佳pH值可能会削弱细胞功能(Hinga, 2002)。酸化还会引起海水化学性质的改变, 影响金属吸附相和溶解相之间平衡, 进而导致微量金属的在海水中的组分发生变化, 并增加铜等元素的毒性(Granéli et al, 1993)。因此, 酸化可能通过多种机制对藻细胞产生负面影响, 进而抑制了VHCs的释放。
3.2.3 温度和pCO2的交互作用对VHCs的影响pCO2升高会抑制3种VHCs的释放, 酸化基础上升高5 ℃, 将促进VHCs的释放, 温度对VHCs的促进作用高于pCO2的抑制作用(图 5)。温度和pCO2胁迫通过直接或间接的方式影响了藻细胞的光合作用、酶的活性, 进而影响了VHCs的释放。已有研究证明温度和pCO2交互作用下, 温度对硅藻生长的影响更显著(Feng et al, 2008)95, Olischläger等(2013)的报道指出预测的海洋酸化水平可能会加剧升温对微藻生长和光合作用的影响。与pCO2升高相比, 温度和pCO2同时升高促进了Fv/Fm的增加(图 3)和ROS的产生(图 4)。这说明在温度和pCO2的交互作用下, VHCs释放主要受藻细胞生理状态如微藻的生长、ROS和光合活性的影响。ROS增加后由卤过氧化物酶催化H2O2进行卤化反应产生抗氧化应激的VHCs, Fv/Fm的增加表明微藻的光合活性增加, 导致VHCs释放量增加。综上所述, 温度和pCO2同时升高对中肋骨条藻VHCs释放产生了协同效应, 进一步加剧了温室气体VHCs的释放。关于温度和pCO2的交互作用对VHCs释放的影响还需要进一步的探究。
4 结论(1) 温度升高促进中肋骨条藻VHCs的释放, 与对照组T=20 ℃相比, 25 ℃时CHBr3、CHBr2Cl和CHBrCl2的释放量分别增加了10.55%、9.45%和12.18%; 温度升高时, 指数期中肋骨条藻的Fv/Fm和ROS均增加, 表明温度升高通过促进微藻的光合作用产生更多的氧化应激, 进而促进VHCs的释放。
(2) pCO2升高抑制中肋骨条藻VHCs的释放, 与对照组pCO2=395 mg/L相比, pCO2=790 mg/L时CHBr3和CHBrCl2释放量的抑制率分别高达19.29%和30.80%; pCO2升高时, 藻密度、叶绿素a浓度和Fv/Fm均会降低, 且叶绿素a浓度与Fv/Fm存在显著相关性(R=0.689, P<0.01), 表明由pCO2升高引起的海水酸化通过抑制微藻的生长和光合作用, 进而抑制VHCs的释放。
(3) 温度和pCO2同时升高促进中肋骨条藻VHCs的释放, 与对照组相比, T=25 ℃、pCO2=790 mg/L时CHBr3、CHBr2Cl和CHBrCl2释放的促进率分别为8.06%、29.02%和2.57%, 这进一步表明, 温度和pCO2同时升高对中肋骨条藻VHCs释放产生了协同效应, 进一步加剧了温室气体VHCs的释放。
于海潮, 张洪海, 高旭旭, 等, 2020. 温度和pH变化对旋链角毛藻生长及释放二甲基硫化物的影响. 中国海洋大学学报, 50(7): 94-100 |
倪洁, 刘珊珊, 陈妍, 等, 2020. 光照和硝酸盐浓度对东海原甲藻和三角褐指藻释放挥发性卤代烃的影响. 海洋学报, 42(12): 119-128 |
徐军田, 高坤山, 2010. 二氧化碳和阳光紫外辐射对龙须菜生长和光合生理的影响. 海洋学报, 32(5): 144-151 |
霍文毅, 俞志明, 邹景忠, 等, 2001. 胶州湾中肋骨条藻赤潮与环境因子的关系. 海洋与湖沼, 32(3): 311-318 |
ABRAHAMSSON K, BERTILSSON S, CHIERICI M, et al, 2004. Variations of biochemical parameters along a transect in the Southern Ocean, with special emphasis on volatile halogenated organic compounds. Deep Sea Research Part Ⅱ: Topical Studies in Oceanography, 51(22/23/24): 2745-2756 |
ABRAHAMSSON K, CHOO K S, PEDERSÉN M, et al, 2003. Effects of temperature on the production of hydrogen peroxide and volatile halocarbons by brackish-water algae. Phytochemistry, 64(3): 725-734 DOI:10.1016/S0031-9422(03)00419-9 |
BÉNARD R, LEVASSEUR M, SCARRATT M, et al, 2019. Contrasting effects of acidification and warming on dimethylsulfide concentrations during a temperate estuarine fall bloom mesocosm experiment. Biogeosciences, 16(6): 1167-1185 DOI:10.5194/bg-16-1167-2019 |
BORLONGAN I A G, GERUNG G S, NISHIHARA G N, et al, 2017. Light and temperature effects on photosynthetic activity of Eucheuma denticulatum and Kappaphycus alvarezii (brown and green color morphotypes) from Sulawesi Utara, Indonesia. Phycological Research, 65(1): 69-79 DOI:10.1111/pre.12155 |
BRODIE J, WILLIAMSON C J, SMALE D A, et al, 2014. The future of the northeast Atlantic benthic flora in a high CO2 world. Ecology and Evolution, 4(13): 2787-2798 DOI:10.1002/ece3.1105 |
CARPENTER L J, LISS P S, 2000. On temperate sources of bromoform and other reactive organic bromine gases. Journal of Geophysical Research: Atmospheres, 105(D16): 20539-20547 DOI:10.1029/2000JD900242 |
CINCINELLI A, PIERI F, ZHANG Y, et al, 2012. Compound Specific Isotope Analysis (CSIA) for chlorine and bromine: a review of techniques and applications to elucidate environmental sources and processes. Environmental Pollution, 169: 112-127 DOI:10.1016/j.envpol.2012.05.006 |
DIETZ K J, 2016. Thiol-based peroxidases and ascorbate peroxidases: why plants rely on multiple peroxidase systems in the photosynthesizing chloroplast?. Molecules and Cells, 39(1): 20-25 DOI:10.14348/molcells.2016.2324 |
DUMMERMUTH A L, KARSTEN U, FISCH K M, et al, 2003. Responses of marine macroalgae to hydrogen-peroxide stress. Journal of Experimental Marine Biology and Ecology, 289(1): 103-121 DOI:10.1016/S0022-0981(03)00042-X |
FALKOWSKI P G, KATZ M E, KNOLL A H, et al, 2004. The evolution of modern eukaryotic phytoplankton. Science, 305(5682): 354-360 DOI:10.1126/science.1095964 |
FENG Y Y, WARNER M E, ZHANG Y H, et al, 2008. Interactive effects of increased pCO2, temperature and irradiance on the marine coccolithophore Emiliania huxleyi (Prymnesiophyceae). European Journal of Phycology, 43(1): 87-98 DOI:10.1080/09670260701664674 |
GARCÍA-GÓMEZ C, GORDILLO F J L, PALMA A, et al, 2014. Elevated CO2 alleviates high PAR and UV stress in the unicellular chlorophyte Dunaliella tertiolecta. Photochemical & Photobiological Sciences, 13(9): 1347-1358 |
GRANÉLI E, HARALDSSON C, 1993. Can increased leaching of trace metals from acidified areas influence phytoplankton growth in coastal waters?. Ambio, 22(5): 308-311 |
GU X Y, LI K Q, PANG K, et al, 2017. Effects of pH on the growth and NH4-N uptake of Skeletonema costatum and Nitzschia closterium. Marine Pollution Bulletin, 124(2): 946-952 DOI:10.1016/j.marpolbul.2017.01.048 |
HANSEN J, SATO M, RUEDY R, et al, 2006. Global temperature change. Proceedings of the National Academy of Sciences of the United States of America, 103(39): 14288-14293 |
HINGA K R, 2002. Effects of pH on coastal marine phytoplankton. Marine Ecology Progress Series, 238: 281-300 DOI:10.3354/meps238281 |
HOPKINS F E, KIMMANCE S A, STEPHENS J A, et al, 2013. Response of halocarbons to ocean acidification in the Arctic. Biogeosciences, 10(4): 2331-2345 DOI:10.5194/bg-10-2331-2013 |
HUGHES C, JOHNSON M, UTTING R, et al, 2013. Microbial control of bromocarbon concentrations in coastal waters of the western Antarctic Peninsula. Marine Chemistry, 151: 35-46 DOI:10.1016/j.marchem.2013.01.007 |
HUGHES C, SUN S, 2016. Light and brominating activity in two species of marine diatom. Marine Chemistry, 181: 1-9 DOI:10.1016/j.marchem.2016.02.003 |
JIA Y, TEGTMEIER S, ATLAS E, et al, 2019. How marine emissions of bromoform impact the remote atmosphere. Atmospheric Chemistry and Physics, 19(17): 11089-11103 DOI:10.5194/acp-19-11089-2019 |
KENG F S L, PHANG S M, ABD RAHMAN N, et al, 2021. Halocarbon emissions by selected tropical seaweeds exposed to different temperatures. Phytochemistry, 190: 112869 DOI:10.1016/j.phytochem.2021.112869 |
LANG X P, NI J, HE Z, 2022. Effects of polystyrene microplastic on the growth and volatile halocarbons release of microalgae Phaeodactylum tricornutum. Marine Pollution Bulletin, 174: 113197 DOI:10.1016/j.marpolbul.2021.113197 |
LATURNUS F, GIESE B, WIENCKE C, et al, 2000. Low-molecular-weight organoiodine and organobromine compounds released by polar macroalgae–The influence of abiotic factors. Fresenius' Journal of Analytical Chemistry, 368(2/3): 297-302 |
LI P F, YANG G P, LIU C Y, 2020. Combined effects of elevated temperature and pCO2 on the production of DMSP and DMS in the culture of Amphidinium carterae. Journal of Applied Phycology, 32(2): 1063-1074 DOI:10.1007/s10811-020-02058-8 |
LI P F, YANG G P, ZHANG J, et al, 2018. Impacts of elevated pCO2 on trace gas emissions in two microalgae: Phaeocystis globosa and Nitzschia closterium. Environmental Chemistry, 14(7): 425-441 |
LIM Y K, PHANG S M, ABDUL RAHMAN N, et al, 2017. Halocarbon emissions from marine phytoplankton and climate change. International Journal of Environmental Science and Technology, 14(6): 1355-1370 DOI:10.1007/s13762-016-1219-5 |
LIM Y K, PHANG S M, STURGES W T, et al, 2018. Emission of short-lived halocarbons by three common tropical marine microalgae during batch culture. Journal of Applied Phycology, 30(1): 341-353 DOI:10.1007/s10811-017-1250-z |
MITHOO-SINGH P K, KENG F S L, PHANG S M, et al, 2017. Halocarbon emissions by selected tropical seaweeds: species-specific and compound-specific responses under changing pH. PeerJ, 5: e2918 DOI:10.7717/peerj.2918 |
MTOLERA M S P, COLLÉN J, PEDERSÉN M, et al, 1996. Stress-induced production of volatile halogenated organic compounds in Eucheuma denticulatum (Rhodophyta) caused by elevated pH and high light intensities. European Journal of Phycology, 31(1): 89-95 |
OLISCHLÄGER M, WIENCKE C, 2013. Ocean acidification alleviates low-temperature effects on growth and photosynthesis of the red alga Neosiphonia harveyi (Rhodophyta). Journal of Experimental Botany, 64(18): 5587-5597 |
PASSOW U, ALLDREDGE A L, LOGAN B E, 1994. The role of particulate carbohydrate exudates in the flocculation of diatom blooms. Deep Sea Research Part Ⅰ: Oceanographic Research Papers, 41(2): 335-357 |
SCARRATT M G, MOORE R M, 1996. Production of methyl chloride and methyl bromide in laboratory cultures of marine phytoplankton. Marine Chemistry, 54(3/4): 263-272 |
STOCKER T F, QIN D, PLATTNER G K, et al, 2014. Climate Change 2013: The Physical Science Basis. Working Group Ⅰ to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge, UK: Cambridge University Press, 1-1552
|
WAYNE R P, POULET G, BIGGS P, et al, 1995. Halogen oxides: radicals, sources and reservoirs in the laboratory and in the atmosphere. Atmospheric Environment, 29(20): 2677-2881 |
WEBB A L, LEEDHAM-ELVIDGE E, HUGHES C, et al, 2016. Effect of ocean acidification and elevated fCO2 on trace gas production by a Baltic Sea summer phytoplankton community. Biogeosciences, 13(15): 4595-4613 |
WOLF-GLADROW D A, RIEBESELL U, BURKHARDT S, et al, 1999. Direct effects of CO2 concentration on growth and isotopic composition of marine plankton. Tellus B: Chemical and Physical Meteorology, 51(2): 461-476 |
YUAN D, YANG G P, HE Z, 2016. Spatio-temporal distributions of chlorofluorocarbons and methyl iodide in the Changjiang (Yangtze River) estuary and its adjacent marine area. Marine Pollution Bulletin, 103(1/2): 247-259 |
 2023, Vol. 54
2023, Vol. 54


