
中国海洋湖沼学会主办。
文章信息
- 史竞园, 刘云, 张樱馨, 张绪涛, 宋书群, 李才文. 2023.
- SHI Jing-Yuan, LIU Yun, ZHANG Ying-Xin, ZHANG Xu-Tao, SONG Shu-Qun, LI Cai-Wen. 2023.
- 不同氮源、磷源对链状裸甲藻生长与酶活性的影响
- EFFECTS OF NITROGEN AND PHOSPHORUS SOURCES ON GROWTH AND ASSIMILATION ENZYMES OF DINOFLAGELLATE GYMNODINIUM CATENATUM
- 海洋与湖沼, 54(4): 1048-1057
- Oceanologia et Limnologia Sinica, 54(4): 1048-1057.
- http://dx.doi.org/10.11693/hyhz20221200334
文章历史
-
收稿日期:2022-12-18
收修改稿日期:2023-02-06
2. 崂山实验室 海洋生态与环境科学功能实验室 山东青岛 266237;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学研究中心 山东青岛 266071
2. Marine Ecology and Environmental Science laboratory, Laoshan Laboratory, Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
氮、磷作为许多生物活性物质的主要组成成分, 在海洋生命活动中起着非常重要的作用, 是浮游植物生长的营养盐限制因子(Yamamoto et al, 2004; Lee et al, 2012; Liu et al, 2015)。海洋中的氮和磷主要以无机态和有机态两种形式存在, 浮游植物可以直接吸收利用无机态营养盐, 也可以通过酶的作用水解有机态营养盐为无机态后再吸收(Oh et al, 2002; 张清春等, 2005)。其中, 参与氮同化的关键酶主要有硝酸还原酶(nitrate reductase, NR)、谷氨酰胺合成酶(glutamine synthetase, GS)和脲酶(urease, UE), 硝酸还原酶参与硝态氮的还原过程, 是藻细胞同化硝氮过程中的第一步; 谷氨酰胺合成酶催化铵氮的转氨基作用从而将铵氮转化为藻细胞可利用的氨基酸; 脲酶是将尿素催化水解转化为氨及氨基甲酸酯的重要酶, 这三种酶的活性通常被用于评价海洋浮游植物生长状态(Mobley et al, 1989; Iriarte et al, 2005; Berges et al, 2008; 钟娜等, 2008; Solomon et al, 2010)。此外, 浮游植物可以通过碱性磷酸酶(alkaline phosphatase, AkP)水解胞外有机态磷, 酸性磷酸酶(acid phosphatase, AcP)水解胞内磷来同化磷, 维持正常的生命活动(王艳等, 2006; 赵艳芳等, 2009)。
链状裸甲藻(Gymnodinium catenatum)隶属于甲藻纲, 裸甲藻目, 裸甲藻科, 裸甲藻属, 是已有报道中唯一一种可产生麻痹性贝类毒素的裸甲藻(Bolch et al, 2002; Cembella et al, 2018)。麻痹性贝类毒素可在食物链中传递, 通过堵塞肌纤维Na+通道抑制神经传导, 导致动物及人类中毒甚至死亡(Wang et al, 2016)。在中国近海, 链状裸甲藻营养细胞及孢囊分布广泛(Qi et al, 1996; Gu et al, 2013), 自2005年至今, 共引发赤潮12次(中国海洋生态环境状况公报, 2003~2018年), 其中在2017年的福建海域造成严重的中毒事件, 给当地水产养殖业带来巨大的经济损失(陈火荣, 2018; 梁玉波等, 2019)。可见, 链状裸甲藻已成为危害我国近海生态健康与食品安全的常见赤潮藻。
目前, 已有研究表明不同海域的链状裸甲藻藻株生长特性存在差别(Yamamoto et al, 2002; Lim et al, 2005), 而关于我国福建沿海链状裸甲藻藻株的生长特性的研究尚未见报道。因此, 本文通过比较不用形态氮源和磷源对链状裸甲藻生长和相关酶活性的影响, 探究其对不同氮源和磷源的适应性, 为揭示我国近海链状裸甲藻赤潮的发生机制提供参考资料。
1 材料与方法 1.1 实验材料实验用链状裸甲藻分离自福建厦门湾, 由国家海洋局第三海洋研究所提供。藻种采用f/2+Se培养基进行培养(Doblin et al, 2000)。培养温度为(20.0±0.1) ℃, 光暗比为12h︰12h, 光照强度约为70 μmol/(m2·s)。培养所用海水取自青岛太平湾海域, 盐度为30.0±0.1, 经0.22 μm孔径混合纤维膜过滤后, 121 ℃高温灭菌30 min后使用。
1.2 实验方法取指数生长期的链状裸甲藻藻液, 按照起始密度为400 cells/mL分别接种于180 mL的海水中, 饥饿48 h用于后续实验。
1.2.1 生长实验不同氮源培养组分别以NaNO3、NaNO2、NH4Cl、尿素为唯一氮源, 其他元素按照f/2+Se培养基配方添加。设置6个氮浓度: 0、25、50、100、200和800 μmol/L (按氮浓度计)。不同磷源培养组分别以NaH2PO4、6-磷酸葡萄糖(G-6-P)、β-甘油磷酸(β-G-P)和三磷酸腺苷(ATP)为唯一磷源, 其他元素按照f/2+Se培养基配方添加。设置6个磷浓度: 0、2、4、8、16和32 μmol/L (按磷浓度计)。具体实验设置见表 1。每个处理组设置3个平行, 每日多次摇晃, 防止藻细胞贴壁下沉。隔日于固定时间取1 mL藻液, 经Lugol’s碘液固定, 在倒置显微镜(SZ61, Olympus, 日本)下对藻细胞进行计数。
| 形态 | 氮浓度/(μmol/L) | 磷浓度/(μmol/L) |
| NaNO3 | 0、25、50、100、200、800 | 36 |
| NaNO2 | 0、25、50、100、200、800 | 36 |
| NH4Cl | 0、25、50、100、200、800 | 36 |
| 尿素 | 0、25、50、100、200、800 | 36 |
| NaH2PO4 | 883 | 0、2、4、8、16、32 |
| G-6-P | 883 | 0、2、4、8、16、32 |
| β-G-P | 883 | 0、2、4、8、16、32 |
| ATP | 883 | 0、2、4、8、16、32 |
氮源培养组分别以NaNO3、NaNO2、NH4Cl、尿素为唯一氮源, 设置氮浓度为100 μmol/L, 其他元素按照f/2+Se培养基配方添加, 每个处理组设置9个平行。在第4、8、12天取藻液50 mL, 之后在4 ℃, 3 000 g下离心5 min收集藻细胞, 加入相应试剂盒中缓冲液后于4 ℃下以3 m/s速度匀质化处理60 s。然后于4 ℃ 8 000 r/min下离心5 min, 取上清液用于氮相关酶活测定。硝酸还原酶采用硝酸还原酶活性检测试剂盒(索莱宝, 北京)进行测定, 谷氨酰胺合成酶采用谷氨酰胺合成酶试剂盒(科铭生物, 苏州)进行测定; 脲酶采用土壤脲酶试剂盒(南京建成, 南京)进行测定。测定过程均按照试剂盒说明进行。
磷源培养组分别以NaH2PO4、G-6-P、β-G-P和ATP为唯一磷源, 设置磷浓度为32 μmol/L, 其他元素按照f/2+Se培养基配方添加, 每个处理组设置9个平行。分别在第4、10、16天取藻液50 mL, 之后在4 ℃, 3 000 g下离心5 min收集藻细胞, 加入相应试剂盒中缓冲液后于4 ℃下以3 m/s匀质化处理60 s。然后于4 ℃ 8 000 r/min下离心5 min, 取上清液用于碱性磷酸酶和酸性磷酸酶活性测定。两种酶的检测分别使用碱性磷酸酶活性测定试剂盒和酸性磷酸酶活性测定试剂盒(科铭生物, 苏州)按照说明进行。
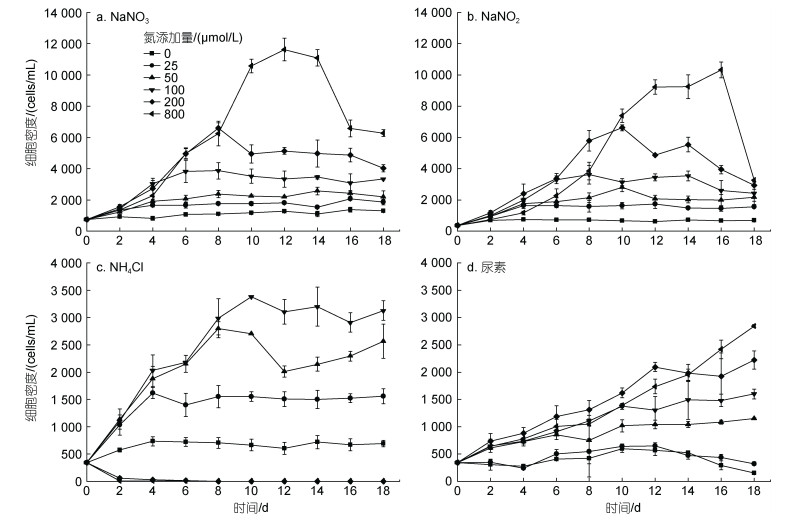
1.3 数据处理本研究采用的比生长率(μ)计算公式为:
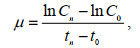 (1)
(1)式中, μ为链状裸甲藻的比生长率, 单位: d–1; C0和Cn分别为初始t0时刻的细胞密度和经过时间n后tn时刻的细胞密度, 单位: cells/mL。
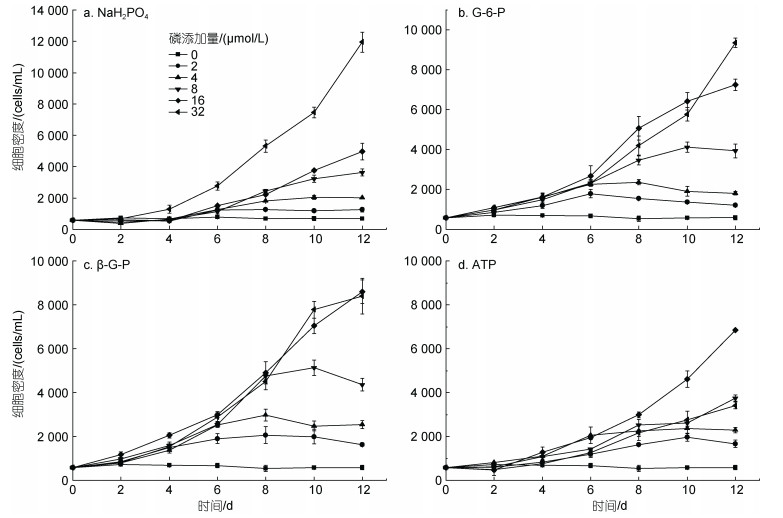
采用米氏方程拟合链状裸甲藻比生长率与营养盐浓度的关系(Monod, 1958):
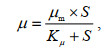 (2)
(2)式中, μ为链状裸甲藻比生长率, 单位: d–1; μm为链状裸甲藻最大比生长率, 单位: d–1; S为初始营养盐浓度, 单位: μmol/L; Kμ为半饱和常数, 单位: μmol/L, 其值为μ=μm/2时的营养盐浓度。
不同处理组藻最大细胞密度、比生长率及酶活性差异采用单因素方差分析(one-way ANOVA)进行统计(SPSS 20.0), 采用Origin Pro 2021软件对数据进行图表绘制。
2 结果与分析 2.1 不同氮源对链状裸甲藻生长的影响不同氮源对链状裸甲藻生长的影响如图 1所示。4种氮源均可促进链状裸甲藻的生长, 但生长状况不同。除0 μmol/L添加组外, 其余各组藻细胞均在接种后的第2天进入指数生长期。以NaNO3、NaNO2和尿素作为氮源时, 细胞密度均随着初始氮浓度的增加而增加(P<0.01), 当浓度为800 μmol/L时达到最高值, 分别为11 638、10 326和3 630 cells/mL。而以NH4Cl为氮源时, 在氮浓度0~100 μmol/L范围内, 细胞密度随初始氮浓度增加而增加, 100 μmol/L时达到最高值6 000 cells/mL (P<0.01); 200和800 μmol/L氮添加组的藻细胞在培养开始后迅速下降, 于第4天时降至0 cells/mL。
 |
| 图 1 不同氮形态和浓度条件下链状裸甲藻的生长曲线 Fig. 1 Growth curves of G. catenatum in different concentrations of different nitrogen sources |
不同氮浓度对链状裸甲藻的比生长率有显著影响。在NaNO3处理组中, 链状裸甲藻的比生长率随初始氮浓度的增加而增大, 最大为0.26 d−1。当以NaNO2、NH4Cl和尿素作为氮源时, 比生长率在0~ 100 μmol/L的范围内随氮浓度的增加而增大, 其最大值出现在NaNO2处理组中为0.29 d−1, 较高氮浓度处理组(200和800 μmol/L)中比生长率较低, 分别为0.27和0.25 d−1 (NaNO2处理组), 0.15和0.12 d−1 (尿素处理组)。链状裸甲藻的生长符合米氏方程, 拟合结果显示(表 2), 最大比生长率(μm)的范围是0.147~0.297 d−1, NaNO3处理组最高; 半饱和常数(Kμ)的范围是1.691~23.948 μmol/L, NaNO2处理组最大, NH4Cl处理组最小, 偏好系数(α)的最小值为0.005 (NaNO3处理组), 最大值为0.118 (NH4Cl处理组)。
| 氮源 | μm/(d−1) | Kμ/(μmol/L) | α | R2 |
| NaNO3 | 0.297 | 59.020 | 0.005 | 0.906 |
| NaNO2 | 0.292 | 23.948 | 0.012 | 0.870 |
| NH4Cl | 0.199 | 1.691 | 0.118 | 0.940 |
| 尿素 | 0.147 | 17.891 | 0.008 | 0.856 |
| 注: μm为最大比生长率; Kμ为半饱和常数; α为偏好系数, 等于μm和Kμ的比值; R2为拟合优度 | ||||
不同磷源条件下链状裸甲藻的生长如图 2所示。结果表明, 4种磷源均可促进链状裸甲藻的生长, 在NaH2PO4、G-6-P和ATP处理组中, 0~32 μmol/L浓度范围内, 细胞密度均呈现随磷浓度增加而增加的趋势, 其最大细胞密度分别为11 638、9 353、9 530 cells/mL。当以β-G-P为磷源时, 细胞密度在磷浓度0~16 μmol/L的范围内随磷浓度增加而增加, 32 μmol/L处理组最大细胞密度与16 μmol/L处理组无显著差异(P>0.05)。
 |
| 图 2 不同磷形态和浓度条件下链状裸甲藻的生长曲线 Fig. 2 Growth curves of G. catenatum in different concentrations of different phosphorus sources |
不同磷浓度影响链状裸甲藻的比生长率。在NaH2PO4和β-G-P处理组中, 链状裸甲藻的比生长率随磷浓度的增加而增加, 在32 μmol/L组中达到最大值, 分别为0.25和0.28 d−1; 以G-6-P为磷源时, 比生长率的范围是0.04~0.23 d−1, 其中最大值出现在8 μmol/L组; 在ATP处理组中, 在0~16 μmol/L范围内比生长率随着磷浓度增加而增大, 最大值为0.25 d−1, 而在32 μmol/L处理组中略有下降。链状裸甲藻在不同磷处理组中的生长符合米氏方程, 拟合结果(表 3)显示, β-G-P处理组的μm值最高, 为0.257 d−1; G-6-P处理组的μm值最低, 为0.229 d−1。ATP处理组的半饱和常数(Kμ)最大, 为1.517 μmol/L; G-6-P处理组的半饱和常数(Kμ)最小, 为0.665 μmol/L。偏好系数(α)的最高值出现在β-G-P处理组为0.385, 最低值出现在ATP处理组为0.160。
| 磷源 | μm /(d−1) | Kμ/(μmol/L) | α | R2 |
| NaH2PO4 | 0.230 | 0.743 | 0.310 | 0.880 |
| G-6-P | 0.229 | 0.665 | 0.344 | 0.911 |
| β-G-P | 0.257 | 0.667 | 0.385 | 0.902 |
| ATP | 0.243 | 1.517 | 0.160 | 0.850 |
不同氮形态处理组中, 链状裸甲藻谷氨酰胺合成酶, 脲酶和硝酸还原酶的酶活性随时间变化如图 3所示。结果表明, 各组谷氨酰胺合成酶活性变化趋势相似, 呈现出随着培养时间延长而下降的趋势, 培养第4天时, NH4Cl处理组的谷氨酰胺合成酶活性显著高于其他组(2.42×10–6 U/cell, P<0.05), 培养第8天时, 尿素处理组的酶活性则显著高于其他处理组(1.64×10–6 U/cell, P<0.05), 而NaNO3处理组的酶活性最低(0.78×10–6 U/cell), 培养至第12天时, 尿素处理组的酶活性依旧显著高于其他组(1.40×10–6 U/cell, P<0.05), 而NH4Cl处理组的酶活性最低(0.53×10–6 U/cell)。脲酶活性在NaNO2和尿素处理组中随培养时间先上升后下降, 而在NH4Cl和NaNO3处理组中先下降后上升, 其中在培养第8天时, 各组酶活性差异显著(P<0.05), 最高值(795.69×10–6 U/cell)出现在尿素处理组, 最低值(150.38×10–6 U/cell)出现在NaNO3处理组中; 在培养第12天时, 尿素处理组的酶活性显著高于其他处理组, 为652.09×10–6 U/cell (P<0.05)。实验中, 硝酸还原酶活性界于0.08×10–8~2.40×10–8 U/cell, 各处理组的硝酸还原酶活性无显著差异(P>0.05)。
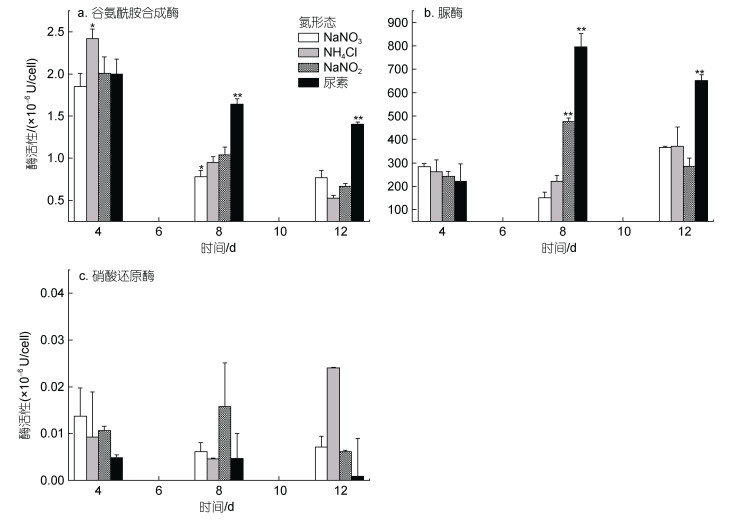 |
|
图 3 不同氮源对链状裸甲藻氮同化酶活性的影响 Fig. 3 Activity of nitrogen assimilation enzymes in G.catenatum in different nitrogen sources 注: 谷氨酰胺合成酶活性定义: 每个细胞在每mL反应体系中每小时产生1 μmol γ-谷氨酰基异羟肟酸为一个活力单位(U); 脲酶活性定义: 每个细胞每小时产生1 μg NH3-N为一个活力单位(U); 硝酸还原酶活性定义: 每个细胞每小时消耗1 μmol NADH为一个活力单位(U)。 *P<0.05, **P<0.01。 |
在不同磷形态条件下, 链状裸甲藻碱性磷酸酶和酸性磷酸酶活性随培养时间变化如图 4所示。结果表明, 在不同磷形态处理组中, 链状裸甲藻的碱性磷酸酶活性变化趋势相似, 即藻细胞的碱性磷酸酶活性在生长第10天达到最大值, 其中ATP处理组的碱性磷酸酶活性最高(28.92×10–6 U/cell), NaH2PO4处理组的碱性磷酸酶活性最低(11.26×10–6 U/cell); 第16天各培养组碱性磷酸酶活性最低。酸性磷酸酶活性在ATP处理组中呈现出相似的趋势, 即在第10天达到最高值(2.03×10–6 U/cell), 第4天的活性次之, 第16天活性最低。而其余三个处理组中酸性磷酸酶活性的变化趋势则是随培养时间而下降。其中, ATP处理组的酸性磷酸酶活性显著高于其他三个处理组(P<0.01)。
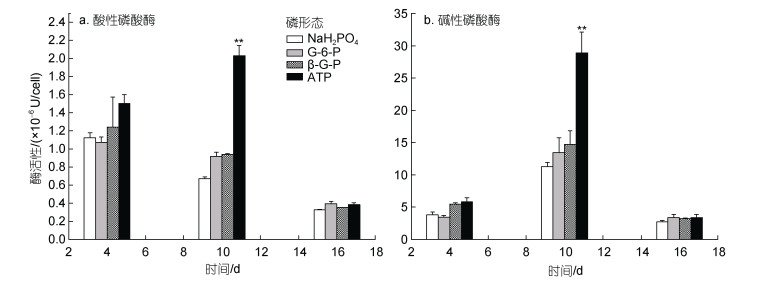 |
| 图 4 不同磷源对链状裸甲藻磷同化酶活性的影响 Fig. 4 Activity of phosphorus assimilation enzymes in G. catenatum in different phosphorus sources 注: 碱性磷酸酶活性定义: 20 ℃中每个细胞每分钟催化产生1 μmol酚定义为1个活力单位(U); 酸性磷酸酶活性定义: 20 ℃中每个细胞每分钟催化产生1 μmol 4-硝基苯酚定义为1个活力单位(U)。**P<0.01 |
氮是浮游植物生长的必需元素, 是合成浮游植物细胞结构的必要组分。本研究中链状裸甲藻在以NaNO3、NaNO2、NH4Cl、尿素为唯一氮源的培养基中均可以生长, 有明显的指数生长期和平台期, 并达到较高细胞密度, 表明链状裸甲藻可以利用NaNO3、NaNO2、NH4Cl和尿素作为氮源, 利于其在自然环境中利用不同形态氮源维持正常的生长。当以硝态氮为唯一氮源时, 链状裸甲藻的最大比生长率(μm)是其他处理组μm的1.5~2.0倍, 但是营养吸收动力学结果显示半饱和常数(Kμ)的大小顺序为NaNO3>NaNO2>尿素>NH4Cl, 表明链状裸甲藻对铵盐的亲和性最高(亲和系数α值=0.118), 该特点与其他藻种类似, 因为与尿素和硝氮相比, 铵氮被转化为氨基酸被利用所需的途径较少, 是消耗能量最低最“经济”的氮源(Levasseur et al, 1993; Hunter, 2000; 陈建业等, 2014; Liu et al, 2015)。但是, 当培养基中NH4Cl浓度大于100 μmol/L时, 链状裸甲藻细胞死亡; 因为, 较高浓度NH4+可转化为NH3, 对藻细胞产生毒害作用, 类似结果在以往研究中也有报道(Leong et al, 2004; 李朝霞等, 2010; Liu et al, 2015)。而且, 相似的毒性效应也出现在以尿素和NaNO2为唯一氮源的处理组中, 800 μmol/L处理组的比生长率均低于200 μmol/L处理组, 且藻密度在第8天后快速增长, 可能是此时培养基中的尿素或NaNO2浓度下降, 对藻细胞生长的抑制作用降低(Taylor et al, 2006; 滕亚娟, 2006; 钟娜等, 2008)。本研究中链状裸甲藻对NaNO3、NaNO2、尿素吸收的半饱和常数(Kμ)均大于10 μmol/L, 同时日本海域链状裸甲藻藻株对NaNO3的半饱和常数为7.60 μmol/L, 均高于很多其他赤潮物种, 表明该藻对这几种氮营养的需求较高, 在低氮浓度的环境中不具备竞争优势(Yamamoto et al, 2004; 钟娜等, 2008; Liu et al, 2015)。但链状裸甲藻对NH4+吸收的半饱和常数(Kμ, 1.691 μmol/L)低于其他赤潮生物, 如红色赤潮藻(Akashiwo sanguinea, 3.47 μmol/L), 尖刺拟菱形藻(Pseudonitzschia pungens, 2.18 μmol/L)等, 表明该藻对铵盐的利用优于其他藻种, 铵盐在该藻赤潮形成过程中可能发挥重要作用(张诚等, 1997; Liu et al, 2015)。
磷也是浮游植物生存所需的主要元素, 是构成某些大分子物质不可缺少的组分(Xu et al, 2010; Lee et al, 2012)。本实验结果表明, 4种磷源均可以促进链状裸甲藻的生长, 证明链状裸甲藻具有与其他浮游藻类类似的利用无机磷和有机磷化合物作为营养物质来源的能力(张清春等, 2005; 赵艳芳等, 2009; 陈建业等, 2014; 于倩等, 2015)。在NaH2PO4、G-6-P、β-G-P三种处理组中链状裸甲藻的生长差别不明显, 但在以ATP为唯一磷源处理组中, 链状裸甲藻的最大比生长率最低, 且相同磷浓度条件下ATP处理组细胞密度始终低于其他处理组, 同时, 营养吸收动力学结果表明ATP处理组的半饱和系数最高, 说明链状裸甲藻对ATP的亲和性最低, 因此推测链状裸甲藻利用ATP的能力弱于其他三种磷源。本实验中链状裸甲藻对磷酸盐吸收的半饱和常数(0.743 μmol/L)低于许多藻种, 如三角褐指藻(Phaeodactylum tricornutum Bohlin, 5.49 μmol/L), 并且高于韩国株系(2.65 μmol/L, Oh et al, 2007), 在福建海域链状裸甲藻赤潮发生期间, 水体中的磷酸盐浓度检出至1.465 μmol/L, 推测在低浓度磷酸盐水体中, 链状裸甲藻可由于竞争力较强而导致赤潮(樊娟, 2010; 李光毅等, 2022)。
3.2 营养盐对链状裸甲藻酶活性的影响近海水体中氮源形态多种多样, 因此对多种形态氮源的吸收利用对于维持浮游藻类细胞正常生长极为重要。本实验中各处理组中均检测到低水平的硝酸还原酶活性, 说明链状裸甲藻硝酸还原酶存在结构性表达(Mathew, 1981; 钟娜等, 2008; 蒙蕊, 2018)。硝酸还原酶催化硝酸盐还原为亚硝酸盐, 是硝酸盐同化过程中的限速步骤, 从而影响着藻类的生长(Solomonson et al, 1990; 唐洪杰等, 2006)。本研究中, 链状裸甲藻的硝酸还原酶活性最大为2.40×10–8 U/cell, 远低于其他藻种的硝酸还原酶活性, 再次说明链状裸甲藻在低氮浓度环境中不具备竞争优势(王金花等, 2008; 王燕, 2011; 丁雁雁, 2012; Liu et al, 2015)。与其他氮源相比, NH4+被转化为氨基酸所需的途径较少, 是谷氨酰胺合成酶催化反应的底物, 以NH4+为氮源会提高谷氨酰胺合成酶活性表达, 这与之前的研究类似(赵越等, 2003; Forde et al, 2007; Liu et al, 2015; 丁光茂, 2018; 蒙蕊, 2018; 江志坚等, 2023)。随着培养时间的延长, 尿素处理组的谷氨酰胺合成酶活性显著高于其他处理组, 这可能是与该藻对尿素的吸收过程有关。藻细胞对不同形态氮源的吸收存在主动吸收和被动吸收两种形式: 对于无机营养盐, 可以通过主动运输的方式在很短时间内大量吸收后再利用; 而对于尿素的吸收过程是被动运输, 需要胞内外的浓度差, 细胞内尿素经脲酶水解利用后浓度下降, 再吸收细胞外的尿素, 因此, 藻细胞对尿素的吸收利用是一个缓慢的过程。本研究中, 培养到第8天后, 与其他无机盐处理组相比, 尿素处理组中仍有较高的氮浓度(图 5), 导致谷氨酰胺合成酶活性较高(Carvalho et al, 2004; Collos et al, 2005; Lindehoff et al, 2010)。本研究在4种氮源处理组中均检测到脲酶活性, 意味着脲酶是链状裸甲藻的一种组成酶, 可以随时吸收利用水体中的尿素(Antia et al, 1991; Singh, 1991; 蒙蕊等, 2018)。但不同氮源条件下其表达活性仍有所不同, 以尿素为唯一氮源的处理组中脲酶活性显著高于其他处理组(P<0.01), 表明脲酶活性受环境中氮源的调控(Dyhrman et al, 2003; Fan et al, 2003; Liu et al, 2015; 黄晓云, 2015)。但不同藻种的脲酶活性受外界氮浓度的影响有所不同, 研究发现球形棕囊藻(Phaeocystis globosa)藻细胞中脲酶活性与硝酸盐浓度呈显著正相关关系, 而野外亚历山大藻(Alexandrium fundyense)中脲酶活性随着溶解无机氮浓度而降低, 这种差异在其他藻种中也有发现(Peers et al, 2000; Dyhrman et al, 2003; 蒙蕊, 2018), 可见氮浓度对链状裸甲藻脲酶活性的影响仍需进一步地研究。
 |
| 图 5 100 μmol/L浓度不同氮源处理组中氮营养盐浓度变化 Fig. 5 Variations of nitrogen concentration in different nitrogen sources at 100 μmol/L |
海洋中磷源多种多样, 许多藻种都具有利用多种含磷化合物的能力。研究表明, 在无机磷缺失的环境中, 藻细胞可以通过诱导合成碱性磷酸酶分解水体中的有机磷, 或者通过酸性磷酸酶水解胞内储存的多聚磷酸盐, 来供藻类维持生长(黄邦钦等, 1999; Hernández et al, 2002; Bai et al, 2014)。本研究中, 培养初期, 各处理组藻细胞内可能仍有部分储存的多聚磷酸盐供藻类维持生长, 此时酸性磷酸酶活性处于高点; 随着培养的进行, 胞内磷酸盐逐渐降低, 酸性磷酸酶活性下降, 而碱性磷酸酶活性升高, 用于分解胞外可利用的有机磷。培养末期, 两种酶的活性均降到了低值, 推测是由于胞外和胞内的磷营养都被耗尽, 这种酶活性随培养时间的变化与之前的研究类似(Oh et al, 2002; 张清春等, 2005; 杨维东等, 2008; Bai et al, 2014; 于倩等, 2015)。其中, 无机磷处理组的碱性磷酸酶活性始终低于其他有机磷处理组, Oh等(2002)的研究结果也表明外界较高的H2PO4–浓度会抑制碱性磷酸酶活性的表达, 当外界无机营养盐浓度降低时细胞内碱性磷酸酶活性会迅速上升, Oh等(2002)也发现外界磷酸盐浓度降低会诱导链状裸甲藻细胞内碱性磷酸酶活性上升。目前, 关于浮游植物对有机磷的利用途径有2种猜想: 一种是可被直接吸收利用的小分子有机磷, 如G-6-P; 另一种是需经碱性磷酸酶等水解作用后才能被吸收利用的较大分子有机磷, 如蛋黄卵磷脂(Bentzen et al, 1991; 洪华生等, 1992; 黄邦钦等, 1999; 邹迪等, 2005)。本研究中, G-6-P和β-G-P虽然是有机磷, 但是这两个处理组碱性磷酸酶活性大小与无机磷处理组无显著差异, 推测这两种有机磷可能无需通过酶解作用而被直接吸收利用; 而在第10天时ATP处理组的碱性磷酸酶活性是其他处理组的2倍, 因此推测链状裸甲藻可能并不是直接吸收ATP, 而是经由碱性磷酸酶或者5′核苷酸酶水解成为无机磷后才可被细胞吸收利用(王艳等, 2006; 杨维东等, 2008)。
4 结论(1) 链状裸甲藻在以NaNO3、NaNO2、NH4Cl、尿素为唯一氮源的水体中均可生长, 但对NH4Cl的亲和性最高, 高浓度的NaNO2、NH4Cl、尿素对藻细胞有毒性效应。
(2) 链状裸甲藻在以NaH2PO4、G-6-P、β-G-P和ATP为唯一磷源的水体中均可生长, 但对ATP的利用效率最低。
(3) 链状裸甲藻中硝酸还原酶是结构性表达且活性较低, 导致链状裸甲藻在低氮环境中不具备竞争优势; 谷氨酰胺合成酶和脲酶的活性分别受其铵盐、尿素底物的诱导而增高; 链状裸甲藻对尿素的缓慢吸收可能导致培养后期谷氨酰胺合成酶的活性高于无机氮培养组。
(4) 链状裸甲藻可通过提高碱性磷酸酶活性水解环境中的有机磷, 满足藻细胞对磷的需求; 链状裸甲藻细胞对小分子有机磷G-6-P、β-G-P的吸收利用可能并不需要碱性磷酸酶的参与, ATP为磷源时可诱导藻细胞产生较高的碱性磷酸酶活性。
丁光茂, 2018. 链状亚历山大藻谷氨酰胺合成酶的分离纯化及酶学特性研究. 渔业研究, 40(2): 98-103 |
丁雁雁, 2012. 温度、光照对东海几种典型赤潮藻生长及硝酸还原酶活性的影响[D]. 青岛: 中国海洋大学.
|
于倩, 王清, 袁泽轶, 等, 2015. 不同形态磷源对具槽帕拉藻(Paralia sulcata)生长和磷酸酶活性的影响. 海洋与湖沼, 46(5): 1018-1023 |
王金花, 唐洪杰, 王修林, 等, 2008. 氮、磷营养盐对东海原甲藻生长和硝酸还原酶活性的影响. 应用与环境生物学报, 14(5): 620-623 |
王艳, 唐海溶, 2006. 不同形态的磷源对球形棕囊藻生长及碱性磷酸酶的影响. 生态科学, 25(1): 38-40 |
王燕, 2011. 海洋浮游植物细胞体积与细胞碳、氮及叶绿素a含量之间的关系[D]. 青岛: 中国海洋大学.
|
江志坚, PREMARATHNE C I, 方扬, 等, 2023. 铵态氮加富对贝克喜盐草光合作用、谷氨酰胺合成酶和氨基酸成分的影响. 热带海洋学报, 42(3): 116-125 |
李光毅, 刘保清, 邱勇, 等, 2022. 链状裸甲藻赤潮消亡过程及其与休眠包囊关系的初步研究. 海洋学报, 44(8): 123-132 |
李朝霞, 刘升平, 2010. 施用不同氮源对球等鞭金藻3011生长的影响. 中国农学通报, 26(1): 303-307 |
杨维东, 钟娜, 刘洁生, 等, 2008. 不同磷源及浓度对利玛原甲藻生长和产毒的影响研究. 环境科学, 29(10): 2760-2765 |
邹迪, 肖琳, 杨柳燕, 等, 2005. 不同氮磷比对铜绿微囊藻及附生假单胞菌磷代谢的影响. 环境化学, 24(6): 647-650 |
张诚, 邹景忠, 1997. 尖刺拟菱形藻氮磷吸收动力学以及氮磷限制下的增殖特征. 海洋与湖沼, 28(6): 599-603 |
张清春, 于仁诚, 周名江, 等, 2005. 不同类型含磷营养物质对微小亚历山大藻(Alexandrium minutum)生长和毒素产生的影响. 海洋与湖沼, 36(5): 465-474 |
陈火荣, 2018. 2017年福建海域链状裸甲藻赤潮事件应急处置与思考. 渔业研究, 40(4): 308-314 |
陈建业, 林丹, 黄健, 等, 2014. 不同氮源、磷源营养盐对亚心型扁藻(Platymonus subcordiformis)生长的影响. 福建水产, 36(4): 258-263 |
赵艳芳, 俞志明, 宋秀贤, 等, 2009. 不同磷源形态对中肋骨条藻和东海原甲藻生长及磷酸酶活性的影响. 环境科学, 30(3): 693-699 DOI:10.3321/j.issn:0250-3301.2009.03.012 |
赵越, 魏自民, 马凤鸣, 2003. 不同水平铵态氮对甜菜硝酸还原酶和谷氨酰胺合成酶活力的影响. 中国糖料, (1): 22-25 |
钟娜, 杨维东, 刘洁生, 等, 2008. 不同氮源对利玛原甲藻(Prorocentrum lima)生长和产毒的影响. 环境科学学报, 28(6): 1186-1191 |
洪华生, 戴民汉, 郑效成, 1992. 海水中碱性磷酸酶活力的测定及其在磷的循环中的作用初探. 海洋与湖沼, 23(4): 415-420 |
唐洪杰, 王金花, 祝陈坚, 等, 2006. 几种海洋微藻硝酸还原酶特性的初步研究. 海洋水产研究, 27(6): 48-54 |
黄邦钦, 黄世玉, 翁妍, 等, 1999. 溶解态磷在海洋微藻碱性磷酸酶活力变化中的调控作用. 海洋学报, 21(1): 55-60 |
黄晓云, 2015. 五种浮游植物的脲酶生理学特性的研究[D]. 广州: 暨南大学.
|
梁玉波, 李冬梅, 姚敬元, 等, 2019. 中国近海藻毒素及有毒微藻产毒原因种调查研究进展. 海洋与湖沼, 50(3): 511-524 |
蒙蕊, 2018. 典型赤潮微藻对不同氮源的响应机制研究[D]. 青岛: 中国科学院大学(中国科学院海洋研究所).
|
蒙蕊, 宋秀贤, 刘淑雅, 等, 2018. 球形棕囊藻对不同氮源的吸收利用机制. 海洋与湖沼, 49(4): 802-808 |
樊娟, 2010. 氮、磷浓度及氮输入频度对两种海洋微藻生长的影响研究[D]. 天津: 南开大学.
|
滕亚娟, 2006. 不同氮源对骨条藻生长的影响. 水利渔业, 26(4): 55-56, 109 |
ANTIA N J, HARRISON P J, OLIVEIRA L, 1991. The role of dissolved organic nitrogen in phytoplankton nutrition, cell biology and ecology. Phycologia, 30(1): 1-89 |
BAI F, LIU R, YANG Y J, et al, 2014. Dissolved organic phosphorus use by the invasive freshwater diazotroph cyanobacterium, Cylindrospermopsis raciborskii. Harmful Algae, 39: 112-120 |
BENTZEN E, TAYLOR W D, 1991. Estimating organic P utilization by freshwater plankton using [32P]ATP. Journal of Plankton Research, 13(6): 1223-1238 |
BERGES J A, MULHOLLAND M R, 2008. Enzymes and nitrogen cycling [M]// CAPONE D G, BRONK D A, MULHOLLAND M R, et al. Nitrogen in the Marine Environment. 2nd ed. Massachusetts, USA: Academic Press: 1385-1444.
|
BOLCH C J S, NEGRI A P, BLACKBURN S I, et al, 2002. Life cycle variation in PST content and cell toxicity in PST-producing dinoflagellates [C] // Lifehab: Life History of Microalgal Species Causing Harmful Blooms. Santa Ponca, Spain.
|
CARVALHO J C M, FRANCISCO F R, ALMEIDA K A, et al, 2004. Cultivation of Arthrospira (spirulina) platensis (Cyanophyceae) by fed-batch addition of ammonium chloride at exponentially increasing feeding rates. Journal of Phycology, 40(3): 589-597 |
CEMBELLA A D, BAND-SCHMIDT C J, 2018. Harmful algal species fact sheet: Gymnodinium catenatum [M] // SHUMWAY S E, BURKHOLDER J M, MORTON S L. Harmful Algal Blooms: A Compendium Desk Reference. Singapore: John Wiley & Sons Ltd: 605-612.
|
COLLOS Y, VAQUER A, SOUCHU P, 2005. Acclimation of nitrate uptake by phytoplankton to high substrate levels. Journal of Phycology, 41(3): 466-478 |
DOBLIN M A, BLACKBURN S I, HALLEGRAEFF G M, 2000. Intraspecific variation in the selenium requirement of different geographic strains of the toxic dinoflagellate Gymnodinium catenatum. Journal of Plankton Research, 22(3): 421-432 |
DYHRMAN S T, ANDERSON D M, 2003. Urease activity in cultures and field populations of the toxic dinoflagellate Alexandrium. Limnology and Oceanography, 48(2): 647-655 |
FAN C, GLIBERT P M, ALEXANDER J, et al, 2003. Characterization of urease activity in three marine phytoplankton species, Aureococcus anophagefferens, Prorocentrum minimum, and Thalassiosira weissflogii. Marine Biology, 142(5): 949-958 |
FORDE B G, LEA P J, 2007. Glutamate in plants: metabolism, regulation, and signalling. Journal of Experimental Botany, 58(9): 2339-2358 |
GU H F, LIU T T, VALE P, et al, 2013. Morphology, phylogeny and toxin profiles of Gymnodinium inusitatum sp. nov., Gymnodinium catenatum and Gymnodinium microreticulatum (Dinophyceae) from the Yellow Sea, China. Harmful Algae, 28: 97-107 |
HERNÁNDEZ I, NIELL F X, WHITTON B A, 2002. Phosphatase activity of benthic marine algae. An overview. Journal of Applied Phycology, 14(6): 475-487 |
HUNTER J R, 2000. Huon estuary study-environmental research for integrated catchment management and aquaculture [R]. Hobart: CSIRO Marine Research, Marine Laboratories.
|
IRIARTE J L, QUIÑONES R A, GONZÁLEZ R R, 2005. Relationship between biomass and enzymatic activity of a bloom-forming dinoflagellate (Dinophyceae) in southern Chile (41°S): a field approach. Journal of Plankton Research, 27(2): 159-166 |
LEE T C H, KWOK O T, HO K C, et al, 2012. Effects of different nitrate and phosphate concentrations on the growth and toxin production of an Alexandrium tamarense strain collected from Drake Passage. Marine Environmental Research, 81: 62-69 |
LEONG S C Y, TAGUCHI S, 2004. Response of the dinoflagellate Alexandrium tamarense to a range of nitrogen sources and concentrations: growth rate, chemical carbon and nitrogen, and pigments. Hydrobiologia, 515(1/2/3): 215-224 |
LEVASSEUR M, THOMPSON P A, HARRISON P J, 1993. Physiological acclimation of marine phytoplankton to different nitrogen sources. Journal of Phycology, 29(5): 587-595 |
LIM P T, OGATA T, 2005. Salinity effect on growth and toxin production of four tropical Alexandrium species (Dinophyceae). Toxicon, 45(6): 699-710 |
LINDEHOFF E, GRANÉLI E, GLIBERT P M, 2010. Influence of prey and nutritional status on the rate of nitrogen uptake by Prymnesium parvum (haptophyte). Journal of the American Water Resources Association, 46(1): 121-132 |
LIU Y, CHEN T T, SONG S Q, et al, 2015. Effects of nitrogenous nutrition on growth and nitrogen assimilation enzymes of dinoflagellate Akashiwo sanguinea. Harmful Algae, 50: 99-106 |
MATHEW T, 1981. Nitrate reduction in Chlorococcales. Hydrobiologia, 79(1): 3-14 |
MOBLEY H L, HAUSINGER R P, 1989. Microbial ureases: significance, regulation, and molecular characterization. Microbiological Reviews, 53(1): 85-108 |
MONOD J, 1942. Recherches sur la croissance des cultures bactériennes. 2nd ed. Paris: Hermann et Cie, 211
|
OH S J, YAMAMOTO T, KATAOKA Y, et al, 2002. Utilization of dissolved organic phosphorus by the two toxic dinoflagellates, Alexandrium tamarense and Gymnodinium catenatum (Dinophyceae). Fisheries Science, 68(2): 416-424 |
OH S J, YOON Y H, YANG H S, 2007. Growth and phosphate uptake of the toxic dinoflagellate Gymnodinium catenatum isolated from Yeosuhae Bay, South Korea. Korean Journal of Fisheries and Aquatic Sciences, 40(2): 95-101 |
PEERS G S, MILLIGAN A J, HARRISON P J, 2000. Assay optimization and regulation of urease activity in two marine diatoms. Journal of Phycology, 36(3): 523-528 |
QI Y Z, HONG Y, ZHENG L, et al, 1996. Dinoflagellate cysts from recent marine sediments of the South and East China Seas. Asian Marine Biology, 13: 87-103 |
SINGH S, 1991. Regulation of growth in a diazothrophic cyanobacterium Anabaena doliolum by nitrogen sources. Proceedings of the Indian National Science Academy, 57(3B-4B): 271-276 |
SOLOMON C M, COLLIER J L, BERG G M, et al, 2010. Role of urea in microbial metabolism in aquatic systems: a biochemical and molecular review. Aquatic Microbial Ecology, 59(1): 67-88 |
SOLOMONSON L P, BARBER M J, 1990. Assimilatory nitrate reductase: functional properties and regulation. Annual Review of Plant Physiology and Plant Molecular Biology, 41: 225-253 |
TAYLOR G T, GOBLER C J, SAÑUDO-WILHELMY S A, 2006. Speciation and concentrations of dissolved nitrogen as determinants of brown tide Aureococcus anophagefferens bloom initiation. Marine Ecology Progress, 312: 67-83 |
WANG D Z, ZHANG S F, ZHANG Y, et al, 2016. Paralytic shellfish toxin biosynthesis in cyanobacteria and dinoflagellates: a molecular overview. Journal of Proteomics, 135: 132-140 |
XU S S, SONG J M, LI X G, et al, 2010. Changes in nitrogen and phosphorus and their effects on phytoplankton in the Bohai Sea. Chinese Journal of Oceanology and Limnology, 28(4): 945-952 |
YAMAMOTO T, OH S J, KATAOKA Y, 2002. Effects of temperature, salinity and irradiance on the growth of the toxic dinoflagellate Gymnodinium catenatum (Dinophyceae) isolated from Hiroshima Bay, Japan. Fisheries Science, 68(2): 356-363 |
YAMAMOTO T, OH S J, KATAOKA Y, 2004. Growth and uptake kinetics for nitrate, ammonium and phosphate by the toxic dinoflagellate Gymnodinium catenatum isolated from Hiroshima Bay, Japan. Fisheries Science, 70(1): 108-115 |
 2023, Vol. 54
2023, Vol. 54


