
中国海洋湖沼学会主办。
文章信息
- 石彭兰, 王强俊, 谭佐莉, 赵思弈, 汤锦铭, 黄志雄, 高树基, 徐敏. 2023.
- SHI Peng-Lan, WANG Qiang-Jun, TAN Zuo-Li, ZHAO Si-Yi, TANG Jin-Ming, HUANG Zhi-Xiong, KAO Shuh-Ji, XU Min Nina. 2023.
- 冬季东寨港微微型浮游植物丰度、分布及影响因素
- ABUNDANCE, DISTRIBUTION AND ENVIRONMENTAL CONTROL OF PICOPHYTOPLANKTON IN THE WINTER DONGZHAI HARBOR
- 海洋与湖沼, 54(4): 1058-1069
- Oceanologia et Limnologia Sinica, 54(4): 1058-1069.
- http://dx.doi.org/10.11693/hyhz20221100288
文章历史
-
收稿日期:2022-11-02
收修改稿日期:2023-01-14
2. 海南大学生态与环境学院 海南海口 570228;
3. 海南大学海洋学院 海南海口 570228;
4. 近海海洋环境科学国家重点实验室 厦门大学海洋与地球学院 福建厦门 361102
2. Institute of Ecology and Environment, Hainan University, Haikou 570228, China;
3. Institute of Marine, Hainan University, Haikou 570228, China;
4. State Key Laboratory of Marine Environmental Science, College of Ocean and Earth Sciences, Xiamen University, Xiamen 361102, China
浮游植物是海洋生态系统中最主要的初级生产者, 是生物泵的重要基础结构和碳汇环节中的重要部分, 在物质循环、能量流动和信息传递中起到重要作用(王晓敏等, 2017)。浮游植物的光合固碳占全球光合固碳总量的一半, 驱动大气CO2不断向海洋融入, 是重要的碳汇过程之一(高坤山, 2014)。浮游植物可分为不同类群, 根据粒径大小, 可将浮游植物分为小型浮游植物(20~200 μm)、微型浮游植物(2.0~20 μm)和微微型浮游植物(0.2~2.0 μm)(郑耀洋等, 2016)。微微型浮游植物(Picophytoplankton)又可分为微微型光合原核浮游植物(Prokaryotes)和微微型真核浮游植物(Pico-Eukaryotes, Euk); 微微型光合原核浮游植物包括原绿球藻(Prochlorococcus, Pro)和聚球藻(Synechococcus, Syn), 聚球藻又可分为富含藻红蛋白的聚球藻(Phycoerythrin-rich, PE)和富含藻蓝蛋白的聚球藻(Phycocyanin-rich, PC)(杨琳等, 2012)。
目前关于对微微型浮游植物的研究, 在非极地海区较为普遍。Glover等(1985)研究光合速率发现, 缅因州海域小于3 μm的微微型浮游植物是初级生产力的主要贡献者。Moreira-Turcq等(1998)报道, 普帖夫海(北冰洋边缘海)的深度越深微微型浮游植物的生物量就越少, 然而在该海域水深20~30 m依然可以发现微微型真核浮游植物的存在, 说明在0~1 ℃的低温情况, 大量的微微型浮游植物仍然可以进行光合作用。我国关于海洋微微型浮游植物分布的研究主要集中于近岸和远洋, 例如北部湾近岸海域(赵越等, 2019)、黄渤海(宋伦等, 2016)、东海近岸海域(孙军等, 2009)、南海(Gui et al, 2020)等, 在珠江口、长江口、黄河三角洲等一些大流域入海口也有关于微微型浮游植物的研究(何青等, 2009; 王育红等, 2013; 张霞等, 2013), 相比之下小流域入海口的相关研究明显不足, 对东寨港微微型浮游植物的分布等研究较少。
东寨港是我国第一个红树林保护区。近年来, 在全球气候变暖的自然因素和围塘养殖、生活污水排放等人为因素的干扰下(颜秀花等, 2019), 东寨港水域水体污染程度加剧, 冲击了红树林生态系统生物多样性, 使红树林面积大幅下降(李棉巧等, 2021), 降低了红树林生态系统服务功能, 影响了东寨港红树林的储碳量和碳汇能力(李翠华等, 2020)。东寨港水体从2005年开始被污染, 到2008年时有机污染已经达到4级的轻度污染, 水体富营养化水平高(李鹏山等, 2010)。从2009~2016年东寨港海水养殖区的有机污染由严重变为中度污染, 富营养水平由高变低(李仕平等, 2017), 同期间的2015年8月东寨港水域受到多环芳烃的污染严重, 比珠三角流域、辽河、滦河、莫斯科河和希腊北部水域还严重(张禹等, 2016)。目前, 随着我国对生态保护力度的不断加大, 对于如何防治东寨港红树林保护区内的水体污染也逐渐受到人们的重视, 有研究表明微微型浮游植物在水体中的丰度和分布能反映出水体的污染程度(孙晓庆等, 2008), 通常微微型浮游植物在寡营养水域中占优势, 在营养丰富的环境中所占的比例则相对较少, 因此可以根据微微型浮游植物的占比变化, 判断不同水域营养状况。因此, 本研究拟通过对东寨港保护区开阔水域的微微型浮游植物的丰度和分布进行调查研究, 丰富对东寨港水域微微型浮游植物认识, 同时补充现有数据, 为后续进一步探究东寨港水体污染程度演变以及生态环境保护提供参考依据。
1 材料与方法 1.1 调查区域本调查研究于2022年1月5日在海南海口东寨港保护区开阔水域(110°32′~110°55′E, 19°51′~20°01′N)及其水域周边近岸河流和海端进行。在东寨港水域设置14个站位(S1~S14), 在5条近岸河流设置6个站位(分别为R1演丰西河、R2演丰东河、R3和R3-1三江河、R4演州河、R5珠溪河), 在新埠海设置海端站位SW (图 1)。东寨港水域站位经纬度使用船载CTD的GPS卫星定位获得数据, 近岸河流和海端点站位经纬度使用手机GPS卫星定位获得数据。
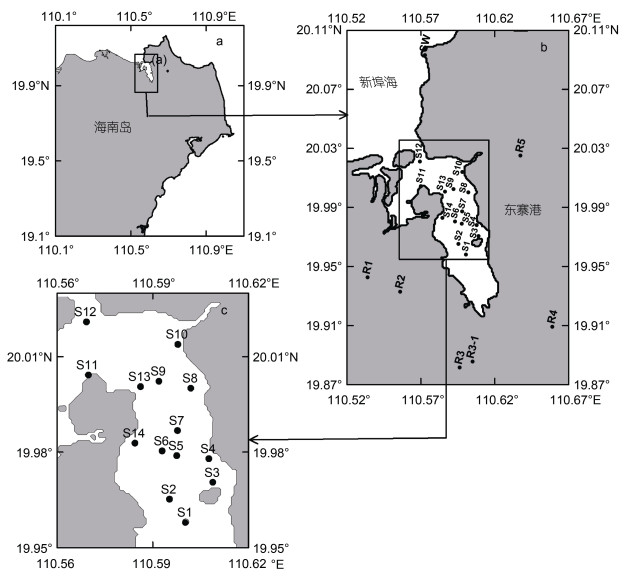 |
| 图 1 采样站位图 Fig. 1 Distribution of the sampling stations 注: a: 采样区域; b: 东寨港入港河流(R)及新埠海海端(SW)站位; c: 东寨港采样站位(S) |
本调查采取的样品分别为在东寨港水域设置的14个站位的表层和底层水样品(表 1), 6个河流站位的表层水样品和海端站位SW的表层水样品。水样取自表层水(水表以下约0.5 m), 底层水(离水底约0.5 m)。水样经200 μm孔径筛绢预过滤后分装到500 mL HDPE棕色不透光样品瓶, 避光低温保存直到运送达实验室进行处理。水样摇匀后取200 mL过滤于450 ℃预烧4 h的GF/F滤膜上, 滤膜放入2 mL冻存管中, 于–80 ℃冰箱内存储, 用于叶绿素a (chl a)含量的测定。
| 站位 | S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | S9 | S10 | S11 | S12 | S13 | S14 |
| 水深/m | 2.0 | 2.5 | 1.7 | 2.0 | 2.5 | 2.5 | 7.5 | 1.7 | 8.5 | 1.5 | 4.5 | 4.5 | 3.0 | 2.0 |
HDPE样品瓶中的水样用20 μm筛绢过滤进5 mL离心管内充分润洗后弃去, 重复润洗三次后再次过滤10~15 mL于离心管。移液枪吸取过滤的水样1.4 mL于2 mL对应编号冻存管内, 再向每个冻存管加入0.2 mL 0.22 μm预过滤的4%多聚甲醛组织细胞固定液(终浓度为0.5%), 拧紧冻存管盖子后上下颠倒震荡, 使水样与细胞固定液充分混合, 固定后的最终体积为1.6 mL。每个站位水样重复以上步骤。震荡后的样品置于4 ℃冰盒黑暗固定15 min后转移至−80 ℃冰箱直至样品后续使用流式细胞技术检测。
1.3 样品的测定方法 1.3.1 水体基础水文参数测定东寨港水域采样站位和走航线路的水体理化参数测定使用船载的温盐深度剖面仪(CTD)和多参数水质分析仪(WTW)测量, 现场测定得到的水体表底层理化参数分别有温度、盐度、pH、深度、光照强度(PAR)和水体溶氧(DO)浓度等。河流站位和海端站位使用温度计、盐度计现场分别测得温度和盐度。叶绿素a滤膜用新配制的浓度为95% (体积比)的丙酮避光−20 ℃萃取16~ 20 h后, 用荧光仪(Trilogy)测定叶绿素a的质量浓度。
1.3.2 微微型浮游植物细胞丰度和分类根据浮游植物的自发荧光特性, 采用流式细胞仪(Becton-Dickinson AccuriTM C6)对微微型浮游植物进行分类和计数。在BD Accuri C6波长为488 nm的绿色激发光激发下, 聚球藻中含有的藻红素和叶绿素可在560~590 nm和658 nm处分别激发出橙色荧光(FL2)与红色荧光(FL3)。原绿球藻和微微型真核藻类中含有叶绿素, 能发出红色荧光, 从而区分出可以发射橙色荧光的聚球藻(赵相伟等, 2020)。另外, 根据前向散射光(FSC)可以直接表征细胞或者微粒大小的作用, 分出原绿球藻与微微型真核藻类群(Wei et al, 2019), 以荧光微球(Beads)大小作为内部参照, 可以估算出检测细胞类群的大小(Zhao et al, 2010)。细胞颗粒较小、叶绿素信号较弱的是原绿球藻, 细胞颗粒大、叶绿素含量信号相对较强的是微微型真核藻(宁修仁等, 2003)。使用BD Accuri C6测定微微型浮游植物的具体操作方法和BD Accuri C6 Software的使用方法详见文献(赵越等, 2019; Wang et al, 2021)。
1.3.3 微微型浮游植物碳生物量估算目前微微型浮游植物的生物量通常按照各类群的碳转换系数来估算。但是对于不同海域, 不同的微微型浮游植物类群碳转换系数会存在很大差异。根据中国科学院青岛生物能源与过程研究所等(2016)提出的海洋微微型浮游植物固碳量的估算方法进行碳生物量估算。
1.4 数据处理与分析方法本文涉及的数据可视化绘图使用Surfer15和OriginPro。表底层间单因素方差分析使用MC-EXCEL。SPSS19.0进行Pearson相关性分析(双尾检验)微微型浮游植物细胞丰度和环境参数的相关性关系, 以P < 0.05表示显著性差异。
2 结果 2.1 东寨港水文参数和水体叶绿素a分布东寨港水域表层温度范围是20.76~22.26 ℃, 平均温度为(21.12±0.41) ℃ (图 2a, 2b); 底层水体的温度为20.62~22.21 ℃, 平均温度为(20.91±0.42) ℃; 且深度越深温度越低(图 2c)。温度整体呈现出西岸高东侧低的分布形式。表底层温度并无显著差异(P > 0.05)。近岸河流和海端的站位表层平均温度为(22.03±0.26) ℃ (表 2)。采集的河流端盐度的最低值为0, 最高为三江河的R3-1站位5.10; 海端盐度为33.00 (表 2)。
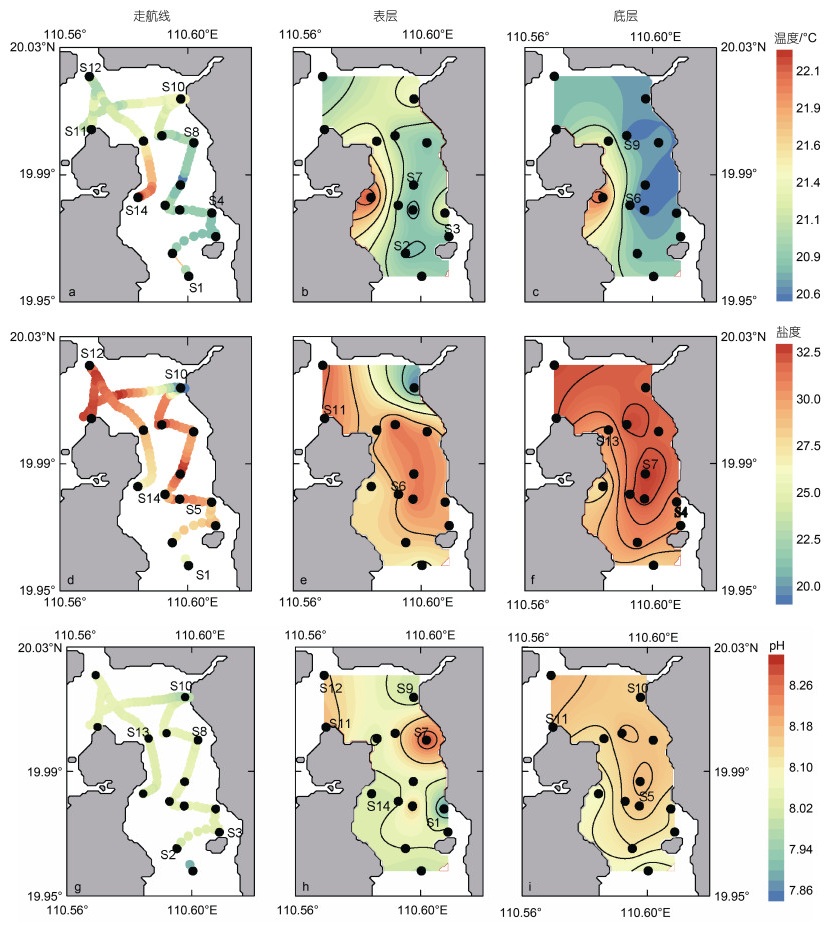 |
| 图 2 调查水域走航路线(起止站位)和表底层的温度、盐度、pH分布等值线图 Fig. 2 Contour lines of temperature, salinity and pH distribution of the navigation route, the surface and bottom water bodies in the surveyed waters |
| 站位 | 温度/℃ | 盐度 | 叶绿素a /(μg/L) |
Syn-PC /(cells/mL) |
Syn-PE /(cells/mL) |
Euk /(cells/mL) |
| R1 | 22.0 | 0.00 | 18.05 | 1.37×105 | 1.15×102 | 4.94×105 |
| R2 | 22.0 | 0.70 | — | 5.27×104 | 1.54×102 | 7.17×104 |
| R3 | 21.8 | 0.00 | — | 1.21×105 | 8.68×103 | 2.29×105 |
| R3-1 | 21.9 | 5.10 | 4.09 | 4.28×104 | 1.60×103 | 1.41×105 |
| R4 | 21.9 | 0.00 | 41.45 | 2.78×105 | 6.91×103 | 2.41×105 |
| R5 | 22.0 | 0.60 | 86.11 | 3.73×105 | 6.54×102 | 6.89×105 |
| SW | 22.6 | 33.00 | 3.59 | 1.01×104 | 2.54×104 | 1.19×105 |
| 注: 表中Syn-PC、Syn-PE和Euk分别表示富含藻蓝蛋白聚球藻、富含藻红蛋白聚球藻和微微型真核浮游植物, “—”为无数据。 | ||||||
港内表层水体盐度平均值为28.95±3.24 (图 2d, 2e), 最高值为32.24, 出现在距铺前湾(海端)最近的S12站位, 主要是受到外海水的影响; 由于受到珠溪河水汇入的影响(图 2e), S10站位盐度最低为19.19。东寨港保护水域底层水盐度平均值为30.92±1.74, 底层水盐度高于表层水(图 2f), 说明高盐外海水由底层入侵进入东寨港内。
研究水域表底层pH分布较均匀, 表底层差距小。表底层水体pH平均值分别为8.07±0.11和8.13± 0.04 (图 2g~2i), 东寨港表底层水体呈弱碱性。表层水体的溶解氧(DO)浓度介于296.8~346.6 μmol/L, 平均浓度为(324.0±18.6) μmol/L; 水体中部DO普遍比近岸高(图 3a)。底层水体DO值显著低于表层水体(P < 0.01), DO均值为(285.1±5.8) μmol/L, 范围介于274.1~300.9 μmol/L(图 3b)。
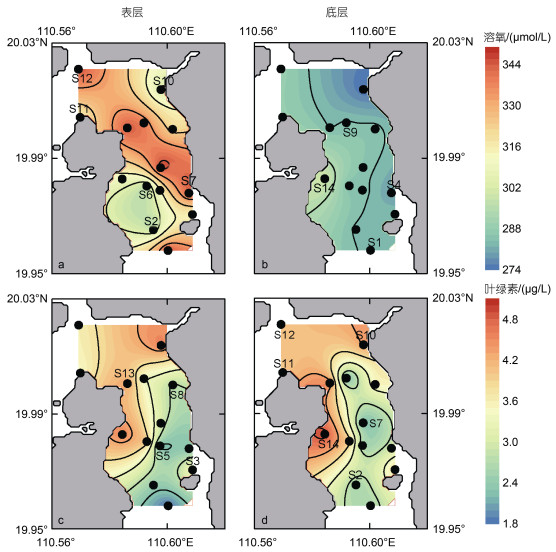 |
| 图 3 调查水域表底层水体溶氧(DO)浓度与叶绿素a分布等值线图 Fig. 3 Contour lines of water dissolved oxygen (DO) concentration and Chl a distribution in the surface and bottom water bodies of the surveyed waters |
东寨港水域表层叶绿素a的含量在1.79~4.57 μg/L, 平均含量为(3.27±0.85) μg/L; 其中含量最高为S10站位, 最低值为S1站位(图 3c)。底层叶绿素a的含量介于2.24~4.92 μg/L, 平均含量为(3.45±0.89) μg/L, 位于珠溪河河口附近的S10站位也明显比其他非河口区域高(图 3d), 可能是珠溪河输入影响。表底层叶绿素a之间的含量无显著性差异(P > 0.05)。冬季东寨港水域叶绿素a整体呈现南边低北边高、中部低沿岸高、非河口低靠近河口高的分布形式(图 3c, 3d)。东寨港冬季叶绿素a的含量显著高于平均含量只有0.53 μg/L的珠江口流域(张霞等, 2013)。本研究河流站位的叶绿素a介于4.09~86.11 μg/L之间, 平均含量为(30.66± 34.60) μg/L, 其中最高值出现在珠溪河的R5站位, 可见东寨港周边支流淡水的叶绿素a含量比咸水得高。
2.2 聚球藻丰度分布 2.2.1 富含藻蓝蛋白聚球藻(Phycocyanin-rich, PC)丰度分布东寨港保护水域内, 表层水体Syn-PC丰度在1.42×104~5.29×104 cells/mL之间, 平均丰度为(2.61×104±1.09×104) cells/mL, 平均细胞大小为(0.77±0.01) μm(图 5a, 表 3)。表层水体Syn-PC站位与站位之间的丰度差距较大, 呈现中部区域明显低于四周的分布形式, 其中水域中部S5站位丰度最低, 靠近珠溪河入口处的S10站位最高(图 4a)。底层水体Syn-PC的丰度在1.06×104~5.93×104 cells/mL之间, 平均丰度为(2.64×104±1.38×104) cells/mL(图 5b); 丰度分布形式总体与表层水体相似, 呈现东部沿岸和南部的几个站位高, 北部、中部和西部沿岸低的趋势, 但是底层S10站位的Syn-PC低于其表层(图 4b)。河流端站位Syn-PC的丰度平均为(1.45×105±1.34×105) cells/mL, 其中最高丰度为珠溪河的R5站位3.73×105 cells/mL, 明显高于东寨港保护区域和新埠海海端SW站位(丰度为1.01×104 cells/mL)(表 2, 图 5c)。
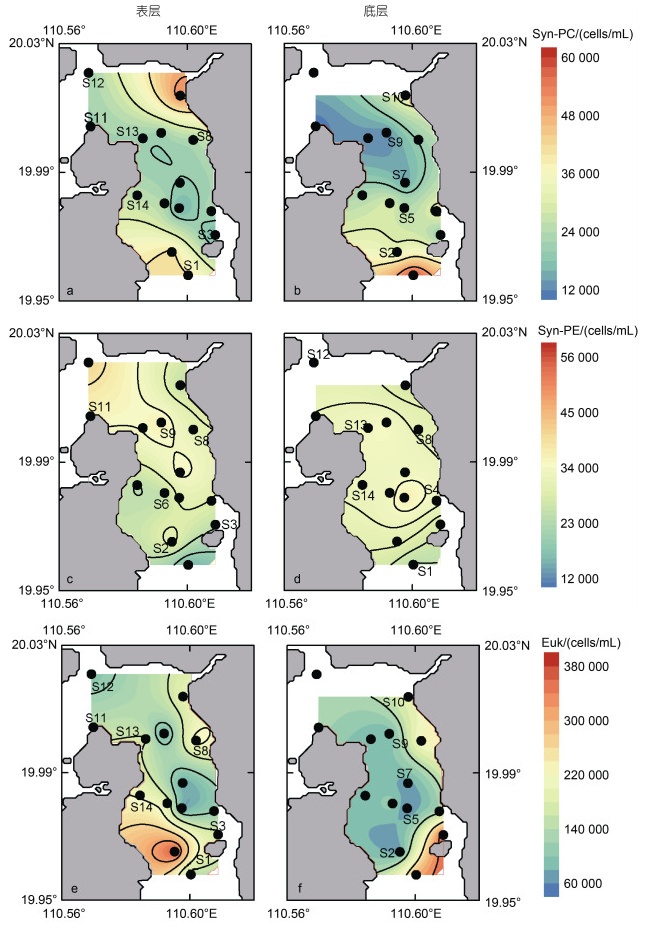 |
| 图 4 调查水域表底层水体微微型浮游植物(Syn-PC、Syn-PE、Euk)丰度分布 Fig. 4 Distribution of microscopic phytoplankton (Syn-PC, Syn-PE, Euk) in the surface and bottom waters of the surveyed regions |
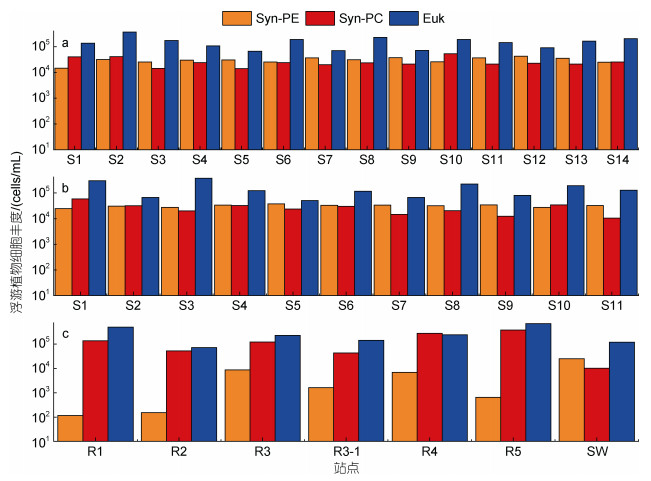 |
| 图 5 东寨港研究水域站位在表层(a)、底层(b)和河流及新埠海海端(c)各类群细胞丰度 Fig. 5 Abundance of various groups of cells in the surface (a), bottom (b), the rivers and the sea end of the Xinbu Sea (c) at the station in Dongzhai Harbor |
| FSAU | D/μm | |||||
| Syn-PE | Syn-PC | Euk | Syn-PE | Syn-PC | Euk | |
| 0.046±0.014 | 0.269±0.024 | 4.568±0.688 | 0.54±0.03 | 0.77±0.01 | 1.35±0.04 | |
| 注: D = DBeads × (FS)1/5 (Zhao et al, 2010); 表中FSAU表示使用流式细胞仪检测的前向散射光信号(FSC)的强度与荧光微球(Beads)的FSC信号强度之比, D和DBeads分别表示估算的样品平均细胞大小(单位为μm); DBeads为Beads的大小, 本研究为1 μm | ||||||
东寨港水域内, 表层水体Syn-PE的丰度在1.47×104~4.25×104 cells/mL之间, 平均丰度为(3.06×104±7.05×103) cells/mL, 平均细胞大小为(0.54± 0.03) μm, 略小于Syn-PC细胞(表 3, 图 5a)。其中, 距海最远的S1站位丰度最低, 离海最近的S12站位丰度最高; 表层水体Syn-PE的丰度分布呈现出明显的北部区域高于南部区域, 靠近珠溪河的S10站位丰度偏低的分布(图 4c)。底层水体Syn-PE的丰度相比于表层水体略高, 介于2.47×104~3.80×104 cells/mL之间, 平均为(3.17×104±3.81×103) cells/mL, 呈现出从中部水域逐渐向四周递减(图 4d, 5b)。河流站位的Syn-PE丰度介于1.15×102~8.68×103 cells/mL之间, 其中站位R1最低, 离海最远的站位R3最高, 丰度显著低于海端SW站位(丰度高达2.54×104 cells/mL) (表 2, 图 5c)。
2.3 微微型真核浮游植物(Pico-Eukaryote, Euk)丰度分布东寨港保护水域内, Euk的丰度比聚球藻Syn高。表层水Euk的丰度在6.66×104~3.66×105 cells/mL之间, 平均丰度为(1.56×105±8.03×104) cells/mL; 平均细胞大小为(1.35±0.04) μm, 大于聚球藻(表 3, 图 5a)。Euk在表层水体的丰度分布呈现西边、东边沿岸和南部水域高, 中部区域和北部区域低, 西南沿岸最高而东南近中部区域最低的分布形式(图 4e)。底层Euk的丰度在5.12×104~3.74×105 cells/mL之间, 平均丰度为(1.57×105±1.05×105) cells/mL。底层水体Euk丰度分布明显呈现东部沿岸高, 中部、西部和西南部以及北部区域低, 南部和东南部区域偏高, 西南部和中部区域偏低的分布情况(图 4f, 5b)。表底Euk丰度无显著性差异(P > 0.05)。河流站位的Euk丰度范围介于7.17×104~6.89×105 cells/mL之间, 平均丰度为(2.84×105± 2.26×105) cells/mL, 其中丰度最高是珠溪河的R5站位; 河流Euk显著高于对应站位的Syn (P < 0.05, 表 2, 图 5c)。
2.4 微微型浮游植物碳生物量水体微微型浮游植物碳生物量Euk>Syn; 对于Syn, 只有河流站位的Syn-PC的平均碳生物量占比高于Syn-PE, 聚球藻两个亚群表现出咸水水体的Syn-PE高于Syn-PC, 淡水水体相反的特征(图 6)。东寨港研究水域内表底层水体Syn-PC的碳生物量分别为(6.65±2.79)和(6.72±3.51) mg C/m3, 约占微型和微微型浮游植物总碳量1.59% (图 6)。河流Syn-PC的碳生物量为(42.69±34.11) mg C/m3, 高出海端SW站位10~20倍(图 6)。东寨港研究水域内, 表层和底层水体Syn-PE的碳生物量分别为(7.80±1.79)和(8.09±0.97) mg C/m3 (图 6)。河流Syn-PE的碳生物量为0.03~2.22 mg C/m3, 占比小于0.1%; 海端SW站位最高为6.47 mg C/m3。调查水域内Euk的碳生物量占比高于94% (图 6)。
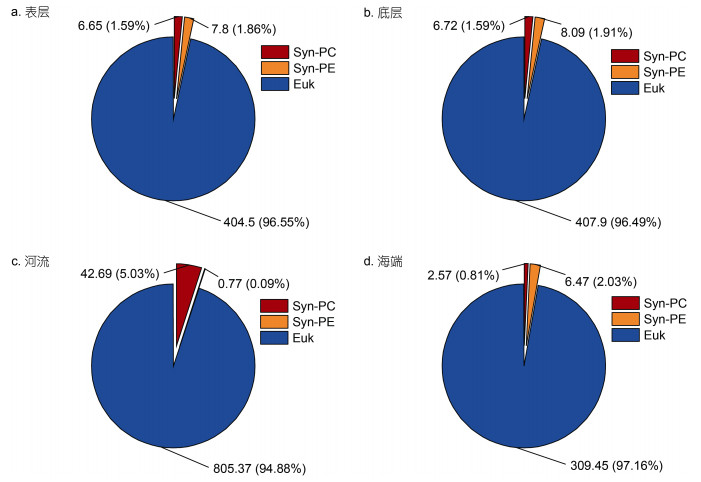 |
| 图 6 东寨港水域表层(a)、底层(b)、河流(c)和海端(d)各类群碳生物量平均值占比 Fig. 6 Percentage of mean carbon biomass of various groups in the surface (a), bottom (b), the rivers (c) and the sea end of the Xinbu Sea (d) in Dongzhai Harbor waters |
研究水域表层水体Syn-PC与盐度呈显著负相关(P < 0.01), Euk与DO呈显著负相关(P < 0.05, 图 7a)。底层水体Syn-PE的丰度与温度呈显著负相关(P < 0.01), 与盐度和pH呈显著正相关(P < 0.01); Syn-PC的丰度与温度呈显著正相关(P < 0.05), 与盐度和pH呈显著负相关(P < 0.01, 图 7b); Euk与温度呈显著正相关(P < 0.05), 与盐度呈显著负相关(P < 0.05); Syn-PE和Syn-PC呈显著负相关(P < 0.05, 图 7b)。河流中Syn-PE的丰度与温度和盐度呈显著正相关, Syn-PC和Euk丰度与叶绿素a呈显著正相关(P < 0.05, 图 7c)。
 |
| 图 7 东寨港研究水域微微型浮游植物细胞丰度和水体基础参数间相关性分析热图: (a)港内表层水体, (b)港内底层水体, (c)东寨港入港河流及新埠海海端(SW) Fig. 7 Heat map of correlation analysis between pico-phytoplankton cell abundance and relevant parameters of the water column in the Dongzhai Harbor study area: (a) surface waters, (b) bottom waters, (c) river around Dongzhai Harbor and seawater 注: 图中右上部分显示相关性圆状色阶。根据比色条显示, 红色表示正相关, 蓝色表示负相关, 紫色表示不相关。圆的大小表示相关程度, 越大说明相关性越高。“*”表示在0.05水平显著, “**”表示在0.01水平显著。图中左下部分显示相关性系数, 字体颜色与右上部分圆形颜色相对应 |
本次调查检测到大量的Euk和Syn, 并未检测到Pro, 主要是三种不同微微型浮游植物的生理特征差异导致的。Euk包含的藻种丰富, 分布及其广泛, 其中包括许多耐低温的物种能够在低温环境中大量生存(Worden, 2006)。Syn在低营养和富营养水域以及赤道到北极地区都被发现(Waleron et al, 2007; Li et al, 2012; Mitbavkar et al, 2012)。Pro主要分布中国东海和南海海域等(宁修仁等, 2003; 陈纪新等, 2006), 但极易受到温度的影响, 其生长的最适温度在24~30 ℃之间(赵越等, 2019)。我们的结果中并没有发现Pro, 这可能与季节有关, 冬季东寨港水域水体的平均温度在20 ℃左右, 导致Pro的丰度急剧下降, 这可能是在东寨港没有检测到Pro的原因之一。东寨港研究水域内Euk的碳生物量占比高于94%, 占有绝对的优势, 赵燕楚等(2018)在桑沟湾的研究同样发现微微型真核浮游生物占自养微微型浮游生物总生物量比例最高, 远高于聚球藻。与我们研究不同的是, 王军星等(2016)年在南海南部发现原绿球藻碳生物量所占比例在所有站位中的均值为50%以上。微微型浮游植物具有不同的生态习性, 在不同地理位置上可以适应不同的水文条件并发挥作用。
Euk大于Syn丰度, Euk包含的藻种丰富, 分布极其广泛, 其中许多耐低温的物种能够在低温环境中大量生存(Worden, 2006)。与杨铭玉等人(2020)在冬季的舟山海域调查结果得出的Euk高于Syn的丰度一致; 聚球藻通常存在于真光层上层0~50 m内, 具有广泛的温度耐受范围, 更为适应热带海域表层水温(张渊洲等, 2015)。然而, 对于聚球藻的两种亚群, 在东寨港研究水域内, Syn-PE和Syn-PC在表底层水体的丰度成反比, 说明二者在环境中处于一种竞争状态, 这与Mao等(2022)在新加坡热带河口的研究结果一致。Syn-PC丰度在东寨港水域和河流有明显差别, 研究发现Syn-PC和Syn-PE丰度会随盐度梯度变化(Rajaneesh et al, 2013), Jiang等(2016)同样发现珠江口Syn-PC: Syn-PE丰度比值与盐度呈负相关, 说明Syn-PC在低盐水中更具优势, 也支持了本研究中表底层水体Syn-PC的丰度分布主要表现为近岸丰度高远岸丰度低的结果, 这与杨铭玉等人(2020)在舟山海域的调查结果相似。通过估算的丰度显示, 东寨港研究水域的Syn-PC高于Syn-PE, 但是在河流却相反, 表明两者同时存在时Syn-PC在咸水区域低于Syn-PE的丰度, 在淡水区域相反。河流站位中Syn-PC丰度明显高于Syn-PE, 可能是与两类聚球藻的生理特性有关, 两类聚球藻的光吸收谱系不同, Syn-PC能有效吸收红光, 呈现蓝绿色, Syn-PE能有效吸收绿光, 呈现红色。研究发现水体浊度的变化, 会影响不同聚球藻水下的光质(Stomp et al, 2007), 从而影响两类聚球藻的丰度(Jiang et al, 2016), 因此浊度可能是影响Syn-PC和Syn-PE组成和分布的主要原因之一。
综合以上分析, 微微型浮游植物的空间分布差异与水体理化参数, 如温度、盐度、pH和DO等密切相关。统计分析结果显示, 表层水体中的Syn-PC丰度与盐度呈现显著负相关; 底层水体的Syn-PC与温度呈现显著正相关, 与盐度和pH呈现显著负相关。不同于Syn-PC是, 底层水体的Syn-PE与温度呈现显著负相关, 与盐度和pH呈现显著正相关, 说明聚球藻与水文条件关系密切, 这也与王军星等(2016)在研究冬季南海南部聚球藻与环境因子之间的关系类似, 同时也表明Syn-PC与Syn-PE在环境中占据不同的生态位。Euk在东寨港研究水域表底层水体分布不同, 表层水体的丰度分布呈现出中部水域低, 西南部水域最高, 西北部水域低的特点; 中部水域和西北部水域在底层水体中同样较低, 但是不同的是底层水体呈现出西南部水域最低, 东南部水域最高的特点。我们的研究结果表明表层水体的DO对Euk丰度分布影响较大, 两者呈现出明显的负相关关系。底层水体的Euk丰度与温度呈正相关但与盐度负相关, 表明在适宜的范围内随着温度的升高而增多, 同时又受到盐度的升高而减少。Zippel等(1999)发现, 微微型真核浮游植物在低盐湖(盐度6.5~8)中具有生长优势, 可能是因为它们细胞体积小, 对无机营养盐的吸收率高。温度对Euk的影响显著, 这与魏玉秋等(2015)的研究结果类似, 其研究表明Euk具有较强的环境适应能力, 即使在寡营养盐海域都可检测到, 并且Euk的分布会受到温度的强烈影响。此外, 营养盐水平也可能是影响微微型浮游植物分布的重要环境因子。王军星等(2016)在调查冬季南海南部微微型浮游植物分布时发现微微型真核生物与硝酸盐和磷酸盐浓度呈显著负相关。张渊洲等(2015)在春季对南海北部微微型浮游植物丰度分布的研究中也同样发现聚球藻、原绿球藻和微微型真核生物与硝酸盐和磷酸盐浓度呈负相关。后续研究将进一步综合考虑营养盐和基础水文参数等对本研究区域微微型以及其他粒径浮游植物的调控。
4 结论(1) 东寨港水域的表底层水体以及近岸河流和海端微微型浮游植物的组成主要包括聚球藻的两个亚群, Syn-PC和Syn-PE, 以及Euk这三种类群, 在该水域中没有检测到原绿球藻。研究水域中Euk的丰度最高, 河流站位中Syn-PC丰度明显高于Syn-PE。
(2) Euk的碳生物量在研究水域中处于绝对优势, 碳生物量占比大约96%, 聚球藻的碳生物量低(大约4%), 其中Syn-PC的碳生物量大约为1.6%, 而在河流水域Syn-PC的碳生物量却比Syn-PE高出23倍。
(3) 东寨港水域微微型浮游植物在表层水体的丰度略高于底层水体, 河流的丰度相对于东寨港水域高。研究水域的微微型浮游植物丰度分布不均, 表底层表现出不同的分布形式, 这与表底层水体的物理参数不同有关。其中温度、盐度和pH对底层水体微微型浮游植物的分布有显著影响; 温度与底层水体中Syn-PC和Euk显著正相关, 与Syn-PE显著负相关, 盐度与Syn-PC和Euk存在显著负相关关系, 与Syn-PE显著正相关, pH与Syn-PC显著负相关, 与Syn-PE显著正相关。温度和盐度对河流、海端中Syn-PE的分布显著正相关。
(4) 本次调查主要针对东寨港红树林开阔水域微微型浮游植物的丰富和分布, 丰富了对东寨港水域微微型浮游植物认识, 同时补充了现有数据中对微微型浮游植物研究的空缺。后续我们会继续深入对东寨港红树林开阔水域浮游植物的研究, 进一步划分不同的粒级, 同步检测不同粒级下叶绿素水平以及营养盐指标, 补充基础数据的同时, 评估不同粒级浮游植物碳汇潜能。
致谢 感谢航次过程中谭萼辉、苏剑钟、符友飞、倪司麟、陆安帅等协助采样。
王军星, 谭烨辉, 黄良民, 等, 2016. 冬季南海南部微微型浮游植物分布及其影响因素. 生态学报, 36(6): 1698-1710 |
王育红, 杨建敏, 张明亮, 等, 2013. 黄河三角洲海参养殖池塘微型浮游植物多样性研究. 海洋与湖沼, 44(2): 415-420 |
中国科学院青岛生物能源与过程研究所, 山东海之宝海洋科技有限公司, 2016. 一种海洋超微型浮游植物固碳量的估算方法: 201610114849.0[P]. 2019-03-26.
|
王晓敏, 江涛, 吕淑果, 等, 2017. 海南陵水湾与新村湾浮游植物光合色素及群落结构的时空分布特征. 海洋环境科学, 36(4): 488-494 |
宁修仁, 蔡昱明, 李国为, 等, 2003. 南海北部微微型光合浮游生物的丰度及环境调控. 海洋学报, 25(3): 83-97 |
孙军, 宋书群, 2009. 东海春季水华期浮游植物生长与微型浮游动物摄食. 生态学报, 29(12): 6429-6438 |
孙晓庆, 董树刚, 2008. 微微型浮游植物的生态学研究进展. 海洋科学, 32(5): 67-72 |
李仕平, 李仙, 张光磊, 等, 2017. 东寨港海水增养殖区水质状况及变化趋势研究. 海南师范大学学报(自然科学版), 30(4): 430-435 |
李汝伟, 徐大鹏, 刘强, 等, 2017. 浙江近海海域超微型光合自养浮游生物的时空分布. 西南农业学报, 30(4): 923-930 |
李棉巧, 徐忠, 汪恒, 2021. 基于稳定同位素的海南东寨港红树林湿地水生食物网结构研究. 中国资源综合利用, 39(6): 49-52 |
李鹏山, 谢跟踪, 李巧香, 等, 2010. 东寨港红树林国家级自然保护区海水水质状况分析与评价. 海洋湖沼通报, (4): 53-60 |
李翠华, 蔡榕硕, 颜秀花, 2020. 2010-2018年海南东寨港红树林湿地碳收支的变化分析. 海洋通报, 39(4): 488-497 |
杨铭玉, 王铠, 赵淑江, 2020. 舟山海域不同功能区微微型自养浮游生物的时空分布. 广东海洋大学学报, 40(2): 44-52 |
杨琳, 汪岷, 刘冠群, 等, 2012. 胶州湾微微型浮游植物丰度及其与环境因子的相关性分析. 海洋与湖沼, 43(5): 967-975 |
何青, 孙军, 栾青杉, 等, 2009. 冬季长江口及其邻近水域的浮游植物. 海洋环境科学, 28(4): 360-365 |
宋伦, 吴景, 刘卫东, 等, 2016. 渤海长兴岛海域微型和微微型浮游植物多样性. 环境科学研究, 29(11): 1635-1642 |
张禹, 刁晓平, 黎平, 等, 2016. 东寨港表层海水中多环芳烃(PAHs)的分布特征及来源分析. 生态环境学报, 25(11): 1779-1785 |
张渊洲, 张健林, 杨清松, 等, 2015. 南海北部春季微微型浮游植物丰度的分布. 生物学杂志, 32(5): 58-62 |
张霞, 黄小平, 施震, 等, 2013. 珠江口超微型浮游植物时空分布及其与环境因子的关系. 生态学报, 33(07): 2200-2211 |
陈纪新, 黄邦钦, 刘媛, 等, 2006. 应用特征光合色素研究东海和南海北部浮游植物的群落结构. 地球科学进展, 21(7): 738-746 |
郑耀洋, 江涛, 吕淑果, 等, 2016. 冬季海南岛五个海湾浮游植物光合色素分布的比较研究. 海洋科学, 40(8): 1-9 |
赵相伟, 魏玉秋, 孙军, 等, 2020. 春、夏季秦皇岛海域超微型浮游植物. 海洋学报, 42(2): 106-114 |
赵越, 于仁成, 张清春, 等, 2019. 北部湾海域微型、微微型浮游植物类群季节变化及其与棕囊藻赤潮的关系初探. 海洋与湖沼, 50(3): 590-600 |
赵燕楚, 赵丽, 张武昌, 等, 2018. 桑沟湾微微型浮游生物丰度和生物量分布的季节变化. 海洋科学, 42(5): 145-154 |
高坤山, 2014. 藻类固碳——理论、进展与方法. 北京: 科学出版社
|
颜秀花, 蔡榕硕, 郭海峡, 等, 2019. 气候变化背景下海南东寨港红树林生态系统的脆弱性评估. 应用海洋学学报, 38(3): 338-349 |
魏玉秋, 孙军, 丁昌玲, 2015. 2014年夏季南海北部超微型浮游植物分布及环境因子影响. 海洋学报, 37(12): 56-65 |
GLOVER H E, PHINNEY D A, YENTSCH C S, 1985. Photosynthetic characteristics of picoplankton compared with those of larger phytoplankton populations, in various water masses in the Gulf of Maine. Biological Oceanography, 3(3): 223-248 |
GUI J, WEI Y Q, SUN J, et al, 2020. Summer phytoplankton assemblages and carbon biomass in the northern south China sea. Continental Shelf Research, 210: 104276 |
JIANG T, CHAI C, WANG J F, et al, 2016. Temporal and spatial variations of abundance of phycocyanin- and phycoerythrin-rich Synechococcus in Pearl River Estuary and adjacent coastal area. Journal of Ocean University of China, 15(5): 897-904 |
LI Y, LI D J, 2012. Spatial distributions of picoplankton and viruses in the Changjiang Estuary and its adjacent sea area during summer. Journal of Marine Biology, 2012: 465168 |
MAO F J, LI W X, SIM Z Y, et al, 2022. Phycocyanin-rich Synechococcus dominates the blooms in a tropical estuary lake. Journal of Environmental Management, 311: 114889 |
MITBAVKAR S, RAGHU C, RAJANEESH K M, et al, 2012. Picophytoplankton community from tropical marine biofilms. Journal of Experimental Marine Biology and Ecology, 426/427: 88-96 |
MOREIRA-TURCQ P F, MARTIN J M, 1998. Characterisation of fine particles by flow cytometry in estuarine and coastal Arctic waters. Journal of Sea Research, 39(3/4): 217-226 |
RAJANEESH K M, MITBAVKAR S, 2013. Factors controlling the temporal and spatial variations in Synechococcus abundance in a monsoonal estuary. Marine Environmental Research, 92: 133-143 |
STOMP M, HUISMAN J, VÖRÖS L, et al, 2007. Colourful coexistence of red and green picocyanobacteria in lakes and seas. Ecology Letters, 10(4): 290-298 |
WALERON M, WALERON K, VINCENT W F, et al, 2007. Allochthonous inputs of riverine picocyanobacteria to coastal waters in the Arctic Ocean. FEMS Microbiology Ecology, 59(2): 356-365 |
WANG F, WEI, Y Q, YUE, J Q, et al, 2021. Distribution and environmental impact factors of picophytoplankton in the East China Sea during spring. Journal of Oceanology and Limnology, 39(4): 1316-1327 |
WEI Y Q, SUN J, ZHANG X D, et al, 2019. Picophytoplankton size and biomass around equatorial eastern Indian Ocean. MicrobiologyOpen, 8(2): e00629 |
WORDEN A Z, 2006. Picoeukaryote diversity in coastal waters of the Pacific Ocean. Aquatic Microbial Ecology, 43: 165-175 |
ZHAO S J, WEI J W, YUE H D, et al, 2010. Picophytoplankton abundance and community structure in the Philippine Sea, western Pacific. Chinese Journal of Oceanology and Limnology, 28(1): 88-95 |
ZIPPEL B, SCHIMMELE M, 1999. Composition and dynamics of autotrophic picoplankton and spectral light distribution in saline lignite mining lakes of Germany. Aquatic Ecosystem Health and Management, 2(3): 319-329 |
 2023, Vol. 54
2023, Vol. 54


