
中国海洋湖沼学会主办。
文章信息
- 陈晓丽, 张吉昌, 王新良, 韩正兵, 彭全材, 王延清, 杨光. 2023.
- CHEN Xiao-Li, ZHANG Ji-Chang, WANG Xin-Liang, HAN Zheng-Bing, PENG Quan-Cai, WANG Yan-Qing, YANG Guang. 2023.
- 冰藻对南大洋大西洋扇区南极磷虾越冬期间碳源的贡献
- CONTRIBUTION OF ICE ALGAE TO CARBON SOURCES OF ANTARCTIC KRILL FROM THE SOUTHWEST ATLANTIC SECTOR OF THE SOUTHERN OCEAN DURING WINTER
- 海洋与湖沼, 54(4): 1101-1112
- Oceanologia et Limnologia Sinica, 54(4): 1101-1112.
- http://dx.doi.org/10.11693/hyhz20221200324
文章历史
-
收稿日期:2022-12-08
收修改稿日期:2023-02-27
2. 崂山实验室 山东青岛 266237;
3. 中国科学院大学 北京 100049;
4. 中国科学院海洋大科学中心 山东青岛 266071;
5. 中国水产科学研究院黄海水产研究所 农业农村部极地渔业可持续利用重点实验室 山东青岛 266071;
6. 崂山实验室 深蓝渔业工程联合实验室 山东青岛 266237;
7. 自然资源部第二海洋研究所 浙江杭州 310012;
8. 中国科学院海洋研究所工程技术部 山东青岛 266071
2. Laoshan Laboratory, Qingdao 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. Center for Ocean Mega Science, Chinese Academy of Sciences, Qingdao 266071, China;
5. Key Laboratory of Sustainable Development of Polar Fishery, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;
6. Joint Laboratory for Open Sea Fishery Engineering, Laoshan Laboratory, Qingdao 266237, China;
7. Second Institute of Oceanography, Ministry of Natural Resources, Hangzhou 310012, China;
8. Engineering Technology Department, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China
极地是全球变化的敏感区域, 全球变暖引起的海冰变化及其对生态系统的影响受到人们的广泛关注(Murphy et al, 2016; Atkinson et al, 2019)。南极大磷虾(Euphausia superba, 以下简称为南极磷虾或磷虾)被认为是南大洋生态系统的基石物种, 一方面南极磷虾作为连接初级生产和高营养级生物的中间环节, 在南大洋食物网中的物质循环和能量传递过程起着重要作用(Schmidt et al, 2016); 另一方面南极磷虾通过摄食浮游植物、粪便排放以及残骸沉降对南大洋生物泵的输出效率产生重要贡献(Cavan et al, 2019; Manno et al, 2020)。因此南极磷虾的种群变动对整个南大洋食物网和生态系统产生重要影响(Kohlbach et al, 2017a)。
尽管南极磷虾是环南极分布物种, 其种群主要集中在南大洋的大西洋扇区, 国际上关于南极磷虾种群变动的研究也多聚焦于这个扇区(Loeb et al, 1997; Atkinson et al, 2004, 2008; Flores et al, 2012)。基于20世纪初期Discovery环南极航次数据结果, 接近70%的磷虾种群聚集在该扇区(Atkinson et al, 2008)。同时该扇区也是南大洋温度升高、海冰减少最为明显的区域(Yang et al, 2021a), 受到海冰减少等环境变化的影响, 南大洋大西洋扇区磷虾丰度显著降低(Atkinson et al, 2004), 种群极向收缩(Atkinson et al, 2019), 并且在高纬度海区形成了新的栖息地(Atkinson et al, 2022)。与大西洋扇区相比, 南大洋其他扇区海冰变化的速率甚至是方向均不一致, 例如罗斯海扇区海冰甚至呈现增加的趋势(Blanchard-Wrigglesworth et al, 2021)。大西洋扇区海冰的减少以及其他扇区生境的相对稳定使得磷虾种群聚集区丰度降低, 从而在环南极尺度上变得更加均匀(Yang et al, 2021b)。
海冰在南极磷虾生活史过程中起着重要作用, 一方面冬季海冰为磷虾越冬提供了重要的饵料(冰藻)和庇护场所; 另一方面夏季海冰消退时形成的稳定水体及藻类的释放利于浮游植物的暴发, 为磷虾种群补充提供饵料(Loeb et al, 1997)。但是目前磷虾种群变动与海冰变化的耦合机制还不明确, 甚至存在一定的争议(Meyer et al, 2017)。主流观点认为海冰为磷虾幼体和成体在冬季和春季浮游植物暴发前提供重要的摄食场所和栖息地(Atkinson et al, 2004, 2019; Flores et al, 2012), 或者强调季节性海冰覆盖间接性地对夏季浮游植物生产和磷虾种群补充产生一定的贡献(Saba et al, 2014); 而也有研究认为海冰与磷虾种群补充没有太直接的关系(Reiss et al, 2017), 并且通过冬季航次的观测强调海冰只是为磷虾幼体越冬的存活提供了庇护场所, 但并非良好的摄食场所(Meyer et al, 2017)。解决这一分歧的关键在于量化出不同区域冰藻及源于水体浮游植物的初级生产对南极磷虾碳源的贡献及其与时间序列海冰变化的耦合关系。
将南大洋食物网中的冰藻碳源和水体中的浮游植物碳源清晰分开具有一定的难度, 磷虾胃含物分析鉴定的硅藻可以源于冰藻, 也可以源于浮游植物(Schmidt et al, 2006, 2014)。近些年两种类异戊二烯化合物(IPSO25及HBI Ⅲ)被分别用作源于海冰的硅藻和源于水体的浮游植物硅藻的标记物应用于极地食物网的研究工作中(Goutte et al, 2014; Belt et al, 2016, 2017)。
本研究基于冬季磷虾生产船采集的样品, 通过选取两种高度支链类异戊二烯标记(IPSO25和HBI Ⅲ)作为冰藻碳源和浮游植物碳源的标志物, 结合磷虾的δ13C和δ15N稳定同位素分析, 对冬季南大洋大西洋扇区48.1亚区和48.3亚区磷虾对冰藻碳源的依赖进行分析。本研究的目的在于解释以下三个问题: (1) 南极磷虾对海冰冰藻和水体浮游藻的依赖是否呈现区域差异? (2) 南极磷虾对两种藻类碳源的依赖是否与体长相关? (3) 摄食冰藻是否影响了南极磷虾的营养级地位?
1 材料与方法 1.1 冬季磷虾样品的获取本研究中所使用的南极磷虾样品由“福荣海”号磷虾渔船采集。采样船在2020年对南极海洋生物资源养护委员会(CCAMLR, Conservation of Antarctic Marine Living Resources)所划定的48.1亚区(布兰斯菲尔德海峡)(63°~64°S, 57°~60°W, 3~5月)和48.3亚区(南乔治亚岛)(53°~54.5°S, 35.5°~36.5°W, 6~8月)的冬季渔业生产期间(3~8月), 每间隔10~14天进行一次磷虾样品的收集, 共计19个采样位点(图 1)。磷虾捕捞后立即−20 ℃冷冻保存, 直至实验室分析。
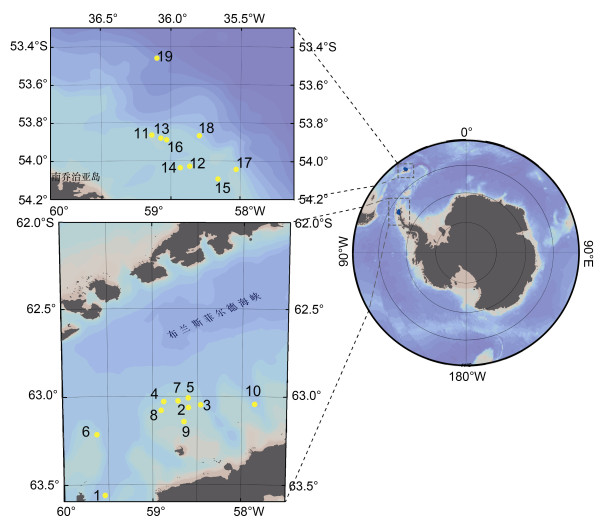 |
| 图 1 大西洋扇区采样站位分布图 Fig. 1 Sampling stations in the Atlantic sector of the Southern Ocean 注: 黄点1~19表示采样站位, 1~10号(按采样时间排序)站位处于48.1亚区(布兰斯菲尔德海峡区域); 11~19号站位处于48.3亚区(南乔治亚岛周边区域) |
磷虾样品在4 ℃条件下进行解冻, 每个采样位点随机挑取5尾形态完整的磷虾, 共计95尾个体作为样本, 记录其单尾个体的体长(LB)、湿重(MW)、性别等基本参数, 并通过公式计算干重(MD)、碳重(MC)、体重体长比(CF)。保留磷虾第二腹节进行稳定同位素δ13C和δ15N测定。相关公式如下:
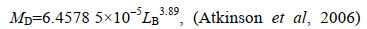 (1)
(1)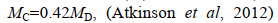 (2)
(2)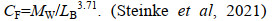 (3)
(3)磷虾样品的第二腹节经真空冷冻干燥48 h后, 使用研钵研磨成粉, 放置于冻存管, −80 ℃条件下保存直到分析。样品的稳定性同位素分析采用稳定同位素比质谱仪(Isoprime-100, Elementar, 英国)进行测定。碳氮的稳定同位素比值以国际通用的δ值(单位: ‰)表示:
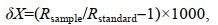
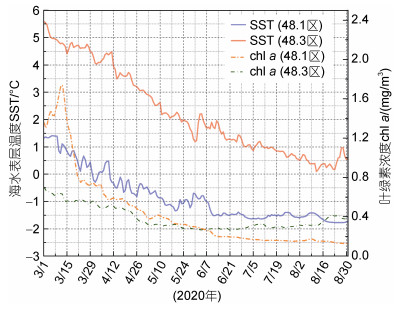
式中, X代表13C或15N, Rsample表示所测得的同位素比值(13C/12C或15N/14N), 碳、氮稳定同位素的Rstandard分别以国际标准物质美洲拟箭石(PDB)和大气氮的同位素值来表示。所有样品的稳定同位素δ13C和δ15N值均在中国水产科学研究院黄海水产研究所完成分析。
1.4 IPSO25和HBI Ⅲ分析利用磷虾样品测定类异戊二烯化合物(IPSO25和HBI Ⅲ)的分析方法参考Belt的相关方法(Belt et al, 2012)。将已测定好各项生物参数的磷虾样品进行真空冷冻干燥, 加入7-HND和9-OHD作为内标, 加入20%氢氧化钾-甲醇溶液, 80 ℃条件下反应2 h, 再用正己烷萃取中性组分, 接着在25 ℃条件下氮吹吹干, 用正己烷定容。随后立即采用Agilen 7890A-5975C气相色谱-质谱联用仪进行测定。IPSO25和HBI Ⅲ含量均以ng/g表示。此外, 对IPSO25/[IPSO25+HBI Ⅲ](简写为Ⅱ/[Ⅱ+Ⅲ], 表示冰藻在磷虾藻类来源的饵料(冰藻和浮游藻)中的占比)进行计算, 而磷虾体组分的(Ⅱ/[Ⅱ+Ⅲ])比值可以用于揭示磷虾的摄食历史(Schmidt et al, 2018)。
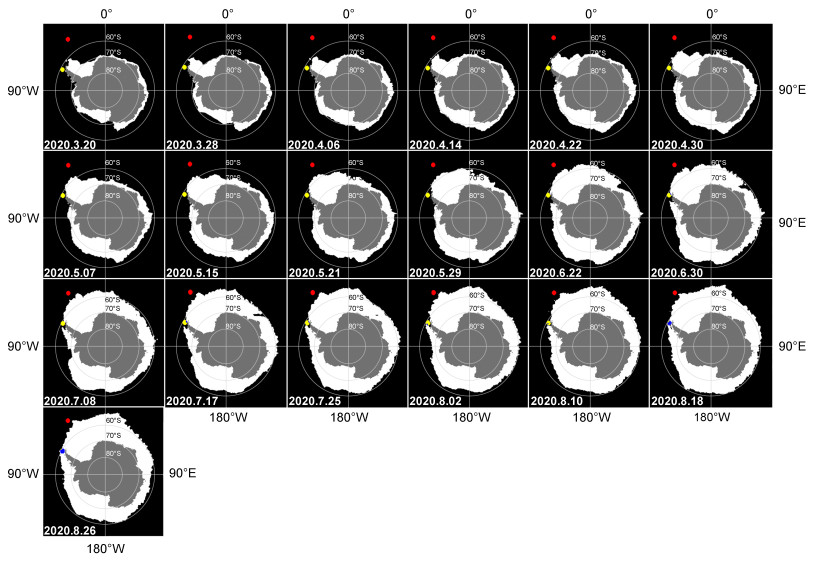
1.5 海冰及叶绿素浓度和海水表层温度数据的获取本研究中磷虾样品采集区域(48.1亚区, 48.3亚区)和采集时期(2020年3~8月)的海冰、表层温度及表层叶绿素浓度数据从相关卫星数据渠道获取, 其中海冰数据源于美国冰雪数据中心(NSIDC)(39°~90°S, 0~360°E; 分辨率: 25 km×25 km)(https://nsidc.org/data/NSIDC-0079/versions/3), 图 2; 叶绿素浓度数据源于全球海洋生物地球化学分析与预测(80°S~90°N, 0~360°E; 分辨率: 0.25°×0.25°)(https://data.marine.copernicus.eu/product/GLOBAL_ANALYSIS_FORECAST_BIO_001_028/description); 海水表层温度(SST)来自NOAA海面温度(90°S~90°N, 180°E~ 180°W; 分辨率: 0.25°×0.25°)(https://www.ncei.noaa.gov/products/climate-data-records/sea-surface-temperature-optimum-interpolation), 叶绿素浓度(chl a)和SST数据皆为2020年3月1日至8月31日的每日数据, 并通过Origin绘图软件制作折线图。
 |
| 图 2 2020年3~8月采样海区海冰状况 Fig. 2 Sea ice conditions in the sampled areas in August, 2020 注: 图中黄点表示48.1亚区采样点, 红点表示48.3亚区采样点, 蓝点表示采样海区与海冰的重合区域 |
对两个区域的各参数, SST、chl a、体长、碳重、稳定同位素(δ13C、δ15N)以及两种HBIs利用SPSS统计软件进行独立样本T检验, 比较均值的区域性差异; 同时也利用SPSS软件对于各区域内的磷虾的体长、体重体长比、碳重、两种HBIs、氮同位素各项数据进行log对数转化后两两之间进行Pearson相关性分析。站位分布图使用ODV (Ocean Data View)软件制作, 海冰状况图使用Arcgis和Photoshop软件制作, 其他图表使用Origin绘图软件完成绘制。
2 结果 2.1 采样区域环境特征采样期间内, 48.1亚区周边海域海冰密集度逐渐升高, 处于边缘冰区, 而48.3亚区则一直处于开阔水域(图 2)。结合SST和chl a (表 1, 图 3), 采样期间48.1亚区的海水表层温度显著低于48.3亚区。48.1亚区的叶绿素浓度3~5月份显著高于48.3亚区, 而6~8月份显著低于48.3亚区。
| 环境参数 | 采样时间 (2020年) |
48.1亚区 | 48.3亚区 | P | ||
| 范围 | 均值±标准差 | 范围 | 均值±标准差 | |||
| 海洋表面温度SST/℃ | 3~8月 | −1.77~1.41 | −0.81±0.91 | 0.09~5.60 | 2.27±1.59 | < 0.01 |
| 叶绿素浓度 chl a/(mg/m3) |
3~5月 | 0.29~1.74 | 0.70±0.40 | 0.26~0.69 | 0.45±0.13 | < 0.01 |
| 6~8月 | 0.13~0.29 | 0.18±0.04 | 0.26~0.41 | 0.31±0.04 | < 0.01 | |
 |
| 图 3 2020年3~8月采样区域海水表层温度(SST)和叶绿素浓度(chl a) Fig. 3 Sea surface temperature (SST) and chlorophyll concentration (chl a) in the sampling area from March to August, 2020 |
通过对比两区域间磷虾的体长和碳重, 发现48.3亚区磷虾体长[(42.69±3.36) mm]和碳重[(42.37±11.80) mg C]都显著高于48.1亚区[体长(38.11±2.78) mm, 碳重(27.60±7.27) mg C; P < 0.05, 图 4]。
 |
| 图 4 不同采样区域磷虾的体长和碳重均值 Fig. 4 Individual krill body length and carbon mass from different sampling areas |
稳定同位素分析结果显示, 48.3亚区南极磷虾δ13C (−23.49‰±1.76‰)和δ15N (5.10‰±0.43‰)都显著高于48.1亚区(δ13C: −28.42‰±1.64‰, δ15N: 3.93‰± 0.84‰; P < 0.05), 这说明48.3亚区的磷虾营养级地位高于48.1亚区的磷虾(图 5)。
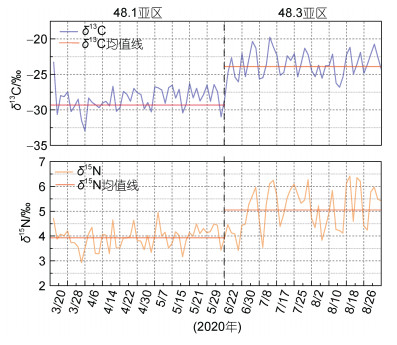 |
| 图 5 不同区域稳定同位素比值(δ13C、δ15N) Fig. 5 Stable isotopes (δ13C and δ15N) from different sampling areas |
通过定量分析HBIs数据发现, 48.1亚区的磷虾体内的IPSO25显著高于48.3亚区磷虾(P < 0.01); 与IPSO25的区域对比结果相反, HBI Ⅲ在48.3亚区磷虾的体内的含量显著高于48.1亚区磷虾(P < 0.01), 同时48.3亚区的HBI Ⅲ数据波动范围更大(图 6)。另外, 本研究也对指示磷虾饵料的比值Ⅱ/(Ⅱ+Ⅲ)进行了区域对比, Ⅱ/(Ⅱ+Ⅲ)比值越高表示磷虾以冰藻硅藻为食的比例越高, 并且磷虾的Ⅱ/(Ⅱ+Ⅲ)比值是随着站点距冰边缘的距离的增加而降低(Schmidt et al, 2018), 磷虾体内IPSO25含量占总类异戊二烯含量百分比的区域性差异(48.1亚区磷虾显著高于48.3亚区)与两区域冰藻对磷虾贡献度的差异以及距冰缘距离的远近(48.1亚区: 冰缘区; 48.3亚区: 开阔水域)有很好的吻合。
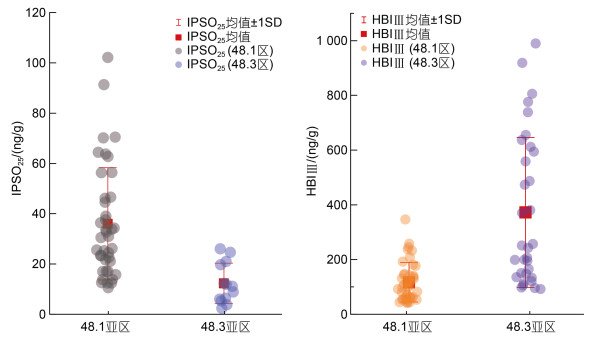 |
| 图 6 不同采样区域磷虾体内高支链类异戊二烯(IPSO25和HBI Ⅲ)含量 Fig. 6 Highly branched isoprenoid(IPSO25 and HBI Ⅲ)concentrations in krill collected from different sampling areas |
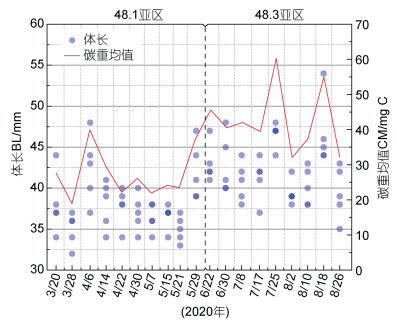
48.1亚区的磷虾两种HBIs在体长范围在30~ 41 mm时呈现同样的增加的趋势, 体长大于45 mm之后, 两种HBIs都呈现下降的趋势; 说明边缘冰区的冰藻可能在磷虾体长较短的时期提供重要碳源。48.3亚区的磷虾两种HBIs与体长的关系呈现出与48.1亚区完全不同的趋势, 可能是因为无冰区磷虾在体长较短的时期对于冰藻碳源的依赖程度低(图 8)。两个区域磷虾δ15N稳定同位素基本随着体长的增加而增加(图 8)。
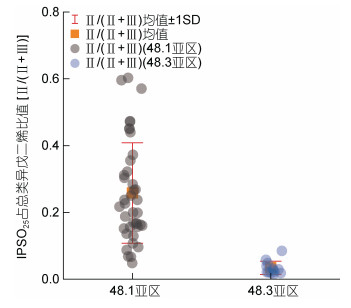 |
| 图 7 不同区域IPSO25占总高支链类异戊二烯的比值[Ⅱ/(Ⅱ+Ⅲ)] Fig. 7 Proportion of IPSO25 to the combined concentrations of IPSO25 and HBI Ⅲ [Ⅱ/(Ⅱ+Ⅲ)] in krill collected from different sampling areas |
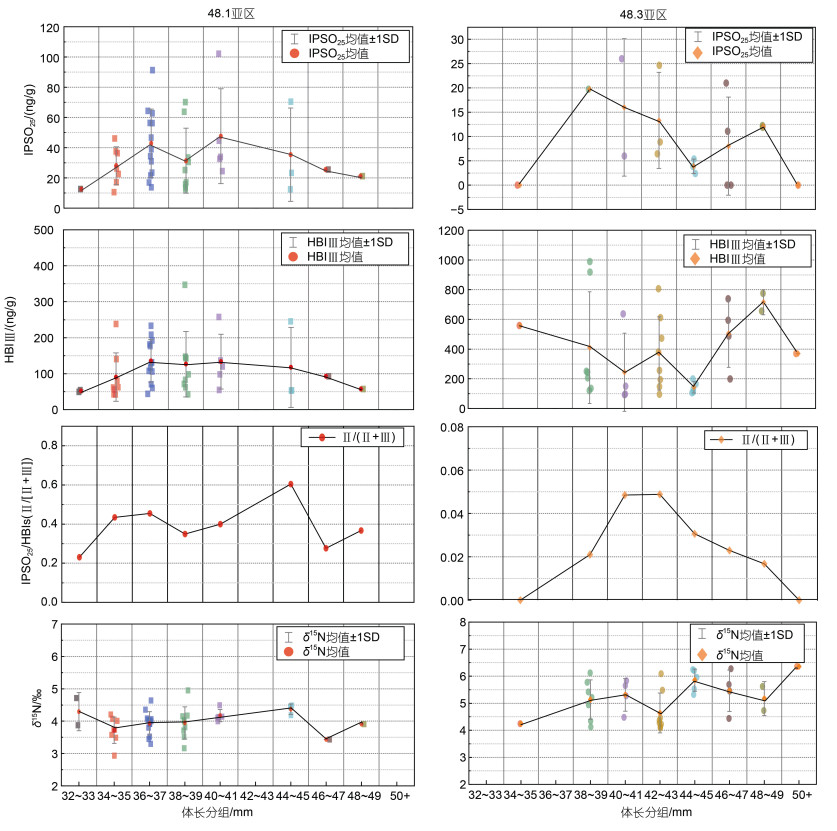 |
| 图 8 不同区域IPSO25、HBI Ⅲ浓度、IPSO25/HBIs比值和δ15N值随体长的变化趋势 Fig. 8 Variation trends of IPSO25, HBI Ⅲ concentrations, IPSO25/HBI ratio and δ15N values with krill body length (BL) from different sampling areas |
Pearson相关性分析显示48.1亚区磷虾体重体长比和碳重具有极显著正相关关系(P < 0.01), 同时IPSO25和氮同位素δ15N呈现显著的正相关关系(P < 0.05)。这说明在边缘冰区的冰藻碳源对于南极磷虾营养级地位的升高有重要贡献。
在48.3亚区, 磷虾的体长和体重体长比具有显著的负相关关系, 和碳重具有极显著的正相关关系(P < 0.01); HBI Ⅲ和IPSO25和氮同位素δ15N都具有极显著的负相关关系(P < 0.01)。这说明在无冰区的冰藻碳源并没有提高南极磷虾的营养级地位, 氮同位素δ15N与两种HBIs负相关关系说明了其他饵料(动物性饵料)的重要性。
3 讨论 3.1 冰藻生物标志物在极地海域食物网中的应用极地海域海冰减少伴随的冰藻供应的变化及其对食物网和生态系统的影响逐渐受到人们的关注(表 2)。目前多数冰藻碳源、浮游植物碳源的定量研究主要基于特定化合物的稳定同位素分析方法(compound-specific stable isotope analyses, CSIA)。Kohlbach等(2017a)基于源于海冰的有机颗粒物(i-POM)、源于水体的有机颗粒物(p-POM)以及南极磷虾体内特定硅藻、甲藻脂肪酸标志物的稳定同位素分析, 结合贝叶斯多源稳定同位素混合模型(MixSIAR)分析, 发现冰藻产生的碳αice对磷虾碳源的贡献可达到88%。Wang等(2015)运用相似方法对北极白令海区域三种浮游动物优势物种(端足类Themisto libellula, 桡足类Calanus glacialis及磷虾Thysaneossa raschii)进行研究, 发现冰藻是北极浮游动物的重要饵料, 为北极不同浮游动物提供了重要的碳源。
| 序号 | 动物类群 | 采样区域 | 经纬度 | 采样时间 | 分析方法 | 主要结论 | 参考文献 |
| 1 | Euphausia superba, Euphausia crystallorophias | 阿德利 海岸 |
65.57°~66.55°S; 139.98°~143.60°E | 2011年1月 | HBIs生物标记 | 磷虾种群中HBIs的纳入可能与浮冰的存在有关。HBI生物标记物是一种很有前景的工具, 可用于估计来自南极大洋区域消费者冰藻类的有机物的贡献 | Goutte et al, 2013 |
| 2 | Calanus.spp. | 威德尔海-斯科特海交汇区 | 58.46°~61.2°S; 26.05°~42.06°W | 2013年8月14日~10月 16日 |
特定化合物稳定同位素分析(CSIA, 下同) | 桡足类和其他依赖冰的浮游动物将大量的碳从冰藻转移到大洋区域, 进而促进食物网、生物碳泵和元素循环的效率。了解冰藻产生的碳在这些过程中的作用将是预测未来海冰减少对南极生态系统功能影响的关键 | Kohlbach et al, 2018 |
| 3 | Euphausia superba | 威德尔海-斯科特海交汇区 | 58.46°~61.20°S; 42.06~26.05°W | 2013年8月14日 | 脂肪酸标记; CSIA | 在海冰季节缩短的区域, 冰藻的减少可能无法通过冬季浮游植物的多余产量得到补偿。因此, 海冰的减少会严重危及幼体磷虾冬季的存活, 进而影响磷虾的整体生物量 | Kohlbach et al, 2017a |
| 4 | Calanus spp., Thysanoessa spp. | 白令海 | 61.59°~63.09°N; 173.29°~173.71°E | 2009年4~ 5月 |
脂肪酸标记; CSIA | 在北极浮游动物生活史的关键时期, 当其无法从水体浮游植物中获得营养时, 冰藻可能是浮游动物的重要食物来源。水体浮游植物生产力的预测增加可能有助于抵消冰藻生产力的预期减少及其可能对浮游动物等消费者产生的任何有害影响 | Wang et al, 2015 |
| 5 | 冰下浮游群落 | 北冰洋的欧亚区 | 81.30°~88.28°N; 30.10°~58.86°E | 2012年8月2日~10月7日 | CSIA | 北冰洋中部的关键生态物种在冰藻的供应下大量繁殖。由于海冰与大洋食物网之间的紧密联系, 海冰覆盖和冰藻产量的变化可能会对大洋食物网的功能和碳动态产生重要影响 | Kohlbach et al, 2016 |
| 6 | 浮游动物 | 北极-加拿大通道 | 74.67°N; 95.26°E | 1992年5月7日~6月25日 | 模型分析 | 冰藻在冰融化早期对大洋消费者具 有重要意义, 并且冰藻向更高营养 水平的转移超出了冰下藻类的最大 产量时期 |
Michel et al, 1997 |
| 7 | Boreogadus saida | 北冰洋的欧亚区 | 81.30°~88.28°N; 30.10°~58.86°E |
2012年8月2日~10月7日 | CSIA | 极地鳕鱼对冰藻产生的碳有很强的依赖性, 幼体极地鳕鱼可能更容易受到海冰栖息地分布和结构变化的影响。由于极地鳕鱼在生态上的关键作用, 与海冰相关的食物网基底的变化可能会影响高纬度北极海洋生态系统的更高营养级生物 | Kohlbach et al, 2017b |
| 8 | Euphausia superba | 斯科特海和乔治亚岛 | 52.00°~63.00°S; 25.00°~60.00°W | 2003年1月9日~2月16日 | HBIs生物标记 | 从海冰中释放出来后, 悬浮或下沉的冰藻可以在浮游植物浓度较低的情况下作为植食动物的饵料补充。季节性海冰的调节作用可以在浮游植物浓度较低时起作用。季节性海冰的调节作用可以促进大洋初级生产力, 从而提高春夏季节的食物供应 | Schmidt et al, 2018 |
近些年生活在海冰中的冰藻产生的高支链类异戊二烯化合物(HBIs)逐渐被用到极地海洋食物网研究中(Schmidt et al, 2016)。高支链类异戊二烯化合物起先被主要用于极地海域海冰的重建, 其中单烯型HBI Ⅰ主要被用于北极(Belt et al, 2015; 吴嘉琪等, 2020), 二烯型HBI Ⅱ主要用于南极(Massé et al, 2011)。目前HBIs作为生物标志物的研究显示这类化合物广泛存在于南大洋中(Schmidt et al, 2018), 可用于估计南极海域动物体内冰藻类碳源和浮游藻类的碳源贡献(Goutte et al, 2013)。Schmidt等(2018)通过IPSO25和HBI Ⅲ标记结合浮游动物的生理学参数干重/体长比、消化腺尺寸及生长率等的测定评估了海冰对南大洋西南极半岛海域浮游动物的影响。本研究在此基础上, 结合了δ13C和δ15N稳定同位素的测定, 来更好地评估南大洋大西洋扇区主要磷虾渔业生产区磷虾越冬期间对海冰冰藻碳源的依赖及其对营养级地位等的影响和区域性差异。
3.2 海冰/冰藻对南极磷虾越冬的重要性南极磷虾在南大洋夏季12~3月产卵, 秋季个体发育成带叉幼体, 带叉幼体在整个冬季需要不断摄食来保证这期间能量的需求(Meyer, 2012)。因为冬季饵料相对匮乏, 越冬阶段被认为是磷虾种群生活史受气候变化影响最为敏感和脆弱的阶段(Flores et al, 2012)。目前, 关于海冰变动(冰藻供给)与磷虾种群补充的相关关系存在一定的争议。一些研究表明, 冬季海冰持续时间缩短的区域, 冰藻碳的减少无法通过冬季浮游藻的增加得到补偿, 因此海冰的减少会影响越冬期幼体磷虾的生存, 从而影响整个磷虾种群的生物量(Kohlbach et al, 2017a)。而Meyer等(2017)通过冬季航次的观察结果认为海冰为磷虾越冬提供的仅仅是一个庇护所, 并不是一个好的摄食场所。
通过特定脂肪酸化合物的稳定同位素分析, Kohlbach等(2017a)首次量化并比较了源于冰藻的碳源和源于浮游藻类的碳源对磷虾幼体的贡献, 研究结果发现威德尔海北部区域磷虾幼体以及1龄虾冬季对冰藻碳源的依赖可以达到67%, 成体磷虾对冰藻碳源的依赖可以降低到30%以下, 我们的研究结果与其相吻合(图 6)。磷虾成体在越冬时有更为灵活的策略来应对饵料的不足, 比如磷虾成体能够降低代谢率, 消耗身体储存的脂类进而呈现负生长现象, 对碎屑、桡足类甚至其他磷虾进行摄食(Ikeda et al, 1982; Meyer et al, 2010; Schmidt et al, 2011)。磷虾成体这种灵活的摄食策略增加了解释冬季不同海冰状况下磷虾饵料与种群补充之间关系过程中的不确定性(Walsh et al, 2020)。
本研究结果显示南极磷虾成体越冬期间对于冰藻和浮游藻类的摄食存在显著的区域性差异(图 6)。HBIs数据显示位于乔治亚岛周边海域的48.3亚区磷虾体内源于浮游藻类的HBI Ⅲ含量显著高于位于布拉斯菲尔德海峡周边海域的48.1亚区的磷虾, 而48.3亚区磷虾体内源于冰藻的IPSO25含量则明显更低(图 6)。海冰密集度及叶绿素浓度数据显示即使在南大洋冬季6~8月份, 南乔治亚岛周边海域海冰密集度低且维持了一定的浮游植物的生长(图 2, 3), 这与此区域磷虾体内更高的浮游藻类的信号有很好的对应(图 6)。同时48.3亚区周边海域磷虾成体更高的δ15N数值(图 5)说明此区域磷虾对动物性饵料有更高的摄食。以往研究也显示越冬期间南乔治亚岛周边海域的磷虾以小型桡足动物(如Oithona spp.)和原生动物作为重要的食物来源(Schmidt et al, 2014)。48.1亚区周边海域磷虾体内更高的IPSO25含量显示冰藻为此区域磷虾越冬阶段提供了重要碳源, 且磷虾对冰藻的摄食提高了自身的营养级地位(图 5, 6), 说明除了冰藻, 浮冰下大量的异养型生物(如原生动物、桡足类等)也可能为磷虾提供了重要的饵料(Meyer et al, 2009)。我们研究结果显示南大洋未来无冰期的延长可能利于低纬度南乔治亚岛周边海域成体磷虾越冬阶段的摄食(Flores et al, 2012), 而不利于高纬度季节性冰区磷虾越冬饵料的供给。
与成体相比, 磷虾幼体脂类含量非常低, 不足以支撑冬季长时间的无饵料饥饿状态。因此冬季初级生产非常低时被认为是磷虾幼体发育的瓶颈期(Loeb et al, 1997; Atkinson et al, 2014)。同时南大洋冬季单纯浮游藻类难以满足磷虾幼体的能量供应, 其必须借助于其他饵料碳源(比如源于海冰的冰藻)来成功越冬(Daly, 1990), 摄食冰藻可促进磷虾幼体的生长和发育, 海冰密集度降低会引起冰藻对于幼年磷虾冬季能量收支贡献的大幅度降低(~146%下降到~16%) (Bernard et al, 2019)。高丰度的磷虾幼体也在南大洋冬季浮冰下被频繁地发现(Meyer et al, 2009; David et al, 2017)。虽然本研究结果显示无冰区的冰藻碳源对于该区域磷虾碳源贡献不高, 但基于磷虾HBIs和营养级随体长的变化关系(图 8), 可以推测在磷虾体长较短的时期, 如成体的早期阶段, 冰藻碳源对其越冬期碳源贡献更为明显。另外, IPSO25占总类异戊二烯化合物(HBIs)的比值[Ⅱ/(Ⅱ+Ⅲ)]越高代表磷虾的饵料组成中冰藻的占比越高(Schmidt et al, 2018), 通过Ⅱ/(Ⅱ+Ⅲ)的比值图(图 8), 表明在成体磷虾体长较短的时期, 冰藻的饵料贡献度有明显升高。简而言之, 冰藻对磷虾越冬阶段的贡献随着个体发育过程发生转变, 磷虾幼体、未成体及早期磷虾成体对冰藻碳源的依赖性更高。
冰藻碳源在夏季浮游植物暴发之前, 特别是冬季末期到春季的过渡期间, 对磷虾的饵料来源起着非常重要的贡献(Kohlbach et al, 2017a)。南大洋大西洋扇区海冰的减少及海冰覆盖季节的缩短伴随的冰藻碳源供应的不足, 使得此区域磷虾丰度降低(Atkinson et al, 2004), 且种群向极地高纬度海域收缩(Atkinson et al, 2019, 2021)。而与之相反的是一种浮游被囊类纽鳃樽因为其种群生活史不依赖于海冰且更易于在相对温暖且无冰的环境中生存将逐渐取代南极磷虾在南大洋生态系统的地位(Atkinson et al, 2004; Pauli et al, 2021)。由于纽鳃樽与南极磷虾在营养价值、碳含量等方面显著的差异(Yang et al, 2022), 这种优势物种的更替将对高营养级生物及整个南大洋生态系统产生影响(Trivelpiece et al, 2011; Constable et al, 2014)。此外南大洋大西洋扇区也是磷虾渔业的主要集中区域, 近些年约70%以上的磷虾渔业集中在这个区域(Krafft et al, 2021), 如果未来该海域海冰持续减少的话, 这将严重影响整个磷虾种群、磷虾渔业的可持续发展和区域性生态系统的稳定。
4 结论本研究显示南大洋大西洋扇区南极磷虾越冬期间对饵料的摄食策略存在显著的区域性差异, 48.3亚区(南乔治亚岛周边海域)的南极磷虾主要以浮游植物和动物性饵料作为越冬期间的主要食物, 呈现出更高的营养级地位; 而48.1亚区(布兰斯菲尔德海峡周边海域)的南极磷虾越冬期间对冰藻有更高的依赖, 特别是体长较短的早期成体。
尽管人们从20世纪起就对南极磷虾进行了大量的研究, 目前关于南极磷虾是否能够适应未来环境的变化还不清楚。未来气候变化对南大洋海冰及伴随的冰藻供应的影响将会通过上行效应影响南大洋食物网和生态系统。对此问题的探究需要我们将海冰变化、海洋变化、饵料供应变化与磷虾分布及种群变动结合起来, 从多圈层的角度预测未来气候变化背景下磷虾种群变动的重要性。
致谢 感谢辽宁远洋渔业有限公司“福荣海”轮船组领导和船员以及南极磷虾科学观察员对南极磷虾样品采集给予的大力协助。
吴嘉琪, 赵军, 韩正兵, 等, 2020. 利用高支链类异戊二烯(HBIs)重建极地海冰的研究进展. 极地研究, 32(1): 121-131 DOI:10.13679/j.jdyj.20190004 |
ATKINSON A, HILL S L, BARANGE M, et al, 2014. Sardine cycles, krill declines, and locust plagues: revisiting 'wasp-waist' food webs. Trends in Ecology & Evolution, 29(6): 309-316 |
ATKINSON A, HILL S L, PAKHOMOV E A, et al, 2019. Krill (Euphausia superba) distribution contracts southward during rapid regional warming. Nature Climate Change, 9(2): 142-147 DOI:10.1038/s41558-018-0370-z |
ATKINSON A, HILL S L, REISS C S, et al, 2022. Stepping stones towards Antarctica: Switch to southern spawning grounds explains an abrupt range shift in krill. Global Change Biology, 28(4): 1359-1375 DOI:10.1111/gcb.16009 |
ATKINSON A, MEYER B, KAWAGUCHI S, et al, 2021. Evaluating change within the krill-based food web and developing solutions for the future sampling of krill: report of the online SCAR krill action group (SKAG) workshop, 26-30 April 2021 [EB/OL]. Zenodo. (2021-05-21). https://zenodo.org/record/4776335#.ZGS0APnQnqs.
|
ATKINSON A, SHREEVE R S, HIRST A G, et al, 2006. Natural growth rates in Antarctic krill (Euphausia superba): Ⅱ. Predictive models based on food, temperature, body length, sex, and maturity stage. Limnology and Oceanography, 51(2): 973-987 DOI:10.4319/lo.2006.51.2.0973 |
ATKINSON A, SIEGEL V, PAKHOMOV E, et al, 2004. Long-term decline in krill stock and increase in salps within the Southern Ocean. Nature, 432(7013): 100-3 DOI:10.1038/nature02996 |
ATKINSON A, SIEGEL V, PAKHOMOV E A, et al, 2008. Oceanic circumpolar habitats of Antarctic krill. Marine Ecology Progress Series, 362: 1-23 DOI:10.3354/meps07498 |
ATKINSON A, WARD P, HUNT B P V, et al, 2012. An overview of Southern Ocean zooplankton data: abundance, biomass, feeding and functional relationships. CCAMLR Science, 19: 171-218 |
BELT S T, BROWN T A, SMIK L, et al, 2017. Identification of C25 highly branched isoprenoid (HBI) alkenes in diatoms of the genus Rhizosolenia in polar and sub-polar marine phytoplankton. Organic Geochemistry, 110: 65-72 DOI:10.1016/j.orggeochem.2017.05.007 |
BELT S T, CABEDO-SANZ P, SMIK L, et al, 2015. Identification of paleo Arctic winter sea ice limits and the marginal ice zone: optimised biomarker-based reconstructions of late Quaternary Arctic sea ice. Earth and Planetary Science Letters, 431: 127-139 DOI:10.1016/j.epsl.2015.09.020 |
BELT S T, SMIK L, BROWN T A, et al, 2016. Source identification and distribution reveals the potential of the geochemical Antarctic sea ice proxy IPSO25. Nature Communications, 7: 12655 DOI:10.1038/ncomms12655 |
BELT S T, BROWN T A, RODRIGUEZ A N, et al, 2012. A reproducible method for the extraction, identification and quantification of the Arctic sea ice proxy IP 25 from marine sediments. Analytical methods, 4(3): 705-713 DOI:10.1039/c2ay05728j |
BERNARD K S, GUNTHER L A, MAHAFFEY S H, et al, 2019. The contribution of ice algae to the winter energy budget of juvenile Antarctic krill in years with contrasting sea ice conditions. ICES Journal of Marine Science, 76(1): 206-216 DOI:10.1093/icesjms/fsy145 |
BLANCHARD-WRIGGLESWORTH E, ROACH L A, DONOHOE A, et al, 2021. Impact of winds and Southern Ocean SSTs on Antarctic sea ice trends and variability. Journal of Climate, 34(3): 949-965 DOI:10.1175/JCLI-D-20-0386.1 |
CAVAN E I, BELCHER A, ATKINSON A, et al, 2019. The importance of Antarctic krill in biogeochemical cycles. Nature Communications, 10(1): 4742 DOI:10.1038/s41467-019-12668-7 |
CONSTABLE A J, MELBOURNE-THOMAS J, CORNEY S P, et al, 2014. Climate change and Southern Ocean ecosystems I: how changes in physical habitats directly affect marine biota. Global Change Biology, 20(10): 3004-3025 DOI:10.1111/gcb.12623 |
DALY K L, 1990. Overwintering development, growth, and feeding of larval Euphausia superba in the Antarctic marginal ice zone. Limnology and Oceanography, 35(7): 1564-1576 DOI:10.4319/lo.1990.35.7.1564 |
DAVID C, SCHAAFSMA F L, VAN FRANEKER J A, et al, 2017. Community structure of under-ice fauna in relation to winter sea-ice habitat properties from the Weddell Sea. Polar Biology, 40(2): 247-261 DOI:10.1007/s00300-016-1948-4 |
FLORES H, ATKINSON A, KAWAGUCHI S, et al, 2012. Impact of climate change on Antarctic krill. Marine Ecology Progress Series, 458: 1-19 DOI:10.3354/meps09831 |
GOUTTE A, CHARRASSIN J B, CHEREL Y, et al, 2014. Importance of ice algal production for top predators: new insights using sea-ice biomarkers. Marine Ecology Progress Series, 513: 269-275 DOI:10.3354/meps10971 |
GOUTTE A, CHEREL Y, HOUSSAIS M N, et al, 2013. Diatom-specific highly branched isoprenoids as biomarkers in Antarctic consumers. PLoS One, 8(2): e56504 DOI:10.1371/journal.pone.0056504 |
IKEDA T, DIXON P, 1982. Body shrinkage as a possible over-wintering mechanism of the Antarctic krill, Euphausia superba Dana. Journal of Experimental Marine Biology and Ecology, 62(2): 143-151 DOI:10.1016/0022-0981(82)90088-0 |
KOHLBACH D, GRAEVE M, LANGE B A, et al, 2016. The importance of ice algae-produced carbon in the central Arctic Ocean ecosystem: Food web relationships revealed by lipid and stable isotope analyses. Limnology and Oceanography, 61(6): 2027-2044 DOI:10.1002/lno.10351 |
KOHLBACH D, GRAEVE M, LANGE B A, et al, 2018. Dependency of Antarctic zooplankton species on ice algae-produced carbon suggests a sea ice-driven pelagic ecosystem during winter. Global Change Biology, 24(10): 4667-4681 DOI:10.1111/gcb.14392 |
KOHLBACH D, LANGE B A, SCHAAFSMA F L, et al, 2017a. Ice algae-produced carbon is critical for overwintering of Antarctic krill Euphausia superba. Frontiers in Marine Science, 4: 310 DOI:10.3389/fmars.2017.00310 |
KOHLBACH D, SCHAAFSMA F L, GRAEVE M, et al, 2017b. Strong linkage of polar cod (Boreogadus saida) to sea ice algae-produced carbon: evidence from stomach content, fatty acid and stable isotope analyses. Progress in Oceanography, 152: 62-74 DOI:10.1016/j.pocean.2017.02.003 |
KRAFFT B A, MACAULAY G J, SKARET G, et al, 2021. Standing stock of Antarctic krill (Euphausia superba Dana, 1850) (Euphausiacea) in the Southwest Atlantic sector of the Southern Ocean, 2018-19. Journal of Crustacean Biology, 41(3): ruab046 |
LOEB V, SIEGEL V, HOLM-HANSEN O, et al, 1997. Effects of sea-ice extent and krill or salp dominance on the Antarctic food web. Nature, 387(6636): 897-900 DOI:10.1038/43174 |
MANNO C, FIELDING S, STOWASSER G, et al, 2020. Continuous moulting by Antarctic krill drives major pulses of carbon export in the north Scotia Sea, Southern Ocean. Nature Communications, 11(1): 6051 DOI:10.1038/s41467-020-19956-7 |
MASSÉ G, BELT S T, CROSTA X, et al, 2011. Highly branched isoprenoids as proxies for variable sea ice conditions in the Southern Ocean. Antarctic Science, 23(5): 487-498 DOI:10.1017/S0954102011000381 |
MEYER B, 2012. The overwintering of Antarctic krill, Euphausia superba, from an ecophysiological perspective. Polar Biology, 35(1): 15-37 DOI:10.1007/s00300-011-1120-0 |
MEYER B, AUERSWALD L, SIEGEL V, et al, 2010. Seasonal variation in body composition, metabolic activity, feeding, and growth of adult krill Euphausia superba in the Lazarev Sea. Marine Ecology Progress Series, 398: 1-18 DOI:10.3354/meps08371 |
MEYER B, FREIER U, GRIMM V, et al, 2017. The winter pack-ice zone provides a sheltered but food-poor habitat for larval Antarctic krill. Nature Ecology & Evolution, 1(12): 1853-1861 |
MEYER B, FUENTES V, GUERRA C, et al, 2009. Physiology, growth, and development of larval krill Euphausia superba in autumn and winter in the Lazarev Sea, Antarctica. Limnology and Oceanography, 54(5): 1595-1614 DOI:10.4319/lo.2009.54.5.1595 |
MICHEL C, LEGENDRE L, INGRAM R G, et al, 1997. Carbon budget of sea-ice algae in spring: evidence of a significant transfer to zooplankton grazers. Oceanographic Literature Review, 44(2): 230 |
MURPHY E J, CAVANAGH R D, DRINKWATER K F, et al, 2016. Understanding the structure and functioning of polar pelagic ecosystems to predict the impacts of change. Proceedings of the Royal Society B: Biological Sciences, 283(1844): 20161646 DOI:10.1098/rspb.2016.1646 |
PAULI N C, METFIES K, PAKHOMOV E A, et al, 2021. Selective feeding in Southern Ocean key grazers—diet composition of krill and salps. Communications Biology, 4(1): 1061 DOI:10.1038/s42003-021-02581-5 |
REISS C S, COSSIO A, SANTORA J A, et al, 2017. Overwinter habitat selection by Antarctic krill under varying sea-ice conditions: implications for top predators and fishery management. Marine Ecology Progress Series, 568: 1-16 DOI:10.3354/meps12099 |
SABA G K, FRASER W R, SABA V S, et al, 2014. Winter and spring controls on the summer food web of the coastal West Antarctic Peninsula. Nature Communications, 5: 4318 DOI:10.1038/ncomms5318 |
SCHMIDT K, ATKINSON A, 2016. Feeding and food processing in Antarctic krill (Euphausia superba Dana) [M] // SIEGEL V. Biology and Ecology of Antarctic Krill. Cham: Springer: 175-224.
|
SCHMIDT K, ATKINSON A, PETZKE K J, et al, 2006. Protozoans as a food source for Antarctic krill, Euphausia superba: Complementary insights from stomach content, fatty acids, and stable isotopes. Limnology and Oceanography, 51(5): 2409-2427 DOI:10.4319/lo.2006.51.5.2409 |
SCHMIDT K, ATKINSON A, POND D W, et al, 2014. Feeding and overwintering of Antarctic krill across its major habitats: The role of sea ice cover, water depth, and phytoplankton abundance. Limnology and Oceanography, 59(1): 17-36 DOI:10.4319/lo.2014.59.1.0017 |
SCHMIDT K, ATKINSON A, STEIGENBERGER S, et al, 2011. Seabed foraging by Antarctic krill: Implications for stock assessment, bentho-pelagic coupling, and the vertical transfer of iron. Limnology and Oceanography, 56(4): 1411-1428 DOI:10.4319/lo.2011.56.4.1411 |
SCHMIDT K, BROWN T A, BELT S T, et al, 2018. Do pelagic grazers benefit from sea ice? Insights from the Antarctic sea ice proxy IPSO25. Biogeosciences, 15(7): 1987-2006 DOI:10.5194/bg-15-1987-2018 |
STEINKE K B, BERNARD K S, ROSS R M, et al, 2021. Environmental drivers of the physiological condition of mature female Antarctic krill during the spawning season: implications for krill recruitment. Marine Ecology Progress Series, 669: 65-82 DOI:10.3354/meps13720 |
TRIVELPIECE W Z, HINKE J T, MILLER A K, et al, 2011. Variability in krill biomass links harvesting and climate warming to penguin population changes in Antarctica. Proceedings of the National Academy of Sciences of the United States of America, 108(18): 7625-7628 |
WALSH J, REISS C S, WATTERS G M, 2020. Flexibility in Antarctic krill Euphausia superba decouples diet and recruitment from overwinter sea-ice conditions in the northern Antarctic Peninsula. Marine Ecology Progress Series, 642: 1-19 DOI:10.3354/meps13325 |
WANG S W, BUDGE S M, IKEN K, et al, 2015. Importance of sympagic production to Bering Sea zooplankton as revealed from fatty acid-carbon stable isotope analyses. Marine Ecology Progress Series, 518: 31-50 DOI:10.3354/meps11076 |
YANG G, ATKINSON A, HILL S L, et al, 2021b. Changing circumpolar distributions and isoscapes of Antarctic krill: Indo-Pacific habitat refuges counter long-term degradation of the Atlantic sector. Limnology and Oceanography, 66(1): 272-287 DOI:10.1002/lno.11603 |
YANG G, ATKINSON A, PAKHOMOV E A, et al, 2022. Massive circumpolar biomass of Southern Ocean zooplankton: Implications for food web structure, carbon export, and marine spatial planning. Limnology and Oceanography, 67(11): 2516-2530 DOI:10.1002/lno.12219 |
YANG J, XIAO C D, LIU J P, et al, 2021a. Variability of Antarctic sea ice extent over the past 200 years. Science Bulletin, 66(23): 2394-2404 DOI:10.1016/j.scib.2021.07.028 |
 2023, Vol. 54
2023, Vol. 54


