
中国海洋湖沼学会主办。
文章信息
- 魏靖乘, 孔令锋. 2023.
- WEI Jing-Cheng, KONG Ling-Feng. 2023.
- 中国近海三种囊舌目(异鳃亚纲, 腹足纲)软体动物的分类学修订
- REVISION OF THREE SPECIES OF SACOGLOSSA (GASTROPODA, HETEROBRANCHIA) FROM CHINA
- 海洋与湖沼, 54(4): 1134-1148
- Oceanologia et Limnologia Sinica, 54(4): 1134-1148.
- http://dx.doi.org/10.11693/hyhz20221000251
文章历史
-
收稿日期:2022-10-05
收修改稿日期:2022-12-22
2. 中国海洋大学三亚海洋研究院 海南三亚 572000;
3. 崂山实验室海洋渔业科学与食物产出过程功能实验室 山东青岛 266237
2. Sanya Oceanographic Institution, Ocean University of China, Sanya 572000, China;
3. Laboratory for Marine Fisheries Science and Food Production Processes, Laoshan Laboratory, Qingdao 266237, China
囊舌目Sacoglossa隶属于腹足纲Gastropoda, 异鳃亚纲Heterobranchia, 是一类生活在潮间带与潮下带海藻丛中的小型海洋软体动物, 该类群中的部分种类体内具有光合活性的盗质体(kleptoplast) (Greene, 1970), 因而引起了软体动物学家们广泛而深入的研究(Casalduero et al, 2008; Christa et al, 2015)。此外, 囊舌目的一些物种可以为药物的研发提供新的材料, 例如从海天牛科的红绿海天牛Elysia rufescens中发现了可用于抗癌的化合物Kahalalide (Hamann et al, 1996); 一些囊舌目的物种还可以作为生物防治入侵藻类的候选物种(Trowbridge, 2004; Burfeind et al, 2009)。
我国目前已发表囊舌目物种5科12属25种(尤仲杰等, 2004; 李琪, 2019; 李歆毓等, 2021)。早期的囊舌目分类学研究较为零散, 主要在区域性物种调查中记录了少数囊舌目物种(林光宇等, 1965; 赵汝翼等, 1981), 这些记录仅提供了形态学描述和手绘图片等有限的信息。近年来, 林光宇和尤仲杰对囊舌目开展了许多以目和科为单位的、较为系统的研究(尤仲杰等, 2004, 2006, 2007), 详细记录了中国近海囊舌目的物种和区系分布, 描述了物种的形态以及齿舌特征, 并提供了手绘图片, 为我国囊舌目物种研究提供了宝贵的资料。
由于原始描述模糊或者模式标本丢失, 国内记录的部分囊舌目物种分类学地位仍然存在许多争议, 下面对本研究涉及的物种进行介绍: (1) 绿海天牛Elysia viridis (Montagu, 1804)。绿海天牛Elysia viridis在山东、浙江、福建、两广地区都有报道, 我国还记录两种和E.viridis形态相似的Elysia属物种, 分别是深绿海天牛E. atroviridis Baba, 1955和黄斑海天牛Elysia flavomacula Jensen, 1990, 其中E. flavomacula模式产地在中国香港, 嗅角为黑色, 侧足边缘有一道白边, 颈部有一个黄色的斑块; E. atroviridis同样具有黑色的嗅角和侧足边缘的白边, 有研究指出E. atroviridis的这些特征存在高度的可变性, 并把依据这些特征区分的濑户海天牛E. setoensis Hamatani, 1968修订为E. atroviridis的同物异名(Takano et al, 2013)。(2) 华丽海天牛Elysia ornata (Swainson, 1840)。《中国近海软体动物图志》记录了在中国南海分布的华丽海天牛E. ornata (李琪, 2019), 但E. ornata的模式产地在加勒比海, 特征为侧足边缘一条黑边, 黑边下有一条橙边, Marcus(1980)基于加勒比海的标本重新描述了该种。在印度-太平洋海域有2种和E. ornata形态相似且分类地位存在争议的同属物种: 三边海天牛E. marginata (Pease, 1871)和大叶海天牛E. grandifolia Kelaart, 1858。三边海天牛E. marginata的模式产地为波利尼西亚, 特征为在侧足的黑边和橙边中间具一条白边。大叶海天牛E. grandifolia Kelaart, 1858的模式产地在斯里兰卡, 特征为侧足与尾部相连且侧足边缘具一条黑边和一条金黄色内边。在一些研究中, E. marginata和E. grandifolia被认为是E. ornata的同物异名(Marcus, 1980; Heller et al, 1983; Jensen, 1992)。Krug等(2013)通过对印度-太平洋海域的“华丽海天牛”相似物种的广泛采样和系统发育分析, 认为除E. ornata外, 在印度-太平洋海域的“华丽海天牛”相似物种中至少存在5个独立的物种。(3)指状棍螺Placida dendritica (Alder et al, 1843)。虽然指状棍螺P.dendritica的模式产地在地中海, 一百多年来却几乎在所有的北半球温带水域都有报道(Okutani, 2000), 在我国的山东青岛和浙江洞头也有分布(尤仲杰等, 2004)。在太平洋海域还有一种分类学地位存在争议的Placida属物种: 马场棍螺P. babai Ev. Marcus, 1982。Marcus(1982)最初建议用P. babai来描述马场菊太郎(Kikutaro Baba)在相模湾收集到的标本以及分布在西太平洋的棍螺属物种, 用以区分分布在大西洋的P. dendritica。最新的分子研究表明, 太平洋海域的Placida属物种与P. dendritica应该是两个独立的物种(Chichvarkhin et al, 2016)。此外, Trowbridge等(2006)曾怀疑分布在中国香港的鹤咀棍螺P. daguilarensis Jensen, 1990是P. babai的同物异名, 但由于P. babai的模式标本可能已经丢失, 该问题目前尚未得到解决。
为厘清以上3个物种的分类学争议, 本研究中, 我们采集了山东青岛、浙江舟山、海南陵水的囊舌目动物标本, 结合齿舌的扫描电镜照片进行了形态学描述和比较, 开展了COI基因测序, 并与已发表重要文献同属物种序列构建系统发育树, 计算遗传距离, 并应用最新的ASAP方法(assemble species by automatic partitioning, Puillandre et al, 2021)进行了物种界定分析。
1 材料与方法 1.1 样品采集本研究的样品采集自山东青岛和即墨、浙江舟山、海南陵水的潮间带或潮下带海藻丛中, 鲜活样品使用尼康D4相机拍照, 固定于95%的酒精中用于后续的分子和齿舌形态学分析。
1.2 扫描电镜图像拍摄在体视显微镜下解剖样品, 取头部置于10%的KOH溶液中溶解结缔组织和肌肉组织, 仅留下齿舌, 用清水冲洗后置于体视显微镜下挑出, 待样品风干后小心地将其放在双面导电胶上完成制片, 在约20.0 kV电压控制的扫描电镜下观察并拍照。
1.3 DNA提取、PCR扩增与测序从每个样品的腹足取10~20 mg肌肉组织, 按照说明书的流程使用TIANGEN海洋动物组织基因组DNA提取试剂盒(离心柱型)提取样品DNA (TIANGEN Biotech Beijing Co. Ltd.), 线粒体COI基因使用通用引物LCO1490和HCO2198扩增(Folmer et al, 1994), 用1%的琼脂糖凝胶电泳检测后置于–20 ℃环境保存。
PCR扩增采用25 µL反应体系, 金牌mix 22 µL (Tsingke Biotechnology Co. Ltd.), 正反引物各1 µL, 模板DNA 1 µL。PCR反应参数为: 94 ℃预变性3 min; 36次循环, 每次循环包括: 94 ℃变性30 s, 48 ℃退火30 s, 72 ℃延伸1 min; 最后72 ℃延伸10 min, 4 ℃保存。PCR产物经1.5%的琼脂糖电泳检测后进行纯化测序。纯化与测序由华大基因科技股份有限公司完成, 所有样品的测序反应都采用双向测序。
1.4 系统发育分析所得序列使用Seqman软件(DNASTAR®软件包)去除引物片段并对测序结果进行校正。从NCBI上下载其他海天牛属以及棍螺属物种的COI序列构建数据集(表 1), 使用MAFFT软件对序列进行比对(Katoh et al, 2013), 所得的数据集分别使用IQtree和PhyloBayes构建基于最大似然法(ML)和贝叶斯法(BI)的系统发育树(Lartillot et al, 2006; Nguyen et al, 2015)。对于深绿海天牛和三边海天牛的ML分析, 使用IQtree的--modellomatic参数自动寻找最适模型, 并运行10 000次重复自举。关于马场棍螺的ML分析, --modellomatic推荐的模型得分较低, 因此使用GHOST异质性模型(Crotty et al, 2020)用于系统发育树的构建。BI分析全部使用CAT+GTR+G4模型(Lartillot et al, 2007), 运行两条独立的蒙特卡罗马尔可夫链, 运行100 000次并丢弃前10%的树, 此后每100代取样一次, 拟合的树分裂频率小于0.01时停止。使用MEGAX软件计算物种间的p-distance遗传距离(Kumar et al, 2018)。对于海天牛属和棍螺属中物种的区分, 使用默认参数设置的ASAP软件进行物种界定(Puillandre et al, 2021)。
| 物种名 | 样品编号 | 采集地 | GenBank编号 | 数据来源 |
| Elysia abei | Elysia abei Jap01 | 日本, 白滨町 | KC573711 | Krug et al, 2013 |
| Elysia abei Jap02 | 日本, 白滨町 | JN819115 | Krug et al, 2013 | |
| Elysia abei Jap03 | 日本, 白滨町 | JN819114 | Krug et al, 2013 | |
| Elysia abei ss1 | 日本, 新潟 | AB758953 | Takano et al, 2013 | |
| Elysia atroviridis | Elysia atroviridis Jap01 | 日本, 千叶 | KC573760 | Krug et al, 2013 |
| Elysia atroviridis TypeM 28 | 日本, 神奈川 | AB758943 | Takano et al, 2013 | |
| Elysia atroviridis TypeA 1 | 日本, 冈山 | AB758905 | Takano et al, 2013 | |
| Elysia atroviridis ElA1 | 日本, 黑岛 | KY061148 | 未发表 | |
| Elysia atroviridis Zhoushan | 中国, 舟山 | OP921571 | 本研究 | |
| Elysia atroviridis Qingdao | 中国, 青岛 | OP921570 | 本研究 | |
| Elysia crispata | Elysia crispata ECR13 | DQ471225 | 未发表 | |
| Elysia crispata ECR42 | DQ471223 | 未发表 | ||
| Elysia crispata ECR46 | DQ471224 | 未发表 | ||
| Elysia cf. marginata | E. cf. marginata Guan01 | 关岛, 帕果湾 | JN819099 | Krug et al, 2013 |
| E. cf. marginata Guan10 | 关岛, 帕果湾 | JN819100 | Krug et al, 2013 | |
| E. cf. marginata Mor01 | 法属波利尼西亚, 莫雷阿岛 | JN819098 | Krug et al, 2013 | |
| Elysia cf. marginata sp.2 | E. cf. marginata sp.2 Jap01 | 日本, 冲绳岛 | KC573692 | Krug et al, 2013 |
| E. cf. marginata sp.2 Jap02 | 日本, 冲绳岛 | KC573693 | Krug et al, 2013 | |
| E. cf. marginata sp.2 Guan01 | 关岛, 皮提湾 | KC573694 | Krug et al, 2013 | |
| E. cf. marginata sp.2 Guan02 | 关岛, 帕果湾 | KC573695 | Krug et al, 2013 | |
| E. cf. marginata sp.2 Van01 | 瓦努阿图, 圣埃斯皮里图 | KC573697 | Krug et al, 2013 | |
| Elysia cf. marginata sp.3 | E. cf. marginata sp.3 Mor01 | 法属波利尼西亚, 莫雷阿岛 | KC573703 | Krug et al, 2013 |
| E. cf. marginata sp.3 Mor02 | 法属波利尼西亚, 莫雷阿岛 | KC573704 | Krug et al, 2013 | |
| E. cf. marginata sp.3 Mor03 | 法属波利尼西亚, 莫雷阿岛 | KC573705 | Krug et al, 2013 | |
| E. cf. marginata sp.3 Mor04 | 法属波利尼西亚, 莫雷阿岛 | KC573706 | Krug et al, 2013 | |
| E. cf. marginata sp.3 Palm01 | 莱恩群岛, 巴尔米拉环礁 | KC573707 | Krug et al, 2013 | |
| E. cf. marginata sp.3 Palm03 | 莱恩群岛, 巴尔米拉环礁 | KC573709 | Krug et al, 2013 | |
| E. cf. marginata Kanagawa | 日本, 神奈川 | KC573700 | Krug et al, 2013 | |
| E. marginata‘ Okinawa | 日本, 冲绳岛 | KC573698 | Krug et al, 2013 | |
| Elysia marginata Hainan1 | 中国, 陵水 | OP921572 | 本研究 | |
| Elysia marginata Hainan2 | 中国, 陵水 | OP921573 | 本研究 | |
| Elysia marginata Hainan3 | 中国, 陵水 | OP921574 | 本研究 | |
| Elysia ornata | Elysia ornata Cur01 | 库拉索 | JN819096 | Krug et al, 2013 |
| Elysia ornata Cur02 | 库拉索 | JN819097 | Krug et al, 2013 | |
| Elysia ornata Cur03 | 库拉索 | JN819095 | Krug et al, 2013 | |
| Elysia ornata Jam02 | 牙买加 | JN819094 | Krug et al, 2013 | |
| Elysia rufescens | Elysia rufescens Jap01 | 日本, 冲绳岛 | KC573688 | Krug et al, 2013 |
| Elysia rufescens Haw01 | 美国, 夏威夷 | KC573689 | Krug et al, 2013 | |
| Elysia rufescens Haw02 | 美国, 夏威夷 | KC573690 | Krug et al, 2013 | |
| Elysia viridis | Elysia viridis 727 | 法国 | GQ996669 | Händeler et al, 2009 |
| Elysia viridis 738 | 法国 | GQ996668 | Händeler et al, 2009 | |
| Plakobranchus ocellatus | Plakobranchus cf. ocellatus PoccKT | 菲律宾 | JX272685 | Christa et al, 2013 |
| Plakobranchus papua | Plakobranchus papua PpapKT1 | 印度尼西亚, 苏拉威西岛 | KC573732 | Krug et al, 2013 |
| Placida barackobamai | Placida barackobamai Syd01 Aus | 澳大利亚 | MF773473 | McCarthy et al, 2019 |
| Placida barackobamai JCP03 | 美国, 夏威夷 | MF773472 | McCarthy et al, 2019 | |
| Placida barackobamai JCP17 | 美国, 夏威夷 | MF773475 | McCarthy et al, 2019 | |
| Placida brookae | Placida brookae JCP02 | 美国, 加利福尼亚 | MF773467 | McCarthy et al, 2019 |
| Placida brookae JCP04 | 美国, 加利福尼亚 | MF773468 | McCarthy et al, 2019 | |
| Placida brookae JCP05 | 美国, 加利福尼亚 | MF773469 | McCarthy et al, 2019 | |
| Placida brookae JCP06 | 美国, 加利福尼亚 | MF773470 | McCarthy et al, 2019 | |
| Placida dendritica | Placida dendritica ie236 R | KU140946 | Chichvarkhin et al, 2016 | |
| Placida dendritica 793 spain | 西班牙 | KF921396 | Christa et al, 2014 | |
| Placida dendritica 0681 USA | 美国, 弗吉尼亚 | KP254613 | Leray et al, 2015 | |
| Placida dendritica 0683 USA | 美国, 弗吉尼亚 | KP255161 | Leray et al, 2015 | |
| Placida babai | Placida babai AC1111 R | 日本, 千叶 | KU133301 | Chichvarkhin et al, 2016 |
| Placida babai AC2118 R | 俄罗斯, 符拉迪沃斯托克 | KU133296 | Chichvarkhin et al, 2016 | |
| Placida babai 180 R | 俄罗斯, 涅韦尔斯克 | KU133297 | Chichvarkhin et al, 2016 | |
| Placida babai 181 R | 俄罗斯, 涅韦尔斯克 | KU133298 | Chichvarkhin et al, 2016 | |
| Placida babai 183 R | 俄罗斯, 沃斯托克 | KU133299 | Chichvarkhin et al, 2016 | |
| Placida babai Qingdao 1 | 中国, 青岛 | OP921575 | 本研究 | |
| Placida babai Qingdao 2 | 中国, 青岛 | OP921576 | 本研究 | |
| Placida daguilarensis | Placida daguilarensis PIdagSado J | 日本, 黑岛 | LC531984 | 未发表 |
| Placida daguilarensis waka1 J | 日本, 和歌山 | LC531994 | 未发表 | |
| Placida daguilarensis waka2 J | 日本, 和歌山 | LC531995 | 未发表 | |
| Placida kevinleei | Placida kevinleei Okinawa | 日本, 冲绳岛 | KM086427 | Krug et al, 2015 |
| Stiliger aureomarginatus | Stiliger aureomarginatus Jap01 | 日本, 冲绳岛 | KM086439 | Krug et al, 2015 |
| Stiliger ornatus | Stiliger ornatus 843 | 埃及, 达哈布 | HQ380203 | Wägele et al, 2010 |
腹足纲Gastropoda Cuvier, 1795
异鳃亚纲Heterobranchia Burmeister, 1837
泛肺螺总目Panpulmonata Jörger, Stöger, Kano, Fukuda, Knebelsberger & Schrödl, 2010
囊舌目Sacoglossa Ihering, 1876
海天牛亚目Plakobranchacea Gray, 1840
海天牛总科Plakobranchoidea Gray, 1840
海天牛科Plakobranchidae Rang, 1829
海天牛属Elysia Risso, 1818
身体光滑或有小的突起, 头部小, 颈部和足细长。眼位于嗅角基部两侧, 嗅角通常外侧有裂沟, 呈耳状或棒状。足前侧隅角状或钝圆。腹足向上延展形成侧足, 与足末端连接, 形态多变, 或发达可伸展呈圆形, 或狭小仅能覆盖身体背部。背前中部可透见圆形、卵圆形、长圆形的围心囊。齿舌单列, 呈剃刀状, 齿光滑或有小锯齿。
深绿海天牛Elysia atroviridis Baba, 1955 (图 1)
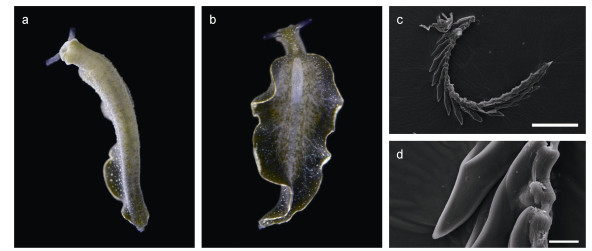 |
| 图 1 深绿海天牛Elysia atroviridis Baba, 1955 Fig. 1 Elysia atroviridis Baba, 1955 注: a, b. 动物活体(22 mm); c, d. 齿舌。比例尺: 200 μm (c); 20 μm (d) |
Elysia atroviridis Baba, 1955: 12, 42, text- figs 11-12; Jensen, 1985: 79-81, figs 1A, 2A, E; 尤仲杰、林光宇, 2007: pl. Ⅱ: 3.
样品检视: 30个来自山东青岛第三海水浴场的样品, 20~40 mm, 36°3′21.6″N, 120°22′22.8″E; 2个来自浙江舟山枸杞岛的样品, 5~20 mm, 30°42′39.6″N, 122°47′34.8″E。
形态描述: 长度最长超过40 mm, 身体呈深绿色, 嗅角黑色, 较短, 呈棒状, 基部有白点, 末端为白色。围心囊长圆形, 可见数条白色的肝分支从围心囊伸展至侧足各处, 且从围心囊末端伸出一根长肝分支直到尾部末端。眼明显, 位于嗅角基部后端。侧足发达或狭长, 在侧足边缘有一道白边, 侧足上布满了白色小点, 有的标本也可见小的白色突起, 这些突起在标本酒精固定后消失。足底背面白色-淡绿色, 有许多小的白点和白色突起, 并可见深绿色的小的腺体分支到达。齿舌呈剃刀状, 齿侧面有小的锯齿。
生物学: 常在潮间带和潮下带的石莼等藻类上缓慢爬行, 生境中可见松藻属和刚毛藻属的藻类。卵带白色, 紧密地盘绕呈圆形。在野外捕捉到的个体为深绿色, 在水箱中饲养一段时间后会观察到体表颜色逐渐变浅, 可能是体内的盗质体逐渐凋亡而得不到补充导致的。
讨论: Takano等(2013)总结了濑户海天牛E. setoensis的形态特征: 侧足有红棕色圆圈, 颈部和嗅角有白色疣突, 嗅角尖端为黑色, 而深绿海天牛E. atroviridis的原始描述中形态特征为侧足表面深绿色并有白色斑点, 侧足边缘有一道白边, 整个嗅角都为黑色。Takano等(2013)依据这些特征收集并仔细区分了45个海天牛标本, 发现了6个完全符合E. atroviridis特征的标本和5个完全符合E. setoensis特征的标本, 以及34个同时包含两个物种混合特征的标本。然而, 基于COI和16S的分子研究都指出所有的45个标本为同一物种。因此, Takano等(2013)认为濑户海天牛E. setoensis是深绿海天牛E. atroviridis的同物异名。由此可见, E. atroviridis在侧足有无红色斑点、嗅角是否有疣突、体表是否有白色突起、颈部是否有白色斑块等形态特征上存在很大的变异, 这些变异可能导致早期的形态学研究和物种鉴定出现偏差。尽管我国先前的分类学研究中报道了绿海天牛E. viridis (尤仲杰等, 2007), 但是在地理分布上, 绿海天牛E. viridis的模式产地在地中海, 印度-太平洋海域未见有E. viridis的报道[WoRMS Editorial Board (2023)], 形态上, 绿海天牛E. viridis区别于深绿海天牛E. atroviridis的主要形态特征为侧足表面有小蓝点和四个大白色斑块, 较易与E. atroviridis侧足的白色疣突相混淆。因此, 国内先前报道的E. viridis可能为E. atroviridis的误定。此外, 国内的研究提到一些深绿海天牛标本头部有黄色斑块(尤仲杰等, 2007), 这些标本可能是与深绿海天牛相似的黄斑海天牛E. flavomacula。Takano等(2013)对E. flavomacula的有效性提出了质疑, 认为E. flavomacula可能也是E. atroviridis的同物异名。但Tsuyoshi的研究中E. flavomacula样品数量很少且并不来自模式产地, 对于E. flavomacula是否是一个有效名这一问题, 仍需对来自模式产地的样品进行系统的解剖学与系统发育分析来进一步讨论。在水箱中饲养时观察到了部分个体到将颈部以下身体全部舍弃的自切行为, 有研究指出这可能是为了驱逐体内的寄生虫而引起的(Mitoh et al, 2021)。如此大体积的自切(甚至舍弃了全部的消化系统和大部分循环系统)在自然界中相当罕见, 目前仅在E. atroviridis和Elysia cf. marginata中有报道(Mitoh et al, 2021)。
三边海天牛Elysia marginata (Pease, 1871) (图 2)
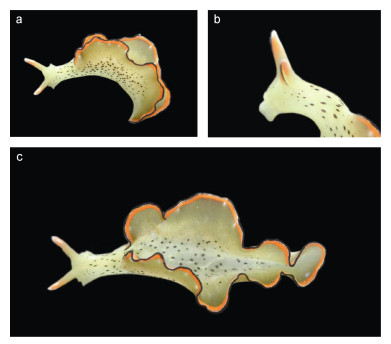 |
| 图 2 三边海天牛Elysia marginata (Pease, 1871) Fig. 2 Elysia marginata (Pease, 1871) 注: a、b、c均为动物活体(25 mm) |
Pterogasteron marginatus Pease, 1871: pl.21, fig. 3.
Elysia marginata Baba, 1955: fig. 5.
Elysia ornata Jensen, 1992: fig. 11; Okutani, 2000: 451, pl.407, fig. 1; 李琪, 2019: 236 (non Swainson, 1840).
样品检视: 5个海南陵水小赤岭的样品, 20~ 30 mm, 18°23′13.2″N, 109°51′10.8″E。
形态描述: 长度在20~30 mm之间, 身体翠绿色。嗅角较长, 基部与身体颜色相同, 柄部为橙红色, 末端有白色斑点, 嗅角外侧有裂沟, 呈耳状, 裂沟边缘有一道黑边。围心囊长圆形, 可见数条白色的肝分支从围心囊伸展至侧足各处, 但不明显。眼位于嗅角基部后端, 易与体表的黑斑混淆。侧足发达或狭长, 侧足边缘从外到内分别有黑、白、橙三道窄边, 侧足上可见零星的白斑和小的橙红色小点, 颈部和身体有较大的黑色斑点, 较为稀疏。足底背面翠绿色, 有零星的黑色小点。
生物学: 生活在潮间带和潮下带的海藻丛中, 生境中有松藻属和蕨藻属的藻类。卵带白色, 紧密地盘绕呈圆形。与E. atroviridis同样, Elysia cf. marginata也存在大程度的自切行为(Mitoh et al, 2021), 海南的E. marginata未被观察到有此行为, 并不确定该物种能否进行如此极限的自切。
讨论: Krug等(2013)描述了5种来自印度-太平洋海域的E. ornata相似物种, 本研究的分子数据支持海南的样品与来自法属波利尼西亚的“sp.3”编号的Elysia cf. marginata是同一物种。由于模式标本已丢失, 无法对海南的标本进一步鉴定。但E. marginata的模式产地就是波利尼西亚, 因此, 在E. marginata得到修订或重新描述之前, 我们建议把中国南海和线岛附近海域的Elysia属物种暂定为三边海天牛Elysia marginata。与“sp.3”编号物种相比, 海南的样品具有一些独有的特征, 例如身体有细小的橙色斑点, 黑色斑点大而稀疏, 并不扩散到侧足和嗅角等, 没有表现出Krug等(2013)提到的“身体颜色较深”和“弯折的侧足”等特点。此外, Krug等(2013)还发现了两种遗传距离较远但是形态上没有显著区别的E. ornata相似物种, 进一步导致了整个印度-太平洋的E. ornata相似物种的分类地位混乱, 而该问题的彻底解决需要使用综合的物种界定方法对已命名的几个物种进行重新修订。
柱螺科Limapontiidae Gray, 1847
棍螺属Placida Trinchese, 1876
身体柔软、扁平、伸长。头部短小, 前缘稍扩张, 形似头幕。头触角细长, 外侧有裂沟。体背围心囊两侧有数列背鳃突起, 长短不一, 其中包含肝分支和粘液腺分支。眼小, 明显, 位于嗅角基部后侧。围心囊卵圆形, 位于背前中部。头部前侧隅扩张形成短小的嗅角, 呈耳形。齿舌单列, 齿侧面光滑或有小的锯齿。
马场棍螺Placida babai Ev. Marcus, 1982 (图 3)
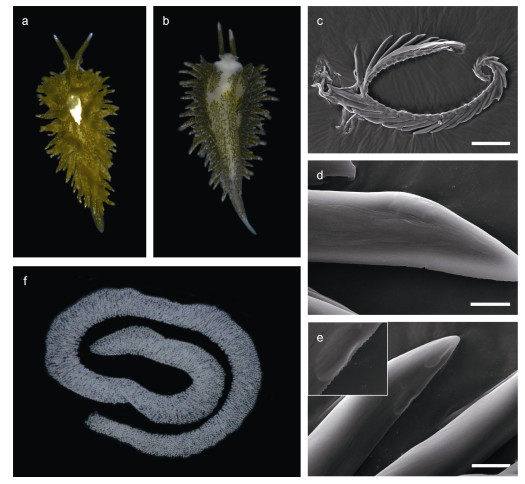 |
| 图 3 马场棍螺Placida babai Ev. Marcus, 1982 Fig. 3 Placida dendritica Ev. Marcus, 1982 注: a, b. 动物活体(18 mm); c. 齿舌; d. 光滑型齿; e. 锯齿型齿; f. 卵块。比例尺: c. 100 μm; d, e. 10 μm |
Placida dendritica Baba, 1955: 10, 41, pl. Ⅲ, fig. 9, text- fig. 9; 齐钟彦、林光宇, 1986: 55; 1989: 113-114, pl.Ⅰ: 17; Okutani, 2000: 450 pl. 406, fig. 2; 尤仲杰、林光宇, 2004: fig. 1; 张素萍等, 2016: 193, fig. 236 (non Alder & Hancock, 1843).
Placida babai Marcus, 1982: 9, figs 31-32; Chichvarkhin et al, 2016: figs 2A, D.
样品检视: 2个来自山东青岛第三海水浴场的样品, 10~20 mm, 36°3′21.6″N, 120°22′22.8″E; 11个来自山东即墨田横的样品, 15~20 mm, 36°33′39.6″N, 120°58′33.6″E。
形态描述: 体长在10~20 mm之间, 身体青绿色。头部短小, 前缘稍扩张, 形似头幕, 嗅角细长, 青绿色, 外侧有一道裂沟, 末端有一白斑并有细小白点。眼位于嗅角基部后侧, 较明显。围心囊水滴形, 呈白色, 并在其中可见青绿色的腺体分支, 从围心囊发出大量树枝状肝分支, 到达身体各处。背部在围心囊两侧有数列背鳃, 背鳃青绿色, 大小不一, 表面有小的白色斑点。足底背面白色, 有大量树枝状的肝分支到达。齿舌单列, 呈尖锥状, 齿侧面光滑或有小锯齿。
生物学: 生活在潮间带和潮下带的海藻丛中, 生境中有松藻属和刚毛藻属的藻类。卵带白色, 形状不规则(图 3f)。野外捕捉到的个体为青绿色, 在水箱中饲养一段时间后逐渐变为黄褐色, 可能是体内盗质体逐渐凋亡导致的。体背部的背鳃易脱落, 脱落后还可自行蠕动一段时间, 可能是该生物的一种御敌手段。
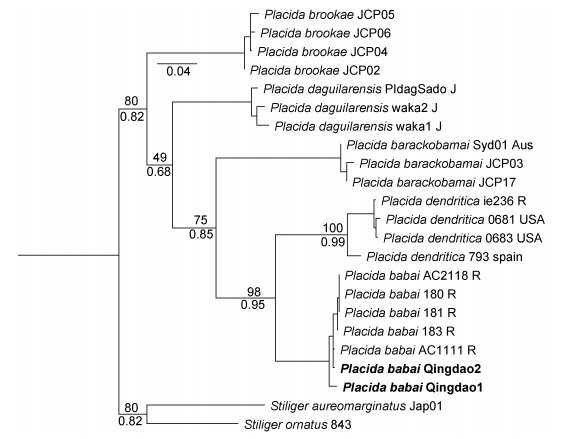
讨论: P. babai最初被用来描述马场菊太郎(Kikutaro Baba)在相模湾收集到的标本(Baba, 1955), Baba(1955)将这些标本鉴定为指状棍螺P. dendritica, 但是Marcus(1982)基于Baba(1955)的描述将它们确立为一个新种, 即马场棍螺P. babai。随后Baba(1986)通过对这些标本齿舌的研究, 认为P. babai不是一个有效名, 但他也指出这些标本不是P. dendritica而是另一种Placida属的物种, 并暂称这些标本为Placida sp.。Hirao等(2006)通过对日本相模湾(P. babai的模式产地)的Placida属样品进行解剖, 认为先前报道的P. dendritica是一个误定, 他总结了P. dendritica与这些样品在器官结构方面的主要差异: P. dendritica的前列腺分裂为四个部分而Placida sp.的前列腺并不分裂, 并建议在使用整合分类学方法研究P. dendritica相似物种之前, 使用Placida sp.而不是P. babai来指定这些样品。Chichvarkhin等(2016)对采自俄罗斯、日本的标本和西班牙、英国等地的P. dendritica进行了系统的解剖学和分子系统学研究, 支持使用P. babai这一有效名描述采自俄罗斯、日本的样品。我们的分子研究显示, 采自中国黄海的棍螺属物种和Chichvarkhin等(2016)采集的俄罗斯、日本的棍螺属物种同为一种, 且与大西洋的P. dendritica在遗传距离上有显著差距。此外, P. babai仍是一个合乎国际动物命名法规(ICZN)的有效名, 因此国内先前报道的指状棍螺P. dendritica应该是马场棍螺P. babai的误定。在形态上, P. dendritica与P. babai的区别主要在于P. dendritica背部有两条主要的肝分支从嗅角贯穿到腹足, 而P. babai则被细密的枝状肝分支充满全身。此外, Chichvarkhin等(2016)描述的俄罗斯的P. babai以及P. dendritica腹足背面干净, 没有肝分支到达, 但是在中国黄海发现的所有P. babai样品腹足背面都可见大量的青绿色肝分支(图 3b), 这可能是中国黄海P. babai种群独特的形态特征。
2.2 系统发育分析 2.2.1 深绿海天牛Elysia atroviridis Baba, 1955来自太平洋和大西洋的20个Elysia属物种的COI序列的最大似然(ML)和贝叶斯(BI)分析表现出了一致的拓扑结构, 山东青岛和浙江舟山的Elysia属样品的序列与所有已发表的深绿海天牛E. atroviridis序列聚为一枝(图 4)。遗传距离的结果也显示, 来自青岛和舟山的样品与E. atroviridis的遗传距离在0.2%~1%之间, E. viridis以及Elysia属其他物种与青岛和舟山样品的遗传距离在15%~19%之间(表 2)。ASAP的物种界定分析中, 在最低得分2.5分(即最可靠)的情况下划分了六个物种分区, 与系统发育的分析结果一致, 青岛与舟山的样品与其他E. atroviridis聚在同一分区(图 5)。
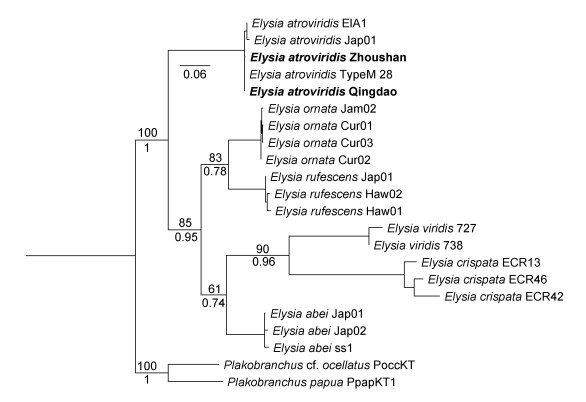 |
| 图 4 基于COI序列的海天牛属物种的ML树(左)和BI树(右) Fig. 4 Phylogenetic hypothesis for the Elysia species based on COI sequences 注: bootstrap值标注在对应的枝上, posterior probability(PP)值标注在对应的枝下(加粗代表本研究中测序的序列) |
| 物种名 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 1. Elysia atroviridis, Qingdao | ||||||||
| 2. E. atroviridis, Zhoushan | 0.002 | |||||||
| 3. E. atroviridis, Kanagawa | 0.000 | 0.002 | ||||||
| 4. E. atroviridis, Kuroshima Is | 0.005 | 0.007 | 0.005 | |||||
| 5. E. atroviridis, Choshi | 0.009 | 0.010 | 0.009 | 0.005 | ||||
| 6. E. ornata, Jamaica | 0.150 | 0.153 | 0.151 | 0.151 | 0.152 | |||
| 7. E. rufescens, Okinawa | 0.150 | 0.148 | 0.151 | 0.155 | 0.159 | 0.096 | ||
| 8. E. crispata | 0.186 | 0.187 | 0.186 | 0.183 | 0.184 | 0.165 | 0.178 | |
| 9. E. viridis, Banyuls-sur-Mer | 0.192 | 0.188 | 0.191 | 0.191 | 0.188 | 0.173 | 0.188 | 0.180 |
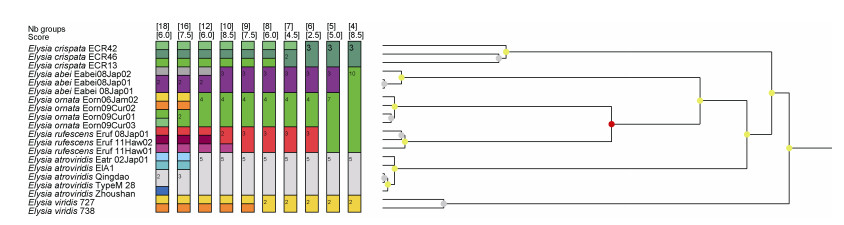 |
| 图 5 对于海天牛属的ASAP物种界定分析 Fig. 5 ASAP analysis of the Elysia species based on COI sequences 注: 在最低得分(2.5)时ASAP方法为海天牛属区分出六个物种 |
来自印度-太平洋海域和加勒比海的21个E. ornata类似物种的COI序列被用于系统发育树构建和物种界定分析。ML与BI分析呈现出一致的结果, 只在法属波利尼西亚样品的系统发育关系中出现了差别, 来自海南的样品与法属波利尼西亚和线岛的样品聚为一枝, 形成了其他所有类群的姐妹群, 两枝来自关岛的样品和一枝来自日本的样品与来自加勒比海的E. ornata互为姐妹群(图 6)。ASAP的物种界定分析中, 在最低得分1.5分(即最可靠)的情况下划分了除确定的E. ornata和E. rufescens以外四个潜在的物种, 与系统发育的分析结果一致, 支持来自海南的样品与法属波利尼西亚和线岛的样品为同一物种(图 7)。由表 3可知, 在对COI的p-distance遗传距离分析中, 来自海南的样品与法属波利尼西亚和线岛的样品遗传距离最小, 在0.2%~0.8%之间, 与E. ornata和其他印度-太平洋海域的类似物种的遗传距离在9%~10%之间。值得注意的是, 在法属波利尼西亚有另一个E. ornata的类似物种与海南的样品遗传距离达到了9%, 意味着法属波利尼西亚可能存在形态相似但分子遗传距离较远的两个物种。同样, 来自关岛的样品在系统发育分析中也形成了两个分支, 表明在印度-太平洋域的E. ornata相似物种中存在相当大的潜在物种多样性, 在同一区域可能存在多个分子上差异显著的物种。
 |
| 图 6 基于COI序列的“华丽海天牛”类似物种的ML树(左)和BI树(右) Fig. 6 Phylogenetic hypothesis of E. ornata complex based on COI sequences 注: bootstrap值标注在对应的枝上, posterior probability (PP)值标注在对应的枝下(加粗代表本研究中测序的序列) |
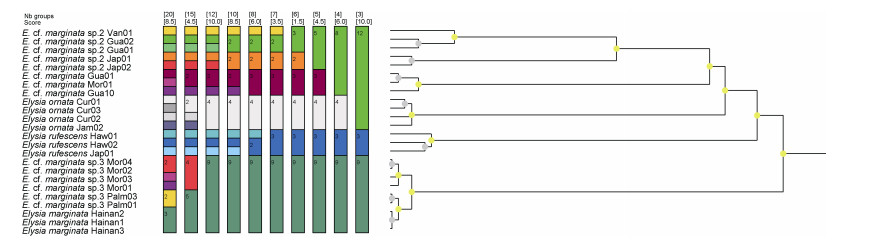 |
| 图 7 对于“华丽海天牛”类似物种的ASAP物种界定分析 Fig. 7 ASAP analysis of E. ornata complex based on COI sequences 注: 在最低得分(1.5)时ASAP方法为“华丽海天牛”相似物种区分出六个潜在物种 |
| 物种名 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 1. Elysia marginata, Hainan | |||||||||
| 2. E cf. marginata, Palmyra Atoll | 0.002 | ||||||||
| 3. E cf. marginata, Kanagawa | 0.005 | 0.003 | |||||||
| 4. E cf. marginata, Moorea | 0.008 | 0.006 | 0.009 | ||||||
| 5. E cf. marginata, Moorea | 0.090 | 0.088 | 0.087 | 0.094 | |||||
| 6. E cf. marginata, Okinawa | 0.091 | 0.093 | 0.094 | 0.093 | 0.071 | ||||
| 7. E. ornata, Jamaica | 0.101 | 0.099 | 0.101 | 0.099 | 0.092 | 0.083 | |||
| 8. E. rufescens, Okinawa | 0.102 | 0.100 | 0.100 | 0.103 | 0.099 | 0.084 | 0.090 | ||
| 9. E cf. marginata, Vanuatu | 0.104 | 0.102 | 0.102 | 0.104 | 0.085 | 0.054 | 0.090 | 0.083 | |
| 10. E. abei, Shirahama | 0.120 | 0.120 | 0.122 | 0.123 | 0.129 | 0.117 | 0.129 | 0.128 | 0.126 |
来自大西洋和太平洋棍螺属21个COI序列的ML和BI分析取得了一致的结果, 山东青岛的棍螺样品与采自俄罗斯、日本的棍螺属物种聚为一枝, 与西班牙、美国、加拿大的指状棍螺P. dendritica互为姐妹群, 中国香港的鹤咀棍螺P. daguilarensis单独聚为一枝(图 8)。基于COI的p-distance遗传距离分析显示, 青岛的棍螺与俄罗斯海、日本千叶的棍螺样品遗传距离最小, 在0.3%~0.8%之间, 与温哥华和西班牙的P. dendritica在11%~13%之间, 表明俄罗斯海、日本、中国黄海的棍螺属物种与P. dendritica不是同一物种。此外, 鹤咀棍螺P. daguilarensis与P. dendritica和P. babi的遗传距离在16%~22%之间(表 4), 从分子水平上支持P. daguilarensis的有效性。ASAP的物种界定分析中, 在最低得分1.5分(即最可靠)的情况下划分了五个物种分区, 与系统发育的分析结果一致, 青岛的样品与俄罗斯海的P. babai聚在同一分区(图 9)。
 |
| 图 8 基于COI序列的棍螺属物种的ML树(左)和BI树(右) Fig. 8 Phylogenetic hypothesis of Placida species based on COI sequences 注: bootstrap值标注在对应的枝上, posterior probability (PP)值标注在对应的枝下(加粗代表本研究中测序的序列) |
| 物种名 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 1. Placida babai, Qingdao | |||||||||
| 2. P. babai, Chiba | 0.003 | ||||||||
| 3. P.babai, Nevelsk | 0.008 | 0.008 | |||||||
| 4. P. babi, Vladivostok | 0.008 | 0.008 | 0.000 | ||||||
| 5. P. dendritica, Vancouver Island | 0.114 | 0.111 | 0.116 | 0.116 | |||||
| 6. P. dendritica, Spain | 0.123 | 0.122 | 0.125 | 0.125 | 0.038 | ||||
| 7. P. daguilarensis, Kuroshima | 0.181 | 0.181 | 0.185 | 0.185 | 0.203 | 0.211 | |||
| 8. P. barackobamai, Sydney | 0.183 | 0.184 | 0.182 | 0.182 | 0.191 | 0.192 | 0.183 | ||
| 9. P. brookae, California | 0.188 | 0.189 | 0.189 | 0.189 | 0.192 | 0.180 | 0.167 | 0.197 | |
| 10. P. kevinleei, Okinawa | 0.188 | 0.186 | 0.183 | 0.183 | 0.205 | 0.197 | 0.226 | 0.196 | 0.179 |
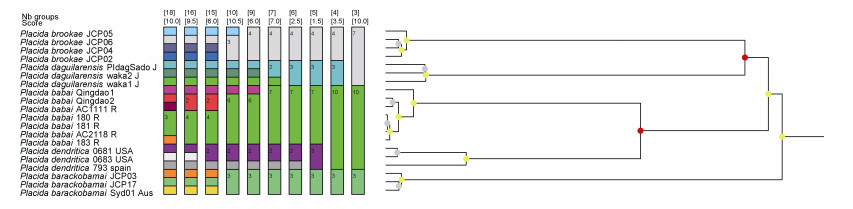 |
| 图 9 对于棍螺属的ASAP物种界定分析 Fig. 9 ASAP analysis of Placida species based on COI sequences 注: 在最低得分(1.5)时ASAP方法为棍螺属区分出五个物种 |
囊舌目物种成体的壳大多退化, 相较于其他腹足纲动物, 缺少易于量化的形态特征, 因此早期的形态学研究侧重于齿舌形态来作为分类的依据(Reid, 1964; Marcus, 1980)。但后来的一些研究表明囊舌目动物的齿舌具有很高的可塑性, 有可能随年龄或取食藻类的不同而产生较大的种内差异, 因此将齿舌作为分类的依据并不可靠(Baba, 1986; Jensen, 1993; Trowbridge et al, 2006)。Baba(1986)通过对P. babai的解剖, 发现P. babai定种的唯一依据——齿舌形态在种内存在很大的变异。本研究支持了Baba的这一发现, 在即墨田横采集到的棍螺标本中, 同时存在齿舌侧边有小锯齿(图 3e)和齿舌侧边光滑(图 3d)的个体。此外, 在海天牛属中, 齿舌也存在较大的种内和种间变异, Jensen(1993)通过对取食不同藻类绿海天牛E. viridis齿舌的观察, 发现取食Codium属藻类的绿海天牛样品齿舌大, 尖端弯曲并有侧面突起, 而取食Chaetomorpha属藻类的绿海天牛样品齿舌小, 几乎笔直且有小锯齿, 因此齿舌难以作为鉴定E. viridis的可靠材料。剃刀状的齿(图 1d)一直以来被认为是海天牛属的齿舌特征, 部分物种因为有三角形的齿而被划分到了拟海天牛属Elysiella (Jensen, 1993), 然而后续的分子研究却表明拟海天牛属的物种属于海天牛属(Händeler et al, 2007), 因此将齿舌的形状作为海天牛属的鉴别特征并不可靠。实际上, 根据Jensen(1993)对55种囊舌目物种齿舌的比较观察, 囊舌目的齿舌形态可能更反应取食偏好而非系统发育关系, 例如在海天牛科、长足螺科中都有齿舌剃刀状的物种, 这些物种更偏向于取食细丝状的藻类, 而海天牛科和长足螺科中取食其他藻类的物种则拥有三角形的齿舌。基于以上研究以及本研究对P. babai齿舌的检视, 囊舌目的齿舌形态不应作为物种界定时优先考虑的定种依据。
3.2 新的物种界定方法揭示了更多隐种多样性DNA条形码技术为物种界定带来了一种方便且可靠的手段, 但是物种界定的阈值, 也就是所谓的“条形码间隙”在不同的类群难以统一, 因此使用DNA条形码来提出通用的物种界定标准始终难以实现(Blaxter et al, 2005; Ward, 2009)。此外, 适应辐射也会导致物种间的DNA条形码间隙变得模糊, 使得很多潜在的物种被视作其他物种的同物异名(Hebert et al, 2004; Meyer et al, 2005)。近年来, 随着生物信息技术的发展, 一些新的物种界定方法被用于发现传统方法难以区分的物种, 并在异鳃亚纲的部分类群中得到应用(Krug et al, 2013; Tibiriçá et al, 2018; Ekimova et al, 2020)。本研究通过使用新的ASAP (Assemble Species by Automatic Partitioning)方法分析了海天牛属和棍螺属内的物种划分, 在所有的分析中, ASAP方法都很好地支持了系统发育分析结果并在对传统分类方法难以区分的印度-太平洋海域“华丽海天牛”相似物种的分析中划分了至少五个独立的物种, 对这些潜在物种的发掘将会使人们对印度-太平洋海域软体动物的物种多样性有更全面的认识。
3.3 对于中国沿海囊舌目物种研究的展望目前, 我国对于囊舌目物种的研究主要集中于分类学, 对该类群独特的盗质体形成机制以及其中蕴含的细胞内共生原理仍缺少聚焦。国外学者从早期就对囊舌目物种的这一独特现象表现出浓厚兴趣, 并通过实验对这一生理特征进行了总结(Hinde et al, 1974), 而且随着科研方法的更新, 对于盗质体的研究也越来越深入(Cruz et al, 2020), 但始终没有证实盗质体的形成机理。国内虽然缺少对于盗质体的研究基础, 但拥有数量庞大、种类繁多的囊舌目物种资源, 对于该领域的研究具备得天独厚的优势。此外, 在分类学研究方面, 虽然21世纪初我国的分类学者对囊舌目的一些类群进行了较为系统的区系研究(尤仲杰等, 2004, 2006, 2007), 但此后鲜少有人将囊舌目动物的分类学研究继续深入, 无论是动物活体的高清彩色图片、齿舌的扫描电镜还是对于生殖系统解剖的研究都寥寥无几甚至存在空白, 这些工作仍需国内的软体动物分类学家们更广泛和深入的研究以及不懈努力。由于早期的研究多集中于形态学, 我国沿海的囊舌目动物研究存在多样性调查严重不足以及分类混乱的问题(Zhang et al, 2020), 囊舌目动物在形态上的广泛变异以及高度适应食性的齿舌结构也给这一类群的分类学研究增添了挑战, 在这种情况下, 我们更提倡用分子系统学和形态学研究相结合的整合分类学方法进行分类学研究, 在形态、地理分布、系统发育分析等多证据的综合佐证下对囊舌目物种进行鉴定。
4 结论(1) 国内先前记录的指状棍螺P. dendritica应是马场棍螺P. babai的误定。
(2) 海南的“华丽海天牛”不是E. ornata, 而应与法属波利尼西亚和线岛的“华丽海天牛”相似物种为同一物种, 在三边海天牛E. marginata得到重新修订前, 我们建议将海南的样品暂定为三边海天牛E. marginata。
(3) 囊舌目动物的外部形态特征存在很大程度的种内变异, 齿舌形状也常因为年龄和取食植物的不同而产生分化。因此, 提倡使用比较形态学与分子系统学相结合的整合分类学方法对该类群进行分类学研究。
尤仲杰, 林光宇, 2004. 中国近海棍螺科(后鳃类)的研究. 宁波大学学报(理工版), 17(4): 373-379 DOI:10.3969/j.issn.1001-5132.2004.04.001 |
尤仲杰, 林光宇, 2006. 中国近海背楯目、囊舌目(软体动物)区系的研究. 宁波大学学报(理工版), 19(1): 40-43 DOI:10.3969/j.issn.1001-5132.2006.01.010 |
尤仲杰, 林光宇, 2007. 中国近海海天牛科(后鳃类)的研究. 浙江海洋学院学报(自然科学版), 26(4): 363-370 DOI:10.3969/j.issn.1008-830X.2007.04.001 |
齐钟彦, 1986. 中国动物图谱——软体动物(第三册). 北京: 科学出版社, 55-57
|
齐钟彦, 1989. 黄渤海的软体动物. 北京: 农业出版社, 113-114
|
李琪, 2019. 中国近海软体动物图志. 北京: 科学出版社, 236-237
|
李歆毓, 崔闯, 安启源, 等, 2021. 海南省海口市发现白边侧足海天牛. 动物学杂志, 56(4): 631-635 DOI:10.13859/j.cjz.202104016 |
张素萍, 张均龙, 陈志云, 等, 2016. 黄渤海软体动物图志. 北京: 科学出版社, 193-194
|
林光宇, 张玺, 1965. 海南岛潮间带的后鳃类软体动物. 海洋与湖沼, 7(1): 1-20 |
赵汝翼, 程济民, 赵大东, 1981. 大连潮间带后鳃类软体动物记录. 东北师大学报自然科学版, (1): 43-50 |
ALDER J, HANCOCK A, 1843. XXVIII. —Notice of a British species of Calliopæa, D'Orbigny, and of Four new species of Eolis, with observations of the Development and Structure of the Nudibranchiate Mollusca. Annals and Magazine of Natural History, 12(77): 233-238 DOI:10.1080/03745484309442517 |
BABA K, 1955. Opisthobranchia of Sagami Bay. Tokyo: Iwanami Shoten, 12, 24
|
BABA K, 1986. Anatomical information on Placida sp. =Hermaea dendritica of Baba, 1937 and 1955, from Japan. Shells and Sea Life, 18: 21-22 |
BLAXTER M, MANN J, CHAPMAN T, et al, 2005. Defining operational taxonomic units using DNA barcode data. Philosophical Transactions of the Royal Society B: Biological Sciences, 360(1462): 1935-1943 DOI:10.1098/rstb.2005.1725 |
BURFEIND D D, TIBBETTS I R, UDY J W, 2009. Grazing rates of Elysia tomentosa on native and introduced Caulerpa taxifolia. Hydrobiologia, 632(1): 355-358 DOI:10.1007/s10750-009-9845-2 |
CASALDUERO F G, MUNIAIN C, 2008. The role of kleptoplasts in the survival rates of Elysia timida (Risso, 1818): (Sacoglossa: Opisthobranchia) during periods of food shortage. Journal of Experimental Marine Biology and Ecology, 357(2): 181-187 DOI:10.1016/j.jembe.2008.01.020 |
CHICHVARKHIN A Y, EKIMOVA I A, CHALENKO K P, et al, 2016. Placida babai (Mollusca, Sacoglossa) from Russian waters of the Sea of Japan. The Bulletin of the Russian Far East Malacological Society, 20(1): 41-56 |
CHRISTA G, GOULD S B, FRANKEN J, et al, 2014. Functional kleptoplasty in a limapontioidean genus: phylogeny, food preferences and photosynthesis in Costasiella, with a focus on C. ocellifera (Gastropoda: Sacoglossa). Journal of Molluscan Studies, 80(5): 499-507 DOI:10.1093/mollus/eyu026 |
CHRISTA G, HÄNDELER K, KÜCK P, et al, 2015. Phylogenetic evidence for multiple independent origins of functional kleptoplasty in Sacoglossa (Heterobranchia, Gastropoda). Organisms Diversity & Evolution, 15(1): 23-36 |
CHRISTA G, WESCOTT L, SCHÄBERLE T F, et al, 2013. What remains after 2 months of starvation? Analysis of sequestered algae in a photosynthetic slug, Plakobranchus ocellatus (Sacoglossa, Opisthobranchia), by barcoding. Planta, 237(2): 559-572 DOI:10.1007/s00425-012-1788-6 |
CROTTY S M, MINH B Q, BEAN N G, et al, 2020. GHOST: recovering historical signal from heterotachously evolved sequence alignments. Systematic Biology, 69(2): 249-264 |
CRUZ S, LEKIEFFRE C, CARTAXANA P, et al, 2020. Functional kleptoplasts intermediate incorporation of carbon and nitrogen in cells of the Sacoglossa sea slug Elysia viridis. Scientific Reports, 10(1): 10548 DOI:10.1038/s41598-020-66909-7 |
EKIMOVA I A, ANTOKHINA T I, SCHEPETOV D M, 2020. Molecular data and updated morphological description of Flabellina rubrolineata (Nudibranchia: Flabellinidae) from the Red and Arabian seas. Ruthenica, 30(4): 183-194 DOI:10.35885/ruthenica.2021.30(4).1 |
FOLMER O, BLACK M, HOEH W, et al, 1994. DNA primers for amplification of mitochondrial cytochrome c oxidase subunit I from diverse metazoan invertebrates. Molecular Marine Biology and Biotechnology, 3(5): 294-299 |
GREENE R W, 1970. Symbiosis in sacoglossan opisthobranchs: functional capacity of symbiotic chloroplasts. Marine Biology, 7(2): 138-142 DOI:10.1007/BF00354917 |
HAMANN M T, OTTO C S, SCHEUER P J, et al, 1996. Kahalalides: bioactive peptides from a marine mollusk Elysiarufescens and its algal diet Bryopsis sp.. The Journal of Organic Chemistry, 61(19): 6594-6600 DOI:10.1021/jo960877+ |
HAMATANI I, 1968. A new species of Elysia from Kii, Japan (Opisthobranchia-Sacoglossa). Publications of the Seto Marine Biological Laboratory, 16(1): 51-54 DOI:10.5134/175490 |
HÄNDELER K, GRZYMBOWSKI Y P, KRUG P J, et al, 2009. Functional chloroplasts in metazoan cells - a unique evolutionary strategy in animal life. Frontiers in Zoology, 6(1): 28 DOI:10.1186/1742-9994-6-28 |
HÄNDELER K, WÄGELE H, 2007. Preliminary study on molecular phylogeny of Sacoglossa and a compilation of their food organisms. Bonner Zoologische Beiträ ge, 55: 231-254 |
HEBERT P D N, PENTON E H, BURNS J M, et al, 2004. Ten species in one: DNA barcoding reveals cryptic species in the neotropical skipper butterfly Astraptes fulgerator. Proceedings of the National Academy of Sciences of the United States of America, 101(41): 14812-14817 |
HELLER J, THOMPSON T E, 1983. Opisthobranch molluscs of the Sudanese Red Sea. Zoological Journal of the Linnean Society, 78(4): 317-348 DOI:10.1111/j.1096-3642.1975.tb02263.x |
HINDE R, SMITH D C, 1974. "Chloroplast symbiosis" and the extent to which it occurs in Sacoglossa (Gastropoda: Mollusca). Biological Journal of the Linnean Society, 6(4): 349-356 DOI:10.1111/j.1095-8312.1974.tb00729.x |
HIRAO Y J, HIRANO Y M, TROWBRIDGE C D, 2006. Record of a common but cryptic sacoglossan, Placida daguilarensis Jensen, 1990, from Japan. Memoirs of the National Science Museum Tokyo, (40): 283-294 |
JENSEN K R, 1985. Annotated checklist of Hong Kong, Ascoglossa (Mollusca: Opisthobranchia), with descriptions of four new species [C]//Proceeding of the 2nd International Workshop on the Malacofauna of Hong Kong and Southern China. Hong Kong, China: Hong Kong University Press: 77-107.
|
JENSEN K R, 1990. Three new species of Ascoglossa (Mollusca, Opisthobranchia) from Hong Kong, and a description of the internal anatomy of Costasiella pallida Jensen, 1985 [C]//Proceedings of the 2nd International Marine Biological Workshop: The Marine Flora and Fauna of Hong Kong and Southern China, Hong Kong, 1986. Hong Kong, China: Hong Kong University Press: 419-432.
|
JENSEN K R, 1992. Anatomy of some Indo-Pacific Elysiidae (Opisthobranchia: Sacoglossa (=Ascoglossa)), with a discussion of the generic division and phylogeny. Journal of Molluscan Studies, 58(3): 257-296 DOI:10.1093/mollus/58.3.257 |
JENSEN K R, 1993. Morphological adaptations and plasticity of radular teeth of the Sacoglossa (=Ascoglossa) (Mollusca: Opisthobranchia) in relation to their food plants. Biological Journal of the Linnean Society, 48(2): 135-155 DOI:10.1111/j.1095-8312.1993.tb00883.x |
KATOH K, STANDLEY D M, 2013. MAFFT multiple sequence alignment software version 7: improvements in performance and usability. Molecular Biology and Evolution, 30(4): 772-780 DOI:10.1093/molbev/mst010 |
KELAART E F, 1858. Description of new and little known species of Ceylon nudibranchiate molluscs, and zoophytes. Journal of the Ceylon Branch of the Royal Asiatic Society, 3: 84-139 |
KRUG P J, VENDETTI J E, ELLINGSON R A, et al, 2015. Species selection favors dispersive life histories in sea slugs, but higher per-offspring investment drives shifts to short-lived larvae. Systematic Biology, 64(6): 983-999 DOI:10.1093/sysbio/syv046 |
KRUG P J, VENDETTI J E, RODRIGUEZ A K, et al, 2013. Integrative species delimitation in photosynthetic sea slugs reveals twenty candidate species in three nominal taxa studied for drug discovery, plastid symbiosis or biological control. Molecular Phylogenetics and Evolution, 69: 1101-1119 DOI:10.1016/j.ympev.2013.07.009 |
KUMAR S, STECHER G, LI M, et al, 2018. MEGA X: molecular evolutionary genetics analysis across computing platforms. Molecular Biology and Evolution, 35(6): 1547-1549 DOI:10.1093/molbev/msy096 |
LARTILLOT N, BRINKMANN H, PHILIPPE H, 2007. Suppression of long-branch attraction artefacts in the animal phylogeny using a site-heterogeneous model. BMC Evolutionary Biology, 7(S1): S4 |
LARTILLOT N, PHILIPPE H, 2006. Computing bayes factors using thermodynamic integration. Systematic Biology, 55(2): 195-207 DOI:10.1080/10635150500433722 |
LERAY M, KNOWLTON N, 2015. DNA barcoding and metabarcoding of standardized samples reveal patterns of marine benthic diversity. Proceedings of the National Academy of Sciences of the United States of America, 112(7): 2076-2081 |
Marcus E D B R, 1980. Review of western Atlantic Elysiidae (Opisthobranchia Ascoglossa) with a description of a new Elysia species. Bulletin of Marine Science, 30(1): 54-79 |
MARCUS E D B R, 1982. Systematics of the genera of the Order Ascoglossa (Gastropoda). Journal of Molluscan Studies, 40(S10): 1-31 |
MCCARTHY J B, KRUG P J, VALDÉS Á, 2019. Integrative systematics of Placida cremoniana (Trinchese, 1892) (Gastropoda, Heterobranchia, Sacoglossa) reveals multiple pseudocryptic species. Marine Biodiversity, 49(1): 357-371 DOI:10.1007/s12526-017-0812-2 |
MEYER C P, PAULAY G, 2005. DNA barcoding: error rates based on comprehensive sampling. PLoS Biology, 3(12): e422 DOI:10.1371/journal.pbio.0030422 |
MITOH S, YUSA Y, 2021. Extreme autotomy and whole-body regeneration in photosynthetic sea slugs. Current Biology, 31(5): R233-R234 DOI:10.1016/j.cub.2021.01.014 |
MONTAGU G, 1804. Description of several marine animals found on the south coast of Devonshire. Transactions of the Linnean Society of London, os-7(1): 61-85 |
NGUYEN L T, SCHMIDT H A, VON HAESELER A, et al, 2015. IQ-TREE: a fast and effective stochastic algorithm for estimating maximum-likelihood phylogenies. Molecular Biology and Evolution, 32(1): 268-274 DOI:10.1093/molbev/msu300 |
OKUTANI T, 2000. Marine Mollusks in Japan. Tokyo: Tokai University Press, 450-451, 761-765
|
PEASE W H, 1871. Descriptions of nudibranchiate Mollusca inhabiting Polynesia. American Journal of Conchology, 6: 299-305 |
PUILLANDRE N, BROUILLET S, ACHAZ G, 2021. ASAP: assemble species by automatic partitioning. Molecular Ecology Resources, 21(2): 609-620 DOI:10.1111/1755-0998.13281 |
REID J D, 1964. The reproduction of the sacoglossan opisthobranch Elysia maoria. Proceedings of the Zoological Society of London, 143(3): 365-393 DOI:10.1111/j.1469-7998.1964.tb03869.x |
SWAINSON W, 1840. Treatise on Malacology, or the Natural Classification of Shells and Shell Fish. London: Orme, Brown, Green & Longmans, 419
|
TAKANO T, HIRANO Y M, TROWBRIDGE C D, et al, 2013. Taxonomic clarification in the genus Elysia (Gastropoda: Sacoglossa): E. atroviridis and E. setoensis. American Malacological Bulletin, 31(1): 25-37 DOI:10.4003/006.031.0114 |
TIBIRIÇÁ T, POLA M, CERVERA J L, 2018. Systematics of the genus Halgerda Bergh, 1880 (Heterobranchia: Nudibranchia) of Mozambique with descriptions of six new species. Invertebrate Systematics, 32(6): 1388-1421 DOI:10.1071/IS17095 |
TROWBRIDGE C D, 2004. Emerging associations on marine rocky shores: specialist herbivores on introduced macroalgae. Journal of Animal Ecology, 73(2): 294-308 DOI:10.1111/j.0021-8790.2004.00808.x |
TROWBRIDGE C D, HIRANO Y M, SUDO K, et al, 2006. Elysia trisinuata and E. sugashimae: distinct species or intraspecific variation?. Venus, 65: 272 |
WÄGELE H, STEMMER K, BURGHARDT I, et al, 2010. Two new sacoglossan sea slug species (Opisthobranchia, Gastropoda): Ercolania annelyleorum sp. nov. (Limapontioidea) and Elysia asbecki sp. nov. (Plakobranchoidea), with notes on anatomy, histology and biology. Zootaxa, 2676(1): 1-28 DOI:10.11646/zootaxa.2676.1.1 |
WARD R D, 2009. DNA barcode divergence among species and genera of birds and fishes. Molecular Ecology Resources, 9(4): 1077-1085 DOI:10.1111/j.1755-0998.2009.02541.x |
WoRMS Editorial Board, 2023. World register of marine species [EB/OL]. https://doi.org/10.14284/170.
|
ZHANG S Q, LIAO M J, WANG Y G, et al, 2020. Morphological and molecular evidence of a new species of Melanochlamys (Gastropoda: Heterobranchia) from the Bohai Sea, China. Zootaxa, 4861(3): 399-410 |
 2023, Vol. 54
2023, Vol. 54


