中国海洋湖沼学会主办。
文章信息
- 吴海珠, 臧娜, 林东明. 2023.
- WU Hai-Zhu, ZANG Na, LIN Dong-Ming. 2023.
- 阿根廷滑柔鱼(Illex argentinus)雌性成熟个体的有效繁殖力及有效生殖投入
- THE EFFECTIVE FECUNDITY AND EFFECTIVE REPRODUCTIVE INVESTMENT IN MATURE FEMALE ILLEX ARGENTINUS
- 海洋与湖沼, 54(4): 1149-1157
- Oceanologia et Limnologia Sinica, 54(4): 1149-1157.
- http://dx.doi.org/10.11693/hyhz20221100297
文章历史
-
收稿日期:2022-11-13
收修改稿日期:2023-01-12
2. 大洋渔业资源可持续开发省部共建教育部重点实验室 上海 201306;
3. 国家远洋渔业工程技术研究中心 上海 201306;
4. 农业农村部大洋渔业开发重点实验室 上海 201306
2. Key Laboratory of Sustainable Exploitation of Oceanic Fishery Resources, Ministry of Education, Shanghai Ocean University, Shanghai 201306, China;
3. National Distant-water Fisheries Engineering Research Center, Ministry of Science and Technology, Shanghai 201306, China;
4. Key Laboratory of Oceanic Fisheries Exploration, Ministry of Agriculture and Rural Affairs, Shanghai 201306, China
阿根廷滑柔鱼(Illex argentinus)为大洋性种类, 隶属于头足纲(Cephalopoda)、枪形目(Teuthoidea)、柔鱼科(Ommastrephidae)。该种类分布在22°~54°S的西南大西洋大陆架和大陆坡海域, 尤以35°~52°S海域的资源量最为丰富(Rodhouse et al, 2013), 是西南大西洋最为重要的渔业资源种类之一, 也是我国远洋鱿钓渔业的重要捕捞对象(陈新军, 2019)。阿根廷滑柔鱼生长速度快, 胴长和体质量的最大绝对生长率分别为1.09 mm/d和6.35 g/d (陆化杰等, 2012); 生命周期短, 最小性成熟年龄仅为100 d, 最大年龄为400 d (陆化杰等, 2012; Schwarz et al, 2013); 营终生一次繁殖产卵, 产卵结束后不久便死亡(Rodhouse et al, 2013)。在生长发育过程中, 阿根廷滑柔鱼的生殖投入以摄入食物转化投入为主, 肌肉组织存储能量投入为辅(Lin et al, 2015, 2019a)。已有研究表明, 阿根廷滑柔鱼的潜在繁殖力可达75万粒卵母细胞, 实际排卵量则占其70%左右(Laptikhovsky et al, 1992, 1993)。Santos等(1997)对成熟胴长为29~34 cm的雌性个体计数卵径 > 0.4 mm的卵母细胞, 发现繁殖力仅在9.3~29万粒卵母细胞。林东明等(2015)发现成熟胴长为22~27 cm的雌性个体计数卵径 > 0.08 mm的卵母细胞, 所得的最大繁殖力仅为13.5万粒卵母细胞。可见, 阿根廷滑柔鱼的繁殖力尚有较多的不确定性, 并且与亲体体型存在密切相关性。
繁殖力是生物种类繁衍及维持群体资源量的重要生物学特性, 是繁殖生物学研究的重要内容之一(陈新军, 2014)。同时, 繁殖力也是生物种类对栖息环境的选择适应性, 体现了物种的环境耐受度和可塑能力(Beasley et al, 2018), 与生殖能量的投入分配密切相关(Pecl et al, 2006; Barneche et al, 2018), 进而影响物种的补充量大小(Stearns, 2000; Lavin et al, 2021; Chen et al, 2022)。有效繁殖力是潜在繁殖力的有效部分, 表征研究对象亲本自然排出卵巢并完成受精的配子数目(林东明等, 2021); 而基于有效繁殖力数量估算亲本的生殖投入, 将可用于比较分析个体之间生殖能量投入分配的差异性, 更好地反映个体的繁殖力情况及其能量投入水平(Melo et al, 1999; Hernández-Muñoz et al, 2016)。为此, 为了深入掌握阿根廷滑柔鱼的繁殖生物学特性, 本研究拟对我国鱿钓渔业渔汛期间采集的阿根廷滑柔鱼雌性成熟个体, 进行有效繁殖力的研究分析; 并利用组织能量密度测定技术, 分析雌性成熟个体的生殖能量投入, 旨在深入掌握该种类资源的繁殖特性, 为资源的可持续开发利用提供科学资料参考。
1 材料与方法 1.1 样本来源阿根廷滑柔鱼实验样本采集自我国远洋灯光鱿钓作业渔船在西南大西洋作业期间的渔获物。采样时间为2021年2~4月, 采样海域为西南大西洋–49.32°S~ –41.58°S, –60.60°W~–57.53°W海域(图 1)。样本采集后, 经冷冻保存运回岸上并在实验室进行分析。
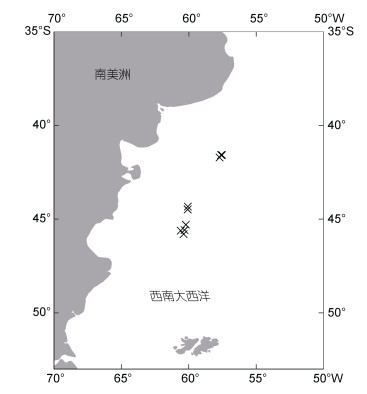 |
| 图 1 西南大西洋阿根廷滑柔鱼采样海域 Fig. 1 Sampling region and the locations (× marked) for I. argentinus in the southwest Atlantic Ocean 注: “×”表示采样站点 |
样本在实验室常温解冻后进行生物学数据测定, 测定项目包括胴长(mantle length, ML)、体质量(body weight, BW)、性别、性腺发育成熟度等。胴长测定精确至1 mm, 体质量测定精确至1 g。性腺成熟度划分, 依据林东明等(2014)的划分标准对每尾实验样本的性腺发育成熟度进行Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ、Ⅶ、Ⅷ共八个时期的判断, 其中, Ⅰ~Ⅲ期为性腺发育未成熟期, Ⅳ~Ⅵ期为性腺发育成熟期, Ⅶ期为繁殖期, Ⅷ期为繁殖后期。性腺成熟度判别后, 摘取雌性个体的性腺组织(卵巢、缠卵腺、输卵管、输卵管腺)并称量, 精确至0.01 g。样本中未见Ⅷ期样本。
阿根廷滑柔鱼雌性个体自性腺发育成熟度Ⅳ期开始产生成熟卵子排入输卵管, 并且大部分的卵巢卵母细胞发生至卵黄早期(卵径≥0.40 mm) (Lin et al, 2017a)。已有研究表明, 卵巢卵母细胞进入卵黄早期之后被退化吸收的情况较少, 绝大部分可以正常发育成熟, 并在繁殖期间成功受精(Melo et al, 1999; Hernández-Muñoz et al, 2016); 这部分卵母细胞可定义为有效繁殖力(林东明等, 2021)。为此, 本实验共选取Ⅳ期至Ⅵ期的雌性样本31尾, 进行有效繁殖力及有效生殖投入的分析研究, 其中Ⅳ期10尾、Ⅴ期10尾和Ⅵ期11尾。
1.3 有效繁殖力测定有效繁殖力大小为卵巢中卵径≥0.40 mm的卵黄卵母细胞数量, 与输卵管中成熟卵子的数量之和(林东明等, 2021)。为此, 本实验对取样的雌性个体卵巢卵黄卵母细胞和输卵管卵子分别计数, 均采用重量计数法, 计数公式为
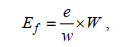 (1)
(1)式中, Ef为卵巢的卵母细胞数量或输卵管的成熟卵子数量(单位: 粒); w为切取的卵巢组织样品重量或者选取的输卵管部分卵子重量(单位: mg); e为切取的卵巢组织样品中计数的卵母细胞数量或者选取的输卵管部分卵子样品所计数的卵子数量(单位: 粒); W为卵巢总重量或者输卵管卵子总重量(单位: mg)。
具体测定方法参照林东明等(2015)的实验方法, 即(1) 卵巢的卵黄卵母细胞计数, 称取卵巢总重量, 于卵巢的前、中、后三个部位分别切取300~500 mg的组织样品, 计数每份组织样品的卵母细胞数量, 使用上述公式计算卵巢卵母细胞的数量。(2) 输卵管的成熟卵子计数, 称取左、右输卵管卵子总重量, 于左输卵管、右输卵管中部挑取300~500 mg的卵子样品并计数卵子数量, 使用上述公式计算输卵管成熟卵子的数量。
1.4 个体有效生殖投入的测定有效生殖投入计算为输卵管卵子的能量密度值与有效繁殖力及单个成熟卵子干重的乘积(单位: kJ)。计算公式为
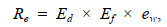 (2)
(2)式中, Re为有效生殖投入(单位: kJ); Ed为输卵管卵子的能量密度值(单位: kJ/g); Ef为有效繁殖力(单位: 粒); ew为单个成熟卵子的干重(单位: g)。
输卵管卵子能量密度值测定, 称取1.0 g输卵管卵子置于冷冻干燥机(Scientz-48)中−50 ℃冷冻干燥24~36 h, 待干燥至恒重后取出并称量组织干重(dry weight, DW), 测定精确至0.001 g。随后, 干燥的输卵管卵子置于研磨机(Scientz-10N)中研磨粉碎, 利用氧弹热量仪测定能量密度值(单位: kJ/g)。
单个成熟卵子干重测定, 根据“1.3有效繁殖力的测定”中输卵管卵子计数方法, 计算1.0 g输卵管卵子的卵子数; 1.0 g输卵管卵子的干重与其卵子数的比值即为单个成熟卵子的干重(单位: g)。
1.5 数据处理应用R统计平台处理分析实验数据, 所有数据以均值±标准差表示。
利用幂函数拟合分析阿根廷滑柔鱼雌性成熟个体的体质量与胴长关系, 拟合公式为
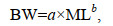 (3)
(3)式中, BW为体质量(单位: g), ML为胴长(单位: mm), a、b为待估算参数。
根据体质量和胴长(BW-ML)的幂函数回归关系, 计算阿根廷滑柔鱼雌性成熟个体的体征指标(韩飞等, 2019; 臧娜等, 2021)。体征指标计算为体质量-胴长的残差值并标准化, 标准化残差值具有基于个体水平又独立于个体大小, 能够反映个体肌肉组织的健康状况: 残差值为负值, 表示组织的健康状况不佳; 残差值为正值, 表示组织的健康状况良好(Green, 2001; Jackson et al, 2004)。因此, 体质量和胴长关系的残差值(BW-ML)可作为个体的体征指标(body condition index, CI)。
利用单样本Kolmogorov-Smirnoff分析检验体征、有效繁殖力、有效生殖投入等数据的正态性。若符合正态分布, 则利用单因素方差分析(ANOVA)检验分析各数据分布的性腺发育成熟度差异性, 并进行Tukey HSD随后检验; 若不符合正态分布, 则利用Kruskall-Wallis非参数检验分析各数据分布的性腺发育成熟度差异性, 利用Games-Howell HSD进行随后的显著性检验。同时, 利用线性混合效应模型(linear mixed-effects models, LMM)拟合分析雌性成熟个体的有效繁殖力与体质量、体征, 有效生殖投入与体质量、体征的关系, 模型中体质量、有效繁殖力和有效生殖投入均进行自然对数转换, 性腺发育成熟度作为随机效应因子。LMM模型采用R语言lmerTest数据包进行处理。统计分析的显著性水平为P < 0.05。
2 结果 2.1 个体大小与体征实验结果显示阿根廷滑柔鱼雌性成熟个体的胴长为218~289 mm, 平均胴长为(244.90±16.36) mm; 体质量为180~470 g, 平均体质量为(295.16±64.85) g。胴长大小呈单峰值区间分布(图 2a)。其中, 以Ⅵ期的个体胴长最大, 平均胴长为(250.45±19.08) mm, 其次为Ⅴ期, 平均胴长为(249.60±11.93) mm; Ⅳ期个体的平均胴长最小, 为(234.10±12.40) mm。
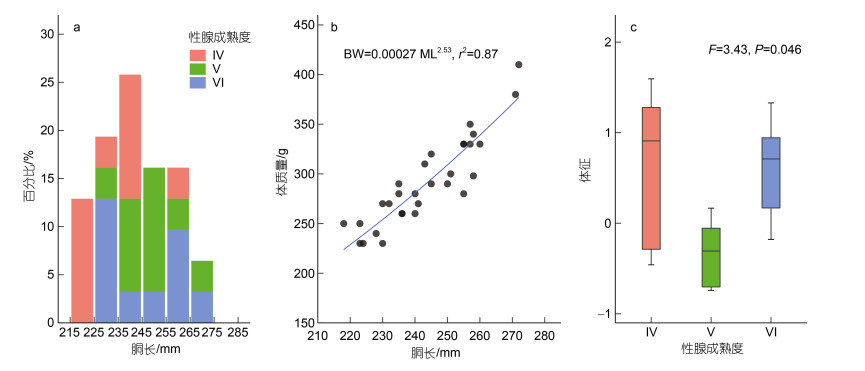 |
| 图 2 阿根廷滑柔鱼雌性成熟个体的胴长分布、体质量-胴长关系及体征分布 Fig. 2 The distribution of mantle length, body weight - mantle length relationship and body condition distribution for mature female I. argentinus 注: a. 胴长分布; b. 体质量-胴长关系; c. 体征分布 |
雌性成熟个体的体质量与胴长的幂函数关系式为BW=0.000 27×ML2.53 (R2=0.87) (图 2b)。不同性腺成熟度之间, 个体的体征差异显著(F=3.43, P=0.046); 其中以Ⅴ期时体征最差, Ⅳ期和Ⅵ期时体征处于较好水平(图 2c)。
2.2 有效繁殖力阿根廷滑柔鱼的有效繁殖力为24 363~102 633粒卵母细胞, 平均有效繁殖力为(63 158.49±16 782.00)粒卵母细胞。不同性腺成熟度之间, 个体的有效繁殖力存在显著性差异(F=3.99, P=0.03); 其中以Ⅵ期时个体的有效繁殖力最大, 平均有效繁殖力为(73 107.85± 16 242.67)粒卵母细胞; Ⅴ期的个体有效繁殖力次之, 平均值为(60 738.58±15 387.49)粒卵母细胞; Ⅳ期的个体有效繁殖力最小, 平均值为(54 634.11±14 164.72)粒卵母细胞(图 3a)。然而, 不同性腺成熟度之间, 个体的体质量相对有效繁殖力没有显著差异(F=0.60, P=0.55); Ⅳ期、Ⅴ期和Ⅵ期的个体的体质量相对有效繁殖力分别为(212.42±48.53)、(205.75±39.68)和(226.35± 43.44)粒/g (图 3b)。
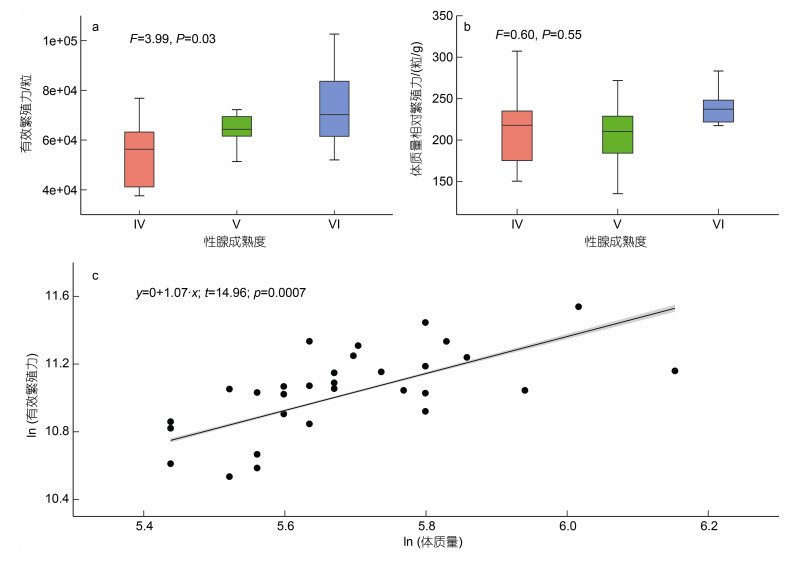 |
| 图 3 阿根廷滑柔鱼雌性成熟个体的有效繁殖力分布及与体质量的关系 Fig. 3 The distribution of effective fecundity and relation to the body weight of mature female I. argentinus 注: a. 有效繁殖力; b. 体质量相对繁殖力; c. 有效繁殖力与体质量关系 |
线性混合模型结果显示, 阿根廷滑柔鱼的有效繁殖力与体质量呈显著的正相关关系(t=14.96, P=0.000 7; 图 3c), 而与体征没有显著的相关性(t=0.07, P=0.95); 模型的合计方差解释率为38% (R2=0.38; 表 1)。
| 模型效应 | 模型参数因子 | 估计 | 标准偏差 | t | P |
| 随机效应 | 性腺成熟度 | — | 0.05 | — | — |
| 残差 | — | 0.23 | — | — | |
| 固定效应 | 截距 | 5.03 | 1.55 | 3.25 | 0.003 |
| 体质量 | 1.05 | 0.27 | 3.87 | 0.001 | |
| 体征 | 0.003 | 0.05 | 0.07 | 0.950 | |
| 注: 模型分析中有效繁殖力、体质量均作自然对数转换 | |||||
阿根廷滑柔鱼的卵子能量密度值为25.01~ 26.09 kJ/g, 平均值为(25.71±0.25) kJ/g; 不同性腺成熟度之间, 卵子能量密度值没有显著差异(F=1.87, P=0.17; 图 4a)。有效生殖投入为219.80~817.06 kJ, 平均有效生殖投入为(465.02±158.71) kJ; 其中以Ⅵ期个体的有效生殖投入最大, 平均有效生殖投入为(540.32±173.25) kJ; Ⅴ期的个体有效生殖投入次之, 平均值为(467.71±105.81) kJ; Ⅳ期的个体有效生殖投入最小, 平均值为(358.45±139.95) kJ (图 4b)。然而, 不同性腺成熟度之间, 个体的体质量相对有效生殖投入没有显著差异(F=1.56, P=0.23); Ⅳ期、Ⅴ期和Ⅵ期个体的体质量相对有效生殖投入分别为(1.34± 0.40)、(1.54±0.36)和(1.70±0.51) kJ/g (图 4c)。
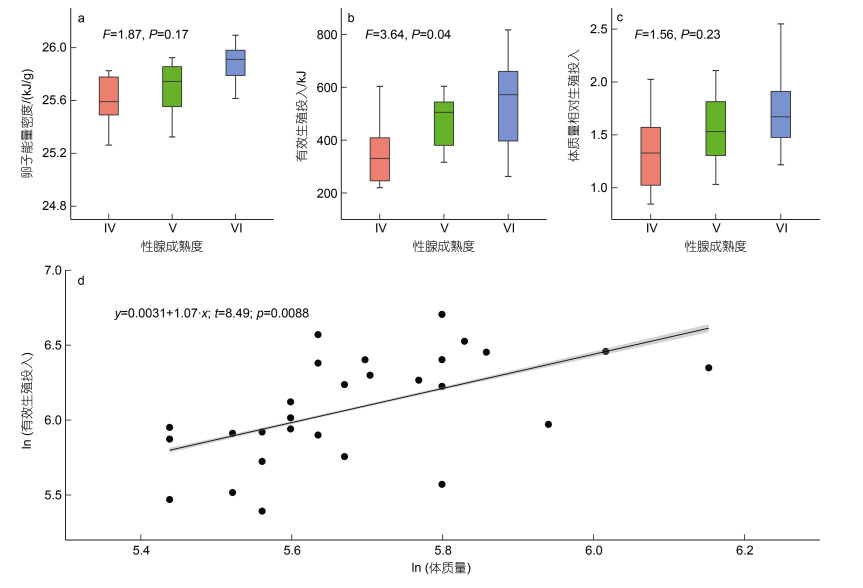 |
| 图 4 阿根廷滑柔鱼雌性成熟个体的卵子能量密度分布和有效生殖投入分布及与体质量的关系 Fig. 4 The distribution of egg energy density, effective reproductive investment, and relationship between effective reproductive investment and body weight for mature female I. argentinus 注: a. 卵子能量密度; b. 有效生殖投入; c. 体质量相对生殖投入; d. 有效生殖投入与体质量关系 |
线性混合模型结果显示, 阿根廷滑柔鱼的有效生殖投入与体质量呈显著的正相关关系(t=2.91, P=0.009; 图 4d), 而与体征没有显著的相关性(t=0.03, P=0.97); 模型的合计方差解释率为29% (R2=0.29; 表 2)。
| 模型效应 | 模型参数因子 | 估计 | 标准偏差 | t | P |
| 随机效应 | 性腺成熟度 | — | 0.06 | — | — |
| 残差 | — | 0.31 | — | — | |
| 固定效应 | 截距 | 0.31 | 2.09 | 3.00 | 0.002 |
| 体质量 | 1.07 | 0.37 | 2.91 | 0.009 | |
| 体征 | 0.002 | 0.06 | 0.03 | 0.970 | |
| 注: 模型分析中有效生殖投入、体质量均作自然对数转换 | |||||
头足类鞘亚纲种类具有寿命短、生长快等生活史特点, 并且营终生一次繁殖产卵策略(Rocha et al, 2001)。已有研究表明, 在性腺发育开始之后, 这些种类卵巢停止发生新的卵母细胞, 已有卵母细胞数量维持在一个相对稳定的数量水平, 并且随着性腺发育卵径较大的卵黄卵母细胞数量逐渐增多(Laptikhovsky et al, 1992)。本研究结果显示, 阿根廷滑柔鱼雌性成熟个体的有效繁殖力在生理性成熟早期(Ⅳ期)时最小, 平均有效繁殖力为54 634粒; 在功能性成熟期(Ⅵ期)达到最大值, 平均有效繁殖力为73 107粒。卵巢组织切片显示, 阿根廷滑柔鱼雌性个体只发生一组卵母细胞, 卵母细胞分批次成熟(Lin et al, 2017a)。可见, 阿根廷滑柔鱼雌性个体有效繁殖力逐渐增加是卵巢卵母细胞批次发育的过程所致, 与加利福尼亚外海的茎柔鱼(Nigmatullin et al, 2009)、阿根廷滑柔鱼夏季产卵种群(林东明等, 2015)和南海鸢乌贼微型群体(朱凯等, 2020b)等雌性个体繁殖力的变化趋势相一致。然而, 卵巢组织切片也显示, 头足类雌性个体卵巢中小型卵母细胞退化的数量随着性腺发育过程逐渐增加, 卵径较大的卵黄卵母细胞退化现象很少(Melo et al, 1998; Hernández-Muñoz et al, 2016; Lin et al, 2017a)。过去研究中, 阿根廷滑柔鱼雌性个体的潜在繁殖力(计数所有尺寸大小卵母细胞获得的繁殖力)可达75万粒卵母细胞, 而实际的有效产卵量为其70%左右(Laptikhovsky et al, 1992, 1993)。本研究的阿根廷滑柔鱼的功能性成熟雌性个体的有效繁殖力最大可达10.3万粒卵母细胞, 约为体型相当个体潜在繁殖力[13.5万粒(林东明等, 2015)]的76%, 说明通过研究分析功能性成熟个体的有效繁殖力(计数卵径较大的卵黄卵母细胞数量)是可以获知研究对象的生殖能力(林东明等, 2021)。
同时, 本研究发现阿根廷滑柔鱼雌性成熟个体的体质量相对有效繁殖力在不同性腺成熟度之间没有显著差异, 并且成熟个体体征对其有效繁殖力没有显著的效应关系。说明阿根廷滑柔鱼具有稳定的单位质量繁殖力(reproductive value), 并且独立于个体的体征变化。这可能与阿根廷滑柔鱼营收入-资本混合型的生殖投入方式密切相关, 生殖能量主要依赖于发育过程中食物摄入的转化吸收(Lin et al, 2015, 2019a)。然而, 值得注意的是, 阿根廷滑柔鱼有效繁殖力与体质量呈显著的正相关关系, 说明体型较大的个体具有较高的繁殖力, 与真蛸(Octopus vulgaris) (Otero et al, 2007)、乌贼(Lin et al, 2019b)和茎柔鱼(Nigmatullin et al, 2009)等的繁殖力随体型增加而增大的结果相近。通常, 海洋生物种类的繁殖产出(reproductive output)与体质量呈超几何正相关关系, 即亲体所产出的后代数量与其体质量之间的关系不是简单的线性比例关系, 而是指数型的比例函数(Barneche et al, 2018)。这与体型较大的亲体具有较好的生殖能量积累能力(Piatkowski et al, 1997; Hastie et al, 2009; Lin et al, 2017b)密切相关, 并且体型大的个体也具有较大的体腔承载较大的生殖系统发育(Boyle et al, 2005)。
3.2 有效生殖投入特性生殖投入反映生物个体生活史过程对繁殖活动的投入分配水平, 是自然生物繁衍后代、延续生命的重要生活史策略之一(McBride et al, 2015)。类似于有效繁殖力, 有效生殖投入体现了生物个体对后代存活的有效贡献度, 对掌握研究对象的繁殖力和补充群体资源量有着重要的理论价值和实践意义(Nigmatullin et al, 1995; 林东明等, 2021)。本研究结果显示, 阿根廷滑柔鱼的卵子能量密度平均值为25.71 kJ/g, 大于其肌肉组织能量密度值23.42 kJ/g和卵巢组织能量密度值25.15 kJ/g (Lin et al, 2017b; 林东明等, 2017)。这说明阿根廷滑柔鱼成熟卵子的能量物质较高, 与其卵黄物质积累密切相关(Lin et al, 2017a)。以阿根廷滑柔鱼、茎柔鱼、柔鱼等为代表的大洋性柔鱼类, 在生殖模式上均为卵生, 胚胎发育营养依靠卵子的卵黄营养(Boyle et al, 2005; Chen et al, 2022)。因此, 较高的卵子能量密度值也表明阿根廷滑柔鱼的单位质量生殖投入较高, 以实现最大的繁殖成功率。
同时, 本研究发现有效生殖投入随着性腺成熟度变化增加显著, 与有效繁殖力的变化相一致。然而, 体质量相对有效生殖投入在不同性腺成熟度之间没有显著差异, 说明阿根廷滑柔鱼具有稳定的单位质量生殖投入。通常, 为了适应外界环境变化, 生物个体会权衡生殖投入总量与繁殖力大小以获得最佳的繁殖成功率(Lowerre-Barbieri et al, 2017)。阿根廷滑柔鱼稳定的单位质量生殖投入也可能是这种权衡的结果, 以实现胚胎发育及仔鱼存活率的最大化。但是, 具体情况仍需后续结合多年份、多个海洋物理场景下有效生殖投入和有效繁殖力的研究分析。
此外, 本研究发现阿根廷滑柔鱼雌性成熟个体的有效生殖投入随着体质量增加而显著增大, 表明体型较大的个体具有较大的生殖能量投入。该结果与茎柔鱼(韩飞等, 2019)、鸢乌贼(朱凯等, 2020a)、海洋鱼类(Barneche et al, 2018)等的生殖投入与体型呈正相关关系是相一致的。这种正相关关系可能是体型较大的个体具有较大的繁殖力及繁殖产出所致, 因为繁殖力和繁殖产出与前期的繁殖投入呈指数函数关系(Barneche et al, 2018)。同时, 体型较大的生物个体往往具有较强的捕食能力和能量储备能力(Uchikawa et al, 2014; Paul et al, 2018), 这也可能是它们具备较大生殖投入的原因之一。值得注意的是, 阿根廷滑柔鱼雌性成熟个体的有效生殖投入与体征没有显著的相关性, 后者往往与肌肉组织健康状况密切相关(Green, 2001)。阿根廷滑柔鱼的生殖能量来源以现场食物摄食的外源性投入为主, 肌肉存储能量的内源性投入为辅(Lin et al, 2015, 2019a)。因此, 有效生殖投入独立于体征也进一步佐证了阿根廷滑柔鱼的生殖投入以外源性投入为主。
4 结论本研究通过分析阿根廷滑柔鱼雌性成熟个体的有效繁殖力与有效生殖投入, 进一步阐明了阿根廷滑柔鱼繁殖特性。阿根廷滑柔鱼雌性成熟个体的有效繁殖力和有效生殖投入均在功能性成熟期达到最大值, 体质量相对有效繁殖力和体质量相对有效生殖投入均在不同发育时期保持稳定水平。此外, 阿根廷滑柔鱼的有效繁殖力、有效生殖投入均随着体质量增加而增大, 但与体征没有显著的相关性, 表明体型较大的个体具有较大的繁殖力且独立于体征。这些结果增进认知了阿根廷滑柔鱼的繁殖生物学特性, 为深入开展柔鱼类的繁殖力及其生活史过程研究提供了基础, 也为后续开展这些种类的可持续开发与管理提供科学的资料参考。
朱凯, 张立川, 肖楚源, 等, 2020b. 南海鸢乌贼微型群雌性个体繁殖力研究. 渔业科学进展, 41(6): 140-148 |
朱凯, 姚吉祥, 陈新军, 等, 2020a. 南海鸢乌贼微型群肌肉和性腺组织能量积累及其分配. 上海海洋大学学报, 29(6): 910-920 |
陆化杰, 陈新军, 2012. 利用耳石微结构研究西南大西洋阿根廷滑柔鱼的日龄、生长与种群结构. 水产学报, 36(7): 1049-1056 |
陈新军, 2014. 渔业资源与渔场学. 2版. 北京: 海洋出版社, 460
|
陈新军, 2019. 世界头足类资源开发现状及我国远洋鱿钓渔业发展对策. 上海海洋大学学报, 28(3): 321-330 |
林东明, 方学燕, 陈新军, 2015. 阿根廷滑柔鱼夏季产卵种群繁殖力及其卵母细胞的生长模式. 海洋渔业, 37(5): 389-398 DOI:10.3969/j.issn.1004-2490.2015.05.001 |
林东明, 陈新军, 方舟, 2014. 西南大西洋阿根廷滑柔鱼夏季产卵种群繁殖生物学的初步研究. 水产学报, 38(6): 843-852 |
林东明, 陈新军, 魏嫣然, 等, 2017. 阿根廷滑柔鱼雌性个体肌肉和性腺组织能量积累及其生殖投入. 水产学报, 41(1): 70-80 |
林东明, 宣思鹏, 陈新军, 2021. 头足类鞘亚纲繁殖力研究进展. 海洋渔业, 43(1): 112-128 |
韩飞, 陈新军, 林东明, 等, 2019. 东太平洋赤道海域茎柔鱼体征生长及生殖投入. 水产学报, 43(12): 2511-2522 DOI:10.11964/jfc.20180611323 |
臧娜, 连晋欣, 陈新军, 等, 2021. 阿根廷滑柔鱼年间生长及体征变化. 水生生物学报, 45(4): 906-916 |
BARNECHE D R, ROBERTSON D R, WHITE C R, et al, 2018. Fish reproductive-energy output increases disproportionately with body size. Science, 360(6389): 642-645 DOI:10.1126/science.aao6868 |
BEASLEY A L, HALL K C, LATELLA C I, et al, 2018. Reproductive characteristics of three small-bodied cuttlefish in subtropical waters. Marine and Freshwater Research, 69(3): 403-417 DOI:10.1071/MF17169 |
BOYLE P, RODHOUSE P, 2005. Cephalopods: ecology and fisheries. Oxford, UK: Blackwell, 464
|
CHEN X J, LIU B L, LIN D M, 2022. Sexual maturation, reproductive habits, and fecundity of fish [M]//CHEN X J, LIU B L. Biology of Fishery Resources. Singapore: Springer: 113-142.
|
GREEN A J, 2001. Mass/length residuals: measures of body condition or generators of spurious results?. Ecology, 82(5): 1473-1483 DOI:10.1890/0012-9658(2001)082[1473:MLRMOB]2.0.CO;2 |
HASTIE L C, NYEGAARD M, COLLINS M A, et al, 2009. Reproductive biology of the loliginid squid, Alloteuthis subulata, in the north-east Atlantic and adjacent waters. Aquatic Living Resources, 22(1): 35-44 DOI:10.1051/alr/2009002 |
HERNÁNDEZ-MUÑOZ A T, RODRÍGUEZ-JARAMILLO C, MEJÍA-REBOLLO A, et al, 2016. Reproductive strategy in jumbo squid Dosidicus gigas (D'Orbigny, 1835): a new perspective. Fisheries Research, 173: 145-150 DOI:10.1016/j.fishres.2015.09.005 |
JACKSON G D, SEMMENS J M, PHILLIPS K L, et al, 2004. Reproduction in the deepwater squid Moroteuthis ingens, what does it cost?. Marine Biology, 145(5): 905-916 |
LAPTIKHOVSKY V V, NIGMATULLIN C M, 1992. Caracteristicas reproductivas de machos y hembras del calamar (Illex argentinus). Frente Marítimo, 12(A): 23-37 |
LAPTIKHOVSKY V V, NIGMATULLIN C M, 1993. Egg size, fecundity, and spawning in females of the genus Illex (Cephalopoda: Ommastrephidae). ICES Journal of Marine Science, 50(4): 393-403 |
LAVIN C P, JONES G P, WILLIAMSON D H et al, 2021. Minimum size limits and the reproductive value of numerous, young, mature female fish. Proceedings of the Royal Society B: Biological Sciences, 288(1946): 20202714 |
LIN D M, CHEN X J, CHEN Y et al, 2015. Sex-specific reproductive investment of summer spawners of Illex argentinus in the southwest Atlantic. Invertebrate Biology, 134(3): 203-213 |
LIN D M, CHEN X J, CHEN Y, et al, 2017a. Ovarian development in Argentinean shortfin squid Illex argentinus: group-synchrony for corroboration of intermittent spawning strategy. Hydrobiologia, 795(1): 327-339 |
LIN D M, CHEN X J, WEI Y R, et al, 2017b. The energy accumulation of somatic tissue and reproductive organs in post-recruit female Illex argentinus and the relationship with sea surface oceanography. Fisheries Research, 185: 102-114 |
LIN D M, HAN F, XUAN S P, et al, 2019a. Fatty acid composition and the evidence for mixed income–capital breeding in female Argentinean short-fin squid Illex argentinus. Marine Biology, 166(7): 90 |
LIN D M, XUAN S P, CHEN Z M, et al, 2019b. The ovarian development, fecundity and hypothesis on spawning pattern of common cuttlefish Sepia officinalis off Mauritania. Fisheries Research, 210: 193-197 |
LOWERRE-BARBIERI S, DECELLES G, PEPIN P, et al, 2017. Reproductive resilience: a paradigm shift in understanding spawner-recruit systems in exploited marine fish. Fish and Fisheries, 18(2): 285-312 |
MCBRIDE R S, SOMARAKIS S, FITZHUGH G R, et al, 2015. Energy acquisition and allocation to egg production in relation to fish reproductive strategies. Fish and Fisheries, 16(1): 23-57 |
MELO Y C, SAUER W H H, 1998. Ovarian atresia in cephalopods. South African Journal of Marine Science, 20(1): 143-151 |
MELO Y C, SAUER W H H, 1999. Confirmation of serial spawning in the chokka squid Loligo vulgaris reynaudii off the coast of South Africa. Marine Biology, 135(2): 307-313 |
NIGMATULLIN C M, ARKHIPKIN A I, SABIROV R M, 1995. Age, growth and reproductive biology of diamond-shaped squid Thysanoteuthis rhombus (Oegopsida: Thysanoteuthidae). Marine Ecology Progress Series, 124(1/2/3): 73-87 |
NIGMATULLIN C M, MARKAIDA U, 2009. Oocyte development, fecundity and spawning strategy of large sized jumbo squid Dosidicus gigas (Oegopsida: Ommastrephinae). Journal of the Marine Biological Association of the United Kingdom, 89(4): 789-801 |
OTERO J, GONZÁLEZ Á F, SIEIRO M P, et al, 2007. Reproductive cycle and energy allocation of Octopus vulgaris in Galician waters, NE Atlantic. Fisheries Research, 85(1/2): 122-129 |
PAUL M, HAJISAMAE S, PRADIT S et al, 2018. Trophic Ecology of Eight Sympatric Nemipterid Fishes (Nemipteridae) in the Lower Part of the South China Sea. Turkish Journal of Fisheries and Aquatic Sciences, 18(2): 277-287 |
PECL G T, MOLTSCHANIWSKYJ N A, 2006. Life history of a short-lived squid (Sepioteuthis australis): resource allocation as a function of size, growth, maturation, and hatching season. ICES Journal of Marine Science, 63(6): 995-1004 |
PIATKOWSKI U, RODHOUSE P G, NIGMATULLIN C M, 1997. A hypothesis of reproductive strategy in Antarctic squids [M]//LIPINSKI M R, AUGUSTYN C J, ROBERTS M J, et al. Cephalopod: Biodiversity, Ecology and Evolution. International Symposium and Workshops. Cape Town, South Africa: South African Journal of Marine Science.
|
ROCHA F, GUERRA Á, GONZÁLEZ Á F, 2001. A review of reproductive strategies in cephalopods. Biological Reviews, 76(3): 291-304 |
RODHOUSE P G K, ARKHIPKIN A I, LAPTIKHOVSKY V, et al, 2013. Illex argentinus, Argentine shortfin squid [M]//ROSA R, PIERCE G, O'DOR R. Advances in Squid Biology, Ecology and Fisheries Part Ⅱ - Oegopsid Squids. New York, NY, USA: Nova Science Publishers: 109-148.
|
SANTOS R A, HAIMOVICI M, 1997. Reproductive biology of winter-spring spawners of Illex argentinus (Cephalopoda: Ommastrephidae) off Southern Brazil. Scientia Marina, 61(1): 53-64 |
SCHWARZ R, PEREZ J A A, 2013. Age structure and life cycles of the Argentine shortfin squid Illex argentinus (Cephalopoda: Ommastrephidae) in southern Brazil. Journal of the Marine Biological Association of the United Kingdom, 93(2): 557-565 |
STEARNS S C, 2000. Life history evolution: successes, limitations, and prospects. Naturwissenschaften, 87(11): 476-486 |
UCHIKAWA K, KIDOKORO H, 2014. Feeding habits of juvenile Japanese common squid Todarodes pacificus: relationship between dietary shift and allometric growth. Fisheries Research, 152: 29-36 |
 2023, Vol. 54
2023, Vol. 54


