中国海洋湖沼学会主办。
文章信息
- 张伟伟, 吕建建, 李玉坤, 初凡智, 高保全, 刘萍. 2023.
- ZHANG Wei-Wei, LYU Jian-Jian, LI Yu-Kun, CHU Fan-Zhi, GAO Bao-Quan, LIU Ping. 2023.
- 三疣梭子蟹PtToll6基因克隆及其在免疫中的功能研究
- CLONING OF PTTOLL6 GENE IN PORTUNUS TRITURATUS AND ITS FUNCTION IN IMMUNITY
- 海洋与湖沼, 54(4): 1172-1181
- Oceanologia et Limnologia Sinica, 54(4): 1172-1181.
- http://dx.doi.org/10.11693/hyhz20221100285
文章历史
-
收稿日期:2022-11-01
收修改稿日期:2023-01-14
2. 中国水产科学研究院黄海水产研究所 海水养殖生物育种与可持续产出全国重点实验室 山东青岛 266071
2. National Key Laboratory of Marine Breeding and Sustainable Production, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China
三疣梭子蟹(Portunus trituberculatus)隶属于甲壳纲(Crustacea)、十足目(Decapoda)、梭子蟹科(Portunidae)、梭子蟹属(Portunus), 地理分布集中在我国渤海、黄海, 以及日本等海域, 肉多且脂膏肥美, 具有十分重要的经济价值(戴爱云等, 1977; 薛俊增等, 1997)。随着人工养殖的规模逐渐扩大, 苗种参差不齐, 导致病害严重, 给养殖业带来了巨大的经济损失。副溶血弧菌(Vibrio parahaemolyticus)是三疣梭子蟹主要的致病菌之一, 可以诱导肝胰腺坏死病等多种病症, 该病原可引发梭子蟹生长缓慢、嗜睡、空腹、空肠, 最终致其死亡(郝景伟等, 2019; 霍诗天等, 2022)。与哺乳类动物不同的是, 三疣梭子蟹没有B淋巴细胞和T淋巴细胞, 缺少获得性免疫系统。在应对病原入侵时, 只能依赖于与生俱来的先天性免疫系统, 通过免疫信号通路级联反应来实现识别清除病原的作用(Uematsu et al, 2008)。因此, 研究其先天性免疫机理对三疣梭子蟹抗病以及新品种培育有着重要意义。
Toll样受体(Toll-like receptor, TLR)等模式识别受体(Pathogen recognize receptor, PRR)能够在病原刺激中介导三疣梭子蟹等甲壳动物的先天免疫, 各类PRR都能通过识别病原中某种保守的病原相关分子模式(Pathogen associated molecular pattern, PAMPs), 启动先天性免疫应答(Carty et al, 2010)。TLR家族基因具有高度的保守性, 在漫长的生物进化历程中末端的TIR结构域都高度同源, 且Toll蛋白均属于Ⅰ型跨膜结构蛋白。其结构包括胞外在免疫中起到关键识别作用的序列区(LRR)、跨膜区(TM)和与白介素受体高度同源的胞内区(TIR) (Slack et al, 2000; 章晓联等, 2002; Uribe et al, 2011)。TLR家族下信号通路主要有两种依赖途径, 一条是MyD88 (髓样分化因子88)依赖途径, 另一条是非依赖MyD88途径, 通过TRIF进行信号转导, MyD88与TRIF都属于TLR的下游接头分子(Yamamoto et al, 2002; Tang et al, 2012)。目前在甲壳动物中, TLRs家族基因都只进行了一些基础性的研究, 如Yang等(2007)在凡纳滨对虾(Litopenaeus vannamei)中发现了一个Toll样受体, 命名为LvToll, 这是在甲壳动物中发现的首个TLR家族基因。另外, 在三疣梭子蟹中已克隆了5个TLR基因并初步分析其在病原胁迫后的表达模式(Zhou et al, 2015; 张杰, 2017)。然而, 相比哺乳类(王有琴等, 2021; 章琳俐等, 2021)和昆虫类(Yagi et al, 2010), 甲壳动物TLR基因的研究基础相对薄弱, 主要体现在: (1) 尚不明确其识别的PAMPs, (2) 缺乏必要的功能验证研究, (3) 对其分子调控通路解析不足。
本实验克隆了三疣梭子蟹PtToll6基因, 分析了该基因的组织表达分布特征, 明确了其主要识别的PAMPs。初步验证了PtToll6基因在抗副溶血弧菌感染中具有一定作用, 可能依赖MyD88途径发挥免疫功能。研究结果为深入解析甲壳动物TLR基因的功能提供依据, 同时可为三疣梭子蟹抗病良种培育提供一定参考。
1 材料与方法 1.1 实验样品的采集实验所用的三疣梭子蟹取自于山东省昌邑市海丰水产公司。在饲养至80日龄时, 选取健康有活力的三疣梭子蟹[体重为(30±5) g], 将其置于一个20 m3的混凝土池塘中暂养7 d, 用于后续实验。实验条件保持昼夜水温(25±3) ℃, 盐度35, pH 8.7。每天对水体进行换水, 换水量为1/3, 并定时喂食新鲜杂鱼, 实验全程于此公司实验车间进行。
在室内水泥池暂养7 d后, 随机选取9只暂养的健康三疣梭子蟹, 分别采集心脏、表皮、胃、肠、脑、肝胰腺、鳃、眼柄、血淋巴、肌肉共10个不同的组织, 置于液氮中保存, 用于合成RACE模板和PtToll6的组织表达分析。
1.2 实验方法 1.2.1 总RNA提取、cDNA和RACE模板合成取上述三疣梭子蟹10个不同的组织各50 mg, 按照TRIzol® Reagent (Roche公司)方法进行总RNA提取, 并利用紫外分光光度计(NanoDrop2000, Thermo)和1%琼脂糖凝胶电泳检测提取的总RNA的质量和浓度。
选取不同组织高质量的RNA, 使用HiScript Ⅱ Q RT Super Mixfor qPCR (+gDNA wiper) kit (诺维赞, 南京)合成cDNA。将各组织中高质量的总RNA均匀混合, 使用SMARTer® RACE cDNA Amplification Kit (TaKaRa, 日本)合成3′和5′ RACE cDNA模板。
1.2.2 三疣梭子蟹Pt-Toll6的cDNA全长的克隆、序列及进化分析根据从本实验室构建的三疣梭子蟹基因组数据库中筛选验证得到的PtToll6基因EST序列, 利用PrimerPremier5.0软件设计PtToll6的3′和5′ RACE特异性引物及通用引物并由上海生工生物工程有限公司合成(表 1)。使用TransTaq® DNA Polymerase High Fidelity (HiFi)高保真聚合酶(全式金生物, 北京)参照说明书进行RACE 3′和5′末端巢式PCR扩增, 将PCR产物回收纯化并进行连接转化, 挑取单克隆, 经菌落PCR鉴定后筛选目的菌液送至上海生工生物工程有限公司进行测序, 参照宋柳等(2019)。
| 引物 | 序列 | 用途 |
| PtToll6-5′R1 | ACTTGTATGCCTGACACGGGTTC | 5′RACE |
| PtToll6-5′R2 | CTGCAATGCGACAGTACATAAGGT | 5′RACE |
| PtToll6-3′F1 | AGGACGCCGACCACTACCTGTACGA | 3′RACE |
| PtToll6-3′F2 | CATCAACTCAGTAGATCGCTCCA | 3′RACE |
| β-actin-F | CGAAACCTTCAACACTCCCG | qRT-PCR内参 |
| β-actin-R | GGGACAGTGTGTGAAACGCC | qRT-PCR内参 |
| PtToll6-F5 | GTAATCCGTTCGTGTGCGAC | 荧光定量引物 |
| PtToll6-R5 | CCGAGTAGCACTTGATGTCCT | 荧光定量引物 |
通过ContigExpress软件将克隆序列与EST序列进行拼接、验证, 得到PtToll6基因的cDNA全长, 分别采用NCBI-BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi)、ORFFinder (https://www.ncbi.nlm.nih.gov/orffinder/)在线网站对序列进行比对分析及开放阅读框(ORF)的预测。蛋白质功能结构域利用SMART (http://smart.emblheidelberg.de/)网站进行预测。利用DNAMAN软件将PtToll6与甲壳动物中的TLR基因进行蛋白质序列比对, 并通过MEGA软件对PtToll6进行构建系统进化树分析。
1.2.3 三疣梭子蟹PtToll6的组织表达分析将不同个体相同组织的cDNA等浓度混合, 用于组织表达分析。根据已获得的PtToll6 cDNA全长序列, 通过PrimerPremier5.0软件设计实时荧光定量PCR特异性引物, 内参基因选用β-actin (表 1), 具体PCR实验体系及方法参考宋柳等(2019)。使用SPSS19.0软件对实验过程中产生的数据进行单因素方差分析, 借助OriginPro将统计结果整理形成图表, P < 0.05为显著差异, P < 0.01为极显著性差异。
1.2.4 病原相关分子模式刺激随机选择120只经过室内暂养后大小一致、健康有活力的三疣梭子蟹, 平均分成4组, 各组分别注射1×PBS缓冲液100 μL、1 mg/mL脂多糖100 μL、1 mg/mL肽聚糖100 μL以及1 mg/mL Poly IC 100 μL。在注射后0、12、24、48、72 h, 每组分别随机选取3只三疣梭子蟹, 取肝胰腺组织置于液氮中保存, 用于RNA提取。
1.2.5 副溶血弧菌感染随机将60只室内暂养后大小一致、健康有活力的三疣梭子蟹, 平均分成2组(攻毒组和对照组)进行预实验。对照组为注射无菌的海洋甲壳动物生理盐水, 攻毒组为注射副溶血弧菌, 浓度依据张杰等(2017)报道注射副溶血弧菌的浓度(2.6×107 CFU/mL)进行预实验。剂量均为1 μL/g (体重)。在自然海水以及最适温度下, 72 h半致死, 而对照组没有死亡情况出现, 此剂量浓度作为正式实验使用。
选取180只三疣梭子蟹进行正式实验, 平均分为两组即实验组与对照组, 在梭子蟹游泳足的第一关节基部处进行注射(谢建军等, 2011; Ren et al, 2017)。实验组注射2.6×107 CFU/mL的副溶血弧菌, 对照组注射海洋甲壳动物生理盐水, 剂量均为1 μL/g。副溶血弧菌悬液参照窦全伟等(2018)的方法提取制备。分别在注射后0、12、24、48、72 h, 每组各随机取3只三疣梭子蟹的肝胰腺组织于液氮中保存, 用于RNA提取。
1.2.6 PtToll6基因RNAi实验本实验通过生工生物工程(上海)股份有限公司设计的干扰序列进行位点筛选, 最后确定具有干扰效果的一对序列由公司合成(表 2)。
| 双链RNA | 序列(5'~3') |
| PtToll6 | GCA ACU CGC UCA UCA CCA UTT AUG GUG AUG AGC GAG UUG CTT |
| NC | UUC UCC GAA CGU GUC ACG UTT ACG UGA CAC GUU CGG AGA ATT |
RNAi实验共分为4组各60个个体: 实验组(注射PtToll6 siRNA)、阴性对照组(注射NC siRNA)、空白对照组(注射生理盐水)、阳性对照组(注射生理盐水)。将siRNA浓度稀释为1 μg/μL, 阴性对照组和实验组根据三疣梭子蟹个体的体重进行注射(注射量为1 μg/g); 空白对照组和阳性对照组根据三疣梭子蟹个体的体重进行注射生理盐水(注射量为1 μL/g)。在注射后0、24、48、72 h, 分别取空白对照组、阴性对照组和实验组3只三疣梭子蟹的肝胰腺组织于液氮中保存, 用于干扰效率检测。
在RNAi实验24 h后, 4组各取30个个体进行攻毒实验, 按体重注射(注射量为1 μL/g): 空白对照组注射1×PBS缓冲液; 其他3个组注射2.6×107 CFU/mL副溶血弧菌。实验每3 h统计一次死亡数。在0、12、24、48、72 h, 每组分别选取3只依然存活的三疣梭子蟹解剖取肝胰腺组织存于液氮中保存。
1.2.7 接头分子的实时荧光定量分析利用材料1.2.2方法, 得到了MyD88与TRIF的cDNA序列, 并设计了qRT-PCR引物, 所用引物如表 3, 使用1.2.6中PtToll6 RNAi材料, 对其下游接头分子进行实时荧光定量分析。
| 引物 | 序列 | 用途 |
| β-actin-F | CGAAACCTTCAACACTCCCG | qRT-PCR内参 |
| β-actin-R | GGGACAGTGTGTGAAACGCC | qRT-PCR内参 |
| MyD88-F1 | CAGATGAGAAAGACCCCGTT | 荧光定量引物 |
| MyD88-R1 | ATTCCCCAGAAGTGGACGAC | 荧光定量引物 |
| TRIF-F1 | TCTGCCTACGACTGAACCTAA | 荧光定量引物 |
| TRIF-R1 | CCAGTAAGGCAAAGGTGATGAC | 荧光定量引物 |
PtToll6的cDNA全长为4 034 bp, 其中包括129 bp的5′ UTR, 2 934 bp的ORF区域, 和1 100 bp的3′ UTR, 预测分子量为109.078 kDa, 理论等电点为6.06, 共编码977个氨基酸(图 1)。利用SMART在线预测分析网站以及DNAMAN软件对PtToll6进行蛋白结构、序列比对分析。结果显示, PtToll6具有Toll样受体蛋白的重要结构域: LRR、TIR (图 2), 且PtToll6与其他甲壳动物Toll具有高度同源的TIR保守区, 而胞外的LRR较为复杂多样(图 3)。三疣梭子蟹PtToll6与其他Toll的序列同源性较低, 同源性为8.42%~17.92%, 其中同源性最高的是克氏原螯虾(Procambarus clarkii), 同源性为17.92%。利用MEGA 5.0软件对PtToll6基因进行系统进化分析, 图 4结果显示, PtToll6没有与亲缘关系近的甲壳动物聚在一起, 反而是与同属节肢动物门的果蝇Dm Toll 9单独聚为一支(PtToll6以红色圆点表示)。在已发表的三疣梭子蟹中, 有两个分别与亲缘关系较近的中华绒螯蟹(Eriocheir sinensis) EsToll2、拟穴青蟹(Scylla paramamosain) SpToll聚在一起, 而其他三疣梭子蟹Toll都是与果蝇Toll聚在一起(已发表的三疣梭子蟹Toll以红色圆圈表示)。
 |
| 图 1 PtToll6基因cDNA全长及氨基酸序列 Fig. 1 Full-length cDNA and amino acid sequence of PtToll6 gene |
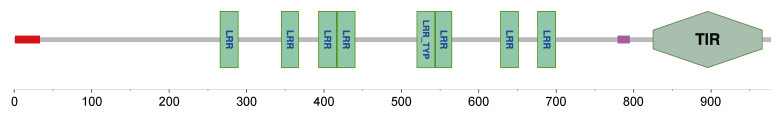 |
| 图 2 PtToll6基因编码蛋白结构域位置 Fig. 2 The location of the protein domain encoded by the PtToll6 gene |
 |
| 图 3 PtToll6氨基酸序列的多序列比对 Fig. 3 Multiple sequence alignment of the PtToll6 amino acid sequence |
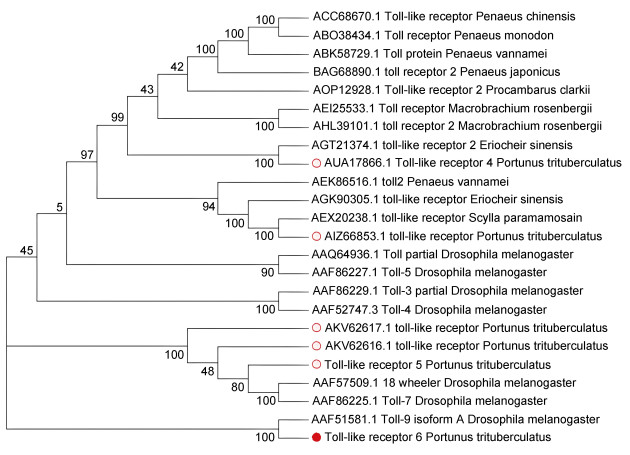 |
| 图 4 PtToll6的系统进化树 Fig. 4 Phylogenetic analysis of PtToll6 注: PtToll6以红色圆点表示; 已发表的三疣梭子蟹Toll以红色圆圈表示 |
利用实时荧光定量PCR技术, 分析了PtToll6在不同组织中的相对表达情况。如图 5所示, PtToll6在心脏、表皮、胃、肠、脑、肝胰腺、鳃、眼柄、血淋巴、肌肉这10个组织中均有表达。其中, PtToll6在肝胰腺中特异性地高表达, 其次在肠以及脑中的表达量相对较高, 在鳃组织中的表达量最低。
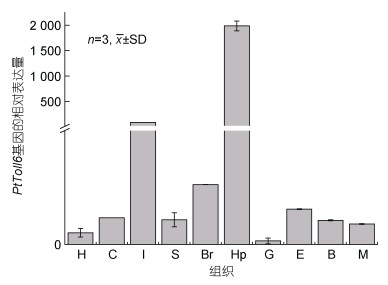 |
| 图 5 PtToll6基因在不同组织中的表达分析 Fig. 5 Relative mRNA expression level of PtToll6 gene in different tissues 注: H: 心脏; Hp: 肝胰腺; E: 眼柄; M: 肌肉; B: 血细胞; G: 鳃; S: 胃; C: 表皮; I: 肠; Br: 脑 |
利用荧光实时定量PCR对PAMPs刺激的3个实验组和对照组进行分析。从图 6中可以发现, 在肝胰腺组织中, 脂多糖以及Poly IC的刺激均使PtToll6基因的表达显著上调(P < 0.05), 且都在48 h达到峰值, 72 h开始回落, 但对脂多糖的响应更加强烈(对照组的上千倍)。在肽聚糖的刺激下, PtToll6基因在12 h、24 h下调, 但在48 h出现上调现象(P < 0.05)。
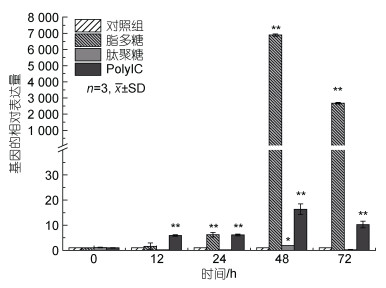 |
| 图 6 不同PAMPs刺激下PtToll6基因的表达分析 Fig. 6 Expression analysis of PtToll6 gene stimulated with different PAMPs 注: *表示差异显著(P < 0.05), **表示差异极显著(P < 0.01)。下同 |
在副溶血弧菌的感染下, PtToll6在三疣梭子蟹的肝胰腺中呈显著上调表达(P < 0.05), 12 h显著上调至0 h的2.74倍, 于24 h上调至9.02倍达到峰值, 后有回落又小幅上调(图 7)。MyD88也在感染下呈上调表达(P < 0.05), 在72 h达到峰值为0 h的11.4倍。而TRIF在感染后则是下调趋势(图 8)。
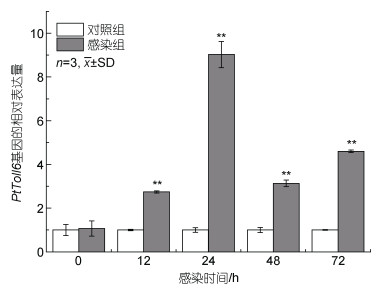 |
| 图 7 副溶血弧菌刺激后PtToll6基因的表达变化情况 Fig. 7 Expression of PtToll6 gene after infection with V. parahaemolyticus |
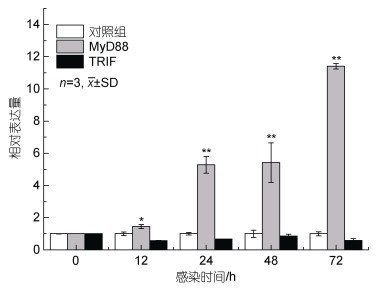 |
| 图 8 副溶血弧菌刺激后PtToll6接头分子的表达变化情况 Fig. 8 Expression of the linker molecule of PtToll6 gene after infection with V. parahaemolyticus |
RNAi实验结果显示, 注射双链RNA后, 三疣梭子蟹PtToll6基因在24 h、48 h都呈现下调表达, 差异显著(P < 0.05), 产生敲降效果, 24 h的干扰效率大于99% (图 9)。RNAi试验后死亡率统计实验结果显示(图 10), 阳性对照组的死亡率为50%, NC阴性对照组的死亡率为53.34%, 而实验组的死亡率为93.34%, 结果表明实验组死亡率显著升高, 为阴性对照组的1.8倍(P < 0.05)。
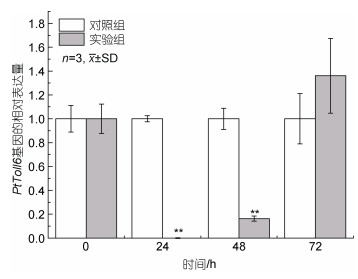 |
| 图 9 PtToll6基因干扰后的表达分析 Fig. 9 Relative mRNA expression level of PtToll6 after interference 注: 对照组为注射的序列打乱的双链RNA, 实验组为注射的PtToll6干扰序列。下同 |
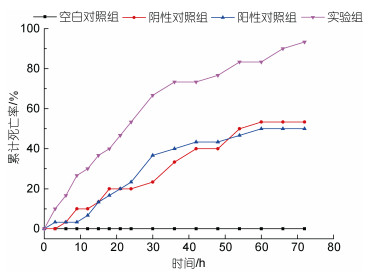 |
| 图 10 干扰后三疣梭子蟹在感染下的死亡率 Fig. 10 The mortality of the infected P. trituberculatus after interference |
在PtToll6敲降后, MyD88的表达也受到了抑制, 24 h至72 h之间几乎不表达, 具有明显的干扰效果, 而TRIF在24 h与72 h都呈上调趋势(图 11)。
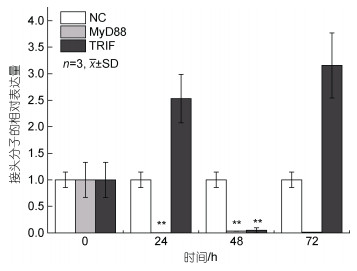 |
| 图 11 接头分子干扰后的相对表达量 Fig. 11 Relative expression levels after interference of linker molecules |
先天免疫是三疣梭子蟹等无脊椎动物抵抗外界病原入侵的重要防御机制, 主要由胚系基因所编码的PRR所介导, 其中TLR是一种在病原入侵后发挥识别和清除功能的重要PRR (Carty et al, 2010)。本实验克隆了三疣梭子蟹PtToll6基因的cDNA全长序列, 并预测了其编码蛋白结构域。与已发表的5个三疣梭子蟹TLR基因相比, PtToll6没有LRR-CT (C端-LRR), LRR仅有8个, 是该物种中已知LRR数量最少的TLR基因(Zhou et al, 2015; 张杰, 2017)。LRR结构域发挥着TLR基因识别PAMPs的功能, 不同的LRR结构域赋予了TLR基因能特异性识别病原相关分子模式的能力(Johnson et al, 2003)。PtToll6具有较少的LRR的特征可能与其识别特定的PAMPs相关。
三疣梭子蟹PtToll6在肝胰腺中特异性地高表达, 这与已发表的其他三疣梭子蟹TLR基因主要在血淋巴、鳃组织等组织高表达不同(Zhou et al, 2015; 张杰, 2017)。肝胰腺是甲壳动物解毒代谢和免疫调节的主要组织(Rőszer et al, 2014; Xu et al, 2020), 推测PtToll6可能在该组织中发挥重要的免疫功能。为了明确PtToll6所识别的PAMPs, 我们采用脂多糖、肽聚糖、Poly IC进行注射刺激, 发现3种PAMPs均能诱导PtToll6显著上调表达。值得注意的是PtToll6对脂多糖的响应最为强烈, 在感染48 h后肝胰腺中的表达量上调上千倍, 表明脂多糖是PtToll6主要识别的PAMPs。
副溶血弧菌属于典型的革兰氏阴性菌, 而脂多糖(又称内毒素)是革兰氏阴性菌细胞壁外膜中的主要成分(于耕红等, 2011; 霍诗天等, 2022)。为了探究TLR 6是否能够识别含有脂多糖的副溶血弧菌, 本研究进行了梭子蟹人工感染副溶血弧菌的实验。qPCR结果显示PtToll6在副溶血弧菌感染12 h后开始上调表达, 至24 h达到峰值, 表明其可以识别并响应该病原的入侵。为了进一步验证其在抗副溶血弧菌中的功能, 我们采用RNAi技术成功敲降了PtToll6的表达。对比不同组别人工感染副溶血弧菌的死亡率, 发现实验组的死亡率显著高于阴性对照组(1.8倍), 表明PtToll6基因的确在抗副溶血弧菌中发挥了重要的免疫作用。
我们分析了PtToll6敲降后下游两种接头分子的表达情况, 实验发现MyD88与PtToll6趋势相同, 在24 h、48 h被抑制表达, 而TRIF的表达没有被抑制。在副溶血弧菌感染实验中, MyD88也与PtToll6趋势相同, 呈上调表达, 而TRIF则是下调趋势。实验结果说明, PtToll6主要依赖MyD88途径, MyD88是其下游通路的接头分子。有研究表明, MyD88在副溶血弧菌感染中发挥了重要免疫功能, 如南美白对虾(Penaeus vannamei)在用脂多糖、金黄色葡萄菌和WSSV等刺激后, LvMyD88上调表达, 在天然免疫中可能发挥了作用(Zhang et al, 2012)。在栉孔扇贝(Chlamys farreri), 经过脂多糖、肽聚糖处理后, MyD88在原代培养的血细胞中也上调表达(Qiu et al, 2007)。本实验中, MyD88同样在副溶血弧菌感染下呈上调表达, 一定程度地参与了天然免疫进程。
4 结论本实验成功克隆了三疣梭子蟹PtToll6基因cDNA全长序列并分析了该基因的功能结构域和物种进化关系。通过分析PtToll6基因的组织表达、不同PAMPs刺激后的表达、病原感染下的表达特征以及RNAi后的死亡率, 探究了该基因在三疣梭子蟹天然免疫中的功能以及初步明确了其下游接头分子。研究结果有助于全面解析三疣梭子蟹中TLR家族的免疫机制。
于耕红, 范昕, 冯咏梅, 2011. 溃疡性结肠炎患者CA125及内毒素检测价值的探讨. 临床和实验医学杂志, 10(11): 827-829 DOI:10.3969/j.issn.1671-4695.2011.11.011 |
王有琴, 黄飞, 张睿, 等, 2021. 柯里拉京对小鼠单纯疱疹病毒性脑炎Toll样受体3-干扰素诱导链接蛋白通路的调控机制研究. 儿科药学杂志, 27(5): 1-5 |
宋柳, 吕建建, 王磊, 等, 2019. 三疣梭子蟹几丁质酶基因(PtCht6)的克隆及其在免疫中的功能分析. 海洋与湖沼, 50(5): 1080-1090 |
张杰, 2017. 三疣梭子蟹Toll、HMGB家族基因在先天免疫中的功能研究[D]. 上海: 上海海洋大学: 35-36.
|
张杰, 吕建建, 刘萍, 等, 2017. 三疣梭子蟹HMGBa基因克隆及其应答不同病原入侵的表达特征. 水生生物学报, 41(6): 1193-1199 |
郝景伟, 高保全, 王崇, 等, 2019. 致急性肝胰腺坏死病副溶血弧菌(VpAHPND)自然感染三疣梭子蟹. 水产学报, 43(7): 1647-1660 |
章晓联, 潘勤, 2002. Toll样受体在免疫学方面的研究进展. 细胞与分子免疫学杂志, 18(5): 670-672 |
章琳俐, 辛清武, 李丽, 等, 2021. TLRs在雄性动物生殖中的生物学功能. 福建畜牧兽医, 43(2): 22-24 DOI:10.3969/j.issn.1003-4331.2021.02.008 |
谢建军, 许文军, 施慧, 等, 2011. 溶藻弧菌诱导对三疣梭子蟹血淋巴非特异性免疫水平的影响. 水产学报, 35(9): 1392-1398 |
窦全伟, 李吉涛, 刘萍, 等, 2018. 脊尾白虾血蓝蛋白大亚基基因的克隆及表达分析. 水生生物学报, 42(1): 86-93 |
薛俊增, 堵南山, 赖伟, 等, 1997. 中国三疣梭子蟹Portunus trituberculatus Miers的研究. 东海海洋, 15(4): 61-66 |
霍诗天, 焦厚琪, 李清, 等, 2022. 克氏原螯虾副溶血弧菌的分离鉴定及药敏特性. 水生态学杂志, 43(1): 124-129 |
戴爱云, 冯钟琪, 宋玉枝, 等, 1977. 三疣梭子蟹渔业生物学的初步调查. 动物学杂志, (2): 30-39 |
CARTY M, BOWIE A G, 2010. Recent insights into the role of Toll-like receptors in viral infection. Clinical and Experimental Immunology, 161(3): 397-406 |
JOHNSON G B, BRUNN G J, TANG A H, et al, 2003. Evolutionary clues to the functions of the Toll-like family as surveillance receptors. Trends in Immunology, 24(1): 19-24 |
QIU L M, SONG L S, YU Y D, et al, 2007. Identification and characterization of a myeloid differentiation factor 88 (MyD88) cDNA from Zhikong scallop Chlamys farreri. Fish & Shellfish Immunology, 23(3): 614-623 |
REN X Y, WANG Z Q, GAO B Q, et al, 2017. Effects of florfenicol on the antioxidant status, detoxification system and biomolecule damage in the swimming crab (Portunus trituberculatus). Ecotoxicology and Environmental Safety, 143: 6-11 |
RŐSZER T, 2014. The invertebrate midintestinal gland ("hepatopancreas") is an evolutionary forerunner in the integration of immunity and metabolism. Cell and Tissue Research, 358(3): 685-695 |
SLACK J L, SCHOOLEY K, BONNERT T P, et al, 2000. Identification of two major sites in the type Ⅰ interleukin-1 receptor cytoplasmic region responsible for coupling to pro-inflammatory signaling pathways. Journal of Biological Chemistry, 275(7): 4670-4678 |
TANG D, GAO Y H, WANG R X, et al, 2012. Characterization, genomic organization, and expression profiles of MyD88, a key adaptor molecule in the TLR signaling pathways in miiuy croaker (Miichthys miiuy). Fish Physiology and Biochemistry, 38(6): 1667-1677 |
UEMATSU S, AKIRA S, 2008. Toll-Like Receptors (TLRs) and their ligands[M]//BAUER S, HARTMANN G. Toll-Like Receptors (TLRs) and Innate Immunity. Berlin: Springer: 1-20.
|
URIBE C, FOLCH H, ENRIQUEZ R, et al, 2011. Innate and adaptive immunity in teleost fish: a review. Veterinární Medicína, 56(10): 486-503 |
XU Z N, WEI Y J, GUO S L, et al, 2020. Short neuropeptide F enhances the immune response in the hepatopancreas of mud crab (Scylla paramamosain). Fish & Shellfish Immunology, 101: 244-251 |
YAGI Y, NISHIDA Y, IP Y T, 2010. Functional analysis of Toll-related genes in Drosophila. Development, Growth & Differentiation, 52(9): 771-783 |
YAMAMOTO M, SATO S, MORI K, et al, 2002. Cutting edge: a novel Toll/IL-1 receptor domain-containing adapter that preferentially activates the IFN-β promoter in the Toll-like receptor signaling. The Journal of Immunology, 169(12): 6668-6672 |
YANG L S, YIN Z X, LIAO J X, et al, 2007. A Toll receptor in shrimp. Molecular Immunology, 44(8): 1999-2008 |
ZHANG S, LI C Z, YAN H, et al, 2012. Identification and function of myeloid differentiation factor 88 (MyD88) in Litopenaeus vannamei. PLoS One, 7(10): e47038 |
ZHOU S M, YUAN X M, LIU S, et al, 2015. Three novel Toll genes (PtToll1-3) identified from a marine crab, Portunus trituberculatus: different tissue expression and response to pathogens. Fish & Shellfish Immunology, 46(2): 737-744 |
 2023, Vol. 54
2023, Vol. 54


