中国海洋湖沼学会主办。
文章信息
- 周鹤庭, 徐永江, 姜燕, 崔爱君, 王滨, 柳学周. 2023.
- ZHOU He-Ting, XU Yong-Jiang, JIANG Yan, CUI Ai-Jun, WANG Bin, LIU Xue-Zhou. 2023.
- 黄条鰤(Seriola aureovittata)生长对工厂化养殖密度的微生态适应特性
- ROLE OF GASTROINTESTINAL MICROBIOTA IN GROWTH REGULATION OF YELLOWTAIL KINGFISH SERIOLA AUREOVITTATA UNDER INDOOR TANK CULTURE IN DIFFERENT STOCKING DENSITIES
- 海洋与湖沼, 54(4): 1227-1237
- Oceanologia et Limnologia Sinica, 54(4): 1227-1237.
- http://dx.doi.org/10.11693/hyhz20221200344
文章历史
-
收稿日期:2022-12-31
收修改稿日期:2023-03-24
2. 上海海洋大学 水产科学国家级实验教学示范中心 上海 201306
2. National Demonstration Center for Experimental Fisheries Science Education, Shanghai Ocean University, Shanghai 201306, China
黄条鰤(Seriola aureovittata)隶属鲈形目(Perciformes)、鲹科(Carangidae)、鰤属(Seriola), 是一种广泛分布于全球海洋中上层的暖温大洋性经济鱼类, 具有长距离洄游的特性(张春霖, 1955)。黄条鰤肉质具有优良的口感、鲜度和较高的营养价值, 加工成生鱼片的品质可与三文鱼(Salmo salar)、蓝鳍金枪鱼(Thunnus thynnus)媲美(柳学周等, 2017)。黄条鰤兼顾生长速度较快和肉质良好等优点, 随着全球市场需求的不断增长, 其开发应用前景广阔(崔爱君等, 2021)。黄条鰤适宜于工厂化车间养殖、深水网箱养殖、深远海平台养殖等多种模式, 但当下产业设施情况最易实现工厂化养殖, 开发工厂化黄条鰤繁育与养殖关键技术, 可尽快为我国海水鱼类养殖多元化发展提供优良品种与高效工艺支撑(徐永江等, 2019)。
鱼类的养殖生长与健康水平受到多种因素的影响, 如低氧(王鹏飞, 2014)、盐度(史宝等, 2020)、密度(张奇, 2020; 倪金金, 2020)等, 其中密度是一种关键的制约因素。已有研究表明, 适宜的养殖密度会促进养殖鱼的生长, 较高的养殖密度会造成生长的迟滞和生理胁迫(宋志飞等, 2014; 韩岑等, 2017; 张奇, 2020; 倪金金, 2020)。关于密度对鱼类生长和健康影响的机制, 国内外诸多学者从鱼类摄食(倪金金, 2020)、饵料转化率(Yang et al, 2020)、养殖水质(Zahedi et al, 2019)等角度进行了研究和阐释, 鲜见有从消化道微生态角度进行研究的报道。
鱼类消化道内存在着数量庞大、结构复杂的微生物群落, 与其宿主自身形成一个特定的消化道微生态系统, 并在鱼类消化道内与宿主相互作用, 在宿主新陈代谢、生长发育以及免疫等重要生理过程中起关键的调控作用(高权新等, 2010; Wang et al, 2018)。周茜等(Zhou et al, 2022)发现半滑舌鳎的肠道菌群可以通过和宿主体内基因互作来启动免疫机制抵御哈维氏弧菌的感染。黄条鰤在工厂化和网箱养殖环境中表现出不同的生长性能, 同时其消化道菌群丰度结构及注释的功能通路发生改变(周鹤庭等, 2022)。黄条鰤作为大洋性长距离洄游性鱼类, 在进行工厂化车间养殖时, 需圈养在一个相对较小的养殖环境中, 养殖鱼可能会承受养殖密度带来的相关生理胁迫, 从而为养殖生长带来不利的影响。目前尚未见养殖密度对黄条鰤生长影响的微生态适应方面的报道, 因此采用基于Illumina MiSeq平台的高通量测序技术, 以工厂化养殖的黄条鰤为对象, 尝试从微生态角度来揭示养殖鱼生长代谢水平与养殖密度适应的关系, 以期为黄条鰤工厂化健康养殖技术提供理论依据。
1 材料与方法 1.1 实验鱼来源与实验设计实验于2020年7~8月在大连富谷食品有限公司的工厂化养殖车间完成, 试验周期为60 d。实验用黄条鰤来自于该公司自主培育的均一规格、体质健康的1龄养殖鱼, 平均体长(33.12±0.83) cm, 平均体质量(565.83±70.22) g。
使用容积为3 m3圆柱形玻璃缸水槽作为试验容器。实验设置低密度组(5 kg/m3)、中密度组(10 kg/m3)、高密度组(15 kg/m3)等三个实验组, 每个实验组设置一个重复。实验鱼放入各密度组暂养适应7 d后正式开始。实验采用流水养殖方式, 日换水率在400%以上。整个实验过程中, 养殖水温保持在22~27 ℃, 盐度31~32, 溶解氧 > 6 mg/L。实验期间投喂冰鲜玉筋鱼, 投喂量为鱼体重的3%~5%, 均饱食投喂。每天投喂后1 h清理养殖水槽, 保持底部清洁。
1.2 实验样品采集与处理实验结束后, 实验鱼经MS-222麻醉(80 mg/L)后, 测量体重、体长, 用一次性注射器于尾部静脉取血, 血液样本在室温下静止10 min后离心(4 ℃, 4 000 r/min, 10 min), 取血清保存在液氮中, 用于皮质醇和葡萄糖等指标分析。消化道菌群样本采集时, 先采用75%酒精棉擦拭体表, 随后解剖并快速取胃、幽门盲囊、肠道三个组织, 排出组织内残余内容物, 采用预冷的生理盐水冲洗后分装保存于液氮中。
工厂化养殖车间内每个实验组取样三尾鱼的消化道各个组织部位作为平行样品, 故样品命名情况如下: C2AS为低密度(A)组胃部(Stomach), C2BP为中密度(B)组幽门盲囊(Pyloric caecum), C2CG为高密度(C)组肠道(Intestinal), 依次类推命名样品。
1.3 生长与血清指标计算生长参数的计算按照下述公式进行:
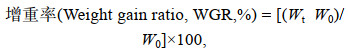 (1)
(1) (2)
(2)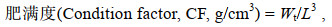 (3)
(3)上述式中, W0、Wt分别为试验初始和结束平均鱼体质量(湿重, g); t为试验天数(d); L为体长(cm)。
血清指标包括: 皮质醇、葡萄糖。上述指标均采用南京建成生物工程研究所生产的试剂盒, 严格按照其操作说明完成测定。
1.4 微生物总DNA提取与高通量测序将黄条鰤消化道样品用DNA抽提试剂盒(DNeasy PowerSoil Kit)提取基因组DNA, 之后利用Nano Drop 2000和琼脂糖凝胶电泳检测DNA的浓度, 质量合格后将其分离。以基因组DNA为模板, 使用带barcode的特异引物Tks Gflex DNA Polymerase (TaKaRa)进行PCR以确保扩增效率, 引物使用343F (5’-TACGGR AGGCAGCAG-3’)和798R (5’-AGGGTATCTAATCC T-3’) 扩增区域为16S V3-V4区。PCR产物经电泳检测和磁珠纯化后进行二轮PCR并重复上述检测与纯化步骤。最后根据PCR产物浓度进行稀释后等量混样, 随后通过Illumina MiSeq PE300平台进行高通量测序, 具体步骤参考该文章(Zhou et al, 2023)。
1.5 数据处理与统计分析高通量测序得到的原始图像数据文件经碱基识别分析转化为FASTQ格式的原始测序序列, 经过一系列剪切、去杂、拼接、质控和去除嵌合体后得到有效序列。根据序列的相似性, 将序列归为多个可分类操作单元(OTU), 序列相似度≥97%被归为一个OTU单元。使用QIIME软件包选取每个OTU中丰度最大的序列作为该OTU的代表序列(tags), 并将所有代表序列与Silva(version123)数据库进行比对注释, 物种比对注释使用RDP classifier软件, 保留置信区间大于0.7的注释结果。采用tax4fun(0.3.1)对微生物群基因参与的KEGG通路进行比对分析。
数据处理使用Excel2016, 并用SPSS 26.0软件进行统计分析。数值均采用“平均值±标准差” (Means± S.D.)表示。分析过程中利用单因素方差分析(One-way ANOVA)方法对不同密度组间的生长指标、血液指标、微生物多样性指标、属水平上优势菌群以及参与KEGG二级通路的tags数目等结果进行统计分析, 利用Duncan’s检验对三个不同密度组黄条鰤样品的差异性进行LSD多重比较, 显著差异水平为P < 0.05。
2 结果 2.1 不同密度下黄条鰤的生长与生理指标差异在工厂化不同养殖密度下, 经过60 d养殖后, 低密度组实验鱼终末体质量显著高于高密度组(P < 0.05), 增重率和特定生长率显著高于中、高密度组(P < 0.05), 另外, 低密度组实验鱼血清中皮质醇、葡萄糖水平显著高于中、高密度组(P < 0.05), 而中、高密度组之间的生长和生理指标均无显著性差异(P > 0.05) (图 1、表 1)。
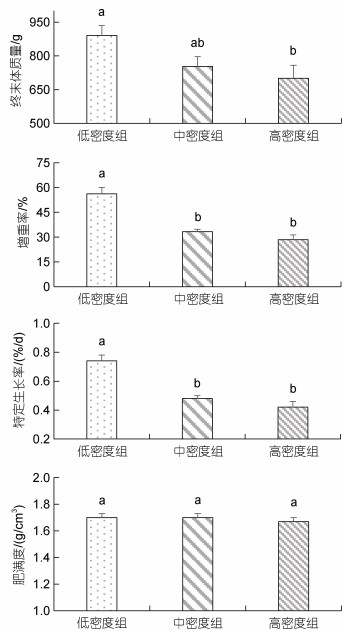 |
| 图 1 不同密度下黄条鰤的养殖生长指数 Fig. 1 Growth index of S. aureovittata in different stocking densities 注: 不同上标小写字母表示同一指标不同密度组之间的差异显著性(P < 0.05); 下同 |
| 血液指标 | 低密度组 | 中密度组 | 高密度组 |
| 皮质醇(ng/mL) | 29.96±0.31c | 34.04±0.15b | 39.59±0.23a |
| 葡萄糖(μmol/L) | 10.78±0.24c | 13.72±0.40b | 16.03±0.18a |
| 注: 不同小写字母上标表示不同密度组间的显著性差异(P < 0.05) | |||
共采集到27个黄条鰤消化道样品, 经测序和生物信息学处理, 共得到1 707 224条有效数据序列。图 2显示: 在胃中, 高密度组OTU数量最多, 低密度组同中、高密度组共有的OTU数目分别为2 018 (25.40%)、2 124 (25.34%)个; 在幽门盲囊中, 低、高密度OTU数目相等, 低密度组同中、高密度组共有的OTU数目分别为2 129 (25.44%)、2 185 (25.79%)个; 在肠道中, 低密度组OTU数目最多, 低密度组同中、高密度组共有的OTU数目分别为2 163 (25.53%)、2 210 (25.63%)个。综上发现, 不同养殖密度下实验鱼各组织之间共有OTU数目均在25%~26%之间, 无明显差异。
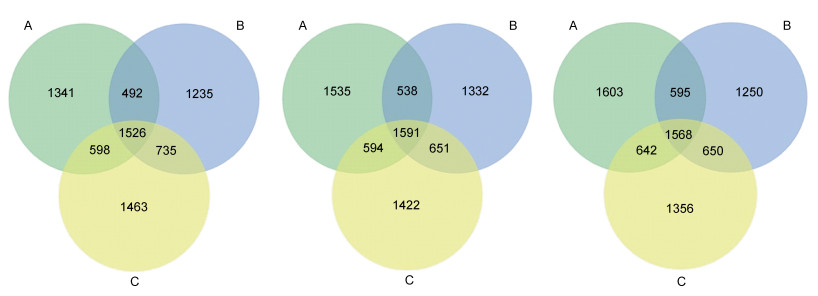 |
| 图 2 胃部、幽门盲囊、肠道微生物OTU的Venn图 Fig. 2 Venn diagrams of the OTU of microflora in stomach, pyloric caecum and intestine 注: 从左至右依次为胃部、幽门盲囊、肠道; A、B、C分别代表低、中、高密度组; 下同 |
测序结果显示获得的黄条鰤消化道菌群多样性指数覆盖度均达到0.98以上, 表明数据测定结果可靠(表 2)。在胃组织中, 低密度和高密度组的Chao1指数显著高于中密度组(P < 0.05), 低密度组的Shannon指数和Simpson指数显著高于中、高密度组(P < 0.05)。在幽门盲囊组织中, chao1指数在低密度组中显著高于中密度组(P < 0.05), 低密度组的Shannon指数和Simpson指数显著高于中、高密度组(P < 0.05)。在肠道组织中, chao1指数在各密度组中无显著性差异(P > 0.05), Shannon指数显示低密度组显著高于中、高密度组(P < 0.05), 低密度组的Simpson指数最大, 且显著高于中密度组(P < 0.05)。结果表明为低密度组在不同实验组中、肠道在各组织中的微生物群落多样性指数最高。
| 样品 | 序列 | 分类单元 | Chao1指数 | Shannon指数 | Simpson指数 | 覆盖度/% | |
| C2AS | 63 048±1 373 | 1 935±103 | 3 307.47±170.41b | 7.74±0.60b | 0.97±0.02b | 98.73±0.10 | |
| C2BS | 64 873±2 563 | 1 974±237 | 2 889.82±90.45a | 6.22±0.11a | 0.88±0.00a | 99.01±0.03 | |
| C2CS | 63 635±2 214 | 2 170±162 | 3 339.61±160.13b | 6.49±0.22a | 0.89±0.01a | 98.82±0.04 | |
| C2AP | 64 049±2 874 | 2 156±93 | 3 612.54±206.83b | 8.34±0.09b | 0.98±0.00b | 98.57±0.07 | |
| C2BP | 62 102±2 871 | 2 028±58 | 2 982.58±18.17a | 6.23±1.13a | 0.87±0.06a | 98.92±0.07 | |
| C2CP | 63 177±2 317 | 2 129±386 | 3 356.80±449.56ab | 6.20±0.15a | 0.87±0.01a | 98.77±0.17 | |
| C2AG | 62 527±3 243 | 2 203±182 | 3 616.34±91.69 | 8.44±0.39b | 0.98±0.00b | 98.64±0.07 | |
| C2BG | 62 621±3 915 | 2 026±160 | 3 051.86±194.12 | 6.27±0.82a | 0.92±0.09a | 98.93±0.06 | |
| C2CG | 63 043±1 250 | 2 097±226 | 3 356.85±457.50 | 6.80±0.87a | 0.91±0.05ab | 98.78±0.23 | |
| 注: 不同上标小写字母表示不同密度组实验鱼同一组织部位之间的差异显著性(P < 0.05) | |||||||
测序结果显示检测到的黄条鰤消化道菌群来源于32个门, 其中相对丰度值大于1%的有7个门, 分别是变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、芽单胞菌门(Gemmatimonadetes)、酸杆菌门(Acidobacteria)、软壁菌门(Tenericutes), 丰度值累积占比在98%以上。
胃部的菌群变化体现以下两个方面: 变形菌门、软壁菌门在低密度组中的相对丰度占比远低于中、高密度组, 而拟杆菌门等优势菌门在低密度组中的相对丰度占比都高于中、高密度组。幽门盲囊和肠道中的门水平菌群变化情况同胃部基本一致。以上结果表明, 一方面胃、幽门盲囊和肠的菌群组成一个稳定的微生态环境, 菌群丰度的变化趋势基本同步; 另一方面, 低密度组同中、高密度组相比, 门水平上的各菌群丰度值出现了较大的波动, 但菌群组成并无明显变化(图 3)。
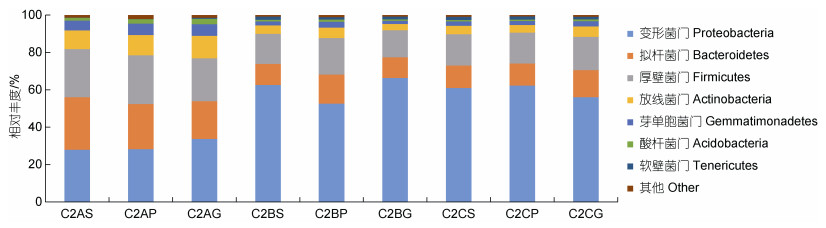 |
| 图 3 基于门水平的黄条鰤消化道菌群结构 Fig. 3 Structure of bacteria in digestive tract of S. aureovittata at phylum level Bacteroides Sphingomonas Klebsiella Bifidobacterium |
不同养殖密度组的黄条鰤消化道样品的菌群分布于763个属, 其中丰度值> 1%的属有11个(图 4)。属水平上, 优势菌属(丰度大于2%)均出现了显著性差异变化。在胃组织中, 乳杆菌属(Lactobacillus)、鞘氨醇单胞菌属(Sphingomonas)、双歧杆菌属(Bifidobacterium)、Faecalibaculum和Ruminococcaceae_ UCG的丰度在低密度组中显著高于中、高密度组(P < 0.05), 克雷伯氏菌属(Klebsiella)丰度在低密度组显著低于中、高密度组(P < 0.05)。此外, 幽门盲囊和肠道中的优势菌属变化趋势同胃一致。低密度组的胃组织拟杆菌属(Bacteroides)丰度显著高于中密度组(P < 0.05), 与高密度组无显著差异, 在幽门盲囊、肠的不同密度下均未出现显著性差异。各优势菌属在中、高密度组间丰度均无显著性差异(P > 0.05), 但中密度组, 幽门盲囊优势菌属的丰度值高于肠道, 趋势与高密度组相反(图 5)。
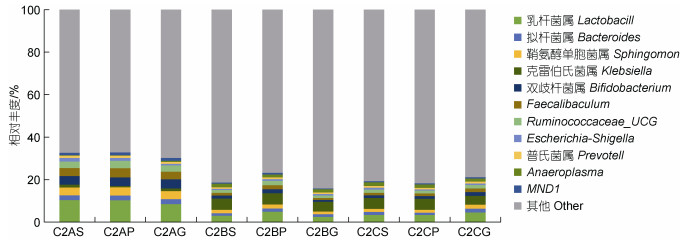 |
| 图 4 基于属水平不同密度养殖的黄条鰤消化道优势菌群结构 Fig. 4 Structure of dominant bacteria in digestive tract of S. aureovittata at genus level |
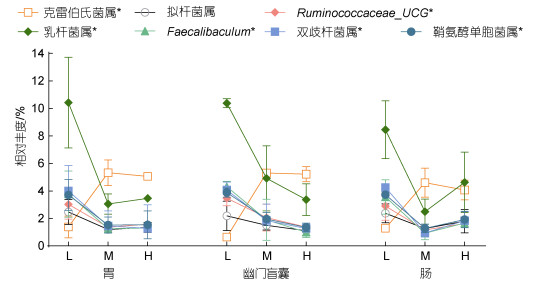 |
| 图 5 基于属水平不同密度养殖的黄条鰤消化道优势菌群差异 Fig. 5 Difference of dominant bacteria in digestive tract of S. aureovittata at genus level 注: L、M、H分别表示低、中、高密度组, *表示该菌属的低密度组和中、高密度组间具有差异显著性(P < 0.05) |
通过KEGG分析, 在一级通路水平, 各密度组消化道中的菌群功能主要集中在代谢(Metabolism)、环境信息过程(Environmental Information Processing)、遗传信息过程(Genetic Information Processing)等三个方面, 低密度组中消化道菌群参与功能通路的基因数目远低于中、高密度组, 同时中、高密度组在代谢、环境信息过程和遗传信息过程三个通路中注释的tags数目远大于低密度组(图 6)。二级通路中, 碳水化合物代谢、氨基酸代谢、能量代谢、辅助因子、维生素的代谢、核苷酸代谢、脂质代谢、膜运输、信号传导、翻译、转录和折叠、分类和降解等通路均出现低密度组显著低于中、高密度组(P < 0.05), 中、高密度组之间无显著性差异的情况(P > 0.05) (图 7)。
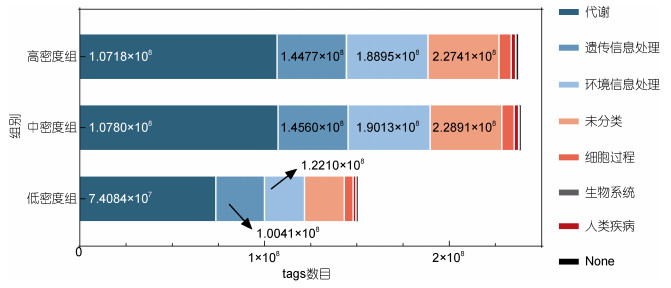 |
| 图 6 黄条鰤消化道菌群KEGG一级通路功能注释 Fig. 6 Functional notes of KEGG 1 level pathway of digestive tract bacteria of S. aureovittata |
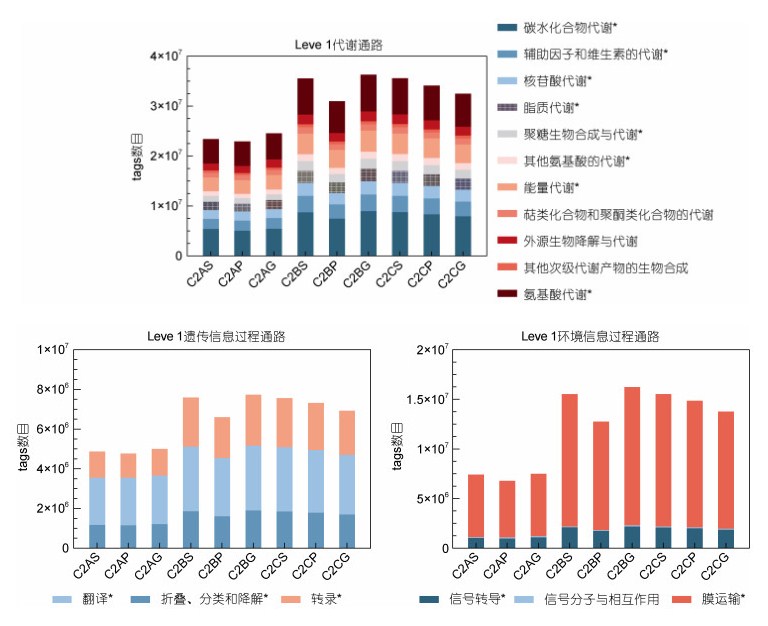 |
| 图 7 KEGG通路功能注释(二级) Fig. 7 Functional notes of KEGG pathway (Level Ⅱ) 注: *表示该功能通路中, 低密度组和中、高密度组间具有差异显著性(P < 0.05) |
养殖生产过程中, 鱼类生长会受到各种环境因子的影响, 密度就是其中一个关键因素。有研究表明, 大口黑鲈(Micropterus salmoides) (倪金金, 2020)的终末体质量随养殖密度升高显著下降, 与文章结果一致。中华鲟(Acipenser sinensis) (Long et al, 2019)的研究也表明高养殖密度对鱼类的生长性能存在不利的影响。在黄条鰤的终末体质量等生长指标和血清激素指标的差异性变化表明中、高密度养殖组相对低密度养殖组来说, 对生长代谢和生理都表现出一定的胁迫抑制作用。
3.2 不同养殖密度下黄条鰤消化道菌群多样性变化消化道微生物的多样性被认为是代表宿主机体健康和代谢能力的指标(Jena et al, 2018), 当多样性下降时, 或可表明消化道微生物群落趋于不稳定, 微生态功能受影响, 容易导致生物患病(金若晨等, 2020)。杜世聪等(2019)研究认为表示多样性的Shannon指数下降可以作为凡纳滨对虾(Litopenaeus Vannamei)出现健康分化的标志。微生物菌群多样性的变化会受生存环境和不同消化道区段的影响(Ni et al, 2014)。姜燕等(2020)在工厂化养殖大黄鱼(Larimichthys crocea)的研究中, 发现菌群多样性随消化道延伸出现下降趋势。随着消化道延伸, 高密度组胃部、幽门盲囊、肠道中的OTU数量呈逐渐减少趋势, 低密度组中呈增加趋势; Shannon指数和Simpson指数也在不同密度组间呈现显著性差异, 中、高密度组显著低于低密度组。这些都进一步说明中、高密度组的黄条鰤机体消化道微生态环境受到一定程度的胁迫, 菌群多样性降低, 趋于不稳定状态, 对病菌等侵害抵抗力下降, 更容易遭受细菌等外源不利因素的侵袭而发生病害。
3.3 不同养殖密度下黄条鰤消化道菌群结构特性有学者提出肠道微生物核心菌群的概念, 即环境改变会导致菌群结构改变, 但对核心菌群的组成影响不大, 菌群区系的相对稳定性成熟, 不容易受外界环境影响(涂宗财等, 2017; 丁红秀等, 2021)。结果显示同一密度组的不同组织间OUT及多样性无显著差异, 且微生物群落组成相似。工厂化养殖黄条鰤的消化道菌群门水平上的优势群类主要为变形菌门、拟杆菌门、厚壁菌门、放线菌门, 与先前报道鱼类肠道常见的优势微生物的结果(Kostic et al, 2013; Li et al, 2013)相似。有研究称, 体内菌群中变形菌门的持续增加会打破菌群环境稳态, 导致宿主出现体内营养代谢紊乱、免疫功能失调等情况(Carvalho et al, 2012), 并指出生物体内变形菌门的增加可作为判断有潜在疾病的诊断标志(Shin et al, 2015)。姜燕等(2021)关于患病和健康大黄鱼的研究中, 认为患病鱼消化道内的变形菌门丰度显著高于健康鱼, 拟杆菌门和厚壁菌门显著低于健康鱼。变形菌门在中、高密度中相对低密度养殖环境大幅增加, 这一定程度上可能预示着消化道内菌群出现紊乱。拟杆菌门主要与DNA、蛋白质、降解多糖等碳水化合物和脂类的吸收转化有较大关联(朱亦晨等, 2020)。拟杆菌门在中、高养殖密度组中相对低密度组大幅减少。厚壁菌门中的部分细菌在多糖发酵和纤维降解中有重要的作用, 一定程度上可增强机体免疫力(姬玉娇等, 2016), 中、高密度组厚壁菌门菌群丰度的降低也反映出机体免疫力的下降。结合结果中门水平菌群结构变化, 中、高密度养殖组相对低密度组条件致病菌门的菌群丰度的升高, 与养殖鱼生长受到抑制(特定生长率、肥满度等降低)、生理胁迫(皮质醇激素、葡萄糖水平升高)的变化一致, 其可能的机制是这些条件致病菌的增加影响了鱼体的营养吸收和生理代谢, 并在血清皮质醇激素、葡萄糖代谢等免疫相关指标上体现出来。
在属水平的菌群结构上, 厚壁菌门的乳杆菌属丰度占比最大, 且能定殖在宿主的肠道内, 与病原菌竞争肠道上皮的附着点, 一方面可以维持微生态环境稳定、增强消化道黏膜免疫调节; 另一方面可以有效减少宿主感染致病菌。重组植物乳杆菌(L. plantarum) (Soltani et al, 2019)、鼠李糖乳杆菌JCM1136 (L. rhamnosus JCM1136) (Xia et al, 2018)可以显著提高虹鳟(Oncorhynchus mykiss)血清中的IgM, 促使免疫基因表达上调, 提升宿主免疫力。在养殖生产中, 乳杆菌常被用作益生菌添加在水产养殖的饲料中, 可以帮助饲料消化、促进生长, 如利用添加乳杆菌的饲料投喂大菱鲆(Scophthalmus maximus)后存活率和生长率得到提升(苏晨阳, 2015)。有研究表明, 乳杆菌和双歧杆菌会影响宿主糖代谢, 促进机体生长(Yan et al, 2016; Asgharian et al, 2020), 拟杆菌属在消化道内有分解蛋白质、复杂多糖并促进脂质代谢的作用(Singh et al, 2015)。在动物生长过程中需要大量的细胞增殖, 需要大量的磷脂和能量来维持细胞快速的增大和分化, 而脂代谢产物可以为细胞提供磷脂等脂质, 糖代谢则为细胞提供了碳骨架与能量(徐振海, 1990; Varki, 2017)。乳杆菌、拟杆菌、双歧杆菌、Faecalibaculum等可以产生短链脂肪酸(short-chain fatty acids, SCFA), SCFA能够调节机体脂肪、骨骼肌及肝脏等器官的能量代谢, 诱导产生胰岛素样生长因子1 (insulin-like growth factor-1, IGF-1), 影响动物生长及体重(Holzer et al, 2001; Canfora et al, 2015; Yan et al, 2016; 程冉冉, 2020; Zagato et al, 2020; 袁志发等, 2021)。结果显示, 低密度组黄条鰤消化道各组织中乳杆菌属、双歧杆菌属、Faecalibaculum等的丰度值均显著高于中、高密度, 但是中密度组中幽门盲囊内丰度值高于肠道, 在高密度组中, 肠道内丰度值高于幽门盲囊, 这可能是由于肠道微生物的多样性更丰富, 中密度的胁迫下仍能一定程度保持菌群相对平衡, 但在更高密度的胁迫下产生紊乱。以上讨论的乳杆菌属、双歧杆菌属等菌属在不同密度组间的适应性变化与低密度组养殖鱼肥满度、增重率、生长速率高等密切相关, 说明这部分菌属在维持鱼体内消化道微生态稳定, 增强黏膜免疫, 制约条件致病菌的增殖, 促进低密度下养殖鱼脂质和糖类的代谢等方面具有一定的开发应用潜力(苏晨阳, 2015; 姬玉娇等, 2016; Wang et al, 2018; 姜燕等, 2021)。前期研究结果提示我们, 养殖过程中或可通过在黄条鰤饵料中适当增加乳杆菌等益生菌, 提升养殖鱼的生长效率和抗病力等。另外, 本团队已有研究表明, 低密度组养殖的黄条鰤血清中IGF-1和生长激素显著高于中、高密度组(姜燕等, 2022), 结合本研究中低密度组养殖鱼消化道优势菌属丰度显著高于中、高密度组, 推测消化道优势菌属可能与血清IGF-1表达存在协同调控关系, 从而促进养殖鱼表现出更佳的生长性能, 具体的调控作用及可能机制有待于深入研究。
克雷伯氏菌属和Anaeroplasma同属变形菌门, 这两种菌属在中、高密度组中的增加是引起变形菌门丰度值变化的原因。克雷伯氏菌属是常见的条件致病菌属, 当宿主机体健康状态下降、有益菌丰度降低时, 平衡状态被打破, 即可导致宿主发病。克雷伯氏菌属下有肺炎克雷伯菌(Klebsiella pneumoniae)、产酸克雷伯菌(K. oxytoca)等众多细菌, 但肺炎克雷伯菌在水生动物中多次被发现并报道, 在发病的鲤鱼(Cyprinus carpio) (卢玉婷等, 2014)、出现烂鳃的白鲢(Silver carp) (唐毅等, 2007)、暴发出血病的团头鲂(Megalobrama amhlycephala) (滕涛等, 2016)中均分离或鉴定出该菌。本次研究中高密度组养殖鱼消化道中的克雷伯氏菌属上升, 虽然未出现病理表现, 但与生长指标和血清皮质醇等生理指标方面的表现相一致, 存在暴发疾病的潜在风险。
3.4 不同养殖密度下黄条鰤消化道菌群功能注释分析通过KEGG通路分析来看, 消化道菌群主要功能注释集中在代谢、遗传信息处理和环境信息处理这三方面。在KEGG二级通路中, 低密度组实验鱼消化道菌群对应的功能基因数目显著低于中、高密度组, 且中、高密度组之间无显著性差异, 表明当中、高养殖密度对生长造成生理胁迫时, 养殖鱼本身可能通过消化道菌群结构和丰度的调整来调动更多的代谢途径参与到胁迫应答的过程中, 从而对机体的生长进行代谢补偿以尽量维持机体消化道微生态稳定。二级代谢通路下, 碳水化合物代谢、氨基酸代谢、能量代谢、辅助因子和维生素代谢、核苷酸代谢、聚糖生物和代谢等通路富集均出现在中、高密度组中显著高于低密度组的情况, 这可能是中、高密度条件下黄条鰤消化道菌群积极参与了由于密度胁迫引发的生长代谢补偿调控过程, 与曾晨爔等(2020)的研究结果一致。中、高密度组在翻译, 转录, 折叠、分类和降解这三个通路中, 参与的基因数目显著高于低密度组, 这可能由于中、高养殖密度造成的胁迫导致鱼体应激反应出现了DNA损伤(冉茂良等, 2013), 而密度胁迫下的黄条鰤消化道菌群积极参与了遗传信息加工处理, 其对遗传物质具体的调控机制有待于今后深入研究。
4 结论黄条鰤在低(5 kg/m3)、中(10 kg/m3)、高(15 kg/m3)三个工厂化养殖密度条件下, 生理指标和消化道微生物群表现出显著性差异, 表明养殖密度对黄条鰤的生理造成胁迫从而影响了生长代谢水平。5 kg/m3的密度条件中, 消化道中微生物的Alpha多样性以及乳杆菌属等有益菌的丰度显著较高, 皮质醇和葡萄糖显著较低, 同时增重率和特定生长率显著高于其他密度, 说明该密度组黄条鰤的生长性能和生理状态优于其他密度组。该研究为养殖黄条鰤的适宜密度和工厂化健康养殖技术提供理论支撑。
丁红秀, 李忠莹, 刘俊, 等, 2021. 不同生境草鱼肠道微生物组成和群落特征分析. 微生物学报, 61(3): 729-739 |
王鹏飞, 2014. 鳜热休克蛋白和低氧反应基因的克隆和表达研究[D]. 广州: 中山大学: 1-16.
|
卢玉婷, 郑丹丹, 胡扬扬, 等, 2014. 鲤鱼肺炎克雷伯氏菌分离与鉴定. 中国兽药杂志, 48(9): 9-13 |
史宝, 柳学周, 刘永山, 等, 2020. 盐度渐变对黄条鰤消化酶和超氧化物歧化酶活力及甲状腺激素的影响. 中国海洋大学学报, 50(1): 48-56 |
冉茂良, 高环, 尹杰, 等, 2013. 氧化应激与DNA损伤. 动物营养学报, 25(10): 2238-2245 |
朱亦晨, 谭洪新, 罗国芝, 2020. 养殖密度对硝化型生物絮团系统中凡纳滨对虾生长和水质的影响. 上海海洋大学学报, 29(1): 27-35 |
苏晨阳, 2015. 海水养殖有益菌微生物的筛选鉴定及应用[D]. 青岛: 中国海洋大学: 1-22.
|
杜世聪, 黄雷, 杨坤杰, 等, 2019. 凡纳滨对虾健康状态分化前后养殖水体浮游细菌群落的比较. 生态学杂志, 38(8): 2456-2465 |
宋志飞, 温海深, 李吉方, 等, 2014. 养殖密度对流水养殖系统中俄罗斯鲟幼鱼生长的影响. 水产学报, 38(6): 835-842 |
张奇, 2020. 圈养模式下养殖密度对大口黑鲈生长、生理指标以及肌肉品质影响的研究[D]. 武汉: 华中农业大学: 6-12.
|
张春霖, 1955. 黄渤海鱼类调查报告. 北京: 科学出版社, 116-119
|
金若晨, 江敏, 孙世玉, 等, 2020. 凡纳滨对虾养殖环境及肠道微生物群落特征分析. 水产学报, 44(12): 2037-2054 |
周鹤庭, 徐永江, 姜燕, 等, 2022. 两种养殖模式下黄条鰤幼鱼消化道菌群对生长的微生态调控作用. 中国水产科学, 29(10): 1437-1448 |
柳学周, 徐永江, 李荣, 等, 2017. 黄条鰤(Seriola aureovittata)肌肉营养组成分析与评价. 渔业科学进展, 38(1): 128-135 |
姜燕, 于超勇, 徐永江, 等, 2021. 健康与患病大黄鱼消化道微生物结构特征分析. 中国海洋大学学报, 51(5): 32-40 |
姜燕, 王维鑫, 徐永江, 等, 2022. 工厂化养殖密度对黄条鰤生长和生理特性的影响. 中国水产科学, 29(9): 1290-1299 |
姜燕, 徐永江, 于超勇, 等, 2020. 大黄鱼消化道菌群结构、消化酶和非特异性免疫酶活力分析. 渔业科学进展, 41(5): 61-72 |
袁志发, 张通, 蔡金池, 等, 2021. 肠道菌群、IGF-1与骨代谢联系机制的研究进展. 中国骨质疏松杂志, 27(4): 599-604 |
倪金金, 2020. 池塘工程化循环水养殖模式下养殖密度对大口黑鲈生长与生理机能的影响[D]. 上海: 上海海洋大学: 1-18.
|
徐永江, 张正荣, 柳学周, 等, 2019. 黄条鰤早期生长发育特征. 中国水产科学, 26(1): 172-182 |
徐振海, 1990. 脂肪代谢在运动中的作用. 杭州教育学院学报, (4): 71-75 |
高权新, 吴天星, 王进波, 2010. 肠道微生物与寄主的共生关系研究进展. 动物营养学报, 22(3): 519-526 |
唐毅, 张芬, 孙翰昌, 等, 2007. 白鲢肺炎克雷伯氏菌的分离鉴定. 西南大学学报(自然科学版), 29(6): 73-76 |
涂宗财, 庞娟娟, 王辉, 等, 2017. 水环境中重金属铜对异育银鲫肠道微生物的影响. 微生物学报, 57(7): 1060-1068 |
姬玉娇, 祝倩, 耿梅梅, 等, 2016. 高、低营养水平饲粮对环江香猪结肠菌群结构及代谢物的影响. 微生物学通报, 43(7): 1650-1659 |
崔爱君, 徐永江, 王滨, 等, 2021. 黄条鰤生长性状全基因组关联分析. 渔业科学进展, 42(2): 71-78 |
韩岑, 雷霁霖, 刘宝良, 等, 2017. 养殖密度对循环水系统中大菱鲆生长和蛋白质代谢的影响. 海洋科学, 41(3): 32-40 |
程冉冉, 2020. 粪菌移植对鸡生长发育及肠道菌群的影响[D]. 武汉: 华中农业大学: 1-19.
|
曾晨爔, 林茂, 李忠琴, 等, 2020. 基于16S rRNA基因扩增子测序分析日本囊对虾肠道菌群结构与功能的特征. 微生物学通报, 47(6): 1857-1866 |
滕涛, 梁利国, 谢骏, 等, 2016. 团头鲂源肺炎克雷伯氏菌的分离鉴定. 水生态学杂志, 37(6): 95-100 |
ASGHARIAN H, HOMAYOUNI-RAD A, MIRGHAFOURVAND M, et al, 2020. Effect of probiotic yoghurt on plasma glucose in overweight and obese pregnant women: a randomized controlled clinical trial. European Journal of Nutrition, 59(1): 205-215 |
CANFORA E E, JOCKEN J W, BLAAK E E, 2015. Short-chain fatty acids in control of body weight and insulin sensitivity. Nature Reviews Endocrinology, 11(10): 577-591 |
CARVALHO F, KOREN O, GOODRICH J, et al, 2012. Transient inability to manage proteobacteria promotes chronic gut inflammation in TLR5-deficient mice. Cell Host & Microbe, 12(2): 139-152 |
HOLZER M, DANNER H, MAYRHUBER E, et al, 2001. The aerobic stability of silages influenced by metabolites of lactic acid bacteria. Mededelingen (Rijksuniversiteit te Gent. Fakulteit van de Landbouwkundige en Toegepaste Biologische Wetenschappen), 66(3b): 459-461 |
JENA P K, SHENG L L, NAGAR N, et al, 2018. The effect of synbiotics Bifidobacterium infantis and milk oligosaccharides on shaping gut microbiota community structure and NASH treatment. Data in Brief, 19: 1025-1029 |
KOSTIC A D, HOWITT M R, GARRETT W S, 2013. Exploring host-microbiota interactions in animal models and humans. Genes & Development, 27(7): 701-718 |
LI X M, YAN Q Y, XIE S Q, et al, 2013. Gut microbiota contributes to the growth of fast-growing transgenic common carp (Cyprinus carpio L.). PLoS One, 8(5): e64577 |
LONG L N, ZHANG H G, NI Q, et al, 2019. Effects of stocking density on growth, stress, and immune responses of juvenile Chinese sturgeon (Acipenser sinensis) in a recirculating aquaculture system. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 219: 25-34 |
NI J J, YAN Q Y, YU Y H, et al, 2014. Fish gut microecosystem: a model for detecting spatial pattern of microorganisms. Chinese Journal of Oceanology and Limnology, 32(1): 54-57 |
SHIN N R, WHON T W, BAE J W, 2015. Proteobacteria: microbial signature of dysbiosis in gut microbiota. Trends in Biotechnology, 33(9): 496-503 |
SINGH V, CHASSAING B, ZHANG L M, et al, 2015. Microbiota-dependent hepatic lipogenesis mediated by stearoyl CoA desaturase 1 (SCD1) promotes metabolic syndrome in TLR5-deficient mice. Cell Metabolism, 22(6): 983-996 |
SOLTANI M, PAKZAD K, TAHERI-MIRGHAED A, et al, 2019. Dietary application of the Probiotic Lactobacillus plantarum 426951 enhances immune status and growth of rainbow trout (Oncorhynchus mykiss) vaccinated against Yersinia ruckeri. Probiotics and Antimicrobial Proteins, 11(1): 207-219 |
VARKI A, 2017. Biological roles of glycans. Glycobiology, 27(1): 3-49 |
WANG A R, RAN C, RINGØ E, et al, 2018. Progress in fish gastrointestinal microbiota research. Reviews in Aquaculture, 10(3): 626-640 |
XIA Y, LU M X, CHEN G, et al, 2018. Effects of dietary Lactobacillus rhamnosus JCM1136 and Lactococcus lactis subsp. lactis JCM5805 on the growth, intestinal microbiota, morphology, immune response and disease resistance of juvenile Nile tilapia, Oreochromis niloticus. Fish & Shellfish Immunology, 76: 368-379 |
YAN J, HERZOG J W, TSANG K, et al, 2016. Gut microbiota induce IGF-1 and promote bone formation and growth. Proceedings of the National Academy of Sciences of the United States of America, 113(47): E7554-E7563 |
YANG Q, GUO L, LIU B S, et al, 2020. Effects of stocking density on the growth performance, serum biochemistry, muscle composition and HSP70 gene expression of juvenile golden pompano Trachinotus ovatus (Linnaeus, 1758). Aquaculture, 518: 734841 |
ZAGATO E, POZZI C, BERTOCCHI A, et al, 2020. Endogenous murine microbiota member Faecalibaculum rodentium and its human homologue protect from intestinal tumour growth. Nature Microbiology, 5(3): 511-524 |
ZAHEDI S, AKBARZADEH A, MEHRZAD J, et al, 2019. Effect of stocking density on growth performance, plasma biochemistry and muscle gene expression in rainbow trout (Oncorhynchus mykiss). Aquaculture, 498: 271-278 |
ZHOU H T, JIANG Y, XU Y J, et al, 2023. Histological, microecological and transcriptomic physiological responses underlying hypoxia and reoxygenation adaptation in yellowtail kingfish (Seriola lalandi). Frontiers in Marine Science, 10: 1121866 |
ZHOU Q, ZHU X, LI Y Z, et al, 2022. Intestinal microbiome-mediated resistance against vibriosis for Cynoglossus semilaevis. Microbiome, 10(1): 153 |
 2023, Vol. 54
2023, Vol. 54


