
中国海洋湖沼学会主办。
文章信息
- 许翠娅. 2023.
- XU Cui-Ya. 2023.
- 链状裸甲藻所产麻痹性贝类毒素在翡翠贻贝体内的累积、转化和排出
- ACCUMULATION, TRANSFORMATION AND DEPURATION OF PARALYTIC SHELLFISH TOXINS FROM DINOFLAGELLATE GYMNODIMIUM CATENATUM IN MUSSEL PERNA VIRIDIS
- 海洋与湖沼, 54(5): 1363-1372
- Oceanologia et Limnologia Sinica, 54(5): 1363-1372.
- http://dx.doi.org/10.11693/hyhz20230200025
文章历史
-
收稿日期:2023-02-06
收修改稿日期:2023-03-29
2. 福建省海洋生物资源开发利用协同创新中心 福建厦门 361013
2. Fujian Collaborative Innovation Center for Exploitation and Utilization of Marine Biological Resources, Xiamen 361013, China
链状裸甲藻(Gymnodinium catenatum)属于甲藻门裸甲藻属, 为广温广盐种, 主要分布于北美、欧洲、意大利和日本, 我国珠江口海域和东南沿海也有分布。链状裸甲藻是高毒性赤潮种, 可产生麻痹性贝类毒素(paralytic shellfish toxins, PST) (郭皓, 2004)。2017年6月, 在福建省漳州、泉州海域发生了链状裸甲藻赤潮, 这是福建省首次记录的链状裸甲藻赤潮, 造成了赤潮海域的贻贝、牡蛎、扇贝等滤食性贝类体内PST含量超标, 并通过食物链传递, 导致多地民众因食用翡翠贻贝(Perna viridis)中毒的事件发生(陈火荣, 2018)。
PST广泛分布于世界各地的海洋和淡水生态系统中(Peacock et al, 2018), 被认为是严重危害人类健康的藻源毒素之一(Etheridge, 2010), 它不但直接影响生物活性, 威胁海洋和淡水生态系统稳定, 还通过食物链传递到贝类、鱼类等生物体内, 尤其是通过双壳贝类作为食物链传递媒介, 对世界各地民众健康和安全造成严重威胁。目前, 已有一些国内外学者对PST在贝类体内的累积、转化和排出进行研究, 其中关于亚历山大藻产生的PST相关报道较多(颜天等, 2001; Lassus et al, 2007; Murray et al, 2009; 田华等, 2010; Andres et al, 2019; 张海涛等, 2023)。研究表明, 贝类对PST的累积和排出能力差异很大, 这与贝类种类、对产毒藻的敏感性, 以及产毒藻的种类、密度、细胞毒性等有较大关系(Chen et al, 2001; 朱明远等, 2003)。来自不同海域的链状裸甲藻不同株系间的生长特性和产毒能力也存在很大差异(Yamamoto et al, 2002), 关于链状裸甲藻产生的PST在贝类体内的累积、转化和排出研究国内外相关报道较少。
弄清贝类对PST的累积、分布及排出的过程, 了解毒素生成及组分转化, 是正确解析贝类中PST危害形成的前提和基础。贻贝作为世界性分布的沿岸底栖双壳类, 由于其分布广、活动性低、有经济价值和对污染物有较强的生物富集能力, 已被广泛地用于海洋污染的生物监测中(张少娜等, 2004)。与其他贝类相比, 贻贝对PST具有更高的累积能力(De Carvalho et al, 2019)。本文以链状裸甲藻为产毒藻, 研究其产生的PST在翡翠贻贝体内的累积、转化和排出规律, 以期为贝类脱毒与净化、赤潮减灾和水产品质量风险防控提供基础数据和理论依据。
1 材料与方法 1.1 受试生物试验用链状裸甲藻和中肋骨条藻(Skeletonema costatum)藻液均由厦门大学海洋微型生物保种中心提供, 链状裸甲藻藻种于2017年6月分离自泉州海域。翡翠贻贝来自漳州东山乌礁湾海域, 选择活力好、健康、无外伤的贻贝, 运送至福建省水产研究所生态试验场。将贻贝置于规格25 L的玻璃水槽中, 按试验密度进行驯养(2只/L)。驯养3 d, 期间每日定时换水, 并投喂中肋骨条藻(水体中藻液初始密度5×106 cells/L)两次, 全天充气。驯养期间贻贝活力良好、摄食正常, 死亡率0.3%。驯养后贻贝取样测定PST含量作为本底值。试验前随机抽取30只贻贝进行生物性状测量, 试验贻贝壳长(3.2±0.1) cm, 壳高(7.0±0.3) cm, 全重(25.1±2.7) g。
1.2 试验药剂与主要试验仪器 1.2.1 试验药剂主要化学试剂包括: 乙腈(色谱纯), 德国Sigma公司生产; 甲酸(色谱纯), 美国ACS公司生产; 甲酸铵(分析纯), 上海麦克林生化科技有限公司生产; 乙酸(分析纯)、氨水(分析纯), 西陇科学股份有限公司生产。PST标准品包括石房蛤毒素(STX)、新石房蛤毒素(neoSTX)、脱氨基甲酰基类毒素(dcSTX、dcGTX2 & 3)、N-磺酰胺基甲酰类毒素(GTX5、C1 & 2)、膝沟藻毒素(GTX1 & 4、GTX2 & 3), 均购自加拿大海洋生物研究所。
1.2.2 主要试验仪器超高效液相色谱-质谱仪(TSQ Quantis, 美国赛默飞世尔公司)、冷冻离心机(5804R, 德国艾本德公司)、超纯水系统(Elixs3+A10, 美国密理博公司)、手持式匀浆机(T10, 德国IKA公司)、超声波细胞破碎仪(JY92-IIN, 宁波新芝公司)、超声波清洗器(KQ-600DB, 江苏昆山舒美公司)、涡旋振荡器(MS3, 德国IKA公司)、多管涡旋混合仪(U14005-826, 美国VWR公司)、固相萃取装置(Visiprep 24 DL, 美国Supelco公司)、全自动正置荧光显微镜(DM6B, 德国莱卡公司)。
1.3 试验方法与条件试验所用海水来自厦门海域。试验期间海水盐度30.0±0.1, 水温(23±1) ℃, pH值8.00~8.12, 溶解氧7.19~7.38 mg/L。
1.3.1 短期累积试验短期累积试验周期12 h。设置3个试验组和1个对照组, 各组均设3个平行。从驯养3 d的贻贝中选出大小一致、健康的贻贝, 每组24只贻贝×3个平行, 分别置于盛有12 L海水的玻璃水槽中。试验组投喂处于对数生长后期的链状裸甲藻, 设置3个试验梯度, 藻液初始密度分别为2.5×105、5.0×105和1.0×106 cells/L。对照组投喂处于对数生长后期的中肋骨条藻, 藻液初始密度为5.0×106 cells/L。投喂后0.5、1、2、4、6、8、10、12 h取贻贝样品用于检测PST含量, 每次每缸分别随机取3只贻贝。
1.3.2 长期累积试验自然海域环境条件下, 链状裸甲藻赤潮周期为7 d左右, 长期累积试验周期适当延长, 设置为10 d。试验设置1个试验组和1个对照组, 各组均设3个平行。从驯养3 d的贻贝中选出大小一致、健康的贻贝, 每组40只贻贝×3个平行, 分别置于盛有20 L海水的玻璃水槽中, 试验组和对照组分别投喂处于对数生长后期的链状裸甲藻和中肋骨条藻, 试验密度分别为5.0×105和5.0×106 cells/L。每日投喂藻液2次、换水1次, 试验过程中随贻贝的减少相应减少所投喂的藻量和更换的水体积。试验开始后分别在1、2、4、6、8和10 d取贻贝样品, 每次每缸分别随机取3只贻贝用于检测PST含量, 并在换水前取混合均匀的海水样品0.8 L用于检测水体PST含量, 该水样包括海水、贻贝滤食后剩余的藻细胞和粪便等混合物。
1.3.3 排出试验长期累积试验结束后, 停止投喂链状裸甲藻, 彻底换水后投喂中肋骨条藻(藻液初始密度5.0×106 cells/L), 开始排出试验, 试验周期28 d。每4 d取一次贻贝样品(每次每缸3只)和混合均匀的海水样品(每次每缸0.8 L), 分别用于检测贻贝和水体中PST含量。
1.3.4 PST的提取与分析PST的测定采用液相色谱-串联质谱法。贻贝、藻及水体中PST的前处理方法参考相关文献(岳亚军等, 2017; Liu et al, 2020a), 液相色谱及质谱条件参考GB 5009.213-2016《食品安全国家标准贝类中麻痹性贝类毒素的测定》。贻贝分不同部位取样检测, 包括内脏团、闭壳肌和其他组织(外套膜、鳃和足等) 3部分。
1.4 数据分析PST各组分毒素含量换算成PST总毒力(STXeq)进行比较, 计算公式为: 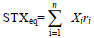
应用SPSS 22软件对试验数据进行单因素方差分析(LSD多重比较法)和T检验(α=0.05), 利用Excel 2007软件作图, 图中数据为平均值±标准差。
2 结果 2.1 链状裸甲藻PST毒素组成和含量经检测, 在盐度30.0±0.1、水温(23±1) ℃的环境条件下, 链状裸甲藻PST含量为(7.41±0.79) pg/cell。共检出9种PST毒素, 分别属于氨基甲酸酯类毒素(STX、neoSTX、GTX3), N-磺氨甲酰基类毒素(C1-2、GTX5)和脱氨甲酰基类毒素(dcGTX2-3、dcSTX), 其中以低毒性的C2物质的量百分比最高, 占39.4%, 其次为neoSTX(26.9%)、GTX5(18.5%)和STX(9.0%)占比较高, dcSTX(2.9%)、C1(2.8%)、GTX3(0.4%)、dcGTX3(0.2%)和dcGTX2(0.1%)占比较低。与其他海域的链状裸甲藻相比, 本试验藻株毒素组成存在较大差异。澳大利亚海域藻株中主要组分为C毒素(C1-4), 含少量的B1-2、GTX2-3、dcSTX、STX和neoSTX, 西班牙和葡萄牙藻株含有B1-2(Negri et al, 2001); 新加坡海域藻株所产毒素主要组分为GTX1和GTX4, 含少量的GTX2/3、neoSTX和STX(Holmes et al, 2002); 香港藻株主要组分为C毒素(C1-2)、GTX5(B1)、dcGTX2-3和dcSTX, 以C毒素和GTX5为主(胡蓉等, 2012)。
2.2 PST在翡翠贻贝体内的短期累积在贻贝的滤食作用下, 链状裸甲藻细胞密度随着时间的推移逐渐降低。在投喂0.5 h后, 不同组别的藻液密度均下降了1个数量级, 1 h后下降了约2个数量级, 1 h后藻液密度下降的速度有所放缓, 12 h后各试验组藻液密度均下降至很低的水平, 在102~103 cells/L的数量级(图 1)。
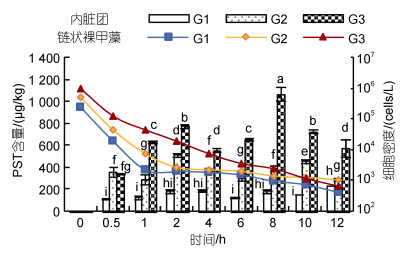 |
| 图 1 短期累积试验链状裸甲藻细胞密度和翡翠贻贝内脏团PST含量的变化 Fig. 1 Variations in cell density of Gymnodinium catenatum and content of PST in Perna viridis in the short-term accumulation experiment 注: G1: 2.5×105 cells/L试验组; G2: 5.0×105 cells/L试验组; G3: 1.0×106 cells/L试验组; 图中不同字母表示PST含量差异显著(P<0.05), 下同 |
对照组贻贝内脏团、闭壳肌和其他组织(外套膜、鳃和足等)均未检出PST。试验组贻贝内脏团PST含量基本呈波浪形上升的变化趋势, 累积0.5 h后各试验组内脏团均可检出PST (图 1)。2.5×105 cells/L试验组内脏团PST含量波动范围为(111.9±8.7)~(236.2±0.8) μg/kg, 累积12 h达到最大值; 闭壳肌和其他组织未检出PST。5.0×105 cells/L试验组贻贝内脏团PST含量波动范围为(290.9±48.0)~(515.5±18.8) μg/kg, 累积2 h达到峰值, 次高峰出现在累积10 h, 为(457.8±21.0) μg/kg; 闭壳肌和其他组织未检出PST。1.0×106 cells/L试验组贻贝内脏团PST含量波动范围为(339.2±6.5)~(1 068.6±62.0) μg/kg, 累积8 h达到最大值, 超过食用贝类毒素安全标准(800 μg/kg), 次高峰出现在累积2 h, 为(775.4±20.8) μg/kg; 闭壳肌和其他组织分别在累积2 h和0.5 h后检出PST, 含量均较低。短期累积期间, 内脏团PST含量显著高于闭壳肌和其他组织。累积12 h后, 1.0×106 cells/L试验组内脏团、闭壳肌和其他组织的PST含量分别占贻贝PST总含量的91.9%、2.7%和5.4%。
3个试验组贻贝内脏团均检出7种PST组分, 包括: STX、neoSTX、C1、GTX5、dcSTX、dcGTX2和dcGTX3, 在产毒藻中占比最高的C2(39.4%)和占比较低的GTX3(0.4%)未检出。产毒藻中主要组分neoSTX(26.9%)在贻贝体内占比较低, 累积12 h后在内脏团中占比为4.1%~6.1%。各试验组内脏团PST均主要以dcSTX、dcGTX2、C1和GTX5的形式存在。累积12 h后, 各试验组内脏团主要毒素组分占比为: dcSTX(30.3%~38.0%)、dcGTX2(19.2%~22.8%)、C1(14.9%~17.5%)和GTX5(14.1%~15.0%) (图 2)。1.0×106 cells/L试验组闭壳肌和其他组织毒素组分与内脏团相比少了占比最低的dcGTX3, 其他PST组分占比与内脏团相似。
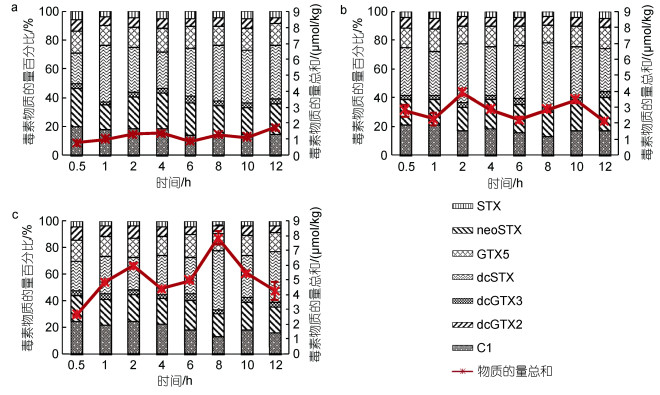 |
| 图 2 短期累积试验各试验组翡翠贻贝内脏团PST组分的变化 Fig. 2 Variations of PST components in visceral mass of Perna viridis during the short-term accumulation experiment 注: a: 2.5×105 cells/L试验组; b: 5.0×105 cells/L试验组; c: 1.0×106 cells/L试验组 |
长期累积和排出试验中, 对照组贻贝内脏团、闭壳肌和其他组织均未检出PST。随着累积时间的延长, 试验组贻贝内脏团、闭壳肌和其他组织的PST含量均呈先上升后下降的变化趋势。内脏团的毒素累积速率显著高于闭壳肌和其他组织, 内脏团PST含量累积2 d即超过食用贝类毒素安全标准, 达到(1 223.8± 64.7) μg/kg; 累积8 d达到峰值(3 590.4±545.7) μg/kg, 超过限量标准3.5倍, 平均累积速率为448.8 μg/(kg·d); 累积10 d后PST含量为(2 763.1±173.4) μg/kg。长期累积期间试验组闭壳肌和其他组织PST均未超标, 含量范围分别为(46.5±8.3)~(396.1±11.3)和(54.5± 2.2)~(405.3±16.8) μg/kg。累积期间内脏团PST含量显著高于闭壳肌和其他组织, 闭壳肌和其他组织在同一时间则无显著差异(图 3)。累积10 d后, 内脏团、闭壳肌和其他组织PST含量分别占贻贝PST总含量的88.4%、4.4%和7.2%。
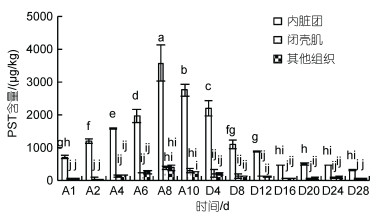 |
| 图 3 长期累积和排出试验翡翠贻贝不同组织PST含量的变化 Fig. 3 Variations of PST content in different tissues of Perna viridis in the long-term accumulation and depuration experiment 注: 横坐标刻度值中A表示累积, D表示排出, 数字表示试验天数, 下同 |
排出过程贻贝内脏团、闭壳肌和其他组织的PST含量均呈下降的变化趋势, 内脏团PST含量在排出16 d后低于食用贝类毒素安全标准, 排出28 d后内脏团、闭壳肌和其他组织仍检出PST, 含量分别为(329.6±12.3)、(65.2±4.7)和(68.4±4.4) μg/kg。排出期间内脏团的PST含量显著高于闭壳肌和其他组织, 闭壳肌和其他组织在同一时间则无显著差异(图 3)。排出28 d后贻贝内脏团、闭壳肌和其他组织的排出率分别为88.1%、79.1%和76.3%。总体来看, 排出速率先快后慢, 前8 d排出速率较快, 内脏团、闭壳肌和其他组织平均每天毒素排出率分别为7.5%、6.6%和6.1%, 其中内脏团排出速率为207.4 μg/(kg·d), 后20 d排出速率较慢, 内脏团、闭壳肌和其他组织的平均每天毒素排出率分别为3.5%、2.8%和2.7%。内脏团的毒素排出速率显著高于闭壳肌和其他组织, 闭壳肌和其他组织则无显著差异。
长期累积期间试验组贻贝闭壳肌和其他组织共检出8种PST组分: STX、neoSTX、C1、C2、GTX5、dcGTX2、dcGTX3和dcSTX, 内脏团多检出GTX2, 共9种PST组分。与短期累积试验相比, 内脏团多检出2种组分: C2和GTX2, 与链状裸甲藻相比少了GTX3、多了GTX2, 占比均较低。长期累积过程中贻贝内脏团、闭壳肌和其他组织中dcSTX物质的量百分比均呈增加的趋势。累积10 d后, 贻贝不同组织PST均以dcSTX(41.2%~45.6%)物质的量百分比最高, 其次为GTX5(19.0%~21.4%)、dcGTX2(13.8%~14.4%)和C1(9.5%~11.7%), 不同组织这4种组分所占比例较接近。试验组贻贝内脏团在排出4 d后未检出GTX2, 排出28 d未检出C2。排出过程中dcSTX占比继续呈增加的趋势, 在闭壳肌和其他组织中占比增加得尤为显著, 其余PST组分占比总体下降。排出28 d后, 贻贝不同组织PST均以dcSTX(51.1%~67.4%)占比最高, 其次为dcGTX2(12.9%~16.1%)和GTX5(8.8%~ 15.4%) (图 4)。
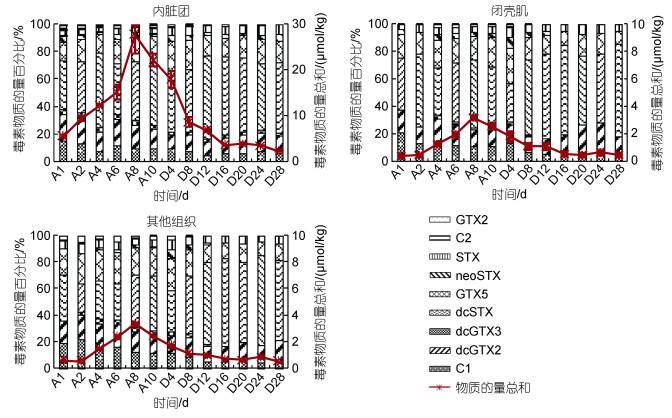 |
| 图 4 长期累积和排出试验翡翠贻贝不同组织PST组分的变化 Fig. 4 Variations of PST components in different tissues of Perna viridis during the long-term accumulation and depuration experiment |
试验水体包括海水、贻贝滤食12 h后剩余的少量藻细胞(102~103 cells/L)和粪便等混合物。长期累积试验对照组水体未检出PST。试验组水体中PST含量基本呈先上升后下降的变化趋势, 波动范围为(560.4±7.3)~(1 874.8±20.6) ng/L, 累积6 d时PST含量最高, 累积10 d PST含量为(1 416.5±54.4) ng/L。排出试验水体中PST含量呈下降的变化趋势, 下降速度先快后慢, 排出16 d后下降速度缓慢。排出过程水体中PST含量波动范围为(90.9±2.7)~(1 416.5±54.4) ng/L, 排出28 d PST含量最低, 相比排出初始降低了93.6% (图 5)。
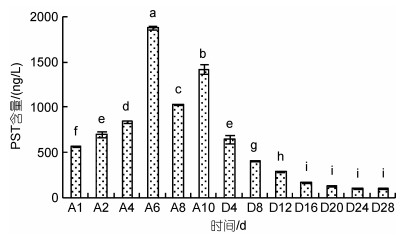 |
| 图 5 长期累积和排出试验水体中PST含量的变化 Fig. 5 Variations of PST content of seawater during the long-term accumulation and depuration experiment |
长期累积期间试验组水体中共检出8种PSTs组分, 分别为STX、neoSTX、dcSTX、dcGTX2、dcGTX3、GTX5、C1、C2, 贻贝内脏团中微量的GTX2组分在水体中未检出。累积试验期间水体中PST各组分占比相对稳定, 主要以C2(21.0%~24.8%)、GTX5 (17.6%~ 21.5%)、C1(17.6%~20.6%)和dcGTX2(12.6%~ 15.0%)形式存在, 累积10 d主要PST组分为C2(22.9%)、GTX5(21.5%)、C1(20.1%)和dcGTX2 (13.9%)。与累积试验结束时相比, 排出4 d后水体中微量的dcGTX3未检出, 排出20 d后dcSTX未检出。排出期间水体中PST各组分占比波动较大, 主要以dcGTX2 (12.9%~33.6%)、STX(11.2%~33.3%)、GTX5 (12.5%~25.8%)、C2(0~22.9%)和C1(2.2%~20.1%)形式存在, 其中dcGTX2和STX基本呈上升趋势, C1则呈下降趋势。排出28 d水体中主要PST组分为STX (28.7%)、dcGTX2(27.7%)、C2(18.1%)和GTX5(12.5%) (图 6)。
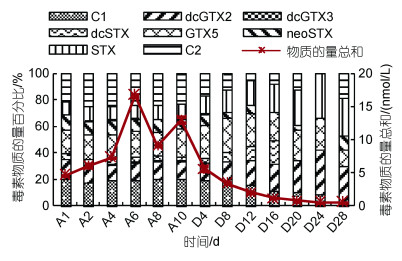 |
| 图 6 长期累积和排出试验水体中PST组分的变化 Fig. 6 Variations of PST components of seawater during the long-term accumulation and depuration experiment |
短期累积试验结果表明, 试验组贻贝内脏团PST含量基本呈波浪形上升的变化趋势, 说明毒素的累积并不是一个不断累加的过程, 而是一个累积和排出同时进行的复杂动态过程。PST主要累积在贻贝内脏团中, 随着产毒藻密度的成倍数增加, 内脏团PST含量也呈一定的倍数增加, PST含量峰值出现的时间也相应提前, 贻贝内脏团PST含量与产毒藻密度呈显著正相关关系。当投喂高密度(1.0×106 cells/L)链状裸甲藻时, 贻贝内脏团PST含量在累积2 h后已达(775.4±20.8) μg/kg, 接近食用贝类毒素安全标准, 累积8 h后超标, 达到(1 068.6±62.0) μg/kg, 说明翡翠贻贝具有较强的毒素累积能力。本试验产毒藻投喂频率是12 h一次, 镜检数据显示, 投喂1 h后藻细胞密度由1.0×106 cells/L下降至4.5×104 cells/L, 下降了接近2个数量级。而在自然海域中, 如果发生链状裸甲藻赤潮, 产毒藻会持续维持在高密度水平, 当藻细胞密度达到1.0×106 cells/L时, 推测累积时间不到2 h, 贻贝内脏团PST含量就会超过食用贝类毒素安全标准。
长期累积期间, 试验组贻贝内脏团、闭壳肌和其他组织的PST含量均呈先上升后下降的变化趋势。试验期间投喂产毒藻的密度和频率是保持一致的, 贻贝的清滤率没有显著变化, 推测当贻贝体内PST累积到一定浓度时, 其排出速度也会加快, 当排出速度大于累积速度时, 贻贝体内PST含量将下降。试验组贻贝内脏团PST含量在累积2 d超过食用贝类毒素安全标准, 累积8 d达到峰值(3 590.4±545.7) μg/kg。已有研究表明, 毛蚶(Scapharca subcrenata)摄食初始密度为400 cells/mL的链状裸甲藻24 h后, PST含量为207 µg/kg (林卓如等, 2022); 紫贻贝(Mytilus galloprovincialis)摄食链状亚历山大藻(Alexandrium catenella) 7 d后, 内脏团PST含量高达6 815.36 µg/kg (张海涛等, 2023); 栉孔扇贝(Chlamys farreri)在摄食塔玛亚历山大藻(A. tamarense) 5 d后, 体内毒素总量为1 903 μg/kg (邴晓菲等, 2017); 近江牡蛎(Ostrea rivularis)摄食微小亚历山大藻(A. minutum) 5 d后, 体内毒素累积量为(3 069.2±178.2) MU/100g (解万翠等, 2013)。可以看出, 不同试验中贝类体内毒素累积情况差异显著, 这与产毒藻的种类、毒性大小、投喂浓度以及试验贝类的品种密切相关。
贻贝PST含量在累积8 d达到最大值, 贻贝全贝PST含量为1 836.7 μg/kg, 1只贻贝肉重的平均值为8.94 g, 因此累积8 d后平均每只贻贝毒素累积量为16.42 μg。链状裸甲藻PST含量为7.41 pg/cell, 累积8 d每只贻贝摄食的毒素总量为29.58 μg, 因此贻贝对PST的整体吸收效率为55.5%。根据试验水体中PST含量计算得出, 累积8 d平均每只贻贝通过粪便排出的PST总量为2.50 μg (含少量藻细胞毒素), 因此每只贻贝累积和排出的毒素总量为18.92 μg, 与摄入毒素总量存在差异, 毒素总量约减少了36%。导致这种差异的原因应该主要是由于毒素在贻贝体内的代谢消除造成的, 产毒藻进入贻贝体内后发生了毒素转化, 一些高毒性的PST组分转化为低毒性的组分, 导致毒素总量下降。
累积和排出前8 d贻贝内脏团平均毒素累积速率和排出速率分别为448.8和207.4 μg/(kg·d), 累积速率为排出速率的2.2倍, 排出28 d贻贝各组织仍检出PST, 说明贻贝对PST具有累积快排出慢的特点, 与其他贝类的相关研究结果一致(朱明远等, 2003; 田华等, 2010; 邴晓菲等, 2017)。贝类的毒素排出过程分为两个阶段: 前期的快速阶段和后期的慢速阶段。快速阶段是通过内脏排出未吸收的毒素, 慢速阶段中则大多排出内脏和其他组织中吸收的毒素(Lassus et al, 1989; Silvert et al, 1995; Bricelj et al, 1998)。PST毒素排出速率先快后慢的特点也可能与贝类在毒素水平较高时, 其自净排出率也会保持在较高水平有关(陈光, 2008)。本试验的排毒过程很明显分为两个阶段, 前8 d排毒速率较快, 贻贝内脏团、闭壳肌和其他组织的排出速率>6%/d, 后20 d排毒速率较慢, 排出速率在3%/d左右, 这与双阶段排毒理论相符。根据Bricelj等(1998)对双壳贝类毒素排出速率的划分, 快/中速排毒者毒素排出率一般为(6%~17%)/d, 慢速排毒者排出率则通常为(0.3%~4%)/d, 多数贻贝和牡蛎与部分扇贝和蛤属于前者, 而大多数蛤与扇贝属于后者。本项目组2017年6月对链状裸甲藻赤潮海域贝类的跟踪监测结果显示, 翡翠贻贝PST含量可高达74 472 MU/100g(小鼠生物法), 超标185倍(限量值为400 MU/100g), 赤潮消亡后7 d内, PST毒素的排出速率约为10%/d, 表明翡翠贻贝属于快/中速排毒者。本试验链状裸甲藻藻株的毒性水平不高, 投喂量不大, 累积试验结束时贻贝体内PST含量远未达到累积饱和点, 排放初始贻贝PST含量较低, 因此排出速率也相对较低。贻贝体内PST含量在下降到较低水平后并未全部排出, 而是维持了相当长一段时间, 原因可能为低浓度的PST基本不影响贻贝的正常生理状态, 因此贻贝对其的排出速率也大大下降。
3.2 翡翠贻贝不同组织对PST的累积和排出差异短期累积和长期累积试验结果表明, 贻贝内脏团对PST的累积能力显著高于闭壳肌和其他组织(外套膜、鳃和足等), PST主要累积在内脏团中, 内脏团PST含量可占贻贝PST总含量的90%左右, 闭壳肌和其他组织的PST含量则无显著差异。已有研究结果表明, 栉孔扇贝、虾夷扇贝(Patinopecten yessoensis)不同组织对PST累积能力由大到小顺序为内脏团、外套膜、闭壳肌, 以内脏团累积能力最强(朱明远等, 2003; 汪娜等, 2013; 邴晓菲等, 2017), 紫贻贝不同组织对PST的累积能力为内脏远远高于肌肉(颜天等, 2001), 与本研究结果基本一致。排出试验结果表明, 内脏团的毒素排出速率显著高于闭壳肌和其他组织, 内脏团PST毒素排出速率较高, 可能是由于贝类毒素累积主要在内脏进行, 其自净排除率也会保持在较高水平。
3.3 PST在累积和排出过程中的转化双壳贝类中, PST代谢过程中的转化作用包括差向异构体间转化以及不同毒素种类间转化。一般来说, 生物体内化学物质间的转化是等分子数转化。Oshima(1995)提出, 双壳贝类中C11位有羟基硫酸基团的PST可以通过热力学平衡发生差向异构化, 因此, 毒藻中稳定的β型(GTX3/4和C2)毒素在双壳贝类中逐渐转化成更稳定的α型(GTX2/1和C1), 直至两者比例达到1∶3 (Mizuta et al, 1999; Choi et al, 2006)。邴晓菲等(2017)依据PST在栉孔扇贝体内的代谢分析得出, 其发生的主要转化反应包括羟基化和去磺酸化, 可能的转化趋势为C1→GTX2, C1→ dcGTX2, C2→GTX3。本试验链状裸甲藻中C2(39.4%)物质的量百分比最高, 其次为neoSTX (26.9%), dcSTX(2.9%)、dcGTX2(0.1%)和C1(2.8%)占比较低。而短期累积和长期累积过程中贻贝dcSTX和dcGTX2占比最高, 其中5.0×105 cells/L试验组累积12 h后, 贻贝内脏团中dcSTX和dcGTX2占比分别为30.3%和22.8%, 产毒藻中占比最高的C2组分未检出, neoSTX和C1占比分别为6.1%和17.5%。累积10 d贻贝内脏团中dcSTX和dcGTX2占比分别为45.6%和14.0%, C2、neoSTX和C1占比分别为2.4%、1.9%和9.5%。dcSTX、dcGTX2和C1在内脏团中占比显著高于其在产毒藻中占比, C2和neoSTX占比则显著下降。排出期间贻贝主要PST组分与累积期间相似, 排出28 d内脏团中dcSTX和dcGTX2占比分别为51.1%和12.9%, C2未检出, neoSTX和C1占比分别为4.8%和5.9%, dcSTX占比继续显著升高。累积期间贻贝内脏团PST组分与产毒藻相比少了GTX3, 多了GTX2, 贻贝与摄入的产毒藻之间PST组分的差异, 以及累积和排出过程中贻贝毒素组成和占比的差异, 说明毒素进入贻贝体内后发生了代谢转化(Blanco et al, 2003; Yu et al, 2007)。推测贻贝中C11位有羟基硫酸基团的PST发生差向异构化, 从β型转化成α型毒素, 即GTX3→GTX2, C2→C1; 部分C1毒素可能通过去磺酸化转化成dcGTX2, 即: C2→C1→dcGTX2。此外, dcSTX占比在累积和排放过程中的显著升高, 以及neoSTX和STX占比的显著下降, 表明贻贝可能在氨甲酰水解酶的作用下将藻细胞中高毒的STX转化为较低毒的dcSTX(包振民等, 2021), 同时说明贻贝对dcSTX有较强的累积能力且排出能力较弱。而neoSTX是否转化为dcneoSTX或M类毒素还有待进一步研究。
累积和排出过程试验水体与贻贝、试验水体与产毒藻之间PST各组分占比均差异显著。导致试验过程中水体组分差异的主要原因是贻贝粪便组分的变化。累积10 d水体中主要PST组分为C2(22.9%)、GTX5(21.5%)、C1(20.1%)和dcGTX2(13.9%), 排出阶段水体中STX和dcGTX2占比持续升高, C1则持续下降, GTX5也显著下降, 排出28 d水体中主要PST组分为STX(28.7%)、dcGTX2(27.7%)、C2(18.1%)和GTX5(12.5%)。推测贻贝代谢过程中, 消化道中C1通过去磺酸化转化成dcGTX2, 而GTX5则可能水解转化为STX, 再通过粪便排放到水体中。已有研究表明, 双壳贝类中普遍存在N-磺胺甲酰基类向氨基甲酸酯类毒素的转化, 如无齿蚌(Anodonta cygnea)摄入柔细束丝藻(Aphanizomenon issatschenkoi)、虾夷扇贝摄入太平洋亚历山大藻(Alexandrium pacificum)后, GTX5转化成为高毒性的STX(Pereira et al, 2004; Liu et al, 2020b; 包振民等, 2021)。无论在累积还是排出阶段, dcSTX在水体中占比均远远低于其在内脏团中占比, 而STX在水体中占比则显著高于内脏团, 水体中dcSTX和STX占比均与其在产毒藻中占比较接近。本试验内脏团主要包含了消化道(食道、胃、肠道等)、肝胰腺、肾等, 试验水体PST则主要来自贻贝肠道中粪便和少量产毒藻, 二者毒素组分占比差异表明dcSTX在肠道中占比较低, 可能主要存在于肝胰腺和肾中。已有研究表明, 肝胰腺和肾是PST累积的主要部位, 也是毒素代谢和转化最活跃的组织(Lassus et al, 1996; Lu et al, 2002)。
4 结论翡翠贻贝具有较强的毒素累积能力, 内脏团是PST累积的主要部位, PST含量与链状裸甲藻的密度呈显著正相关关系。当链状裸甲藻密度为1.0×106 cells/L时, 贻贝内脏团PST含量累积2 h已接近食用贝类毒素安全标准, 累积8 h超标。当产毒藻密度为5.0×105 cells/L时, 贻贝内脏团PST含量累积2 d超标, 累积8 d达到峰值(3 590.4±545.7) μg/kg。当自然海域发生赤潮时, 产毒藻会持续维持在高密度水平, 因此贻贝体内PST含量超标的累积用时会短于试验用时。贻贝对PST具有累积快排出慢的特点, 内脏团PST含量在排出16 d达标, 排出速率先快后慢。内脏团对PST的累积和排出速率显著高于闭壳肌和其他组织, 闭壳肌和其他组织则无显著差异。PST进入贻贝体内后发生了代谢转化, 贻贝可能将产毒藻中GTX3转化为GTX2, C2转化为C1, 部分C1转化为dcGTX2, 并将高毒的STX转化为较低毒的dcSTX。贻贝对dcSTX有较强的累积能力且排出能力较弱, 肝胰腺和肾可能是PST累积的主要部位。目前, 双壳贝类体内PST组分间的转化机制许多尚未明确, PST各组分间复杂的转化过程, 以及累积、转化、排出过程中的重要分子途径以及关键基因功能尚有待进一步研究和揭示。
致谢 福建省水产研究所的陈小红、杨芳、钱卓真、罗冬莲、陈财珍、王雪玲等参与了本试验, 谨致谢忱。
田华, 张晓红, 高春蕾, 等, 2010. 麻痹性贝毒在栉孔扇贝体内短期的累积与排出过程[J]. 海洋环境科学, 29(4): 521-524. DOI:10.3969/j.issn.1007-6336.2010.04.016 |
包振民, 孔令玲, 史姣霞, 等, 2021. 双壳贝类积累转化麻痹性贝毒的研究进展[J]. 中国海洋大学学报, 51(10): 1-11. |
朱明远, 邹迎麟, 吴荣军, 等, 2003. 栉孔扇贝体内麻痹性贝毒的累积与排出过程研究[J]. 海洋学报, 25(2): 75-83. DOI:10.3321/j.issn:0253-4193.2003.02.009 |
邴晓菲, 吴海燕, 王群, 等, 2017. 麻痹性贝类毒素在栉孔扇贝体内的代谢轮廓[J]. 中国水产科学, 24(3): 623-632. |
汪娜, 梁玉波, 宋涛, 等, 2013. 麻痹性贝毒在虾夷扇贝体内累积、转化和排出过程研究[J]. 海洋环境科学, 32(4): 565-569. |
张少娜, 孙耀, 宋云利, 等, 2004. 紫贻贝(Mytilus edulis)对4种重金属的生物富集动力学特性研究[J]. 海洋与湖沼, 35(5): 438-445. DOI:10.3321/j.issn:0029-814X.2004.05.007 |
张海涛, 吴海燕, 郑关超, 等, 2023. 链状亚历山大藻暴露下紫贻贝体内麻痹性贝毒蓄积转化规律[J]. 渔业科学进展, 44(1): 181-190. |
陈火荣, 2018. 2017年福建海域链状裸甲藻赤潮事件应急处置与思考[J]. 渔业研究, 40(4): 308-314. |
陈光, 2008. 塔玛亚历山大藻所产麻痹性贝毒(PSP)在菲律宾蛤仔体内的累积与排出[D]. 青岛: 国家海洋局第一海洋研究所: 44.
|
林卓如, 耿慧霞, 唐文娇, 等, 2022. 麻痹性贝毒在毛蚶体内的转化过程研究[J]. 海洋与湖沼, 53(5): 1131-1142. |
岳亚军, 张律, 曾丽兰, 2017. 高效液相色谱-串联质谱法测定双壳类水产品麻痹性贝类毒素[J]. 中国食品卫生杂志, 29(5): 571-576. |
胡蓉, 徐艳红, 张文, 等, 2012. N、P、Mn和Fe对链状裸甲藻生长和产毒的影响[J]. 海洋环境科学, 31(2): 167-172. |
郭皓, 2004. 中国近海赤潮生物图谱[M]. 北京: 海洋出版社, 63.
|
解万翠, 卞中园, 杨锡洪, 等, 2013. 微小亚历山大藻对近江牡蛎清滤率以及麻痹性贝类毒素(PSP)蓄积的影响[J]. 水产学报, 37(12): 1848-1853. |
颜天, 傅萌, 李钧, 等, 2001. 麻痹性贝毒PSP在紫贻贝体内的累积、转化与排出[J]. 海洋与湖沼, 32(4): 420-427. DOI:10.3321/j.issn:0029-814X.2001.04.011 |
ANDRES J K, YÑIGUEZ A T, MAISTER J M, et al, 2019. Paralytic shellfish toxin uptake, assimilation, depuration, and transformation in the Southeast Asian green-lipped mussel (Perna viridis)[J]. Toxins (Basel), 11(8): 468. DOI:10.3390/toxins11080468 |
BLANCO J, REYERO M I, FRANCO J, 2003. Kinetics of accumulation and transformation of paralytic shellfish toxins in the blue mussel Mytilus galloprovincialis[J]. Toxicon, 42(7): 777-784. DOI:10.1016/j.toxicon.2003.10.007 |
BRICELJ V M, SHUMWAY S E, 1998. Paralytic shellfish toxins in bivalve molluscs: occurrence, transfer kinetics, and biotransformation[J]. Reviews in Fisheries Science, 6(4): 315-383. DOI:10.1080/10641269891314294 |
CHEN C Y, CHOU H N, 2001. Accumulation and depuration of paralytic shellfish poisoning toxins by purple clam Hiatula rostrata Lighttoot[J]. Toxicon, 39(7): 1029-1034. DOI:10.1016/S0041-0101(00)00242-7 |
CHOI M C, YU P K N, HSIEH D P H, et al, 2006. Trophic transfer of paralytic shellfish toxins from clams (Ruditapes philippinarum) to gastropods (Nassarius festivus)[J]. Chemosphere, 64(10): 1642-1649. DOI:10.1016/j.chemosphere.2006.01.036 |
DE CARVALHO I L, PELERITO A, RIBEIRO I, et al, 2019. Paralytic shellfish poisoning due to ingestion of contaminated mussels: a 2018 case report in Caparica (Portugal)[J]. Toxicon: X, 4: 100017. DOI:10.1016/j.toxcx.2019.100017 |
ETHERIDGE S M, 2010. Paralytic shellfish poisoning: Seafood safety and human health perspectives[J]. Toxicon, 56(2): 108-122. DOI:10.1016/j.toxicon.2009.12.013 |
HOLMES M J, BOLCH C J S, GREEN D H, et al, 2002. Singapore isolates of the dinoflagellate Gymnodinium catenatum (Dinophyceae) produce a unique profile of paralytic shellfish poisoning toxins[J]. Journal of Phycology, 38(1): 96-106. DOI:10.1046/j.1529-8817.2002.01153.x |
LASSUS P, AMZIL Z, BARON R, et al, 2007. Modelling the accumulation of PSP toxins in Thau Lagoon oysters (Crassostrea gigas) from trials using mixed cultures of Alexandrium catenella and Thalassiosira weissflogii[J]. Aquatic Living Resources, 20(1): 59-67. DOI:10.1051/alr:2007016 |
LASSUS P, BARDOUIL M, LEDOUX M, et al, 1996. Role of the kidneys in bioaccumulation of paralytic toxins by scallop (Pecten maximus) tissues[J]. Journal of Natural Toxins, 5(1): 107-115. |
LASSUS P, FREMY J W, LEDOUX M, et al, 1989. Patterns of experimental contamination by Protogonyaulax tamarensis in some French commercial shellfish[J]. Toxicon, 27(12): 1313-1321. DOI:10.1016/0041-0101(89)90063-9 |
LIU L J, CHEN J H, HE X P, et al, 2020a. First determination of extracellular paralytic shellfish poisoning toxins in the culture medium of toxigenic dinoflagellates by HILIC–HRMS[J]. Ecotoxicology and Environmental Safety, 204: 111042. DOI:10.1016/j.ecoenv.2020.111042 |
LIU Y, KONG F Z, XUN X G, et al, 2020b. Biokinetics and biotransformation of paralytic shellfish toxins in different tissues of Yesso scallops, Patinopecten yessoensis[J]. Chemosphere, 261: 128063. DOI:10.1016/j.chemosphere.2020.128063 |
LU Y H, HWANG D F, 2002. Effects of toxic dinoflagellates and toxin biotransformation in bivalves[J]. Journal of Natural Toxins, 11(4): 315-322. |
MIZUTA M, YAMADA K, TAKATA K, et al, 1999. Differences of accumulation and elimination of paralytic shellfish poisons among oyster, mussel and scallop[J]. Food Hygiene and Safety Science, 40(1): 19-22. |
MURRAY S A, O'CONNOR W A, ALVIN A, et al, 2009. Differential accumulation of paralytic shellfish toxins from Alexandrium minutum in the pearl oyster, Pinctada imbricata[J]. Toxicon, 54(3): 217-223. |
NEGRI A P, BOLCH C J S, BLACKBUM S I, et al, 2001. Paralytic shellfish toxins in Gymnodinium catenatum strains from six countries. [C] // Harmful Algal Blooms 2000. Intergovernmental Oceanographic Commission of UNESCO 2001. United Nations Educational, Scientific, and Cultural Organization, 210-213. https://www.researchgate.net/publication/328890241.
|
OSHIMA Y, 1995. Chemical and enzymatic transformation of paralytic shellfish toxins in marine organisms [M] // LASSUS P, ARZUL G, ERARD E, et al. Harmful Marine Algal Blooms. Paris: Lavoisier Publ. : 475-480.
|
PEACOCK M B, GIBBLE C M, SENN D B, et al, 2018. Blurred lines: multiple freshwater and marine algal toxins at the land-sea interface of San Francisco Bay, California[J]. Harmful Algae, 73: 138-147. |
PEREIRA P, DIAS E, FRANCA S, et al, 2004. Accumulation and depuration of cyanobacterial paralytic shellfish toxins by the freshwater mussel Anodonta cygnea[J]. Aquatic Toxicology, 68(4): 339-350. |
SILVERT W L, CEMBELLA A D, 1995. Dynamic modelling of phycotoxin kinetics in the blue mussel, Mytilus edulis, with implications for other marine invertebrates[J]. Canadian journal of Fisheries and Aquatic Sciences, 52(3): 521-531. |
YAMAMOTO T, OH S J, KATAOKA Y, 2002. Effects of temperature, salinity and irradiance on the growth of the toxic dinoflagellate Gymnodinium catenatum (Dinophyceae) isolated from Hiroshima Bay, Japan[J]. Fisheries Science, 68(2): 356-363. |
YU K N, KWONG R W M, WANG W X, et al, 2007. Biokinetics of paralytic shellfish toxins in the green-lipped mussel, Perna viridis[J]. Marine Pollution Bulletin, 54(7): 1068-1071. |
 2023, Vol. 54
2023, Vol. 54

