中国海洋湖沼学会主办。
文章信息
- 刘炜鑫, 陈晓玲, 李蒙, 王君霞, 张绪涛, 黄骞, 李才文. 2023.
- LIU Wei-Xin, CHEN Xiao-Ling, LI Meng, WANG Jun-Xia, ZHANG Xu-Tao, HUANG Qian, LI Cai-Wen. 2023.
- 日照沿海养殖三疣梭子蟹血卵涡鞭虫流行病发生过程研究
- EPIDEMIC OUTBREAK OF HEMATODINIUM DISEASE IN CULTURED PORTUNUS TRITUBERCULATUS ALONG RIZHAO COAST
- 海洋与湖沼, 54(5): 1373-1382
- Oceanologia et Limnologia Sinica, 54(5): 1373-1382.
- http://dx.doi.org/10.11693/hyhz20230100006
文章历史
-
收稿日期:2023-01-09
收修改稿日期:2023-03-21
2. 日照市海洋与渔业研究院 山东日照 276826;
3. 崂山实验室海洋生态与环境科学功能实验室 山东青岛 266237;
4. 中国科学院大学 北京 100049;
5. 中国科学院海洋大科学研究中心 山东青岛 266071
2. Rizhao Ocean and Fishery Research Institute, Rizhao 276826, China;
3. Marine Ecology and Environmental Science Laboratory, Laoshan Laboratory, Qingdao 266237, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China;
5. Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China
三疣梭子蟹(Portunus trituberculatus)隶属于甲壳纲(Crustacea)、十足目(Decapoda)、梭子蟹科(Portunidae)、梭子蟹属(Portunus), 是我国沿海的重要养殖经济蟹类之一, 养殖区域主要涵盖江苏、山东半岛、浙江、福建、广东等沿海地区, 其2021年产量超过10万吨(农业农村部渔业渔政管理局等, 2022)。日照是山东省沿海地市三疣梭子蟹规模化养殖的重要区域, 已有20多年的养殖历史。2007年以来, 日照地区养殖三疣梭子蟹频繁发病发生大规模死亡事件; 病蟹个体主要表现为行动迟缓、溜边, 停止摄食, 逐渐消瘦, 体重下降; 病蟹肌肉呈现白浊、乳黄色病变, 打开病蟹壳后通常可见大量黄白色、乳白色液体, 伴随有空肠、空胃等情况, 据此当地养殖户将该病害称为“牙膏病”或“牛奶病”。夏季暴发期间, 养殖池塘中梭子蟹死亡率达到60%~80%, 给当地养殖户造成了严重经济损失。
血卵涡鞭虫(Hematodinium spp.)是一类主要感染海水甲壳类的致病性寄生甲藻(parasitic dinoflagellates), 在世界范围内感染40多种蟹、虾类, 其中包括美国兰蟹、挪威龙虾、帝王蟹、三疣梭子蟹、锯缘青蟹等多种重要经济物种(Small, 2012; Stentiford et al, 2015; Li et al, 2021)。该寄生甲藻主要寄生于海水甲壳类动物的血淋巴和组织血腔中; 感染后期, 寄生甲藻在宿主体内大量增殖, 导致宿主的心脏、肝胰腺、鳃等重要器官发生功能失调乃至丧失, 最终造成宿主死亡(Field et al, 1995; Taylor et al, 1996; Sheppard et al, 2003)。近年来, 在我国浙江舟山、广东汕头、山东青岛、河北黄骅等沿海地区的主要经济蟹类养殖区均报道发现了血卵涡鞭虫流行病发生, 且三疣梭子蟹(P. trituberculatus)、拟穴青蟹(Scylla paramamosain)、锯缘青蟹(Scylla serrata)和脊尾白对虾(Exopalaemon carinicauda)等我国主要经济甲壳动物均可被感染(许文军等, 2007a, 2007b; Li et al, 2008; Xu et al, 2010; 刘顺等, 2014; Wang et al, 2017)。近年来, 血卵涡鞭虫的流行区域和宿主种类持续增加, 已成为影响海水经济甲壳动物渔业养殖业可持续发展的新型流行性病原(Stentiford et al, 2005; Small, 2012; Li et al, 2021)。
课题组前期在日照地区采集的养殖梭子蟹样品中发现存在血卵涡鞭虫感染, 为进一步探究该区域夏季养殖三疣梭子蟹大规模死亡的原因和流行病发生过程, 本研究对日照沿海地区的主要梭子蟹养殖区域开展了系统的流行病学调查, 并对该区域内代表性养殖池塘进行了连续现场监测, 以解析该地区血卵涡鞭虫流行病发生的生态学过程, 为防控三疣梭子蟹血卵涡鞭虫流行病提供理论依据。
1 材料与方法 1.1 样品采集2020年8月, 在日照市主要三疣梭子蟹养殖区进行了血卵涡鞭虫感染情况调查, 自东港区两城镇和经济技术开发区的发病池塘分别采集了23和26只养殖三疣梭子蟹成蟹, 于湿润、低温、充氧条件下运回实验室, 后根据检测方法要求分别采集血淋巴、组织样品进行血卵涡鞭虫形态学观察及组织病理检测。
2021年5~9月, 在日照市两城镇一梭子蟹养殖池塘进行了血卵涡鞭虫流行病发生过程连续监测调查(每月1~2次), 分别采集60~100只养殖梭子蟹个体, 置于低温、潮湿泡沫盒中, 充氧后即刻运至实验室, 进行类似处理、采集相应样品; 同时在养殖池塘(设4个采样点)进行环境样品采集, 自水面以下0.5 m处用采水器采集2 L水样装于样品瓶中, 运至实验室进行下一步处理。
1.2 养殖池塘环境因子测定养殖池塘水体温度和盐度通过YSI水质分析仪(EC300, EcoSense, 中国)现场测定。
叶绿素a样品的处理与测定: 将现场采集的水样通过真空泵负压抽滤到Whatman GF/F滤膜上, 滤膜用铝箔包裹后于−80 ℃保存; 滤膜用90%丙酮萃取24 h后, 使用Trilogy荧光计(7200-000, Turner, 美国)测定上清液酸化前后的荧光值, 计算叶绿素a的质量浓度(中华人民共和国国家质量监督检验检疫总局等, 2008a)。
营养盐样品的处理与测定: 将现场采集的水样经0.45 μm孔径的滤膜过滤, 加入氯仿固定, 于−80 ℃保存; 使用营养盐连续流动分析仪(San Plus, Skalar, 荷兰)测定硝酸盐、亚硝酸盐、铵盐、硅酸盐和磷酸盐的质量浓度(中华人民共和国国家质量监督检验检疫总局等, 2008b)。
1.3 血卵涡鞭虫形态学观察及组织病理检测采用中性红染色血涂片法(Stentiford et al, 2005)对三疣梭子蟹中的血卵涡鞭虫感染情况进行形态学检测, 具体步骤如下: 采用一次性1 mL无菌注射器从梭子蟹第五步足的关节膜处抽取约200 μL血淋巴, 将1~2滴血淋巴液滴在载玻片上并与等体积的中性红溶液(质量体积比为0.04%, 过滤海水)混匀, 盖上盖玻片于显微镜(BX53, Olympus)下观察; 将剩余血淋巴加入到含有800 μL无水乙醇的1.5 mL离心管中固定, 于−20 ℃下保存, 用于DNA提取。参照Wang等(2017), 基于200×显微镜视野下观察到的血卵涡鞭虫数量, 将梭子蟹感染程度认定为轻度(< 10)、中度(10~100)、重度(> 100)感染状态。
将经血涂片法确认存在血卵涡鞭虫感染的三疣梭子蟹解剖, 采集肝胰腺、心脏、鳃、肌肉等组织, 置于波恩氏液进行固定, 48 h后转移到70%酒精中保存。参考Wheeler等(2007)的步骤处理固定的组织样品, 经系列脱水后进行H & E(hematoxylin & eosin)染色, 切片经盖片、封片后于显微镜下观察梭子蟹感染血卵涡鞭虫后的组织病理变化。
1.4 血卵涡鞭虫的分子生物学鉴定及遗传分析使用海洋动物组织基因组DNA提取试剂盒(TIANGEN, 天津)提取1.3采集的梭子蟹血淋巴样品的基因组DNA, 于−20 ℃保存, 以待后续检测使用。
采用血卵涡鞭虫ITS1序列的特异性引物(F: 5′CATTCACCGTGAACCTTAGCC3′; R: 5′CTAGTCAT ACGTTTGAAGAAAGCC3′)(Small et al, 2007)对梭子蟹中的血卵涡鞭虫感染情况进行分子PCR检测。PCR扩增反应体系为: 2× ApexHF FS PCR Master Mix(艾科瑞生物, 海南)10.0 μL, DNA模板1.0 μL, 上、下游引物(10 μM)各0.8 μL, 无菌水7.4 μL。扩增程序为: 94 ℃预变性5 min; 94 ℃变性30 s, 56 ℃退火30 s, 72 ℃延伸30 s, 进行30个循环; 72 ℃延伸10 min, 4 ℃保存。采用1.5%的琼脂糖凝胶对PCR扩增产物进行电泳检测分析。挑选阳性PCR产物进行琼脂糖凝胶电泳并切胶回收, 送上海生工生物工程股份有限公司纯化后进行TA克隆和Sanger测序。将获得的血卵涡鞭虫ITS1序列在NCBI网站进行BLAST分析, 并与GenBank中对应的代表性ITS1序列进行比对, 运用Mega 5.05软件基于最大似然法构建系统发育树。
1.5 环境水体中血卵涡鞭虫丰度的qRT-PCR检测将现场采集的环境水样(300 mL)通过真空泵负压抽滤到孔径为0.2 μm的聚碳酸酯膜上, 滤膜置于2 mL冻存管中, 经液氮速冻后, 置于−80 ℃保存, 以待后续检测使用。
使用Biomarker Soil Genomic Kit试剂盒(百迈客生物科技, 北京)提取100 mL环境水样的环境基因组DNA, 参照Li等(2010)的方法对水体中的血卵涡鞭虫进行qRT-PCR检测。将含有ITS1扩增子的质粒经梯度稀释为102~109 copies/μL, 进行qRT-PCR检测, 反应体系为: TB Green® Premix Ex Taq™ Ⅱ(TaKaRa, 日本) 10.0 μL, DNA模板1.0 μL, 上、下游引物(10 μmol/L)各0.8 μL, 无菌水7.4 μL, 反应条件为: 95 ℃, 30 s; 95 ℃, 5 s, 60 ℃, 30 s, 进行40个循环。所得扩增循环数(threshold cycle, CT)与每反应拷贝数的对数值通过线性回归拟合为标准曲线。将样品DNA进行qRT-PCR检测, 根据标准曲线计算得到每反应拷贝数的对数值, 根据单个血卵涡鞭虫细胞中有300个ITS1序列拷贝数(Li et al, 2010), 将拷贝数换算为血卵涡鞭虫细胞数, 估算环境水体中的血卵涡鞭虫丰度。
1.6 数据分析使用SPSS 23.0软件, 对不同时期水体中血卵涡鞭虫的丰度是否存在差异进行单因素方差分析(one-way ANOVA, P < 0.05), 并对梭子蟹感染率、水体中血卵涡鞭虫丰度和环境因子进行Pearson相关性分析。
2 结果与分析 2.1 日照地区血卵涡鞭虫株系的鉴定分析 2.1.1 血卵涡鞭虫形态学观察及组织病理检测对三疣梭子蟹进行中性红染色血淋巴涂片显微观察, 健康梭子蟹个体血淋巴涂片中的细胞均为未被中性红染色的宿主血细胞, 未见被中性红染色的血卵涡鞭虫细胞(图 1a)。染病梭子蟹个体的镜检结果显示, 除了未被中性红染色的血细胞外, 血淋巴中充斥着大量近似球形的类变形虫状滋养体, 其直径约为10~15 μm, 细胞内多个溶酶体吸收中性红染液而呈亮红色(图 1b)。
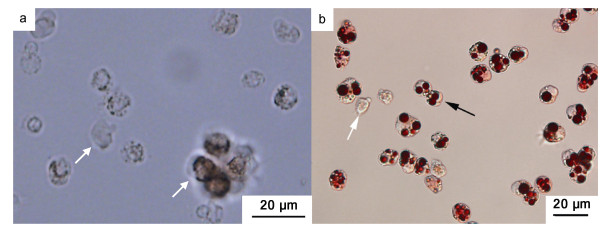 |
| 图 1 日照地区采集三疣梭子蟹血淋巴及其中血卵涡鞭虫滋养体的细胞形态 Fig. 1 Morphological observation of the H. perezi trophonts in hemopymph of crab P. trituberculatus 注: a. 健康梭子蟹血淋巴中的血细胞(白色箭头); b. 染病梭子蟹血淋巴中的血卵涡鞭虫(类变形虫滋养体, 黑色箭头)和血细胞(白色箭头) |
组织病理学观察显示, 染病梭子蟹个体的肝胰腺、心脏、肌肉、鳃等器官和组织中均发现存在血卵涡鞭虫感染(图 2)。大多数血卵涡鞭虫处于类变形虫滋养体阶段, 充斥在肝胰腺的肝小管间隙以及心肌和步足肌的肌束间隙中(图 2a, 2b, 2d), 鳃组织中也存在少量的血卵涡鞭虫细胞(图 2c)。染病梭子蟹个体肌肉组织中的肌束间隙明显增大, 肌丝断裂溶解, 相邻肌丝纤维互相分离; 肝胰腺的肝小管间隙和管腔增大, 结缔组织严重缺失, 肝小管纤毛柱状上皮结构发生溶解变性呈空泡状; 鳃组织中除鳃丝末端发生膨大外, 未见其他明显的组织病理变化。
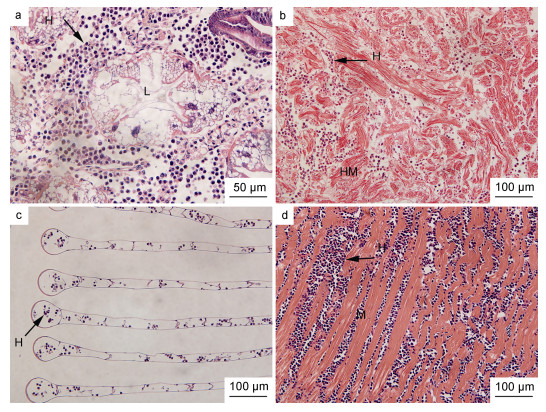 |
| 图 2 重度感染血卵涡鞭虫的三疣梭子蟹组织病理学观察 Fig. 2 Histopathological observation on the major tissues of crab P. trituberculatus that severely infected with Hematodinium perezi 注: H: 血卵涡鞭虫(类变形虫滋养体); L: 肝小管管腔; HM: 心肌; M: 肌肉。a. 肝小管管腔增大, 结缔组织被病原虫细胞取代; b. 心脏肌丝溶解变性, 肌束间隙增大, 分布有病原虫细胞; c. 鳃丝末端发生膨大; d. 步足肌肌丝断裂溶解, 肌束间隙充斥大量病原虫细胞 |
感染梭子蟹的心脏、肌肉、肝胰腺、鳃等多个重要组织器官中能够观察到血卵涡鞭虫的多种生活史阶段, 包括丝状滋养体(图 3a)、类变形虫滋养体(图 2a)、蛛网状滋养体(图 3b)、团块状聚合体(图 3c)、孢子前细胞和孢子(图 3d)。其中, 丝状滋养体主要出现在处于感染早期的病蟹血淋巴或组织中; 类变形虫滋养体是检测中常见的生活史阶段, 在感染早期和中期的病蟹血淋巴和组织器官中常被发现; 蛛网状滋养体、团块状聚合体是血卵涡鞭虫的主要增殖阶段, 主要出现于感染中、后期的病蟹组织中; 孢子前细胞、孢子是血卵涡鞭虫在宿主体内生活史发展的末尾阶段, 出现在感染晚期的病蟹组织中。
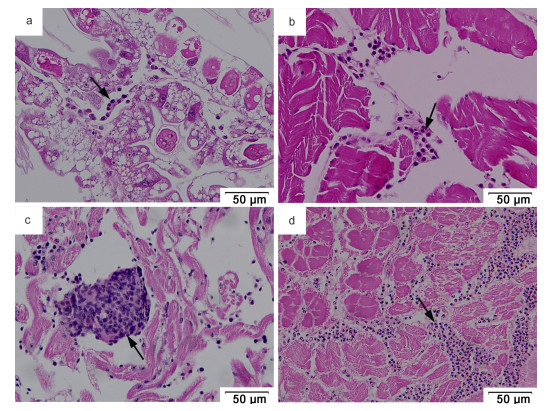 |
| 图 3 病蟹组织中血卵涡鞭虫的多个生活史阶段 Fig. 3 Various life stages of H. perezi in the tissues of infected P. trituberculatus 注: a. 病蟹肝胰腺中的丝状滋养体(箭头); b. 病蟹心脏中的蛛网状滋养体(箭头); c. 病蟹心脏中的团块状聚合体(箭头); d. 感染晚期病蟹肌肉中的孢子前细胞和孢子(箭头) |
通过分子克隆和测序方法, 分别从日照市2个梭子蟹养殖区(东港区两城镇和经济技术开发区)的感染梭子蟹样品中获得了长度约为~299 bp的特异性Hematodinium ITS1 rDNA序列, 并提交至GenBank数据库(序列号分别为ON668054、ON668055和ON668056)。NCBI数据库BLAST比对分析结果显示, 该序列与数据库中感染我国沿海甲壳类的H. perezi株系的ITS1序列相似性为98%~100%, 系统发育分析结果也表明本研究获得的ITS1序列与感染我国海水蟹类的血卵涡鞭虫ITS1序列聚为一枝(图 4), 同属于H. perezi基因Ⅱ型。
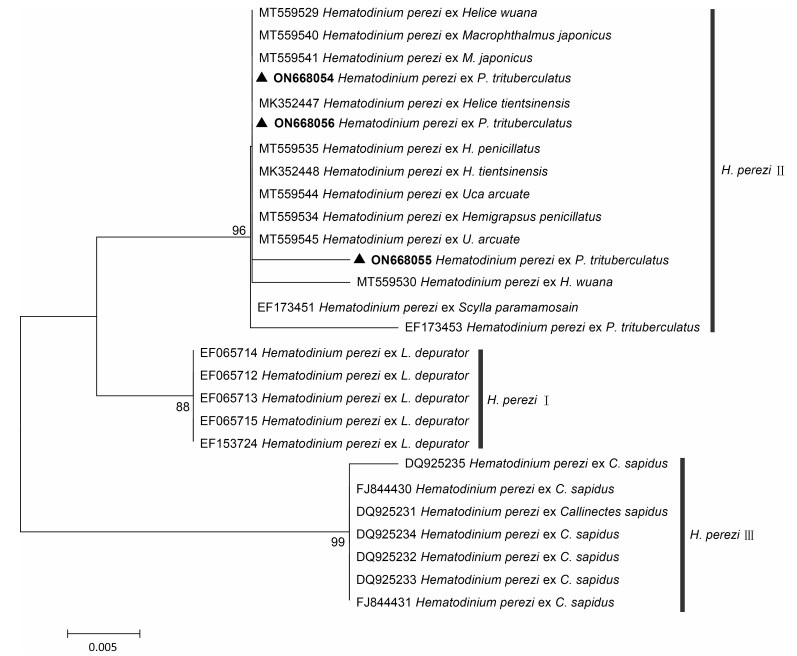 |
| 图 4 基于ITS1序列构建的日照地区养殖池塘中感染三疣梭子蟹的血卵涡鞭虫系统发育树 Fig. 4 Molecular phylogenetic analysis of H. perezi infected P. trituberculatus in Rizhaoarea based on Hematodinium ITS1 注: 图中加粗显示序列为本研究测序所得序列, 其他序列下载自NCBI GenBank数据库; 每个节点附近的数字表示ML树的自展支持率 |
2020年8月自日照市2个养殖区域(东港区两城镇和经济技术开发区)采集的三疣梭子蟹成体中的血卵涡鞭虫感染率分别为52.2%和42.3%, 其中多数为中、重度感染。
2021年5至9月, 我们对日照两城镇养殖池塘中梭子蟹的血卵涡鞭虫感染情况进行了连续定期采样检测, 统计分析养殖期间梭子蟹的感染率和感染程度(图 5)。结果显示, 5月在梭子蟹幼苗中未发现血卵涡鞭虫感染。6月梭子蟹血卵涡鞭虫感染率为24.5%, 其中轻度感染个体占比较高, 占感染宿主的60.9%。7月中旬, 梭子蟹感染率上升至50.7%, 感染宿主中轻度感染个体比例下降, 中、重度感染个体比例升高, 分别为47.2%、22.2%和30.6%。7月底, 梭子蟹感染率为47.0%, 轻度感染个体比例升高, 占感染宿主的59.0%。8月下旬, 梭子蟹感染率达到峰值, 为52.5%。感染宿主中, 轻度感染个体的比例出现下降, 由8月中旬的55.6%下降至18.8%; 而中度和重度感染个体的比例升高, 分别由25.9%和18.5%升至43.7%和37.5%, 中、重度感染个体比例高达81.2%。9月梭子蟹感染率下降至23.8%, 感染宿主中33.3%为轻度感染、6.7%为中度感染, 60.0%为重度感染。该养殖池塘中血卵涡鞭虫流行病高发期为7至8月, 其中8月下旬中、重度感染宿主占比最高。
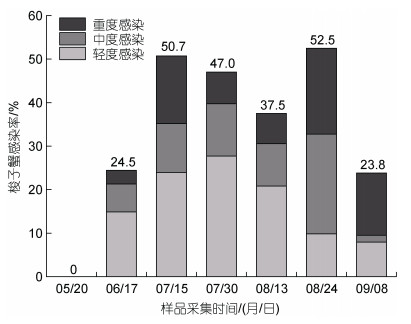 |
| 图 5 三疣梭子蟹血卵涡鞭虫感染的流行情况 Fig. 5 Prevalence of H. perezi infection in P. trituberculatus |
2021年5~11月, 在日照两城镇养殖池塘环境水体中检测到血卵涡鞭虫存在, 其丰度不同时间点有明显变化(图 6)。养殖池塘水体中血卵涡鞭虫的丰度在5至6月较高(血卵涡鞭虫细胞数量1 194~1 271 cells/L)与7月中旬、8月至11月有显著差异(P < 0.05); 后在7月中旬出现呈下降趋势, 到下旬再次出现峰值(676 cells/L), 随后8月中旬至11月中旬, 血卵涡鞭虫丰度在193~ 556 cells/L之间波动, 但无显著差异(P > 0.05)。进一步分析梭子蟹血卵涡鞭虫感染率变化与养殖池塘水体中血卵涡鞭虫丰度变化的关联性发现, 梭子蟹感染率的峰值出现在水体血卵涡鞭虫丰度高值期之后(图 6)。
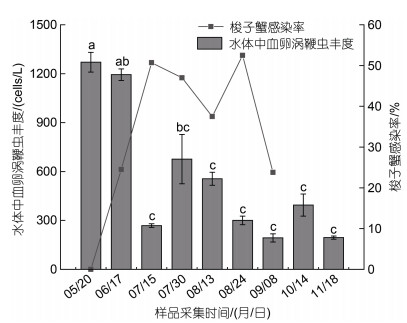 |
| 图 6 三疣梭子蟹血卵涡鞭虫感染率与水体中血卵涡鞭虫丰度的关联性 Fig. 6 Correlation between the prevalence of H. perezi and the abundance of H. perezi 注: 不同时期水体中血卵涡鞭虫丰度对比组间无相同字母符号者表示差异显著(P < 0.05) |
2021年5至11月调查期间, 日照市两城镇养殖池塘水体主要环境指标变化概述如下: 水温从5~6月开始升高, 到7~8月达到26.2~28.6 ℃, 随后开始降低。养殖水体盐度变化范围在20.7~29.6, 最大值为6月的29.6, 最小值为9月的20.7。叶绿素a浓度变化范围在2.2~13.3 μg/L, 在5月、8~10月维持在较高水平(8.0~13.3 μg/L), 峰值在8月。硝酸盐浓度变化范围在0.5~694.3 μg/L, 峰值出现在9月为694.3 μg/L。亚硝酸盐浓度变化范围在0~72.9 μg/L, 峰值出现在9月为72.9 μg/L。铵盐浓度变化范围在31.2~616.4 μg/L, 峰值出现在8月为616.4 μg/L。磷酸盐浓度变化范围在6.5~48.2 μg/L, 峰值出现在8月为48.2 μg/L。硅酸盐浓度变化范围在521.4~2 735.0 μg/L, 峰值出现在9月为2 735.0 μg/L。
养殖池塘梭子蟹感染率和各因子之间进行Pearson相关性分析, 结果显示梭子蟹血卵涡鞭虫感染率与温度极显著正相关(P < 0.01), 梭子蟹感染率与温度的变化趋势基本一致, 7月至8月, 养殖池塘水温较高时(> 25 ℃)发病率最高(图 7); 梭子蟹血卵涡鞭虫感染率与其他生物及环境因子无显著相关性(表 1)。养殖池塘水体中血卵涡鞭虫丰度和各因子之间的Pearson相关性分析结果显示, 水体中血卵涡鞭虫丰度与盐度显著正相关(P < 0.05), 两者变化趋势基本一致(图 8); 与亚硝酸盐、铵盐、磷酸盐呈显著负相关(P < 0.05); 而叶绿素a、硝酸盐、硅酸盐与环境水体中的血卵涡鞭虫丰度无显著相关性(表 1)。
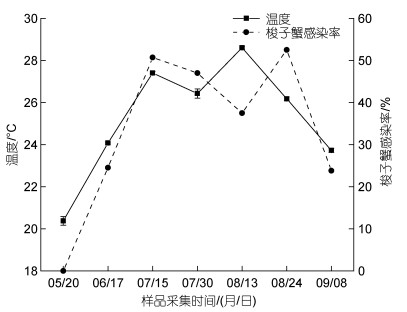 |
| 图 7 三疣梭子蟹血卵涡鞭虫感染率与水体温度的关联性 Fig. 7 Correlation between the prevalence of H. perezi and the temperature |
| T | S | chl a | NO3- | NO2- | NH4+ | PO43- | SiO32- | |
| 梭子蟹感染率 | 0.989** | −0.382 | −0.126 | 0.079 | 0.319 | 0.816 | 0.633 | −0.139 |
| 水体血卵涡鞭虫丰度 | −0.630 | 0.945* | −0.355 | −0.769 | −0.901* | −0.944* | −0.912* | −0.540 |
| 注: *表示相关显著(P < 0.05), **表示相关极显著(P < 0.01) | ||||||||
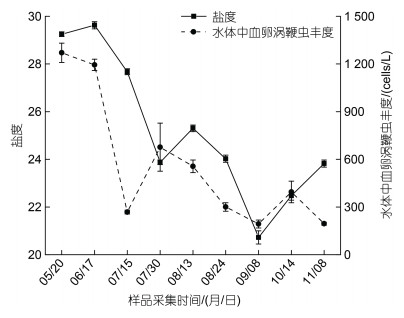 |
| 图 8 水体盐度与水体中血卵涡鞭虫丰度的关联性 Fig. 8 Correlation between the salinity and the abundance of H. perezi in water |
本研究首次在日照市沿海地区的养殖三疣梭子蟹中报道发现了海洋寄生甲藻血卵涡鞭虫感染。2020~2021年在日照沿海地区的主要养殖区采集的“牛奶病”症状梭子蟹的血淋巴和器官、组织中均发现了包括丝状滋养体、类变形虫滋养体、蛛网状滋养体、团块状聚合体、孢子前细胞和孢子等血卵涡鞭虫的多个生活史阶段。染病梭子蟹血淋巴中存在大量的血卵涡鞭虫细胞, 尚存在少量的血淋巴细胞; 病蟹肝胰腺的肝小管间隙和管腔增大, 充斥着大量的血卵涡鞭虫, 结缔组织严重缺失; 心脏肌肉组织中的肌束间隙明显增大, 肌丝断裂溶解, 血窦中存在着大量的血卵涡鞭虫。这些染病梭子蟹的主要器官和组织病理变化与我国沿海其他地区报道的血卵涡鞭虫感染导致宿主的组织病理变化类似(许文军等, 2007a, 2007b; 王金凤等, 2015; 王印庚等, 2017)。进一步的分子遗传学分析结果显示, 日照地区发现的血卵涡鞭虫株系与感染我国沿海蟹类的血卵涡鞭虫株系的序列相似性较高、亲缘关系较近, 属于我国沿海广泛分布的主要致病株系Hematodinium perezi基因Ⅱ型(Small et al, 2012; Xiao et al, 2016)。
该养殖区域血卵涡鞭虫流行病主要发生在6~9月, 其中7~8月为高峰期。养殖池塘中梭子蟹血卵涡鞭虫感染率峰值与水体中血卵涡鞭虫丰度变化呈现错峰交替现象, 间隔时间(约3~4周)基本与血卵涡鞭虫生活史发展周期一致(Messick et al, 2000; Li et al, 2011; Shields et al, 2015)。5~6月, 水体中血卵涡鞭虫的丰度处于高值; 6月, 在梭子蟹中检测到血卵涡鞭虫感染, 且轻度感染比例较高; 7月中旬, 梭子蟹感染率升高至50.7%, 半数以上为中、重度感染。7月中旬重度感染的个体数量较多, 而水体中血卵涡鞭虫的丰度在7月中旬至7月底期间升高; 表明血卵涡鞭虫已经在宿主体内完成生活史过程, 重度感染宿主将大量的血卵涡鞭虫孢子释放到环境水体中(Appleton et al, 1998; Li et al, 2010)。水体中的大量血卵涡鞭虫孢子又引发了新一轮感染, 7月底至8月中旬又出现大量轻、中度感染个体, 至8月下旬感染率再次达到峰值, 且多为重度感染个体。一般宿主从感染血卵涡鞭虫到重度感染或死亡的高峰期需经过一个月左右时间(Messick et al, 2000); 据此认为6月和7月中下旬为该区域血卵涡鞭虫传播扩散和梭子蟹大量感染的关键时期。
血卵涡鞭虫流行病的发生与水体温度和盐度变化密切相关。本研究发现, 梭子蟹血卵涡鞭虫感染率与温度极显著正相关(P < 0.01), 梭子蟹血卵涡鞭虫感染率在7~8月养殖池塘水温较高(26.2~28.6 ℃)时达到峰值。血卵涡鞭虫流行病发生具有季节性特征, 其发生受温度影响(Briggs et al, 2002; Shields et al, 2015; Huang et al, 2021)。在美国兰蟹中, 血卵涡鞭虫能够在20~24 ℃下迅速发展(Messick et al, 2000), 其流行的最适温度是25 ℃(Huchin-Mian et al, 2018)。分离自山东沿海的血卵涡鞭虫可以在15~25 ℃下在宿主体内正常发育, 且温度越高, 发展越快, 25 ℃时能迅速增殖发育(吕晓阳等, 2022)。因此, 认为是7~8月适宜的温度促进了养殖池塘血卵涡鞭虫流行病的爆发。本研究中, 水体中血卵涡鞭虫的丰度与盐度显著正相关(P < 0.05)。7月底至9月, 水体盐度较低(20.7~ 25.3), 大致呈降低趋势, 与水体中血卵涡鞭虫丰度变化趋势基本一致。血卵涡鞭虫孢子可以在20~35盐度的环境中存活3~7天(Li et al, 2011), 其生存最适盐度是30(Huchin-Mian et al, 2018), 其活性在10~20盐度中有明显降低(Coffey et al, 2012)。因此, 认为盐度降低抑制了水体中血卵涡鞭虫存活, 进而限制了血卵涡鞭虫传播扩散。
本研究在放苗期(5月)的三疣梭子蟹蟹苗(C2~C4期)中未发现阳性感染个体, 而在后续养殖过程中采集的梭子蟹成蟹中陆续发现了血卵涡鞭虫感染, 表明该区域养殖环境中存在血卵涡鞭虫的病原来源。此前研究也发现, 养殖池塘及周边环境中的野生宿主的是养殖梭子蟹血卵涡鞭虫流行病的重要病原来源(Huang et al, 2021), 孢子水体传播是养殖池塘内血卵涡鞭虫流行病传播扩散的主要途径(Shields et al, 2017; Huang et al, 2019, 2021)。本研究环境因子相关性分析显示, 水体中血卵涡鞭虫丰度与亚硝酸盐、铵盐、磷酸盐也呈显著负相关关系, 氮、磷营养盐的变化会影响环境微生物群落结构(Wei et al, 2016)。然而, 血卵涡鞭虫属于海洋寄生甲藻类群, 其生活史过程主要在甲壳动物宿主内完成, 在感染晚期释放游动孢子到环境水体中(Appleton et al, 1998; Li et al, 2010), 微生物群落结构的改变有可能对孢子的存活产生一定的影响。因此, 进一步明确养殖区域血卵涡鞭虫的病原来源, 揭示关键环境因子对于其流行病发生的影响机理是后续研究的重点, 可为养殖生产中有效防控该流行性提供理论依据和参考。
4 结论本研究首次报道发现了日照地区养殖三疣梭子蟹感染寄生甲藻血卵涡鞭虫及其流行病发生情况。该区域血卵涡鞭虫流行病主要发生在6~9月间, 7~8月为暴发期, 发病池塘中梭子蟹感染率超过50%。梭子蟹血卵涡鞭虫感染率变化与水体中血卵涡鞭虫丰度变化密切相关, 梭子蟹感染率峰值出现在水体血卵涡鞭虫丰度高值的3至4周之后。养殖池塘中血卵涡鞭虫流行病的发生与水体温度和盐度密切相关, 7~8月较高的水温(26.2~28.6 ℃)促进了血卵涡鞭虫在宿主体内快速增殖及流行病暴发, 而较低的盐度(20.7~25.3)可能抑制了水环境中血卵涡鞭虫的存活及其传播扩散。
致谢 感谢日照市春祥水产合作社及黄海水产研究所谢国驷博士在现场调查及实验过程中给予的帮助和支持。
王印庚, 杨洋, 张正, 等, 2017. 津冀地区养殖三疣梭子蟹大量死亡的病原和病理分析[J]. 中国水产科学, 24(3): 596-605. |
王金凤, 李才文, 李蒙, 等, 2015. 血卵涡鞭虫感染三疣梭子蟹的病原形态学及组织病理学变化[J]. 海洋与湖沼, 46(4): 748-757. |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会, 2008a. 海洋调查规范第6部分: 海洋生物调查: GB/T 12763.6-2007[S]. 北京: 中国标准出版社: 6-9.
|
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会, 2008b. 海洋调查规范第4部分: 海水化学要素调查: GB/T 12763.4-2007[S]. 北京: 中国标准出版社: 13-23.
|
吕晓阳, 黄骞, 李蒙, 等, 2022. 海洋寄生甲藻血卵涡鞭虫生活史及温度对其发展的影响[J]. 海洋与湖沼, 53(6): 1430-1440. |
刘顺, 戴瑜来, 周素明, 等, 2014. 拟穴青蟹(Scylla paramamosain)血卵涡鞭虫病的流行病学分析[J]. 海洋与湖沼, 45(3): 595-601. |
许文军, 施慧, 徐汉祥, 等, 2007a. 养殖梭子蟹血卵涡鞭虫感染的初步研究[J]. 水生生物学报, 31(5): 637-642. |
许文军, 绳秀珍, 徐汉祥, 等, 2007b. 血卵涡鞭虫在养殖锯缘青蟹中的寄生[J]. 中国海洋大学学报, 37(6): 916-920. |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会, 2022. 2022中国渔业统计年鉴[M]. 北京: 中国农业出版社, 22.
|
APPLETON P L, VICKERMAN K, 1998. In vitro cultivation and developmental cycle in culture of a parasitic dinoflagellate (Hematodinium sp.) associated with mortality of the Norway lobster (Nephrops norvegicus) in British waters[J]. Parasitology, 116(2): 115-130. DOI:10.1017/S0031182097002096 |
BRIGGS R P, MCALISKEY M, 2002. The prevalence of Hematodinium in Nephrops norvegicus from the western Irish Sea[J]. Journal of the Marine Biological Association of the United Kingdom, 82(3): 427-433. DOI:10.1017/S0025315402005684 |
COFFEY A H, LI C W, SHIELDS J D, 2012. The effect of salinity on experimental infections of a Hematodinium sp. in blue crabs, Callinectes sapidus[J]. Journal of parasitology, 98(3): 536-542. DOI:10.1645/GE-2971.1 |
FIELD R H, APPLETON P L, 1995. A Hematodinium-like dinoflagellate infection of the Norway lobster Nephrops norvegicus: observations on pathology and progression of infection[J]. Diseases of Aquatic Organisms, 22(2): 115-128. |
HUANG Q, LI M, WANG F, et al, 2019. The parasitic dinoflagellate Hematodinium perezi infecting mudflat crabs, Helice tientsinensis, in polyculture system in China[J]. Journal of Invertebrate Pathology, 166: 107229. DOI:10.1016/j.jip.2019.107229 |
HUANG Q, LI M, WANG F, et al, 2021. Transmission pattern of the parasitic dinoflagellate Hematodinium perezi in polyculture ponds of coastal China[J]. Aquaculture, 538: 736549. DOI:10.1016/j.aquaculture.2021.736549 |
HUCHIN-MIAN J P, SMALL H J, SHIELDS J D, 2018. The influence of temperature and salinity on mortality of recently recruited blue crabs, Callinectes sapidus, naturally infected with Hematodinium perezi (Dinoflagellata)[J]. Journal of Invertebrate Pathology, 152: 8-16. DOI:10.1016/j.jip.2018.01.003 |
LI C W, LI M, HUANG Q, 2021. The parasitic dinoflagellate Hematodinium infects marine crustaceans[J]. Marine Life Science & Technology, 3(3): 313-325. |
LI C W, MILLER T L, SMALL H J, et al, 2011. In vitro culture and developmental cycle of the parasitic dinoflagellate Hematodinium sp. from the blue crab Callinectes sapidus[J]. Parasitology, 138(14): 1924-1934. DOI:10.1017/S0031182011001405 |
LI C W, SHIELDS J D, MILLER T L, et al, 2010. Detection and quantification of the free-living stage of the parasitic dinoflagellate Hematodinium sp. in laboratory and environmental samples[J]. Harmful Algae, 9(5): 515-521. DOI:10.1016/j.hal.2010.04.001 |
LI Y Y, XIA X A, WU Q Y, et al, 2008. Infection with Hematodinium sp. in mud crabs Scylla serrata cultured in low salinity water in southern China[J]. Diseases of Aquatic Organisms, 82(2): 145-150. |
MESSICK G A, SHIELDS J D, 2000. Epizootiology of the parasitic dinoflagellate Hematodinium sp. in the American blue crab Callinectes sapidus[J]. Diseases of Aquatic Organisms, 43(2): 139-152. |
SHEPPARD M, WALKER A, FRISCHER M E, et al, 2003. Histopathology and prevalence of the parasitic dinoflagellate Hematodinium sp, in crabs (Callinectes sapidus, Callinectes similis, Neopanope sayi, Libiniae marginata, Menippemer cenaria) from a Georgia estuary[J]. Journal of Shellfish Research, 22(3): 873-880. |
SHIELDS J D, HUCHIN-MIAN J P, O'LEARY P A, et al, 2017. New insight into transmission dynamics of the crustacean pathogen Hematodinium perezi (Dinoflagellata) using a novel sentinel methodology[J]. Marine Ecology Progress Series, 573: 73-84. DOI:10.3354/meps12175 |
SHIELDS J D, SULLIVAN S E, SMALL H J, 2015. Overwintering of the parasitic dinoflagellate Hematodinium perezi in dredged blue crabs (Callinectes sapidus) from Wachapreague Creek, Virginia[J]. Journal of Invertebrate Pathology, 130: 124-132. DOI:10.1016/j.jip.2015.07.013 |
SMALL H J, 2012. Advances in our understanding of the global diversity and distribution of Hematodinium spp.-Significant pathogens of commercially exploited crustaceans[J]. Journal of Invertebrate Pathology, 110(2): 234-246. DOI:10.1016/j.jip.2012.03.012 |
SMALL H J, SHIELDS J D, HUDSON K L, et al, 2007. Molecular detection of Hematodinium sp. infecting the blue crab, Callinectes sapidus[J]. Journal of Shellfish Research, 26(1): 131-139. DOI:10.2983/0730-8000(2007)26[131:MDOHSI]2.0.CO;2 |
SMALL H J, SHIELDS J D, REECE K S, et al, 2012. Morphological and molecular characterization of Hematodinium perezi (Dinophyceae: Syndiniales), a Dinoflagellate parasite of the harbour crab, Liocarcinus depurator[J]. Journal of Eukaryotic Microbiology, 59(1): 54-66. DOI:10.1111/j.1550-7408.2011.00592.x |
STENTIFORD G D, NEIL D M, ALBALAT A, et al, 2015. The effect of parasitic infection by Hematodinium sp. on escape swimming and subsequent recovery in the Norway lobster, Nephrops norvegicus (L.)[J]. Journal of Crustacean Biology, 35(1): 1-10. DOI:10.1163/1937240X-00002296 |
STENTIFORD G D, SHIELDS J D, 2005. A review of the parasitic dinoflagellates Hematodinium species and Hematodinium-like infections in marine crustaceans[J]. Diseases of Aquatic Organisms, 66(1): 47-70. |
TAYLOR A C, FIELD R H, PARSLOW-WILLIAMS P J, 1996. The effects of Hematodinium sp.-infection on aspects of the respiratory physiology of the Norway lobster, Nephrops norvegicus (L.)[J]. Journal of Experimental Marine Biology and Ecology, 207(1/2): 217-228. |
WANG J F, LI M, XIAO J, et al, 2017. Hematodinium spp. infections in wild and cultured populations of marine crustaceans along the coast of China[J]. Diseases of Aquatic Organisms, 124(3): 181-191. DOI:10.3354/dao03119 |
WEI G S, LI M C, LI F G, et al, 2016. Distinct distribution patterns of prokaryotes between sediment and water in the Yellow River estuary[J]. Applied Microbiology and Biotechnology, 100(22): 9683-9697. DOI:10.1007/s00253-016-7802-3 |
WHEELER K, SHIELDS J D, TAYLOR D M, 2007. Pathology of Hematodinium infections in snow crabs (Chionoecetes opilio) from Newfoundland, Canada[J]. Journal of Invertebrate Pathology, 95(2): 93-100. DOI:10.1016/j.jip.2007.01.002 |
XIAO J, MIAO X X, LI C W, et al, 2016. Genetic variations of the parasitic dinoflagellate Hematodinium infecting cultured marine crustaceans in China[J]. Protist, 167(6): 597-609. DOI:10.1016/j.protis.2016.10.003 |
XU W J, XIE J J, SHI H, et al, 2010. Hematodinium infections in cultured ridgetail white prawns, Exopalaemon carinicauda, in eastern China[J]. Aquaculture, 300(1/2/3/4): 25-31. |
 2023, Vol. 54
2023, Vol. 54


