中国海洋湖沼学会主办。
文章信息
- 张玥, 李玉凤, 贾悦, 邱春琦, 王雨青, 黄琬淳, 刘红玉, 袁振威. 2023.
- ZHANG Yue, LI Yu-Feng, JIA Yue, QIU Chun-Qi, WANG Yu-Qing, HUANG Wan-Chun, LIU Hong-Yu, YUAN Zhen-Wei. 2023.
- 滨海湿地蟹类分布特征及其生境影响因子分析——以江苏省条子泥为例
- IMPACT FACTORS ON DISTRIBUTION AND HABITAT OF CRAB IN COASTAL WETLAND IN TIAOZINI, JIANGSU, CHINA
- 海洋与湖沼, 54(5): 1383-1394
- Oceanologia et Limnologia Sinica, 54(5): 1383-1394.
- http://dx.doi.org/10.11693/hyhz20221200339
文章历史
-
收稿日期:2022-12-23
收修改稿日期:2023-03-24
滨海湿地生态系统是地球上生产力、生物多样性和生态服务价值最高的生态系统之一, 也是对气候变化响应极为敏感、受人类强烈干扰的生态系统(郎赟超等, 2022)。潮滩作为滨海湿地生态系统的重要组成部分, 在维持海岸生态系统健康、抵御海岸自然灾害、蓝碳固存等方面发挥着重要作用。蟹类是潮滩重要生物类群, 也是潮滩生态系统“工程师”, 通过改变生物或非生物的物理状态, 直接或间接地对其他物种产生影响(Jones et al, 1994)。蟹类适应盐度范围较广并在潮间带营穴居生活, 通过修建和维持洞穴进行生物扰动, 还通过食草消耗大量植物影响盐沼生态系统(安鑫龙等, 2022)。同时, 蟹类的挖掘能够改变潮滩地形地貌特征, 构建凹凸不平的微地形地貌单元, 甚至改善土壤质地, 这对开展滨海湿地生态修复具有重要指示意义(邱冬冬等, 2018)。
2019年条子泥湿地作为中国黄(渤)海候鸟栖息地(第一期)核心区, 成为我国第14处世界自然遗产, 填补了我国滨海湿地类世界自然遗产空白。条子泥是全球最重要的滨海湿地生态系统之一, 也是东亚-澳大利西亚候鸟迁徙线上最为重要的越冬地和补给站。由于长期处于淤积环境, 在特殊的水文条件和历史变迁过程中, 条子泥逐渐形成现有的淤泥质潮滩, 区域内的潮滩沉积物主要为极细砂和粉砂(侯国伟等, 2019)。大规模淤泥质滩涂和良好的生态环境孕育了数百种底栖生物, 其中, 蟹类是湿地鸟类的重要食物来源, 研究条子泥蟹类数量与分布特征, 对于保护条子泥湿地鸟类及生物多样性具有重要意义。目前对于底栖动物分布影响因子的研究主要集中于水环境、沉积物等方面(王新艳等, 2019; 宋远柳等, 2023), 关于植被、地形等生境影响因子以及各生境因子对底栖动物的综合作用还需要进一步探究, 而随着互花米草在江苏滨海湿地的扩张, 其对底栖动物的影响不容忽视。因此, 本研究选择在江苏条子泥互花米草入侵区域开展野外调查, 探究影响滨海湿地蟹类数量分布的生境因子。
1 材料与方法 1.1 研究区概况条子泥位于江苏省盐城市东南角, 地处辐射沙脊群与江苏海岸的交汇带(如图 1所示)。研究区在条子泥南部潮沟发育地区, 位于32°43′~32°44′N, 120°56′~120°57′E。该区域属亚热带季风气候, 年均气温为14 ℃, 年均降水量1 000 mm。研究区面积约为8.07 hm2, 结合无人机遥感影像和野外调查发现, 植被主要由碱蓬群落和互花米草群落组成。条子泥垦区为新围垦区, 是2011年江苏盐城百万滩涂围垦计划的首期项目。随着土壤的脱盐及水文条件的改变, 植被也从无到有。目前, 由于条子泥湿地已停止围垦与开发, 滩涂植被群落保持自然演替状态(图 1)。
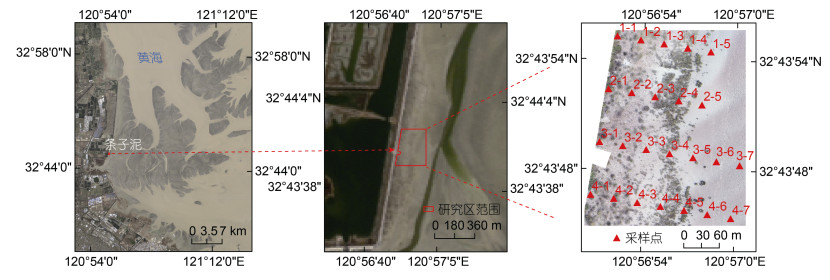 |
| 图 1 研究区及采样点位置 Fig. 1 The locations of the study area and sampling sites |
研究采用的是大疆精灵4RTK无人机, 配备1英寸2 000万像素互补金属氧化物半导体(complementary metal oxide semiconductor, CMOS)影像传感器, 获取红、绿、蓝真彩色JPEG格式影像。于2022年6月19日8:30~11:00对研究区进行拍摄, 在设定的100 m航高下影像空间分辨率为0.03 m。利用Pix4Dmapper 4软件对无人机拍摄影像进行拼接处理, 得到研究区可见光波段影像, 包含红光波段、绿光波段和蓝光波段。在此基础上, 使用eCognition软件对研究区覆被进行解译分类, 同时结合可见光波段差异植被指数(visible-band difference vegetation index, VDVI) (汪小钦等, 2015)计算植被覆盖度(fraction of vegetation coverage, FVC)。
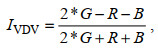 (1)
(1)其中, IVDV表示可见光波段差异植被指数, R为红光波段灰度值, G为绿光波段灰度值, B为蓝光波段灰度值。
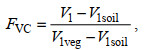 (2)
(2)其中, FVC为植被覆盖度; V1为像元的植被指数值; V1soil为裸土或无植被覆盖像元的植被指数值; V1veg为纯植被像元的植被指数值(凌成星等, 2021)。
1.3 地形水文数据获取及处理地形数据使用的是2022年江苏省沿海DEM (digital elevation model)数据, 影像空间分辨率为2 m, 同时结合野外调查获取的采样点高程数据, 利用DEM数据计算得到地表粗糙度[式(3)]; 在已知的相对高程数据基础上, 结合条子泥潮位数据, 推算研究区淹水时长。
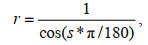 (3)
(3)其中, r表示某一特定区域的地表粗糙度, s指从DEM数据提取的坡度, π一般取值3.141 59 (李龙等, 2022)。
1.4 野外样品采集2022年6月19~20日开展野外样品采集, 野外样品采集主要包括蟹类样品采集、土壤样品采集和植物样品采集。蟹类样品采集依据《海洋调查规范第6部分: 海洋生物调查》(GB/T 12763.6—2007); 土壤样品采集和植物样品采集依据《海岸带生态系统现状调查与评估技术导则第4部分: 盐沼》(T/CAOE 20.4— 2020)执行。
由海向陆选取四条采样断面, 每个断面间隔40 m选取采样点(图 1)。在每个采样点设置0.5 m × 0.5 m的样方, 分别调查记录每个样方中蟹类洞穴的数量和开口直径, 同时采集样方中的植物, 地上生物量进行现场称重, 并装袋带回实验室进行生物量干重测定。在样点附近放置直径20 cm、深度21 cm的取样桶, 将其埋藏于土下25 cm左右, 使桶口低于地面, 用陷阱诱捕法(Li et al, 2014)获取约24 h样方附近的蟹类。获取的蟹类用样品袋装好, 并用浓度95%的酒精固定后带回实验室进行鉴定和生物量测定。最后, 挖取每个样方内约15 cm深的土壤带回实验室, 在60 ℃烘箱内烘干后测定土壤含水量、pH值、盐度等指标。土壤含水量利用土壤干重和湿重计算得出; 干土在研磨过筛后, 取10 g干土粉末加水(土壤与水的比例为1︰2.5), 振荡3 min并静置30 min后进行抽滤, 用pH检测仪对抽滤后的溶液pH值进行测定得到土壤pH值; 用土壤盐度测定仪对抽滤后的溶液盐度进行测定得到土壤盐度。
1.5 数据处理 1.5.1 相对多度和相对重要性指数计算利用相对多度和相对重要性指数分析蟹类群落特征。相对多度(relative abundance, NRA)可以对蟹类个体数目进行估测, 计算公式为
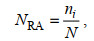 (4)
(4)式(4)中, ni为第i种蟹类的个体数; N为蟹类总个体数(童春富, 2012)。
相对重要性指数(index of relative importance, IRI)可以用来确定蟹类优势种, 其计算公式为
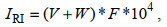 (5)
(5)式(5)中, IRI为相对重要性指数; V为某种蟹类的数量占蟹类总数量的百分比; W为某种蟹类的重量占蟹类总重量的百分比; F为某种蟹类出现的点位数占野外调查总样点数的百分比。IRI大于1 000的视为优势种, 100~1 000的视为常见种(孙儒泳等, 2002)。
1.5.2 相关性分析及冗余分析采用统计软件包(IBM SPSS Statistics 26)中Pearson相关系数进行蟹类数量分布与生境因子的相关性分析, 并进行双尾检验。经去趋势对应分析(decentred correspondence analysis, DCA), 排序轴最大梯度长度为0.87, 说明性状沿排序轴趋于线性分布, 因此采用冗余分析(redundancy analysis, RDA)对各生境因子相关性进行排序(骆蓓菁等, 2019), 将蟹类数量和蟹穴数量作为响应变量, 各生境因子作为解释变量, RDA分析在软件CANOCO 5.0中进行。
1.5.3 偏最小二乘结构方程模型分析偏最小二乘结构方程模型(partial least squares-structural equation model, PLS-SEM)结合主成分分析与多元回归进行迭代估计, 能够通过少量样本量反映事物结构特征及规律, 普适性高(Venturini et al, 2019)。一个完整的PLS-SEM模型由外模式(测量模型)与内模式(结构模型)组成, 外模型用于表达观测变量和潜变量之间的关系, 内模型用于表达外生潜变量和内生潜变量之间的关系。根据研究实际, 在smartPLS 4软件中构建PLS-SEM以探究蟹类特征、植被特征、土壤特征和水文微地形特征之间的相互作用关系。
2 研究结果 2.1 研究区蟹类特征及其分布 2.1.1 蟹类群落生物学特征野外采样捕获的蟹类主要属两科, 即沙蟹科和方蟹科, 其中, 沙蟹科包括弧边招潮蟹和日本大眼蟹两种, 方蟹科包括双齿近相手蟹、天津厚蟹和伍氏拟厚蟹三种。同一生长阶段的同种掘穴蟹类的大小基本一致, 经过测量, 双齿近相手蟹甲壳宽为1.51±0.4 cm (n=69, n表示数量), 平均蟹重为2.41 g; 弧边招潮蟹平均甲壳宽为2.5 cm (n=2), 平均蟹重为5.52 g; 伍氏拟厚蟹甲壳宽为1.11±0.59 cm (n=4), 平均蟹重为1.30 g; 天津厚蟹甲壳宽为1.77±0.40 cm (n=3), 平均蟹重为3.47 g; 日本大眼蟹甲壳宽为2.9 cm (n=1), 蟹重为8.65 g。
2.1.2 蟹类群落结构特征野外采样捕获的蟹类总数为79只, 在所有蟹类样品中, 双齿近相手蟹数量最多, 共有69只, 占螃蟹样品总数的87.34%。根据野外调查发现, 双齿近相手蟹出现的点位数最多, 日本大眼蟹出现的点位数最少。如图 2所示, 双齿近相手蟹相对重要性指数显著高于其他蟹类, 属于优势种, 而日本大眼蟹的相对重要性指数最小, 说明该蟹类在研究区内总数相对较少。
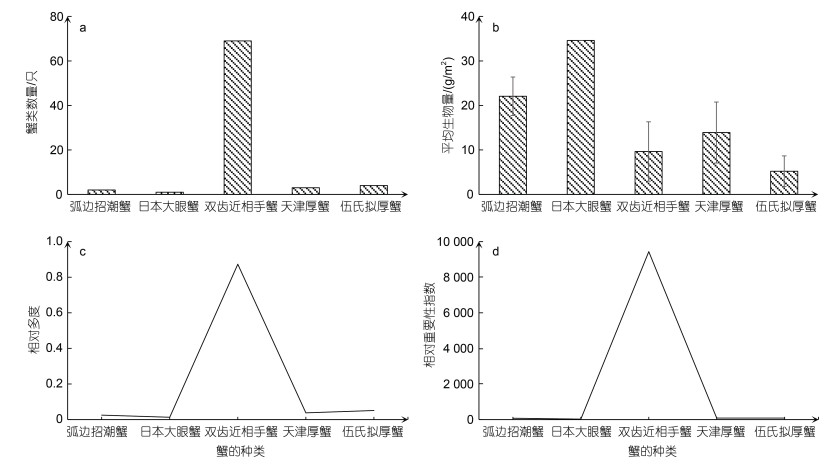 |
| 图 2 蟹类群落结构特征指标 Fig. 2 Indexes of crab community structure 注: a.不同品种蟹类数量; b.蟹类平均生物量; c.蟹类相对多度; d.蟹类相对重要性指数 |
从各样方的蟹类数量上看(图 3b), 由陆向海方向, 四条采样断面中蟹类数量最多的均为第一个样方, 其蟹类数量明显高于各采样断面的最后一个样方, 蟹类数量由陆向海整体呈现减少趋势。通过野外调查发现, 蟹类洞穴广泛分布于高潮线和低潮线之间的潮滩上, 蟹穴数量总体呈现由陆向海逐渐减少的趋势(图 3a), 洞穴孔径大小不一, 海水退潮留下的洞穴由陆向海方向孔径逐渐减小, 在靠海一侧含水量较大的光滩上, 蟹类数量稀少。
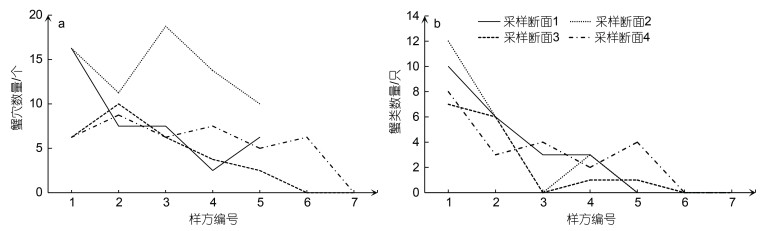 |
| 图 3 各样方蟹穴(a)数量及蟹类(b)数量对比 Fig. 3 Comparison in the number of crabs and crab holes in each quadrat |
生境特征主要从植被、土壤和水文地貌等方面展开研究: 植被因子包括地上生物量和植被覆盖度; 土壤因子包括土壤盐度、土壤pH和土壤含水量; 地形因子包括相对高程和地表粗糙度; 水文因子包括淹水时长, 即潮滩被潮水淹没的时长。
2.2.1 研究区植被类型及其分布特征研究区主要植被类型有互花米草和碱蓬, 互花米草面积约为15 751 m2, 碱蓬面积约为9 904 m2。如图 4a所示, 互花米草群落在研究区中部呈斑块状分布, 覆盖度较高; 碱蓬群落由互花米草群落左侧至内陆方向从零星分布转为斑块状分布; 在靠近海堤公路一侧互花米草群落和碱蓬群落交错分布。从地上生物量来看(图 4b), 碱蓬群落略高于互花米草群落; 从不同覆被类型的植被覆盖度看(图 4c), 互花米草群落的平均植被覆盖度为62.06%, 明显高于其他三种覆被类型。
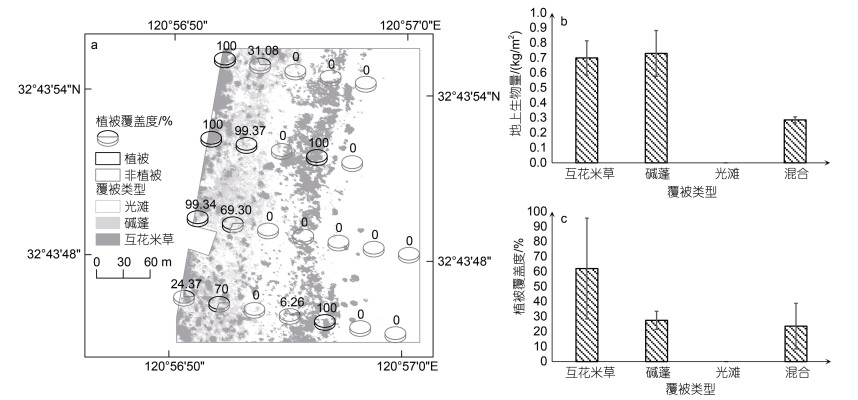 |
| 图 4 研究区覆被类型及植被特征 Fig. 4 Cover type and vegetation characteristics of the study area 注: a. 研究区覆被类型; b. 各覆被类型的地上生物量; c. 各覆被类型的植被覆盖度 |
如图 5所示, 土壤盐度、土壤pH值和土壤含水量在各采样断面上的变化存在差异。研究区土壤盐度的范围是1.6‰~4.5‰, 土壤盐度在采样断面1整体呈现逐渐减小的趋势, 在采样断面2波动变化, 采样断面3和采样断面4的土壤盐度总体呈现由陆向海波动增大的趋势, 其中, 采样点1-4的土壤盐度最小, 采样点1-1的土壤盐度最大; 土壤pH值在7.33~8.05, 在各采样断面上无明显变化规律, 其中, 采样点1-3和2-1的土壤pH值最大, 采样点1-1的土壤pH值最小; 研究区土壤含水量在24.58%~43.88%之间, 除采样断面1外, 土壤含水量在其余采样断面总体呈现由陆向海增加的趋势, 其中, 采样点3-7土壤含水量最大, 采样点3-1土壤含水量最小。
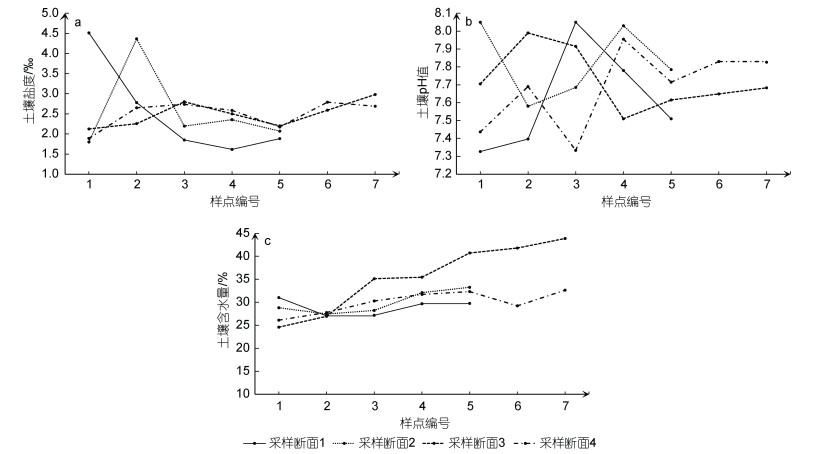 |
| 图 5 各样点土壤特征 Fig. 5 Soil characteristics of each sampling site 注: a. 土壤盐度; b. 土壤pH值; c. 土壤含水量 |
从图 6及图 7a中可以看出, 四条采样断面上的采样点相对高程均由海堤公路向海一侧逐渐减小。6月淹水时长由海向陆逐渐减小, 时长在1~5 h (包含5 h)的区域面积最大, 靠近海堤公路一侧的1号和2号样点的淹水时长为0 (图 7b)。从图 6的地表粗糙度分布上看, 研究区地表粗糙度空间差异不大, 潮沟处地表粗糙度明显高于周边区域, 采样点3-4的地表粗糙度最大(图 7c)。
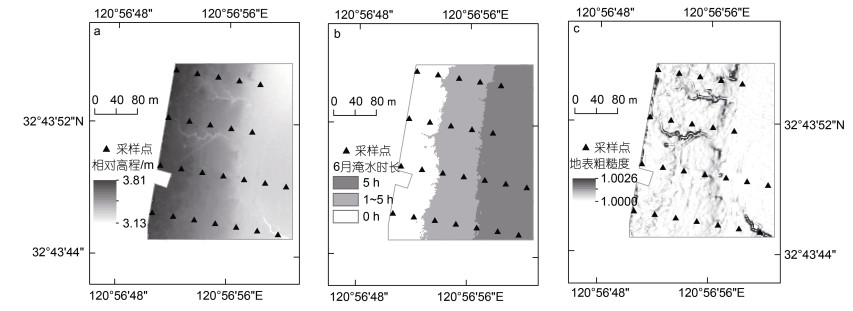 |
| 图 6 研究区水文微地形特征 Fig. 6 Hydrological and microtopographic characteristics of the study area |
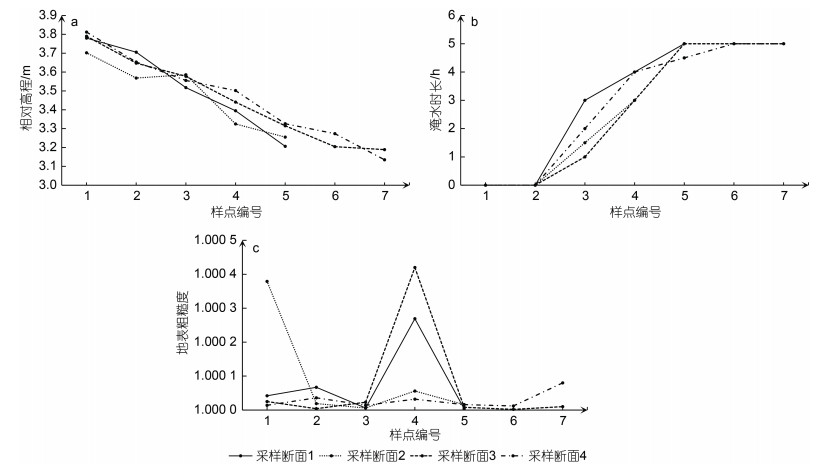 |
| 图 7 各样点水文微地形特征 Fig. 7 Hydrological and microtopographic characteristics of each sampling site |
结合研究区各样方野外调查情况发现, 蟹类的空间差异和生境之间存在一定的关系。在所有样方中, 有植被覆盖且有蟹类分布的样方有14个, 占样方总数的58%。蟹类选择在有植被覆盖的区域掘穴, 这与其生活习性相符合, 植被可以为在潮滩生活的掘穴蟹类提供隐蔽的场所以及食物。在互花米草或碱蓬植株的根部附近, 大多有蟹类洞穴的分布, 对比光滩上的蟹穴, 植物根部附近的蟹穴孔径更大。尤其在靠近海堤公路一侧的互花米草丛中, 蟹类洞穴分布密集, 洞穴孔径也较大。
不同覆被类型中的蟹类多度利用每一类型中的蟹类数量占蟹类总数的比例来反映(图 8a), 互花米草生境中的蟹类多度明显高于其他覆被类型。如图 8b所示, 不同种蟹类在各覆被类型中的分布特征也有明显差异。双齿近相手蟹在研究区的多度分布表现为互花米草区明显高于其他区域, 且在光滩区少有分布; 弧边招潮蟹的分布表现为聚集于互花米草-碱蓬混合区, 其余区域少有分布; 伍氏拟厚蟹广泛分布于碱蓬区, 在光滩区也有一定分布; 天津厚蟹多分布于互花米草区和互花米草-碱蓬混合区; 日本大眼蟹集中分布于光滩区。
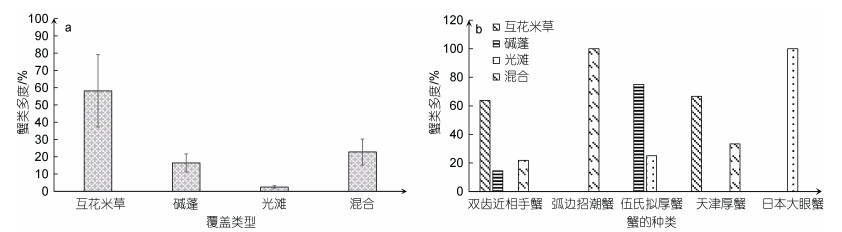 |
| 图 8 蟹类多度分布特征 Fig. 8 Distribution characteristics of crab abundance 注: a. 总体蟹类多度; b. 不同种蟹类多度 |
如表 1所示, 蟹类总数与土壤盐度、土壤pH值、土壤含水量和地表粗糙度无显著相关性(P > 0.05), 与地上生物量、植被覆盖度、相对高程以及淹水时长呈现极显著相关性(P < 0.01), 其中, 蟹类总数量与淹水时长呈负相关性。不同品种蟹类数量与各生境因子的相关性有所差异: 弧边招潮蟹数量与土壤盐度呈现显著的相关性(P < 0.05); 双齿近相手蟹数量与地上生物量、植被覆盖度、淹水时长及相对高程呈现极显著相关性(P < 0.01); 伍氏拟厚蟹数量与地表粗糙度呈现极显著相关性(P < 0.01); 日本大眼蟹和天津厚蟹数量与各生境因子无显著相关性(P > 0.05)。已有研究表明植被对这几种蟹类具有显著的影响(李欢欢等, 2007; 侯文昊等, 2019), 这也佐证了本研究中植被是影响蟹类分布的关键生境因子这一结论。
| 品种 | 土壤因子 | 植被因子 | 水文地貌因子 | |||||||
| 土壤盐度 | 土壤pH | 土壤含水量 | 地上生物量 | 植被覆盖度 | 相对高程 | 地表粗糙度 | 淹水时长 | |||
| 弧边招潮蟹 | 0.495* | −0.344 | −0.104 | −0.066 | −0.132 | 0.263 | −0.055 | −0.349 | ||
| 日本大眼蟹 | 0.007 | −0.214 | 0.349 | −0.205 | −0.147 | −0.294 | −0.108 | 0.368 | ||
| 双齿近相手蟹 | 0.255 | −0.210 | −0.067 | 0.745** | 0.620** | 0.804** | 0.233 | −0.715** | ||
| 天津厚蟹 | −0.001 | 0.333 | 0.104 | −0.072 | −0.186 | 0.045 | −0.108 | −0.005 | ||
| 伍氏拟厚蟹 | 0.100 | 0.191 | 0.332 | −0.205 | −0.186 | −0.107 | 0.720** | 0.165 | ||
| 蟹类总数量 | 0.314 | −0.202 | −0.020 | 0.726** | 0.580** | 0.833** | 0.260 | −0.734** | ||
| 注: **表示在0.01级别, 相关性显著; *表示在0.05级别, 相关性显著 | ||||||||||
RDA排序结果如图 9所示, 箭头长度代表环境因子与群落分布间相关程度的大小, 箭头越长, 相关性越大; 环境因子与蟹类数量、蟹穴数量的夹角反映二者之间的相关性, 夹角越小, 相关性越大。由此看出, 蟹类数量分布受相对高程的影响最大, 其次受地上生物量的影响较大, 同时蟹类数量与淹水时长呈现显著负相关性, 而蟹穴数量受植被覆盖度的影响最大。
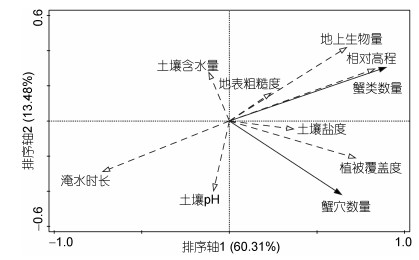 |
| 图 9 蟹类数量与蟹穴数量的生境影响因子RDA排序 Fig. 9 RDA of the habitat factors affecting the number of crabs and crab caves 注: 百分比表示对整体解释量的重要性 |
通过偏最小二乘结构方程模型(PLS-SEM)确定蟹类特征、植被特征、土壤特征和水文地貌特征之间的关系。椭圆框表示潜在变量, 矩形框表示观测变量, 潜在变量之间的实线箭头表示直接影响, 箭头粗细表示各变量的相对价值大小。椭圆框中的数字为R2, 即多重判定系数, R2在0.25~0.50之间说明模型的解释能力较弱, 在0.50~0.75之间解释能力适中(Campón-Cerro et al, 2015), R2数值越大, 模型的解释能力越强。为了提高模型拟合度, 在构建模型时将相关性较小的观测变量剔除。如图 10所示, 潜在变量蟹类特征的R2为0.849, 加之模型的标准化均方根残差(standardized root mean square residual, SRMR)为0.078, 小于0.08 (Hu et al, 1998), 表明模型拟合程度较好。观测变量与潜在变量之间的数字代表因子权重, 数值越大, 表明因子权重越高。两个潜在变量之间的数字代表路径系数, 数值越大, 表明变量之间的影响越大(李久林等, 2021)。水文微地形特征对蟹类特征的影响最大, 路径系数为−0.564, 为负向影响; 其次是植被特征, 路径系数为0.526, 为正向影响; 影响最小的是土壤特征, 路径系数为−0.068, 为负向影响。该模型显示了各要素对蟹类特征的影响效果, 也为更科学合理地制定保护条子泥生物多样性的措施提供参考。
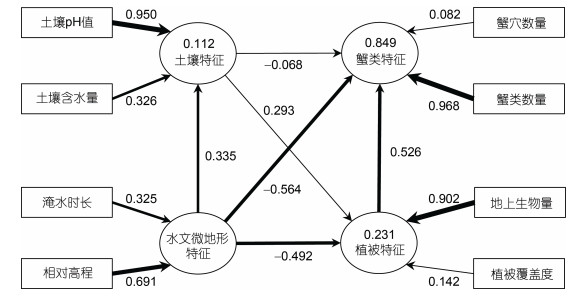 |
| 图 10 蟹类特征影响因子PLS-SEM模型 Fig. 10 The PLS-SEM model of influencing factors of crab characteristics 注: 图中数字表示因子权重及路径系数 |
生物和非生物共同组成蟹类的生活环境, 较多研究表明生境类型差异对蟹穴分布特征具有重要影响。以掘穴蟹类作为主要研究对象, 在江苏条子泥滨海湿地开展互花米草群落、碱蓬群落和光滩三种覆被类型以及蟹穴和蟹类数量分布特征的调查研究。在这三种典型覆被中, 蟹类的分布有所差异, 较多蟹类分布于互花米草区, 不同蟹类的生境偏好也有所不同。但野外获取的不同种蟹类样本量存在不均衡的状况, 相比于双齿近相手蟹, 其余四种蟹类样本量较少, 导致其包含的特征相对较少, 会影响不同种蟹类分布特征差异的显著性。野外调查中还发现, 潮滩上存在较多活跃的幼蟹个体, 已有研究表明蟹类幼体具有显著的日间垂直迁移现象(叶振江等, 2022), 但由于幼蟹活动范围较小且具有较高的警惕性, 难以用陷阱法对其数量进行准确量化(李翔等, 2021), 因此依靠野外数据推测蟹类数量以及蟹类的生境偏好存在一定的误差, 还需要更多数据来验证。
目前, 关于影响蟹类时空分布的因素研究主要从生物因子和非生物因子两方面展开。植被类型会影响蟹类分布, 植被通过其物理结构和生物学特性影响相关生物的丰富度和分布情况, 还可以为蟹类提供食物和躲避捕食者的场所, 同时植物的根系能为蟹类掘穴提供支撑, 但也有研究发现互花米草过密的根茎会阻碍蟹类在垂直和水平方向广泛挖掘洞穴(Wang et al, 2014)。非生物因子比如盐度、水分、光照和温度也是调节蟹类分布和存活的重要因素(孟寒玉, 2017), 沉积物特征对蟹类的分布也具有重要的影响, 有研究表明蟹类更喜欢具有高有机碳含量和相对较高湿度的泥质底层区域(Devi et al, 2021)。土壤理化性质可以直接影响生态系统的物质循环和能量流动过程, 影响植物的生长状况以及群落的演替(苏玉萍等, 2017), 进而对其他生物产生影响。潮滩土壤养分的转化, 会对植物的生长以及底栖动物的生存产生影响。此外, 蟹穴的分布和数量在一定程度上反映蟹类的分布和数量, 但蟹穴的利用率也是需要探究的问题, 通过野外调查发现, 部分样方蟹穴虽多, 但蟹类数量却少。有研究发现在局部和区域尺度上, 蟹穴占用率和蟹穴密度之间存在非线性关系, 当蟹穴密度达到20~30个/100 m2的时候, 蟹穴占用率随着蟹穴密度的增加而降低(Costa et al, 2021)。因此, 在以后的研究中还应进一步了解影响蟹类掘穴活动和蟹穴利用率的因素。
影响蟹类分布的因子主要包含生物因子和非生物因子, 但不同区域的研究结果也存在一定差异。王金庆(2008)和王琰等(2017)在长江口盐沼蟹类分布研究中发现, 植物群落类型、植株密度、植物地上生物量以及沉积物含水率、pH值和氧化还原电位等因子对蟹类分布的影响较大; 陈国贵等(2021)在福建漳江口的研究中发现, 温度、pH值、氧化还原电位及植被类型等对蟹类分布影响显著。不同区域独特的地理位置、气候、水文条件等造就不同的蟹类生境, 加之不同种蟹类对生境的选择也存在差异, 因此各区域内影响蟹类分布的生境因子不尽相同。与前人研究结果相比, 本研究也证实植被因子是影响蟹类分布的关键因子, 但关于非生物因子的影响还需要进一步探究。
3.2 人为活动及互花米草入侵对蟹类群落结构和分布特征的影响围垦是滨海湿地人为干扰的主要方式, 也是改变土壤盐度的重要途径, 已有研究表明盐度淡化是底栖动物群落变化最为关键的影响因素(Lv et al, 2014; Liu et al, 2018)。盐度的下降可能导致环境离子的含量降低, 而甲壳类底栖动物在进行外壳钙化过程中需要钙离子, 因此围垦导致的土壤盐度降低可能会对大型底栖动物造成不良影响。不少全封闭围垦区中, 甲壳类底栖动物已不复存在; 开放式围垦区水文连通性较好, 盐度下降趋势稍缓, 大型底栖动物生存环境相对稳定; 而潮滩在潮汐的影响下, 其盐度仍处于较高水平, 因此潮滩上大型底栖动物物种丰度、生物量和多样性指数相对较高(黄银盈, 2022)。围垦施工后会改变潮滩高程以及被围垦区域的潮汐动力作用, 导致底栖动物食物来源减少, 使其群落结构特征发生改变; 同时围垦工程加速滩涂促淤并改变沉积物特征, 导致部分原有底栖动物因不适应生境变化而消失, 同时也会出现新物种(涂琦乐等, 2015)。
研究中发现互花米草带附近的蟹类明显多于其他区域, 这与丁宏印等(2010)的研究结果相符。互花米草已成为江苏滨海湿地生态系统植被的优势种, 其入侵导致盐沼湿地理化环境的改变, 从而对底栖生物产生影响。沈永明等(2013)研究发现, 江苏东台盐沼湿地大型底栖动物分布与互花米草生长状况有关。隋皓辰等(2019)在黄河三角洲潮间带盐沼湿地的研究中发现, 海草和互花米草共存生境增加了甲壳类底栖动物的密度和生物量, 但降低了多毛类底栖动物的密度和生物量以及软体类底栖动物的生物量。赵彩云等(2015)研究发现, 互花米草入侵广西北海光滩后增加了大型底栖动物的物种数。此外, 有研究表明互花米草入侵时间不同, 其对大型底栖动物群落的影响也不尽相同。仇乐等(2010)在江苏射阳河口调查发现, 新生互花米草斑块增加了大型底栖动物的物种数量和丰富度, 但随着互花米草入侵时间的增加, 大型底栖动物的物种数量和多样性均下降。谢志发等(2008)的研究表明随着互花米草盐沼发育时间的推移, 崇明东滩大型底栖动物群落的物种丰富度和多样性会随着整个盐沼生态系统的稳定而逐渐上升。这说明互花米草盐沼对底栖动物的影响存在时空差异, 且其发育程度不同, 对底栖动物群落产生的影响也不同。
3.3 蟹类等大型底栖动物对滨海湿地生态系统的作用大型底栖动物调查是滨海湿地生物多样性监测的重要环节(谷宣等, 2022), 大型底栖动物是湿地生态系统能量流动和物质循环的关键组成部分, 它们取食贝类、浮游生物和有机碎屑等, 同时又是湿地鸟类等的食物来源(牛威震等, 2022), 在湿地食物链中起着承上启下的作用。
蟹类的取食或者掘穴活动会影响表层土壤的有机质稳定性和碳氮分解, 进而影响植物生物量, 对植物群落造成扰动(罗康宁等, 2021)。蟹类在掘穴时搬运土团的活动还会增加潮滩小尺度地貌的粗糙度, 加上潮汐作用, 共同对潮滩微地形起到一定的改造作用(陈雪等, 2021)。此外, 蟹类的生物扰动能改变沉积物的物理化学性质, 比如增加沉积物含水量、促进沉积物中多种营养盐向水体的转移等(陈友媛等, 2007; 龚紫娟等, 2022), 有研究表明蟹穴的存在极大地促进了沉积物与水体的氮交换(Li et al, 2021)。同时, 蟹类的生物扰动还可以改变土壤微生物群落结构和功能, 并通过有机质降解这一关键生态系统过程实现土壤营养物质循环(Wu et al, 2021)。
以大型底栖动物为主的滨海湿地生物及其生活的环境共同组成了滨海湿地生态系统, 二者相互影响、相互作用, 共同维持滨海湿地生态系统的平衡与稳定。因此, 保护和合理开发利用底栖动物资源对实现滨海湿地可持续发展和保护生态系统多样性具有重要意义。本研究选取的影响因子可能存在一定的局限性, 还需要结合更多野外数据和实验数据进行更全面的分析, 进一步探究生物因子和非生物因子对蟹类分布的影响, 更好地为条子泥湿地生态系统保护和生物多样性维持提供科学指导。
4 结论蟹类分布特征具有明显的空间差异, 在靠近海堤公路一侧的互花米草丛中, 蟹类分布密度较大, 这种空间分布差异主要是生境差异所致。从各生境因子对蟹类特征的影响程度上看, 植被因子和水文地貌因子对蟹类数量分布的影响较大。蟹类种类不同, 对于生境的选择也有所不同, 如研究区内优势蟹种双齿近相手蟹偏好有互花米草分布的生境, 而生境是复杂多变的, 这也会导致蟹类数量分布在不同时空的变化。
丁宏印, 章飞军, 邱树萍, 等, 2010. 秀山岛潮间带蟹类组成与分布[J]. 海洋湖沼通报, (2): 49-53. |
王金庆, 2008. 长江口盐沼优势蟹类的生境选择与生态系统工程师效应[D]. 上海: 复旦大学: 8-18.
|
王琰, 童春富, 2017. 长江口芦苇和互花米草盐沼湿地蟹类洞穴分布特征及主要影响因子[J]. 生态学报, 37(16): 5504-5513. |
王新艳, 闫家国, 白军红, 等, 2019. 黄河口滨海湿地水文连通对大型底栖动物生物连通的影响[J]. 自然资源学报, 34(12): 2544-2553. |
牛威震, 韩磊, 俞存根, 等, 2022. 舟山群岛东侧海域蟹类群落结构及其与环境因子的关系[J]. 海洋学报, 44(2): 29-38. |
仇乐, 刘金娥, 陈建琴, 等, 2010. 互花米草扩张对江苏海滨湿地大型底栖动物的影响[J]. 海洋科学, 34(8): 50-55. |
叶振江, 彭玉强, 何天庆, 等, 2022. 黄海近岸潮汐锋海域蟹类幼体日间垂直迁移特征[J]. 中国海洋大学学报, 52(9): 35-42. |
安鑫龙, 顾继光, 黄凌风, 等, 2022. "海洋生态系统工程师"及其生态作用[J]. 应用生态学报, 33(11): 3159-3168. |
孙儒泳, 李庆芬, 牛翠娟, 等, 2002. 基础生态学[M]. 北京: 高等教育出版社, 141.
|
苏玉萍, 李赫龙, 钟燕平, 等, 2017. 不同形态磷对沉积物-水界面浮游植物增殖及群落结构演替的影响[J]. 环境科学学报, 37(5): 1641-1648. |
李久林, 储金龙, 李瑶, 2021. 基于偏最小二乘法结构方程模型的传统村落振兴路径研究——以古徽州地区为例[J]. 小城镇建设, 39(7): 16-24. |
李龙, 秦富仓, 钱秋颖, 等, 2022. 砒砂岩区水力侵蚀下坡面微地貌变化特征及过程研究[J]. 土壤, 54(1): 198-205. |
李欢欢, 鲍毅新, 胡知渊, 等, 2007. 夏季杭州湾南岸不同生境伍氏厚蟹种群特征及回归关系[J]. 浙江师范大学学报(自然科学版), 88(4): 460-466. |
李翔, 田慧敏, 吴靖颖, 等, 2021. 奉贤滨海湿地蟹类和蟹洞的分布特征及影响因子[J]. 华东师范大学学报(自然科学版), (2): 160-170. |
邱冬冬, 路峰, 闫家国, 等, 2018. 滨海湿地生态系统工程师对潮间带土壤环境的影响机制[J]. 北京师范大学学报(自然科学版), 54(1): 9-16. |
谷宣, 陈国贵, 王文卿, 等, 2022. 相机陷阱法在潮间带底栖蟹类群落生态学中的应用研究[J]. 生态学报, 42(7): 2974-2983. |
汪小钦, 王苗苗, 王绍强, 等, 2015. 基于可见光波段无人机遥感的植被信息提取[J]. 农业工程学报, 31(5): 152-159. |
沈永明, 王艳芳, 陈寿军, 等, 2013. 互花米草盐沼湿地大型底栖动物时空分布特征[J]. 地理研究, 32(4): 638-644. |
宋远柳, 刘晓收, 2023. 夏、秋季南黄海小型底栖动物空间分布格局及其环境影响因素[J]. 海洋学报, 45(1): 38-52. |
陈友媛, 刘道彬, 贾永刚, 等, 2007. 生物活动对黄河口潮滩表层沉积物扰动作用的研究[J]. 中国海洋大学学报, 37(5): 829-833. |
陈国贵, 王文卿, 谷宣, 等, 2021. 漳江口红树植物群落周转对大型底栖动物群落结构的影响[J]. 生态学报, 41(11): 4310-4317. |
陈雪, 贺强, 辛沛, 等, 2021. 河口海岸潮滩蟹类生物扰动行为过程研究进展[J]. 海洋科学, 45(10): 113-122. |
罗康宁, 廖安邦, 肖孟阳, 等, 2021. 滩涂湿地蟹类活动对表层土壤的扰动效应[J]. 生态科学, 40(6): 83-88. |
郎赟超, 丁虎, 韩晓昆, 等, 2022. 地球系统科学观下的滨海湿地生态系统保护和恢复科学[J]. 中国科学基金, 36(3): 376-382. |
孟寒玉, 2017. 互花米草入侵下漳江口红树林区两种蟹类分布与生境选择研究[J]. 厦门: 厦门大学: 5: 40. |
赵彩云, 白加德, 柳晓燕, 等, 2015. 互花米草入侵对广西北海光滩大型底栖动物群落的影响[J]. 环境科学研究, 28(3): 377-383. |
侯文昊, 卢伟志, 赵开远, 等, 2019. 辽河口红海滩天津厚蟹种群时空分布特征研究[J]. 海洋环境科学, 38(2): 272-277. |
侯国伟, 张志垚, 陈哲, 等, 2019. 江苏北部条子泥潮滩波痕沉积物粒度特征[J]. 长江大学学报(自然科学版), 16(7): 9-14. |
骆蓓菁, 李翔, 罗鼎晖, 等, 2019. 天津厚蟹与褶痕相手蟹对杭州湾北岸典型盐沼植物的摄食偏好[J]. 华东师范大学学报(自然科学版), (6): 123-131. |
凌成星, 刘华, 纪平, 等, 2021. 基于无人机影像VDVI指数的植被覆盖度估算——以陕西神木防护林工程研究区为例[J]. 森林工程, 37(2): 57-66. |
涂琦乐, 刘晓东, 华祖林, 等, 2015. 条子泥围垦工程对近海生态环境的影响[J]. 河海大学学报(自然科学版), 43(6): 542-547. |
黄银盈, 2022. 不同围垦方式对南汇和崇明东滩湿地大型底栖动物的影响[D]. 上海: 华东师范大学: 90-92.
|
龚紫娟, 张青田, 2022. 生物扰动影响沉积物理化特征的研究进展[J]. 海洋湖沼通报, 44(2): 166-172. |
隋皓辰, 闫家国, 崔保山, 等, 2019. 互花米草与海草床的共生效应对盐沼湿地底栖动物群落的影响[J]. 环境生态学, 1(8): 21-27. |
童春富, 2012. 长江河口潮间带盐沼植被分布区及邻近光滩鱼类组成特征[J]. 生态学报, 32(20): 6501-6510. |
谢志发, 何文珊, 刘文亮, 等, 2008. 不同发育时间的互花米草盐沼对大型底栖动物群落的影响[J]. 生态学杂志, 27(1): 63-67. |
CAMPÓN-CERRO A M, BAPTISTA ALVES H M, HERNÁNDEZ-MOGOLLÓN J M, 2015. Attachment as a factor in generating satisfaction with, and loyalty to, rural tourism destinations[J]. Tourism & Management Studies, 11(1): 70-76. |
COSTA L L, SOARES-GOMES A, ZALMON I R, 2021. Burrow occupation rates and spatial distribution within habitat of the ghost crab Ocypode quadrata (Fabricius, 1787): implications for impact assessments[J]. Regional Studies in Marine Science, 44: 101699. |
DEVI P L, JOSEPH A, KORATH A, 2021. Habitat ecology and substratum preference of brachyuran crabs of a tropical estuary, south-west coast of India[J]. Regional Studies in Marine Science, 44: 101709. |
HU L T, BENTLER P M, 1998. Fit indices in covariance structure modeling: sensitivity to underparameterized model misspecification[J]. Psychological Methods, 3(4): 424-453. |
JONES C G, LAWTON J H, SHACHAK M, 1994. Organisms as ecosystem engineers[J]. Oikos, 69(3): 373-386. |
LI J L, HUA G F, LIU S Q, et al, 2021. Effects of crab disturbance on nitrogen migration and transformation in a coastal tidal flat wetland[J]. Environmental Science and Pollution Research, 28(37): 52345-52356. |
LI Z J, WANG W Q, ZHANG Y H, 2014. Recruitment and herbivory affect spread of invasive Spartina alterniflora in China[J]. Ecology, 95(7): 1972-1980. |
LIU Z Q, CHEN M H, LI Y M, et al, 2018. Different effects of reclamation methods on macrobenthos community structure in the Yangtze Estuary, China[J]. Marine Pollution Bulletin, 127: 429-436. |
LV W W, MA C A, HUANG Y H, et al, 2014. Macrobenthic diversity in protected, disturbed, and newly formed intertidal wetlands of a subtropical estuary in China[J]. Marine Pollution Bulletin, 89(1/2): 259-266. |
VENTURINI S, MEHMETOGLU M, 2019. Plssem: a stata package for structural equation modeling with partial least squares[J]. Journal of Statistical Software, 88(8): 1-35. |
WANG M, GAO X Q, WANG W Q, 2014. Differences in burrow morphology of crabs between Spartina alterniflora marsh and mangrove habitats[J]. Ecological Engineering, 69: 213-219. |
Wu C J, Wu H T, Liu D D, et al, 2021. Crab bioturbation significantly alters sediment microbial composition and function in an intertidal marsh[J]. Estuarine, Coastal and Shelf Science, 249: 107116. |
 2023, Vol. 54
2023, Vol. 54


