
中国海洋湖沼学会主办。
文章信息
- 纪凯, 黄天晴, 谷伟, 刘恩慧, 王高超, 王炳谦, 郭福元, 曹学彬, 郑龙华, 董福霖, 徐革锋. 2023.
- JI Kai, HUANG Tian-Qing, GU Wei, LIU En-Hui, WANG Gao-Chao, WANG Bing-Qian, GUO Fu-Yuan, CAO Xue-Bin, ZHENG Long-Hua, DONG Fu-Lin, XU Ge-Feng. 2023.
- 温度和盐度对虹鳟(Oncorhynchus mykiss)“水科1号”生长、消化酶活性和相关基因表达的影响
- EFFECTS OF TEMPERATURE AND SALINITY ON GROWTH, INTESTINAL DIGESTIVE ENZYME ACTIVITY, AND GENE EXPRESSION IN TISSUES OF RAINBOW TROUT (ONCORHYNCHUS MYKISS)
- 海洋与湖沼, 54(5): 1476-1487
- Oceanologia et Limnologia Sinica, 54(5): 1476-1487.
- http://dx.doi.org/10.11693/hyhz20221200345
文章历史
-
收稿日期:2022-12-31
收修改稿日期:2023-02-28
2. 上海海洋大学水产与生命学院 上海 201306;
3. 烟台经海海洋渔业有限公司 山东烟台 264006
2. College of Fisheries and Life, Shanghai Ocean University, Shanghai 201306, China;
3. Yantai Jinghai Marine Fishery Co. Ltd., Yantai 264006, China
鲑鳟是世界第三大水产养殖品种, 据联合国粮农组织统计, 2019年全球产量超过350万吨(FAO, 2021)。中国渔业统计年鉴资料显示, 2021年我国鲑鳟总产量不足4万t, 同时相较于2020年总产量约减少2.89%。鲑鳟因其肉质鲜嫩可口而深受国内外的消费者喜爱, 对其的需求量也因此逐年增加, 而我国虹鳟产量远不能满足国内市场的需求, 仍需从国外大量进口(户国等, 2017)。我国淡水养殖的鲑鳟品种主要以虹鳟(Oncorhynchus mykiss)为主, 虹鳟属于鲑形目鲑科的一种广盐性鱼类, 是我国广泛养殖的冷水鱼品种, 适宜生长的温度为12~18 ℃ (孙大江等, 2010)。受到我国淡水资源日趋紧张及虹鳟生活习性的制约, 海水养殖虹鳟成为扩大我国鲑鳟产量, 解决市场供不应求的一种养殖方式。我国水产科技工作人员自20世纪70年代起在大连、烟台、青岛等地的开放海域尝试养殖鲑鱼, 但因夏季海水温度过高不适合鲑鳟生存而失败(董双林, 2019)。然而, 在黄海中央洼地存在一个巨大的季节性冷水团, 为鲑鳟鱼在海区开展养殖创造了条件(张竹琦, 1990; Yu et al, 2006; Dong, 2015; Xin et al, 2015; Han et al, 2016)。
鳃和肠作为鱼类渗透压调节的重要器官, 能够相互协调发挥作用, 两组织均通过离子交换实现机体渗透压调节(Giffard-Mena et al, 2006; Con et al, 2017)。鳃和肠道中特定的离子转运细胞通过多种离子通道和转运蛋白来维持渗透压平衡, 如nka和aqp3等。Nka通过为鱼类体内的许多离子转运系统提供驱动力, 在维持鱼类体内渗透压平衡的过程中发挥着重要作用(Kültz, 2015)。Aqp3是重要的水通道, 参与调节细胞的水通量(Cutler et al, 2007)。环境盐度的变化通过影响nka和aqp3的基因表达进而对鱼类的渗透压平衡产生影响。盐度和温度的协同作用会对鱼类的渗透压平衡及消化吸收产生负面作用, 引起应激现象发生。热休克蛋白是机体在应激情况下细胞内迅速合成的一组蛋白质, 在应对外界环境变化的过程中发挥着重要的作用。据报道, hsp70在水生动物适应温度和盐度变化的过程中发挥着作用(Yang et al, 1992)。同时, 肠道渗透压调节功能还与消化和吸收密切相关, 因为上皮组织吸收营养由离子梯度和膜转运蛋白驱动(Bakke et al, 2010), 肠道渗透压的改变通过影响鱼类的消化和吸收进而影响鱼类的生长和发育。gh-igf-1轴是鱼类生长发育的重要调控轴, 外界盐度的变化可通过扰乱gh和igf-1等因子的表达, 从而影响鱼类的生长发育(李文笙等, 2010; 郑艳等, 2012; 岳蒙蒙, 2017)。
虹鳟具有很强的渗透压调节能力, 经过科学合理的盐度驯化可以在海水中存活, 并表现出良好的生长性能(Thorarensen et al, 1996; 刘骋跃等, 2018)。早期研究主要集中于不同盐度条件下虹鳟的驯化方式(付占斐等, 2020)、消化酶活性和氧化应激能力(杨静雯等, 2019)对虹鳟的影响, 而关于温度和盐度交互作用对虹鳟生长、渗透压调节、消化酶活性及应激影响的研究尚未见报道。本研究以虹鳟“水科1号”为研究对象, 通过在3种温度(10、16和22 ℃)条件下均设置5种盐度梯度处理(盐度分别为0、8、16、24、32), 进行为期21 d的养殖试验, 比较探究温度和盐度交互作用对虹鳟生长、消化酶活性和生长、应激和渗透压调节相关基因表达的影响, 以期为虹鳟的海水驯化和海水养殖提供科学依据。
1 材料与方法 1.1 实验鱼来源及暂养虹鳟“水科1号”来自中国水产科学研究院黑龙江水产研究所渤海冷水性鱼类实验站。在循环控温水族箱(180 cm×60 cm×50 cm)中暂养14 d后进行实验, 暂养期间的光暗比为(12L : 12D), 水温控制在(16±0.5) ℃。暂养期间保持连续供氧, 实测溶解氧浓度为7.8~ 10.0 mg/L, pH 7.1~7.5。暂养期间每日按照鱼体重的2%投喂配合饲料(北京汉业科技有限公司), 实验前一天停止投饵。挑选健康个体作为实验对象备用, 规格为初始体长(14.16±1.03) cm、初始体重(40.00± 2.36) g。
1.2 实验设计实验共设3种温度梯度(10、16和22 ℃), 同时每种温度下设置5个盐度梯度处理(盐度分别为0、8、16、24、32)。10 ℃条件下盐度梯度分别以A1~A5表示; 16 ℃条件下分别以B1~B5表示; 22 ℃条件下分别以C1~C5表示。以16 ℃且盐度0组作为基础, 采用日升(降)温度1 ℃的同时日升盐度2的方法, 直至达到目的温度和盐度, 暂养1 d后开展为期21 d的养殖试验, 实验设计见表 1。每种盐度处理设置三组平行实验组, 每个平行组放置8尾鱼。盐度采用曝气自来水与海水素(海之绚海洋生物有限公司, 青岛, 中国)调配, 盐度变化通过手持盐度计(AZ-8371)测定。温度通过循环控温水族箱控制温度, 温差控制在±0.2 ℃。实验期间管理与暂养期间一致, 每日投喂商业饲料两次至视觉饱足并做好记录。实验期间及时捞出死鱼及粪便等。
| 实验温度 | 10 ℃ | 16 ℃ | 22 ℃ | ||||||||||||
| 盐度处理组 | A1 | A2 | A3 | A4 | A5 | B1 | B2 | B3 | B4 | B5 | C1 | C2 | C3 | C4 | C5 |
| 变温所用时间/d | 6 | 6 | 6 | 6 | 6 | 0 | 0 | 0 | 0 | 0 | 6 | 6 | 6 | 6 | 6 |
| 升盐所用时间/d | 0 | 4 | 8 | 12 | 16 | 0 | 4 | 8 | 12 | 16 | 0 | 4 | 8 | 12 | 16 |
| 目的温度/℃ | 10 | 10 | 10 | 10 | 10 | 16 | 16 | 16 | 16 | 16 | 22 | 22 | 22 | 22 | 22 |
| 目的盐度 | 0 | 8 | 16 | 24 | 32 | 0 | 8 | 16 | 24 | 32 | 0 | 8 | 16 | 24 | 32 |
生长实验结束后停食1 d, 将实验鱼经MS-222麻醉后用电子天平(HC-C, 0.01 g)测量终末体重。随后, 分别从每种实验条件下的三组平行组中各随机选取6尾鱼分别用于消化酶活性测定以及RNA提取, 在无菌冰盘上解剖取得鳃和肠道组织(中肠), 剔除内容物和脂肪, 经液氮迅速冷冻后于–80 ℃超低温冰箱中保存, 用于后续实验测定。
1.4 肠组织酶活性测定淀粉酶(AMS)活性、脂肪酶(LPS)活性及酶液蛋白含量测定均采用南京建成生物工程研究所生产的试剂盒进行测定。相关酶活性及蛋白含量的测定均按照相应的试剂盒说明书进行。
1.5 相关基因表达分析将鳃和肠组织解冻后, 使用Simply P总RNA提取试剂盒(BioFlux, 杭州, 中国)对RNA进行提取。通过分光光度计在260和280 nm处测定吸光度值来检测所提取RNA的纯度, 1%琼脂糖凝胶电泳评估RNA的完整性。使用PrimeScript RT试剂盒(TaKaRa, 大连, 中国)合成cDNA。采用Roche公司(瑞士) FastStart Universal SYBR® Green Master Mix (ROX)进行实时定量PCR。qPCR反应体系为10.0 μL, PCR反应条件为: 95 ℃ 10 min, 95 ℃下变性15 s, 40个循环60 ℃下退火30 s。以β-actin作为内参基因。使用CFX96 C1000 TOUCH荧光定量仪(BIO-RAD, 美国)检测Ct值, 通过2–ΔΔCt方法计算基因的相对表达水平, 每个样本重复三次。实验中所用到的引物序列见表 2。
| 引物名称 | 核苷酸序列(5′~3′) | 登记号 |
| gh | F: TTGACGGTACCCTGTTGCCT | M22731.1 |
| R: TTGTCGACTGGGCTCACGAT | ||
| igf-1 | F: TATGGCCCCAGTTCACGG | M95183.1 |
| R: GCTGCCTTGCCAGACTTGAC | ||
| hsp70 | F: GGGGACGCAGCCAAGAAC | BT073047.1 |
| R: GGGCCGTGTCGAGTCGTT | ||
| aqp3 | F: GGGTTCAGGTGGCCTCCT | GBTD01029024.1 |
| R: GTTTGGCTGTGGTGCGGT | ||
| nka | F: CTGAGAGGATTCTGGACCGC | AY319390.1 |
| R: GGTCATCAGGGAGCTGGAAA | ||
| β-actin | F: CTACCTGATGAAGATCCTGACGG | LOC100136352 |
| R: CAGCTTCTCCTTGATGTCTCGTA | ||
| 注: gh: 生长激素(growth hormone); igf-1: 胰岛素生长因子(insulin-like growth factor); hsp70: 热休克蛋白70 (heat shock protein 70); nka: 钠-钾ATP酶(Na+/K+-ATPase); aqp3: 水通道蛋白3 (Aquaporin 3) | ||
饵料转化率FCE (feed conversion efficiency)、增重率WGR (weight gain rate)和特定生长率SGR (specific growth rate)的计算公式如下:
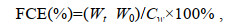 (1)
(1)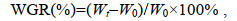 (2)
(2)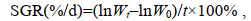 (3)
(3)式中, W0和Wt分别表示实验鱼初始体重和终末体重(g); Cw表示实验鱼在实验期间总摄食量(g); t表示实验时间(d)。
实验数据均使用SPSS 25.0版(SPSS Inc, Chicago, USA)进行统计分析, 以温度和盐度作为自变量, 进行双因素方差分析(Two-Way ANOVA), 并采用Duncan多重比较法检验不同实验组平均值间是否存在差异(P < 0.05)。统计结果均以平均值±标准差(Mean±SD)表示, 以P < 0.05作为差异显著水平。使用GraphPad Prism 5.0 (San Diego, CA, USA) 可视化所有统计数据。
2 结果 2.1 不同温度和盐度对虹鳟“水科1号”生长性能的影响温度和盐度交互处理后虹鳟的FCE、WGR和SGR及存活率见表 3。从表 3中可以看出, 10 ℃时, 随着盐度增大FCE、WGR和SGR三项指标均呈下降趋势; 除A1组FCE与B1 (淡水对照组)无显著差异外, 其余盐度组FCE、WGR、SGR三项指标均低于B1 (淡水对照组)。16 ℃时, 随着盐度增大FCE、WGR和SGR均呈先升高后下降的趋势; 除B2组FCE、WGR和SGR均高于B1 (淡水对照组), 其余实验组三项指标均较B1 (淡水对照组)下降。22 ℃时, 随着盐度增大FCE、WGR和SGR三项指标均呈下降趋势, 均显著低于B1 (淡水对照组)。此外, 养殖实验过程中, 三种不同温度条件下均在32盐度组中出现实验鱼死亡现象, 其中16 ℃时三组平行组共死亡1尾鱼, 10 ℃时三组平行组共死亡3尾鱼, 22 ℃时三组平行组共死亡4尾鱼。不同温度和盐度处理后虹鳟的FCE、WGR和SGR双因素方差分析结果如表 4所示。从表 4中可得出, 虹鳟的FCE、WGR和SGR均受到温度和盐度的交互影响显著(P < 0.05)。
| 温度 | 盐度组 | 饵料转化率/% | 增重率/% | 特定生长率/% | 存活率/% |
| 10 ℃ | A1 | 13.03±0.34Aa | 74.02±4.50Ba | 2.64±0.12Ba | 100.0 |
| A2 | 12.66±0.63Bb | 69.74±4.26Bb | 2.52±0.12Bb | 100.0 | |
| A3 | 11.04±0.35Bc | 57.69±2.43Bc | 2.17±0.07Bc | 100.0 | |
| A4 | 10.02±0.42Bd | 48.66±3.17Bd | 1.89±0.10Bd | 100.0 | |
| A5 | 7.64±0.26Be | 32.84±1.04Be | 1.35±0.04Be | 87.5 | |
| 16 ℃ | B1 | 13.05±0.31Ab | 77.44±4.05Ab | 2.73±0.11Ab | 100.0 |
| B2 | 13.97±0.20Aa | 88.16±3.67Aa | 3.01±0.09Aa | 100.0 | |
| B3 | 12.18±0.32Ac | 72.05±2.23Ac | 2.58±0.06Ac | 100.0 | |
| B4 | 11.68±0.27Ad | 62.31±3.01Ad | 2.31±0.09Ad | 100.0 | |
| B5 | 9.89±0.39Ae | 48.05±2.40Ae | 1.87±0.08Ae | 95.8 | |
| 22 ℃ | C1 | 12.32±0.43Ba | 68.15±3.44Ca | 2.47±0.10Ca | 100.0 |
| C2 | 11.37±0.60Cb | 60.76±3.79Cb | 2.26±0.11Cb | 100.0 | |
| C3 | 9.84±0.68Cc | 49.39±4.52Cc | 1.91±0.14Cc | 100.0 | |
| C4 | 8.39±0.76Cd | 38.67±4.47Cd | 1.56±0.15Cd | 100.0 | |
| C5 | 5.12±0.30Ce | 21.44±1.33Ce | 0.92±0.05Ce | 83.3 | |
| 注: 数值为三组平行组的平均值。不同小写字母表示同一温度下不同盐度处理组间存在显著差异(P < 0.05), 不同大写字母表示同一盐度条件下不同温度处理组之间存在显著差异(P < 0.05) | |||||
| 指标 | 饵料转化率/% | 增重率/% | 特定生长率/% |
| 温度 | 0.000 | 0.000 | 0.000 |
| 盐度 | 0.000 | 0.000 | 0.000 |
| 温度×盐度 | 0.000 | 0.003 | 0.000 |
温度和盐度交互作用下虹鳟肠道淀粉酶活性和脂肪酶活性变化见图 1。由图 1可知, 10 ℃时, 肠道中淀粉酶和脂肪酶活性均随着盐度增大呈降低趋势, 各盐度组淀粉酶活性分别较对照组活性显著降低约15%、16%、29%、53%和75% (P < 0.05); 脂肪酶活性分别较对照组显著下降约12%、21%、30%、39%和46% (P < 0.05)。16 ℃时, 淀粉酶和脂肪酶活性随着盐度增大均呈先升高后下降的趋势, 淀粉酶活性除B2组较对照组显著升高约23%, 其余盐度组淀粉酶活性分别较对照组显著下降约25%、45%和49%; 脂肪酶活性除B2组较对照组显著升高约8%, 其余盐度组脂肪酶活性分别较对照组显著下降约12%、24%和31%。22 ℃时, 肠道中淀粉酶活性和脂肪酶活性随着盐度的增大呈下降趋势, 各盐度组淀粉酶活性分别较对照组显著下降约18%、32%、42%、51%和63%; 脂肪酶活性分别较对照组显著下降约10%、16%、19%、34%和47%。此外, 在同一盐度条件下, 肠道中淀粉酶和脂肪酶活性均随着温度的升高呈先升高后下降的趋势, 16 ℃实验组显著高于10和22 ℃实验组(P < 0.05)。温度和盐度交互处理后虹鳟肠道中淀粉酶活性和脂肪酶活性双因素方差分析结果如表 5所示。从表 5中可以看出, 虹鳟肠道中淀粉酶活性和脂肪酶活性均受到温度和盐度的交互影响显著(P < 0.05)。
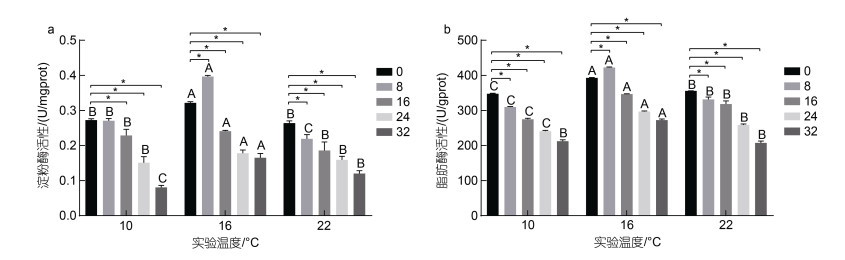 |
| 图 1 温度和盐度交互作用对虹鳟肠道消化酶活性的影响 Fig. 1 Effect of temperature-salinity interaction on intestinal digestive enzyme activity of rainbow trout 注: a. 淀粉酶; b. 脂肪酶。*字母表示同一温度不同盐度条件下各组之间的显著差异(P < 0.05), 不同大写字母表示同一盐度不同温度条件下各组之间的显著差异(P < 0.05) |
| 指标 | 淀粉酶 | 脂肪酶 |
| 温度 | 0.000 | 0.000 |
| 盐度 | 0.000 | 0.000 |
| 温度×盐度 | 0.000 | 0.000 |
鳃组织中gh表达量如图 2a, 结果表明, 10 ℃时, gh表达量随着盐度增大呈下调趋势, 各实验组分别较对照组显著下调6%、10%、18%、22%和31% (P < 0.05); 16 ℃时, gh表达量随实验组盐度增大呈先上调后下调的趋势, B2组和B3组表达量分别较对照组显著上调约79%和47%, B4组较对照组无显著差异(P > 0.05), B5组较对照组显著下调16% (P < 0.05); 22 ℃时, gh表达量随着盐度增大呈下调趋势, 各实验组分别较对照组显著下调5%、7%、13%、19%和28% (P < 0.05)。鳃组织中igf-1表达量如图 2b所示, 从图中可以观察到, igf-1表达量的变化趋势基本与gh一致, 10 ℃时, igf-1表达量随着盐度增大呈下调趋势, 各实验组分别较对照组显著下调1%、1%、8%、29%和49% (P < 0.05); 16 ℃时, igf-1表达量随实验组盐度增大呈先上调后下调的趋势, B2组和B3组表达量分别较对照组显著上调约48%和21%, B4组较对照组无显著差异(P > 0.05), B5组较对照组显著下调16% (P < 0.05); 22 ℃时, igf-1表达量随着盐度增大呈下调趋势, 各实验组分别较对照组显著下调1%、3%、7%、19%和27% (P < 0.05)。鳃组织中hsp70表达量如图 2c所示, 各温度下hsp70表达量随盐度增大呈上调趋势, 10 ℃时, 各盐度组hsp70分别较对照组显著上调约25%、98%、132%、218%和494% (P < 0.05); 16 ℃时, 除B2组和B3组较对照组无显著差异外(P > 0.05), 其余盐度组分别较对照组显著上调约73%和129%; 22 ℃时, 各盐度组分别较对照组显著上调约68%、128%、118%、246%和301% (P < 0.05)。鳃组织中aqp3表达量如图 2d所示, 三种不同温度下aqp3表达量随盐度增大均呈下调趋势, 10 ℃时, 除A1组与对照组无显著差异外(P > 0.05), 其余盐度组分别较对照组显著下调9%、17%、25%和40% (P < 0.05); 16 ℃时, 除B2组较对照组无显著差异外(P > 0.05), 其余盐度组分别较对照组显著下调10%、22%和33% (P < 0.05); 22 ℃时, 除C1组较对照组无显著差异外(P > 0.05), 其余盐度组分别较对照组显著下调6%、15%、25%和36% (P < 0.05)。鳃组织中nka表达量如图 2e所示, 三种不同的温度下nka表达量随盐度增大均呈上调趋势, 10 ℃时, 除A1组与对照组无显著差异外(P > 0.05), 其余盐度组分别较对照组显著上调19%、98%、210%和390% (P < 0.05); 16 ℃时, 除B2组较对照组无显著差异外(P > 0.05), 其余盐度组分别较对照组显著上调56%、155%和310% (P < 0.05); 22 ℃时, 除C1组较对照组无显著差异外(P > 0.05), 其余盐度组分别较对照组显著上调9%、83%、198%和365% (P < 0.05)。此外, 在盐度相同温度不同时, 16 ℃实验组较10 ℃和22 ℃实验组gh和igf-1表达量显著上调(P < 0.05)、hsp70表达量显著下调(P < 0.05)、aqp3表达量(除16和32盐度时)无显著差异(P > 0.05)、nka表达量(除0盐度时)显著下调(P < 0.05)。不同温度和盐度处理后虹鳟鳃组织中gh、igf-1、hsp70、aqp3和nka基因表达双因素方差分析结果如表 6所示。从表 6中可以看出, 虹鳟鳃组织中gh、igf-1、hsp70、aqp3和nka基因表达均受到温度和盐度的交互影响显著(P < 0.05)。
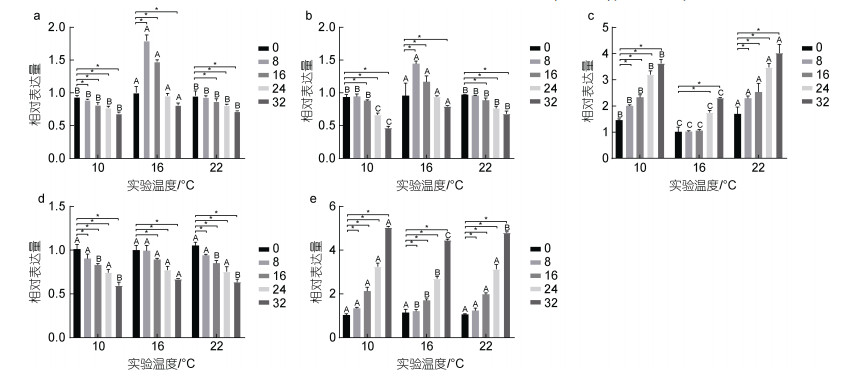 |
| 图 2 温度和盐度交互作用对虹鳟鳃组织中gh、igf-1、hsp70、aqp3和nka基因表达的影响 Fig. 2 Effect of temperature-salinity interaction on gh, igf-1, hsp70, aqp3, and nka gene expression in gill tissue of rainbow trout 注: a. gh; b. igf-1; c. hsp70; d. aqp3; e. nka。所有数据用平均值±标准差表示(n=3), 表达水平以温度16 ℃盐度0组为对照。*表示在同一温度不同盐度下各实验组间的显著差异(P < 0.05), 不同大写字母表示在同一盐度不同温度下各实验组间的显著差异(P < 0.05) |
| 指标 | 鳃组织 | ||||
| gh | igf-1 | hsp70 | aqp3 | nka | |
| 温度 | 0.000 | 0.000 | 0.000 | 0.007 | 0.000 |
| 盐度 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| 温度×盐度 | 0.000 | 0.000 | 0.000 | 0.036 | 0.000 |
肠组织中gh表达量如图 3a, 10 ℃时, gh表达量随盐度增大呈先上调后下降的趋势, 除A2组较对照组无显著差异外(P > 0.05), 其余盐度组分别较对照组显著下调8%、14%、19%和25% (P < 0.05); 16 ℃时gh表达量随盐度增大呈先上调后下调的趋势, B2和B3组分别较对照组显著上调77%和16% (P < 0.05), 其余盐度组分别较对照组显著下调2%和11% (P < 0.05); 22 ℃时, gh表达量随盐度增大整体呈下降趋势, 各盐度组分别较对照组显著下调10%、10%、19%、24%和31% (P < 0.05)。肠组织中IGF表达量如图 3b, 10 ℃时, igf-1表达量随盐度增大呈先上调后下调的趋势, 除A2组较对照组无显著差异外(P > 0.05), 其余盐度组分别较对照组显著下调7%、11%、18%和24% (P < 0.05); 16 ℃时, igf-1表达量随盐度增大呈先上调后下调的趋势, B2和B3组分别较对照组显著上调92%和7% (P < 0.05), 其余盐度组分别较对照组显著下调7%和13% (P < 0.05); 22 ℃时, igf-1表达力随盐度增大呈下调的趋势; 各实验组分别均较对照组显著下调9%、6%、19%、23%和30%(P < 0.05)。肠组织中hsp70表达量如图 3c, 结果显示, 不同温度条件下hsp70表达量随盐度增大均呈上调趋势; 10 ℃时, 各盐度组hsp70分别较对照组显著上调约31%、29%、97%、159%和205% (P < 0.05); 16 ℃时, 除B2组较对照组无显著差异外(P > 0.05), 其余盐度组分别较对照组显著上调约34%、93%和124%; 22 ℃时, 各盐度组分别较对照组显著上调约76%、71%、180%、217%和285% (P < 0.05)。肠组织中aqp3表达量如图 3d, 不同温度条件下aqp3表达量均随盐度增大呈上调趋势, 10 ℃时, 随着盐度组盐度增大, 各盐度组分别较对照组显著下调4%、45%、304%、316%和497% (P < 0.05); 16 ℃时, 随着盐度组盐度增大, 各盐度组分别较对照组显著下调36%、176%、273%和418% (P < 0.05); 22 ℃时, 随着盐度组盐度增大, 各盐度组分别较对照组显著下调5%、60%、257%、291%和778% (P < 0.05)。肠组织中nka表达量如图 3e, 三种不同的温度下, 各实验组nka表达量随盐度增大均呈上调趋势, 10 ℃时, 随着盐度组盐度增大, 各盐度组分别较对照组显著上调6%、135%、469%、595%和606% (P < 0.05); 16 ℃时, 随着盐度组盐度增大, 各盐度组分别较对照组显著上调61%、354%、597%和719% (P < 0.05); 22 ℃时, 随着盐度组盐度增大, 各盐度组分别较对照组显著上调18%、84%、350%、560%和700% (P < 0.05)。此外, 在盐度相同温度不同时, 16 ℃实验组较10 ℃和22 ℃实验组gh和igf-1表达量显著上调(P < 0.05)、hsp70表达量显著下调(P < 0.05)。温度和盐度交互处理后虹鳟鳃组织中gh、igf-1、hsp70、aqp3和nka基因表达双因素方差分析结果如表 7所示。从表 7中可以看出, 虹鳟肠组织中gh、igf-1、hsp70、aqp3和nka基因表达均受到温度和盐度的交互影响显著(P < 0.05)。
 |
| 图 3 不同温度和盐度对虹鳟肠组织中gh、igf-1、hsp70、aqp3和nka基因表达的影响 Fig. 3 Effects of temperature and salinity on gh, igf-1, hsp70, aqp3, and nka gene expression in intestinal tissue of rainbow trout 注: a. gh; b. igf-1; c. hsp70; d. aqp3; e. nka。所有数据用平均值±标准差表示(n=3), 表达水平以温度16 ℃盐度0组为对照。*表示在同一温度不同盐度下各实验组间的显著差异(P < 0.05), 不同大写字母表示在同一盐度不同温度下各实验组间的显著差异(P < 0.05) |
| 指标 | 肠组织 | ||||
| gh | igf-1 | hsp70 | aqp3 | nka | |
| 温度 | 0.000 | 0.000 | 0.000 | 0.000 | 0.039 |
| 盐度 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
| 温度×盐度 | 0.000 | 0.000 | 0.000 | 0.000 | 0.000 |
在温度和盐度驯化过程的中, 不同的升(降)温和升盐方式会影响鱼类的生长发育及存活率。有研究表明, 通过较慢的升温速率更能真实地反映自然环境中鱼类受到影响(Galbreath et al, 2004; 姜旭阳等, 2019)。因此本实验选用日升温度或日降温度1 ℃的方式模拟养殖过程中面临的温度变化。有关鱼类生长发育及存活率受到盐度驯化方式的影响已有不少报道, 盐度驯化过程中升盐速率过大会影响鱼类的生长发育。黄国强等(2013)对褐牙鲆(Paralichthy solivaceus)盐度驯化的过程中发现, 采用日升盐度7的方式时, 褐牙鲆血清渗透压需要2 d才能恢复稳定; 采用日升盐度14的方式血清渗透压则需要4 d才能回复稳定。付占斐等(2020)在研究不同盐度驯化方式对虹鳟和硬头鳟的影响中发现, 随着日升盐度的增大存活率随之下降, 作者指出, 采用缓慢的升盐方式即日升盐度2进行盐度驯化更有利于虹鳟和硬头鳟的生长发育。因此, 本实验中采用日升盐度2的方式达到实验目的盐度, 在养殖试验过程中, 三种不同温度条件均在32盐度组中出现虹鳟死亡现象, 可能由于实验鱼个体间存在差异, 无法耐受当前的实验条件。温度和盐度是影响水产动物生长和存活的重要环境因子, 合适的温度范围以及适当的盐度环境可促进水产动物的生长发育, 反之则会产生不利影响(Buckel et al, 1995; 金方彭等, 2018; 王润萍等, 2019; 李培伦等, 2020b)。据报道, 硬骨动物血液中渗透压约为12, 约为海水盐度(38)的三分之一(Mylonas et al, 2009)。大量研究表明, 中低盐度下会促进广盐性鱼类的生长, 因为此时的盐度更接近鱼类的等渗点, 降低了对渗透压调节的需求, 可为鱼类生长提供更多的能量(Martinez-Cardena et al, 2014; Goda et al, 2019; Haider et al, 2021)。本研究结果表明, 温度和盐度交互影响对虹鳟的FCE、WGR和SGR影响显著(P < 0.05)。在16 ℃时, 盐度为8实验组虹鳟的FCE、WGR和SGR较B1淡水对照组显著增加, 即适当的升高盐度提高了虹鳟的生长性能。这在不同的广盐鱼类中也有报道, 如欧洲鲈(Dicentrarchus labrax) (Bernardino et al, 2016)、黄鳍鲷(Acanthopagrus latus)和亚洲鲈(Lates calcarifer) (Mozanzadeh et al, 2021)、大西洋鳕鱼(Gadus morhua) (Árnason et al, 2013)等。
鱼类的消化酶活性通过影响机体对营养物质的消化和吸收进而影响鱼类的生长发育, 而养殖水体中的温度和盐度是影响鱼类消化酶活性的主要因素(欧志联, 2018)。本研究结果显示, 同一盐度不同温度条件下, 虹鳟肠道中淀粉酶和脂肪酶的活性随着温度增大呈先升高后下降的趋势。刘鉴毅等(2015)在温度对点篮子鱼(Siganus guttatus)消化酶活性影响的研究中发现, 点篮子鱼肠道中淀粉酶的活性随着温度的升高呈先升后降的趋势。梅景良等(2004)在研究温度和pH对黑鲷(Sparus macrocephalus)肠等消化酶活性的影响中发现, 脂肪酶活性的变化趋势随着温度的升高先上升达到峰值后下降。上述研究结果与本实验中观察到的结果相似。本研究中, 同一温度不同盐度条件下, 10 ℃和22 ℃虹鳟肠道中淀粉酶和脂肪活性整体随着盐度的升高而降低; 16 ℃时, 肠道中脂肪酶和淀粉酶活性随盐度增大先升高后下降。杨静雯等(2021)在研究盐度对虹鳟和硬头鳟消化酶活性的研究中发现, 随着盐度的升高, 虹鳟肠道中脂肪酶活性表现为先升后降, 盐度为5时活性最高, 与本研究中温度为16 ℃、盐度为8实验组的研究结果相近。诸多研究表明, 盐度的变化对消化酶活性的影响有三种不同的情况, 分别为促进、抑制和无显著影响(罗鸣钟等, 2015; 刘永士等, 2020; 李培伦等, 2020a)。本研究中, 受到温度和盐度的双重影响, 虹鳟肠道中消化酶的活性在不同实验条件下表现出不同的变化趋势。造成这种现象的原因有很多, 虹鳟的最适生长温度为12~18 ℃, 高出或低于此温度范围都会影响虹鳟正常的生长发育(夏斌鹏等, 2017; 刘骋跃等, 2019; 姜旭阳等, 2021)。温度的变化会影响鱼类获取食物的欲望, 以及在肠道中消化食物吸收营养和储存多余能量的能力(Volkoff et al, 2020)。环境盐度的变化可能会改变鱼类的饮水量、肠道中内容物的pH值以及离子浓度等, 进而影响鱼类的消化酶活性(Liu et al, 2017; Mozanzadeh et al, 2021)。本研究结果表明, 在适宜的温度条件下, 适当的增加盐度会促进虹鳟的消化酶活性, 这与本研究中生长性能指标相印证。同时, 在美洲鲱(Alosa sapidissima) (成永洲, 2015)、斜带石斑鱼(Epinephelus coioides) (Sakamoto et al, 1993)等的研究中也证实了这一点。
生长激素(Growth Hormone, gh)和胰岛素生长因子(Insulin-like Growth Factor, igf)除了参与鱼类生长发育调节作用外, 还能够通过参与渗透压调节来促进水生生物盐度适应的过程(刘红云等, 2004; 董云伟等, 2008)。养殖水体温度和盐度的变化不仅会影响鱼类的生长发育, 渗透压调节等, 还会导致鱼类产生异常的应激反应。在本研究中, 鳃和肠组织中gh和igf-1表达量在16 ℃时随实验组盐度增大呈先升高后下降的趋势, 盐度为8实验组表达量较对照组显著上调(P < 0.05), 说明此盐度下利于促进虹鳟的生长。Madsen等(1992)在对褐鳟(Salmo trutta)和虹鳟海水适应的研究中指出, 低盐度下gh表达量上调从而促进了鱼体的生长发育。李明云等(2015)在研究低盐胁迫对大黄鱼(Pseudosciaena crocea) gh和igf-1基因表达变化的影响时指出, 低盐环境下大黄鱼鳃、肝和肠等组织中gh和igf-1的表达量升高。二者的研究结果与本研究相似。但在10 ℃和22 ℃时, 虹鳟鳃和肠组织中gh和igf-1表达量随着盐度的升高整体呈现下降趋势。这可能是由于在温度和盐度的双重因素影响下, 虹鳟处于应激状态而抑制了鳃和肠组织中gh和igf-1基因的表达。
热休克蛋白70 (Heat Shock Protein, hsp70)又称应激蛋白70, 是HSPs家族中重要的一员, 当机体处于应激条件下(温度、盐度等)时会被诱导表达上调。有报道称, hsp70参与水生动物温度和盐度适应的过程(Bakke et al, 2010)。本研究结果显示, 鳃和肠组织中hsp70的相对表达量在各温度下均随实验组盐度增大呈上调趋势。在盐度相同温度不同时, 鳃和肠组织中hsp70表达量均表现为22 ℃时最高, 10 ℃次之, 16 ℃最低。虹鳟鳃和肠组织中hsp70相对表达量不同程度的变化, 说明温度和盐度的交互影响造成虹鳟体内应激现象的产生。据报道称, 温度和盐度的变化会导致细胞内蛋白质肽链失去原有的折叠结构, 使空间结构发生改变, 失去原有功能; hsp70会在外界因素刺激下大量表达, 修复或降解细胞内的变性蛋白质, 增加机体的抗应激能力, 从而缓解温度和盐度变化带来的应激压力(任宝波等, 2005; 辛苑茹等, 2019)。
养殖环境盐度的改变会影响鱼类渗透压平衡, 进而影响鱼类的生长发育。鳃和肠作为鱼类渗透压调节的重要器官, 能够相互协调发挥作用, 两组织通过离子交换、吸收水分等方式实现机体渗透压调节。在本研究中, 我们观察到暴露于不同温度和盐度下虹鳟鳃和肠道中aqp3的表达存在差异。鳃组织中, 不同温度下, aqp3表达量随着实验组盐度增大呈下调趋势。Tipsmark等(2010)在对大西洋鲑(Salmo salar)海水驯化时渗透压调节组织中水通道蛋白表达的研究中发现, 海水条件下会诱导大西洋鲑鳃组织中aqp3的表达下调。Cutler等(2002)和Giffard-Mena等(2007)分别在对欧洲鳗鲡(Anguilla anguilla)和欧洲鲈受盐度影响的研究中指出, 海水驯化后广盐鱼的鳃组织中aqp3表达量呈下调趋势。上述研究与本实验中观察到的结果相似。有报道指出, aqp3在鳃组织中的作用可能是通过促进水流出鳃上皮到循环系统中(Cutler et al, 2000)。但这不利于处于高盐环境中的鱼类维持渗透压的平衡, 这可能是造成鳃组织中aqp3表达量下调的原因。在本研究的肠组织中, 不同温度下, 肠组织中aqp3的表达量随实验组盐度增大呈上调趋势。Choi等(2013)在对红大马哈鱼(Oncorhynchus nerka)海水驯化的研究中发现, 肠组织中aqp3表达量会增加, 与本实验的研究结果相似。众多的研究表明, aqp3存在于肠道的上皮细胞中, 通过吸收控制盐分的流入来维持渗透压的平衡(Martinez et al, 2005), 本研究肠组织aqp3表达量的变化表明其在维持渗透压平衡中发挥着作用。在本研究中, 不同温度下, 虹鳟鳃和肠组织中nka表达量均随实验组盐度增大呈上调趋势。这与Tang等(2012)对经盐度驯化的日本鳗鲡(Anguilla japonica)鳃组织中的nka和Chourasia等(2018)对高盐适应下罗非鱼(Oreochromis mossambicus)肠道中nka的表达趋势一致。nka对维持细胞内稳态至关重要, 通过进行离子转运产生初始电化学梯度, 为其他跨膜蛋白进行离子和水交换提供基础, 在维持鱼类渗透压平衡中发挥着重要的作用(Zhang et al, 2019; Saghafiankho et al, 2020)。在虹鳟鳃和肠组织中观察到aqp3和nka不同程度的表达水平, 表明aqp3和nka在到维持虹鳟渗透压平衡的调节中发挥着重要的作用。
4 结论综上可得出结论, 本文研究了不同盐度和温度对虹鳟“水科1号”生长指标、消化酶活性及相关基因表达的影响。结果发现, 16 ℃下, 盐度为8实验组的虹鳟较淡水对照组生长表现更好, 即虹鳟在适宜生长的温度下, 适当的提升养殖水体盐度有利于促进虹鳟的生长。本研究中还发现, 与低盐度组相比, 各温度下高盐度组整体的试验周期虽然更长, 但从生长指标、消化酶活性及鳃和肠组织中基因表达的结果来看, 并没有弥补盐度升高带来的负面影响, 尽管在最适的生长温度下, 高盐度仍抑制了虹鳟的生长发育。本研究为温度和盐度变化对虹鳟海水驯化和海水养殖的研究提供了基础资料。
王润萍, 戴铃灵, 陈雅飞, 等, 2019. 短期温度、盐度胁迫对海洋青鳉鱼(Oryziasmelastigma)摄食行为及抗氧化的影响[J]. 海洋与湖沼, 50(2): 378-387. |
户国, 王炳谦, 2017. 国际虹鳟育种产业简介及其对我国的借鉴意义[J]. 水产学杂志, 30(3): 1-6. |
付占斐, 王鑫, 王芳, 等, 2020. 不同盐度驯化方式对虹鳟和硬头鳟幼鱼存活和生长的影响[J]. 中国海洋大学学报, 50(7): 37-43. |
成永洲, 2015. 海水盐度对斜带石斑鱼幼鱼生长及生理生化的影响[D]. 南京: 南京农业大学: 40-46.
|
任宝波, 王玉艳, 王纯净, 等, 2005. HSP70家族的分类及基因结构与功能[J]. 动物医学进展, 26(1): 98-101. |
刘永士, 徐嘉波, 施永海, 等, 2020. 盐度对金钱鱼幼鱼消化酶和抗氧化酶活性的影响[J]. 水产科技情报, 47(4): 181-185. |
刘红云, 童富淡, 2004. 鱼类IGF-I生理功能及其表达调控的研究进展[J]. 水产科学, 23(5): 37-40. DOI:10.3969/j.issn.1003-1111.2004.05.012 |
刘骋跃, 周演根, 孙大江, 等, 2019. 低温和摄食对虹鳟脂肪酸合成基因表达的影响[J]. 中国海洋大学学报, 49(3): 63-71. |
刘骋跃, 周演根, 董亢, 等, 2018. 海水驯化对虹鳟鳃、肌肉和肝脏磷脂脂肪酸组成的影响[J]. 中国海洋大学学报, 48(11): 33-41. |
刘鉴毅, 宋志明, 王妤, 等, 2015. 温度对点篮子鱼幼鱼生长、摄食和消化酶活性的影响[J]. 海洋渔业, 37(5): 442-448. |
孙大江, 王炳谦, 2010. 鲑科鱼类及其养殖状况[J]. 水产学杂志, 23(2): 56-63. DOI:10.3969/j.issn.1005-3832.2010.02.014 |
李文笙, 林浩然, 2010. 鱼类生长激素合成与分泌的内分泌调控网络: 垂体生长激素分泌细胞中的信号整合[J]. 中国科学: 生命科学, 40(2): 149-158. |
李明云, 苗亮, 张浩, 等, 2015. 低盐胁迫对大黄鱼gh、igf-1、hsp90和pparβ基因表达变化的影响[J]. 宁波大学学报(理工版), 28(4): 1-6. |
李培伦, 刘伟, 王继隆, 等, 2020a. 盐度对马苏大麻哈鱼血液生化指标及消化酶活力的影响[J]. 湖南农业大学学报(自然科学版), 46(4): 466-471. |
李培伦, 刘伟, 王继隆, 等, 2020b. 盐度对大麻哈鱼幼鱼存活率、鳃ATP酶活力及其组织结构的影响[J]. 水生生物学报, 44(3): 562-569. |
杨静雯, 杨小刚, 黄铭, 等, 2021. 盐度变化对虹鳟和硬头鳟抗氧化酶活性的影响[J]. 中国海洋大学学报, 51(6): 26-33. |
杨静雯, 周演根, 黄铭, 等, 2019. 盐度对虹鳟和硬头鳟幼鱼消化酶和抗氧化酶活性的比较研究[J]. 中国海洋大学学报, 49(3): 119-128. |
辛苑茹, 温海深, 李吉方, 等, 2019. 急性高温胁迫对虹鳟二倍体和三倍体幼鱼hsps基因表达的影响[J]. 中国海洋大学学报, 49(3): 129-137. |
张竹琦, 1990. 黄海和东海北部夏季底层溶解氧最大值和最小值特征分析[J]. 海洋通报, 9(4): 22-26. |
欧志联, 2018. 鱼类消化酶研究及其在水产养殖中的应用[J]. 江西水产科技, (3): 27-28. |
罗鸣钟, 关瑞章, 靳恒, 2015. 盐度对花鳗鲡和太平洋双色鳗鲡幼鳗生长性能及消化酶活力的影响[J]. 水生生物学报, 39(4): 653-660. |
岳蒙蒙, 2017. 性类固醇激素对尼罗罗非鱼雌雄生长差异与生长相关基因表达的影响[J]. 上海: 上海海洋大学: 6-7.
|
金方彭, 李光华, 李林, 等, 2018. 温度、pH和盐度对后背鲈鲤幼鱼存活的影响[J]. 水生生物学报, 42(3): 578-583. |
郑艳, 汝少国, 2012. 外源化学物质对鱼类生长和GH/IGF-I轴的影响[J]. 中国海洋大学学报, 42(S1): 102-106. |
姜旭阳, 黄铭, 杨小刚, 等, 2021. 急性高温胁迫对虹鳟和硬头鳟幼鱼抗氧化酶活性的影响[J]. 中国水产科学, 28(1): 57-65. |
姜旭阳, 董双林, 刘骋跃, 等, 2019. 虹鳟和硬头鳟幼鱼对温度的耐受性[J]. 中国海洋大学学报, 49(3): 57-62. |
夏斌鹏, 刘哲, 周彦静, 等, 2017. 慢性热应激对虹鳟部分血清非特异性免疫指标的影响[J]. 农业生物技术学报, 25(7): 1078-1085. |
黄国强, 张灵燕, 李洁, 等, 2013. 盐度驯化对褐牙鲆幼鱼渗透压调节和能量代谢的影响[J]. 中国海洋大学学报, 43(5): 44-51. |
梅景良, 马燕梅, 2004. 温度和pH对黑鲷主要消化酶活性的影响[J]. 集美大学学报(自然科学版), 9(3): 226-230. |
董云伟, 董双林, 纪婷婷, 2008. 水生动物热休克蛋白研究进展[J]. 中国海洋大学学报, 38(1): 39-44. |
董双林, 2019. 黄海冷水团大型鲑科鱼类养殖研究进展与展望[J]. 中国海洋大学学报, 49(3): 1-6. |
ÁRNASON T, MAGNADÓTTIR B, BJÖRNSSON B, et al, 2013. Effects of salinity and temperature on growth, plasma ions, cortisol and immune parameters of juvenile Atlantic cod (Gadus morhua)[J]. Aquaculture, 380/381/382/383: 70-79. |
BAKKE A M, GLOVER C, KROGDAHL å, 2010. Feeding, digestion and absorption of nutrients[J]. Fish Physiology, 30: 57-110. |
BERNARDINO R J, FERNANDES C, 2016. Growth performance for European sea bass fingerlings, Dicentrarchus labrax, reared at different salinities [C] // IMMR International Meeting on Marine Research. Peniche: Marine and Environmental Sciences Centre.
|
BUCKEL J A, STEINBERG N D, CONOVER D O, 1995. Effects of temperature, salinity, and fish size on growth and consumption of juvenile bluefish[J]. Journal of Fish Biology, 47(4): 696-706. |
CHOI Y J, SHIN H S, KIM N N, et al, 2013. Expression of aquaporin-3 and− 8 mRNAs in the parr and smolt stages of sockeye salmon, Oncorhynchus nerka: Effects of cortisol treatment and seawater acclimation[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 165(2): 228-236. |
CHOURASIA T K, D'COTTA H, BAROILLER J F, et al, 2018. Effects of the acclimation to high salinity on intestinal ion and peptide transporters in two tilapia species that differ in their salinity tolerance[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 218: 16-23. |
CON P, NITZAN T, CNAANI A, 2017. Salinity-dependent shift in the localization of three peptide transporters along the intestine of the Mozambique tilapia (Oreochromis mossambicus)[J]. Frontiers in Physiology, 8: 8. |
CUTLER C P, CRAMB G, 2000. Water transport and aquaporin expression in fish [M] // HOHMANN S, NIELSEN S. Molecular Biology and Physiology of Water and Solute Transport. New York: Springer: 433-441.
|
CUTLER C P, CRAMB G, 2002. Branchial expression of an aquaporin 3 (AQP-3) homologue is downregulated in the European eel Anguilla anguilla following seawater acclimation[J]. Journal of Experimental Biology, 205(17): 2643-2651. |
CUTLER C P, MARTINEZ A S, CRAMB G, 2007. The role of aquaporin 3 in teleost fish[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 148(1): 82-91. |
DONG S L, 2015. On ecological intensification of aquaculture systems in China[J]. Chinese Fisheries Economics, 33(5): 4-9. |
FAO, 2021. FAO Yearbook. Fishery and Aquaculture Statistics 2019/FAO annuaire. Statistiques des pêches et de l'aquaculture 2019/FAO anuario [R]. Estadísticas de pescay acuicultura 2019. Rome/Roma.
|
GALBREATH P F, ADAMS N D, MARTIN T H, 2004. Influence of heating rate on measurement of time to thermal maximum in trout[J]. Aquaculture, 241(1/2/3/4): 587-599. |
GIFFARD-MENA I, BOULO V, AUJOULAT F, et al, 2007. Aquaporin molecular characterization in the sea-bass (Dicentrarchus labrax): the effect of salinity on AQP1 and AQP3 expression[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 148(2): 430-444. |
GIFFARD-MENA I, CHARMANTIER G, GROUSSET E, et al, 2006. Digestive tract ontogeny of Dicentrarchus labrax: implication in osmoregulation[J]. Development, Growth & Differentiation, 48(3): 139-151. |
GODA A M A S, SROUR T M, MANSOUR A T, et al, 2019. Assessment of stresful ambient water salinity on growth, feed utilization and hematological indices of European sea bass, Dicentrarchus labrax, juveniles[J]. Aquaculture, Aquarium, Conservation & Legislation, 12(2): 553-563. |
HAIDER M S, SHABANA T, IQBAL S, et al, 2021. Comparative impact assessment of varying salinity concentration on growth, survival and blood chemistry of tilapia fingerlings[J]. Journal of Survey in Fisheries Sciences, 7(3): 111-126. |
HAN L M, GUO Y C, DONG S L, 2016. Research on establishing a national offshore aquaculture experimental zone based on the development of the Yellow Sea cold water mass[J]. Pacific Journal, 24(5): 79-85. |
KÜLTZ D, 2015. Physiological mechanisms used by fish to cope with salinity stress[J]. Journal of Experimental Biology, 218(12): 1907-1914. |
LIU Z F, GAO X Q, YU J X, et al, 2017. Effects of different salinities on growth performance, survival, digestive enzyme activity, immune response, and muscle fatty acid composition in juvenile American shad (Alosa sapidissima)[J]. Fish Physiology and Biochemistry, 43(3): 761-773. |
MADSEN S S, BERN H A, 1992. Antagonism of prolactin and growth hormone: impact on seawater adaptation in two salmonids, Salmo trutta and Oncorhynchus mykiss[J]. Zoological Science, 9(4): 775-784. |
MARTINEZ A S, CUTLER C P, WILSON G D, et al, 2005. Regulation of expression of two aquaporin homologs in the intestine of the European eel: effects of seawater acclimation and cortisol treatment[J]. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology, 288(6): R1733-R1743. |
MARTINEZ-CARDENAS L, VALDEZ-HERNÁNDEZ E F, GONZÁLEZ-DÍAZ A A, et al, 2014. Effect of salinity on growth and survival in juvenile opossum pipefish, Microphis brachyurus, in culture conditions[J]. Journal of the World Aquaculture Society, 45(5): 577-585. |
MOZANZADEH M T, SAFARI O, OOSOOLI R, et al, 2021. The effect of salinity on growth performance, digestive and antioxidant enzymes, humoral immunity and stress indices in two euryhaline fish species: Yellowfin seabream (Acanthopagrus latus) and Asian seabass (Lates calcarifer)[J]. Aquaculture, 534: 736329. |
MYLONAS C C, PAVLIDIS M, PAPANDROULAKIS N, et al, 2009. Growth performance and osmoregulation in the shi drum (Umbrina cirrosa) adapted to different environmental salinities[J]. Aquaculture, 287(1/2): 203-210. |
SAGHAFIANKHO S, SALATI A P, MORSHEDI V, et al, 2020. Effects of different levels of salinity on NKA and NKCC expression in Asian Sea Bass (Lates calcarifer)[J]. Turkish Journal of Fisheries and Aquatic Sciences, 21(1): 1-7. |
SAKAMOTO T, MCCORMICK S D, HIRANO T, 1993. Osmoregulatory actions of growth hormone and its mode of action in salmonids: a review[J]. Fish Physiology and Biochemistry, 11(1): 155-164. |
TANG C H, LAI D Y, LEE T H, 2012. Effects of salinity acclimation on Na+/K+–ATPase responses and FXYD11 expression in the gills and kidneys of the Japanese eel (Anguilla japonica)[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 163(3/4): 302-310. |
THORARENSEN H, GALLAUGHER P, FARRELL A P, 1996. Cardiac output in swimming rainbow trout, Oncorhynchus mykiss, acclimated to seawater[J]. Physiological Zoology, 69(1): 139-153. |
TIPSMARK C K, SØRENSEN K J, MADSEN S S, 2010. Aquaporin expression dynamics in osmoregulatory tissues of Atlantic salmon during smoltification and seawater acclimation[J]. Journal of Experimental Biology, 213(3): 368-379. |
VOLKOFF H, RØNNESTAD I, 2020. Effects of temperature on feeding and digestive processes in fish[J]. Temperature, 7(4): 307-320. |
XIN M, MA D Y, WANG B D, 2015. Chemicohydrographic characteristics of the Yellow Sea cold water mass[J]. Acta Oceanologica Sinica, 34(6): 5-11. |
YANG X D, FEIGE U, 1992. Heat shock proteins in autoimmune disease. From causative antigen to specific therapy?[J]. Experientia, 48(7): 650-656. |
YU F, ZHANG Z X, DIAO X Y, et al, 2006. Analysis of evolution of the Huanghai Sea Cold Water Mass and its relationship with adjacent water masses[J]. Acta Oceanologica Sinica, 28(5): 26-34. |
ZHANG X Y, WEN H S, QI X, et al, 2019. Na+-K+-ATPase and nka genes in spotted sea bass (Lateolabrax maculatus) and their involvement in salinity adaptation[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 235: 69-81. |
 2023, Vol. 54
2023, Vol. 54


