
中国海洋湖沼学会主办。
文章信息
- 李有志, 蒋宏雷, 刘哲宇, 曲涛, 江柳, 斯烈钢, 王志铮. 2023.
- LI You-Zhi, JIANG Hong-Lei, LIU Zhe-Yu, QU Tao, JIANG Liu, SI Lie-Gang, WANG Zhi-Zheng. 2023.
- 大黄鱼(Larimichthys crocea)幼鱼同生群内不同增重性能子群间的形质差异
- COMPARATIVE ANALYSIS OF JUVENILE LARGE YELLOW CROAKER (LARIMICHTHYS CROCEA) AMONG SUBGROUPS WITH DIFFERENT GROWTH PERFORMANCES FROM A SAME CONGENITAL GROUP IN MORPHOLOGY AND QUALITY
- 海洋与湖沼, 54(5): 1488-1497
- Oceanologia et Limnologia Sinica, 54(5): 1488-1497.
- http://dx.doi.org/10.11693/hyhz20230100015
文章历史
-
收稿日期:2023-01-24
收修改稿日期:2023-04-18
2. 宁波市海洋与渔业研究院 浙江宁波 315103
2. Ningbo Ocean and Fishery Research Institute, Ningbo 315103, China
大黄鱼(Larimichthys crocea)隶属于硬骨鱼纲(Osteichthyes)、鲈形目(Perciformes)、石首鱼科(Sciaenidae), 与小黄鱼(Larimichthys polyactis)、带鱼(Trichiurus lepturus)、曼氏无针乌贼(Sepiella japonica)并称舟山渔场四大传统知名渔产, 肉鲜味美, 营养经济价值高, 素有“海水国鱼”之美誉。自20世纪90年代初以来, 随着规模化全人工养殖关键技术的不断突破与相关配套装备的不断提升, 我国大黄鱼增养殖产业获得了蓬勃发展, 现已成为当前我国最为重要的海水鱼类养殖对象和近海增殖渔业的当家鱼种(江柳等, 2021)。据《2023中国渔业统计年鉴》(农业农村部渔业渔政管理局等, 2023)报道, 我国2022年大黄鱼养殖产量达25.768 3万t, 居全国主要海水养殖鱼类首位, 捕捞产量达3.709 8万t, 放流效果显著。
种内个体差异是自然界中普遍存在的现象, 尤以个体大小为代表的表型差异最为直观且常见。表型受遗传因子和环境因子的共同影响(Mayr et al, 1953), 作为物种在种质可塑性范围内对特定环境的形态修饰(Robinson et al, 1996; Wagner et al, 2001; Killen et al, 2011), 是划分并阐释水产动物同生群内不同抗逆等级子群间生存对策差异的重要生物学依据(王志铮等, 2016a, 2016b, 2017, 2018)。故, 大黄鱼同生群仔鱼的个体大小差异有随养殖时间推移而逐渐放大的趋势(竺俊全等, 2004), 不同生长性能大黄鱼养殖群体间在肠道菌群种类组成、致病菌含量和肌肉生长调控基因表达上均存在显著差异(李英英等, 2017; 张波等, 2023), 以及形态表型在辨析不同地理居群、养殖条件、遗传特征和不同性别大黄鱼上具重要指示作用(黄良敏等, 2006; 丁文超等, 2009; 谌微等, 2014; 王映等, 2016; 沈伟良等, 2017)等的研究结果, 均无疑为探究大黄鱼同生群内不同增重性能子群间形质特征差异的内在逻辑, 进而揭示造成各子群间生存适应对策分化的主因提供了重要线索和启示。鉴于此, 基于苗种质量是决定水产增养殖产业健康可持续发展的关键, 而国内外迄今尚未见有关大黄鱼苗种质量等级划分与评价方法研究的系统报道之实际, 本研究团队于2019年8月以宁波市象山西沪港海域板式网箱内养殖的同生群大黄鱼幼鱼为研究对象, 较系统开展了不同增重性能子群间形质差异的研究, 以期为精选大黄鱼优质增殖群体和指导大黄鱼幼鱼阶段的科学高效养殖提供参考。
1 材料与方法 1.1 实验用鱼宁波象山港湾水产苗种有限公司育苗车间出池后, 在象山西沪港海域的板式网箱(规格: 5 m×3 m×6 m)内常规养殖3个月的大黄鱼同生群幼鱼。随机捞取形体完整、无病无伤的健壮个体3 000 ind., 立即充气并停食暂养于若干直径1 m、高1.5 m的白色塑料桶(实际水位1.3 m)内。2 d后, 用BSA223S电子天平(赛多利斯科学仪器有限公司, 精度1 mg)逐尾称量体质量, 并根据农业试验研究中的小概率标准(P=0.05) (盖钧镒, 2000), 按其出现率将划分为A、B、C三个增重性能子群(图 1)。
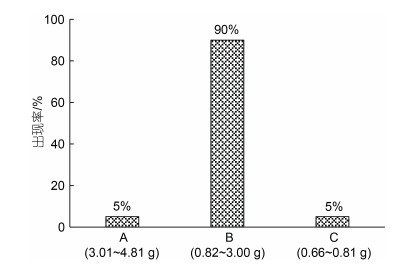 |
| 图 1 实验鱼各子群的出现率及其体质量范围 Fig. 1 The occurrence rate and body weight range of each subgroup of experimental fish 注: A、B、C三个子群的出现率分别为5%、90%、5% |
每一子群各随机选取30 ind.作为生物学测定样本。吸水纸抹净体表水分后, 借助数显游标卡尺(精度0.01 mm, 桂林广陆数字测控股份有限公司)和BSA223S电子天平逐尾测定体长(X1)、体宽(X2)、体高(X3)、肛长(X4)、头长(X5)、头宽(X6)、头高(X7)、眼后头长(X8)、眼径(X9)、鳃盖高(X10)、背鳍部体高(X11)、腹鳍间距(X12)、侧线长(X13)、尾柄长(X14)、尾柄高(X15)等15项体尺性状(具体测量方法见图 2和表 1)和体质量(BW)、净体质量(NW, 去除鳃和内脏后的体质量)、内脏质量(W1)、鳃质量(W2)等4项质量性状。
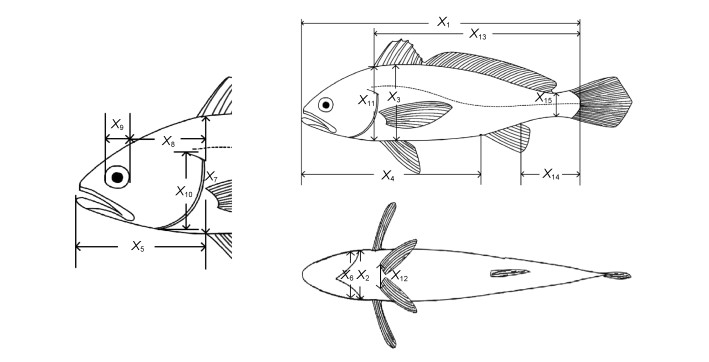 |
| 图 2 实验鱼体尺性状测量示意图 Fig. 2 Pictures showing the measurements of the body size traits of experimental fish 注: X1表示体长; X2表示体宽; X3表示体高; X4表示肛长; X5表示头长; X6表示头宽; X7表示头高; X8表示眼后头长; X9表示眼径; X10表示鳃盖高; X11表示背鳍部体高; X12表示腹鳍间距; X13表示侧线长; X14表示尾柄长; X15尾柄高 |
| 体尺性状 | 代码 | 定义 |
| 体长 | X1 | 吻端至尾椎骨末端的水平距离 |
| 体宽 | X2 | 鱼体躯干部左右两侧的最大水平距离 |
| 体高 | X3 | 鱼体背腹间的最大垂直距离 |
| 肛长 | X4 | 吻端至肛门孔的水平距离 |
| 头长 | X5 | 吻端至鳃盖骨后缘的最大水平距离 |
| 头宽 | X6 | 头部左右两侧的最大水平距离 |
| 头高 | X7 | 经过鳃盖后缘的背腹间垂直距离 |
| 眼后头长 | X8 | 眼球中心至鳃盖骨后缘的最大水平距离 |
| 眼径 | X9 | 眼眶前缘至眼眶后缘的水平距离 |
| 鳃盖高 | X10 | 鳃盖骨在鱼体背腹部两交叉点间的垂直距离 |
| 背鳍部体高 | X11 | 经过背鳍前点的体高 |
| 腹鳍间距 | X12 | 腹鳍基部内侧的水平距离 |
| 侧线长 | X13 | 侧线起始点间的水平距离 |
| 尾柄长 | X14 | 臀鳍基部末端至尾椎骨末端的水平距离 |
| 尾柄高 | X15 | 尾柄部的最小垂直距离 |
根据所得测定数据, 采用SPSS24.0软件计算本研究所涉3个实验子群的各项生物学测定性状和形质评价指标的均值和标准差, 并检验组间差异显著性(视P < 0.05为显著水平); 根据形质评价指标的均值, 在计算3个实验子群间欧氏距离的基础上, 进行聚类分析; 按曲涛等(2022)的方法就形质评价指标进行主成分分析和判别分析, 并参照Li等(2005)的方法计算判别准确率和综合判别率以验证所建Fisher分类函数方程组的可靠性。
2 结果 2.1 生物学测定性状由表 2可见, 除X15呈A > B≈C外, 其余18项性状均呈A > B > C (P < 0.05), 表明A、B、C子群在生物学测定性状上具良好的区分度, 即大黄鱼幼鱼的生物学性状测定值有随其增重性能增强而显著增大的趋势, 反之亦然。
| 性状类型 | 性状/代码 | 单位 | A | B | C |
| M±SE | M±SE | M±SE | |||
| 质量性状 | 体质量/W1 | g | 3.446±0.428a | 1.966±0.507b | 0.738±0.036c |
| 净体质量/W2 | g | 2.383±0.377a | 1.305±0.395b | 0.374±0.052c | |
| 内脏质量/W3 | g | 1.083±0.218a | 0.621±0.151b | 0.350±0.055c | |
| 鳃质量/W4 | g | 0.103±0.021a | 0.056±0.016b | 0.026±0.011c | |
| 体尺性状 | 体长/X1 | mm | 59.62±3.74a | 49.39±5.22b | 30.41±3.26c |
| 体宽/X2 | mm | 6.70±0.79a | 5.65±1.33b | 3.96±0.56c | |
| 体高/X3 | mm | 16.44±0.97a | 13.87±1.43b | 7.97±1.03c | |
| 肛长/X4 | mm | 35.24±1.89a | 29.56±3.19b | 20.99±1.38c | |
| 头长/X5 | mm | 16.75±1.19a | 14.13±1.58b | 8.67±0.95c | |
| 头宽/X6 | mm | 7.57±0.58a | 6.51±0.98b | 3.89±0.56c | |
| 头高/X7 | mm | 15.88±0.91a | 13.37±1.28b | 8.57±0.91c | |
| 眼后头长/X8 | mm | 8.75±0.75a | 7.39±0.91b | 4.57±0.57c | |
| 眼径/X9 | mm | 4.25±0.66a | 3.71±0.61b | 2.66±0.62c | |
| 鳃盖高/X10 | mm | 14.18±1.13a | 12.53±1.49b | 7.97±1.22c | |
| 背鳍部体高/X11 | mm | 16.14±1.22a | 13.32±1.38b | 8.64±1.06c | |
| 腹鳍间距/X12 | mm | 3.93±0.44a | 3.25±0.44b | 1.82±0.28c | |
| 侧线长/X13 | mm | 43.22±2.93a | 36.89±4.69b | 15.21±1.16c | |
| 尾柄长/X14 | mm | 15.18±1.17a | 13.00±1.79b | 5.85±0.80c | |
| 尾柄高/X15 | mm | 4.59±1.38a | 3.68±0.99b | 3.19±0.59b | |
| 注: 上标a、b、c表示组间差异(P < 0.05), 字母相同则无显著差异(P > 0.05), 下同 | |||||
由表 3可见, 各子群间在本研究所涉形质评价指标上的异同表现为: (1) 5项质量比例中, 除C1、C4呈A≈B > C外, 其余指标均呈A≈B < C; (2) 17项体尺比例中, 除L4和L9呈A≈B≈C (P > 0.05), L5仅B、C间存在显著差异(P < 0.05), 呈B > C外, 其余指标均呈A≈B > C; (3) 重长系数K和类肥满度指数F分别呈A > B > C (P < 0.05)和A≈B < C。经计算, 在本研究所涉24项形质评价指标中, A-B、B-C、A-C间的指标相似性指数分别为95.8%、8.3%和12.5%。综上可知, 三子群中仅A、B子群间在形质特征上具高度相似性, 在增重性能等级划分上分辨度最高的形质变量为K, 最低的则为L4和L9。
| 性状类型 | 形质评价指标 | 代码 | 实验子群 | ||
| A (M±SE) | B (M±SE) | C (M±SE) | |||
| 质量比例 | 净体质量/体质量 | C1 | 0.686±0.052a | 0.655±0.062a | 0.509±0.083b |
| 内脏质量/体质量 | C2 | 0.314±0.052a | 0.326±0.085a | 0.475±0.077b | |
| 鳃质量/体质量 | C3 | 0.030±0.004a | 0.029±0.005a | 0.036±0.015b | |
| 鳃质量/内脏质量 | C4 | 0.098±0.024a | 0.094±0.029a | 0.078±0.038b | |
| 鳃质量/净体质量 | C5 | 0.043±0.005a | 0.044±0.009a | 0.071±0.027b | |
| 体尺比例 | 头宽/肛长 | L1 | 0.21±0.02a | 0.22±0.02a | 0.19±0.03b |
| 头高/肛长 | L2 | 0.45±0.02a | 0.45±0.03a | 0.41±0.05b | |
| 眼后头长/肛长 | L3 | 0.25±0.02a | 0.25±0.02a | 0.22±0.03b | |
| 眼径/头长 | L4 | 0.19±0.01a | 0.19±0.01a | 0.19±0.03a | |
| 鳃盖高/肛长 | L5 | 0.40±0.03ab | 0.43±0.04a | 0.38±0.07b | |
| (头长×头宽)0.5/肛长 | L6 | 0.32±0.01a | 0.32±0.02a | 0.28±0.03b | |
| (头高×头宽)0.5/肛长 | L7 | 0.31±0.01a | 0.32±0.02a | 0.27±0.03b | |
| 体长/肛长 | L8 | 1.69±0.06a | 1.67±0.08a | 1.45±0.17b | |
| 体宽/肛长 | L9 | 0.19±0.02a | 0.19±0.04a | 0.19±0.03a | |
| 侧线长/肛长 | L10 | 1.23±0.06a | 1.25±0.08a | 0.73±0.06b | |
| 背鳍部体高/肛长 | L11 | 0.46±0.03a | 0.45±0.03a | 0.41±0.07b | |
| 腹鳍间距/肛长 | L12 | 0.11±0.01a | 0.11±0.01a | 0.09±0.01b | |
| (体长×体高)0.5/肛长 | L13 | 0.89±0.03a | 0.89±0.04a | 0.74±0.07b | |
| (体长×体宽)0.5/肛长 | L14 | 0.57±0.03a | 0.56±0.07a | 0.52±0.07b | |
| (体高×体宽)0.5/肛长 | L15 | 0.30±0.02a | 0.30±0.04a | 0.27±0.03b | |
| 尾柄长/肛长 | L16 | 0.43±0.02a | 0.44±0.04a | 0.28±0.04b | |
| 尾柄高/肛长 | L17 | 0.13±0.04a | 0.13±0.03a | 0.15±0.03b | |
| 重长系数 | 体质量/(0.1×体长) | K | 0.577±0.046a | 0.392±0.067b | 0.245±0.027c |
| 类肥满度指数 | 体质量/(体长×体高×体宽) | F | 0.532±0.074a | 0.520±0.108a | 0.809±0.192b |
由图 3可见, A、B子群间基于各项形质评价指标均值的欧式距离最小, 首先被聚为一支, 而后再与C子群聚在一起, 表明子群C的形质特征与A、B子群均已出现明显乖离, 即绝大多数实验个体的形质特征有向高增重性能等级子群趋同的倾向。
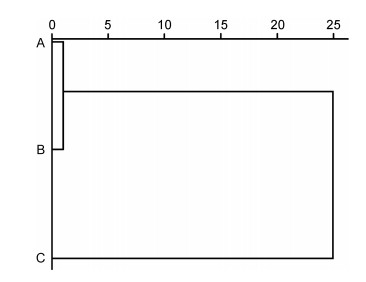 |
| 图 3 各实验子群间的聚类图 Fig. 3 Clustering diagram of each experimental subgroup |
经检验, 本研究所涉各项形质评价指标的相关系数与单位矩阵间具极显著差异(P < 0.01)且适合度尚可(KMO=0.765), 有进行因子分析的必要。相关结果见表 4。经分析, 所获特征根值大于1的5个主成分, 其方差累积贡献率达81.055%, 表明它们为可概括A、B、C子群间形质特征差异的公共因子。其中, PC1特征根值10.997, 方差贡献率45.820%, 主要影响变量(载荷绝对值大于0.5) 9个, 绝对值排序为C2 > L10 > C1 > K > L16 > L13 > F > L12 > L8; PC2特征根值3.087, 方差贡献率12.864%, 主要影响变量5个, 排序为L9 > L14 > L15 > L17 > L11; PC3特征根值2.388, 方差贡献率9.952%, 主要影响变量4个, 排序为L2 > L5 > L3 > L7; PC4与PC5的特征根值分别为1.970和1.010, 方差贡献率分别为8.210%和4.209%, 主要影响变量均为3个, 排序分别为C3 > C4 > C5和L4 > L1 > L6。由此可知, 特征根值、方差贡献率、主要影响变量个数自PC1至PC5均表露出由急剧下降至趋于稳定的态势, 表明PC1在甄别A、B、C子群间形质差异上较其他主成分具极端重要性。绘制PC1和PC2得分散布图, 得图 4。由图 4可见, A、B、C沿FAC1轴自右向左虽大体上均各自占据独立的区域, 但B子群与A、C子群间均存在一定程度重叠, 尤以A、B间为甚, 这既真实反映了B子群为A、C子群间的过渡群体, 以及B子群形质特征有明显向A子群靠拢的倾向的事实, 也客观指示了PC1中含有分辨A、B和B、C子群间形质特征的干扰变量。故, 需进一步做判别分析以进一步提高甄别A、B、C子群的分辨率。
| 形质评价指标 | 代码 | 载荷 | |||||
| PC1 | PC2 | PC3 | PC4 | PC5 | |||
| 净体质量/体质量 | C1 | 0.812* | 0.031 | 0.259 | 0.052 | 0.068 | |
| 内脏质量/体质量 | C2 | –0.880* | –0.018 | 0.041 | –0.138 | –0.110 | |
| 鳃质量/体质量 | C3 | –0.150 | –0.006 | –0.012 | 0.958* | 0.013 | |
| 鳃质量/内脏质量 | C4 | 0.517 | 0.028 | –0.010 | 0.819* | 0.022 | |
| 鳃质量/净体质量 | C5 | –0.490 | –0.019 | –0.142 | 0.800* | –0.037 | |
| 头宽/肛长 | L1 | 0.438 | 0.380 | 0.303 | –0.189 | 0.632* | |
| 头高/肛长 | L2 | 0.268 | 0.199 | 0.768* | –0.033 | 0.126 | |
| 眼后头长/肛长 | L3 | 0.408 | 0.097 | 0.677* | –0.033 | –0.031 | |
| 眼径/头长 | L4 | –0.097 | –0.159 | 0.032 | 0.123 | 0.937* | |
| 鳃盖高/肛长 | L5 | 0.015 | 0.348 | 0.732* | 0.000 | 0.240 | |
| (头长×头宽)0.5/肛长 | L6 | 0.554 | 0.344 | 0.379 | –0.150 | 0.555* | |
| (头高×头宽)0.5/肛长 | L7 | 0.442 | 0.351 | 0.585* | –0.141 | 0.487 | |
| 体长/肛长 | L8 | 0.629* | 0.479 | 0.357 | –0.205 | –0.194 | |
| 体宽/肛长 | L9 | –0.052 | 0.921* | 0.101 | 0.059 | 0.081 | |
| 侧线长/肛长 | L10 | 0.845* | 0.071 | 0.353 | –0.209 | 0.102 | |
| 背鳍部体高/肛长 | L11 | 0.258 | 0.530* | 0.415 | –0.289 | –0.089 | |
| 腹鳍间距/肛长 | L12 | 0.651* | 0.179 | 0.447 | –0.018 | –0.033 | |
| (体长×体高)0.5/肛长 | L13 | 0.713* | 0.366 | 0.483 | –0.151 | –0.101 | |
| (体长×体宽)0.5/肛长 | L14 | 0.247 | 0.913* | 0.236 | –0.052 | –0.031 | |
| (体高×体宽)0.5/肛长 | L15 | 0.341 | 0.796* | 0.354 | 0.000 | 0.045 | |
| 尾柄长/肛长 | L16 | 0.794* | 0.067 | 0.391 | –0.143 | 0.100 | |
| 尾柄高/肛长 | L17 | –0.389 | 0.565* | 0.037 | 0.113 | 0.104 | |
| 体质量/(0.1×体长) | K | 0.799* | 0.020 | 0.099 | –0.149 | 0.108 | |
| 体质量/(体长×体高×体宽) | F | –0.682* | –0.574 | –0.176 | 0.073 | 0.121 | |
| 特征值 | 10.997 | 3.087 | 2.388 | 1.970 | 1.010 | ||
| 贡献率(%) | 45.820 | 12.864 | 9.952 | 8.210 | 4.209 | ||
| 累积贡献率(%) | 45.820 | 58.684 | 68.636 | 76.846 | 81.055 | ||
| 注: *表示各主成分中的主要影响变量 | |||||||
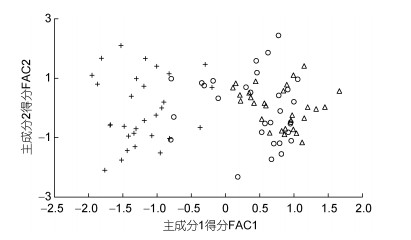 |
| 图 4 主成分得分散布图 Fig. 4 The scatter diagram of principle component 注: △表示A子群; ○表示B子群; +表示子群。下同 |
经逐步导入剔除法, 筛留判别贡献率较大的重长系数K和L10 (侧线长/肛长)进行判别分析。F检验亦表明K、L10均达到极显著水平(P < 0.01), 并据此建立用于判别A、B、C子群的Fisher分类函数方程组于表 5。经计算, A、B、C子群的判别准确率P1依次为100.00%、93.33%和100.00%, P2依次为93.75%、100.00%和100.00%, 综合判别准确率为97.78% (表 6)。与此同时, 图 5所示典型判别函数得分散布图, 无疑更直观证实了上述分类判别结果的可靠性。
| 实验子群 | 自变量系数 | 常数项 | |
| K | L10 | ||
| A | 147.494 | 261.577 | -204.079 |
| B | 69.078 | 280.552 | -189.57 |
| C | 47.366 | 162.110 | -65.784 |
| 实验子群 | 样本数/ind. | 预测分类 | 判别准确率/% | 综合判别率/% | ||||
| A | B | C | P1 | P2 | ||||
| A | 30 | 30 | 0 | 0 | 100.00 | 93.75 | 97.78 | |
| B | 30 | 2 | 28 | 0 | 93.33 | 100.00 | ||
| C | 30 | 0 | 0 | 30 | 100.00 | 100.00 | ||
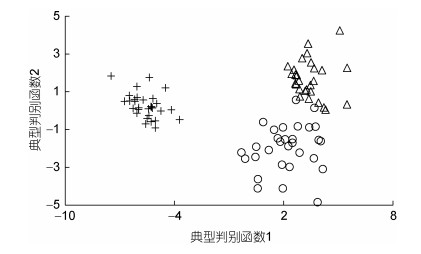 |
| 图 5 各实验子群的典型判别函数散布图 Fig. 5 Typical discriminant function scatter plots of each experimental subgroup |
鱼类网箱养殖模式具鱼群拥挤度高、饲料投喂频次少且时长短的特点, 故养殖于网箱内的鱼类常处于高烈度种内食物竞争状态, 致使能优先获得食物的个体往往能在种内竞争中处于强势地位, 反之亦然。尽可能增加获利并减少消耗, 是生物选择并实施增重对策的底层逻辑。因此, 养殖于网箱内的鱼类同生群增重性能等级的分野势必与其在食物竞争中所选择的“获利-消耗”模式有着极为密切的关系。无疑, 本研究所涉A、B、C子群间形质特征的差异(表 3), 应与它们针对所处网箱养殖生境选择与自身竞食能力相适配的“获利-消耗”模式密切相关。即: (1) 重长系数K作为衡量单位体长生物量的评价指标, 是表征机体营养状况和体质强壮程度的重要形质变量。感觉系统在鱼类捕食过程中起着至关重要的作用(Evans et al, 2004; Coombs et al, 2014), 侧线感觉系统不仅能感知和定位猎物(梁旭方, 1998), 而且还具有过滤或消除嘈杂环境噪音的功能(Engelmann et al, 2000)。由此, 本研究中K为唯一呈A > B > C (P < 0.05)的形质评价指标, 以及K、L10组合成为判别A、B、C子群的关键变量组合的结果(表 3, 表 5), 既揭示了以体质强壮程度和竞食灵敏度为代表的食物抢夺能力在表征大黄鱼幼鱼增重性能等级上的极端重要性的同时, 也映射了切实提高食物保障水平是大黄鱼幼鱼权衡“获利-消耗”的优先选项; (2) “器官代谢活性假说”指出, 活性器官的脏器系数与机体代谢水平呈正相关, 而惰性组织与体质量的比例则与此相反(Itazawa et al, 1983; Oikawa et al, 1992)。故, 表 3所示C2 (内脏质量/体质量)、C3 (鳃质量/体质量)和C5 (鳃质量/净体质量)均呈A≈B < C, 以及C1 (净体质量/体质量)呈A≈B > C的结果, 在客观反映子群C的机体代谢水平显著高于A、B子群的同时, 也隐含了C子群因采取高企摄食运动代谢水平以弥补食物抢夺能力不足的取食机制, 致使其落入高能耗的生长窘境; (3) 据报道, 鱼类的摄食代谢和运动代谢是二个相辅相成的重要生理过程(Hicks et al, 2004; Fu et al, 2007), 可根据运动和摄食这两个重要生理过程的相对重要性, 分为优先保证运动或者摄食的“优先模式” (prioritization model)和同时保证运动和摄食的“添加模式”(additivity model) (Blaikie et al, 1996; Alsop et al, 1997)。故, 在本研究所涉19项生物学测定指标中均呈A > B (P < 0.05), 和24项形质评价指标中除重长系数K呈A > B (P < 0.05)外, 其余均呈A≈B (P > 0.05)的结果(表 2, 表 3), 既客观反映了体质强壮程度差异是致大黄鱼幼鱼生物学测定表型出现显著分化的主因, 也揭示了在网箱养殖生境下大黄鱼幼鱼以专注抢食为导向形成并固化了优先保障摄食运动代谢的生存对策。综上可知, 为实施并贯彻以保障摄食运动为核心的“优先模式”, A子群依托其强劲的竞食优势, 建立了优先获得食物保障的高收益摄食策略, C子群为有效弥补在竞食中的劣势地位, 固化了通过显著提高机体代谢水平以大幅增加觅食运动量的低收益摄食策略, 而竞食能力介于A、C子群之间的B子群, 则确立了通过积极抢食以努力提高食物保障程度的摄食策略。
3.2 增重性能与形质特征间的相关性游泳运动作为支持鱼类捕食活动的重要生理行为, 其运动能力与运动方式势必与所采取的摄食策略有着极为密切的关联, 并将深刻影响其增重机制。据报道, 鱼类在持续运动能力与暴发运动能力之间存在权衡, 即当其持续运动能力获得显著增强时, 暴发运动能力则可能会变弱, 反之亦然; 对于海洋洄游性鱼类而言, 需具较强的持续游泳能力(傅世建等, 2008)。研究发现, 体高的显著增大有助于提升中华倒刺鲃和大黄鱼等纺锤体型鱼类的高速游泳能力(李秀明等, 2013; 沈伟良等, 2017)。故, 陈慧等(2007)报道的网箱养殖大黄鱼体高与体长间的比值普遍大于野生大黄鱼, 以及王映等(2016)报道的室内人工养殖大黄鱼体高与体长间的比值显著大于野生大黄鱼的结果, 均指示了暴发游泳较持续运动对促进养殖大黄鱼生长更具重要性的事实。由此, 结合本研究分析所得A、B、C子群的摄食策略差异, 可导出网箱养殖生境下大黄鱼幼鱼的暴发运动在降低机体代谢能耗、提高抢夺食物成功率和优先获得食物保障上较持续运动更具增重生理生态重要性的推论, 即暴发游泳运动能力越强, 增重越快, 持续游泳运动能力越强, 则增重越慢, 反之亦然。故, 可判定持续运动和暴发运动在运动量上占比的多寡是导致A、B、C子群增重性能差异的重要原因。
经剖析, 本研究通过对形质特征进行降维处理获得的5个相互独立的公共因子PC1、PC2、PC3、PC4和PC5 (表 4), 在揭示引起A、B、C子群间形质特征和摄食策略差异的真实原因的同时, 也进一步支持了持续运动和暴发运动量占比是导致三者增重性能差异的重要原因的可靠性。即: (1) 鱼类的游泳能力与其体长、体型以及鳍的发达程度均密切相关(Webb, 1977; Peake et al, 1998)。据报道, 绝大多数鱼类游泳时主要通过鱼体两侧或腹背肌肉的交替收缩, 由身体前部向尾部依次收缩各肌肉群, 使鱼尾摆动来获得向前的推动力(周应祺, 1985), 并通过背鳍、臀鳍和腹鳍的协助来保持鱼体平衡(李林春, 2009)。因此, 由指示机体代谢强度的C1和C2、表征暴发游泳能力的L8、L13和L16、维系鱼体游泳平衡能力的L1、反映机体生物量积累水平的F, 与被筛留的判别变量组合K、L10共同组成的PC1主要影响变量(表 4, 表 5), 既集中反映了在网箱养殖生境下大黄鱼幼鱼的暴发运动能力、鱼体平衡能力、食物感知与定位能力、体质强壮程度和机体营养状况对显著提升竞食能力的支撑作用, 也映射了提升竞食有效性对降低机体代谢能耗的助益效应。由此表明, 获取食物的难易程度既是影响A、B、C子群选择不同摄食策略的关键因素, 也是导致表 2所示它们在生物学测定性状表露“马太效应”的主要原因。故, 可将PC1归为与机体代谢、鱼体平衡、食物感知与定位、体质与营养状况以及运动方式相关的竞食能力因子; (2) 周应祺(1985)研究发现, 鲐鱼和鳕鱼等纺锤形体型鱼类游泳运动时头部的摆幅最小, 之后波幅沿着鱼体从头至尾呈指数级增大。也就是说, 鱼类的体型框架对推进其游泳运动具重要作用, 尤以头部之后的体型为甚。由此, PC2主要影响变量中除L9呈A≈B≈C (P > 0.05)外, 余下的L11、L14、L15和L17均呈A≈B > C, 以及这些主要影响变量所涵盖的体宽、背鳍部体高、体高、体长和尾柄高等体型框架关键信息均呈A > B > C (P < 0.05)的结果(表 2, 表 3, 表 4), 在进一步印证了浙江中、北部海域大黄鱼幼鱼养殖群体尚处于以长长为主的生长阶段, 与其体质量关系最密切的体尺性状为体长和体高(许益铵, 2014; 江柳等, 2021)的可靠性的同时, 也揭示了这些体型框架变量所隐含的暴发运动能力是导致大黄鱼幼鱼同生群内出现增重性能差异的主要原因。故, 可将PC2归为与暴发运动能力相关的体型框架比例因子; (3) 大黄鱼的视觉、嗅觉器官和鳃均位于头部。研究发现, 视觉在鱼类运动过程中具补偿运动以保持视野稳定的作用(Collin et al, 2003)。故, 眼径呈A > B > C (P < 0.05) (表 2), 和L4呈A≈B≈C (P > 0.05)所示眼径与肛长等速生长的结果(表 3), 表明寻食视野在促进养殖大黄鱼幼鱼的生长上具重要作用。根据“器官代谢活性假说”(Itazawa et al, 1983; Oikawa et al, 1992)可知, 表 3中C3 (鳃质量/体质量)和C5 (鳃质量/净体质量)均呈A≈B < C)所示的C子群的呼吸代谢水平显著高于A、B子群, 和C4(鳃质量/内脏质量)呈A≈B > C所示的C子群的呼吸压力显著大于A、B子群的结果, 在客观反映C子群为弥补视野不足通过显著提升呼吸代谢水平以增加寻食运动频次的同时, 也揭示了由寻食运动频次增加引起的呼吸供氧压力过大是导致C子群内脏中鳃组织增重受抑的根本原因。鉴于主成分越靠后误差越大这一实际(Backhaus et al, 2005), 且PC3、PC4和PC5主要影响变量所涵盖的头宽、头高、眼后头长、鳃盖高、头长等头部框架信息, 均与寻食视野和鳃组织所占空间密切相关, 故可将PC3、PC4和PC5统归为与食物搜寻能力相关的头部框架比例因子。
综上, 上述公共因子所涵盖的竞食能力、暴发运动能力、食物搜寻能力等一系列与增重性能密切相关的生物学功能信息, 既真实反映了暴发运动能力和食物搜寻能力对竞食能力的支撑作用, 以及竞食能力对暴发运动能力和食物搜寻能力的牵引作用, 更揭示了竞食能力、暴发运动能力和食物搜寻能力的三维互动是导致A、B、C子群增重性能产生显著异的内在本质。由此, 建议在大黄鱼网箱养殖具体生产实践中, 一方面可通过适当增加投喂频次并延长投喂时长, 以切实防止个体表型差异过大的现象, 另一方面应及时实施分箱养殖, 通过有效缓减种内食物竞争烈度, 使生长严重受抑个体通过竞争释放(competion release)有效释放生长潜能。
4 结论(1) 从生物学测定性状看, 大黄鱼幼鱼在增重性能上具较大的定向选育价值和潜力; 从形质评价指标看, 绝大多数个体在形质特征上有向高增重性能等级子群趋同的倾向, 其中唯一可清晰分辨A、B、C子群的形质变量为重长系数K。
(2) 大黄鱼幼鱼在网箱养殖生境下贯彻并实施了以优先保障摄食运动代谢为核心的生存对策。其中, A子群依托强劲的竞食优势, 建立了优先获得食物保障的高收益摄食策略, C子群为有效弥补在竞食中所处的劣势地位, 固化了通过显著提高机体代谢水平以大幅增加觅食运动量的低收益摄食策略, 而B子群则确立了通过积极争抢以努力提高食物保障程度的摄食策略。
(3) 网箱养殖生境下, 持续运动和暴发运动在大黄鱼幼鱼运动量上占比的多寡是导致A、B、C子群增重性能差异的重要原因。以判别贡献率较大的重长系数K和L10 (侧线长/肛长)为自变量, 建立的Fisher分类函数方程组可较清晰区分A、B、C子群实验个体, 综合判别准确率达97.78%。
(4) 竞食能力、暴发运动能力和食物搜寻能力的三维互动是导致网箱养殖生境下大黄鱼幼鱼同生群内个体间增重性能产生显著差异的内在本质。在具体网箱养殖生产实践中, 一方面可通过适当增加投喂频次并延长投喂时长, 切实防止个体表型差异过大的现象, 另一方面应及时实施分箱养殖, 通过有效缓减种内食物竞争烈度, 使生长严重受抑个体通过竞争释放有效释放生长潜能。
丁文超, 李明云, 管丹冬, 等, 2009. 大黄鱼4个家系的形态差异分析[J]. 宁波大学学报(理工版), 22(2): 185-190. |
王志铮, 朱海军, 任夙艺, 等, 2016a. 日本囊对虾(Marsupenaeus japonicus)秋繁仔虾形态表型与抗流性能间的相关性[J]. 海洋与湖沼, 47(2): 360-368. |
王志铮, 祝本强, 任夙艺, 等, 2016b. 日本囊对虾(Marsupenaeus japonicus)秋繁同生群仔虾不同耐干露性能群体间的形态表型差异[J]. 海洋与湖沼, 47(3): 673-680. |
王志铮, 张思铭, 蒋宏雷, 等, 2017. 日本囊对虾(Marsupenaeus japonicus)秋繁仔虾形态表型对氨氮耐受性能的影响效应[J]. 海洋与湖沼, 48(5): 1092-1099. |
王志铮, 张晓霞, 任夙艺, 等, 2018. 日本囊对虾(Marsupenaeus japonicus)秋繁同生群仔虾不同耐寒性能群体间的形态表型差异[J]. 海洋与湖沼, 49(1): 142-150. |
王映, 柯巧珍, 刘家富, 等, 2016. 大黄鱼养殖群体和野生群体形态、鳞片及耳石特征比较[J]. 海洋渔业, 38(2): 149-156. |
曲涛, 申屠琰, 牟恩镟, 等, 2022. 越冬对池塘专养模式下中华鳖(Trionyx sinensis)形质的影响特征[J]. 海洋与湖沼, 53(3): 654-663. |
江柳, 傅荣兵, 蒋宏雷, 等, 2021. 大黄鱼幼鱼表型性状对体质量和净体质量的影响效果分析[J]. 浙江海洋大学学报(自然科学版), 40(3): 242-246. |
许益铵, 2014. 舟山附近海域大黄鱼遗传多样性及家系的生长性状研究[D]. 舟山: 浙江海洋学院.
|
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会, 2023. 2023中国渔业统计年鉴[M]. 北京: 中国农业出版社, 22, 39.
|
李秀明, 王川, 于丽娟, 等, 2013. 有氧运动训练对中华倒刺鲃幼鱼形态特征的影响[J]. 西南大学学报(自然科学版), 35(7): 21-26. DOI:10.13718/j.cnki.xdzk.2013.07.028 |
李英英, 陈曦, 宋铁英, 2017. 不同生长速度的大黄鱼肠道菌群结构的差异[J]. 大连海洋大学学报, 32(5): 509-513. DOI:10.16535/j.cnki.dlhyxb.2017.05.002 |
李林春, 2009. 实用鱼类学[M]. 北京: 化学工业出版社, 56-157.
|
沈伟良, 吴雄飞, 申屠基康, 等, 2017. 不同饵料及养殖环境对大黄鱼(Larimichthys crocea)形态差异的影响[J]. 渔业科学进展, 38(6): 70-77. |
张波, 姜丹, 张东玲, 等, 2023. 大黄鱼生长速率差异个体肌肉组织的转录组比较分析[J]. 水产学报, 47(3): 85-98. |
陈慧, 陈武, 林国文, 等, 2007. 官井洋种群网箱养殖大黄鱼的形态特征与生长式型[J]. 海洋渔业, 29(4): 331-336. |
竺俊全, 焦海峰, 2004. 人工育苗条件下大黄鱼仔、稚鱼的摄食与生长[J]. 宁波大学学报(理工版), 17(4): 384-388. |
周应祺, 1985. 鱼类最高游速的研究[J]. 水产学报, 9(2): 105-120. |
黄良敏, 谢仰杰, 苏永全, 2006. 闽-粤东族与岱衢族养殖大黄鱼的遗传多样性研究[J]. 厦门大学学报(自然科学版), 45(6): 836-840. |
盖钧镒, 2000. 试验统计方法[M]. 北京: 中国农业出版社, 49.
|
梁旭方, 1998. 鱼类侧线机械感觉猎物识别和定位的研究进展[J]. 动物学杂志, 33(2): 49-52. |
谌微, 王盼盼, 肖世俊, 等, 2014. 大黄鱼形态指标体系及雌雄差异分析[J]. 集美大学学报(自然科学版), 19(6): 401-408. |
傅世建, 曹振东, 谢小军, 2008. 鱼类摄食代谢和运动代谢研究进展[J]. 动物学杂志, 43(2): 150-159. |
ALSOP D H, WOOD C M, 1997. The interactive effects of feeding and exercise on oxygen consumption, swimming performance and protein usage in juvenile rainbow trout (Oncorhynchus mykiss)[J]. The Journal of Experimental Biology, 200(17): 2337-2346. |
BACKHAUS K, ERICHSON B, PLINKE W, 2005. Multivariate Statistical Analysis[M]. Berdelberg: Springer.
|
BLAIKIE H B, KERR S R, 1996. Effect of activity level on apparent heat increment in Atlantic cod, Gadus morhua[J]. Canadian Journal of Fisheries and Aquatic Sciences, 53(9): 2093-2099. |
COLLIN S P, SHAND J, 2003. Retinal sampling and the visual field in fishes [M] // COLLIN S P, MARSHALL N J. Sensory Processing in Aquatic Environments. New York: Springer: 139-169.
|
COOMBS S, BLECKMANN H, FAY R R, et al, 2014. The Lateral Line System[M]. New York: Springer, 121-150.
|
ENGELMANN J, HANKE W, MOGDANS J, et al, 2000. Hydrodynamic stimuli and the fish lateral line[J]. Nature, 408(6808): 51-52. |
EVANS B I, BROWMAN H I, 2004. Variation in the development of the fish retina[J]. American Fisheries Society Symposium, 40: 145-166. |
FU S J, CAO Z D, PENG J L, 2007. Effect of feeding and fasting on excess post-exercise oxygen consumption in juvenile southern catfish (Silurus meridionalis Chen)[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 146(3): 435-439. |
HICKS J W, BENNETT A F, 2004. Eat and run: prioritization of oxygen delivery during elevated metabolic states[J]. Respiratory Physiology & Neurobiology, 144(2/3): 215-224. |
ITAZAWA Y, OIKAWA S, 1983. Metabolic rates in excised tissues of carp[J]. Experientia, 39(2): 160-161. |
KILLEN S S, MARRAS S, MCKENZIE D J, 2011. Fuel, fasting, fear: routine metabolic rate and food deprivation exert synergistic effects on risk-taking in individual juvenile European sea bass[J]. Journal of Animal Ecology, 80(5): 1024-1033. |
LI S F, WANG C H, CHENG Q Q, 2005. Morphological variations and phylogenesis of four strains in Cyprinus carpio[J]. Journal of Fisheries of China, 29(5): 606-611. |
MAYR E, LINSLEY E G, USINGER R L, 1953. Methods and Principles of Systematic Zoology[M]. New York: McGraw-Hill, 23-39, 125-154.
|
OIKAWA S, TAKEMORI M, ITAZAWA Y, et al, 1992. Relative growth of organs and parts of a marine teleost, the porgy, Pagrus major, with special reference to metabolism-size relationships[J]. Japanese Journal of Ichthyology, 39(3): 243-249. |
PEAKE S, MCKINLEY R S, 1998. A re-evaluation of swimming performance in juvenile salmonids relative to downstream migration[J]. Canadian Journal of Fisheries and Aquatic Sciences, 55(3): 682-687. |
ROBINSON B W, WILSON D S, 1996. Genetic variation and phenotypic plasticity in a trophically polymorphic population of pumpkinseed sunfish (Lepomis gibbosus)[J]. Evolutionary Ecology, 10(6): 631-652. |
WAGNER E J, ARNDT R E, BROUGH M, 2001. Comparative tolerance of four stocks of cutthroat trout to extremes in temperature, salinity, and hypoxia[J]. Western North American Naturalist, 61(4): 434-444. |
WEBB P W, 1977. Effects of size on performance and energetỉcs of fish [M] // PEDLEY J J. Scale Effects in Animal Locomotion. New York: Academic Press: 315-331.
|
 2023, Vol. 54
2023, Vol. 54


