
中国海洋湖沼学会主办。
文章信息
- 刘昊, 刘晓坤, 党奇峰, 刘成圣. 2023.
- LIU Hao, LIU Xiao-Kun, DANG Qi-Feng, LIU Cheng-Sheng. 2023.
- 聚乙烯亚胺修饰的羧甲基甲壳质微球对Cr(Ⅵ)的吸附研究
- POLYETHYLENEIMINE-MODIFIED CARBOXYMETHYL CHITIN MICROSPHERES FOR ADSORPTION TOWARD CR(Ⅵ) IN DIFFERENT AQUEOUS MEDIA
- 海洋与湖沼, 54(6): 1597-1610
- Oceanologia et Limnologia Sinica, 54(6): 1597-1610.
- http://dx.doi.org/10.11693/hyhz20230400091
文章历史
-
收稿日期:2023-04-24
收修改稿日期:2023-05-09
2. 青岛海洋生物医药研究院 山东青岛 266075
2. Marine Biomedical Research Institute of Qingdao, Qingdao 266075, China
水环境的重金属(heavy metals, HMs)污染越来越受到人们的普遍关注, 这些HMs主要来自疏于管理的工业废水、农业和家庭污水(Patel et al, 2018)。含有HMs的废水或污水流入河流、湖泊、地下水或沿海水域, 对水环境构成了严重的威胁。据报道, 与50~100年前的记录值相比, 在过去几十年中海水中所含重金属的浓度增加了5~10倍(Mashiatullah et al, 2013)。在HMs家族中, 铬(Cr)具有极强的毒性和致癌性, 其主要以三价铬Cr(Ⅲ)和六价铬Cr(Ⅵ)两种稳定的氧化态存在于水环境中(Cherdchoo et al, 2019)。由于Cr(Ⅵ)具有高流动性和细胞膜渗透性等特点, 其对人体的毒性是Cr(Ⅲ)的数百倍, 人体摄入Cr(Ⅵ)后会出现肝脏损伤、内出血、呼吸系统紊乱、皮炎、皮肤溃烂和染色体畸变等。同样, 海水中的Cr(Ⅵ)也会对海洋生物产生不利影响, 如造成小龙虾器官的损伤, 影响海洋鱼类幼虫和桡足类的生存、生长和繁殖能力, 还可能导致硅藻等死亡(Mashiatullah et al, 2013)。因此, 有必要开发一种有效的方式去除污染水体中的Cr(Ⅵ)。目前已报道多种去除污染水体中Cr(Ⅵ)的方法, 包括化学沉淀、反渗透、膜分离、电化学处理、吸附和生物处理(Srivastava et al, 2008; Xie et al, 2017; Fuoco et al, 2020; Ho et al, 2021)。众所周知, 吸附剂在吸附中扮演着重要的角色, 而一种优良的吸附剂应具备去除率高、可设计性强、操作简单以及可回收等特点。因此, 吸附剂的选择是去除污染水体中Cr(Ⅵ)的一个关键环节。在众多的吸附剂中, 壳聚糖(chitosan, CS)是研究最广泛的绿色吸附剂之一, 它主要是从海洋动物, 如虾、蟹等甲壳动物中的甲壳质(chitin, CT)脱乙酰而成的线性粘多糖。CS富含的−NH2基团可通过质子化和配位作用去除污染水体中的阴离子和金属阳离子污染物(Xu et al, 2023)。另外, −NH2可以与Cr(Ⅵ)发生反应并形成稳定的络合物, 因此, −NH2基团被认为是去除Cr(Ⅵ)的有效功能基团。从化学结构看, 聚乙烯亚胺(polyethyleneimine, PEI)分子链上具有丰富的−NH2, 常常被用来改性吸附剂, 将−NH2引入到吸附剂中, 致使其对HMs的吸附能力得到有效改善(Lu et al, 2020)。例如, Zhang等(2022)通过简单而环保的方法制备出一种新型的PEI改性Junkus effuses (PEI-JE)吸附剂用于对水溶液中Cr(Ⅵ)的去除。尽管已有不少的PEI改性的CS吸附剂被开发, 但由于CT含−NH2量少、溶解性差而被忽视, 因此, 以PEI修饰羧甲基CT (carboxymethyl chitin, CMC)的吸附材料至今未见报道。
本文设计并制备出一种新型吸附剂(CMC-PEI)用于吸附不同水介质(如海水、自来水等)中的Cr(Ⅵ)。参考并改进Sini等(2005)和Liu等(2016)的工作, 将CT羧甲基化获得高羧化度(94.63%)的CMC, 后以PEI为交联剂和功能基团, 采用反相乳化法首次合成出一种新的PEI修饰的CMC复合微球(CMC-PEI), 并对其理化性质进行表征, 研究pH值、接触时间、初始浓度和共存离子对Cr(Ⅵ)吸附的影响, 最后, 基于X-射线光电子能谱结果, 推断CMC-PEI微球对Cr(Ⅵ)的吸附机制。
1 材料与方法 1.1 主要试剂和仪器CT (分子量MW≥638 kDa, 脱乙酰度DD=6%, 青岛百成海洋生物资源); 氯乙酸(C2H3ClO2, 麦克林); PEI (国药集团); 异丙醇(分析纯, 国药集团); 1-乙基- (3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)、N-羟基琥珀酰亚胺(NHS)、重铬酸钾(K2Cr2O7)、氯化钾(KCl)、磷酸二氢钾(KH2PO4)、硫酸钾(K2SO4)、硝酸钾(KNO3)、氯化钠(NaCl)、氢氧化钠(NaOH)、氯化汞(HgCl2)、硝酸铜[Cu(NO3)2·3H2O]和硝酸镉[Cd(NO3)2·4H2O]均为分析纯, 盐酸(HCl)和硝酸(HNO3)为优级纯, 上述试剂均购自国药集团。
傅里叶红外光谱仪(FTIR, AVATAR-360, 美国Nicolet); X-射线衍射仪(XRD, Smartlab SE, Rigaku, 日本); X-射线光电子能谱仪(XPS, K-Alpha+, Thermo Scientific, 美国); 热重分析仪(TG, TG 209, Netzsch, 德国); 元素分析仪(EA, UNICUBE, ELEMENTAR, 德国); 紫外可见光分光光度计(UV/VIS, 2802S, 尤尼克, 中国上海); 光学显微镜(CX31PTSF, Olympus, 日本); 原子吸收分光光度计(AA-6300C, Himadzu, 日本); 冷冻干燥机(FD-1D-50, 博医康, 中国北京)。
1.2 方法 1.2.1 CMC和CMC-PEI微球的制备根据已报道的方法并加以改进制备CMC (Muramatsu et al, 2003)。将1 g CT溶于16 mL NaOH溶液(40%, w/w)中, 反复冻融后加入40 mL异丙醇进行分散, 再称取10 g C2H3ClO2倒入上述体系, 搅拌后透析6 d, 经冷冻干燥获得CMC。
取45 mL液体石蜡和1.6 g span-80作为乳化液, 将0.4 g CMC溶于10 mL去离子水并加入乳化液搅拌1 h。调节溶液pH为5.0, 加入0.713 8 g EDC、0.176 4 g NHS和0.3 g PEI搅拌反应1.5 h。反应结束后, 清洗、干燥并收集CMC-PEI微球, 备用。CMC和CMC-PEI制备过程中所涉及的主要化学反应如图 1所示。
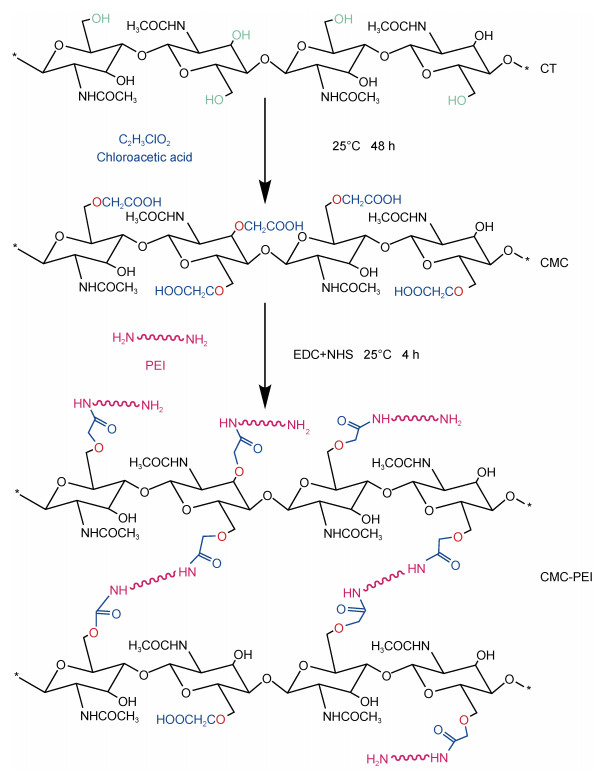 |
| 图 1 CMC和CMC-PEI合成过程中发生的主要化学反应图 Fig. 1 Schema of main reactions during the syntheses of CMC and CMC-PEI 注: CT: 甲壳素; C2H3ClO2: 氯乙酸; CMC: 羧甲基甲壳素; PEI: 聚乙烯亚胺; EDC: 1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐; NHS: N-羟基琥珀酰亚胺; CMC-PEI: PEI修饰的羧甲基甲壳素。下同 |
为证明CMC和CMC-PEI制备成功, 通过FTIR对CT、CMC和CMC-PEI进行红外分析。在真空条件下, 利用XRD对CT和CMC-PEI微球进行测定。利用光学显微镜对CMC-PEI微球进行观察并记录不同放大倍数下的数字照片。采用热重分析仪对样品进行热重测试。通过元素分析仪对CT、CMC和CMC-PEI微球中的C、N、和H定量分析, 并按照公式(1)和(2)计算CMC的羧化度(DS)和PEI的接枝度(DG)。另外, 为探究CMC-PEI微球对Cr(Ⅵ)的吸附机理, 采用XPS技术对吸附前后的微球进行扫描分析。
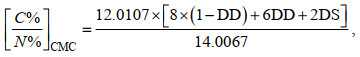 (1)
(1)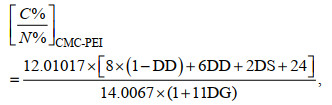 (2)
(2)式中, C%/N%为物质中碳元素和氮元素百分含量比; 12.010 7和14.006 7为C、N的原子量; 8和6为未脱乙酰CT、脱乙酰CT单体的碳原子个数; 11和24为PEI单体的氮、碳原子个数; DD表示CT的脱乙酰度。
1.2.3 CMC-PEI微球对Cr(Ⅵ)的吸附实验探究pH、接触时间、吸附剂剂量和Cr(Ⅵ)的初始浓度对CMC-PEI微球吸附Cr(Ⅵ)的影响, 通过吸附-解吸附实验以评估CMC-PEI微球的循环再生性能。实验前, 称取1.414 5 g K2Cr2O7溶于去离子水, 定容至500 mL, 配成Cr(Ⅵ)浓度为1 000 mg/L的母液。然后用去离子水稀释以及用HCl或NaOH调节pH以获得不同初始浓度和不同pH的Cr(Ⅵ)溶液, 吸附实验在160 r/min的恒温摇床中进行。
吸附实验完成后, 实施固液分离, 并利用原子吸收分光光度计测定滤液中总Cr浓度(Zhu et al, 2019)。另外, 采用1, 5-二苯基碳酰肼法经UV/VIS分光光度计测定溶液中Cr(Ⅵ)浓度。CMC-PEI微球的吸附量(Qe, mg/g)和去除率(R, %)按照公式(3)和(4)计算, 相对去除率(Rr, %)表示Cr(Ⅵ)的循环再生循环能力, 其值按公式(5)计算。
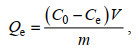 (3)
(3)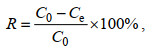 (4)
(4)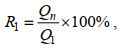 (5)
(5)式中, C0: Cr(Ⅵ)的初始浓度(单位: mg/L); Ce: 吸附平衡时Cr(Ⅵ)的浓度(单位: mg/L); V: Cr(Ⅵ)溶液体积(单位: L); m: 微球质量(单位: g); Q1和Qn: 微球对Cr(Ⅵ)首次和第n次的吸附量(单位: mg/g)。
1.2.4 共存离子、模拟废水和不同水介质吸附实验在实际的污染水体中, Cr(Ⅵ)通常与其他阴、阳离子共存。因此, 我们将30 mg CMC-PEI微球放入到30 mL Cr(Ⅵ)溶液(200 mg/L, pH=2)中, 并加入不同初始浓度的含PO43-、SO42-、NO3-和Cl− (C0 = 50、100、200 mg/L)的溶液。通过混合5种常存在于实际工业废水中的无机盐制备模拟废水, 其中, Cr(Ⅵ)的初始浓度为30 mg/L (pH=2)。另外, 我们使用自来水和海水(取自中国青岛中苑码头东经120°31′41″E, 36°5′33″N)配成200 mg/L的Cr(Ⅵ)溶液。吸附实验前, 调节pH值至2。吸附实验完成后的操作和计算同上述吸附实验一致。
1.2.5 统计学方法采用SPSS 20.0软件进行统计分析, 除已声明的实验外, 所有实验均独立进行至少三次, 数据用均数±标准差表示。两组间均值的比较采用t检验。P < 0.05为差异有统计学意义(*: P < 0.05, **: P < 0.01)。
2 结果与讨论 2.1 CMC和CMC-PEI微球的表征 2.1.1 FTIR分析CT、CMC和CMC-PEI的红外图谱如图 2a所示。在CT中, 1 027 cm−1处是C6−OH的特征谱带, 1 074 cm−1处的吸收谱带归因于C3−OH。而在CMC中, 1 027和1 074 cm−1处的谱带消失, 在1 601和1 416 cm−1处出现两个新的谱带, 分别对应于羧甲基衍生物钠盐的−COO−的不对称和对称伸缩振动(Chen et al, 2017; Jing et al, 2021), 说明CT羧甲基化成CMC, 也说明C6−OH和C3−OH参与此反应。此外, 1 323 cm−1处的酰胺Ⅲ谱带归因于N−H的面内弯曲振动(Dhanabalan et al, 2021), 1 065 cm−1处的谱带也对应于羧基(Dev et al, 2010), 进一步证明CMC被成功制备。在CMC-PEI中, 1 656和1 589 cm−1出现两个新的谱带, 分别对应于酰胺Ⅰ和酰胺Ⅱ谱带, 同时, CMC中1 601 cm−1处的羧基谱带在CMC-PEI中消失, 迁移至1 407 cm−1的羧基峰(CMC中1 416 cm−1的−COO−对称伸缩振动)强度减弱, 说明CMC与PEI发生酰胺反应, 成功合成了CMC-PEI微球。
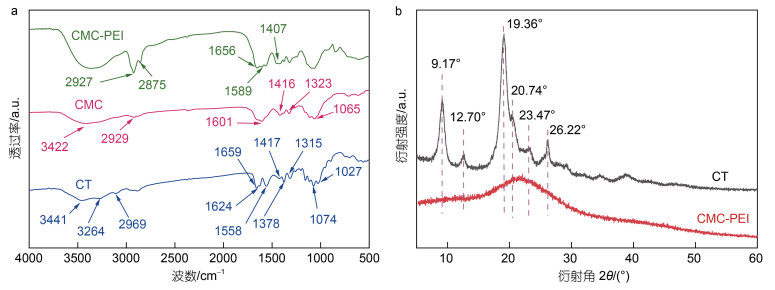 |
| 图 2 CT、CMC、CMC-PEI微球的FTIR光谱(a); CT和CMC-PEI微球的XRD图谱(b) Fig. 2 FTIR spectra of CT, CMC, and CMC-PEI microspheres (a), and XRD patterns of CT and CMC-PEI microspheres (b) |
CT和CMC-PEI的XRD图谱如图 2b所示。CT在9.17°、12.70°、19.36°、20.74°、23.47°和26.22°处存在六个衍射峰(Yen et al, 2009), 而CMC-PEI在23°附近出现一个较弱的宽峰, 计算得出CT和CMC-PEI的结晶度分别为48.35%和9.04%, 这是由于: (1) CT经碱化和反复冻融处理, 其结构中的大量氢键被破坏; (2) PEI的引入破坏了其晶格结构, 因此导致CMC-PEI微球的结晶度降低。研究表明, 结晶度的降低, 有利于吸附剂对HMs离子的吸附(Li et al, 2016)。因此, 低结晶度的CMC-PEI微球更有利于吸附HMs离子。
2.1.3 光学显微镜和扫描电子显微镜结果分析图 3a和3b为CMC-PEI微球的显微镜观察图。CMC-PEI微球在10倍和40倍光学显微镜下呈表面光滑的球状, 粒径分布相对均匀。图 3c和3d为CMC-PEI微球的扫描电子显微镜图, 图 3c (SE模式)显示CMC-PEI微球具有完整的球形结构, 且表面光滑。当采用BSE模式对微球形貌进行观察时(图 3d), 可以看到类似裂纹的图案, 出现这种现象是由于BSE模式下电子束的穿透深度比SE模式下的穿透深度要深很多。
 |
| 图 3 CMC-PEI微球的数码图片(a: 10 ×; b: 40 ×)和扫描电子显微镜图片(c, d: 10.0k ×) Fig. 3 Digital photographs (a: 10 ×; b: 40 ×) and scanning electron microsphere images (c, d: 10.0k ×) of CMC-PEI microspheres |
CT和CMC-PEI的TG和DTG曲线如图 4所示。在30~158 ℃和243~423 ℃的温度范围内, CT有两个失重阶段, 质量损失率分别为3.94%和80.52%, 这是由于: (1) CT粉末中水分的蒸发; (2) CT分子中N-乙酰-葡萄糖的结构发生热分解(Dang et al, 2018)。在30~155 ℃、156~345 ℃和348~598 ℃的温度范围内, CMC-PEI微球有三个失重阶段, 质量损失率分别为14.45%、36.46%和19.05%, 这是由于: (1) CMC-PEI微球中水分的蒸发; (2) CMC-PEI微球中接枝的PEI部分基团发生热分解(Ghiorghita et al, 2022); (3) 聚合物的断裂和CT骨架中有机基团的裂解(Alver et al, 2017)。此外, 在385 ℃时CT的热损失率最大, 热分解最终的残留是11.23%; 在276 ℃时CMC-PEI的热损失率最大, 热分解最终的残留是29.72%, 说明微球具有较好的热稳定性能, 利于在较高温度下进行吸附实验(Wang et al, 2021)。
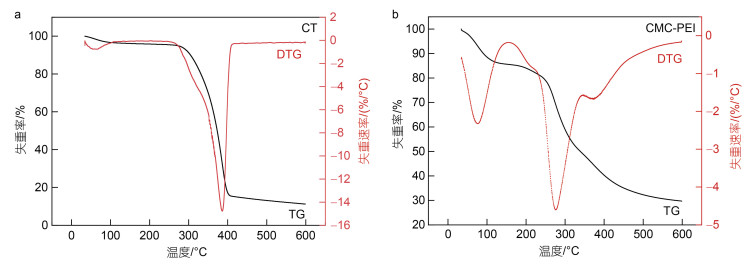 |
| 图 4 CT (a)和CMC-PEI微球(b)的TG和DTG曲线 Fig. 4 TG and DTG curves of CT (a) and CMC-PEI microspheres (b) 注: TG: 热重; DTG: 微熵热重 |
结合表 1数据, 由公式(1)计算出CMC的羧化度DS为94.63%, 由公式(2)计算出PEI的接枝率DG为40.30%。
| 样品 | 元素质量百分含量/% | 元素质量比 | |||
| C | H | N | C/N | C/H | |
| CT | 45.77 ± 0.06 | 6.14 ± 0.04 | 6.70 ± 0.07 | 6.84 | 7.45 |
| CMC | 41.62 ± 0.08 | 4.55 ± 0.05 | 4.97 ± 0.05 | 8.38 | 9.15 |
| CMC-PEI | 43.92 ± 0.06 | 5.73 ± 0.06 | 8.23 ± 0.08 | 5.33 | 7.67 |
如图 5a所示, 在pH值为2时, 微球对Cr(Ⅵ)的吸附量达到最大, 这是由于此时溶液中H+离子浓度大, −NH2质子化, 使吸附剂表面带有大量正电荷可以与Cr(Ⅵ)阴离子(HCrO4-、Cr2O72-)间产生较强的静电引力。此外, 还归因于Cr(Ⅲ)与微球表面官能团之间的静电作用以及配位作用。如图 5b所示, 吸附剂剂量从0.5 g/L增加到2.0 g/L时, CMC-PEI对Cr(Ⅵ)的吸附量从144.90 mg/g降低到60.63 mg/g, 去除率从36.95%迅速升高到60.3%。结果表明: 随着吸附剂用量的增加, 微球提供的吸附位点逐渐增多, 吸附的Cr(Ⅵ)也逐渐增多。初始浓度影响如图 5c, 随着Cr(Ⅵ)浓度从10 mg/L增加到300 mg/L, CMC-PEI微球对Cr(Ⅵ)的吸附量从6.50 mg/g增加到123.26 mg/g, 这是由于: (1) 溶液中Cr(Ⅵ)离子浓度越大, 吸附的驱动力就越强; (2) 吸附剂在初始阶段为Cr(Ⅵ)离子提供了充足的吸附位点。随着溶液初始浓度由300 mg/L增加到500 mg/L, CMC-PEI微球的吸附量达到平衡, 所以, 在300 mg/L之后, 继续提高Cr(Ⅵ)的初始浓度, CMC-PEI对Cr(Ⅵ)的吸附量无明显变化。
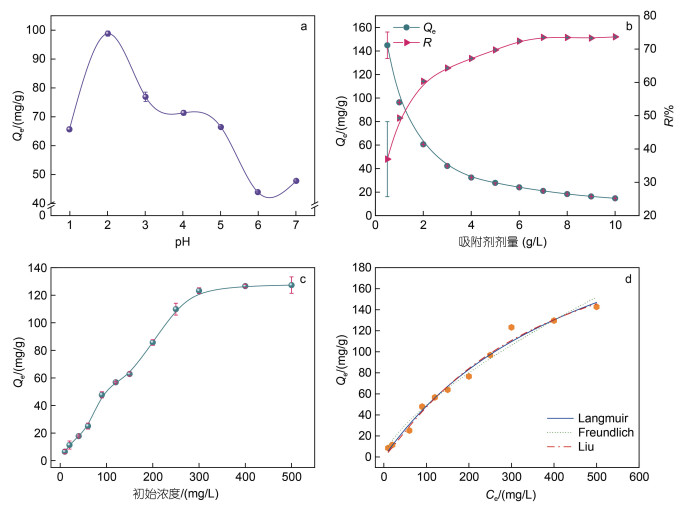 |
| 图 5 pH (a)、吸附剂剂量(b)、初始浓度(c)对Cr(Ⅵ)吸附的影响; 基于Langmuir、Freundlich、Liu等温模型的非线性拟合曲线(d) Fig. 5 Effects of pH (a), dosage (b), and initial concentration (c) on adsorption to Cr(Ⅵ), and nonlinear fitting curves based on the Langmuir, Freundlich, and Liu isothermal models (d) |
选用Langmuir、Freundlich和Liu等温模型对CMC-PEI微球吸附Cr(Ⅵ)的行为进行非线性拟合, 拟合方程见公式(6)、(7)和(8)。
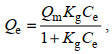 (6)
(6)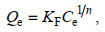 (7)
(7)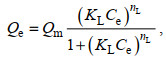 (8)
(8)式中, Qe: 吸附平衡时Cr(Ⅵ)的吸附量(mg/L); Qm: 最大吸附量(mg/g); Ce: 平衡时溶液中Cr(Ⅵ)浓度(mg/L); Kg (单位: L/mg)、KF (单位: mg1−1/nL1/n/g)和KL (单位: L/mg): Langmuir、Freundlich和Liu吸附模型的平衡常数; n: Freundlich指数; nL: Liu模型的无量纲指数。
三种等温吸附模型对CMC-PEI微球吸附Cr(Ⅵ)的实验数据拟合结果如图 5d。由表 2可知, 三种模型的相关系数R2的大小为R2Liu > R2Langmuir > R2Freundlich。因此, 根据Liu模型计算出CMC-PEI微球的Qm= 244.01 mg/g。显然, 这一数据优于其他文献中所研究的吸附剂的Qm (表 3)。
| 等温线模型 | 参数 | 数值 |
| Langmuir | Qm /(mg/g) | 299.52 |
| Kg /(L/mg) | 1.93 ×10−3 | |
| R2 | 0.984 4 | |
| Freundlich | KF /(mg1−1/nL1/n/g) | 1.97 |
| n | 1.43 | |
| R2 | 0.977 1 | |
| Liu | Qm /(mg/g) | 244.01 |
| KL /(L/mg) | 2.83 ×10−3 | |
| nL | 1.13 | |
| R2 | 0.986 7 | |
| 注: Qm是CMC-PEI微球的最大吸附量; Kg、KF和KL依次是Langmuir、Freundlich和Liu吸附模型的平衡参数; n代表Freundlich指数; nL代表Liu模型的无量纲指数 | ||
| 吸附材料 | Qm /(mg/g) | 参考文献 |
| PC | 35.22 | Karthik et al, 2014 |
| PCC | 24.65 | Karthik et al, 2015 |
| CTS/CS-50 | 144.49 | Wu et al, 2022 |
| PPy-SFB | 143.35 | Cao et al, 2022 |
| Chitin | 70.42 | Baran et al, 2007 |
| ETMEDA-CMCPS | 89.77 | Chen et al, 2021 |
| GBP-SPC | 66.33 | Najafi et al, 2021 |
| ECSBNC | 83.33 | Anush et al, 2019 |
| CMC-PEI | 244.01 | 本研究 |
如图 6a所示, CMC-PEI对Cr(Ⅵ)的吸附量随着时间的增加而增加, 并在300 min时达到吸附平衡。因此, 我们选择300 min作为最佳吸附时间。应用伪一级(pseudo-first-order)、伪二级(pseudo-second-order)和粒子内扩散(Weber and Morris)三种动力学模型对CMC-PEI吸附Cr(Ⅵ)的过程进行拟合。三种模型的线性方程参见公式(9)、(10)和(11)。
 (9)
(9)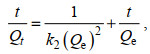 (10)
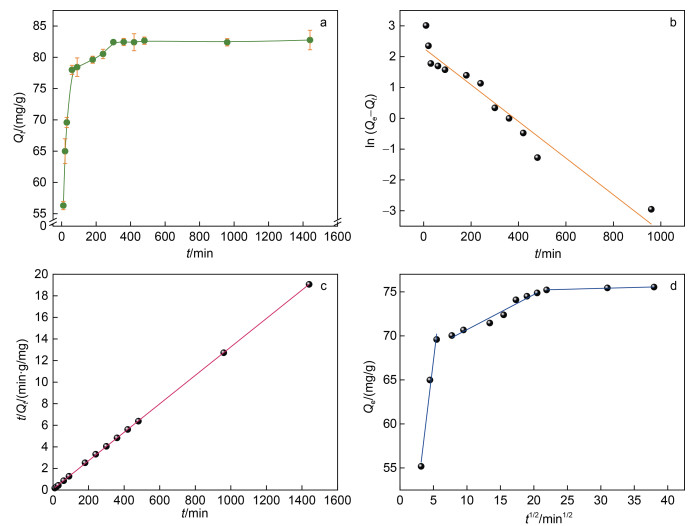
(10)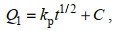 (11)
(11)
 |
| 图 6 接触时间对Cr(Ⅵ)吸附的影响(a); 基于伪一级(b)、伪二级(c)和粒子内扩散(d)动力学模型的线性拟合曲线图 Fig. 6 Effect of contact time on adsorption to Cr(Ⅵ) (a), and linear fitting curves based on the pseudo-first-order (b), pseudo-second-order (c), and Weber-Morris (d) kinetic models |
式中, Qt: t时刻微球对Cr(Ⅵ)的吸附量(单位: mg/g); k1: pseudo-first-order吸附速率常数(单位: min−1); k2: pseudo-second-order吸附速率常数[单位: g/(mg·min)]; kp: Weber and Morris粒子内扩散速率常数[单位: mg/(g·min1/2)]; C: 粒子内扩散常数(单位: mg/g)。
三种模型的线性拟合如图 6b~6d, 相关参数见表 4。相关系数R22 > R12, 说明微球对Cr(Ⅵ)的吸附行为更符合伪二级动力学模型, 其吸附主要为化学吸附(Gamal et al, 2021)。粒子内扩散模型存在三个传质阶段(Tan et al, 2007): 外部传质阶段、颗粒内传质阶段、趋于平缓阶段。Kid1 > Kid2 > Kid3, 表明随着吸附过程的进行, 吸附的驱动力逐渐降低, 粒子内扩散作用逐步减弱。此外, 粒子扩散常数C存在于吸附过程的每个阶段, 说明边界层效应存在于吸附过程的每个阶段中。综上分析, 虽然粒子内扩散在Cr(Ⅵ)吸附到微球上存在一定的作用, 但其拟合曲线并未通过原点, 所以它不是吸附的主要限速步骤和唯一的传质机制(Ohemeng-Boahen et al, 2021)。
| 动力学模型 | 参数 | Cr(Ⅵ) |
| Pseudo-first-order | Qe, cal /(mg/g) | 92.43 |
| k1 /min−1 | 5.95 × 10−3 | |
| R12 | 0.942 0 | |
| Pseudo-second-order | Qe, cal /(mg/g) | 75.82 |
| k2 /[g/(mg·min)] | 2.22 × 10−3 | |
| R22 | 1.000 0 | |
| Weber and Morris | Kid1 /[mg/(g·min1/2)] | 6.28 |
| Kid2 /[mg/(g·min1/2)] | 0.40 | |
| Kid3 /[mg/(g·min1/2)] | 0.02 | |
| C1 /(mg/g) | 35.79 | |
| C2 /(mg/g) | 66.72 | |
| C3 /(mg/g) | 74.79 | |
| 注: Qe, cal是根据动力学模型计算出的CMC-PEI微球的吸附量, k1是Pseudo-first-order动力学吸附速率常数; k2是Pseudo-second-order动力学吸附速率常数; Kid1、Kid2和Kid3是Weber and Morris粒子内扩散速率常数; C1、C2和C3是粒子内扩散常数 | ||
吸附−解吸附实验结果如图 7b所示, NaOH (0.01 mol/L)作为解吸附剂可以有效地从吸附剂表面解吸Cr(Ⅵ)。首次吸附过程中CMC-PEI对Cr(Ⅵ)的相对去除率Rr是100%, 经过第二次吸附后, Rr(92.60%)稍微有所降低, Rr值的降低可能与循环过程中微球质量的损失有关, 经过5次吸附−解吸附过程, Rr仍保持在85.40%, 说明CMC-PEI微球是一种去除Cr(Ⅵ)的理想材料。
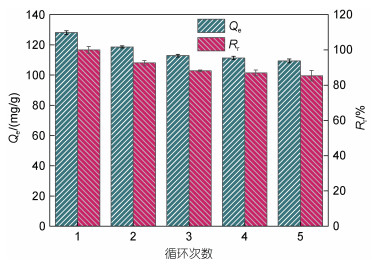 |
| 图 7 连续5次吸附−解吸附的结果 Fig. 7 The results of consecutive adsorption-desorption for five times |
通过XPS分析揭示CMC-PEI微球吸附Cr(Ⅵ)的可能机制。CMC-PEI微球吸附Cr(Ⅵ)前后的全谱图分别是图 8a和8b, 高分辨率能谱参见图 8c~8i。吸附前, C 1s、N 1s和O 1s分别在285.92、400.02和532.25 eV处存在吸收峰。吸附Cr(Ⅵ)后, 在570~590 eV处出现Cr 2p的特征峰, 证明Cr(Ⅵ)被成功吸附。
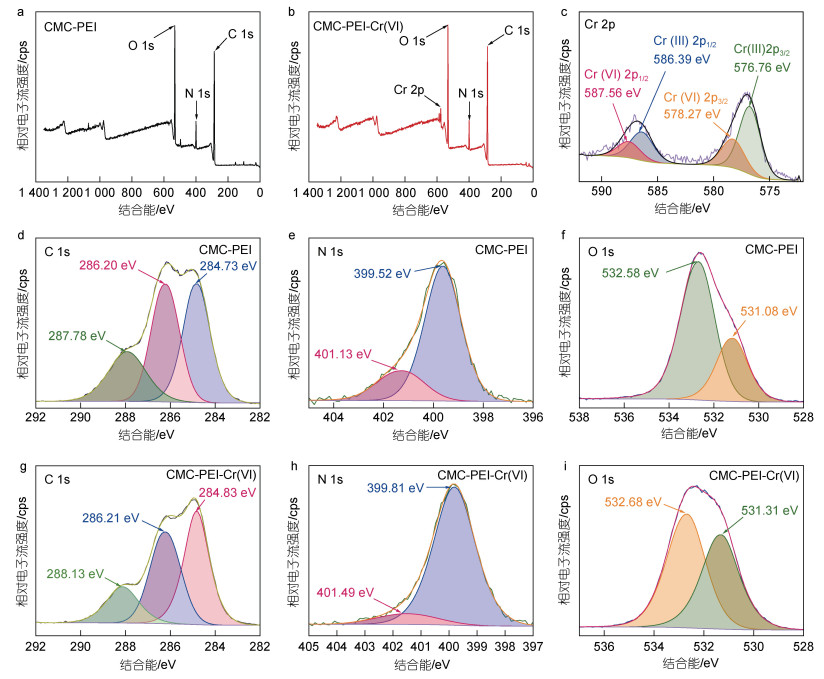 |
| 图 8 CMC-PEI微球吸附Cr(Ⅵ)前后的XPS谱图(a、b); 高分辨率Cr 2p谱图(c); C 1s (d、g)、N 1s (e、h)和O 1s (f、i) 高分辨率谱图 Fig. 8 The XPS spectra of CMC-PEI microspheres before and after Cr(Ⅵ) adsorption (a and b), high-resolution Cr 2p spectra (c), and high-resolution spectra of C 1s (d and g), N 1s (e and h), and O 1s (f and i) of CMC-PEI microspheres before and after adsorption to Cr(Ⅵ) 注: CMC-PEI-Cr(Ⅵ): 吸附Cr(Ⅵ)后的CMC-PEI微球 |
Cr 2p高分辨率能谱如图 8c所示, 576.76和578.27 eV对应于Cr的2p3/2(第一个2: 轨道主量子数n; p: 轨道角动量量子数I; 3/2或1/2: 总角动量量子数J, 下同), 586.39和587.56 eV对应于Cr的2p1/2, 其中576.76和586.39 eV处的峰与Cr(Ⅲ)有关, 578.27和587.56 eV处的峰与Cr(Ⅵ)有关, 表明CMC-PEI- Cr(Ⅵ)微球上同时存在Cr(Ⅵ)和Cr(Ⅲ) (Assi et al, 2016)。经计算, Cr(Ⅲ)的峰面积为66.8%, Cr(Ⅵ)的峰面积为33.2%, 表明在吸附过程中, 大部分Cr(Ⅵ)被还原成低生物毒性的Cr(Ⅲ) (Xiang et al, 2021)。
吸附Cr(Ⅵ)前、后的CMC-PEI微球的C、N和O的高分辨能谱参见图 8d~8i。如图 8d所示, 吸附Cr(Ⅵ)前, C 1s在284.73、286.20和287.78 eV处的峰分别对应于C−C、N−C=O和C=O (Li et al, 2021); 吸附Cr(Ⅵ)后(图 8g), C 1s的结合能分别是284.83、286.21和288.13 eV, 表明C=O在吸附Cr(Ⅵ)的过程中充当了电子供体(Guo et al, 2021)。吸附Cr(Ⅵ)前, N 1s的高分辨能谱如图 8e所示, −NH2/−NH−和−NH3+/−NH2+−的原始结合能分别对应于399.52和401.13 eV; 吸附Cr(Ⅵ)后(图 8h), −NH2/−NH−和−NH3+/−NH2+−的结合能变为399.81和401.49 eV, 归因于−NH3+/−NH2+−均带正电, 可以与HCrO4–和Cr2O72−之间通过静电相互作用相结合, 同时−NH2/−NH−作为电子供体参与了Cr(Ⅵ)的还原反应(Gao et al, 2019; Valadi et al, 2022), 通过质子化的−NH2/−NH−的还原作用, 将有毒的Cr(Ⅵ)还原为毒性较低的Cr(Ⅲ) (Lu et al, 2017; Huang et al, 2018), Cr(Ⅲ)和N原子通过共用电子对以形成共价键, N原子周围的电子云变得更加稀薄, 所以N 1s的结合能增加。微球吸附Cr(Ⅵ)前后的O 1s的能谱图如图 8f和8i所示, 吸附Cr(Ⅵ)前, 532.58和531.08 eV处的两个峰分别对应于N−C=O和C−OH; 吸附Cr(Ⅵ)后, 两个峰分别移动到532.68和531.31 eV处, 表明−COOH和−OH在Cr(Ⅵ)的去除过程中起着重要作用(Luo et al, 2021)。
2.2.5 共存离子、模拟废水和不同水介质实验被Cr(Ⅵ)污染的水环境(例如河流、湖泊、地下水和海洋)中, 常常混有多种阴、阳离子, 因此, 我们以去离子水、自来水和海水为溶剂配制不同的含有Cr(Ⅵ)的溶液, 探究CMC-PEI微球在不同水介质中的吸附效果, 从多个层面评估共存离子对吸附量的影响。共存离子对Cr(Ⅵ)的竞争吸附如图 9a所示, 对Cr(Ⅵ)的吸附干扰能力较强的是多价阴离子PO43-和SO42-, 其次是单价阴离子Cl−和NO3-, 这是由于: (1) PO43-和HCrO4-是四面体构型, 水合度接近(Duranoğlu et al, 2012); (2) 磷酸电离成多种阴离子, 例如: PO43-、HPO42-和H2PO4-, 此类离子将会与Cr(Ⅵ)的阴离子竞争吸附位点; (3) 带两个负电荷的SO42-会占据更多的活性位点(Wu et al, 2022)。模拟废水、自来水和海水实验如图 9b~9d所示, 可以看出, 模拟废水对照组的吸附量明显低于其他两组(自来水和海水)对照组的吸附量, 这是由于模拟废水对照组的Cr(Ⅵ)初始浓度(30 mg/L)远远低于其他两组(自来水和海水)对照组的Cr(Ⅵ)初始浓度(200 mg/L), 而其他吸附条件(吸附剂剂量、接触时间等)均一致所导致。模拟废水实验结果如图 9b所示, 废水中各组成及其对应的含量见插图, 对照组中仅含有K2Cr2O7。与对照组相比, 模拟废水组中CMC-PEI微球对Cr(Ⅵ)的吸附量明显降低(P < 0.01), 说明模拟废水中其他共存离子(阴、阳离子)对Cr(Ⅵ)的吸附产生干扰。因为此类离子会占据CMC-PEI微球上的部分活性位点, 使得一定剂量(按照实验确定的最佳剂量加入)的微球对Cr(Ⅵ)的吸附量有所下降。图 9c和9d显示的是CMC-PEI微球对自来水和海水中Cr(Ⅵ)的吸附量。可以看出, CMC-PEI微球对自来水和海水中Cr(Ⅵ)的吸附量与对照组相比存在显著性差异(自来水P < 0.05; 海水P < 0.01)。去离子水中Cr(Ⅵ)的吸附量是82.67 mg/g, 自来水中Cr(Ⅵ)的吸附量是81.56 mg/g。CMC-PEI微球对海水中Cr(Ⅵ)的吸附量为43.77 mg/g, 明显低于去离子水中Cr(Ⅵ)的吸附量, 这可能是由于: (1) 海水中含有众多的溶解性盐类, 其阴、阳离子占据了定量微球的吸附位点, 从而降低了微球的吸附量; (2) 在海水中也存在着大量浮游藻类、生物碎片和微生物等, 它们自身含有各种官能团, 如羧基、氨基、硫基、羟基和羟基等, 可以与金属离子相互作用, 从而影响CMC-PEI微球对Cr(Ⅵ)的吸附量(González-Dávila et al, 1990); (3) 海水中存在着其他HMs, 这也会降低CMC-PEI微球对Cr(Ⅵ)的吸附量。上述实验结果提示: 倘若处理Cr(Ⅵ)污染的海水, 只有加入更大的吸附剂剂量, 才能达到理想的去除Cr(Ⅵ)效果。同时, 实验结果初步表明, CMC-PEI微球对自来水和海水中Cr(Ⅵ)的去除是可行的。
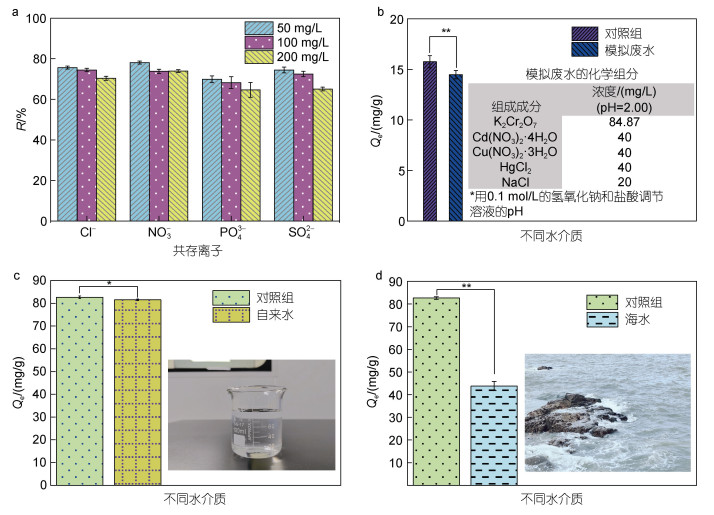 |
| 图 9 共存离子对Cr(Ⅵ)吸附量的影响(a); CMC-PEI微球在模拟废水中对Cr(Ⅵ)的吸附量(b); CMC-PEI微球在自来水中对Cr(Ⅵ)的吸附量(c); CMC-PEI微球在海水中对Cr(Ⅵ)的吸附量(d) Fig. 9 Effect of coexisting ions on adsorption capacity for Cr(Ⅵ) (a), adsorption capacity of CMC-PEI microspheres to Cr(Ⅵ) in synthetic effluents (b), adsorption capacity of CMC-PEI microspheres to Cr(Ⅵ) in tap water (c), and adsorption capacity of CMC-PEI microspheres to Cr(Ⅵ) in sea water (d) 注: *表示P < 0.05, 两组数据间具有显著性差异; **表示P < 0.01, 两组数据间具有非常显著性差异 |
(1) FTIR结果表明, CMC-PEI微球被成功制备。光学显微镜观察可知, CMC-PEI微球呈表面光滑的球形, 且大小分布均一。元素分析显示, CMC的羧化度为94.63%, PEI的接枝率为40.30%。XRD结果显示, CT的结晶度为48.35%, CMC-PEI微球的结晶度为9.04%。
(2) 通过批量吸附实验探究CMC-PEI微球吸附Cr(Ⅵ)的最佳条件。根据Liu模型计算可知, CMC-PEI微球对Cr(Ⅵ)的最大理论吸附量为244.01 mg/g。CMC-PEI微球对Cr(Ⅵ)的吸附行为符合伪二级动力学模型, 说明在微球吸附Cr(Ⅵ)的过程中化学吸附起主导作用。吸附−解吸附实验表明, NaOH能有效地从微球表面解吸Cr(Ⅵ), 微球具有良好的循环再生性能。模拟废水和不同水介质(如自来水和海水等)实验结果表明, CMC-PEI微球对受Cr(Ⅵ)污染的工厂废水、自来水和海水进行去除净化是可行的。
(3) XPS分析表明, Cr(Ⅵ)在CMC-PEI微球表面的吸附主要通过静电作用、还原反应和配位作用来完成。
总之, 通过反相乳化法首次成功制备CMC-PEI微球, 实验证明CMC-PEI微球对不同水介质中的Cr(Ⅵ)具有良好的去除效果, 说明CMC-PEI微球是一种实际应用潜力巨大的新型Cr(Ⅵ)吸附剂, 有希望应用于净化受Cr(Ⅵ)污染的河流、湖泊和海洋中。
ALVER E, METIN A Ü, 2017. Chitosan based metal-chelated copolymer nanoparticles: Laccase immobilization and phenol degradation studies[J]. International Biodeterioration & Biodegradation, 125: 235-242. |
ANUSH S M, VISHALAKSHI B, 2019. Modified chitosan gel incorporated with magnetic nanoparticle for removal of Cu(Ⅱ) and Cr(Ⅵ) from aqueous solution[J]. International Journal of Biological Macromolecules, 133: 1051-1062. DOI:10.1016/j.ijbiomac.2019.04.179 |
ASSI M A, HEZMEE M N M, HARON A W, et al, 2016. The detrimental effects of lead on human and animal health[J]. Veterinary World, 9(6): 660-671. DOI:10.14202/vetworld.2016.660-671 |
BARAN A, BIÇAK E, BAYSAL Ş H, et al, 2007. Comparative studies on the adsorption of Cr(Ⅵ) ions on to various sorbents[J]. Bioresource Technology, 98(3): 661-665. DOI:10.1016/j.biortech.2006.02.020 |
CAO F M, SUN Y Q, ZHANG L, et al, 2022. High efficient adsorption accompanied by in-situ reduction of Cr(Ⅵ) removal by rice straw fiber ball coated with polypyrrole[J]. Applied Surface Science, 575: 151583. DOI:10.1016/j.apsusc.2021.151583 |
CHEN Q L, TANG H L, ZHA Z Q, et al, 2017. β-D-glucan from Antrodia Camphorata ameliorates LPS-induced inflammation and ROS production in human hepatocytes[J]. International Journal of Biological Macromolecules, 104: 768-777. DOI:10.1016/j.ijbiomac.2017.05.191 |
CHEN Y, ZEB S, PENG X J, et al, 2021. Enhanced adsorption of Cr(Ⅵ) under neutral conditions using a novel adsorbent with preorganized diquaternary ammonium structure[J]. Journal of Molecular Liquids, 322: 114905. DOI:10.1016/j.molliq.2020.114905 |
CHERDCHOO W, NITHETTHAM S, CHAROENPANICH J, 2019. Removal of Cr(Ⅵ) from synthetic wastewater by adsorption onto coffee ground and mixed waste tea[J]. Chemosphere, 221: 758-767. DOI:10.1016/j.chemosphere.2019.01.100 |
DANG Q F, LIU K, LIU C S, et al, 2018. Preparation, characterization, and evaluation of 3, 6-O-N- acetylethylenediamine modified chitosan as potential antimicrobial wound dressing material[J]. Carbohydrate Polymers, 180: 1-12. DOI:10.1016/j.carbpol.2017.10.019 |
DEV A, MOHAN J C, SREEJA V, et al, 2010. Novel carboxymethyl chitin nanoparticles for cancer drug delivery applications[J]. Carbohydrate Polymers, 79(4): 1073-1079. DOI:10.1016/j.carbpol.2009.10.038 |
DHANABALAN V, XAVIER K A M, EPPEN S, et al, 2021. Characterization of chitin extracted from enzymatically deproteinized Acetes shell residue with varying degree of hydrolysis[J]. Carbohydrate Polymers, 253: 117203. DOI:10.1016/j.carbpol.2020.117203 |
DURANOĞLU D, TROCHIMCZUK A W, BEKER U, 2012. Kinetics and thermodynamics of hexavalent chromium adsorption onto activated carbon derived from acrylonitrile- divinylbenzene copolymer[J]. Chemical Engineering Journal, 187: 193-202. DOI:10.1016/j.cej.2012.01.120 |
FUOCO I, FIGOLI A, CRISCUOLI A, et al, 2020. Geochemical modeling of chromium release in natural waters and treatment by RO/NF membrane processes[J]. Chemosphere, 254: 126696. DOI:10.1016/j.chemosphere.2020.126696 |
GAMAL A, IBRAHIM A G, ELIWA E M, et al, 2021. Synthesis and characterization of a novel benzothiazole functionalized chitosan and its use for effective adsorption of Cu(Ⅱ)[J]. International Journal of Biological Macromolecules, 183: 1283-1292. DOI:10.1016/j.ijbiomac.2021.05.080 |
GAO X P, LI M Y, ZHAO Y M, et al, 2019. Mechanistic study of selective adsorption of Hg2+ ion by porous alginate beads[J]. Chemical Engineering Journal, 378: 122096. DOI:10.1016/j.cej.2019.122096 |
GHIORGHITA C A, DINU M V, DRAGAN E S, 2022. Burst-free and sustained release of diclofenac sodium from mesoporous silica/PEI microspheres coated with carboxymethyl cellulose/chitosan layer-by-layer films[J]. Cellulose, 29(1): 395-412. DOI:10.1007/s10570-021-04282-y |
GONZALEZ-DAVILA M, MILLERO F J, 1990. The adsorption of copper to chitin in seawater[J]. Geochimica et Cosmochimica Acta, 54(3): 761-768. DOI:10.1016/0016-7037(90)90371-Q |
GUO C, WU S J, GAO X P, et al, 2021. Mechanistic study of Cr(Ⅵ) removal by modified alginate/GO composite via synergistic adsorption and photocatalytic reduction[J]. International Journal of Biological Macromolecules, 189: 910-920. DOI:10.1016/j.ijbiomac.2021.08.203 |
HO C C, YU J S, YANG S W, et al, 2021. Use of packed scrap iron anodes for continuous electrochemical Cr(Ⅵ) reduction process in electroplating wastewater treatment[J]. Journal of Water Process Engineering, 42: 102191. DOI:10.1016/j.jwpe.2021.102191 |
HUANG R F, MA X G, LI X, et al, 2018. A novel ion-imprinted polymer based on graphene oxide-mesoporous silica nanosheet for fast and efficient removal of chromium (Ⅵ) from aqueous solution[J]. Journal of Colloid and Interface Science, 514: 544-553. DOI:10.1016/j.jcis.2017.12.065 |
JING H J, DU X J, MO L, et al, 2021. Self-coacervation of carboxymethyl chitosan as a pH-responsive encapsulation and delivery strategy[J]. International Journal of Biological Macromolecules, 192: 1169-1177. DOI:10.1016/j.ijbiomac.2021.10.072 |
KARTHIK K, MEENAKSHI S, 2014. Synthesis, characterization and Cr(Ⅵ) uptake studies of polypyrrole functionalized chitin[J]. Synthetic Metals, 198: 181-187. DOI:10.1016/j.synthmet.2014.10.012 |
KARTHIK K, MEENAKSHI S, 2015. Synthesis, characterization and Cr(Ⅵ) uptake study of polyaniline coated chitin[J]. International Journal of Biological Macromolecules, 72: 235-242. DOI:10.1016/j.ijbiomac.2014.08.022 |
LI Q H, DONG M, LI R, et al, 2021. Enhancement of Cr(Ⅵ) removal efficiency via adsorption/photocatalysis synergy using electrospun chitosan/g-C3N4/TiO2 nanofibers[J]. Carbohydrate Polymers, 253: 117200. DOI:10.1016/j.carbpol.2020.117200 |
LI M L, ZHANG Z Q, LI R H, et al, 2016. Removal of Pb(Ⅱ) and Cd(Ⅱ) ions from aqueous solution by thiosemicarbazide modified chitosan[J]. International Journal of Biological Macromolecules, 86: 876-884. DOI:10.1016/j.ijbiomac.2016.02.027 |
LIU H, YANG Q Z, ZHANG L N, et al, 2016. Synthesis of carboxymethyl chitin in aqueous solution and its thermo- and pH-sensitive behaviors[J]. Carbohydrate Polymers, 137: 600-607. DOI:10.1016/j.carbpol.2015.11.025 |
LU Y Q, FAN L H, YANG L Y, et al, 2020. PEI-modified core-shell/bead-like amino silica enhanced poly (vinyl alcohol)/chitosan for diclofenac sodium efficient adsorption[J]. Carbohydrate Polymers, 229: 115459. DOI:10.1016/j.carbpol.2019.115459 |
LU W H, LI J H, SHENG Y Q, et al, 2017. One-pot synthesis of magnetic iron oxide nanoparticle-multiwalled carbon nanotube composites for enhanced removal of Cr(Ⅵ) from aqueous solution[J]. Journal of Colloid and Interface Science, 505: 1134-1146. DOI:10.1016/j.jcis.2017.07.013 |
LUO Q Y, HUANG X H, LUO Y, et al, 2021. Fluorescent chitosan-based hydrogel incorporating titanate and cellulose nanofibers modified with carbon dots for adsorption and detection of Cr(Ⅵ)[J]. Chemical Engineering Journal, 407: 127050. DOI:10.1016/j.cej.2020.127050 |
MASHIATULLAH A, CHAUDHARY M Z, AHMAD N, et al, 2013. Metal pollution and ecological risk assessment in marine sediments of Karachi Coast, Pakistan[J]. Environmental Monitoring and Assessment, 185(2): 1555-1565. DOI:10.1007/s10661-012-2650-9 |
MURAMATSU K, MASUDA S, YOSHIHARA Y, et al, 2003. In vitro degradation behavior of freeze-dried carboxymethyl- chitin sponges processed by vacuum-heating and gamma irradiation[J]. Polymer Degradation and Stability, 81(2): 327-332. DOI:10.1016/S0141-3910(03)00103-4 |
NAJAFI H, ASASIAN-KOLUR N, SHARIFIAN S, 2021. Adsorption of chromium(Ⅵ) and crystal violet onto granular biopolymer-silica pillared clay composites from aqueous solutions[J]. Journal of Molecular Liquids, 344: 117822. DOI:10.1016/j.molliq.2021.117822 |
OHEMENG-BOAHEN G, SEWU D D, TRAN H N, et al, 2021. Enhanced adsorption of congo red from aqueous solution using chitosan/hematite nanocomposite hydrogel capsule fabricated via anionic surfactant gelation[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 625: 126911. DOI:10.1016/j.colsurfa.2021.126911 |
PATEL P, RAJU N J, REDDY B C S R, et al, 2018. Heavy metal contamination in river water and sediments of the Swarnamukhi River Basin, India: Risk assessment and environmental implications[J]. Environmental Geochemistry and Health, 40(2): 609-623. DOI:10.1007/s10653-017-0006-7 |
SINI T K, SANTHOSH S, MATHEW P T, 2005. Study of the influence of processing parameters on the production of carboxymethylchitin[J]. Polymer, 46(9): 3128-3131. DOI:10.1016/j.polymer.2005.02.035 |
SRIVASTAVA N K, MAJUMDER C B, 2008. Novel biofiltration methods for the treatment of heavy metals from industrial wastewater[J]. Journal of Hazardous Materials, 151(1): 1-8. DOI:10.1016/j.jhazmat.2007.09.101 |
TAN I A W, HAMEED B H, AHMAD A L, 2007. Equilibrium and kinetic studies on basic dye adsorption by oil palm fibre activated carbon[J]. Chemical Engineering Journal, 127(1/2/3): 111-119. |
VALADI F M, SHAHSAVARI S, AKBARZADEH E, et al, 2022. Preparation of new MOF-808/chitosan composite for Cr(Ⅵ) adsorption from aqueous solution: Experimental and DFT study[J]. Carbohydrate Polymers, 288: 119383. DOI:10.1016/j.carbpol.2022.119383 |
WANG Q Q, DANG Q F, LIU C S, et al, 2021. Novel amidinothiourea-modified chitosan microparticles for selective removal of Hg(Ⅱ) in solution[J]. Carbohydrate Polymers, 269: 118273. DOI:10.1016/j.carbpol.2021.118273 |
WU S J, LI M Y, XIN L L, et al, 2022. Efficient removal of Cr(Ⅵ) by triethylenetetramine modified sodium alginate/carbonized chitosan composite via adsorption and photocatalytic reduction[J]. Journal of Molecular Liquids, 366: 120160. DOI:10.1016/j.molliq.2022.120160 |
XIANG L, NIU C G, TANG N, et al, 2021. Polypyrrole coated molybdenum disulfide composites as adsorbent for enhanced removal of Cr(Ⅵ) in aqueous solutions by adsorption combined with reduction[J]. Chemical Engineering Journal, 408: 127281. DOI:10.1016/j.cej.2020.127281 |
XIE B H, SHAN C, XU Z, et al, 2017. One-step removal of Cr(Ⅵ) at alkaline pH by UV/sulfite process: reduction to Cr(Ⅲ) and in situ Cr(Ⅲ) precipitation[J]. Chemical Engineering Journal, 308: 791-797. DOI:10.1016/j.cej.2016.09.123 |
XU C Z, XU Y L, ZHONG D J, et al, 2023. Zr4+ and glutaraldehyde cross-linked polyethyleneimine functionalized chitosan composite: Synthesis, characterization, Cr(Ⅵ) adsorption performance, mechanism and regeneration[J]. International Journal of Biological Macromolecules, 239: 124266. DOI:10.1016/j.ijbiomac.2023.124266 |
YEN M T, YANG J H, MAU J L, 2009. Physicochemical characterization of chitin and chitosan from crab shells[J]. Carbohydrate Polymers, 75(1): 15-21. DOI:10.1016/j.carbpol.2008.06.006 |
ZHANG S L, LI W, LI M L, et al, 2022. Efficient removal and detoxification of Cr(Ⅵ) by PEI-modified Juncus effuses with a natural 3D network structure[J]. Separation and Purification Technology, 297: 121543. DOI:10.1016/j.seppur.2022.121543 |
ZHU W J, DANG Q F, LIU C S, et al, 2019. Cr(Ⅵ) and Pb(Ⅱ) capture on pH-responsive polyethyleneimine and chloroacetic acid functionalized chitosan microspheres[J]. Carbohydrate Polymers, 219: 353-367. DOI:10.1016/j.carbpol.2019.05.046 |
 2023, Vol. 54
2023, Vol. 54


