中国海洋湖沼学会主办。
文章信息
- 何晴, 郭颖, 周仲元, 王悠, 周斌. 2023.
- HE Qing, GUO Ying, ZHOU Zhong-Yuan, WANG You, ZHOU Bin. 2023.
- 褶皱臂尾轮虫(Branchionus plicatilis)响应四溴联苯醚(BDE-47)胁迫的能量代谢变化研究
- THE CHANGES OF ENERGY METABOLISM OF ROTIFER BRACHIONUS PLICATILIS IN RESPONSE TO BDE-47 STRESS
- 海洋与湖沼, 54(6): 1611-1621
- Oceanologia et Limnologia Sinica, 54(6): 1611-1621.
- http://dx.doi.org/10.11693/hyhz20230300055
文章历史
-
收稿日期:2023-03-08
收修改稿日期:2023-04-14
2. 崂山实验室 山东青岛 266237
2. Laoshan Laboratory, Qingdao 266237, China
多溴联苯醚(polybrominated diphenyl ethers, PBDEs)是典型的持久性有机污染物(persistent organic pollutants, POPs), 是一种阻燃效率高、热稳定性好、用量少、对材料性能影响小且价格便宜的溴化阻燃剂, 被广泛应用于塑料、纺织品、电子电器等诸多领域(de Wit, 2002)。PBDEs以非共价键的形式结合在这些材料中, 因此非常容易释放到环境中(Rahman et al, 2001), 已有研究表明, 其在水体环境中分布广泛且检出率高(陈美林等, 2022)。PBDEs具有亲脂性, 容易在生物体内蓄积, 会随着食物链逐级传递, 因此会对生态可持续性和人类健康构成威胁(Wan et al, 2008; 邓洪齐等, 2022)。而在PBDEs家族共209种同系物中, 2, 2', 4, 4'-四溴联苯醚(BDE-47)是最主要的同系物之一, 在海洋环境中丰度高, 毒性强(耿倩倩等, 2022)。
海洋浮游动物在PBDEs的逐级传递过程中扮演重要角色, 同时也是影响海洋生态系统物质循环与能量流动的关键生物类群(Costa et al, 2008; Fonnum et al, 2009)。褶皱臂尾轮虫(Brachionus plicatilis)是我国近海海域常见的浮游动物之一, 分布广泛且对毒性物质敏感, 在2022年发布的《海洋生物水质基准推导技术指南(试行)》中, 它被列为适合开展毒性试验以推导我国海洋生物水质基准的120种推荐物种之一, 是海洋生态毒理学实验中理想的受试生物。
生物体的能量是有限的, 而其进行的所有生理活动都需要能量供给, 这就意味着当生物体面对环境压力时, 其能量在分配上可能发生变化, 进行必要的权衡(Smolders et al, 2004)。对紫贻贝(Mytilus edulis)进行的研究表明, 环境胁迫会引起紫贻贝的能量分配发生变化, 导致其倾向于将有限的能量分配给更重要的过程而用于生长、繁殖的能量减少, 甚至牺牲掉部分珍珠层(Melzner et al, 2011; Jiang et al, 2021); 早在1997年, De Coen等(1997)就基于生理能量学的细胞能量分配(CEA)方法评估了林丹和氯化汞对大型蚤(Daphnia magna)能量分配的影响, 并表明环境胁迫改变了大型蚤的能量分配。
代谢组学(Metabonomics)是继基因组学、转录组学和蛋白质组学之后, 系统生物学的重要组成部分, 也是目前组学领域研究热点之一。代谢组通过考察受试生物受扰动或刺激后, 其全部或部分代谢产物的变化来研究该刺激对受试生物代谢途径的影响, 目前已在水生生物的毒理学研究方面得到广泛应用。例如, Ren等(2018)应用代谢组学技术研究了短链氯化石蜡对斑马鱼(Danio rerio)胚胎和幼鱼发育以及代谢的影响; Dong等(2022)通过代谢组学技术揭示了栉孔扇贝(Chlamys farreri)响应热应激的能量代谢变化, 表明其具有通过调节能量代谢来适应热应激的潜力。
现有研究表明, 当暴露于PBDEs时, 褶皱臂尾轮虫的体型发育大小会受到抑制, 内壁结构模糊, 不透明度增加, 轮盘和背甲萎缩, 运动受到抑制(沙婧婧等, 2015), 个体产卵数降低(Sha et al, 2015), 线粒体发生损伤(Yang et al, 2021)等。而目前关于PBDEs对褶皱臂尾轮虫能量代谢的影响还缺乏足够了解, 因此本研究从能量获取出发, 探究在BDE-47胁迫条件下褶皱臂尾轮虫的能量代谢变化, 并基于液相色谱质谱(LC-MS)联用的非靶向代谢组学方法探究其潜在的作用机制, 为深入阐明BDE-47的海洋生态学效应提供理论依据。
1 材料与方法 1.1 实验材料 1.1.1 实验动物的培养实验所用褶皱臂尾轮虫由休眠卵孵化而来。将褶皱臂尾轮虫的休眠卵置于装有灭菌海水(盐度30, pH 8.6)的100 mL烧杯中, 于光照培养箱中培养, 温度(25±1) ℃, 光照周期12 h︰12 h, 光照强度60 μmol/(m2·s), 孵化期间投喂密度为1×106 cells/mL的饵料小球藻(Chlorella autotrophica)。培养4 d后, 在体式显微镜下挑选出活泼健壮的轮虫继续培养2个月待用, 培养条件与孵化条件一致, 整个培养过程无需充气。
1.1.2 主要试剂及配制实验所用海水, 经0.45 μm滤膜过滤, 121 ℃, 30 min高压灭菌冷却后使用。实验所用BDE-47为美国AccutSandard公司生产的白色粉末状固体产品, 纯度为100%, 选用二甲亚砜(DMSO)作为助溶剂。实验所采用的DMSO为Sigma-Aldrich公司生产, GC级, 纯度≥99%。BDE-47母液的配制: 将10 mg BDE-47溶于DMSO配制成2 000 mg/L的母液, 室温下避光保存, 实验时, 将BDE-47母液用过滤海水稀释成实验所需的浓度梯度。
1.2 实验方法 1.2.1 滤水率(F)和摄食率(G)的测定实验开始前, 将褶皱臂尾轮虫置于小球藻密度为1×106 cells/mL的烧杯中驯养48 h。在体式显微镜下挑选活泼健壮的挂卵轮虫, 收集幼虫(龄期 < 2 h)进行实验。实验设置空白对照组(海水对照组)、溶剂对照组(DMSO体积浓度为0.9%)、0.008 mg/L(低浓度)、0.08 mg/L(中浓度)、0.8 mg/L(高浓度)处理组和一个无轮虫组, 每组设置3个平行。实验体系为5 mL, 除无轮虫组外, 每组50只幼虫, 胁迫时间为24 h, 期间不再投喂小球藻。胁迫完成之后, 将每组中的50只幼虫重新挑出, 放置于体系为5 mL的海水-小球藻体系中, 并在黑暗环境中震荡培养, 以避免小球藻沉降和繁殖。所有组别体系中的小球藻数目保持一致, 并在放置之前先进行小球藻的计数以获得初始小球藻密度。摄食24 h后, 所有样品用卢戈氏碘液固定, 并在血球计数板上计数小球藻密度, 将无轮虫组的小球藻密度作为最终饵料密度。根据Frost (1972)公式采用饵料密度差减法计算每组的F和G:
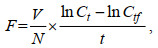 (1)
(1)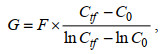 (2)
(2)其中, F为滤水率[mL/(ind.•h)]; G为摄食率[cells/(ind.•h)]; V为实验溶液体积; N为轮虫个体数(ind.); C0为起始饵料密度(cells/mL); Ct为无轮虫组中的最终饵料密度(cells/mL); Ctf为实验组中的最终饵料密度(cells/mL); t为摄食时间。
1.2.2 消化酶活性的测定实验设置空白对照组(海水对照组)、溶剂对照组(DMSO体积浓度为0.9%)、0.008 mg/L (低浓度)、0.08 mg/L (中浓度)和0.8 mg/L (高浓度)处理组。实验体系为50 mL, 胁迫时间24 h。胁迫完成后, 用PBS缓冲液收集至1.5 mL离心管中冰浴匀浆2 min, 600 g离心10 min, 取上清液即为粗酶液。α-淀粉酶、脂肪酶和胰蛋白酶的活性测定均使用南京建成分析试剂盒。
1.2.3 腺苷酸(TAP)含量的测定实验设置同1.2.2。实验体系250 mL, 胁迫时间24 h。腺苷酸的含量用液相色谱-质谱连用的方法检测。将褶皱臂尾轮虫收集到1.5 mL离心管中, 加0.9 mL一级水, 涡旋混匀, 超声提取15 min, 3 300 g离心10 min, 上清液过0.22 μm微孔滤膜后上机检测。色谱柱为Agilent C18 (2.1 mm×100 mm, 1.8 μm), 柱温30 ℃, 流速0.3 mL/min, 进样量为2 μL。总腺苷酸含量(TAP, 单位: μg/g ww, 湿重)的计算方法为(Atkinson et al, 1968):
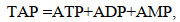 (3)
(3)其中, ATP为三磷酸腺苷, ADP为二磷酸腺苷, AMP为一磷酸腺苷。
1.2.4 能量储备(Ea)和能量消耗(Ec)的测定(1) 能量储备的测定: 以糖原、脂肪和蛋白质的含量表示褶皱臂尾轮虫体内的能量储备。实验设置同1.2.2。糖原含量的检测采用南京建成试剂盒, 蛋白质含量的检测使用索莱宝试剂盒, 脂肪含量采用重量法测定(Sloan et al, 2010)。不同的能量储备组分按照39 500 mJ/mg脂肪、24 000 mJ/mg蛋白质和17 500 mJ/mg糖原转化成其相应的能量值(Gnaiger, 1983), 总能量储备(Ea, 单位: mJ/mg ww)的计算公式为:
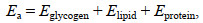 (4)
(4)其中, Eglycogen为糖原能量储备, Elipid为脂肪能量储备, Eprotein为蛋白质能量储备。
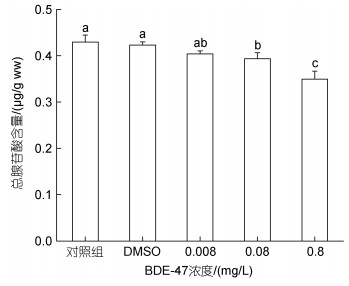
(2) 能量消耗的测定: 实验设置同1.2.2, 根据Owens等(1975)的方法以线粒体电子传递系统(ETS)的活性来表示能量消耗(Ec), 根据Gneiger(1983)的方法将得到的耗氧量转换为能量值(480 kJ/mol O2)。(3) 细胞能量分配(CEA)的计算公式为(Verslycke et al, 2004):
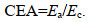 (5)
(5)(1) 样品收集: 实验设置空白对照组(海水对照组)和0.8 mg/L(高浓度)BDE-47处理组, 每组6个平行。实验体系150 mL, 胁迫时间24 h。胁迫完成后收集至2 mL细胞冻存管中, −80 ℃中保存待测。(2) 前处理: 向样本中加入两个小钢珠, 加入1 mL纯水; 在−40 ℃冰箱中放置2 min预冷, 放入研磨机中研磨(60 Hz, 2 min); 冰水浴超声提取30 min, −40 ℃静置2 h后13 000 g离心10 min, 取800 μL上清过SPE小柱, 收集3 mL甲醇洗脱液; 用氮吹仪吹干后, 加入300 μL甲醇-水(体积比为4︰1, 含L-2-氯苯丙氨酸, 4 μg/mL)复溶, 涡旋1 min, 冰水浴超声10 min, 于−40 ℃静置30 min后15 000 g离心10 min, 用注射器吸取150 μL的上清液, 使用0.22 μm的有机相针孔过滤器过滤后, 转移到LC进样小瓶, −80 ℃下保存, 直到进行LC-MS分析。(3) 液相色谱-质谱条件: 本次实验的分析仪器为ACQUITY UPLC I-Class plus超高效液相串联QE plus高分辨质谱仪组成的液质联用系统, 色谱柱: ACQUITY UPLC HSS T3 (100 mm×2.1 mm, 1.8 μm)。流动相A为超纯水(含0.1%的甲酸), B为乙腈。柱温45 ℃, 进样体积5 μL。质谱用电喷雾离子源, 样品质谱信号采集分别采用正负离子扫描模式。
1.3 数据分析数据表示为平均值±标准差(n = 3)。使用SPSS 24.0对所得的实验数据进行统计分析, 首先通过Shapiro- Wilk检验和Levene检验对数据进行正态分布和方差齐性检验, 然后采用单因素方差分析(one-way ANOVA)中的LSD来比较组间差异, 将P < 0.05作为差异显著的标准。用Origin 2021软件作图。
2 结果 2.1 BDE-47对褶皱臂尾轮虫摄食的影响BDE-47胁迫对褶皱臂尾轮虫滤水率(F)和摄食率(G)产生了影响(图 1)。
 |
| 图 1 BDE-47对褶皱臂尾轮虫滤水率、摄食率的影响 Fig. 1 Effect of BDE-47 on the filtering rate and feeding rate of B. plicatilis 注: a. 滤水率; b. 摄食率。DMSO为溶剂对照组, 不同字母表示各组具有显著性差异(P < 0.05), 以下同 |
对滤水率的研究结果表明(图 1a), BDE-47处理组褶皱臂尾轮虫的滤水率呈现出下降的趋势, 与空白对照组相比, 除低浓度处理组滤水率无显著性差异外(P > 0.05), 中浓度处理组和高浓度处理组滤水率都显著性降低(P < 0.05), 高浓度处理组中, 褶皱臂尾轮虫的滤水率下降至空白对照组的47.12%。
对摄食率的研究结果表明(图 1b), 与滤水率相比, 摄食率受到的影响相对较小, 与空白对照组相比, 只有在高浓度处理组中, 褶皱臂尾轮虫的摄食率才出现显著性降低(P < 0.05), 为空白对照组的59.80%。
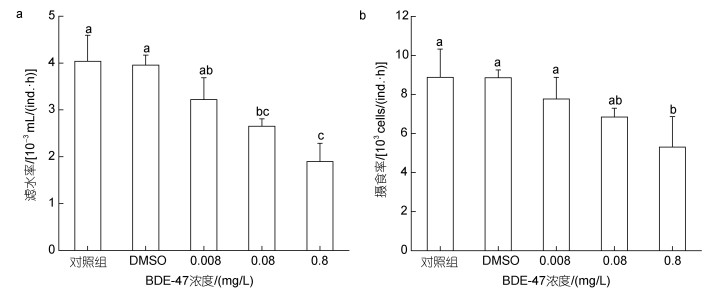
2.2 BDE-47对褶皱臂尾轮虫消化的影响BDE-47胁迫对褶皱臂尾轮虫三种主要消化酶(α-淀粉酶、胰蛋白酶、脂肪酶)的活性均产生了影响(图 2)。
 |
| 图 2 BDE-47对褶皱臂尾轮虫消化酶活性的影响 Fig. 2 Effect of BDE-47 on the digestive enzyme activities of B. plicatilis 注: a. α-淀粉酶; b. 胰蛋白酶; c. 脂肪酶 |
对于α-淀粉酶而言(图 2a), 与空白对照组相比, 在不同浓度的BDE-47胁迫下, 褶皱臂尾轮虫的α-淀粉酶活性均显著降低(P < 0.05); 低、中、高浓度处理组之间α-淀粉酶活性无显著差异(P > 0.05), 其中, 中浓度处理组α-淀粉酶活性为空白对照组的82.37%。
对于胰蛋白酶而言(图 2b), 在不同浓度的BDE-47胁迫下, 褶皱臂尾轮虫的胰蛋白酶活性水平均显著降低(P < 0.05), 但与α-淀粉酶的变化不同的是, 高浓度处理组胰蛋白酶活性显著低于低、中浓度处理组, 为空白对照组的76.45%。
对于脂肪酶而言(图 2c), 与空白对照组相比, 低、中浓度处理组脂肪酶活性无显著性差异(P) > 0.05); 在高浓度处理组中, 脂肪酶活性显著性降低(P < 0.05), 为空白对照组的77.24%。
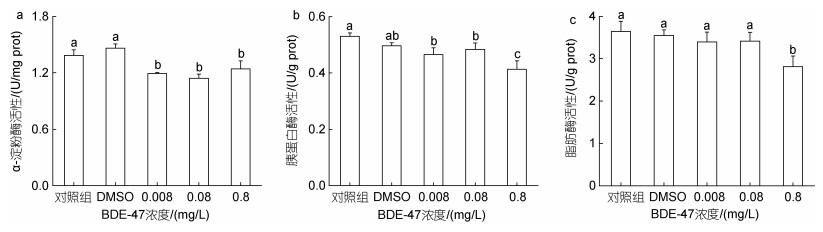
2.3 BDE-47对褶皱臂尾轮虫总腺苷酸含量的影响褶皱臂尾轮虫的总腺苷酸含量(TAP)受到BDE-47胁迫的显著影响(图 3)。低浓度组的褶皱臂尾轮虫腺苷酸含量没有出现显著性变化(P > 0.05), 中、高浓度处理组的腺苷酸含量出现显著性降低(P < 0.05), 尤其是高浓度处理组, TAP含量与空白对照组相比降低了18.6%。
 |
| 图 3 BDE-47对褶皱臂尾轮虫总腺苷酸含量(TAP)的影响 Fig. 3 Effect of BDE-47 on the total adenylate content (TAP) of B. plicatilis |
褶皱臂尾轮虫在BDE-47的胁迫下, 各能量组分及总能量储备的变化如表 1所示。与空白对照组相比, 在不同浓度的BDE-47胁迫下, 糖原和脂质含量均发生显著下降(P < 0.05)。不同的是, 糖原含量在BDE-47浓度为0.08 mg/L时出现最低值, 为空白对照组的69.73%, 脂质含量出现大幅下降, 最低值出现在高浓度组, 仅为空白对照组的38%。与糖原和脂质的变化趋势不同, 蛋白质含量在BDE-47胁迫下显著增加(P < 0.05), 并且在BDE-47浓度为0.8 mg/L时出现最大值。对于总的能量储备, 随着BDE-47浓度的不断升高, 褶皱臂尾轮虫的能量储备不断下降, 当BDE-47浓度为0.8 mg/L时出现最低值。
| BDE-47浓度 | Eglycogen | Elipid | Eprotein | Ea | Ec | CEA |
| 对照组 | 255.81±14.76a | 2 952.26±489.51a | 1 375.68±43.83c | 4 583.76±467.12a | 804.79±18.46b | 5.70±0.61a |
| DMSO | 247.41±7.50a | 2 643.50±343.85a | 1 398.40±18.83c | 4 289.31±359.07a | 817.90±71.23b | 5.30±0.85ab |
| 0.008 mg/L | 195.85±5.44b | 1 798.60±207.53b | 1 479.31±54.30b | 3 473.76±248.34b | 790.86±24.22b | 4.40±0.34bc |
| 0.08 mg/L | 151.98±3.88c | 1 685.53±264.23b | 1 576.60±28.61a | 3 414.10±274.63b | 959.21±50.30a | 3.56±0.20cd |
| 0.8 mg/L | 178.38±4.04d | 1 121.92±372.10b | 1 622.15±20.24a | 2 922.45±387.78b | 989.60±40.23a | 2.96±0.43d |
| 注: Eglycogen: 糖原能量储备; Elipid: 脂肪能量储备; Eprotein: 蛋白质能量储备; Ea: 能量储备; Ec: 能量消耗; CEA: 细胞能量分配; DMSO: 二甲亚砜 | ||||||
褶皱臂尾轮虫的能量消耗在低浓度的BDE-47条件下没有发生显著性变化(P > 0.05), 在中、高浓度组则表现出显著升高(P < 0.05), 并在0.8 mg/L时达到最大值, 与空白对照组相比, 增加了22.96%。
褶皱臂尾轮虫的细胞能量分配在不同浓度的BDE-47胁迫下呈现出显著降低(P < 0.05)。与空白对照组相比, 低、中、高浓度处理组的细胞能量分配值分别下降了22.87%、37.55%和48.08%。
2.5 BDE-47胁迫下褶皱臂尾轮虫的代谢组学分析 2.5.1 主成分分析本研究共检测到5 456个有注释的代谢物, 其中包括正离子模式下检测到的2 829个和负离子模式下检测到的2 627个。对这些代谢物进行主成分分析可见(图 4), 空白对照组与BDE-47处理组明显分离, 表明在BDE-47处理下褶皱臂尾轮虫的代谢物发生明显变化。
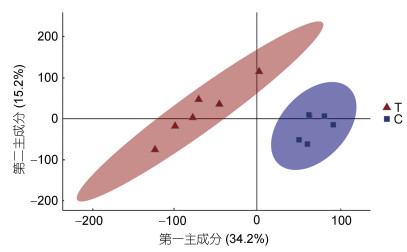 |
| 图 4 主成分分析图 Fig. 4 Diagram of the principal component analysis 注: C为空白对照组; T为BDE-47处理组 |
利用T检验和变异倍数分析比较两组之间的代谢产物, 以VIP(变量权重值) > 1且P-value < 0.05为条件筛选差异表达代谢物并进行富集分析, log2(FC) > 0(FC为差异倍数)为上调, log2(FC) < 0为下调。本实验重点关注了与糖代谢、氨基酸代谢和脂质代谢相关的差异代谢物, 将其进行统计如图 5和图 6所示。与糖代谢相关的差异代谢物有3种, 包括上调的果糖, 下调的β-D-葡萄糖醛酸苷和UDP-D-半乳糖醛酸酯; 与氨基酸代谢相关的差异代谢物有8种, 包括L-异亮氨酸、L-精氨酸和L-色氨酸等, 均呈现下调; 与脂质代谢相关的差异代谢物有15种, 包括上调的8种, 如溶血磷脂酰胆碱LysoPC (18:0/0:0)、LysoPC (16:0/0:0)和LysoPC (17:0/0:0)等, 下调的7种, 如十二碳五烯酸、二十二碳六烯酸和α-亚麻酸等。
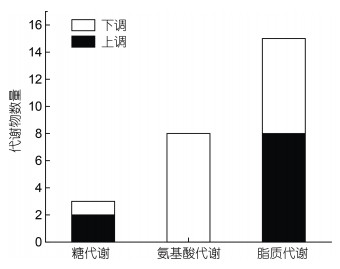 |
| 图 5 与糖代谢、氨基酸代谢、脂质代谢相关的差异代谢物汇总统计 Fig. 5 The statistics of differential metabolites related to glucose metabolism, amino acid metabolism, and lipid metabolism |
 |
| 图 6 与糖代谢、氨基酸代谢、脂质代谢相关的差异代谢物热图 Fig. 6 Heatmap of differential metabolites related to glucose metabolism, amino acid metabolism, and lipid metabolism 注: C1~C6为空白对照组的6个平行样品; T1~T6为BDE-47处理组的6个平行样品; 图例中红色表示上调, 蓝色表示下调, 颜色越深表示上下调幅度越大 |
对差异代谢物进行KEGG富集分析, 如图 7所示是差异代谢物富集气泡图, 分析发现, 在Top-20代谢通路中有5条与脂质代谢有关的通路: 不饱和脂肪酸的生物合成、甘油磷脂代谢、花生四烯酸代谢、乙醚类脂代谢和鞘磷脂代谢; 有5条与氨基酸代谢有关的通路: 甘氨酸/丝氨酸/苏氨酸代谢、精氨酸生物合成、缬氨酸/亮氨酸/异亮氨酸的生物合成、精氨酸和脯氨酸代谢和色氨酸代谢。除此之外, 在其余富集的代谢通路中, 还有与糖代谢有关的两条通路: 氨基糖和核苷酸糖代谢以及戊糖和葡萄糖醛酸的相互转化。
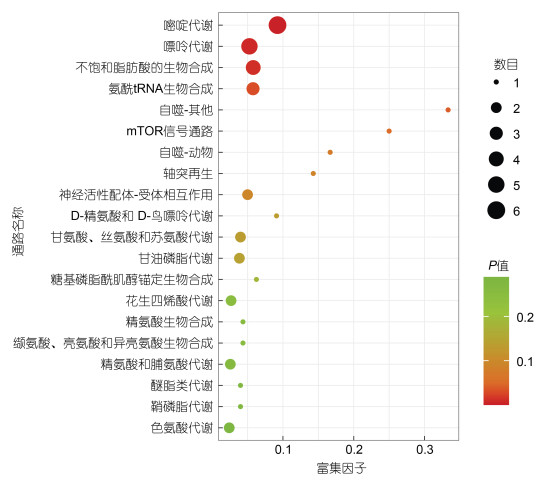 |
| 图 7 TOP-20气泡图 Fig. 7 The TOP-20 bubble diagram |
当外界环境发生变化时, 生物体的生长发育、运动和生殖等一系列生理过程和行为都会受到影响。而实际上, 生物体的所有生理活动都需要一定的能量成本(Jiang et al, 2021), 生物体生命过程中的所有生理和生化过程都严格依赖于它们的能量代谢, 生理表现与能量变化之间存在着密切联系。
3.1 BDE-47对褶皱臂尾轮虫摄食的影响摄食是影响浮游动物能量获取和分配的重要行为(Yan et al, 2017)。褶皱臂尾轮虫作为典型的滤食性浮游动物, 可以通过其滤水率和摄食率的变化研究摄食行为。本研究结果显示, BDE-47能够显著抑制褶皱臂尾轮虫的滤水率和摄食率, 并且具有浓度依赖效应。类似的结果在其他研究中也有报道, 如徐风风等(2013)的研究表明, 高浓度的BDE-47暴露会抑制日本虎斑猛水蚤(Tigriopus japonicas)的摄食; Zhao等(2019)关于两种PBDEs对大型蚤的研究表明, BDE-47和BDE-99胁迫24 h均会对大型蚤的摄食产生抑制, 且二者具有协同作用。究其原因, 可能是褶皱臂尾轮虫需要依靠游泳和头冠纤毛的转动将食物摄入口中, 即轮虫的摄食与运动能力密切相关。而已有的研究表明, BDE-47胁迫一方面会引起线粒体损伤并抑制ATP酶活性, 导致能量短缺从而抑制纤毛运动; 另一方面会抑制AChE活性, 扰乱神经传递, 导致褶皱臂尾轮虫产生运动障碍(沙婧婧等, 2015; Liu et al, 2018; Yang et al, 2021)。这一实验结果表明BDE-47可能首先通过抑制轮虫的摄食影响其能量状态。
3.2 BDE-47对褶皱臂尾轮虫消化的影响动物体摄取食物之后将进行消化和同化, 这是将摄取的食物转化为供有机体进行生命活动的能量的重要环节, 而消化酶在整个过程中发挥着关键作用。在本研究中, BDE-47对褶皱臂尾轮虫的α-淀粉酶、脂肪酶和胰蛋白酶活性均产生不同程度的抑制作用, 但对于α-淀粉酶的抑制作用最显著, 这可能与褶皱臂尾轮虫的食性有关(郭恩棉等, 2009)。该结果与Zhao等(2019)的研究结果相似, 即BDE-47和BDE-99会对大型蚤的消化酶产生抑制效果。
对上述结果提出了以下几种可能: (1) BDE-47对褶皱臂尾轮虫的摄食产生了抑制, 因此褶皱臂尾轮虫的消化腺受到食物蠕动的机械刺激减弱(郭恩棉等, 2009), 从而引起消化酶的活力降低; (2) 褶皱臂尾轮虫的消化腺结构发生损伤。已有研究表明, 贻贝在接触有机污染物和金属离子时, 贻贝组织会受到严重的损伤, 尤其是消化组织可能会出现萎缩或坏死(Cajaraville et al, 1990; Jiang et al, 2021); (3) 消化功能需要神经系统的参与和调节, PBDEs作为一种具有神经毒性的物质(李晋等, 2009), 可能通过影响神经系统影响到褶皱臂尾轮虫的消化功能; (4) PBDEs可能通过影响消化酶基因的表达, 从而对消化酶水平产生影响(Zhao et al, 2019)。
3.3 BDE-47对褶皱臂尾轮虫腺苷酸含量的影响不论是摄食量的减少还是消化酶活性的降低, 都将影响生物体对于能源物质的获取, 进而可能引起生物体能量状态的改变。
一般来说, 尽管ATP、ADP和AMP的比例会随着磷酸化的水平出现一定的波动, 但总腺苷酸含量(TAP)总体上是稳定的, 其含量不仅反映细胞产生高能磷酸化合物的能力, 而且反映了细胞的能量储备状态(Guo et al, 2021)。在本研究中, 与对照组相比, 低浓度处理组的褶皱臂尾轮虫TAP含量没有发生显著变化(P > 0.05), 但在中、高浓度组, 褶皱臂尾轮虫的TAP含量显著性降低(P < 0.05), 这一现象在Jiang等(2021)对紫贻贝响应BDE-47的研究和Guo等(2021)对紫贻贝响应海水酸化的研究中也有报道, 这意味着ATP合成的潜在储备量减少, BDE-47对褶皱臂尾轮虫的能量状态产生了负面影响。
3.4 BDE-47对褶皱臂尾轮虫能量分配的影响目前, 基于细胞能量分配(CEA)方法探讨环境胁迫对褶皱臂尾轮虫影响的研究尚未见报道, 本研究首次基于该方法对BDE-47胁迫下褶皱臂尾轮虫的能量分配进行了研究。结果显示, 作为生物体三大主要供能物质的糖原、脂质和蛋白质均受到BDE-47胁迫的影响, BDE-47胁迫加剧了褶皱臂尾轮虫对糖原和脂质的消耗, 而增加了蛋白质的合成, 这表明褶皱臂尾轮虫可能需要合成更多的蛋白质用以抵御BDE-47暴露带来的不利影响, 例如热休克蛋白(Grosell et al, 2009)。而对于总的能量储备而言, 随着BDE-47浓度的升高, 褶皱臂尾轮虫的能量储备逐渐降低。正如前面所述, 摄食量的减少以及消化能力的降低是引起这一结果的原因之一, 另外, 能量储备的降低也可能是消耗增加的结果。本研究结果显示, BDE-47胁迫增加了褶皱臂尾轮虫的能量消耗, 这可能是其抵御BDE-47胁迫以维持自身生存的需要。相似的研究结果在贻贝和大型蚤的研究中也有报道, 例如, 厚壳贻贝(Mytilus coruscus)暴露于海洋微塑料和酸化条件中14 d, 均会导致其能量储备降低和能量消耗增加(Shang et al, 2021, 2023); 大型蚤暴露于林丹中也会引起其能量储备下降和能量消耗增加(De Coen et al, 1997)。
环境变化会扰乱机体对于能量的分配(唐佳等, 2022), 细胞能量分配可以综合反映生物体在环境胁迫条件下的能量状况, 能量分配的下降通常意味着可用于生长和繁殖的能量减少(Verslycke et al, 2004)。本研究结果显示, BDE-47胁迫降低了褶皱臂尾轮虫的细胞能量分配, 这是能量储备减少和能量消耗增加共同导致的结果, 提示BDE-47会对褶皱臂尾轮虫的生长和繁殖产生不利影响。与本研究结果类似, De Coen等(2003)研究了CdCl2、五氯酚酸钠和直链烷基苯磺酸等六种毒性物质对大型水蚤细胞能量分配的影响, 结果表明, 环境胁迫会对大型蚤的糖原、脂质和蛋白质含量产生影响, 细胞能量分配降低, 并表明这是能量储备降低和能量消耗增加同时作用的结果。在Muyssen等(2001)对大型蚤耐锌性的研究中, 更是提出了细胞能量分配的降低, 尤其是脂肪含量的降低可能是大型水蚤在生存和繁殖之间的一种权衡, 而这终将反映在生物体的种群动态中。
3.5 基于代谢组学探讨褶皱臂尾轮虫应对BDE-47胁迫的能量响应机制为进一步探究BDE-47暴露对褶皱臂尾轮虫能量代谢的影响, 在生理实验的基础上, 本研究应用代谢组学技术对差异最显著的高浓度BDE-47处理组和空白对照组进行了非靶向代谢组学的研究。研究结果表明, BDE-47胁迫影响了褶皱臂尾轮虫的能量代谢, 尤其是氨基酸代谢和脂质代谢。
氨基酸参与生物体的渗透调节、能量代谢和蛋白质合成, 在生物体的代谢中起着重要作用(Gu et al, 2021)。不少研究表明, 当暴露于各种外源性污染物时, 海洋生物体内的氨基酸水平以及氨基酸代谢相关通路会发生变化, 受到严重影响。例如, 邻苯二甲酸酯(PAE)暴露使得厚壳贻贝的多条氨基酸代谢途径受到影响(精氨酸生物合成、酪氨酸代谢、精氨酸和脯氨酸代谢等), 多种氨基酸出现不同程度的上下调, 表明PAE暴露后贻贝中的蛋白质合成被阻断, 并且氨基酸的显著变化也表明了PAE暴露干扰了贻贝的渗透调节机制(Gu et al, 2021)。大型蚤暴露于两种有机磷酸盐和双酚A中均会造成氨基酸含量发生变化, 这可能与大型蚤中能量动力学的改变有关(Nagato et al, 2016)。本研究结果显示, BDE-47暴露影响了褶皱臂尾轮虫中与氨基酸代谢相关的途径, 下调了氨基酸及其衍生物的水平。氨基酸含量的下调可能是氨基酸充当供能物质进行分解供能, 也可能是作为蛋白质的基本组成单位进行蛋白质的合成, 结合本实验前面的实验结果, 氨基酸含量的下调可能更倾向于用以合成蛋白质而非分解供能, 以抵抗BDE-47的胁迫维持正常生存。这种氨基酸的变化模式在其他研究中也有报道, 例如, 将大型蚤暴露于镉中发现其氨基酸发生下调, 并且作者强调氨基酸水平降低的一个潜在机制是摄食吸收减少(Poynton et al, 2011), 这在本研究中也有所体现。
另外, 甘油磷脂代谢、花生四烯酸代谢和鞘磷脂代谢等也是BDE-47胁迫触发的代谢通路, 表明BDE-47暴露对褶皱臂尾轮虫的脂质代谢产生了明显的影响。就富集在脂质代谢相关通路上的差异代谢物而言, 有6种溶血磷脂酰胆碱(lysoPC)和1种磷酸乙醇胺(PE)呈现上调, 这种变化在斑马鱼的研究中也有报道, 即微塑料(Zhao et al, 2021)和短链氯化石蜡(Ren et al, 2018)的暴露使得斑马鱼的脂质过氧化相关代谢物升高, 其中包括lysoPC和PE。而研究表明, lysoPC的积累与氧化应激和炎症损伤有关(Shao et al, 2018; Nanayakkara et al, 2019), 并且可以触发线粒体活性氧(mtROS)的产生(Li et al, 2016)。因此通过代谢组lysoPC和PE的上调推测BDE-47会导致褶皱臂尾轮发生脂质过氧化, 导致氧化损伤, 事实上本课题组前期已经证实了这一结论(沙婧婧, 2015), 而对于lysoPC触发的线粒体活性氧的产生则可能是本实验中腺苷酸含量失衡的原因。脂肪酸是重要的能量来源, 在脂质组成中起着关键作用(Xicoy et al, 2019)。在本研究中, 除了观察到lysoPC和PE的上调之外, 还存在一些下调的脂肪酸, 例如十二碳五烯酸、二十二碳六烯酸、α-亚麻酸以及花生四烯酸, 考虑到这些物质都是水生生物的必需氨基酸(Glencross, 2009), 需要从外界摄食获取, 因此代谢组中检测到的此类脂肪酸下调既可能是因为褶皱臂尾轮虫暴露于BDE-47后消耗了脂肪酸以提供自身所需能量, 也可能是由于摄食量的减少以及消化能力的降低所导致的, 而脂肪酸类的下调尤其是花生四烯酸的下调表明BDE-47暴露会对褶皱臂尾轮虫的繁殖产生不利影响(Wang et al, 2018; Cho et al, 2022)。
相较于脂质代谢和氨基酸代谢, BDE-47暴露对褶皱臂尾轮虫的糖代谢产生的影响较小, 其中仅有果糖含量发生下调, 这将有利于为褶皱臂尾轮虫应对BDE-47胁迫提供能量。
4 结论BDE-47胁迫能够抑制褶皱臂尾轮虫的摄食和消化, 从源头上减少了对于能源物质的获取; 引起腺苷酸库失衡, 对褶皱臂尾轮虫的能量状态产生负面影响; 导致能量储备的减少以及能量消耗的增加, 二者共同引起了细胞能量分配降低。
BDE-47胁迫能够调控褶皱臂尾轮虫的氨基酸代谢、脂质代谢和糖代谢相关通路, 下调氨基酸、脂肪酸以及果糖水平, 上调lysoPC和PE。
邓洪齐, 郭俊恺, 刘浩, 等, 2022. 多溴联苯醚的心血管毒性研究进展[J]. 癌变·畸变·突变, 34(4): 318-323. |
李晋, 王爱国, 2009. 多溴联苯醚的神经毒性作用机制研究进展[J]. 环境与健康杂志, 26(10): 937-939. |
沙婧婧, 2015. 两种多溴联苯醚(BDE-47、BDE-209)对褶皱臂尾轮虫(Brachionus plicatilis)的毒性效应研究[D]. 青岛: 中国海洋大学: 85-87.
|
沙婧婧, 王悠, 王鸿, 等, 2015. 2种多溴联苯醚(BDE-47、BDE-209)对褶皱臂尾轮虫单一和联合毒性效应研究[J]. 中国海洋大学学报(自然科学版), 45(9): 69-77. |
陈美林, 高雅倩, 郭瑞昕, 等, 2022. 多溴联苯醚类污染物在水体中的分布、转化和生态毒性研究进展[J]. 生态毒理学报, 17(4): 291-301. |
耿倩倩, 郭萌萌, 李风铃, 等, 2022. BDE-47在紫贻贝中的分布、蓄积、消除和毒性效应[J]. 中国环境科学, 42(3): 1385-1393. |
徐风风, 朱丽岩, 巩文静, 等, 2013. 四溴联苯醚(BDE-47)对两种海洋桡足类动物的毒性效应[J]. 生态毒理学报, 8(5): 737-747. |
郭恩棉, 王鑫, 陈孝花, 等, 2009. 饥饿与再投喂对褶皱臂尾轮虫几种消化酶活力的影响[J]. 中国农学通报, 25(10): 290-295. |
唐佳, 蔡文启, 闫智聪, 等, 2022. 海水酸化和Cu2+暴露对虫黄藻Cladocopium goreaui营养同化和能量分配的影响[J]. 海洋科学, 46(4): 98-105. |
ATKINSON D E, 1968. Energy charge of the adenylate pool as a regulatory parameter. Interaction with feedback modifiers[J]. Biochemistry, 7(11): 4030-4034. DOI:10.1021/bi00851a033 |
CAJARAVILLE M P, DIEZ G, MARIGÓMEZ I A, et al, 1990. Responses of basophilic cells of the digestive gland of mussels to petroleum hydrocarbon exposure[J]. Diseases of Aquatic Organisms, 9(3): 221-228. |
CHO H, SEOL Y, BAIK S, et al, 2022. Mono (2-ethylhexyl) phthalate modulates lipid accumulation and reproductive signaling in Daphnia magna[J]. Environmental Science and Pollution Research, 29(37): 55639-55650. DOI:10.1007/s11356-022-19701-1 |
COSTA L G, GIORDANO G, TAGLIAFERRI S, et al, 2008. Polybrominated diphenyl ether (PBDE) flame retardants: environmental contamination, human body burden and potential adverse health effects[J]. Acta Bio-medica: Atenei Parmensis, 79(3): 172-183. |
DE COEN W M, JANSSEN C R, 1997. The use of biomarkers in Daphnia magna toxicity testing. Ⅳ. Cellular energy allocation: a new methodology to assess the energy budget of toxicant-stressed Daphnia populations[J]. Journal of Aquatic Ecosystem Stress and Recovery, 6(1): 43-55. DOI:10.1023/A:1008228517955 |
DE COEN W M, JANSSEN C R, 2003. The missing biomarker link: Relationships between effects on the cellular energy allocation biomarker of toxicant-stressed Daphnia magna and corresponding population characteristics[J]. Environmental Toxicology and Chemistry, 22(7): 1632-1641. |
DE WIT C A, 2002. An overview of brominated flame retardants in the environment[J]. Chemosphere, 46(5): 583-624. DOI:10.1016/S0045-6535(01)00225-9 |
DONG X X, YANG Z J, LIU Z, et al, 2022. Metabonomic analysis provides new insights into the response of Zhikong scallop (Chlamys farreri) to heat stress by improving energy metabolism and antioxidant capacity[J]. Antioxidants, 11(6): 1084. DOI:10.3390/antiox11061084 |
FONNUM F, MARIUSSEN E, 2009. Mechanisms involved in the neurotoxic effects of environmental toxicants such as polychlorinated biphenyls and brominated flame retardants[J]. Journal of Neurochemistry, 111(6): 1327-1347. DOI:10.1111/j.1471-4159.2009.06427.x |
FROST B W, 1972. Effects of size and concentration of food particles on the feeding behavior of the marine planktonic copepod Calanus pacificusi[J]. Limnology and Oceanography, 17(6): 805-815. DOI:10.4319/lo.1972.17.6.0805 |
GLENCROSS B D, 2009. Exploring the nutritional demand for essential fatty acids by aquaculture species[J]. Reviews in Aquaculture, 1(2): 71-124. DOI:10.1111/j.1753-5131.2009.01006.x |
GNAIGER E, 1983. Calculation of energetic and biochemical equivalents of respiratory oxygen consumption [M] // GNAIGER E, FORSTNER H. Polarographic Oxygen Sensors: Aquatic and Physiological Applications. Berlin: Springer: 337-345.
|
GROSELL M, GENZ J, TAYLOR J R, et al, 2009. The involvement of H+-ATPase and carbonic anhydrase in intestinal HCO3–secretion in seawater-acclimated rainbow trout[J]. Journal of Experimental Biology, 212(12): 1940-1948. DOI:10.1242/jeb.026856 |
GU Y Y, WEI Q, WANG L Y, et al, 2021. A comprehensive study of the effects of phthalates on marine mussels: bioconcentration, enzymatic activities and metabolomics[J]. Marine Pollution Bulletin, 168: 112393. DOI:10.1016/j.marpolbul.2021.112393 |
GUO Y, ZHOU B, SUN T L, et al, 2021. An explanation based on energy-related changes for blue mussel Mytilus edulis coping with seawater acidification[J]. Frontiers in Physiology, 12: 761117. DOI:10.3389/fphys.2021.761117 |
JIANG Y S, WANG Y, SUN T L, et al, 2021. Depicting an energetic chain involved in physiological responses of blue mussel Mytilus edulis coping with BDE-47 exposure[J]. Chemosphere, 269: 128736. DOI:10.1016/j.chemosphere.2020.128736 |
LI X Y, FANG P, LI Y F, et al, 2016. Mitochondrial reactive oxygen species mediate lysophosphatidylcholine-induced endothelial cell activation[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 36(6): 1090-1100. DOI:10.1161/ATVBAHA.115.306964 |
LIU Y H, GUO R X, TANG S K, et al, 2018. Single and mixture toxicities of BDE-47, 6-OH-BDE-47 and 6-MeO-BDE-47 on the feeding activity of Daphnia magna: from behavior assessment to neurotoxicity[J]. Chemosphere, 195: 542-550. DOI:10.1016/j.chemosphere.2017.12.045 |
MELZNER F, STANGE P, TRÜBENBACH K, et al, 2011. Food supply and seawater pCO2 impact calcification and internal shell dissolution in the blue mussel Mytilus edulis[J]. PLoS One, 6(9): e24223. DOI:10.1371/journal.pone.0024223 |
MUYSSEN B T A, JANSSEN C R, 2001. Multigeneration zinc acclimation and tolerance in Daphnia magna: implications for water-quality guidelines and ecological risk assessment[J]. Environmental Toxicology and Chemistry, 20(9): 2053-2060. |
NAGATO E G, SIMPSON A J, SIMPSON M J, 2016. Metabolomics reveals energetic impairments in Daphnia magna exposed to diazinon, malathion and bisphenol-A[J]. Aquatic Toxicology, 170: 175-186. DOI:10.1016/j.aquatox.2015.11.023 |
NANAYAKKARA G K, WANG H, YANG X F, 2019. Proton leak regulates mitochondrial reactive oxygen species generation in endothelial cell activation and inflammation-a novel concept[J]. Archives of Biochemistry and Biophysics, 662: 68-74. DOI:10.1016/j.abb.2018.12.002 |
OWENS T G, KING F D, 1975. The measurement of respiratory electron-transport-system activity in marine zooplankton[J]. Marine Biology, 30(1): 27-36. DOI:10.1007/BF00393750 |
POYNTON H C, TAYLOR N S, HICKS J, et al, 2011. Metabolomics of microliter hemolymph samples enables an improved understanding of the combined metabolic and transcriptional responses of Daphnia magna to cadmium[J]. Environmental Science & Technology, 45(8): 3710-3717. |
RAHMAN F, LANGFORD K H, SCRIMSHAW M D, et al, 2001. Polybrominated diphenyl ether (PBDE) flame retardants[J]. Science of the Total Environment, 275(1/2/3): 1-17. |
REN X Q, ZHANG H J, GENG N B, et al, 2018. Developmental and metabolic responses of zebrafish (Danio rerio) embryos and larvae to short-chain chlorinated paraffins (SCCPs) exposure[J]. Science of the Total Environment, 622/623: 214-221. |
SHA J J, WANG Y, LV J X, et al, 2015. Effects of two polybrominated diphenyl ethers (BDE-47, BDE-209) on the swimming behavior, population growth and reproduction of the rotifer Brachionus plicatilis[J]. Journal of Environmental Sciences, 28: 54-63. |
SHANG Y Y, WANG X H, CHANG X Q, et al, 2021. The effect of microplastics on the bioenergetics of the mussel Mytilus coruscus assessed by cellular energy allocation approach[J]. Frontiers in Marine Science, 8: 754789. |
SHANG Y Y, WANG X H, SHI Y T, et al, 2023. Ocean acidification affects the bioenergetics of marine mussels as revealed by high-coverage quantitative metabolomics[J]. Science of the Total Environment, 858: 160090. |
SHAO Y, NANAYAKKARA G, CHENG J L, et al, 2018. Lysophospholipids and their receptors serve as conditional DAMPs and DAMP receptors in tissue oxidative and inflammatory injury[J]. Antioxidants & Redox Signaling, 28(10): 973-986. |
SLOAN C A, ANULACION B F, BOLTON J L, et al, 2010. Polybrominated diphenyl ethers in outmigrant juvenile Chinook salmon from the lower Columbia River and estuary and Puget Sound, Washington[J]. Archives of Environmental Contamination and Toxicology, 58(2): 403-414. |
SMOLDERS R, BERVOETS L, DE COEN W, et al, 2004. Cellular energy allocation in zebra mussels exposed along a pollution gradient: linking cellular effects to higher levels of biological organization[J]. Environmental Pollution, 129(1): 99-112. |
VERSLYCKE T, GHEKIERE A, JANSSEN C R, 2004. Seasonal and spatial patterns in cellular energy allocation in the estuarine mysid Neomysis integer (Crustacea: Mysidacea) of the Scheldt estuary (The Netherlands)[J]. Journal of Experimental Marine Biology and Ecology, 306(2): 245-267. |
WAN Y, HU J J, ZHANG K, et al, 2008. Trophodynamics of polybrominated diphenyl ethers in the marine food web of Bohai Bay, North China[J]. Environmental Science & Technology, 42(4): 1078-1083. |
WANG P, NG Q X, ZHANG H, et al, 2018. Metabolite changes behind faster growth and less reproduction of Daphnia similis exposed to low-dose silver nanoparticles[J]. Ecotoxicology and Environmental Safety, 163: 266-273. |
XICOY H, WIERINGA B, MARTENS G J M, 2019. The role of lipids in Parkinson's disease[J]. Cells, 8(1): 27. |
YAN Z Y, YAN K, HE X L, et al, 2017. The impact assessment of anticancer drug imatinib on the feeding behavior of rotifers with an integrated perspective: exposure, post-exposure and re-exposure[J]. Chemosphere, 185: 423-430. |
YANG Y Y, JIAN X Y, TANG X X, et al, 2021. Feeding behavior toxicity in the marine rotifer Brachionus plicatilis caused by 2, 2′, 4, 4′-tetrabromodiphenyl ether (BDE-47): characteristics and mechanisms[J]. Chemosphere, 271: 129512. |
ZHAO Y P, QIAO R X, ZHANG S Y, et al, 2021. Metabolomic profiling reveals the intestinal toxicity of different length of microplastic fibers on zebrafish (Danio rerio)[J]. Journal of Hazardous Materials, 403: 123663. |
ZHAO Y C, WANG Z L, LI D T, et al, 2019. Two PBDEs exposure inducing feeding depression and disorder of digestive and antioxidative system of Daphnia magna[J]. Ecotoxicology and Environmental Safety, 176: 279-287. |
 2023, Vol. 54
2023, Vol. 54


