中国海洋湖沼学会主办。
文章信息
- 冷天泽, 顾海峰, 王瑞芳, 郭卓然, 陆斗定, 戴鑫烽. 2023.
- LENG Tian-Ze, GU Hai-Feng, WANG Rui-Fang, GUO Zhuo-Ran, LU Dou-Ding, DAI Xin-Feng. 2023.
- 中国东海倪氏异冒藻(Heterocapsa niei)的超微形态结构及其分子特征
- ULTRAMORPHOLOGICAL AND MOLECULAR CHARACTERS OF HETEROCAPSA NIEI (DINOPHYCEAE) FROM THE EAST CHINA SEA
- 海洋与湖沼, 54(6): 1634-1644
- Oceanologia et Limnologia Sinica, 54(6): 1634-1644.
- http://dx.doi.org/10.11693/hyhz20230400084
文章历史
-
收稿日期:2023-04-12
收修改稿日期:2023-05-12
2. 自然资源部海洋生态保护与修复重点实验室 自然资源部第三海洋研究所 福建厦门 361005;
3. 浙江大学海洋学院 浙江舟山 316000
2. Key Laboratory of Marine Ecological Conservation and Restoration, Third Institute of Oceanography, Ministry of Natural Resources, Xiamen 361005, China;
3. Ocean College, Zhejiang University, Zhoushan 316000, China
异冒藻属(Heterocapsa)是一类重要的具壳板的甲藻, 包含一些赤潮种, 如环鳞异冒藻(Heterocapsa circularisquama Horiguchi)、极小异冒藻(Heterocapsa pygmaea Loeblich Lii)、圆形异冒藻(Heterocapsa rotundata Hansen)、斯氏异冒藻(Heterocapsa steinii Tillmann)和渤海异冒藻(Heterocapsa bohaiensis J Xiao & R Li)(Baek et al, 2011; Tas, 2015; Sunesen et al, 2020), 由其形成赤潮的区域包括温带和亚热带海域的绝大多数海区(Tas, 2015; Ojamäe, 2016; Xiao et al, 2018)。其中环鳞异冒藻和渤海异冒藻产毒, 尤其环鳞异冒藻因其赤潮期间多次引起鱼虾死亡而备受关注(Hansen, 1995; Baek et al, 2011; Millette et al, 2017)。
异冒藻属是Stein在1883年建立的, 但由于早期缺少清晰的形态学特征描述和分子学数据, 其模式种有过变动。Stein最初在三角薄甲藻(Glenodinium triquetrum Ehrenberg)的基础上建立了该属的模式种为三角异冒藻(Heterocapsa triquetra Stein)(Tillmann et al, 2017), 130年后, 依据更清晰的形态学和分子学特征, Gottschling等(2019)建议将三角异冒藻改为Kryptoperidinium triquetrum Tillmann, 而把斯氏异冒藻定为异冒藻属的模式种(Tillmann et al, 2017)。在Morrill等(1981)描述了该属的完整甲板方程式之后, 甲板的排列方式成为该属种间鉴定的重要参考依据(Iwataki, 2008)。到目前为止, 异冒藻属一共包含29个种(Hanifah et al, 2022; Wu et al, 2022), 该属公认的甲板方程式为Po, cp, 5′, 3a, 7″, 6c, 5~8s, 5″′, 0~1p, 2″″(Tas, 2015)。异冒藻属不同种之间的细胞大小差异较大, 如微小异冒藻(Heterocapsa minima Pomroy)长为7.4 μm, 而太平洋异冒藻(Heterocapsa pacifica Kofoid)长为45 μm (Pomroy, 1989; Iwataki, 2008)。体鳞是异冒藻属一个十分重要的分类保守特征, Iwataki等(2004)提出可以根据不同特征的体鳞来进行种间区分。20世纪80年代, 在香港暴发了多次环鳞异冒藻赤潮, 这是首次在中国海域报道异冒藻(Iwataki, 2002a)。之后, 在东海发现了微小异冒藻和斯氏异冒藻(刘瑞玉, 2008)。近几年, 多次在长江口、大连和青岛近岸检测到环鳞异冒藻和圆形异冒藻(王金辉等, 2006; 刘霜等, 2014)。2008和2012年, 在辽宁盘锦养殖池中暴发了赤潮, 造成大量虾和中华绒螯蟹幼虫死亡, 最后该赤潮原因种被描述为一个新种: 渤海异冒藻(Xiao et al, 2018; 冯彤彤, 2019)。2019年, 福建霞浦暴发的赤潮导致大量鲍鱼死亡, 分离出的堀口异冒藻(Heterocapsa horiguchii)、极小异冒藻和倪氏异冒藻对卤虫有致死效应, 且在有光照时对兔的红细胞有溶血性(Wu et al, 2022)。这是倪氏异冒藻在中国首次被报道, 林森杰教授团队对其形态学和分子学做了一定的描述(Wu et al, 2022)。本次研究是在此基础上开展的更为细致的超微形态学研究, 并详细阐述了多层膜藻类的激光共聚焦显微镜、扫描电镜、透射电镜样品和体鳞染色制作过程, 希望能给后来者提供参考。
1 材料与方法 1.1 藻株分离与培养实验藻株(编号: SIO-H3)于2016年6月在福建省厦门湾采用单细胞分离法得到。采用f/2培养基进行培养(Guillard, 1975), 取远洋海水, 用0.2 µm GF/F膜进行过滤, 加入纯水调节盐度在31~33, 于121 ℃下高温高压灭菌30 min, 浓缩培养基和灭菌海水以1 mL︰1 L比例进行配置。培养环境温度(20±1) ℃, 光照强度130 µmol/(m2·s), 光照周期12 h︰12 h (光︰暗)。
1.2 光学显微镜和激光共聚焦显微镜观察取1 mL指数生长期的藻株培养液, 置于光学显微镜(BX53, Olympus, 日本)下观察并拍照, 使用Olympus cell Sens Standard 2.3 (Olympus, 日本)软件测量细胞大小, 测量细胞数50个或以上。利用激光共聚焦显微镜观察叶绿体和细胞核的形态和分布特征, 为观察到细胞核, 在拍摄前, 加入SYBR green I (Sigma- Aldrich, 上海, 中国, 终浓度0.1 µg/mL)试剂进行染色30~60 s, 在630× (TCS SP5 II, Leica Mannheim, 德国)下拍摄。
1.3 扫描电子显微镜样品处理 1.3.1 固定取2 mL指数期藻液于2 mL离心管中, 以3 000 r/min转速离心10 min (22331, Eppendorf AG, Hamburg, 德国), 去除上清液, 加入1.5 mL 2.5%浓度戊二醛溶液(盐度30)中固定(生工生物工程(上海)股份有限公司, 中国), 于冰箱内4 ℃冷藏过夜。
1.3.2 脱盐和脱水用天然灭菌海水(盐度30)和纯水配置不同盐度梯度(海水与纯水体积比依次为9︰1, 7︰3, 5︰5和3︰7)混合处理液, 将样品浸入其中进行脱盐, 每个梯度30 min, 最后用纯水进行两次30 min的脱盐。再用30%、50%、70%、90%和100%浓度系列乙醇进行梯度脱水, 每一步30 min, 最后用100%乙醇再进行一次30 min脱水处理。
1.3.3 干燥、喷金和观察样品干燥使用二氧化碳临界点干燥仪(大连卓尔高科技有限公司, 中国), 将干燥舱温度调节至10 ℃, 之后放入样品, 充入二氧化碳液体, 待液体覆盖样品后, 等待5 min, 之后排气, 充-排气一共循环3次。然后用导电胶将样品贴到铜制载物台上, 进行表面喷金处理(MSP-1S, Vacuum Device, 日本), 样品制作完成。利用扫描电子显微镜(Ultra 55, Zeiss, Carl 115 Zeiss AB, 德国)进行拍照, 照片通过软件Adobe Photoshop 2021 (Adobe Systems, San Jose, California, 美国)进行后期处理。
1.4 透射电子显微镜样品处理 1.4.1 固定取2 mL指数生长期藻液于2 mL离心管中以3 000 r/min离心5 min (22331, Eppendorf AG, Hamburg, 德国), 去除上清液后, 加入1.5 mL 2.5%浓度的戊二醛溶液(盐度30天然灭菌海水配置), 室温下固定4 h。之后用中性磷酸缓冲液漂洗样品3次, 每次15 min, 再用锇酸溶液(盐度30灭菌天然海水配置, 终浓度1%)固定1~2 h, 用中性缓冲液洗涤3次, 每次15 min。
1.4.2 脱水将上述样品依次置于梯度浓度(30%, 50%, 70%, 80%, 90%和95%)乙醇溶液中, 每个梯度15 min, 用100%乙醇和丙酮(100%浓度)依次再各脱水20 min。
1.4.3 渗透与包埋在室温下, 将上述样品加入到用Spurr包埋剂(SPI-CHEM, 美国)与丙酮的混合液(体积比1︰1)中渗透1 h, 再加入到用Spurr包埋剂与丙酮的混合液(体积比3︰1)中渗透3 h, 之后加热100% Spurr包埋剂到70 ℃, 包埋样品, 过夜。
1.4.4 切片、染色和观察过夜包埋后的样品用超薄切片机(Leica Microsystems, Buffalo Grove, 美国)切片, 获得厚度70~90 nm的细胞切片; 切片经柠檬酸铅溶液、醋酸双氧铀(SPI-CHEM, 美国)和50%乙醇溶液各染色5~10 min后在透射电镜(Hitachi-Science & Technology, 日本)中观察。
1.4.5 体鳞染色观察吸取一滴指数生长期藻液于网状碳支持膜(Formvar-coated)上, 然后用暖灯照射等待液滴干燥后, 用双蒸水洗涤3次, 之后用乙酸铀酰水溶液(2%浓度)染色10 min, 着色后的体鳞在透射电镜下观察。
1.5 DNA提取, PCR扩增和测序取200 mL指数生长期的藻液(密度超过10 000 cells/mL)进行离心收集, 采用DNA提取试剂盒(TaKaRa Mini BEST Plant Genomic DNA Extraction kit, 宝日医生物技术(北京)有限公司)进行DNA提取, 提取方法按说明书进行。将提取的基因组DNA作为PCR反应模板来扩增ITS序列, 扩增引物为Tits(+)和Tits(-)(唐祥海等, 2006)。于0.2 mL PCR管中, 配置20 μL反应体系: 10 × PCR buffer, 2 µL dNTP (2.5 mmol/L), 正向引物与反向引物各1 μL, 超纯水12.8 µL, 0.2 µL Takara Ex Taq polymerase (5 U; TaKaRa, Osaka, 日本)和1 µL DNA。使用PCR扩增仪T100TM Thermal Cycler (Bio-Rad, CA, 美国)进行ITS片段基因扩增, PCR程序如下: 95 ℃下预变性5 min; 95 ℃下变性30 s, 52 ℃退火30 s, 72 ℃延伸90 s, 共35个循环; 72 ℃延伸90 s。PCR产物进行琼脂糖凝胶电泳, 然后选取条带清晰的PCR扩增产物送于生工生物工程(上海)股份有限公司进行测序。
1.6 系统发育分析将测序所得DNA正反向序列用Contig C Express软件拼接查看并进行编辑。将编辑好的序列放入基因库(NCBI)进行比对并选择下载构建系统发育树所需的序列。使用Bio Edit v7.0.5 (Hall, 1999)软件将目标藻株提取的序列与从GenBank中下载的序列进行对比及整理, 切除首尾多余碱基, 利用MEGA-11构建系统进化树, 采用最大似然法和邻接法计算相似度。
2 结果 2.1 显微光学和激光共聚焦照片倪氏异冒藻为一种浮游甲藻, 细胞呈双锥形, 形似花生, 通过对50个以上指数期细胞进行测量, 该藻株体长14.3~18.2 μm [平均(16.1±2.1) μm], 体宽8.4~10.9 μm [平均(9.6±1.4) μm], 长宽比1.3~2.2, 上锥(8.4~10.9 μm)与下锥(9~10.9 μm)宽基本相当(图 1a~1c)。叶绿体遍布周身(图 1a~1c黄褐色和1e~1f红色区域), 细胞核呈球状(图 1d和1f绿色区域), 能看到游动鞭毛(图 1a), 有多个蛋白核(pyrenoid), 呈透明液滴状(图 1c)。
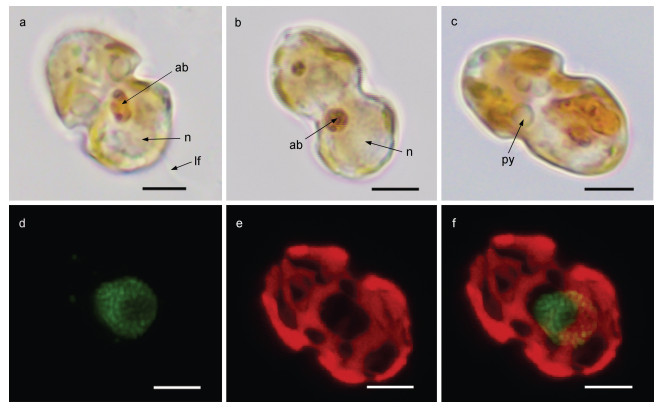 |
| 图 1 倪氏异冒藻光学和荧光照片 Fig. 1 Morphology of H. niei in light microscopy and laser scanning confocal microscopy 注: 图a: 腹面观; 图b~c: 背面观; 图d~f: 使用细胞核染色剂SYBR Green I染色后的细胞核(绿色)和叶绿体(红色)。py: 蛋白核; ab: 聚集体; n: 细胞核; lf: 鞭毛。比例尺: 5 μm |
本实验藻株(SIO-H3)的甲板方程式为Po, cp, 5′, 3a, 7″, 6c, 5s, 5″′, 2″″ (图 2a~2d), 体鳞(body scale)分布于整个藻细胞表面(图 2e), 横鞭毛缠绕在横沟内(图 2c), 体鳞的最小组成单元呈圆三角形, 边长在180~200 nm之间, 每个最小组成单元边长几乎相等, 且每个最小单元被三条中心相连的脊(ridge)均分成3块, 每一小块的形状和排列方式一致(图 2f)。
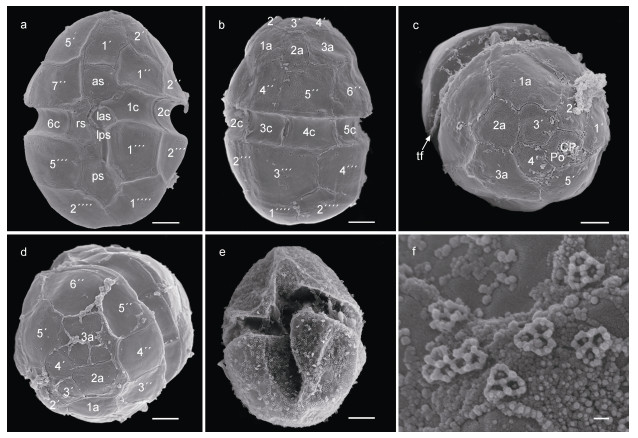 |
| 图 2 倪氏异冒藻扫描电子显微镜照片 Fig. 2 Scanning electron microscopy images of H. niei 注: 图a, e: 腹面观; 图b: 背面观; 图c, d: 上锥部细节; 图e: 体鳞覆盖细胞表面; 图f: 体鳞细节特征。as: 沟前板; las: 左沟前板; lps: 左沟后板; rs: 右沟板; ps: 沟后板; cp: 顶板; po: 顶孔板; tf: 横鞭毛。图a~e比例尺: 2 μm; 图f比例尺: 100 nm |
利用透射电镜可以观察到细胞内各细胞器的形态。细胞壁(膜)由多层膜构成(图 3a~3b, 3f); 叶绿体位于细胞壁(膜)下方, 紧贴细胞壁(膜), 由许多片层堆叠而成(图 3a~3b, 3f); 细胞核位于下锥, 由多个棒状染色体(interphase chromosome)聚集组成(图 3b, 3f); 多个蛋白核分布在细胞各个区域, 其横截面近似圆形(图 3a~图 3b); 横鞭毛孔周围分布着基体(basal body)(图 3a); 淀粉鞘(starch sheath)横截面呈椭圆形, 比蛋白核大(图 3a)。细胞存在两种不同形状的体鳞(图 4): 一种边长为328~406 nm(所测体鳞数目 > 10个), 底层为粗网状纹理的近圆三角结构, 每个鳞片上层正中央有一直立中心刺(central spine), 以此为中心呈约120°角向外辐射出三根中心脊(central ridge, 长约100 nm), 在中心脊末端有1根与直立中心刺平行的外围刺(peripheral spine), 同时中心脊末端分别向两侧再以约120°角辐射出相对细长的拱形外围脊(peripheral ridge), 3个底层外围脊末端之间通过拱形外围脊相连形成3个钟形曲线结构(图 3c~3d, 3k~3m, 4a), 拱形外围脊与底层交汇处共长有6根相对较短的次长外围刺(sub-peripheral spine)(图 3d~3k), 故每个鳞片由1根中心刺、3根中心脊、3根拱形外围脊、3根底层外围脊、3根外围刺和6根次长外围刺组成, 拱形外围脊与中心脊、外围刺和中心刺一起构成一个凸起立体结构(图 3d, 3k~3m); 另一种鳞片呈圆角内凹边三角形, 边长为290~575 nm (所测体鳞数目 > 10个), 鳞片有三层结构, 基底层为致密网状结构, 有3个次中心孔, 外边缘有共有15条立柱(upright), 立柱顶端变尖成短刺(有6根立柱无短刺, 图 3b), 横脊(horizontal beam)将15根立柱顶端连接起来, 横脊所在平面为中层, 在中心以约120°角等长向外辐射三根中心脊(central ridge), 将中层均分成三部分, 每部分的外形近似规则多边形, 三根中心脊末端与横梁相连构成中间层, 与中心脊相邻两立柱无短刺, 中心脊所连横梁上方有一“人”形斜脊, 斜脊最高处向上伸出一直立刺, 立刺近顶端位置向内伸出3根中心脊, 汇交于体鳞中心点并构成顶层, 顶层中心上方有一直立短刺(图 3h~3j, 4b)。
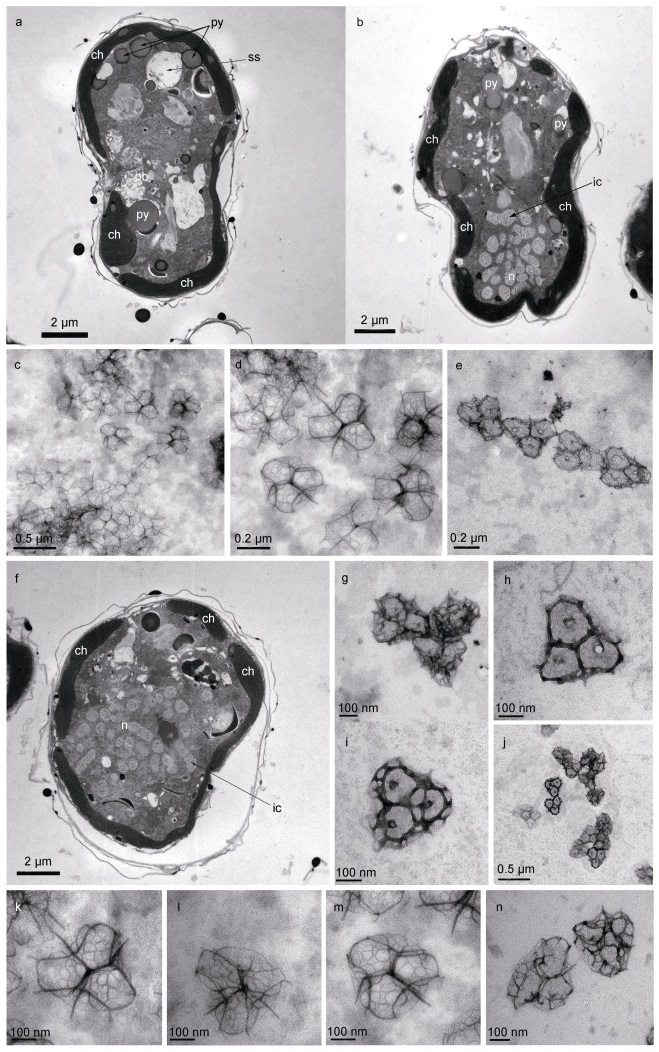 |
| 图 3 倪氏异冒藻透射电子显微镜照片 Fig. 3 Transmission electron microscopy images of H. niei 注: 图a, b: 细胞纵切面; 图f: 细胞横切面; 图c~e和g~n: 体鳞; n: 细胞核; py: 蛋白核; bb: 基体; ch: 叶绿体; ss: 淀粉鞘; ic: 染色质 |
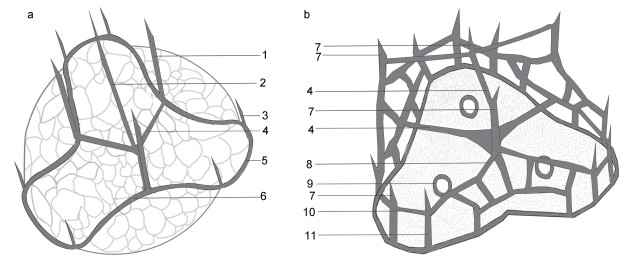 |
| 图 4 倪氏异冒藻两种体鳞结构示意图 Fig. 4 Schematic illustrations of two types of body scales in H. niei 注: a: 体鳞结构1; b: 体鳞结构2。1: 外围刺; 2: (直立)中心刺; 3: 次长外围刺; 4: 中心脊; 5: 底层外围脊; 6: 拱形外围脊; 7: 短刺; 8: 斜脊; 9: 附中心; 10: 横脊; 11: 立柱 |
本次实验藻株提取了一段包含18S、ITS和28S三个片段在内的长基因(用于建树的ITS长度为571 bp, NCBI登录号为ON682372)。以微小原甲藻作为参考株, 与其他文献中的异冒藻一起建立系统发育树。利用最大似然法和邻接法两种方法构建的发育树其主干拓扑结构基本一致, 其中个别节点略有不同(用“*”表示); 来自不同地区的三株倪氏异冒藻聚成一支, 其中: ON682372(厦门湾)和JN020158 (阿曼海)两株的自展值(bootstrap values) 93/97, 这两株与另一株(福建海域ON459702)的自展值为100/98 (图 5)。
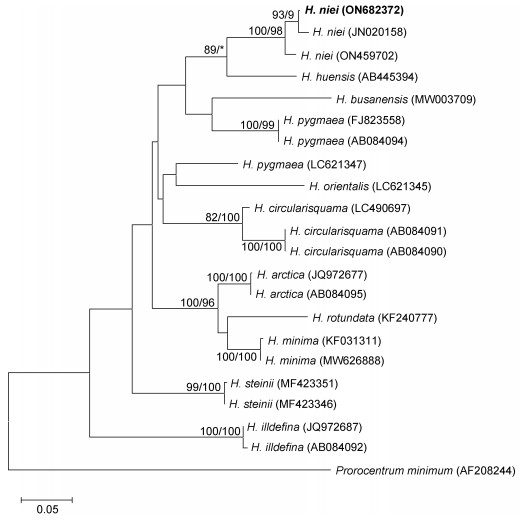 |
| 图 5 基于ITS序列所构建的异冒藻属的系统发育树 Fig. 5 Phylogenetic relationship of Heterocapsa species based on ITS sequence 注: 节点数字代表最大似然法(左)和邻接法分析的置信值(右), 省略70%以下置信值, 可信度检测1 000次 |
通过基于ITS分子序列的Jukes-Cantor遗传距离矩阵比较发现, 三株倪氏异冒藻的核苷酸差异为0.015 7和0.026 6, 与同属藻株之间的核苷酸差异范围为0.015 7~0.237 0, 与外属微小原甲藻的核苷酸差异是0.431 7 (表 1)。

|
在温带和亚热带都暴发过多种异冒藻赤潮, 其呈现的地理扩张需引起我国的重视(Matsuyama et al, 1997; Matsuyama, 2012; Tas, 2015; Benico et al, 2021; Choi et al, 2021)。2008和2012年, 在我国大连近岸养殖池中暴发了渤海异冒藻赤潮(Xiao et al, 2018)。2019年, 在福建海域赤潮暴发期间分离出的倪氏异冒藻、堀口异冒藻和极小异冒藻对卤虫有致死性, 在有光条件下对兔的红细胞具有溶血性(Wu et al, 2022), 这反映了在我国暴发各种有毒有害异冒藻赤潮可能性在增大。然而, 由于异冒藻细胞较小, 其种间形态特征不明显, 存在一定的鉴定难度(Pomroy, 1989; Iwataki, 2008)。根据上锥和下锥大小比例可将该属划分成两大类: 上锥比下锥大(北极异冒藻Heterocapsa arctica Horiguchi, 披针异冒藻Heterocapsa lanceolata Iwataki & Fukuyo, 微小异冒藻和圆形异冒藻), 其余种类上锥和下锥大小基本一致(Iwataki et al, 2003; Iwataki, 2008)。倪氏异冒藻的长度和宽度与北极异冒藻和渤海异冒藻(Iwataki, 2008; Rintala et al, 2010; Xiao et al, 2018)相当, 该藻是一种世界广布种, 在西北太平洋(Morrill et al, 1983)、贝尔海(Belt Sea)(Hällfors, 2004)、日本(Yoshida et al, 2003)、厦门海域(Wu et al, 2022)和马来西亚(Razali et al, 2022)均有检测到, 且在马来西亚野外环境中, 密度达到7 000 cells/L(Razali et al, 2022)。2018年福建福宁湾海域表层沉积物中检出了倪氏异冒藻孢囊(王朝晖等, 2022), 一定程度上表明该藻在早期就可能在此海域发生过赤潮事件(黄海燕等, 2009)。
异冒藻与多种甲藻形态较为相似, 如环胺藻(Azadinium)(Luo et al, 2016)和别什莱藻(Biecheleria) (Luo et al, 2013), 加之细胞较小, 其属内种间就更加难以区分。细胞核和蛋白核的相对位置是异冒藻属种间鉴定的重要特征(Iwataki, 2008), 倪氏异冒藻、喜沙异冒藻(Heterocapsa psammophila Tamura)和极小异冒藻的细胞核处于下锥部, 堀口异冒藻、卵形异冒藻(Heterocapsa ovata Iwataki & Fukuyo)和拟三角异冒藻(Heterocapsa pseudotriquetra)的细胞核位于蛋白核上方(Iwataki, 2008)。本实验藻株细胞核处于下锥底部(图 1a~1b, 1f), 结合细胞核位置(图 4b), 基本可以确认在细胞核下方没有蛋白核的空间, 即倪氏异冒藻蛋白核位于细胞核上方, 这和之前研究结果一致(Iwataki, 2008)。而且本藻株(SIO-H3)甲板方程式Po, cp, 5′, 3a, 7″, 6c, 5s, 5″′, 2″″ (图 2a~2d)与Iwataki(2008)描述一致。
在分类学上, 异冒藻有一个明显的特征是细胞表面布满了体鳞(Morrill et al, 1981; Iwataki, 2008), 除异冒藻外, 目前只在Lepidodinium viride Watanabe, Suda, Inouye, Sawaguchi & Chihara(Watanabe et al, 1987, 1990)和海洋尖尾藻(Oxyrrhis marina Dujardin)(Clarke et al, 1972, 1976)中见到过体鳞的详细描述(Iwataki et al, 2003, 2004)。海洋尖尾藻的体鳞是扁平的, 呈椭圆形, 遍布细胞表面和鞭毛(Loeblich III, 1968; Pennick et al, 1977), L. viride和异冒藻的体鳞是立体结构(Iwataki et al, 2004)。异冒藻中第一个体鳞被清晰描述的物种是三角异冒藻(Pennick et al, 1977; Morrill et al, 1983)。随着环鳞异冒藻(Horiguchi, 1995)、披针异冒藻和堀口异冒藻(Iwataki et al, 2002b)的体鳞也被逐渐详述后, 体鳞被视为该属一种重要的分类保守特征用于属内物种鉴定(Iwataki et al, 2002c; Yoshida et al, 2003)。Iwataki等(2004)集中描述了12种异冒藻的体鳞特征, 提出利用体鳞基底形状(the shape of basal plate)、中央孔(central hole)的有无和刺(uprights, spine, bars)的数量来区分不同异冒藻, 如斯氏异冒藻的基质底部(basal plate)为三角形, 环鳞异冒藻为圆形, 披针异冒藻为六边形(Iwataki et al, 2004); 披针异冒藻和圆形异冒藻有一个中央孔(central hole), 其他异冒藻则没有或还没发现(Iwataki et al, 2004); 三角异冒藻、圆形异冒藻、极小异冒藻、拟三角异冒藻、卵形异冒藻、东方异冒藻(Heterocapsa orientalis Iwataki, Botes & Fukuyo)、Heterocapsa illdefina Herman & Sweeney和堀口异冒藻在基底面上有6根脊(ridge), 披针异冒藻和倪氏异冒藻只有3根, 而北极异冒藻(Heterocapsa arctica Horiguchi T)有3或6根(Iwataki et al, 2004)。在之前的研究中, 倪氏异冒藻只报道了一种类似图 4b的体鳞结构(Iwataki et al, 2004; Iwataki, 2008), 不同的是, 次中心为刺而非本次研究观察到的圆孔(图 3e~3f)。本次研究我们不仅在倪氏异冒藻中同时记录到了两种体鳞结构, 而且描述了一种新的体鳞结构(图 3c~3d、3k~3n, 4a)。除倪氏异冒藻外, 北极异冒藻和环鳞异冒藻在不同的生长阶段也具有不同的体鳞(Iwataki et al, 2004), 成熟细胞的体鳞(mature scale)相比不成熟细胞的体鳞(immature scale)基底外形更圆润, 层次更为丰富, 刺或脊(spine)更多更长; 圆形异冒藻和堀口异冒藻基底的网状结构随着室内培养多代后会消失(Iwataki et al, 2004)。虽然本次实验藻株采用的是指数生长期的细胞, 但是目前还无法完全排除这两种体鳞为不同时期细胞所有。不同倪氏异冒藻藻株的体鳞边长也不相同, 如有210 nm (藻株编号: UTEX1654)(Morrill et al, 1981), 300 nm (藻株编号: CCMP447, NIES420和TG607-1)(Iwataki et al, 2004)和(290~433 nm)(藻株编号: SIO-H3)。
此外, 在之前的文章中(藻株号: UTEX1564), 只有一个或者两个(细胞分裂时)蛋白核(Iwataki, 2008), 而本研究中的倪氏异冒藻含有多个蛋白核, 这说明倪氏异冒藻蛋白核数量存在多种可能。
ITS系列作为非编码区, 承受的选择压力较小, 相较于其他区域变化较大, 通过ITS系列的系统发育分析, 常常用于解决一些甲藻类的分类学模糊问题(Yoshida et al, 2003; Wayne et al, 2007; Stern et al, 2012)。但使用ITS序列进行系统进化研究有条件性, 对分析对象的序列必须做出谨慎选择和调整(谢子强等, 2017)。在对基于ITS的甲藻物种内和物种间遗传距离的总体评估中, Wayne等(2007)发现大多数不同甲藻间的未校正P距离总是在0.04以上, 本实验中的藻株和另外两株倪氏异冒藻在此区间内。对于微小物种鉴定而言, 无论是传统的形态学方法还是利用分子技术手段, 两者都必须相互借鉴和补充(谢子强等, 2017)。
4 结论根据对藻株(SIO-H3)形态学和分子特征研究, 以及相关的研究报告得到以下结论:
(1) 形态学特征和分子进化发育分析证实该研究藻株为倪氏异冒藻。
(2) 先前研究倪氏异冒藻只有一个蛋白核, 本次研究发现倪氏异冒藻细胞质中有多个蛋白核。
(3) 先前研究只观察到倪氏异冒藻的一种体鳞形态, 本次研究发现了倪氏异冒藻有两种形态体鳞: 一种体鳞基底层为粗网状纹路, 上层中心处有一长中心刺向上立起, 中心刺所在位置等长向外辐射三根中心脊, 中心脊末端有三根直立的次长外围刺(该种体鳞结构为第一次报道); 另一种体鳞有三层结构, 其中基底层为致密网状纹, 并有三个次中心孔, 中层和顶层各有一三叉中心脊。
(4) 一种异冒藻不唯一对应一种体鳞分类特征。
王金辉, 秦玉涛, 刘材材, 等, 2006. 长江口赤潮多发区潜在有毒藻类和赤潮毒素的初步调查[J]. 海洋环境科学, 25(S1): 15-19. |
王朝晖, 郑虎, 王文婷, 等, 2022. 福建福宁湾表层沉积物中甲藻孢囊分布与多样性研究[J]. 海洋与湖沼, 53(6): 1396-1404. |
冯彤彤, 2019. 渤海异帽藻的毒性效应及毒素提取研究[D]. 大连: 大连理工大学.
|
刘瑞玉, 2008. 中国海洋生物名录[M]. 北京: 科学出版社, 600.
|
刘霜, 张继民, 张洪亮, 等, 2014. 青岛近海赤潮灾害分级与时空分布及赤潮生物的变化[J]. 水生态学杂志, 35(4): 43-47. |
唐祥海, 于仁成, 颜天, 等, 2006. 中国沿海亚历山大藻(Alexandrium)核糖体rDNA部分序列分析及该藻属分子系统进化研究[J]. 海洋与湖沼, 37(6): 529-535. |
黄海燕, 陆斗定, 2009. 甲藻孢囊研究进展[J]. 海洋学研究, 27(3): 85-92. |
谢子强, 廖宝林, 肖宝华, 等, 2017. 运用ITS基因分析大鹏半岛海域石珊瑚系统发育关系[J]. 广东海洋大学学报, 37(4): 8-15. |
BAEK S H, KI J S, KATANO T, et al, 2011. Dense winter bloom of the dinoflagellate Heterocapsa triquetra below the thick surface ice of brackish Lake Shihwa, Korea[J]. Phycological Research, 59(4): 273-285. DOI:10.1111/j.1440-1835.2011.00626.x |
BENICO G, LUM W M, TAKAHASHI K, et al, 2021. Thecal tabulation, body scale morphology and phylogeny of Heterocapsa philippinensis sp. nov. (Peridiniales, Dinophyceae) from the Philippines[J]. European Journal of Protistology, 80: 125811. DOI:10.1016/j.ejop.2021.125811 |
CHOI H, KIM S, 2021. Heterocapsa busanensis sp. nov. (Peridiniales, Dinophyceae): a new marine thecate dinoflagellate from Korean coastal waters[J]. European Journal of Protistology, 79: 125797. DOI:10.1016/j.ejop.2021.125797 |
CLARKE K J, PENNICK N C, 1972. Flagellar scales in Oxyrrhis marina Dujardin[J]. British Phycological Journal, 7(3): 357-360. DOI:10.1080/00071617200650371 |
CLARKE K J, PENNICK N C, 1976. The occurrence of body scales in Oxyrrhis marina Dujardin[J]. British Phycological Journal, 11: 345-348. DOI:10.1080/00071617600650391 |
GOTTSCHLING M, TILLMANN U, ELBRÄCHTER M, et al, 2019. Glenodinium triquetrum Ehrenb. is a species not of Heterocapsa F. Stein but of Kryptoperidinium Er. Lindem. (Kryptoperidiniaceae, Peridiniales)[J]. Phytotaxa, 391(2): 155-158. DOI:10.11646/phytotaxa.391.2.11 |
GUILLARD R R L, 1975. Culture of phytoplankton for feeding marine invertebrates [M] // SMITH W L, CHANLEY M H. Culture of Marine Invertebrate Animals. New York, USA: Springer: 29-60.
|
HALL T A, 1999. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT[J]. Nucleic Acids Symposium Series, 41: 95-98. |
HÄLLFORS G, 2004. Checklist of Baltic Sea phytoplankton species (including some heterotrophic protistan groups)[J]. Baltic Sea Environment Proceedings, 95: 1-208. |
HANIFAH A H, TENG S T, LAW I K, et al, 2022. Six marine thecate Heterocapsa (Dinophyceae) from Malaysia, including the description of three novel species and their cytotoxicity potential[J]. Harmful Algae, 120: 102338. DOI:10.1016/j.hal.2022.102338 |
HANSEN G, 1995. Analysis of the thecal plate pattern in the dinoflagellate Heterocapsa rotundata (Lohmann) comb. nov. (= Katodinium rotundatum (Lohmann) Loeblich)[J]. Phycologia, 34(2): 166-170. DOI:10.2216/i0031-8884-34-2-166.1 |
HORIGUCHI T, 1995. Heterocapsa circularisquama sp. nov. (Peridiniales, Dinophyceae): a new marine dinoflagellate causing mass mortality of bivalves in Japan[J]. Phycological Research, 43: 129-136. DOI:10.1111/j.1440-1835.1995.tb00016.x |
IWATAKI M, 2008. Taxonomy and identification of the armored dinoflagellate genus Heterocapsa (Peridiniales, Dinophyceae)[J]. Plankton and Benthos Research, 3(3): 135-142. DOI:10.3800/pbr.3.135 |
IWATAKI M, BOTES L, SAWAGUCHI T, et al, 2003. Cellular and body scale structure of Heterocapsa ovata sp. nov. and Heterocapsa orientalis sp. nov. (Peridiniales, Dinophyceae)[J]. Phycologia, 42(6): 629-637. DOI:10.2216/i0031-8884-42-6-629.1 |
IWATAKI M, HANSEN G, SAWAGUCHI T, et al, 2004. Investigations of body scales in twelve Heterocapsa species (Peridiniales, Dinophyceae), including a new species H. pseudotriquetra sp. nov.[J]. Phycologia, 43(4): 394-403. DOI:10.2216/i0031-8884-43-4-394.1 |
IWATAKI M, WONG M W, FUKUYO Y, 2002a. New record of Heterocapsa circularisquama (Dinophyceae) from Hong Kong[J]. Fisheries Science, 68(5): 1161-1163. DOI:10.1046/j.1444-2906.2002.00549.x |
IWATAKI M, TAKAYAMA H, MATSUOKA K, et al, 2002b. Heterocapsa lanceolata sp. nov. and Heterocapsa horiguchii sp. nov. (Peridiniales, Dinophyceae), two new marine dinoflagellates from coastal Japan[J]. Phycologia, 41(5): 470-479. DOI:10.2216/i0031-8884-41-5-470.1 |
IWATAKI M, TAKAYAMA H, MATSUOKA K, et al, 2002c. Taxonomic study on Heterocapsa with special reference to their body scale ultrastructure[J]. Fisheries Science, 68(S1): 631-632. |
LOEBLICH III A R, 1968. A new marine dinoflagellate genus, Cachonina, in axenic culture from the Salton Sea, California with remarks on the genus Peridinium[J]. Proceedings of the Biological Society of Washington, 81: 91-96. |
LUO Z H, KROCK B, MERTENS K N, et al, 2016. Morphology, molecular phylogeny and azaspiracid profile of Azadinium poporum (Dinophyceae) from the Gulf of Mexico[J]. Harmful Algae, 55: 56-65. DOI:10.1016/j.hal.2016.02.006 |
LUO Z H, YANG W D, XU B, et al, 2013. First record of Biecheleria cincta (Dinophyceae) from Chinese coasts, with morphological and molecular characterization of the strains[J]. Chinese Journal of Oceanology and Limnology, 31(4): 835-845. DOI:10.1007/s00343-013-2315-8 |
MATSUYAMA Y, 2012. Impacts of the harmful dinoflagellate Heterocapsa circularisquama bloom on shellfish aquaculture in Japan and some experimental studies on invertebrates[J]. Harmful Algae, 14: 144-155. DOI:10.1016/j.hal.2011.10.019 |
MATSUYAMA Y, UCHIDA T, HONJO T, 1997. Toxic effects of the dinoflagellate Heterocapsa circularisquama on clearance rate of the blue mussel Mytilus galloprovincialis[J]. Marine Ecology Progress Series, 146: 73-80. DOI:10.3354/meps146073 |
MILLETTE N C, PIERSON J J, ACEVES A, et al, 2017. Mixotrophy in Heterocapsa rotundata: a mechanism for dominating the winter phytoplankton[J]. Limnology and Oceanography, 62: 836-845. DOI:10.1002/lno.10470 |
MORRILL L C, LOEBLICH III A R, 1981. A survey for body scales in dinoflagellates and a revision of Cachonina and Heterocapsa (Pyrrhophyta)[J]. Journal of Plankton Research, 3(1): 53-65. DOI:10.1093/plankt/3.1.53 |
MORRILL L C, LOEBLICH III A R, 1983. Formation and release of body scales in the dinoflagellate genus Heterocapsa[J]. Journal of the Marine Biological Association of the United Kingdom, 63(4): 905-913. DOI:10.1017/S0025315400071319 |
OJAMÄE K, PETERSON A, LIPS I, 2016. Dark nutrient uptake at low temperature and subsequent light use efficiency by the dinoflagellate Heterocapsa triquetra[J]. Marine Biology Research, 12(9): 978-985. DOI:10.1080/17451000.2016.1216570 |
PENNICK N C, CLARKE K J, 1977. The occurrence of scales in the peridinian dinoflagellate Heterocapsa triquetra (Ehrenb.) Stein[J]. British Phycological Journal, 12(1): 63-66. DOI:10.1080/00071617700650081 |
POMROY A J, 1989. Scanning electron microscopy of Heterocapsa minima sp. nov. (Dinophyceae) and its seasonal distribution in the Celtic Sea[J]. British Phycological Journal, 24(2): 131-135. DOI:10.1080/00071618900650121 |
RAZALI R M, MUSTAPA N I, YAACOB K K K, et al, 2022. Diversity of Heterocapsa (Dinophyceae) and the algal bloom event in the mariculture areas of Johor Strait, Malaysia[J]. Plankton and Benthos Research, 17(3): 290-300. DOI:10.3800/pbr.17.290 |
RINTALA J M, HÄLLFORS H, HÄLLFORS S, et al, 2010. Heterocapsa arctica subsp. frigida subsp. nov. (Peridiniales, Dinophyceae)-description of a new dinoflagellate and its occurrence in the Baltic Sea[J]. Journal of Phycology, 46: 751-762. DOI:10.1111/j.1529-8817.2010.00868.x |
STERN R F, ANDERSEN R A, JAMESON I, et al, 2012. Evaluating the ribosomal internal transcribed spacer (ITS) as a candidate dinoflagellate barcode marker[J]. PLoS One, 7(8): e42780. DOI:10.1371/journal.pone.0042780 |
SUNESEN I, RODRÍGUEZ F, KUBIS J A T, et al, 2020. Morphological and molecular characterization of Heterocapsa claromecoensis sp. nov. (Peridiniales, Dinophyceae) from Buenos Aires coastal waters (Argentina)[J]. European Journal of Phycology, 55(4): 490-506. DOI:10.1080/09670262.2020.1750059 |
TAS S, 2015. A prolonged red tide of Heterocapsa triquetra (Ehrenberg) F. Stein (Dinophyceae) and phytoplankton succession in a eutrophic estuary in Turkey[J]. Mediterranean Marine Science, 16(3): 621-627. DOI:10.12681/mms.1049 |
TILLMANN U, HOPPENRATH M, GOTTSCHLING M, et al, 2017. Plate pattern clarification of the marine dinophyte Heterocapsa triquetra sensu Stein (Dinophyceae) collected at the Kiel Fjord (Germany)[J]. Journal of Phycology, 53(6): 1305-1324. |
WATANABE M M, SUDA S, INOUYE I, et al, 1990. Lepidodinium viride gen. et sp. nov. (Gymnodinaiales, Dinophyta), a green dinoflagellate with a chlorophyll A- and B-containing endosymbiont[J]. Journal of Phycology, 26: 741-751. DOI:10.1111/j.0022-3646.1990.00741.x |
WATANABE M M, TAKEDA Y, SASA T, et al, 1987. A green dinoflagellate with chlorophylls A and B: morphology, fine structure of the chloroplast and chlorophyll composition[J]. Journal of Phycology, 23: 382-389. |
WAYNE LITAKER R, VANDERSEA M W, KIBLER S R, et al, 2007. Recognizing dinoflagellate species using ITS rDNA sequences[J]. Journal of Phycology, 43(2): 344-355. |
WU X M, LIU Y L, WENG Y B, et al, 2022. Isolation, identification and toxicity of three strains of Heterocapsa (Dinophyceae) in a harmful event in Fujian, China[J]. Harmful Algae, 120: 102355. |
XIAO J, SUN N, ZHANG Y W, et al, 2018. Heterocapsa bohaiensis sp. nov. (Peridiniales: Dinophyceae): a novel marine dinoflagellate from the Liaodong Bay of Bohai Sea, China[J]. Acta Oceanologica Sinica, 37(10): 18-27. |
YOSHIDA T, NAKAI R, SETO H, et al, 2003. Sequence analysis of 5.8S rDNA and the internal transcribed spacer region in dinoflagellate Heterocapsa species (Dinophyceae) and development of selective PCR primers for the bivalve killer Heterocapsa circularisquama[J]. Microbes and Environments, 18(4): 216-222. |
 2023, Vol. 54
2023, Vol. 54


