
中国海洋湖沼学会主办。
文章信息
- 郑嘉豪, 申屠琰, 徐英杰, 李有志, 朱卫东, 王志铮. 2023.
- ZHENG Jia-Hao, SHENTU Yan, XU Ying-Jie, LI You-Zhi, ZHU Wei-Dong, WANG Zhi-Zheng. 2023.
- 离水停食胁迫对中华鳖(Trionyx sinensis)翻身能力、血清生化、裙边质构及脏器相关功能酶活力的影响
- EFFECTS OF AIR EXPOSURE AND STARVATION STRESS ON THE FLIPPING ABILITY, SERUM BIOCHEMISTRY, SOFT TISSUE SKIRT QUALITY, AND ORGAN-RELATED ENZYME ACTIVITY IN CHINESE SOFT-SHELLED TURTLES TRIONYX SINENSIS
- 海洋与湖沼, 54(6): 1737-1745
- Oceanologia et Limnologia Sinica, 54(6): 1737-1745.
- http://dx.doi.org/10.11693/hyhz20230500107
文章历史
- 收修改稿日期:2023-05-18
2. 余姚市水产技术推广中心 浙江余姚 315400
2. Yuyao Aquaculture Technology Extension Center, Yuyao 315400, China
中华鳖(Trionyx sinensis)隶属于爬行纲(Reptilia), 龟鳖目(Chelonia), 鳖科(Trionychidae), 鳖属(Trionyx), 作为我国居民喜食的传统名贵食材和高档滋补品, 历来有活品消费的习惯。浙江省是我国中华鳖的养殖主产区, 最近20余年间产量和产值均一直居全国首位。据《2022中国渔业统计年鉴》报道, 浙江省2021年中华鳖养殖产量为99 764 t, 占全国鳖养殖总产量的27.3% (农业农村部渔业渔政管理局等, 2022), 中华鳖养殖产业现已是助力浙江沿江沿湖地区乡村振兴和共同富裕的重要抓手之一。
在水产品供应链环节, 活品的市场迎合度与销售价格较鲜品和冻品均具明显优势。最近10年间, 随着“农超对接”和“互联网直销”等新型商业销售模式的兴起, 以及水产品保活技术的日臻成熟, 我国水产品活销产业获得了井喷式发展。货架期是指符合标签规定条件下保持食品质量(品质)的期限(国家技术监督局, 1994), 其时长主要取决于配方、加工工艺、包装和贮藏条件。水产动物的活力与其形态、生理健康度和食用口感均密切相关。作为初级水产品的重要组成部分, 活力既是活品有别于鲜品和冻品货架期研究的主要内容, 也是衡量活品品质优劣程度和判定打折或下架与否的关键因素, 但迄今国内外尚未见有关水产活品活力与货架期间相互关系的系统报道, 关于中华鳖的货架期研究也仅见其加工产品(张师师, 2006)。中华鳖以肺呼吸为主, 离水停食是其活体批量运输和销售环节中必须承受的胁迫。研究表明, 饥饿胁迫不仅会引起水生动物形体特征、消化生理、抗氧化生理、血清生化和组织质构等的一系列变化(谢小军等, 1998; 王志铮等, 2006; 李有志等, 2022), 也势必会导致水生动物机体抗逆性能、活力和健康度的显著下降。因此, 探究进而揭示离水停食胁迫对水产养殖动物的活力、食用口感和机体相关生理的影响过程与机制, 对于指导其活体销售具有重要指导价值和现实意义。农超活销实践也发现, 中华鳖的食用口感与其离水停食时长有着极为密切的关系。因此, 确定中华鳖合理的货架时长, 对于切实保障消费者权益和维护企业商誉具重要现实意义。鉴于此, 本研究团队于2020年5~6月间在常温条件下较系统开展了离水停食胁迫对中华鳖翻身能力、血清生化、裙边质构及脏器相关功能酶活力的影响研究, 旨为合理规范中华鳖的货架期提供科学依据, 并为中华鳖的生理生态研究提供基础资料。
1 材料与方法 1.1 供试中华鳖实验用中华鳖(Trionyx sinensis)购自余姚市冷江鳖业有限公司, 为2020年5月20日同塘起捕养殖4年的商品鳖。起捕后, 随机选取其中肢体完整、反应敏捷、无病无伤、规格相近的雄性个体作为研究对象[共计165 ind., 平均体质量(546.86±94.70) g], 并即刻移入该公司加工车间内在常温条件下进行离水停食处理, 并于每日上午8:00用自来水清洗鳖体1次。
1.2 实验方法于2020年5月20日(离水停食处理0 d, 记为S0)、5月24日(离水停食处理4 d, 记为S4)、5月28日(离水停食处理8 d, 记为S8)、6月1日(离水停食处理12 d, 记为S12)和6月5日(离水停食处理16 d, 记为S16)分别任取35只供试鳖作为实验用鳖。其中, 30只用于翻身能力测试, 剩余的5只用于血清生化、裙边物性及脏器酶活力的测定。
1.2.1 翻身能力的测试(1) 连续翻身次数的测定: 任取其中15只实验鳖, 借助人工将鳖体处于背部朝下、腹部朝上状态后让其自主翻身复原, 当实验鳖翻身复原后, 借助人工迅速再次将鳖体恢复至背部朝下、腹部朝上的状态让其自主翻身复原, 如此循环往复, 当实验鳖在30 s内不能完成自主翻身复原状态时, 立即终止测试并记录其连续翻身总次数。
(2) 1 min内翻身次数的测定: 取剩余的15只实验鳖, 以1 min为测试总时长测定并记录其翻身总次数。
1.2.2 血清生化指标的测定75%酒精消毒实验鳖颈部后, 用刀片割断其颈动脉并立即采血制成抗凝血样。血样于3 000 r/min离心10 min后, 将分离获得的血清即刻置于4 ℃冰箱中保存备测。借助日立7020型全自动生化分析仪测定血清中的总蛋白(TP)、白蛋白(ALB)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、甘油三脂(TG)和血糖(GLU-O), 所用测定试剂均购自宁波美康生物工程有限公司。
1.2.3 脏器酶活力的测定于冰盘上逐只解剖采血后的实验鳖, 分别摘取心、肝、脾、肺、胃、肠, 并去除其内容物和附于脏器表面的脂肪与结缔组织。已摘取的所有脏器经4 ℃双蒸水冲净、滤纸吸干表面水分并借助分析天平(Sartorius BP211D型, 精度0.1 mg) 逐一称重后, 立即分别放入已做好标记的样品袋内并置于–80 ℃冰箱中保存备测。测定仪器为岛津UV-1240型紫外可见分光光度计, 各类消化酶和抗氧化酶的酶活力测试盒均购自南京建成生物工程研究所, 测试步骤及计算方法均按所附说明书。
1.2.4 裙边质构的测定取脏器后, 按李有志等(2022)的方法逐只取实验鳖尾根部上侧的裙边组织, 制成10 mm×7 mm×4 mm规格的鲜样后, 立即采用TA.XTplus型质构分析仪逐只测定硬度、黏性、弹性、内聚性、胶黏性、耐咀性和回复性。质构仪采用TPA测量模式, 测量探头为P/36R, 测前、测中和测后速度分别为1、0.5和1 mm/s, 测距2 mm, 测试时间间隔5 s。
1.3 数据处理整理所得各项实验数据, 借助SPSS17.0软件分别统计各实验组的翻身次数、血清生化指标、裙边质构指标、脏器酶活力的均值与标准差, 并分别采用t检验和LSD多重比较法检验组内、组间差异显著性(视P < 0.05为显著水平)。
2 结果 2.1 离水停食对翻身能力的影响观察发现, 实验鳖具有通过伸展头颈部并用头顶住身体接触面实现快速翻身复原的行为学特性。由图 1可见, 离水停食对实验鳖翻身能力的影响主要表现为: (1) 连续翻身次数和1 min内翻身次数均呈以S4、S8实验组为最多(P < 0.05), 其余实验组间均无差异(P > 0.05)的先升后降趋势; (2) 连续翻身次数主要集中于1 min内, 其与1 min内翻身总次数存在差异(P < 0.05)的实验组仅为S4和S8。综上表明, 实验鳖具很强的翻身欲望, 过长的离水停食时间将显著降低其连续翻身能力和1 min内的翻身总次数。
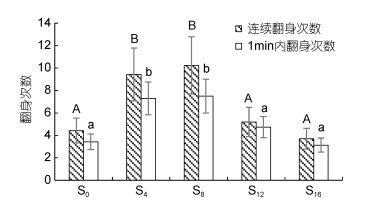 |
| 图 1 离水停食时长对实验鳖翻身次数的影响 Fig. 1 Effects of air exposure and starvation duration on the flipping frequency of experimental turtles 注: S0、S4、S8、S12、S16分别为离水停食处理0 d、4 d、8 d、12 d、16 d实验组; 图内标不同字母表示组间存在显著差异(P < 0.05)。下同 |
由表 1可见, 离水停食对血清生化指标的影响主要表露为: (1) 从蛋白质组成看, TP、ALB含量均无组间差异(P > 0.05); (2) 从血脂组成看, TC、LDL-C含量均无组间差异(P > 0.05), 除S4、S8的TG含量小于S0 (P < 0.05), S12的HDL-C含量大于S0 (P < 0.05)外, 其余实验组在TG和HDL-C含量上均无组间差异(P > 0.05); (3) 从血糖水平看, GLU-O含量以S16实验组为最低(P < 0.05), 呈S0≈S4≈S8≈S12 > S16。
| 指标 | S0 | S4 | S8 | S12 | S16 |
| ALB/(g/L) | 13.100±0.455a | 12.433±0.125a | 13.100±0.613a | 13.367±0.613a | 12.567±1.115a |
| TP/(g/L) | 39.167±3.279a | 38.667±1.922a | 36.730±3.845a | 42.030±3.359a | 40.330±3.524a |
| HDL-C/(g/L) | 0.773±0.155a | 0.920±0.236ab | 0.880±0.022ab | 1.233±0.247b | 0.847±0.100ab |
| LDL-C/(g/L) | 1.683±0.357a | 2.157±0.403a | 2.177±0.155a | 1.857±0.558a | 2.247±0.362a |
| TC/(mmol/L) | 3.927±1.199a | 4.677±0.062a | 3.623±0.363a | 3.943±0.998a | 3.707±0.382a |
| TG/(mmol/L) | 1.187±0.394a | 0.577±0.193b | 0.523±0.113b | 0.740±0.134ab | 0.890±0.127ab |
| GLU-O/(mmol/L) | 8.233±0.813a | 7.317±0.990a | 7.210±1.317a | 6.373±0.274a | 4.313±0.605b |
| 注: TP: 总蛋白; ALB: 白蛋白; HDL-C: 高密度脂蛋白胆固醇; LDL-C: 低密度脂蛋白胆固醇; TC: 总胆固醇; TG: 甘油三脂; GLU-O: 血糖 | |||||
由表 2可见, 离水停食对裙边质构指标的影响主要表露为: (1) 硬度、弹性和胶黏性分别呈S0≈S4≈S8 > S12≈S16、S0≈S4≈S8≈S12≈S16 (P > 0.05)和S4≈S8≈S16 > S0≈S12; (2) 黏性和内聚性, 除S4的黏性显著小于S8 (P < 0.05), S4和S8的内聚性显著大于S0 (P < 0.05)外, 其余均无组间差异(P > 0.05); (3) 耐咀性和回复性, 除S4的耐咀性和S12、S16的回复性与其他实验组均无差异(P > 0.05)外, 其余则分别呈S8≈S16 > S0≈S12和S4≈S8 > S0。由此可知, 上述裙边质构指标中仅硬度与其连续翻身次数(图 1)的组间排序完全重合, 均呈S4≈S8 > S12≈S16。
| 指标 | S0 | S4 | S8 | S12 | S16 |
| 硬度 | 23 942±819a | 26 261±308ab | 25 261±714ab | 27 058±526b | 27 568±2 568b |
| 黏性 | –25.64±5.88ab | –32.52±18.81a | –11.10±2.51b | –20.77±7.67ab | –11.26±1.62ab |
| 弹性 | 0.697±0.055a | 0.75±0.055a | 0.783±0.039a | 0.784±0.051a | 0.731±0.023a |
| 内聚性 | 0.712±0.036a | 0.780±0.027b | 0.800±0.022b | 0.765±0.029ab | 0.746±0.034ab |
| 胶黏性 | 12 797±1 185a | 20 243±615b | 21 094±3 777b | 12 805±3 174a | 20 593±2 236b |
| 耐咀性 | 8 939±1 253a | 13 626±3 582ab | 16 576±3 469 b | 9 941±2 210a | 150 961±2 058b |
| 回复性 | 0.695±0.036a | 0.765±0.032b | 0.790±0.025b | 0.750±0.030ab | 0.735±0.032ab |
由图 2可见, 肝脂肪酶和胃蛋白酶活力分别呈S4 > S0≈S8≈S12≈S16和S0≈S16 > S4≈S8≈S12, 肠淀粉酶活力除S16实验组大于S0、S4 (P < 0.05)外, 其余均无组间差异(P > 0.05)。从离水停食时序上看, S4实验组肝脂肪酶和S16实验组胃蛋白酶活力的显著高企意味着两者均为消化生理发生显著改变的关键时间节点。
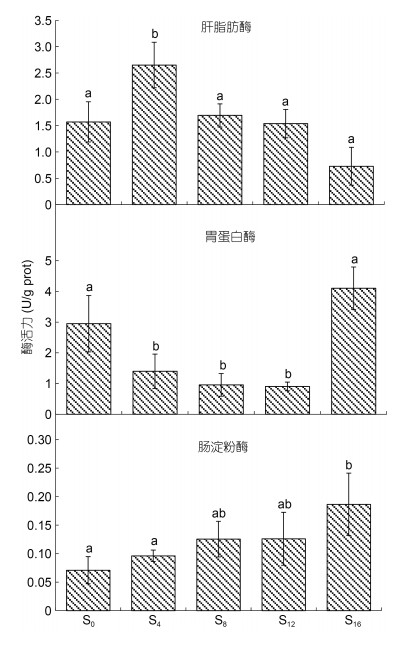 |
| 图 2 离水停食时长对实验鳖消化酶活力的影响 Fig. 2 Effects of air exposure and starvation duration on the digestive enzyme activities of experimental turtles |
由图 3可见, 离水停食对肝脏ATP酶和抗氧化酶活力的影响主要表露为: (1) Na+/K+-ATPase、Ca2+/Mg2+-ATPase酶活力分别呈S0 < S4≈S8≈S12≈S16和S0≈ S4 < S8≈S12 < S16; (2) SOD、POD和GSH-PX酶活力分别呈S0≈S4≈S8≈S12 < S16、S0 < S4≈S8≈S12 < S16和S0≈S4 < S8≈ S12 < S16; (3) CAT酶活力除S16大于S0外(P < 0.05), 其余均无组间差异(P > 0.05)。综上可知, 肝脏抗氧化压力随离水停食时间的延长总体上呈阶梯式上升趋势, 尤以S16的增幅最为显著。
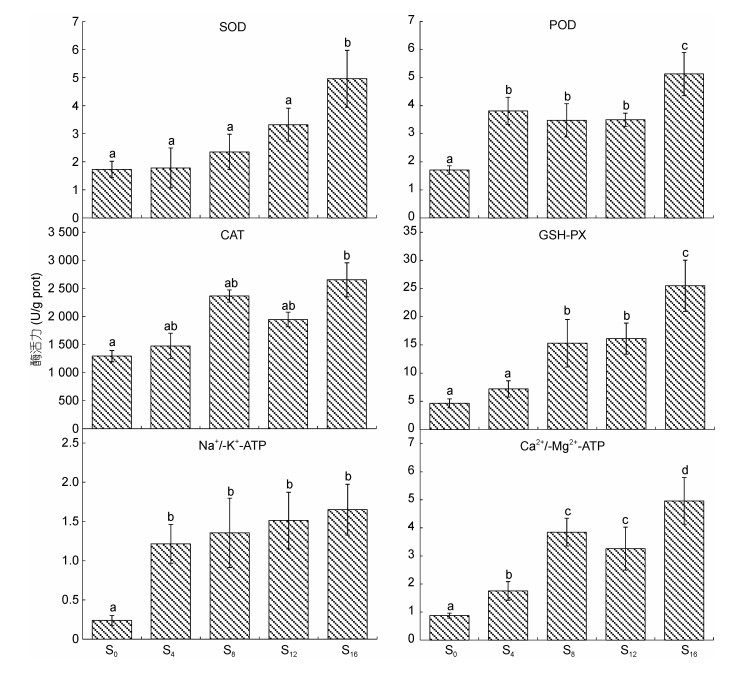 |
| 图 3 离水停食时长对实验鳖肝脏ATP酶和抗氧化酶活力的影响 Fig. 3 Effects of air exposure and starvation duration on hepatic ATPase and antioxidant enzyme activities of experimental turtles |
由图 4可见, 离水停食对心脏抗氧化酶活力的影响主要表露为: (1) SOD、POD酶活力分别呈S0≈S4≈ S8≈S12≈S16 (P > 0.05)和S0≈S16 > S4≈S8≈S12; (2) CAT和GSH-PX酶活力, 除S8的CAT和S4的GSH-PX酶活力均小于S0 (P < 0.05)外, 其余均无组间差异(P > 0.05)。无疑, 心脏POD酶活力的显著高企是导致S0实验组个体连续翻身能力偏弱的重要内因。
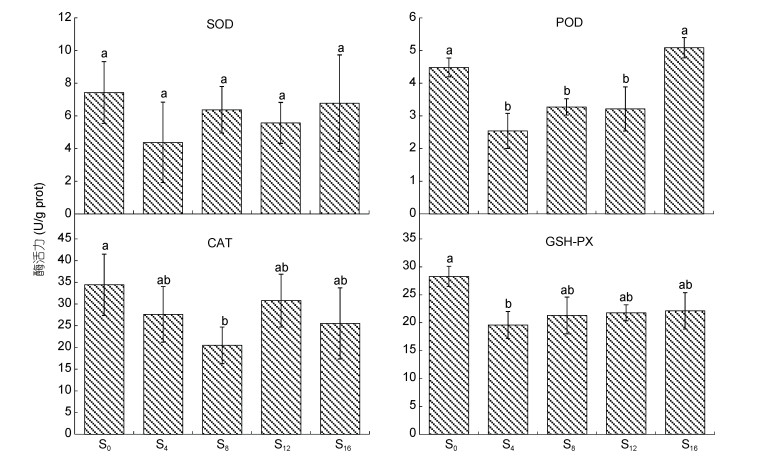 |
| 图 4 离水停食时长对实验鳖心脏抗氧化酶活力的影响 Fig. 4 Effects of air exposure and starvation duration on cardiac antioxidant enzyme activities of experimental turtles |
由图 5可见, 离水停食对脾脏抗氧化酶活力的影响主要表现为: (1) SOD酶活力除S8、S12与其他实验组均无差异(P > 0.05)外, 其余呈S0≈S4 < S16; (2) POD酶活力呈S0≈S4 < S8≈S12 < S16; (3) CAT酶活力除S4低于S8和S16 (P < 0.05)外, 其余均无组间差异(P > 0.05); (4) GSH- PX酶活力呈S4 < S12 < S8≈S16, 且S0与S4、S12均无差异(P > 0.05)。综上可知, S12实验组在酶活力排序上表露明显错位的仅为GSH-PX, 呈S4 < S12 < S8。
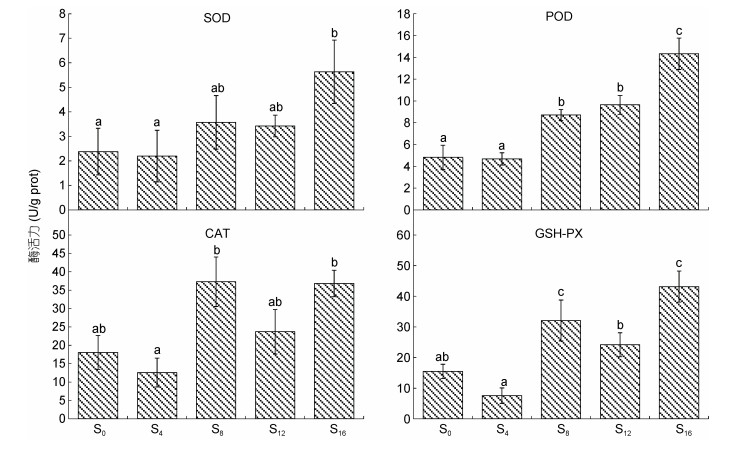 |
| 图 5 离水停食时长对实验鳖脾脏抗氧化酶活力的影响 Fig. 5 Effects of air exposure and starvation duration on splenic antioxidant enzyme activities of experimental turtles |
由图 6可见, 离水停食对肺抗氧化酶活力的影响主要表露为: (1) SOD和CAT酶活力分别呈S4 > S0≈ S8≈S12≈S16和S16 > S0≈S4≈S8≈S12; (2) POD酶活力除S0低于S4和S16 (P < 0.05)外, 其余均无组间差异(P > 0.05); (3) GSH-PX酶活力除S12与其他实验组均无差异(P > 0.05)外, 其余呈S4≈S16 > S0≈S8。综上, 从离水停食时序上看, 离水停食8~12 d为SOD酶活力显著回落后, 以及CAT酶活力显著上升前的稳定期。
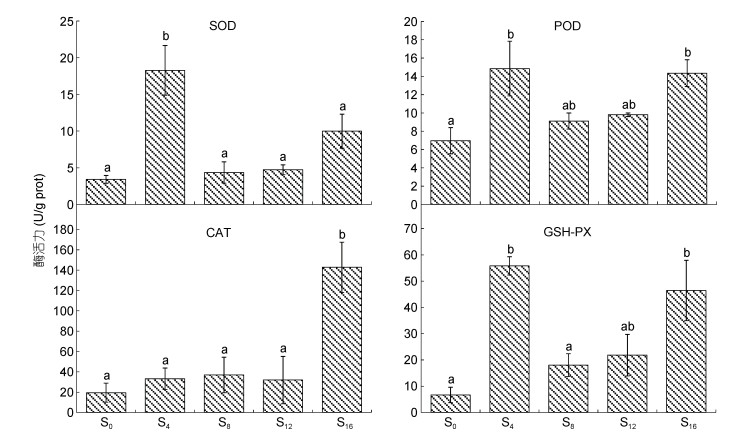 |
| 图 6 离水停食时长对实验鳖肺抗氧化酶活力的影响 Fig. 6 Effects of air exposure and starvation duration on pulmonary antioxidant enzyme activities of experimental turtles |
Arnold(1983)指出, 动物的运动能力和行为表现与其适合度密切相关。鉴于龟鳖类动物在自然生境中因翻身迟缓更易受干旱失水和被捕食等的威胁, 故常将翻身能力视为与其生存直接相关的特性之一(Finkler, 1999; Delmas et al, 2007)。无疑, 本研究中实验鳖连续翻身次数均主要集中于1 min内的结果(图 1), 既印证了翻身作为其生存直接相关特性所表露出的强敏感性, 也映射出其为完成连续翻身所需偿付的巨大能耗。徐本力(1984)指出, 运动员在承受最适负荷后往往会表露出运动积极性下降和休息时间延长的严重疲劳状态。这一现象在动物界中也普遍存在, 按此类比, 本研究将30 s内不能完成自主翻身复原作为终止实验鳖连续翻身的实验设计, 符合最适负荷下的体能测试原则。综上, 可在生产和销售实践中将连续翻身能力作为评价中华鳖活力或体质强健程度的重要依据。
运动负荷等级可粗分为大、中、小三级, 一般将竭尽全力只能完成1~7次、8~18次和19次以上分别评为大、中、小(徐本力, 1984)。本研究亦属竭力负荷测试, 按此类比, S0、S12、S16实验组与S4、S8实验组的连续翻身运动分别属大负荷和中负荷运动(图 1)。与此同时, S0、S12、S16实验组的连续翻身次数均与其1 min内的总翻身次数无差异(P > 0.05), 而S4、S8实验组的连续翻身次数则均与其1 min内的总翻身次数存在显著差异(P < 0.05)的结果, 也印证了图 1中S0、S12、S16实验组与S4、S8实验组间在翻身运动负荷上的差异。据报道, 余姚地区池养中华鳖的捕食活跃期、越冬准备期、越冬休眠期和活动复苏期依次为5月下旬至9月下旬、10月上旬至11月下旬、12月上旬至次年3月下旬、4月上旬至5月下旬(李有志等, 2022)。也就是说, 除S0实验组个体尚处于活动复苏期末期外, 其余实验组个体均已进入捕食活跃期。故, 图 1所示结果无疑表明实验鳖的连续翻身能力不仅与所处的活动阶段有关, 也与因离水停食时间过长导致的体能显著下降有关。
3.2 离水停食对实验鳖脏器抗氧化生理的影响特征抗氧化酶系统在保持动物体内自由基代谢平衡和维系细胞正常代谢中具重要作用(王志铮等, 2013a)。心、肺、脾、肝的健康状况与动物机体的免疫力、抗疲劳能力和持续运动能力具强相关性。因此, 上述这些脏器的抗氧化酶活水平对于指示受检动物在最适运动负荷下的耐受能力具重要参考价值。以S0实验组为参照, 本研究中肝脏抗氧化压力以S16为最高, S0为最低(图 3), 心脏抗氧化压力以S0、S16为最高, S4、S8为最低(图 4), 脾脏抗氧化压力以S16为最高, S0、S4为最低(图 5), 以及肺抗氧化压力显著高于S0的仅为S4和S16 (图 6)的情形, 并结合连续翻身次数呈S4≈S8 > S0≈S12≈S16 (图 1)的结果, 既反映了较高的心脏抗氧化压力是致处于活动复苏期末期的S0实验组个体翻身能力偏弱的客观事实, 也揭示了过长的离水停食时间是引发S16实验组个体心、肝、脾、肺抗氧化压力全面显著高企并致其负荷耐受能力显著下降的主因。一般而言, 生物有机体在正常生理状况下的抗氧化酶活力往往与其抗氧化压力呈正相关, 反之亦然(李有志等, 2022)。无疑, S4、S8、S12实验组在心、肝、脾、肺各抗氧化酶酶活力值排序上, 仅脾脏GSH-PX呈S8 > S12 > S4 (P < 0.05) (图 3, 图 4, 图 5, 图 6), 表露严重错位的结果, 表明S12组实验个体连续翻身能力的显著下降应与其脾脏抗氧化生理已出现一定程度的紊乱有关。综上可知, 由离水停食处理时间过长导致的免疫力和抗疲劳能力下降是引发S12和S16两实验组个体持续翻身能力显著弱于S4和S8的主因。
3.3 离水停食对实验鳖能源物质利用对策和裙边质构的影响特征据报道, 饥饿状态下水生动物对蛋白质的利用往往是在脂肪被大量消耗之后(Stirling, 1976; Kutty, 1978)。无疑, S0、S4两实验组间血清生化指标中仅TG含量存在显著差异, 呈S0 > S4 (P < 0.05) (表 1), 肝脂肪酶、胃蛋白酶和肠淀粉酶分别呈S0 < S4 (P < 0.05)、S0 > S4 (P < 0.05)和S0≈S4 (P > 0.05) (图 2), 以及肝脏Na+/K+- ATPase和Ca2+/Mg2+-ATPase酶活力均呈S0 < S4 (P < 0.05) (图 3)的结果, 既印证了脂肪是中华鳖感知饥饿后首先被大量利用的能源物质的观点(李有志等, 2022), 也揭示了TG含量的显著下降是激发S4实验组肝脂肪酶和ATP酶活力显著高企的主因。随着离水停食时间的延长, S4、S8、S12三实验组间除肝脂肪酶和肺SOD酶活力均呈S4 > S8≈S12外, 血清生化指标与其他消化酶和肺抗氧化酶活力均呈S4≈S8≈S12 (P > 0.05) (表 1, 图 2, 图 6)的结果, 在指示实验鳖通过稳定血脂、血糖和血清蛋白含量以适应离水停食生境的同时, 揭示了离水停食8~12 d期间实验鳖通过减少体脂消耗和降低肺部供氧压力建立了以低能耗代谢为主要特征的能源物资利用对策。与此同时, 三者间连续翻身次数和肝脏Ca2+/Mg2+-ATPase酶活力分别呈S4≈S8 > S12和S4 < S8≈S12的结果(图 1, 图 3), 也客观反映了以肝脏细胞跨膜运输压力高企为代价的低能耗代谢模式在维系实验鳖体能稳定上的不可持续性, 表明离水停食0~4 d、4~8 d、8~12 d依次为实验鳖启动体脂大量消耗的离水停食应激期、向低能耗代谢模式切换的体能稳定期以及以肝脏细胞跨膜运输压力高企为代价的体能下降期。
GLU是生物有机体可直接利用的能源物质(陈永祥等, 2009)。肝脏是糖原的主要存储器官(美国科学院国家研究委员会, 2015)。李有志等(2022)研究指出, 保持血清中GLU含量相对稳定对于维系非休眠期中华鳖的正常生命活动具极端重要性。无疑, S16实验组GLU-O含量的显著下降(P < 0.05)和肝脏SOD、POD、GSH-PX、Ca2+/Mg2+-ATPase酶活力的显著高企(P < 0.05) (表 1, 图 3)的结果, 既表明离水停食16 d后的实验鳖已进入以肝脏细胞抗氧化和跨膜运输压力显著高企为主要特征的低血糖生理紊乱期, 也揭示了低血糖是引发S16实验组免疫力、抗疲劳能力和持续运动能力下降的重要诱因。
研究发现, 硬度与受检动物组织的含脂量呈负相关(Dunajski, 1980; Nielsen et al, 2005; 李文倩等, 2010; Lin et al, 2012; 王志铮等, 2013b), 系表征组织质构的重要评价指标。因此, 受检组织的硬度可作为评判其脂肪消耗程度的重要依据。裙边虽为中华鳖的惰性组织(牟恩镟等, 2021), 但并非储存脂肪的主要蓄库。无疑, 质构评价指标中唯硬度与连续翻身次数均呈S4≈S8 > S12≈S16的结果(图 1, 表3), 在进一步印证脂肪系实验鳖离水停食期间流失的主要能源物质的同时, 也反映了裙边含脂量的显著下降意味着实验鳖机体能量已处于严重透支状态的客观事实。鉴于此, 可将裙边硬度作为指示中华鳖体能表露显著下降的关键评价指标。
4 结论(1) 中华鳖具快速翻身复原的行为学特性。本研究中实验鳖连续翻身次数均主要集中于1 min内的结果, 既印证了翻身作为其生存直接相关特性所表露出的强敏感性, 也映射出其为完成连续翻身所需偿付的巨大能耗。故, 可在生产和销售实践中将连续翻身能力作为评价中华鳖活力或体质强健程度的重要依据。
(2) 中华鳖的连续翻身能力既与所处的活动阶段有关, 也与离水停食时间过长导致的体能显著下降有关。较高的心脏抗氧化压力是尚处于活动复苏期末期的S0实验组个体翻身能力偏弱的重要原因, 免疫力和抗疲劳能力下降是引发S12和S16两实验组个体持续翻身能力显著弱于S4和S8的根本原因。
(3) 在本研究实验条件下, 离水停食0~4 d、4~8 d、8~12 d依次为实验鳖启动体脂大量消耗的应激期、向低能耗代谢模式切换的体能稳定期、以肝脏细胞跨膜运输压力高企为代价的体能下降期, 离水停食16 d后的实验鳖已进入以肝脏细胞抗氧化和跨膜运输压力显著高企为主要特征的低血糖生理紊乱期。
(4) 裙边虽为中华鳖的惰性组织, 但并非储存脂肪的主要蓄库。无疑。S12和S16实验组个体持续翻身能力的显著下降(P < 0.05)与裙边脂质的大幅流失相契合的结果, 表明裙边硬度可作为指示中华鳖体能表露显著下降的关键评价指标。
王志铮, 付英杰, 杨磊, 等, 2013a. 三种养殖模式下日本鳗鲡(Anguilla japonica)养成品体色和肌肉品质的差异[J]. 海洋与湖沼, 44(4): 1042-1049. |
王志铮, 赵晶, 杨磊, 等, 2013b. 三种养殖模式下日本鳗鲡(Anguilla japonica)养成品血清生化指标和脏器消化酶、抗氧化酶活力的差异[J]. 海洋与湖沼, 44(2): 403-408. |
王志铮, 施建军, 吕敢堂, 等, 2006. 受短期饥饿胁迫下麦瑞加拉鲮鱼(Cirrhina mrigola)幼鱼的生长、肌体组分及其内脏消化酶活力的变化特征[J]. 海洋与湖沼, 37(3): 218-224. |
农业农村部渔业渔政管理局, 全国水产技术推广总站, 中国水产学会, 2022. 2022中国渔业统计年鉴[M]. 北京: 中国农业出版社, 24, 35.
|
牟恩镟, 申屠琰, 熊玉凤, 等, 2021. 池塘专养模式下中华鳖养成品形态性状对体质量和净体质量的影响效应[J]. 浙江海洋大学学报(自然科学版), 40(1): 22-28, 79. |
李文倩, 李小勤, 冷向军, 等, 2010. 鳜鱼肌肉品质评价的初步研究[J]. 食品工业科技, 31(9): 114-117, 121. DOI:10.13386/j.issn1002-0306.2010.09.058 |
李有志, 牟恩镟, 申屠琰, 等, 2022. 越冬对池塘专养模式下中华鳖(Trionyx sinensis)机体形态、血清生化、脏器相关功能酶活力及肌肉和裙边物性的影响[J]. 海洋与湖沼, 53(2): 421-429. |
陈永祥, 肖玲远, 严太明, 等, 2009. 野生和养殖裂腹鱼血液学指标的比较研究[J]. 水生生物学报, 33(5): 905-910. |
陈师师, 2006. 中华鳖气调保鲜技术研究[D]. 杭州: 浙江工商大学.
|
国家技术监督局, 1994. 食品标签通用标准: GB 7718-1994[S]. 北京: 中国标准出版社.
|
徐本力, 1984. 第三讲 论运动负荷[J]. 福建体育科技, (S1): 93-168. |
谢小军, 邓利, 张波, 1998. 饥饿对鱼类生理生态学影响的研究进展[J]. 水生生物学报, 22(2): 181-188. |
美国科学院国家研究委员会, 2015. 鱼类与甲壳类营养需要[M]. 麦康森, 李鹏, 赵建民, 译. 北京: 科学出版社: 167.
|
ARNOLD S J, 1983. Morphology, performance and fitness[J]. American Zoologist, 23(2): 347-361. |
DELMAS V, BAUDRY E, GIRONDOT M, et al, 2007. The righting response as a fitness index in freshwater turtles[J]. Biological Journal of the Linnean Society, 91(1): 99-109. |
DUNAJSKI E, 1980. Texture of fish muscle[J]. Journal of Texture Studies, 10(4): 301-318. |
FINKLER M S, 1999. Influence of water availability during incubation on hatchling size, body composition, desiccation tolerance, and terrestrial locomotor performance in the snapping turtle Chelydra serpentine[J]. Physiological and Biochemical Zoology, 72(6): 714-722. |
KUTTY M N, 1978. Ammonia quotient in Sockeye salmon (Oncorhynchus nerka)[J]. Journal of the Fisheries Research Board of Canada, 35(7): 1003-1005. |
LIN W L, ZENG Q X, ZHU Z W, et al, 2012. Relation between protein characteristics and TPA texture characteristics of crisp grass carp (Ctenopharyngodon idellus C. ET V) and grass carp (Ctenopharyngodon idellus)[J]. Journal of Texture Studies, 43(1): 1-11. |
NIELSEN D, HYLDIG G, NIELSEN J, et al, 2005. Liquid holding capacity and instrumental and sensory texture properties of herring (Clupea harengus L.) related to biological and chemical parameters[J]. Journal of Texture Studies, 36(2): 119-138. |
STIRLING H P, 1976. Effects of experimental feeding and starvation on the proximate composition of the European bass Picentrarchus labrax[J]. Marine Biology, 34(1): 85-91. |
 2023, Vol. 54
2023, Vol. 54


