
中国海洋湖沼学会主办。
文章信息
- 郭煜文, 李奕凯, 戴明姝, 梁隽浩, 黄彦霖, 李广丽, 陈华谱. 2023.
- GUO Yu-Wen, LI Yi-Kai, DAI Ming-Shu, LIANG Jun-Hao, HUANG Yan-Lin, LI Guang-Li, CHEN Hua-Pu. 2023.
- 密斑刺鲀(Diodon hystrix) fshβ和lhβ基因的克隆及表达分析
- CLONING AND EXPRESSION ANALYSIS OF fshβ AND lhβ GENE IN DIODON HYSTRIX
- 海洋与湖沼, 54(6): 1775-1785
- Oceanologia et Limnologia Sinica, 54(6): 1775-1785.
- http://dx.doi.org/10.11693/hyhz20230400098
文章历史
-
收稿日期:2023-04-28
收修改稿日期:2023-08-04
在下丘脑-垂体-性腺(HPG)生殖调控轴中, 垂体是中间节点, 其分泌的促性腺激素(Gonadotropic hormone, GtH)是介导生殖调控的重要分子, 并在生殖轴中起到承上启下的关键作用。促性腺激素, 包括卵泡刺激素(follicle-stimulating hormone, Fsh)和黄体生成素(luteinizing hormone, Lh)。Fsh和Lh均为异二聚体、非共价结合的糖蛋白, 由一个相同的α亚基和一个激素特异性β亚基组成。每个亚基都由独立的基因编码(Pierce et al, 1981; Fiddes et al, 1984)。在哺乳动物中, Fsh和Lh由同一种促性腺激素细胞产生(Nakane, 1970), 但在硬骨鱼类中, Fsh和Lh主要由存在于硬骨鱼脑垂体远侧部和中间部的不同的细胞群合成和分泌(Weltzien et al, 2003; Zhou et al, 2010), 这表明硬骨鱼类的Fsh和Lh具有不同的分泌调节机制和生理调控功能(Kim et al, 2005)。
目前, Fsh和Lh已在欧洲鳗鲡(Anguilla anguilla)、日本鳗鲡(A. japonica)、大西洋鲑(Salmo salar)和草鱼(Ctenopharyngodon idella)等多种硬骨鱼类中克隆和鉴定, 并开展了分子结构和表达分析(Chang et al, 1988, 1990; Degani et al, 2003; Kim et al, 2005; Jeng et al, 2007; Banerjee et al, 2008; Zhou et al, 2010)。Fsh和Lh主要是受到来源于下丘脑神经元的促性腺激素释放激素(gonadotropin-releasing hormone, GnRH)的刺激而合成与释放, 释放后的Fsh和Lh分别与性腺中对应的受体Fshr和Lhr结合, 然后促进性腺合成性类固醇激素, 进而调节性腺的发育和成熟(Weltzien et al, 2004; 翟毅等, 2018)。研究表明, Fsh和Lh在性腺发育调控过程中具有互补作用, 在生殖周期的不同阶段, fshβ和lhβ在脑垂体中的表达存在明显差异。在裸盖鱼(Anoplopoma fimbria)的性腺发育过程中, fshβ和lhβ mRNA在垂体中的表达逐渐增加, 并在成熟期中表达量最高(Guzmán et al, 2018); 在美洲条纹狼鲈(Morone saxatilis)雌鱼卵巢发育早期, fshβ和lhβ表达量同样逐步增加, 在卵黄生成后期, fshβ的mRNA含量降低到基础水平, 但GtHα亚基和lhβ mRNA始终保持较高的表达水平(Hassin et al, 1995); GtH基因的表达特征是fshβ在配子发生的早期阶段表达量高, 并被认为作用于性腺早期的卵子发育和精子发生。另一方面, lhβ在配子发生的早期阶段表达量低, 甚至检测不到, 但在性腺成熟阶段表达量达到最高, 并被认为主要作用于配子成熟(Kagawa et al, 1998b)。
密斑刺鲀Diodon hystrix (Linnaeus, 1758), 俗称斑点河鲀, 隶属于鲀形目(Tetraodontiformes), 刺鲀科(Diodontidae), 刺鲀属(Diodon), 主要分布在亚热带海域的潟湖和珊瑚礁中。当前关于密斑刺鲀生殖调控的相关研究较少, 只是涉及促性腺激素释放激素和性腺转录组分析等研究(陈华谱等, 2021; Chen et al, 2021)。由此, 本研究旨在克隆密斑刺鲀fshβ和lhβ的cDNA序列并分析其结构特征, 研究密斑刺鲀fshβ和lhβ的表达模式, 为后续探究密斑刺鲀Fsh和Lh在生殖内分泌调控中的生理功能及构建完整的密斑刺鲀生殖调控轴提供理论基础。
1 材料与方法 1.1 实验材料实验所用密斑刺鲀(Diodon hystrix)为海南省三亚市近海捕捞, 经MS-222麻醉剂(Sigma, 美国)麻醉后解剖, 取心脏、肝脏、脾脏、肾脏、垂体、脑、卵巢和精巢等组织, 经液氮速冻后保存于–80 ℃冰箱待用。
1.2 实验试剂总RNA提取试剂盒Trizol Reagent和PrimeScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒(TaKaRa, 日本); 载体和感受态细胞pEASY-T3 Cloning Kit、2×EasyTaq® PCR SuperMix (+dye)和PerfectStart® Green qPCR SuperMix (全式金生物, 北京); 胶回收试剂盒和质粒提取(东盛生物, 广州); 其余化学试剂均为国产分析纯试剂。
1.3 总RNA提取和cDNA的合成将保存于–80 ℃的组织取出破碎匀浆, 使用Trizol Reagent试剂盒提取密斑刺鲀各组织总RNA。RNA完整性使用1.5%琼脂糖凝胶电泳验证。取1 μg RNA样品, 使用PrimeScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒反转录合成cDNA。
1.4 fshβ和lhβ基因的cDNA克隆 1.4.1 引物设计利用同源比对的方法, 从密斑刺鲀转录组数据(NCBI: PRJNA674446)中进行在线BLAST, 获取到密斑刺鲀fshβ和lhβ的基因序列, 并根据目的基因片段, 设计全长克隆和特异性引物(表l)。
| 引物 | 序列(5′~3′) | 目的 |
| fshβ-F1 | ACAAGGTGTGTAACGGGGACTG | 克隆 |
| fshβ-R1 | CCTTCAATGTGCTTCACCTCGTA | |
| lhβ-F1 | GTGCCGCTCTGTCAACTCGTC | 克隆 |
| lhβ-R1 | CAAGTGCTACAACCTTCCTTCTCC | |
| fshβ-F2 | GCTGGTTGTGATAATAGCAGTGTTG | 实时荧光定量 |
| fshβ-R2 | AGGAAGCGGCTGCAGTACATT | |
| lhβ-F2 | GTGCCGCTCTGTCAACTCGTC | 实时荧光定量 |
| lhβ-R2 | GGGGTAGGTGACAGTCGGGT | |
| β-actin-F | GAGAGGTTCCGTTGCCCAGAG | 内参基因 |
| β-actin-R | CAGACAGCACAGTGTTGGCGT |
以密斑刺鲀垂体组织的cDNA为模板, 结合fshβ和lhβ全长克隆引物, 按照前期研究的基因克隆方法进行密斑刺鲀lhβ和fshβ基因的克隆(陈华谱等, 2017)。PCR产物经1%琼脂糖凝胶电泳检测。将目的片段连接到pEASY-T3载体上, 转化至Trans1-T1感受态细胞, 筛选阳性结果送公司测序。
1.5 生物信息学分析用DNAstar 7.1软件预测密斑刺鲀fshβ和lhβ的开放阅读框并翻译为氨基酸序列, 进行同源性比对。运用在线网站SignalP 6.0 (https://services.healthtech.dtu.dk/service.php?SignalP)预测信号肽。运用在线网站SoftBerry (http://www.softberry.com/)预测蛋白质功能位点。运用Mega 11.0软件构建系统进化树。运用在线网站Swiss-model (https://swissmodel.expasy.org/)进行蛋白质三级结构预测及分析。
1.6 fshβ和lhβ基因的组织表达模式将密斑刺鲀心脏、肝脏、脾脏、肾脏、垂体、脑、卵巢和精巢等组织的cDNA作为模板, 参照PerfectStart® Green qPCR SuperMix试剂盒说明书准备反应体系, 利用Roche LightCycler 480 (Roche, 瑞士)检测fshβ和lhβ在各组织中的表达, 内参为β-actin基因。qPCR反应体系为10 μL︰5 μL qPCR SuperMix, 0.4 μL上游引物, 0.4 μL下游引物, 1 μL cDNA模板, 3.2 μL无酶水。反应程序为: 首先95 ℃预变性1 min; 95 ℃变性5 s, 57 ℃退火10 s, 72 ℃延伸20 s, 84 ℃收集荧光10 s, 共40个循环; 溶解曲线: 95 ℃ 1 min, 52 ℃ 1 min, 95 ℃延伸。每个样品3次重复, 用R=2–∆∆Ct方法计算其相对表达量, 并使用SPSS 25.0软件进行统计分析。
1.7 性腺发育过程中fshβ和lhβ基因在垂体中的表达模式将密斑刺鲀麻醉后取其性腺及垂体组织, 依照Chen等(2020)石蜡切片方法对性腺进行切片观察和组织学分析, 鉴定其发育时期后将对应的垂体组织进行归类。将垂体组织的cDNA作为模板, 实时荧光定量的方法与上述1.6相同, 每个样品5次重复, 检测不同性腺发育时期的垂体组织中fshβ和lhβ基因的相对表达量。
2 结果与分析 2.1 密斑刺鲀fshβ和lhβ基因cDNA克隆及序列分析通过对克隆获得的序列进行分析, 发现密斑刺鲀fshβ cDNA开放阅读框共363 bp, 编码120个氨基酸, 分子量(MW)为13.17 kDa, 理论等电点(pI)为6.01。其中1~18位氨基酸为信号肽, 19~120位氨基酸为成熟肽, 成熟肽部分包含了12个保守的半胱氨酸残基, 19~117位氨基酸为功能结构保守区糖蛋白激素β链同系物(glycoprotein hormone beta chain homologues, GHB)。此外, 在Fshβ氨基酸序列中含有一个N-糖基化位点(图 1)。
 |
图 1 密斑刺鲀fshβ基因开放阅读框序列及其推测的氨基酸序列 Fig. 1 Open reading frame sequence of fshβ gene of D. hystrix and its inferred amino acid sequence 注: 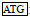 为起始密码子; 为起始密码子; 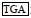 为终止密码子; 下划实线为信号肽; 黑体字母为功能保守区域; 下划波浪线为N-糖基化位点; 灰色阴影为半胱氨酸 为终止密码子; 下划实线为信号肽; 黑体字母为功能保守区域; 下划波浪线为N-糖基化位点; 灰色阴影为半胱氨酸 |
密斑刺鲀lhβ cDNA开放阅读框共420 bp, 编码139个氨基酸, 分子量为15.67 kDa, 理论等电点为5.61。其中1~19位氨基酸为信号肽, 20~139位氨基酸为成熟肽, 成熟肽部分包含了12个保守的半胱氨酸残基, 21~126位氨基酸为功能结构保守区GHB。此外, 在Lhβ氨基酸序列中含有一个N-糖基化位点(图 2)。
 |
图 2 密斑刺鲀lhβ基因开放阅读框序列及其推测的氨基酸序列 Fig. 2 Open reading frame sequence of lhβ gene of D. hystrix and its inferred amino acid sequence 注: 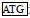 为起始密码子; 为起始密码子; 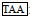 为终止密码子; 下划实线为信号肽; 黑体字母为功能保守区域; 下划波浪线为N-糖基化位点; 灰色阴影为半胱氨酸 为终止密码子; 下划实线为信号肽; 黑体字母为功能保守区域; 下划波浪线为N-糖基化位点; 灰色阴影为半胱氨酸 |
通过SoftBerry网站预测Fshβ和Lhβ其他功能位点。Fshβ功能位点包括: N-豆蔻酰化位点、异戊烯基团结合位点及微体C-末端靶向信号(表 2); Lhβ功能位点包括: 蛋白激酶C磷酸化位点、N-豆蔻酰化位点、原核膜脂质附着位点、异戊烯基团结合位点及糖蛋白激素β链特征1、糖蛋白激素β链特征2 (表 3)。
| 功能位点 | 所在位置/bp | 氨基酸序列 |
| N-豆蔻酰化位点 | 18~23 | GCHFGC |
| 36~41 | GLTVNV | |
| 82~87 | GCPESI | |
| 异戊烯基团结合位点 | 35~38 | CGLT |
| 微体C-末端靶向信号 | 13~15 | ARM |
| 19~21 | CHF | |
| 108~110 | SRF |
| 功能位点 | 所在位置/bp | 氨基酸序列 |
| 蛋白激酶C磷酸化位点 | 74~76 | TYR |
| N-豆蔻酰化位点 | 38~43 | GCSTCQ |
| 87~92 | GCPPGV | |
| 91~96 | GVDPTV | |
| 原核膜脂质附着位点 | 94~104 | PTVTYPVALSC |
| 异戊烯基团结合位点 | 4~7 109~112 |
CLLV CSMN |
| 糖蛋白激素β链特征1 | 50~56 | CSGHCVT |
| 糖蛋白激素β链特征2 | 99~126 | PVALSCHCGHCS MNTTDCTFESLQ PDFC |
将密斑刺鲀与红鳍东方鲀(Takifugu rubripes)、菊黄东方鲀(Takifugu flavidus)和尼罗河鲈鱼(Lates niloticus)等9种脊椎动物Fshβ的氨基酸序列进行多重序列比对及同源性分析。结果显示, 密斑刺鲀Fshβ的氨基酸序列与同为鲀形目的菊黄东方鲀的同源性最高, 为67.5%; 与哺乳类动物小鼠(Mus musculus)和智人(Homo sapiens)的同源性较低, 分别是28.3%和28.7% (图 3) (表 4)。
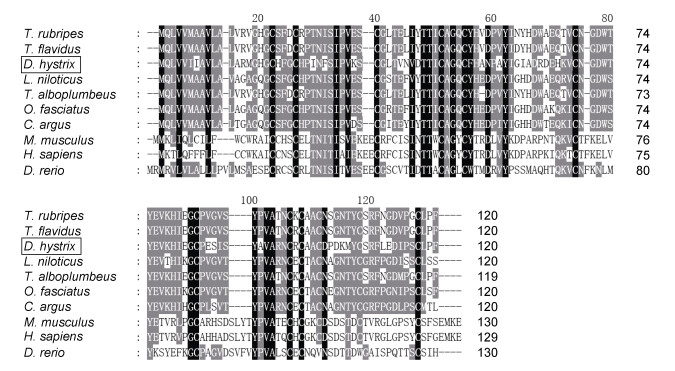 |
| 图 3 密斑刺鲀与其他物种Fshβ氨基酸序列的多重比对 Fig. 3 Multiple alignment of Fshβ amino acid sequences between D. hystrix and other species 注: 以上各物种的NCBI登录号: Takifugu rubripes (红鳍东方鲀) XP_011608222.1, Takifugu flavidus (菊黄东方鲀) TWW67736.1, Lates niloticus (尼罗河鲈鱼) AKE14361.1, Takifugu alboplumbeus (铅点东方鲀) BAJ12081.1, Oplegnathus fasciatus (条石鲷) AIZ66846.1, Channa argus (乌鳢) KAF3686704.1, Mus musculus (小鼠) AAA92804.1, Homo sapiens (智人) ABM88373.1, Danio rerio (斑马鱼) AAR84282.1 |
| 物种 | 同源性/% |
| 斑马鱼(Danio rerio) | 31.9 |
| 红鳍东方鲀(Takifugu rubripes) | 66.7 |
| 菊黄东方鲀(Takifugu flavidus) | 67.5 |
| 尼罗河鲈鱼(Lates niloticus) | 63.0 |
| 铅点东方鲀(Takifugu alboplumbeus) | 66.1 |
| 条石鲷(Oplegnathus fasciatus) | 63.3 |
| 乌鳢(Channa argus) | 62.5 |
| 小鼠(Mus musculus) | 28.3 |
| 智人(Homo sapiens) | 28.7 |
对密斑刺鲀与斑马鱼、高体鰤(Seriola dumerili)和红鳍东方鲀等9种脊椎动物Lhβ的氨基酸序列进行多重序列比对及同源性分析。结果显示, 鱼类Lhβ的氨基酸序列的C-末端区域十分保守, 但N-末端区域与其他硬骨鱼类和哺乳动物差异较大(图 4)。密斑刺鲀与同为鲀形目的菊黄东方鲀的同源性最高, 为70.2%; 与哺乳类动物小鼠和智人的同源性较低, 分别是44.5%和40.6% (表 5)。
 |
| 图 4 密斑刺鲀与其他物种Lhβ氨基酸序列的多重比对 Fig. 4 Multiple alignment of Lhβ amino acid sequences between D. hystrix and other species 注: 以上各物种的NCBI登录号: Danio rerio (斑马鱼) AAV31153.1, Seriola dumerili (高体鰤) XP_022603873.1, Takifugu rubripes (红鳍东方鲀) XP_011601356.1, Monopterus albus (黄鳝) XP_020462355.1, Takifugu flavidus (菊黄东方鲀) TWW78441.1, Anarrhichthys ocellatus (狼鳗) XP_031694696.1, Oreochromis niloticus (尼罗罗非鱼) XP_025753499.1, Mus musculus (小鼠) EDL22853.1, Homo sapiens (智人) KAI4043840.1 |
| 物种 | 同源性/% |
| 斑马鱼(Danio rerio) | 53.0 |
| 高体鰤(Seriola dumerili) | 70.1 |
| 红鳍东方鲀(Takifugu rubripes) | 68.5 |
| 黄鳝(Monopterus albus) | 68.9 |
| 菊黄东方鲀(Takifugu flavidus) | 70.2 |
| 狼鳗(Anarrhichthys ocellatus) | 62.0 |
| 智人(Homo sapiens) | 40.6 |
| 尼罗罗非鱼(Oreochromis niloticus) | 66.7 |
| 小鼠(Mus musculus) | 44.5 |
运用邻位相连算法(Neighbor-Joining)构建密斑刺鲀与其他脊椎动物Fshβ和Lhβ的系统进化树, 以确定密斑刺鲀Fshβ和Lhβ的进化关系。结果表明, 脊椎动物Fshβ聚类为一个独立的进化分支, 而Lhβ则聚类为另一个独立进化分支。其中密斑刺鲀Fshβ和Lhβ与红鳍东方鲀和菊黄东方鲀等鲀型目鱼类的亲缘关系较近(图 5)。
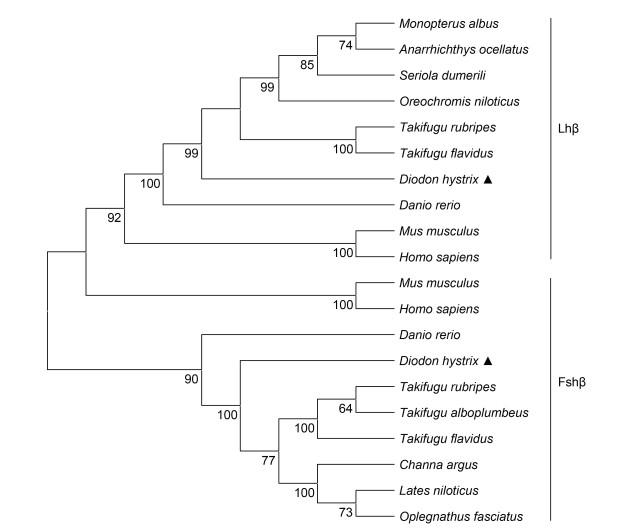 |
| 图 5 Fshβ和Lhβ系统进化树 Fig. 5 The analysis of phylogenetic tree of Fshβ and Lhβ 注: 系统进化树中结点处数值代表1000次评估的自举检验置信度; 三角形表示本研究对象Diodon hystrix |
利用Swiss-model网站预测密斑刺鲀和其他脊椎动物Fshβ和Lhβ成熟肽的三级结构。结果显示, 密斑刺鲀Fshβ成熟肽的三级结构与人和红鳍东方鲀的Fshβ高度相似。而密斑刺鲀Lhβ成熟肽的三级结构与红鳍东方鲀的Lhβ结构相似, 但与人的Lhβ结构差异较大(图 6)。
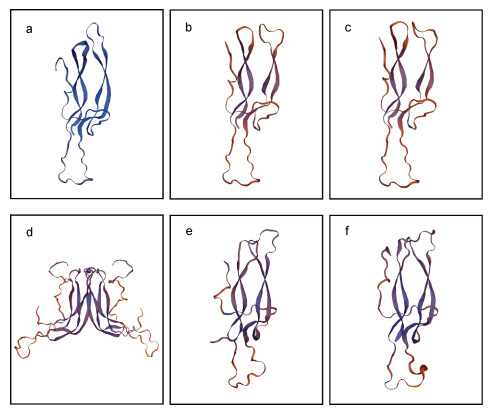 |
| 图 6 密斑刺鲀和其他脊椎动物Fshβ、Lhβ成熟肽的三级预测结构 Fig. 6 The predicted 3D structures of Fshβ and Lhβ mature peptides in D. hystrix and other vertebrates 注: a. 人Fshβ成熟肽; b. 密斑刺鲀Fshβ成熟肽; c. 红鳍东方鲀Fshβ成熟肽; d. 人Lhβ成熟肽; e. 密斑刺鲀Lhβ成熟肽; f. 红鳍东方鲀Lhβ成熟肽 |
通过实时荧光定量的方法检测密斑刺鲀不同组织中fshβ和lhβ mRNA的表达水平。结果表明, 密斑刺鲀fshβ和lhβ在各组织中都有分布, 在雄鱼和雌鱼垂体中的表达量最高, 在性腺中的表达量次之, 而在心脏、脾脏和肾脏中表达量较低(图 7)。
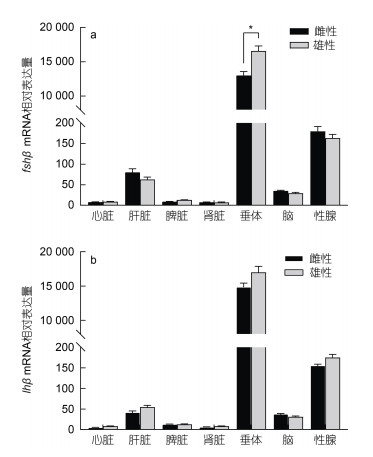 |
| 图 7 密斑刺鲀fshβ和lhβ基因在不同组织中的表达 Fig. 7 Expressions of fshβ and lhβ in different tissues of D. hystrix 注: a. fshβ; b. lhβ。数据以平均值±平均标准方差表示(n=3), 统计差异表示为*P < 0.05 |
按照先前的研究(陈华谱等, 2021), 将密斑刺鲀的雌雄性腺分为早、中和晚期共3个时期。通过检测在雌雄性腺发育的不同时期, 垂体中fshβ和lhβ的表达模式, 发现fshβ基因在卵巢和精巢发育成熟过程中的表达量均逐渐下降, 而lhβ基因在卵巢和精巢发育成熟过程中的表达量逐渐增加(图 8)。
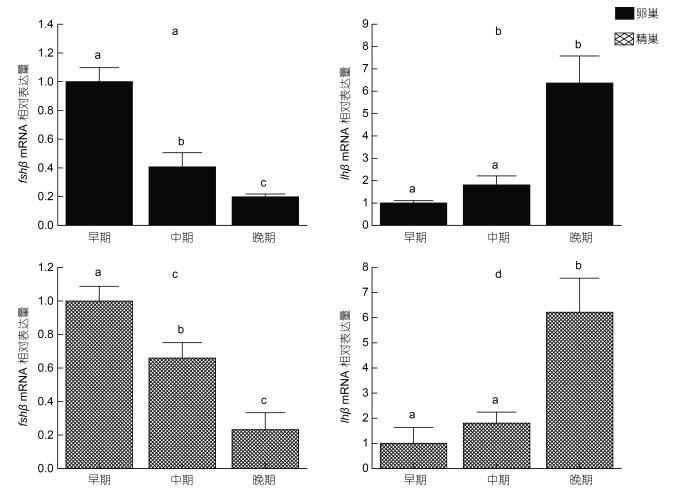 |
| 图 8 密斑刺鲀不同性腺发育时期fshβ和lhβ基因在垂体中的表达 Fig. 8 The expression of fshβ and lhβ in the pituitary of D. hystrix at different gonadal development stages 注: 垂体中fshβ (a)和lhβ (b)在不同卵巢发育时期的表达; 垂体中fshβ (c)和lhβ (d)在不同精巢发育时期的表达。数据以平均值±平均标准方差表示(n=5); 上标不同的字母表示组间的显著性差异(P < 0.05) |
本研究成功克隆了密斑刺鲀fshβ和lhβ基因cDNA序列, 并推导出其氨基酸序列。结果显示, 密斑刺鲀Fshβ和Lhβ的氨基酸序列中, 都含有一个N-糖基化位点和12个半胱氨酸残基, 具有Fshβ和Lhβ典型的组成结构。一般认为, N-糖基化位点和半胱氨酸残基对于蛋白质结合特异性受体、形成异二聚体结构和蛋白质折叠等方面十分关键(Gharib et al, 1990)。当Fshβ和Lhβ的序列中N-糖基化位点和半胱氨酸残基发生突变时, 将不能稳定地与GtHα结合并导致其异二聚体结构不稳定(Swanson et al, 2003; Kim et al, 2005)。研究发现, 在鱼类中Fshβ氨基酸序列中N-糖基化位点的数量有差异。密斑刺鲀Fshβ只含有一个N-糖基化位点, 与齐口裂腹鱼(Schizothorax prenanti) (曹洪涛, 2010)和美洲条纹狼鲈(Hassin et al, 1995)等结果一致, 而在漠斑牙鲆(Paralichthys lethostigma) (柳学周等, 2014)和大菱鲆(Scophthalmus maximus) (高云红, 2020)中, Fshβ含有两个N-糖基化位点。第二个糖基化位点兼具与受体结合以及增强信号转导活性的功能(Flack et al, 1994)。根据同源性分析的结果, 密斑刺鲀Fshβ和Lhβ亚基与同为鲀形目鱼类的同源性最高, 与在其他鱼类中的研究相类似(Kato et al, 1993; Quérat et al, 2000; Ando et al, 2004)。此外, 通过构建系统进化树分析, 发现密斑刺鲀Fshβ和Lhβ分别与其他物种的Fshβ和Lhβ聚为一支, 且均与同为鲀形目的物种亲缘关系最近, 与哺乳类的亲缘关系较远, 符合其传统的分类地位与进化关系(黄小琪等, 2020)。但有意思的是, 通过Fshβ和Lhβ亚基的氨基酸序列三级结构分析, 发现从鱼类到哺乳类其Fshβ亚基三级结构非常相似, 而Lhβ亚基的差异较大, 这可能与氨基酸序列差异相关。Lhβ氨基酸序列C-末端区域保守性较高, 但N-末端区域与其他硬骨鱼类和哺乳动物存在较大差异, 猜测是在进化过程中产生了部分氨基酸缺失(黄小琪等, 2020)。
根据组织分布的检测结果, fshβ和lhβ基因在密斑刺鲀各组织中的表达具有显著的差异, 但雌雄个体之间的组织分布情况高度相似, 均在垂体中表达量最高, 其次是性腺。垂体组织是密斑刺鲀分泌促性腺激素最关键的组织, 而多组织表达的特性, 也预示着fshβ和lhβ基因可能还参与了鱼体内其他的生理过程, 与斑马鱼(So et al, 2005)、丝鳍毛足鲈(Trichogaster trichopterus) (Jackson et al, 1999)和金头鲷(Sparus aurata) (Meiri et al, 2004)中的研究结果相吻合。此外, 在早期的部分鱼类研究中发现促性腺激素仅在垂体中特异性表达, 不具有广泛分布的特性(Tyler et al, 1991; Kagawa et al, 1998a; 牛艳东等, 2008), 可能是由于不同物种间的差异, 或不同的发育状态, 亦或是受限于早期检测技术的较低灵敏度而产生的差异结果。众所周知, 促性腺激素的受体在不同组织中均有广泛的分布, 而促性腺激素作为分泌性蛋白, 可伴随血液循环系统作用到不同组织, 由此, 关于fshβ和lhβ的其他生理功能仍有待发掘。
密斑刺鲀垂体中fshβ和lhβ基因在性腺发育不同时期中具有不同的表达模式。在卵巢和精巢发育早期, fshβ在垂体组织中具有较高的表达量, 随着性腺的进一步成熟, fshβ的表达量逐渐降低, 表明Fsh是密斑刺鲀性腺发育早期起主导作用的促性腺激素类型, 主要调控性腺早期的发育。而在雌雄性腺发育早期, 密斑刺鲀lhβ基因在垂体组织中的表达量较低, 但随着性腺发育而逐渐升高, 表明Lh参与调控性腺发育成熟后期。密斑刺鲀fshβ和lhβ基因在性腺发育过程的表达模式与大刺鳅(Mastacembelus armatus) (黄小琪等, 2020)和条石鲷(陈圣毅等, 2014)等研究结果相一致, 也和传统的认知相同, Fsh作用于性腺发育的早期, Lh主要作用于性腺发育的后期。但在鱼类中, 关于fshβ和lhβ基因在性腺发育不同时期的表达同样存在着多样性。在漠斑牙鲆的研究中发现, 垂体中fshβ在卵巢发育的早期的表达量较低, 到卵巢成熟时, fshβ的表达量显著升高(柳学周等, 2014)。在草鱼(Zhou et al, 2010)的研究中, 发现fshβ和lhβ在草鱼性腺发育过程中具有相同的表达模式, 二者共同调控草鱼性腺的发育和成熟。这表明鱼类Fsh和Lh在发挥生殖调控功能中存在着明显的种间差异和生理功能差异。
4 结论本研究克隆鉴定了密斑刺鲀fshβ和lhβ基因的cDNA序列, 并进行了序列及结构分析, 发现Fshβ和Lhβ都含有一个N-糖基化位点和12个半胱氨酸残基, 在硬骨鱼中Fshβ和Lhβ都与同为鲀形目的物种亲缘关系较近。同时, 发现了fshβ和lhβ在所有组织中均有表达, 在垂体中的表达量最高, 这预示着除了参与性腺发育调控外, fshβ和lhβ基因在密斑刺鲀中可能参与更多样化的调控过程。此外, 密斑刺鲀垂体中fshβ和lhβ基因在性腺发育不同时期的表达模式提示, Fsh主要在性腺发育早期起主导作用, 而性腺发育晚期则主要由Lh发挥功能。本研究为密斑刺鲀生殖调控机制研究提供了一定的理论基础。
牛艳东, 周毅, 陶敏, 等, 2008. 鳙鱼(Hypophthalmichthys nobilis)促性腺激素β亚基的克隆、表达和序列分析[J]. 湖南师范大学自然科学学报, 31(2): 120-124. DOI:10.3969/j.issn.1000-2537.2008.02.029 |
陈圣毅, 柳学周, 史宝, 等, 2014. 条石鲷促性腺激素β (FSH, LH)亚基cDNA克隆及表达特性分析[J]. 水产学报, 38(10): 1673-1686. |
陈华谱, 洪广, 刘燕华, 等, 2017. 泰国斗鱼抗缪勒氏管激素(AMH)基因cDNA克隆及表达[J]. 广东海洋大学学报, 37(6): 84-88. DOI:10.3969/j.issn.1673-9159.2017.06.013 |
陈华谱, 黄春仁, 何睿祺, 等, 2021. 密斑刺鲀(Diodon hystrix) gnrh基因的克隆及表达分析[J]. 海洋与湖沼, 52(4): 994-1006. |
柳学周, 臧坤, 徐永江, 等, 2014. 漠斑牙鲆(Paralichthys lethostigma) LHβ基因克隆及其在卵巢不同发育期的表达特征[J]. 渔业科学进展, 35(4): 22-31. |
高云红, 2020. 大菱鲆(Scophthalmus maximus. L)垂体促性腺激素生理功能研究[D]. 上海: 上海海洋大学.
|
黄小琪, 钟东明, 何佩莹, 等, 2020. 大刺鳅促黄体生成素基因克隆及其组织表达分析[J]. 南方农业学报, 51(7): 1706-1713. DOI:10.3969/j.issn.2095-1191.2020.07.025 |
曹洪涛, 2010. 齐口裂腹鱼(Schizothorax prenanti)FSHβ亚基与LHβ亚基cDNA全序列克隆及生物信息学分析[D]. 雅安: 四川农业大学.
|
翟毅, 刘建业, 贾丽英, 等, 2018. 金钱鱼cyp17a1基因克隆、组织分布及在卵巢发育中的表达[J]. 广东海洋大学学报, 38(5): 1-7. DOI:10.3969/j.issn.1673-9159.2018.05.001 |
ANDO H, SWANSON P, KITANI T, et al, 2004. Synergistic effects of salmon gonadotropin-releasing hormone and estradiol-17β on gonadotropin subunit gene expression and release in masu salmon pituitary cells in vitro[J]. General and Comparative Endocrinology, 137(1): 109-121. DOI:10.1016/j.ygcen.2004.02.012 |
BANERJEE A, KHAN I A, 2008. Molecular cloning of FSH and LH β subunits and their regulation by estrogen in Atlantic croaker[J]. General and Comparative Endocrinology, 155(3): 827-837. DOI:10.1016/j.ygcen.2007.09.016 |
CHANG Y S, HUANG C J, HUANG F L, et al, 1988. Primary structures of carp gonadotropin subunits deduced from cDNA nucleotide sequences[J]. International Journal of Peptide and Protein Research, 32(6): 556-564. DOI:10.1111/j.1399-3011.1988.tb01387.x |
CHANG Y S, HUANG C J, HUANG F L, et al, 1990. Purification, characterization, and molecular cloning of gonadotropin subunits of silver carp (Hypophthalmichthys molitrix)[J]. General and Comparative Endocrinology, 78(1): 23-33. DOI:10.1016/0016-6480(90)90043-L |
CHEN H P, CUI X F, WANG Y R, et al, 2020. Identification, functional characterization, and estrogen regulation on gonadotropin-releasing hormone in the spotted scat, Scatophagus argus[J]. Fish Physiology and Biochemistry, 46(5): 1743-1757. DOI:10.1007/s10695-020-00825-5 |
CHEN H P, LI Z Y, WANG Y R, et al, 2021. Comparison of gonadal transcriptomes uncovers reproduction-related genes with sexually dimorphic expression patterns in Diodon hystrix[J]. Animals, 11(4): 1042. DOI:10.3390/ani11041042 |
DEGANI G, GOLDBERG D, TZCHORI I, et al, 2003. Cloning of European eel (Anguilla anguilla) FSH-β subunit, and expression of FSH-β and LH-β in males and females after sex determination[J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 136(2): 283-293. DOI:10.1016/S1096-4959(03)00207-0 |
FIDDES J C, TALMADGE K, 1984. Structure, expression, and evolution of the genes for the human glycoprotein hormones [M] // GREEP R O. Recent Progress in Hormone Research. Amsterdam: Academic Press: 43-78.
|
FLACK M R, FROEHLICH J, BENNET A P, et al, 1994. Site-directed mutagenesis defines the individual roles of the glycosylation sites on follicle-stimulating hormone[J]. Journal of Biological Chemistry, 269(19): 14015-14020. DOI:10.1016/S0021-9258(17)36748-0 |
GHARIB S D, WIERMAN M E, SHUPNIK M A, et al, 1990. Molecular biology of the pituitary gonadotropins[J]. Endocrine Reviews, 11(1): 177-199. DOI:10.1210/edrv-11-1-177 |
GUZMÁN J M, LUCKENBACH J A, DA SILVA D A M, et al, 2018. Seasonal variation of pituitary gonadotropin subunit, brain-type aromatase and sex steroid receptor mRNAs, and plasma steroids during gametogenesis in wild sablefish[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 219-220: 48-57. |
HASSIN S, ELIZUR A, ZOHAR Y, 1995. Molecular cloning and sequence analysis of striped bass (Morone saxatilis) gonadotrophin-Ⅰ and -Ⅱ subunits[J]. Journal of Molecular Endocrinology, 15(1): 23-35. DOI:10.1677/jme.0.0150023 |
JACKSON K, GOLDBERG D, OFIR M, et al, 1999. Blue gourami (Trichogaster trichopterus) gonadotropic beta subunits (Ⅰ and Ⅱ) cDNA sequences and expression during oogenesis[J]. Journal of Molecular Endocrinology, 23(2): 177-187. DOI:10.1677/jme.0.0230177 |
JENG S R, YUEH W S, CHEN G R, et al, 2007. Differential expression and regulation of gonadotropins and their receptors in the Japanese eel, Anguilla japonica[J]. General and Comparative Endocrinology, 154(1/2/3): 161-173. |
KAGAWA H, KAWAZOE I, TANAKA H, et al, 1998a. Immunocytochemical identification of two distinct gonadotropic cells (GTH Ⅰ and GTH Ⅱ) in the pituitary of bluefin tuna, Thunnus thynnus[J]. General and Comparative Endocrinology, 110(1): 11-18. DOI:10.1006/gcen.1997.7049 |
KAGAWA H, TANAKA H, OKUZAWA K, et al, 1998b. GTH Ⅱ but not GTH I induces final maturation and the development of maturational competence of oocytes of red seabream in vitro[J]. General and Comparative Endocrinology, 112(1): 80-88. DOI:10.1006/gcen.1998.7133 |
KATO Y, GEN K, MARUYAMA O, et al, 1993. Molecular cloning of cDNAs encoding two gonadotrophin beta subunits (GTH-Ⅰ beta and -Ⅱ beta) from the masu salmon, Oncorhynchus masou: rapid divergence of the GTH-I beta gene[J]. Journal of Molecular Endocrinology, 11(3): 275-282. DOI:10.1677/jme.0.0110275 |
KIM D J, CHO Y C, SOHN Y C, 2005. Molecular characterization of rockfish (Sebastes schlegeli) gonadotropin subunits and their mRNA expression profiles during oogenesis[J]. General and Comparative Endocrinology, 141(3): 282-290. DOI:10.1016/j.ygcen.2005.01.001 |
MEIRI I, KNIBB W R, ZOHAR Y, et al, 2004. Temporal profile of β follicle-stimulating hormone, β luteinizing hormone, and growth hormone gene expression in the protandrous hermaphrodite, gilthead seabream, Sparus aurata[J]. General and Comparative Endocrinology, 137(3): 288-299. DOI:10.1016/j.ygcen.2004.04.002 |
NAKANE P K, 1970. Classifications of anterior pituitary cell types with immunoenzyme histochemistry[J]. Journal of Histochemistry & Cytochemistry, 18(1): 9-20. |
PIERCE J G, PARSONS T F, 1981. Glycoprotein hormones: structure and function[J]. Annual Review of Biochemistry, 50: 465-495. DOI:10.1146/annurev.bi.50.070181.002341 |
QUÉRAT B, SELLOUK A, SALMON C, 2000. Phylogenetic analysis of the vertebrate glycoprotein hormone family including new sequences of sturgeon (Acipenser baeri) β subunits of the two gonadotropins and the thyroid-stimulating hormone[J]. Biology of Reproduction, 63(1): 222-228. DOI:10.1095/biolreprod63.1.222 |
SO W K, KWOK H F, GE W, 2005. Zebrafish gonadotropins and their receptors: Ⅱ. Cloning and characterization of zebrafish follicle-stimulating hormone and luteinizing hormone subunits-their spatial-temporal expression patterns and receptor specificity[J]. Biology of Reproduction, 72(6): 1382-1396. DOI:10.1095/biolreprod.104.038216 |
SWANSON P, DICKEY J T, CAMPBELL B, 2003. Biochemistry and physiology of fish gonadotropins[J]. Fish Physiology and Biochemistry, 28(1/2/3/4): 53-59. |
TYLER C R, SUMPTER J P, KAWAUCHI H, et al, 1991. Involvement of gonadotropin in the uptake of vitellogenin into vitellogenic oocytes of the rainbow trout, Oncorhynchus mykiss[J]. General and Comparative Endocrinology, 84(2): 291-299. DOI:10.1016/0016-6480(91)90052-8 |
WELTZIEN F A, ANDERSSON E, ANDERSEN Ø, et al, 2004. The brain-pituitary-gonad axis in male teleosts, with special emphasis on flatfish (Pleuronectiformes)[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 137(3): 447-477. |
WELTZIEN F A, NORBERG B, HELVIK J V, et al, 2003. Identification and localization of eight distinct hormone-producing cell types in the pituitary of male Atlantic halibut (Hippoglossus hippoglossus L.)[J]. Comparative Biochemistry and Physiology Part A: Molecular & Integrative Physiology, 134(2): 315-327. |
ZHOU Y, NIU Y D, TAO M, et al, 2010. Molecular cloning, characterization and expression of FSH and LH beta subunits from grass carp (Ctenopharyngodon idella)[J]. Fish Physiology and Biochemistry, 36(2): 213-221. DOI:10.1007/s10695-008-9223-4 |
 2023, Vol. 54
2023, Vol. 54


