中国海洋湖沼学会主办。
文章信息
- 俞越, 王嫣贝, 范魏丰, 董建玮, 王红兵, 袁振威, 耿乐, 杜永芬, 李玉凤. 2024.
- YU Yue, WANG Yan-Bei, FAN Wei-Feng, DONG Jian-Wei, WANG Hong-Bing, YUAN Zhen-Wei, GENG Le, DU Yong-Fen, LI Yu-Feng. 2024.
- 潮汕海岸带河-海交互区沉积环境及小型底栖动物群落结构研究
- SEDIMENTARY ENVIRONMENT AND MEIOFAUNA COMMUNITY STRUCTURE IN RIVER-SEA INTERACTION AREA OFF CHAOSHAN, GUANGDONG
- 海洋与湖沼, 55(1): 155-170
- Oceanologia et Limnologia Sinica, 55(1): 155-170.
- http://dx.doi.org/10.11693/hyhz20230800160
文章历史
-
收稿日期:2023-08-03
收修改稿日期:2023-10-14
2. 中国地质调查局海口海洋调查中心 海南海口 571127
2. Haikou Marine Survey Center, China Geological Survey, Haikou 571127, China
河口区位于陆海交互带, 受潮汐作用和河流淡水的共同影响(沈国英等, 2010), 物理化学特性复杂多变(Alves et al, 2013; Ngo et al, 2013)。潮汐节律引起盐度的周期性变化是河口区最重要的特点, 此外, 温度、沉积物、溶解氧等也是影响河口区生物分布的关键因子(沈国英等, 2010)。入海河流中丰富的营养盐为生物生长创造了良好环境。然而, 随着全球变化和人类对海洋资源的过度开发, 河口环境也承受着巨大的压力, 如农药、重金属、塑料用品等污染物的大量输入导致的水质退化(Ngo et al, 2013), 继而引起生物多样性和生态系统稳定性降低(毛婕昕等, 2011), 直接危及宜居环境。因此, 河口区的环境质量监测和评价对维持河口生态系统健康具有重要意义。
底栖动物是生活在沉积物上、内或者水体底部所有动物的总称, 包括大型、小型和微型底栖动物, 其中小型底栖动物是指分选时能通过0.5 mm孔径筛网但被0.042 mm孔径筛网阻留的底栖动物(Giere, 1993, Mare, 1942)。在普遍认可的34个门类中, 至少有22个门类的生物属于小型底栖动物类群, 其中自由生活海洋线虫(以下简称线虫)和桡足类通常占优势(Heip et al, 1992)。小型底栖动物因其分布广泛、数量大、繁殖快、与沉积物接触紧密、不同类群对微尺度环境变化具有敏感差异性等特点(Du et al, 2018), 被广泛应用于海洋环境监测和生态评价(Zeppilli et al, 2015)。21世纪以来, 小型底栖动物的研究尺度从特定海域扩大到全球(Hodda et al, 1985; Dalto et al, 2000; Nozais et al, 2005; Alves et al, 2013; Vieira et al, 2023)。
Ghosh等(2021)首次在印度孙德尔本斯河口进行系统的季节性采样, 探究了小型底栖动物组合的分类结构和基于特征的功能多样性模式; Portnova等(2021)解释了东西伯利亚海陆架小型底栖动物的低多样性, 指出径流是控制线虫密度的决定因素。这些研究对河口区小型底栖动物的分布、影响因素及时空变化特点进行了定量刻画, 但是较少涉及基于小型底栖动物特征进行环境评价的研究。我国河口小型底栖动物的研究始于20世纪末期, 得益于潮间带的研究热潮, 河口区的研究相继在渤海(郭玉清等, 2002a)、黄海(陈海燕等, 2009), 长江口、珠江口及其邻近海域陆续开展(袁俏君等, 2012), 并初步探讨了环境污染与小型底栖动物之间的关系。
潮汕位于广东省东南部, 地貌发育以平原为主, 地形开阔平坦, 微向海倾斜。韩江、榕江和练江流经市境汇入南海(陈妙纯, 2007), 其海岸带生态系统多样, 河口、红树林、沙滩以及海湾生态系统等充分发育。然而, 自然资源的过度开发、城市化和工农业发展中污染物的排放、港口建设等人类活动, 对海岸带的可持续发展和生态宜居环境建设带来巨大的压力。长期以来, 多数研究集中在大江大河区域, 对于相对不发达的海岸带专注较少, 然而这些区域正是大量作坊的分布源区, 环境状况堪忧。目前有关对潮汕海岸带的环境生态研究非常有限, 现有资料多为80年代调查资料。
本研究选择潮汕海岸带韩江三角洲河口群区域, 对河-海交互区的沉积环境、小型底栖动物的群落组成、空间分布及其控制因子进行了系统研究; 并基于理化要素和生物信息对沉积物环境进行综合评估, 以期为潮汕河口区资源保护、环境监测、以及海岸带综合管理提供基础数据支持, 为可持续的资源开发与利用提供理论依据。
1 材料与方法 1.1 区域概况与站位分布研究区(116°35′~116°55′E、23°10′~23°30′N)位于韩江下游的三角洲平原, 主要河流包括莲阳河、外砂河、榕江、濠江和练江。其中韩江为广东省第二大江, 流域面积达30 112 km2, 是汕头市最大河流, 多年平均径流量为800.3 m3/s, 平均含沙量0.35 kg/m3。莲阳河与外砂河是韩江在汕头市的入海口; 榕江是汕头市第二大河流, 平均径流量92.6 m3/s, 平均含沙量0.31 kg/m3, 出海口为汕头港外航道; 练江是汕头市第三大河, 经海门湾进入南海; 濠江是一条没有发源地的海湾河涌, 东南接广澳湾流入南海。
研究断面沿向海方向垂直于岸线设置(图 1)。其中, 莲阳河3个站位(LY1-3), 莲阳河与外砂河之间1个站位(LY-W), 外砂河3个站位(W1-3), 外砂河与榕江之间3个站位(W-R1-3), 榕江河口6个站位(R1-6), 濠江河口3个站位(H1-3), 练江河口3个站位(LJ1-3)。
 |
| 图 1 研究区域与站位分布 Fig. 1 Distribution of sampling sites and the study area |
2021年6月, 在设计的站位使用箱式采泥器采集沉积物后, 吸去上覆水, 用改装的采样管(内径2.9 cm) 插管采集0~5 cm芯样。每个站点采集3个平行样, 装入塑料瓶后立即固定(终浓度约5%福尔马林), 用于室内分选。同时, 采集0~2 cm表层沉积物, −20 ℃黑暗冷冻保存在密封袋中, 用于叶绿素a (chl a)、脱镁叶绿酸(Phaeo)、沉积物粒度、有机碳(TOC)、总氮(TN)、重金属等环境因子分析。
现场测定的环境要素包括水深、底层水温、盐度、透明度、溶解氧、pH等。其中温度、盐度、水深使用CTD手持式盐度计(衡欣AZ-8371, 台湾)测定, pH和溶解氧使用便携式pH/电导率/溶解氧仪(三信SX836, 上海)测定, 透明度用萨氏盘测定。
1.3 实验室分析 1.3.1 沉积物环境因子测定沉积物粒度测定使用马尔文激光粒度仪(Malvern Mastersizer 3000, United Kingdom)。TOC测定采用非色散红外吸收法, 使用高频红外碳硫仪(科瑞COREY-205, 四川)。As和Hg测定使用双道原子荧光光度计(海光AFS-9800, 北京), Cu、Zn、Pb、Cd含量使用电感耦合等离子体质谱仪(Thermo Scientific iCAP RQ ICP-MS, Germany) 测定。TN使用全自动凯氏定氮仪(海能K1100, 山东) 测定。Chl a和Phaeo测定用湿样法萃取, 紫外可见分光光度仪(SHIMADZU UV-1750, Japan)测定; chl a计算参照Environmental Sciences Section Inorganic Chemistry Unit, Wisconsin State Lab of Hygiene (1991)的方法, Phaeo计算采用王荣(1986)修订公式, 以单位湿重沉积物中chl a和Phaeo的含量(µg/g)标识。
1.3.2 小型底栖动物的分选小型底栖动物的提取采用密度梯度离心法(Du et al, 2009)。主要步骤包括: 虎红染色, 套筛冲洗(0.5 mm和0.0308 mm孔径), 离心(Ludox-TM 50硅胶, 1 800 r/min, 10 min)。重复操作3次, 所得上清液合并后, 再次过筛冲洗(0.030 8 mm) 至培养皿, 在解剖镜下按类群分选计数。生物量按小型底栖动物各类群的丰度, 乘以相对应类群平均个体干重得到(Widbom, 1984; 郭玉清等, 2002b)。
1.3.3 环境-生物生态评价根据《海洋沉积物质量》(GB18668—2002)进行基于沉积物质量标准的重金属评价; 沉积物有机污染评价采用有机污染指数(organic pollution index, OI) (隋桂荣, 1996); 以Raffaelli等(1981)提出的海洋线虫与桡足类丰度比(N/C)指示海洋环境富营养化: N/C比值≤50属于正常, 介于50~100为轻度有机质污染, 介于100~150为中度有机质污染, ≥150为重度有机质污染。
1.3.4 数据处理与统计分析数据分析包括单变量和多变量分析。单变量包括沉积物粒度、chl a、Phaeo、重金属、丰度和生物量等; 多变量数据为环境和生物群落。环境因子主成分分析(PCA)采用经log(x+1) 转化数据进行; 小型底栖动物丰度经平方根转换, 建立Bray-Curtis相似性矩阵, 用聚类(Cluster)和非度量多维标度(NMDS)分析群落相似性, 继而用ANOSIM进行聚类分组之间的差异性检验; 运用Bio-Env分析影响群落分布的环境因子组合; 以上多元分析采用Primer 6.0软件进行。各变量之间的相关性采用(Spearman) 相关分析, 河口断面和盐度梯度间差异性用单因素方差分析(ANOVA); 以上单因子分析使用SPSS 26.0软件。站位图、环境和生物分布图均利用地理空间数据云上下载的landsat8遥感数据, 使用ArcGIS 10.2软件绘制。
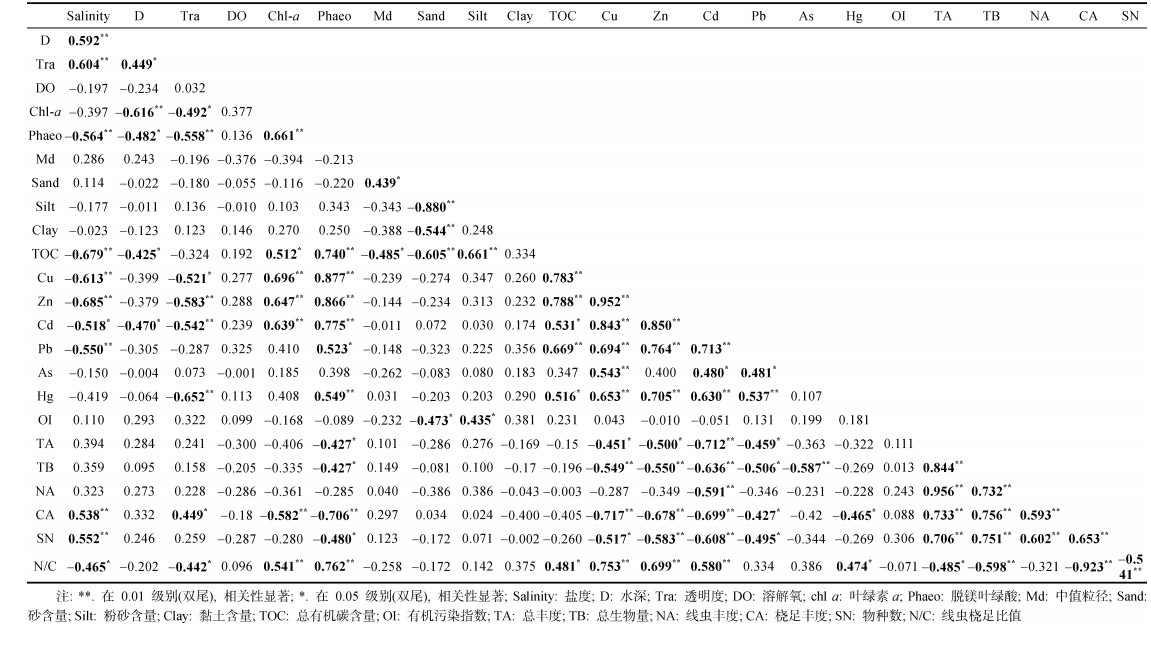
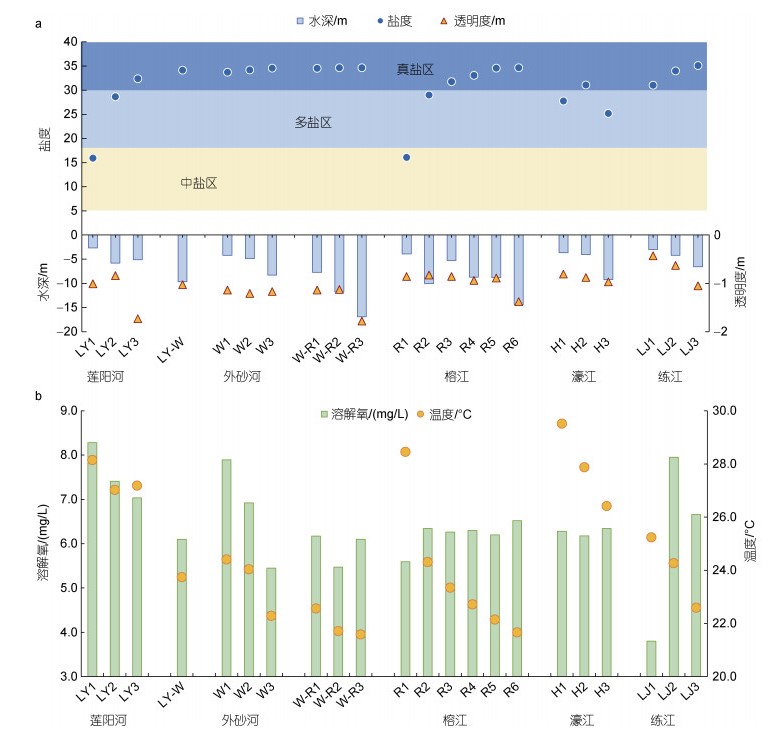
2 结果与分析 2.1 沉积环境 2.1.1 温盐深度等环境研究区的水深为2.69~16.94 m (图 2a), 大部分在10 m以内, 超过10 m的3个站位均在海湾内(W-R2, 11.77 m; W-R3, 16.94 m; R6, 14.41 m)。底层水温为21.59~29.52 ℃ (图 2b), 属潮汕夏初气候, 同时其变化与深度相关。溶解氧含量为3.8~8.28 mg/L (图 2b), 仅LJ1站位溶解氧含量较低(3.8 mg/L), 其余皆大于5.5 mg/L。pH平均为7.6 (7.1~7.9), 呈弱碱性。透明度为0.43~1.78 m (图 2a), 与水深和盐度显著正相关(P < 0.01)(表 3)。
 |
| 图 2 水深、盐度和透明度(a)和溶解氧、温度(b)在各站位的分布 Fig. 2 Distribution of depth, salinity and transparency (a) and dissolved oxygen, temperature (b) in each station |
盐度分布范围为15.91~35.11, 整体上符合河-海水交汇区分布特点(图 2a)。根据河口盐度分区: 中盐区5~18、多盐区18~30和真盐区 > 30 (Pritchard, 1967; Takashi, 1959), LY和R断面站点跨越中盐区、多盐区和真盐区, 盐度梯度明显(5.91~34.63); LY-W、W、W-R以及LJ断面均属于真盐区; H断面中H1和H3处于多盐区, H2处于真盐区。真盐区的温度与中盐区和多盐区的温度均存在显著差异(P < 0.01), 二者均与水深显著相关(P < 0.01)。
2.1.2 沉积物类型参考Shepard (1954)分类方法, 研究区沉积物的类型分为5类: 黏土质粉砂(YT)、粉砂质砂(TS)、砂-粉砂-黏土(STY)、粉砂(T)、砂(S) (表 1)。其中, 黏土质粉砂最多, 共计11个, 且在6个河口(除练江外)均有分布, 砂-粉砂-黏土次之, 集中在R和LJ断面; 砂类出现在W3、H2和LJ3, 粉砂质砂在LY2和R2, 粉砂仅位于H1。
| 站位 | 中值粒径/μm | 砂含量/% | 粉砂含量/% | 黏土含量/% | 沉积物类型 |
| 莲阳河(LY) | |||||
| LY1 | 6.66 | 4.87 | 62.08 | 33.05 | 黏土质粉砂YT |
| LY2 | 115.82 | 60.34 | 28.80 | 10.86 | 粉砂质砂TS |
| LY3 | 7.81 | 19.35 | 46.36 | 34.29 | 黏土质粉砂YT |
| LY-W | 8.49 | 6.54 | 64.56 | 28.90 | 黏土质粉砂YT |
| 外砂河(W) | |||||
| W1 | 7.68 | 9.41 | 63.16 | 27.03 | 黏土质粉砂YT |
| W2 | 7.24 | 15.14 | 53.57 | 31.11 | 黏土质粉砂YT |
| W3 | 277.39 | 96.74 | 2.52 | 0.26 | 砂S |
| W-R1 | 7.09 | 2.98 | 67.17 | 29.85 | 黏土质粉砂YT |
| W-R2 | 747.42 | 13.90 | 60.05 | 26.05 | 黏土质粉砂YT |
| W-R3 | 13.42 | 19.40 | 61.31 | 19.29 | 黏土质粉砂YT |
| 榕江(R) | |||||
| R1 | 8.73 | 9.83 | 73.08 | 17.09 | 黏土质粉砂YT |
| R2 | 104.39 | 58.70 | 27.94 | 13.36 | 粉砂质砂TS |
| R3 | 500.00 | 28.00 | 39.10 | 32.85 | 砂-粉砂-黏土STY |
| R4 | 8.61 | 21.98 | 48.38 | 29.52 | 砂-粉砂-黏土STY |
| R5 | 1 064.37 | 3.97 | 51.08 | 44.95 | 黏土质粉砂YT |
| R6 | 1 049.72 | 27.16 | 51.72 | 21.12 | 砂-粉砂-黏土STY |
| 濠江(H) | |||||
| H1 | 1 301.34 | 9.60 | 77.64 | 11.87 | 粉砂T |
| H2 | 220.68 | 97.84 | 0.00 | 0.00 | 砂S |
| H3 | 7.09 | 3.35 | 74.84 | 21.81 | 黏土质粉砂YT |
| 练江(LJ) | |||||
| LJ1 | 10.03 | 30.46 | 38.58 | 30.96 | 砂-粉砂-黏土STY |
| LJ2 | 8.37 | 22.64 | 50.99 | 26.38 | 砂-粉砂-黏土STY |
| LJ3 | 163.23 | 90.91 | 3.79 | 0.00 | 砂S |
中值粒径波动较大, 为6.66~1 301.34 μm (表 1), 最大值位于唯一的粉砂站位H1, 最小值出现在粉砂质砂的LY1。W、W-R断面的砂含量, 以及R断面(除R1外)的粉砂含量呈现由陆向海增加的趋势。中值粒径与砂含量显著正相关(P < 0.05); 砂含量与粉砂含量、黏土含量、TOC均呈极显著负相关(P < 0.01)(表 3)。
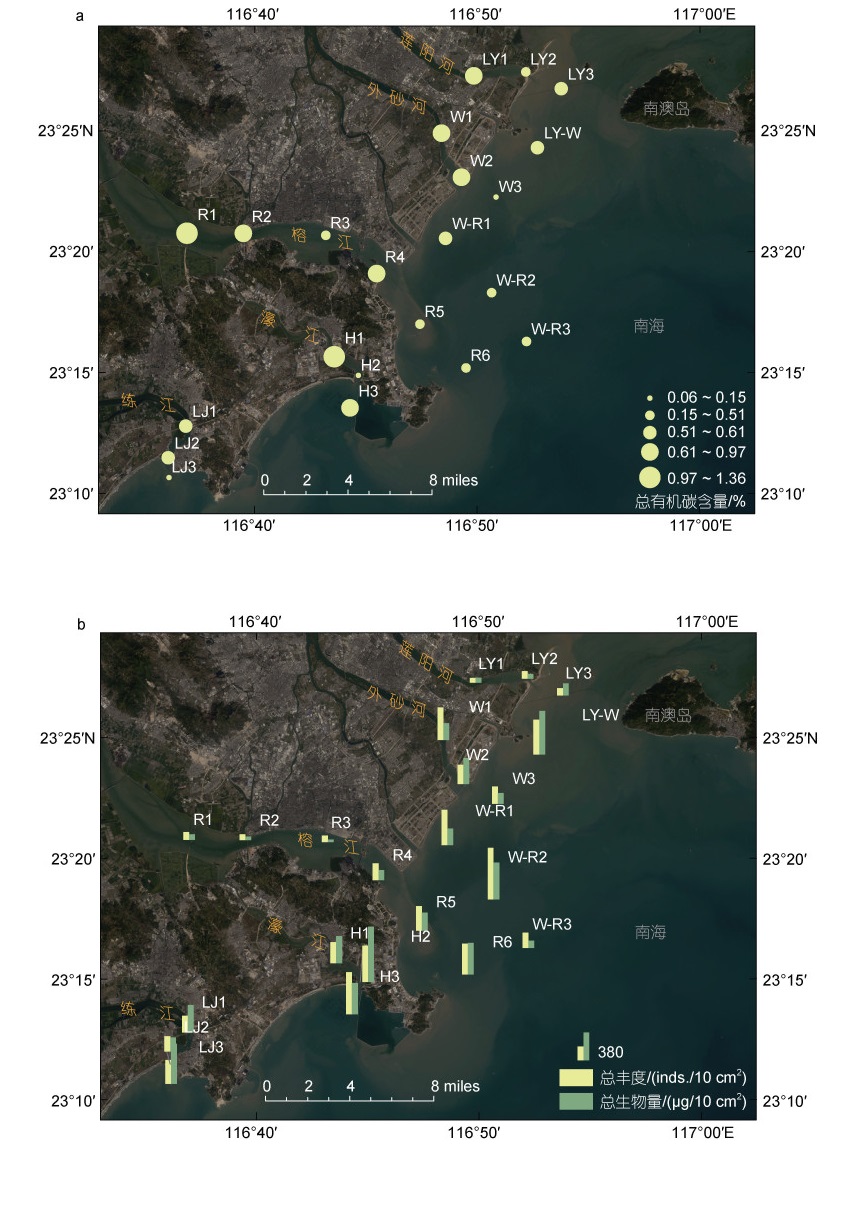
2.1.3 有机碳(TOC) 与重金属分布22个站位的TOC含量为0.06%~1.36% (图 3a), 平均0.61%±0.32%, 整体上由陆向海呈减少趋势, 其中LY、R和H断面在中间站位出现低值。H断面最高(0.81%±0.61%), LJ断面最低(0.42%±0.31%), 河口断面间无显著差异; 中盐区、多盐区与真盐区之间差异显著(P < 0.01)。TOC与盐度呈极显著负相关(P < 0.01)(表 3)。
 |
| 图 3 各站位总有机碳含量(a)和小型底栖动物总丰度、总生物量(b)分布 Fig. 3 Distribution of total organic carbon content (a) and the meiofaunal abundance and biomass (b) in each station |
沉积物重金属包括Cu、Zn、Cd、Pb、Hg和As。除Hg和As外, R断面的Cu、Zn、Cd、Pb平均含量最高, 其中, R2的各重金属含量在所有站位中最高(表 2)。除As外, 所有重金属两两之间均显著正相关(P < 0.01) (表 3)。Cu、Zn、Cd和Pb含量皆在多盐区和真盐区之间差异显著(P < 0.05), 均与盐度显著负相关(P < 0.05)(表 3)。
| 站位 | Cu | Zn | Cd | Pb | Hg | As | TN | TOC | OI |
| LY1 | 33.4 | 138.0 | 0.163 0 | 77.9* | 0.042 0 | 6.49 | 0.01 | 0.97 | 0.012 |
| LY2 | 27.7 | 121.0 | 0.165 0 | 73.6* | 0.059 5 | 10.70 | 0.09 | 0.44 | 0.039 |
| LY3 | 22.4 | 88.3 | 0.127 0 | 73.6* | 0.035 1 | 17.10 | 0.07 | 0.54 | 0.037 |
| LY-W | 20.3 | 83.6 | 0.102 0 | 54.3 | 0.081 4 | 6.52 | 0.07 | 0.6 | 0.041 |
| W1 | 36.8* | 135.0 | 0.159 0 | 84.3* | 0.036 9 | 16.70 | 0.01 | 0.87 | 0.01 |
| W2 | 31.8 | 117.0 | 0.169 0 | 74.1* | 0.038 5 | 17.40 | 0.1 | 0.77 | 0.073 |
| W3 | 11.7 | 67.0 | 0.113 0 | 48.7 | 0.021 0 | 14.60 | 0.02 | 0.08 | 0.002 |
| W-R1 | 32.8 | 93.2 | 0.108 0 | 44.8 | 0.032 0 | 15.20 | 0.07 | 0.59 | 0.038 |
| W-R2 | 18.1 | 83.1 | 0.060 7 | 42.7 | 0.030 6 | 14.40 | 0.06 | 0.45 | 0.028 |
| W-R3 | 16.2 | 79.5 | 0.108 0 | 39.0 | 0.022 5 | 13.50 | 0.06 | 0.4 | 0.021 |
| R1 | 46.0* | 193.0* | 0.339 0 | 78.4* | 0.054 0 | 17.90 | 0.01 | 1.11 | 0.013 |
| R2 | 84.1* | 504.0** | 0.766 0* | 141.0** | 0.081 2 | 18.20 | 0.01 | 0.73 | 0.008 |
| R3 | 39.5* | 163.0* | 0.252 0 | 71.1* | 0.068 1 | 15.30 | 0.01 | 0.51 | 0.005 |
| R4 | 34.6 | 135.0 | 0.146 0 | 65.1* | 0.064 9 | 15.90 | 0.09 | 0.81 | 0.069 |
| R5 | 22.1 | 114.0 | 0.124 0 | 80.8* | 0.065 6 | 7.29 | 0.06 | 0.47 | 0.027 |
| R6 | 20.4 | 93.4 | 0.121 0 | 45.1 | 0.039 7 | 4.34 | 0.07 | 0.43 | 0.028 |
| H1 | 48.4* | 201.0* | 0.311 0 | 77.7* | 0.069 8 | 8.84 | 0.01 | 1.36 | 0.018 |
| H2 | 7.9 | 45.9 | 0.060 0 | 31.0 | 0.004 4 | 5.27 | 0.03 | 0.15 | 0.004 |
| H3 | 29.9 | 122.0 | 0.094 8 | 56.3 | 0.051 1 | 8.02 | 0.01 | 0.93 | 0.013 |
| LJ1 | 31.4 | 124.0 | 0.211 0 | 56.3 | 0.061 1 | 7.19 | 0.01 | 0.61 | 0.007 |
| LJ2 | 37.4* | 127.0 | 0.243 0 | 47.1 | 0.070 0 | 11.40 | 0.01 | 0.58 | 0.008 |
| LJ3 | 7.5 | 58.6 | 0.099 4 | 33.2 | 0.017 2 | 5.21 | 0.02 | 0.06 | 0.001 |
| 注: 根据《海洋沉积物质量》(GB18668—2002), *表示超一类标准, **表示超二类标准。OI值加粗表示该站位污染等级为“轻度污染”, 其余等级为“清洁” | |||||||||
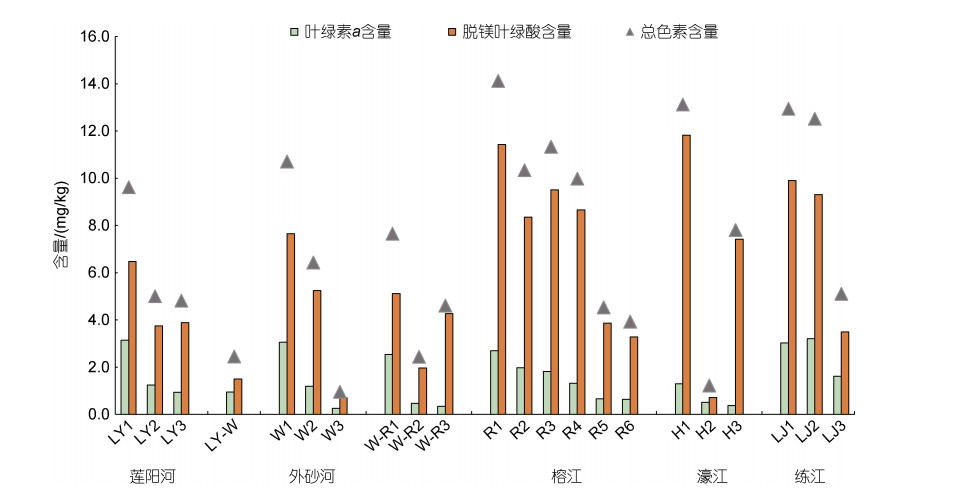
Chl a与Phaeo含量总体从淡水到海水呈降低趋势(图 4)。Chl a含量为0.26~3.21 mg/kg, 平均值为(1.51±1.02) mg/kg, 最高值出现在LJ2; LJ断面含量最高为(2.62± 0.87) mg/kg, H断面平均chl a含量最低为(0.73±0.50) mg/kg, 与TOC分布刚好相反。Chl a与Phaeo、重金属Cu、Zn、Cd和TOC均显著正相关(表 3)。
 |
| 图 4 各站位叶绿素a与脱镁叶绿酸含量分布 Fig. 4 Distribution of chl a and Phaeo contents in each station |
Phaeo含量为0.70~11.82 mg/kg, 平均值为(5.83± 3.41) mg/kg, 其空间分布与chl a基本一致, 但极值点分布存在差异。Phaeo含量最高出现在H和R断面, 最低出现在W3。平均含量最高与chl a一致, 分布在LJ断面(7.57±3.55) mg/kg。Phaeo与TOC及除As之外的重金属均呈极显著正相关, 与盐度呈极显著负相关(表 3)。
2.1.5 PCA分析结果表明PC1轴解释了环境变异度的43.6%, PC1和PC2累计解释了环境变异度的58.3% (图 5)。PC1相关最高的因子分别是Cu (−0.355)、Zn (−0.326)和Phaeo (−0.317); PC2相关最高的是透明度(−0.429)和砂含量(−0.427)。研究区环境差异的主要因子为重金属Cu和Zn、Phaeo、透明度和砂含量。
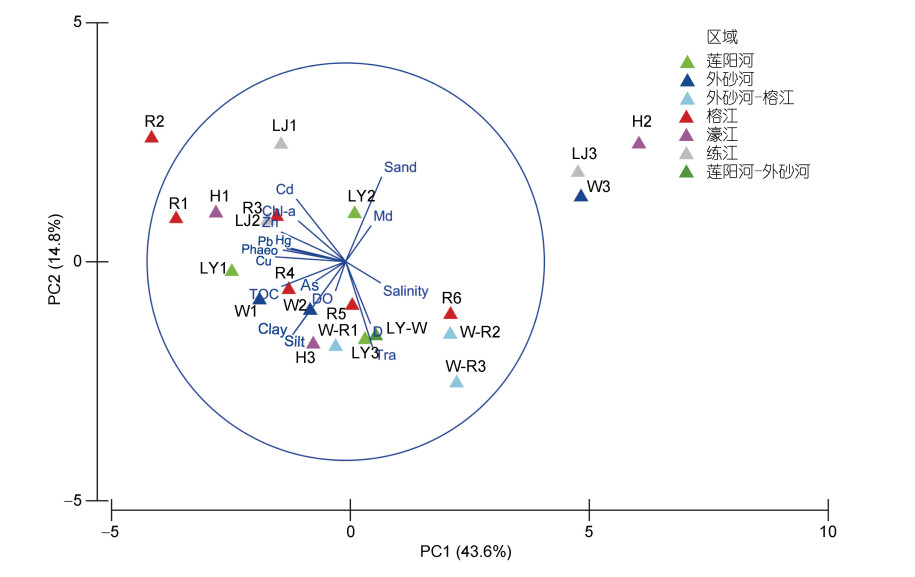 |
| 图 5 环境因子主成分分析(PCA) Fig. 5 Principal Component Analysis (PCA) of environmental factors 注: Salinity: 盐度; D: 水深; DO: 溶解氧; Tra: 透明度; chl a: 叶绿素a含量; Phaeo: 脱镁叶绿酸含量; Md: 中值粒径; Sand: 砂含量; Silt: 粉砂含量; Clay: 黏土含量; TOC: 总有机碳含量 |
研究区22个站位共发现13个小型底栖动物主要类群: 海洋线虫、桡足类、多毛类、双壳类、动吻类、介形类、海螨类、端足类、缓步类、昆虫、蟹幼、轮虫、腔肠动物。其中线虫为最优势类群, 占总丰度的89.52%, 其次是桡足类(6.39%)和多毛类(2.54%), 其他10个类群均小于1%。生物量占比最高的为线虫(38.03%)和多毛类(37.70%), 其次为桡足类(12.61%)和介形类(7.30%)。
在空间分布上, 线虫在所有站位仍为第一丰度优势类群(90.75%±10.60%), 桡足类(5.32%±9.20%)和多毛类(2.42%±2.4%)居次, 其中桡足类在LJ3站位占比较高(图 6a)。海洋线虫的生物量在大部分站位仍占比最高, 但在LY1、LY3, W2和H1、H2, 多毛类占比大于50%, LJ断面的介形类占比最高, 在LJ1介形类可达69.03% (图 6b)。
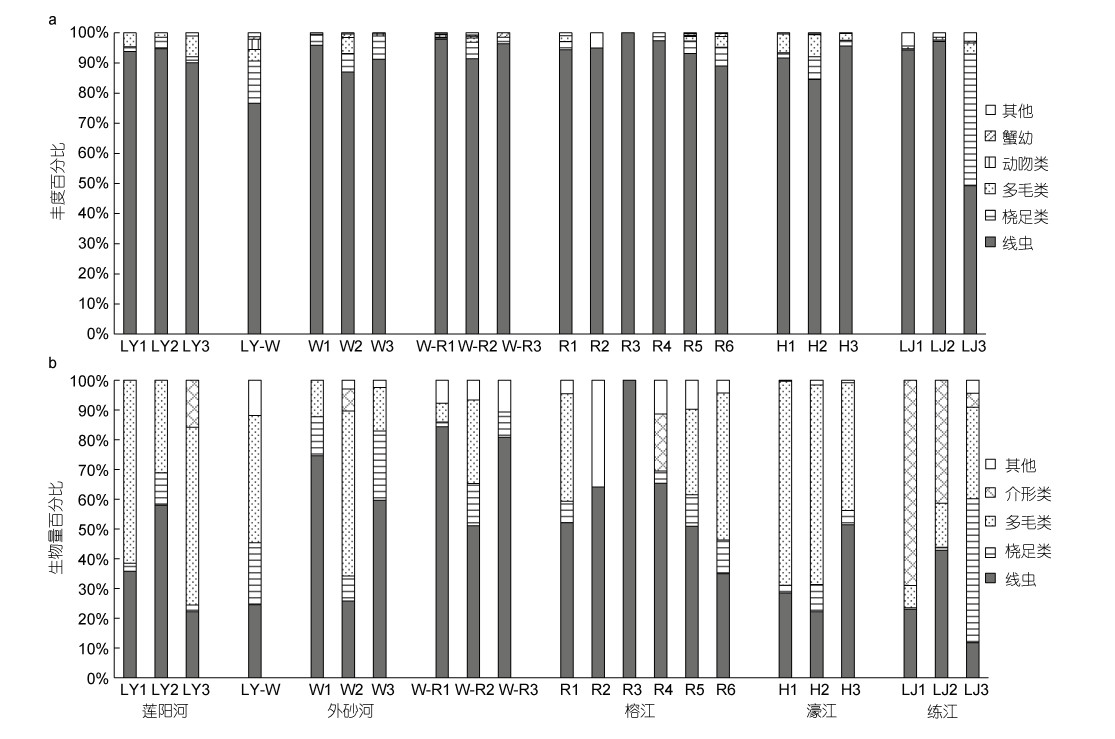 |
| 图 6 小型底栖动物各类群丰度(a)和生物量(b)在各站位的分布 Fig. 6 Distribution of various groups of meiofauna abundance (a) and biomass (b) in each station |
小型底栖动物丰度平均为(295±195) inds./10 cm2, 最高分布在W-R2, 丰度为(704±177) inds./10 cm2, 最低出现在LY1, 丰度为(66±69) inds./10 cm2 (图 3b)。除W断面由陆向海呈减小趋势外, 其余断面呈增高趋势。完全位于海洋区域的LY-W断面和W-R断面平均丰度最高, H断面次之, R断面的入海站位(R4~R6)也较高; LY断面平均丰度最低。小型底栖动物和线虫的丰度在不同河口断面间差异显著(ANOVA, P < 0.05), 主要表现在LY断面与W-R、H断面间, R断面与W-R、H断面之间, 线虫丰度差异还包括W-R与LJ断面间。
小型底栖动物平均生物量为(277.8±202.8) μg/10cm2, 其中线虫贡献(38.03%)与多毛类相当(37.70%), 高于桡足类(12.61%); 丰度仅占0.26%的介形类, 因平均个体干重最大具有相对较高的贡献(7.3%)。空间分布上, 最高值和最低值分别位于H2站位(758.9 μg/ 10 cm2)和R3站位(34.7 μg/10 cm2); 最高断面的是LY-W和H断面, 最低值在LY断面。
2.2.3 群落结构分析Cluster聚类和NMDS分析表明, 在75%的相似水平上, 小型底栖动物群落分为四组。可按照河口盐度梯度大致区分, 高盐度与低盐度集群区分明显(图 7); ANOSIM分析表明, 三组群落间差异显著(P < 0.05); 在80%的相似水平上, 可按照不同河口断面区分为7个集群, 表明同一河口的群落相似性更高。本研究NMDS应力指数Stress为0.08, 小于0.1 (Kruskal, 1964), 可信度较高。盐度和河口断面是影响小型底栖动物群落的重要因素。
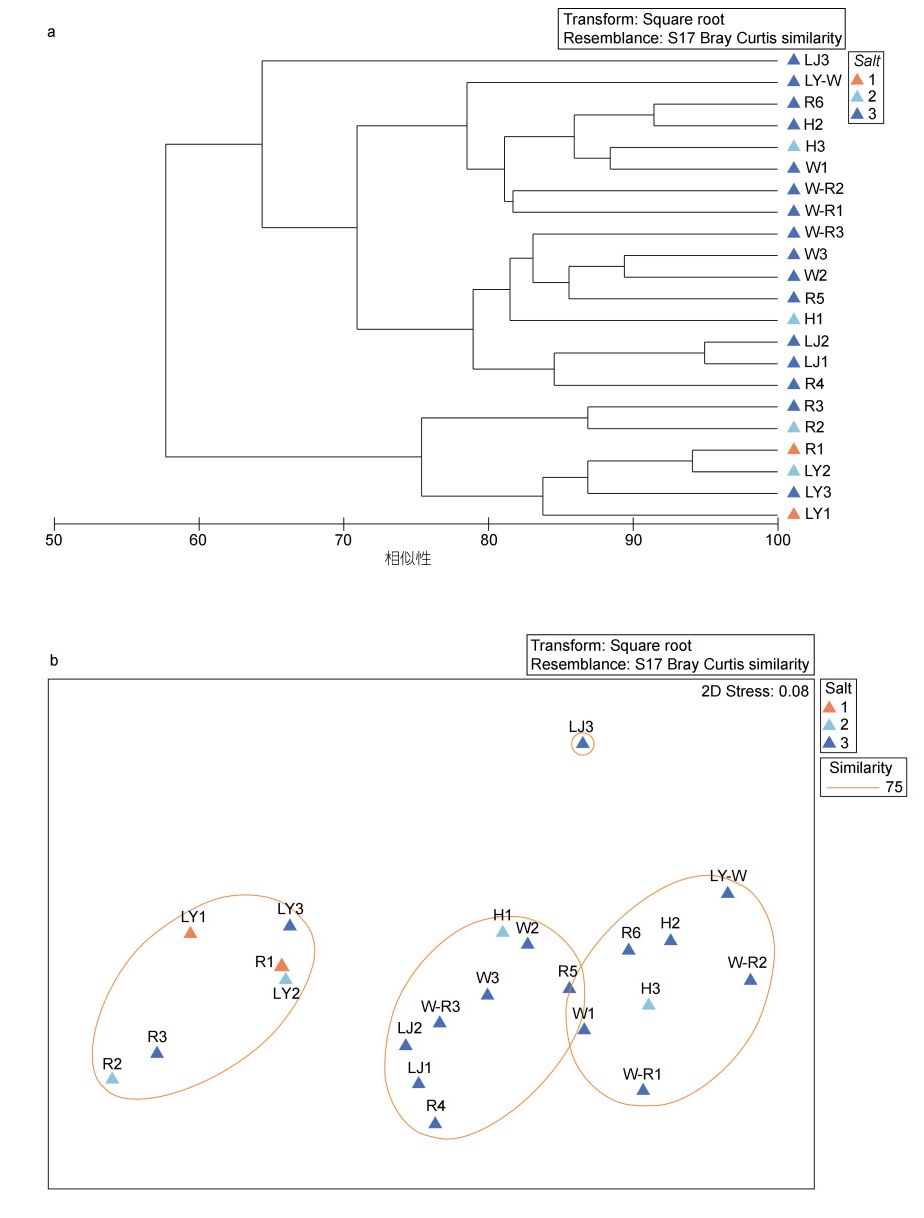 |
| 图 7 小型底栖动物群落的Cluster (a)和nMDS分析(b) Fig. 7 Cluster (a) and nMDS analysis (b) of meiofauna 注: 按盐度梯度分为5~18、18~30、> 30, 对应1~3组 |
小型底栖动物的总丰度、总生物量、物种数、优势类群的丰度与环境因子的相关分析(Spearman)结果, 见表 3。小型底栖动物总丰度、总生物量、物种数、线虫丰度和桡足类丰度彼此间极显著正相关(P < 0.01); 小型底栖动物总丰度、总生物量和物种数与Phaeo和重金属含量(Cu、Zn、Cd、Pb)显著负相关(P < 0.05); 线虫丰度与重金属Cd含量相关; 桡足类丰度与盐度呈极显著正相关(P < 0.01), 与chl a、Phaeo和除Hg之外的重金属含量显著负相关(P < 0.05); 物种数也与盐度极显著正相关(P < 0.01)。
基于NMDS分析对75%水平上形成的三个小型底栖动物群落聚类进行Bio-Env分析, 表明解释群落结构的最佳环境因子组合为盐度和重金属Cd含量(相关系数为0.378)。
2.4 基于生物-环境污染评价 2.4.1 重金属和有机污染指数评价重金属评价中, 超一类标准的站位集中于R断面, 超标因子为Cu、Zn、Cd和Pb, 另外Cu在W1、H1和LJ2超一类标准, Pb在LY断面、W1、W2和H1超一类标准。超二类标准的站位只有R2, 超标因子为Zn和Pb。各站位有机污染评价结果见表 2, 除W2和R4为较清洁, 其余站位均为清洁水平。有机污染指数与砂含量呈显著负相关(P < 0.05), 与粉砂含量呈显著正相关(P < 0.05) (表 3)。
2.4.2 线虫与桡足类比值(N/C)研究区N/C比值见图 8。属于轻污染的站位为LY1、R4、H1; 属于重度污染的站位为W-R1、LJ1和LJ2; 大部分站位属于正常范围。这与2018~2019年练江的水质调查结果(劣Ⅴ类水)基本符合(郭俊康等, 2021); R2、R3未发现桡足类, 不作分析。N/C比值与盐度和透明度显著负相关(P < 0.05), 与TOC显著正相关(P < 0.05), 与chl a、Phaeo和重金属含量(Cu、Zn、Cd、Hg)极显著正相关(P < 0.01)(表 3)。
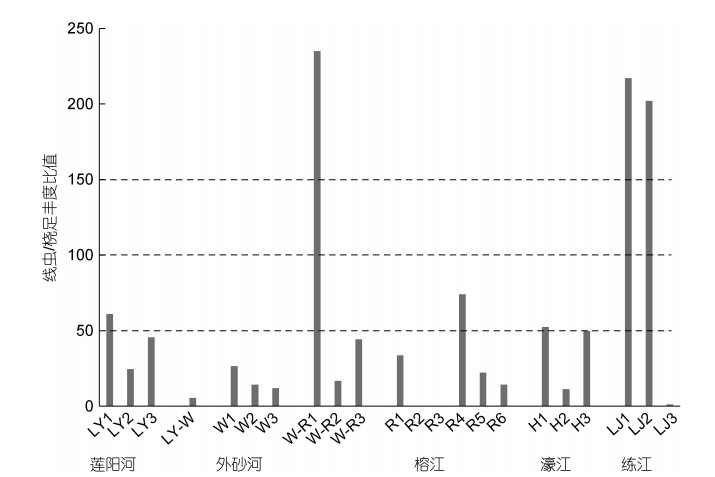 |
| 图 8 研究区线虫和桡足类丰度比(N/C) Fig. 8 Ratios of abundance of nematodes to copepods (N/C) in the study area |
在河-海交互区的研究中, 对大江大河关注得比较多, 一方面其流域面积较大, 另一方面, 这些大江大河也孕育了世界级的都市。然而, 随着经济全球化和信息化, 那些不发达区域的河-海交互区同样承载了巨大的发展负荷, 同样具有研究的重要性。潮汕海岸带位于台湾海峡和珠江口之间。经调查汕头海域夏季在外海高盐水涌升的影响下, 盐度一般为31~34。在调查的22个站位中, 仅靠近内陆的2个站位位于中盐区(盐度为5~18), 4个站位在多盐区(盐度为18~30), 大部分站位属于真盐区(盐度 > 30)。因此研究区域主要受海洋环境的影响, 内陆淡水径流影响较大的区域相对较少, 如莲阳河与榕江盐度相对较低的站位。
通常河口区富含有机质。一方面河岸植物碎屑的渗入和降雨对沿岸土壤的冲刷会给河流带来一定的有机质(Song et al, 2023); 同时受潮汐的影响往往形成涡流。河口是有机质生产、呼吸和转化的重要场所, 但有机物被排放入海前具有一定的滞留(Canuel et al, 2012)。因此随着入海TOC含量降低。这种分布趋势也在本研究中体现出来。但是与其他河口相比(尹盛乐等, 2012; 彭松耀等, 2020; 李红军等, 2022), 研究区有机碳含量略低。这与研究区沉积环境相对均匀、以黏土质粉砂为主, 以及研究站位主要受海洋环境影响有关。TOC含量与砂含量负相关, 即粗砂对于有机碳的吸附能力低于细颗粒沉积物(谭文娟等, 2017)。例如, 濠江断面的H2站位, 砂含量高达98%, 其TOC含量是所有站位最低值。
与TOC的空间分布相似, 重金属Cu、Zn、Cd和Pb含量的相对高值位于榕江入海口前段; 尽管As的分布较均一, 榕江、濠江和练江河口前段含量仍略高于其他区域。一方面有机碳与重金属均可通过表面吸附、阳离子交换和螯合反应, 形成金属有机络合物沉淀而从水体中析出(蔡真珍等, 2022)。另一方面潮汕海岸带重金属企业以铅蓄电池制造、电镀、皮革鞣制加工以及重有色金属冶炼为主, 也涉及造纸和印染纺织, 其排放的废物中重金属含量较高; 义家吉等(2023)认为研究区的重金属可能同源-来自于工业复合污染。TOC和重金属在空间分布相似性和统计上的显著相关性, 说明研究区的有机碳主要来自陆源; 同时说明研究区河口动力环境在阻滞陆源污染入海方面发挥重要作用。
3.2 小型底栖动物群落特点及控制因素小型底栖动物平均丰度为(295±195) inds./10 cm2, 远低于长江口[(1 203±191) inds./10 cm2](史本泽等, 2015)和黄河口[(789±293) inds./10 cm2](张志南等, 1989), 与辽河口夏季丰度[(264±83) inds./10 cm2](叶晟等, 2017)、福建九龙江口春季丰度[(323±404) inds./10 cm2](傅素晶等, 2023)和珠江口夏季[(183±172) inds./10 cm2](袁俏君等, 2012)基本一致。表明小型底栖动物丰度在大型河口区的分布普遍高于小型河口。
我国有关河口区小型底栖动物的研究比较有限, 黄河口(张志南等, 1989)、长江口(王小谷等, 2010)的相关研究主要集中在水下三角洲区域, 而本研究将尺度延伸到了低盐区, 海洋起源的物种通常对低盐的耐受性较差。尽管与史本泽等(2015)在长江口及东海海域的研究相似, 均未发现丰度与盐度之间存在明确关系, 但本研究区小型底栖动物群落能按盐度梯度大致区分, 低盐区或高盐区的群落相似性较高; 盐度是解释群落空间分布的最佳环境因子组合之一; 同时丰度最低的莲阳河LY1站位, 其盐度也是所有站位中最低的。表明盐度是河口区小型底栖动物分布的重要控制因子。
此外, 较低的小型底栖动物丰度站位, 具有相对较高的Phaeo、TOC和重金属含量。如练江河口的丰度较低, 而平均Phaeo含量最高。这可能与练江常年水质较差有关, 区域内土地开垦、化肥生产和化石燃料等引发的水体富营养化, 导致藻类迅速大量繁殖(Cloern, 2001)。其降解而成的较多的Phaeo, 也造成水体透明度下降, 这与练江断面的透明度最低一致。榕江较低丰度, 可能与TOC和重金属含量较高有关。Liu等(2008)指出高有机碳含量会适当增加线虫的分布, 但有机碳含量过高也会造成线虫的数量锐减。榕江断面TOC最高的R1站位丰度较低。另一方面, 榕江重金属含量极高, 降低了该断面小型底栖动物的丰度和生物量, R1、R2、R3站位的影响尤为突出。Rao等(2023)研究认为河口区受到沿岸人为排放的工农业废水、居民生活用水影响, 沉积物中极易富集重金属, 从而干扰底栖生物群落。本研究中桡足类显示出对Cu、Zn、Cd、Pb和Hg的敏感性, 而线虫仅与Cd存在显著负相关, 表明桡足类对环境变化更敏感。重金属处理对线虫的胁迫效应研究发现, Cd对线虫群落结构的改变具有负效应(Bakonyi et al, 2003)。Pb的长期污染可以改变土壤线虫的多样性, 并且其多样性会随着Pb浓度的增加而减少(Zullini et al, 1986)。
综上所述, 潮汕河口区的小型底栖动物群落分布与结构特点是以盐度为主导的多种环境因子共同作用的结果。
3.3 基于环境-生物的污染状态评价重金属评价可直接筛选出重金属超标因子, 是评价环境质量的基础, 适用于受重金属污染严重区域, 可结合相关性分析追溯重金属污染的可能来源; 有机污染指数评价结合了有机碳和有机氮含量, 综合反映沉积物中有机物的污染程度, 但缺乏对总磷的评价。以上两种方法都是用含量直接描述污染程度。N/C比值基于海洋线虫和桡足类对环境的响应差异反映区域污染状况: 海洋线虫种类丰富, 摄食类型多样, 抗干扰能力强; 底栖桡足类一般摄取藻类, 相比较对环境胁迫更为敏感。因此比值越低, 有机污染相对越轻。尽管N/C比值作为环境监测存在诸多争议, 如受沉积物粒度、季节变动等因素影响显著(郭玉清等, 2002c), 仍然在国际生态研究中被广泛应用。
理化要素指标是环境状态的直观反应, 生物是环境压力的受体和响应者, 是评估水域是否满足生物生存的核心指标(娄保锋, 2023)。本文基于理化指标的重金属、有机碳评价以及生物指标的N/C比值, 对区域环境状况进行了综合评估。基于重金属污染的评价中, 位于榕江上部的R2是唯一超二类标准的站位, 超标因子Zn、Pb是造成环境差异或影响小型底栖动物群落分布的重要因子。有机污染指数评价显示, 位于河流入海口处的W2和R4相较其他站位受到一定程度的有机污染。根据N/C比值结果, 位于外砂河与榕江之间的近岸站位W-R1、以及练江口门处LJ1、LJ2的有机污染严重; 调查发现外砂河与榕江河段区域主要是沿岸村居的生活污水和饲养的禽畜粪便, 练江的有机污染主要是来源于沿岸未经处理的工业废水。以上三种评价方法, 都指示出污染较严重的站位一般处于河口入海口门处, 或受河流污染物影响严重, 尽管不同方法中污染程度最高的站位并不一致。这进一步说明环境的复杂性和运用综合指标评价的必要性。
3.4 展望本研究大部分站位分布在盐度大于30的真盐区内, 未来可往低盐度和高盐度区域延伸, 增加盐度梯度; 在生物组成方面只涉及类群组成、丰度和生物量等基础数据, 后续可对优势类群海洋线虫重点分析, 在种属级别上深入探讨生物多样性与河口环境的关系; 此外考虑到丰水/枯水期的影响, 建议叠加时间尺度, 深入探讨河口区底栖动物群落及其影响因素。
4 结论潮汕河口区沉积物类型以黏土质粉砂为主, 沉积环境具有海洋特征。重金属Cu、Zn、Phaeo、透明度和砂含量是沉积环境产生差异的主要原因, 可能与该区域有大量的工业作坊有关。
小型底栖动物群落分布与结构特点与以盐度为主导的多种环境因子有关。小型底栖动物丰度、生物量和物种数与Phaeo及重金属Cu、Zn、Cd、Pb含量存在显著负相关。盐度和重金属Cd是解释小型底栖动物群落结构的最佳环境因子组合。
综合环境-生物评价, 污染较严重的区域一般处于河口入海口门处。线虫与桡足类比值能在一定程度上反映河口区有机质污染状况, 综合其他沉积环境因子, 可提高对环境质量的综合评价水平。
义家吉, 颜历, 王洋, 等, 2023. 粤东近岸海域表层沉积物重金属污染评价及来源解析[J]. 海洋环境科学, 42(2): 200-208, 216. |
王小谷, 王春生, 张东声, 等, 2010. 长江口及其陆架春季小型底栖生物丰度和生物量[J]. 生态学报, 30(17): 4717-4727. |
王荣, 1986. 荧光法测定浮游植物色素计算公式的修正[J]. 海洋科学, 10(3): 1-5. |
毛婕昕, 闫启仑, 王立俊, 2011. 典型河口底栖动物种类数、生物量及种群密度变化趋势的研究[J]. 海洋环境科学, 30(1): 37-40. DOI:10.3969/j.issn.1007-6336.2011.01.008 |
尹盛乐, 刘晓收, 袁超, 等, 2012. 胶州湾大沽河口潮间带沉积物中叶绿素和有机质含量的季节变化[J]. 海洋湖沼通报, (2): 97-106. DOI:10.3969/j.issn.1003-6482.2012.02.011 |
叶晟, 孔飞, 李宏俊, 等, 2017. 辽河口邻近海域小型底栖生物的空间分布及季节变化[J]. 海洋学报, 39(10): 78-89. DOI:10.3969/j.issn.0253-4193.2017.10.007 |
史本泽, 于婷婷, 徐奎栋, 2015. 长江口及东海夏季小型底栖动物丰度和生物量变化[J]. 生态学报, 35(9): 3093-3103. |
李红军, 程岩, 杜益晓, 等, 2022. 鸭绿江口生源要素的垂直分布及对环境变化的响应[J]. 环境化学, 41(12): 4068-4076. DOI:10.7524/j.issn.0254-6108.2021052602 |
沈国英, 黄凌风, 郭丰, 等, 2010. 海洋生态学[M]. 3版. 北京: 科学出版社, 212-216.
|
张志南, 李永贵, 图立红, 等, 1989. 黄河口水下三角洲及其邻近水域小型底栖动物的初步研究[J]. 海洋与湖沼, 20(3): 197-208. DOI:10.3321/j.issn:0029-814X.1989.03.001 |
陈妙纯, 2007. 汕头市水文水环境特性分析[J]. 水利科技与经济, 13(8): 556-558. DOI:10.3969/j.issn.1006-7175.2007.08.011 |
陈海燕, 周红, 慕芳红, 等, 2009. 北黄海小型底栖生物丰度和生物量时空分布特征[J]. 中国海洋大学学报, 39(4): 657-663. |
娄保锋, 2023. 水生态评价方法探索——以汉江中下游为例[J]. 人民长江, 54(1): 24-36. |
袁俏君, 苗素英, 李恒翔, 等, 2012. 珠江口水域夏季小型底栖生物群落结构[J]. 生态学报, 32(19): 5962-5971. |
郭玉清, 张志南, 慕芳红, 2002a. 渤海小型底栖动物丰度的分布格局[J]. 生态学报, 22(9): 1463-1469. |
郭玉清, 张志南, 慕芳红, 2002b. 渤海小型底栖动物生物量的初步研究[J]. 海洋学报, 24(6): 76-83. |
郭玉清, 张志南, 慕芳红, 2002c. 渤海海洋线虫与底栖桡足类数量之比的应用研究[J]. 海洋科学, 26(12): 27-31. |
郭俊康, 周华, 夏海波, 等, 2021. 练江流域水污染治理历程及成效[J]. 给水排水, 47(10): 57-61. |
隋桂荣, 1996. 太湖表层沉积物中OM、TN、TP的现状与评价[J]. 湖泊科学, 8(4): 319-324. |
彭松耀, 赖子尼, 麦永湛, 2020. 珠江口大型底栖动物群落及沉积物生态毒理效应指示种筛选[J]. 海洋渔业, 42(5): 571-584. DOI:10.3969/j.issn.1004-2490.2020.05.007 |
傅素晶, 饶义勇, 林和山, 等, 2023. 九龙江口潮下带春季小型底栖动物分布及优势类群海洋线虫的群落结构分析[J]. 厦门大学学报(自然科学版), 62(1): 127-136. DOI:10.6043/j.issn.0438-0479.202206019 |
蔡真珍, 郑盛华, 杨妙峰, 等, 2022. 福建东山湾八尺门海域水体及沉积物中的重金属污染评价[J]. 应用海洋学学报, 2022, 41(2): 259-267. DOI:10.3969/J.ISSN.2095-4972.2022.02.010 |
谭文娟, 曾佳丽, 李晨岚, 等, 2017. 深圳湾福田红树林区小型底栖动物群落特征分析[J]. 厦门大学学报(自然科学版), 56(6): 859-865. |
ALVES A S, ADãO H, FERRERO T J, et al, 2013. Benthic meiofauna as indicator of ecological changes in estuarine ecosystems: The use of nematodes in ecological quality assessment[J]. Ecological Indicators, 24: 462-475. DOI:10.1016/j.ecolind.2012.07.013 |
BAKONYI G, NAGY P, KÁDÁR I, 2003. Long-term effects of heavy metals and microelements on nematode assemblage[J]. Toxicology Letters, 140-141: 391-401. DOI:10.1016/S0378-4274(03)00035-3 |
CANUEL E A, CAMMER S S, MCINTOSH H A, et al, 2012. Climate change impacts on the organic carbon cycle at the land-ocean interface[J]. Annual Review of Earth and Planetary Sciences, 40: 685-711. DOI:10.1146/annurev-earth-042711-105511 |
CLOERN J, 2001. Our evolving conceptual model of the coastal eutrophication problem[J]. Marine Ecology Progress Series, 210: 223-253. DOI:10.3354/meps210223 |
DALTO A G, ALBUQUERQUE E F, 2000. Meiofauna distribution in a tropical estuary of the South-Western Atlantic (Brazil)[J]. Vie et Milieu, 50(3): 151-162. |
DU Y F, GAO S, LIU X S, et al, 2018. Meiofauna and nematode community characteristics indicate ecological changes induced by geomorphic evolution: A case study on tidal creek systems[J]. Ecological Indicators, 87: 97-106. DOI:10.1016/j.ecolind.2017.12.037 |
DU Y F, XU K D, LEI Y L, et al, 2009. Simultaneous enumeration of diatom, protozoa and meiobenthos from marine sediments using Ludox-QPS method[J]. Chinese Journal of Oceanology and Limnology, 27(4): 775-783. DOI:10.1007/s00343-009-9224-x |
Environmental Sciences Section Inorganic Chemistry Unit, Wisconsin State Lab of Hygiene, 1991. Chlorophyll-spectrophotometric: ESS Method 150.1 [S]. Madison: Environmental Sciences Section Inorganic Chemistry Unit, Wisconsin State Lab of Hygiene, 3359-3363.
|
GHOSH M, MANDAL S, 2021. Disentangling the effect of seasonal dynamics on meiobenthic community structure from River Matla of Sundarbans estuarine system, India[J]. Frontiers in Marine Science, 8: 671372. DOI:10.3389/fmars.2021.671372 |
GIERE O, 1993. Meiobenthology[M]. Berlin, Germany: Springer-Verlag, 328.
|
HEIP C, HUYS R, ALKEMADE R, 1992. Community structure and functional roles of meiofauna in the North Sea[J]. Netherlands Journal of Aquatic Ecology, 26(1): 31-41. DOI:10.1007/BF02298026 |
HODDA M, NICHOLAS W, 1985. Meiofauna associated with mangroves in the Hunter River estuary and Fullerton Cove, south-eastern Australia[J]. Marine and Freshwater Research, 36(1): 41-50. DOI:10.1071/MF9850041 |
KRUSKAL J B, 1964. Multidimensional Scaling by optimizing goodness of fit to a nonmetric hypothesis[J]. Psychometrika, 29(1): 1-27. DOI:10.1007/BF02289565 |
LIU X S, XU W Z, CHEUNG S G, et al, 2008. Subtropical meiobenthic nematode communities in Victoria Harbour, Hong Kong[J]. Marine Pollution Bulletin, 56(8): 1491-1497. DOI:10.1016/j.marpolbul.2008.04.021 |
MARE M F, 1942. A study of a marine benthic community with special reference to the micro-organisms[J]. Journal of the Marine Biological Association of the United Kingdom, 25(3): 517-554. DOI:10.1017/S0025315400055132 |
NGO X Q, SMOL N, VANREUSEL A, 2013. The meiofauna distribution in correlation with environmental characteristics in 5 Mekong estuaries, Vietnam[J]. Cahiers De Biologie Marine, 54(1): 71-83. |
NOZAIS C, PERISSINOTTO R, TITA G, 2005. Seasonal dynamics of meiofauna in a South African temporarily open/closed estuary (Mdloti Estuary, Indian Ocean)[J]. Estuarine, Coastal and Shelf Science, 62(1/2): 325-338. |
PORTNOVA D A, GARLITSKA L A, POLUKHIN A A, 2021. The effect of estuarine system on the meiofauna and nematodes in the East Siberian Sea[J]. Scientific Reports, 11(1): 19306. |
PRITCHARD D W, 1967. What is an estuary: physical viewpoint[J]. American Association for the Advancement of Science, 83: 3-5. |
RAFFAELLI D G, MASON C F, 1981. Pollution monitoring with meiofauna, using the ratio of nematodes to copepods[J]. Marine Pollution Bulletin, 12(5): 158-163. |
RAO M N, GAIKWAD S, RAM A, et al, 2023. Effects of sedimentary heavy metals on meiobenthic community in tropical estuaries along eastern Arabian Sea[J]. Environmental Geochemistry and Health, 45(3): 731-750. |
SHEPARD F P, 1954. Nomenclature based on sand-silt-clay ratios[J]. Journal of Sedimentary Research, 24(3): 151-158. |
SONG X, DONG J W, WANG H B, et al, 2023. Factors influencing the distribution of organic carbon in four different coastal sedimentary environments[J]. Journal of Soils and Sediments, 23(3): 1539-1551. |
TAKASHI ITO, 1958. The Venice system for the classification of marine waters according to salinity: Symposium on the classification of brackish waters, Venice, 8-14 April, 1958[J]. Japanese Journal of Limnology, 20(3): 119-120. |
VIEIRA S, SROCZYŃSKA K, NEVES J, et al, 2023. Distribution patterns of benthic bacteria and nematode communities in estuarine Sediments[J]. Estuarine, Coastal and Shelf Science, 291: 108448. |
WIDBOM B, 1984. Determination of average individual dry weights and ash-free dry weights in different sieve fractions of marine meiofauna[J]. Marine Biology, 84(1): 101-108. |
ZEPPILLI D, SARRAZIN J, LEDUC D, et al, 2015. Is the meiofauna a good indicator for climate change and anthropogenic impacts?[J]. Marine Biodiversity, 45(3): 505-535. |
ZULLINI A, PERETTI E, 1986. Lead pollution and moss-inhabiting nematodes of an industrial area[J]. Water, Air, and Soil Pollution, 27(3/4): 403-410. |
 2024, Vol. 55
2024, Vol. 55