
中国海洋湖沼学会主办。
文章信息
- 叶文婷, 蒋宏雷, 江柳, 刘哲宇, 李有志, 王志铮. 2024.
- YE Wen-Ting, JIANG Hong-Lei, JIANG Liu, LIU Zhe-Yu, LI You-Zhi, WANG Zhi-Zheng. 2024.
- 大黄鱼(Larimichthys crocea)幼鱼同生群内不同增重性能子群间的脏器生理差异
- PHYSIOLOGICAL DIFFERENCES IN THE ORGANS OF DIFFERENT GROWTH PERFORMANCE SUBGROUPS WITHIN THE SAME COHORT OF LARGE YELLOW CROAKER (LARIMICHTHYS CROCEA) JUVENILES
- 海洋与湖沼, 55(1): 223-231
- Oceanologia et Limnologia Sinica, 55(1): 223-231.
- http://dx.doi.org/10.11693/hyhz20230600134
文章历史
-
收稿日期:2023-06-28
收修改稿日期:2023-10-15
2. 宁波市海洋与渔业研究院 浙江宁波 315103
2. Ningbo Marine and Fisheries Research Institute, Ningbo 315103, China
大黄鱼(Larimichthys crocea)隶属于硬骨鱼纲、鲈形目、石首鱼科、黄鱼属, 素有“海水国鱼”之美誉, 是当前我国最为重要的海水网箱养殖对象和近海增殖放流的当家鱼种(江柳等, 2021)。种内个体差异作为自然界普遍存在的现象, 既是直观甄选特异性群体的重要依据, 也是深入探掘种质特异性的宏观生物学基础。全面剖析目标同生群内个体差异的渐变特征, 客观揭示引起群内种质特异性分化的内在逻辑, 对于构建基于种内竞争和环境适应的群体分化理论, 并指导目标物种的精细化选择育种和建立科学高效的养殖模式具有重要研究价值。动物的机体代谢水平与其生长速度密切相关。生长速度作为度量个体差异的重要生物学参数, 既是综合反映目标生物生理状况的显性指标, 也是评判苗种质量优劣程度的重要选项, 更是最为直观的选择育种性状。由此, 针对大黄鱼仔鱼个体大小差异有随养殖时间推移而逐渐放大(竺俊全等, 2004), 以及不同生长性能大黄鱼养殖群体间在形质特征、肠道菌群种类组成、致病菌含量和肌肉生长调控基因表达上均存在显著差异(李英英等, 2017; 李有志等, 2023; 张波等, 2023)的研究结果, 本研究团队以用于人工增殖放流的大黄鱼幼鱼同生群为研究对象, 以鳃和内脏(鉴于多数实验组别的脏器质量过小, 均不足以满足酶活力测定需求, 为便于比较, 以全脏为测定材料)为靶标, 试图从机体代谢角度探析大黄鱼幼鱼同生群内不同增重性能子群间的脏器生理状况差异, 以厘清基于生长性能渐变的生理异化特征, 揭示子群间生长性能分化机制, 并佐证李有志等(2023)所述子群间生存对策差异的可靠性, 旨为大黄鱼生长性能评价体系的构建和指导速生品种选择育种提供科学依据。
1 材料与方法 1.1 材料 1.1.1 实验用鱼宁波象山港湾水产苗种有限公司育苗车间出池后, 在象山西沪港海域的板式网箱(规格: 5 m×3 m×6 m) 内常规养殖3个月的大黄鱼同生群幼鱼。随机捞取其中形体完整、无病无伤的健壮个体3 000尾, 立即充气并停食暂养于若干直径1 m、高1.5 m的白色塑料桶(实际水位1.3 m)内。2 d后, 用Sartorius BS223S型电子天平(赛多利斯科学仪器有限公司, 精度0.01 g)逐尾称量体质量并按其出现率分为5个子群, 具体见表 1。
| 实验子群 | 体质量/g | 出现率/% | 变异系数/% | 样本数/尾 | ||
| 范围 | 均值 | 标准差 | ||||
| A | 3.01~4.81 | 3.45 | 0.43 | 5 | 12.4 | 150 |
| B | 2.34~3.00 | 2.60 | 0.18 | 20 | 6.8 | 600 |
| C | 1.61~2.33 | 2.00 | 0.21 | 50 | 10.6 | 1 500 |
| D | 0.82~1.60 | 1.22 | 0.23 | 20 | 19.1 | 600 |
| E | 0.66~0.81 | 0.74 | 0.04 | 5 | 4.9 | 150 |
48 h暗沉淀、二级沙滤处理后的自然海水, 水温(27.0±0.2) ℃、DO (6.81±0.01) mg/L、pH 8.24±0.01、盐度20.62±0.12。
1.2 实验方法 1.2.1 脏器比例性状的测定各子群均任取实验鱼30尾作为测定对象, 用Sartorius BSA223S型电子天平(赛多利斯科学仪器有限公司, 精度1 mg)逐尾依次称量体质量、鳃质量、内脏质量和净体质量(去除鳃组织和内脏后的体质量), 并据此计算鳃系数(鳃质量/体质量)、内脏系数(内脏质量/体质量)、内脏净重比(内脏质量/净体质量)、鳃净重比(鳃质量/净体质量)和鳃脏比(鳃质量/内脏质量)。
1.2.2 耗氧率的测定以直径32 cm的白色塑料桶(实验实际容积为7.5 L)为呼吸室, 将各子群实验鱼分别置于对应的呼吸室内稳定30 min后, 随即以液态石蜡为绝氧材料密封水表面(石蜡厚度1 cm以上)开始实验, 实验起始时刻均为18:00。各子群均设3个重复, 每个重复各放入实验鱼1尾。实验周期为24 h, 每隔12 h用移液管自呼吸室底部吸取15 mL水样, 并即刻用哈希便携式sensionTM 156多参数测量仪测定其DO值。实验结束时刻, 用定性滤纸吸尽实验鱼体表水分后, 用Sartorius BSA223S型电子天平逐尾称量各呼吸室内实验鱼体质量, 并据此计算各呼吸室的耗氧率(OR)。
1.2.3 窒息点的测定以直径9 cm的透明塑料瓶(实验实际容积为1 L)为呼吸室, 将各子群实验鱼分别置于对应的呼吸室稳定30 min后, 以液态石蜡为绝氧材料密封水表面(石蜡厚度1 cm以上)后即刻开始实验, 实验起始时刻均为18:00。各子群均设4个重复, 每个重复各放入实验鱼4尾。实验期间, 持续观察实验鱼存活情况, 并以玻璃棒多次轻触无反应作为死亡判别标准, 待呼吸室内实验鱼死亡率为50%时, 立即用哈希便携式sensionTM 156多参数测量仪测定取自呼吸室底部水体的DO值。
1.2.4 相关功能酶活力的测定各子群随机选取实验鱼5尾, 于冰盘上逐尾摘取鳃和内脏, 4 ℃双蒸水冲净、滤纸吸干表面水分并借助Sartorius BSA223S型电子天平逐一称重后, 立即分别放入已做好标记的样品袋内并置于–80 ℃冰箱中保存备测。其中, 涉及鳃组织的为抗氧化酶(SOD、CAT、POD)和ATP酶(Na+/K+-ATPase、Ca2+/Mg2+-ATPase), 涉及内脏的为消化酶(淀粉酶、脂肪酶、蛋白酶)、AKP、ACP和ATP酶(Na+/K+-ATPase、Ca2+/Mg2+-ATPase)。上述酶活力测试盒均购自南京建成生物工程研究所, 测试步骤及计算方法均按所附说明书。测定仪器为UV-1240型紫外可见分光光度计(岛津国际贸易有限公司)。
1.3 数据处理整理所得实验测定数据, 运用SPSS24.0软件依次计算本研究所涉各实验子群的脏器比例(鳃系数、内脏系数、内脏净重比、鳃净重比和鳃脏比)、耗氧率(昼均耗氧率、夜均耗氧率、日均耗氧率)、窒息点水中含氧量以及鳃和内脏相关酶活力的均值和标准差, 采用LSD多重比较法检验子群内和子群间的差异显著性(视P < 0.05为显著差异); 借助ChiPlot网站(网址: https://www.chiplot.online/)分别构建各子群基于脏器比例性状和耗氧率性状间欧氏距离的聚类热图。
2 结果 2.1 脏器比例性状的估算与聚类特征由表 2和图 1a可见, 子群间脏器比例性状的差异及其聚类特征主要表现为: (1) 鳃系数呈A≈B≈C≈ D < E, 内脏系数、内脏净重比和鳃净重比均呈A≈B≈ C < D < E, 鳃脏比除A、C子群均显著大于D、E子群(P < 0.05), B子群显著大于E子群(P < 0.05)外, 其余子群间均无显著差异(P > 0.05); (2) 经聚类, 在脏器比例性状上首先聚为一支的分别为A-B子群和C-D子群。综上表明, 鳃系数和内脏系数的显著高企均可致大黄鱼幼鱼增重性能的明显下降, 脏器比例性状聚类对甄别E子群具良好的辨识效果。
| 脏器比例性状 | A子群 | B子群 | C子群 | D子群 | E子群 |
| 鳃系数(鳃质量/体质量) | 0.030±0.004a | 0.028±0.003a | 0.028±0.004a | 0.029±0.005a | 0.036±0.015b |
| 内脏系数(内脏质量/体质量) | 0.314±0.052a | 0.303±0.032a | 0.296±0.050a | 0.393±0.088b | 0.475±0.077c |
| 内脏净重比(内脏质量/净体质量) | 0.465±0.114a | 0.449±0.070a | 0.446±0.107a | 0.694±0.215b | 0.952±0.187c |
| 鳃净重比(鳃质量/净体质量) | 0.043±0.005a | 0.041±0.005a | 0.041±0.006a | 0.051±0.009b | 0.061±0.023c |
| 鳃脏比(鳃质量/内脏质量) | 0.098±0.024a | 0.092±0.017ab | 0.098±0.028a | 0.080±0.029bc | 0.067±0.033c |
| 注: 表内数据为平均值±标准差。上标a、b、c表示组间差异(P < 0.05), 字母相同表示无显著差异(P > 0.05) | |||||
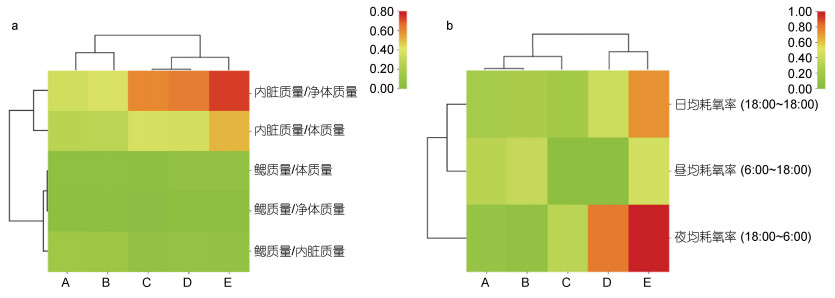 |
| 图 1 基于脏器比例性状和耗氧率的聚类热图 Fig. 1 Clustering heat map based on organ proportion traits and oxygen consumption rate 注: a. 脏器比例性状; b. 耗氧率性状 |
由图 2和图 1b可见, 子群间耗氧率的差异及其聚类特征主要表现为: (1) 日均耗氧率呈A≈B≈C≈ D < E。其中, 夜均耗氧率呈A≈B < C < D < E, 昼均耗氧率呈A≈B > C≈D, 且E子群显著大于除A以外的其他子群(P < 0.05); (2) 耗氧昼夜节律已出现分化。其中, A、B子群的耗氧率均呈昼均 > 夜均(P < 0.05), 其余子群均呈夜均 > 昼均(P < 0.05); (3) 除E子群的日均耗氧率与其昼均和夜均耗氧率均无显著差异(P > 0.05)外, 其余子群的日均耗氧率则均介于昼均、夜均之间, 且三者间均具显著差异(P < 0.05); (4) 经聚类, 在耗氧率性状上首先聚为一支的分别为A-B子群和D-E子群。综上表明, 日均耗氧率的高企和耗氧昼夜节律的分化均可导致大黄鱼幼鱼增重性能的明显改变, 耗氧率性状聚类对甄别C子群具良好的辨识效果。
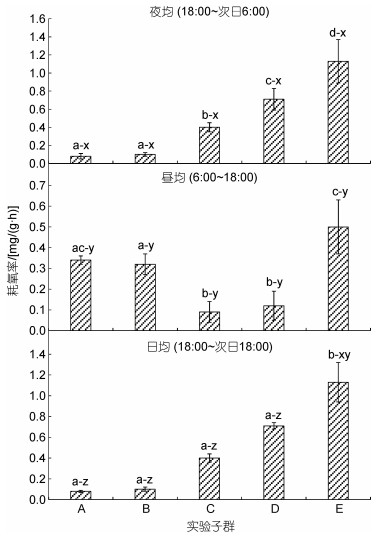 |
| 图 2 实验子群间夜均、昼均和日均耗氧率的差异 Fig. 2 Differences in average nighttime, daytime, and daily oxygen consumption rates among experimental subgroups 注: 不同大写字母表示不同实验组群A、B、C、D、E。上标a、b、c、d示组间差异, 上标x、y、z示组内差异。下同 |
由图 3可见, 窒息点水中氧含量随增重性能的减弱总体上呈渐次增加的趋势。其中, 与E子群存在组间差异(P < 0.05)的仅为A、B, 呈E > A≈B, C、D子群作为过渡类型, 它们的窒息点与其他子群均无组间差异(P > 0.05)。由此可知, 大黄鱼幼鱼的增重性能会随其窒息点水中含氧量的趋势性提高而表露出极明显的减弱效应。
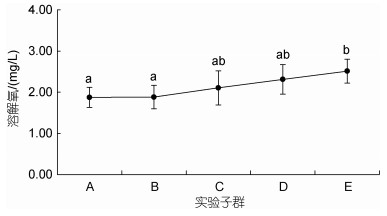 |
| 图 3 实验子群间窒息点水中含氧量的差异 Fig. 3 Differences in oxygen content in water at asphyxiation points among experimental subgroups |
由图 4和图 5可见, 内脏淀粉酶活力随增重性能下降呈阶梯式下降趋势, 其中A最大(P < 0.05), B显著大于E (P < 0.05), C、D、E三者间均无显著差异(P > 0.05); 脂肪酶活力随增重性能下降大体上呈先降后升趋势, 除A显著大于C (P < 0.05), B、C均显著小于E (P < 0.05)外, 其余子群间均无显著差异(P > 0.05); 蛋白酶活力随增重性能下降大体上呈先升后降趋势, 其中A显著小于C、E (P < 0.05), E显著大于除C、D以外的其他子群(P < 0.05); AKP和ACP酶活力分别呈A < B < C < D < E (P < 0.05)和A≈B < C≈D < E。综上可知, 与子群间增重性能排序吻合度最高的内脏消化酶和磷酸酶活力分别为淀粉酶和AKP。
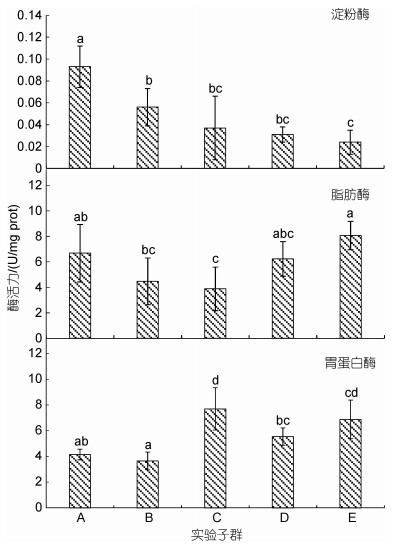 |
| 图 4 实验子群间内脏消化酶活力的差异 Fig. 4 Differences in digestive enzyme activities in the viscera among experimental subgroups |
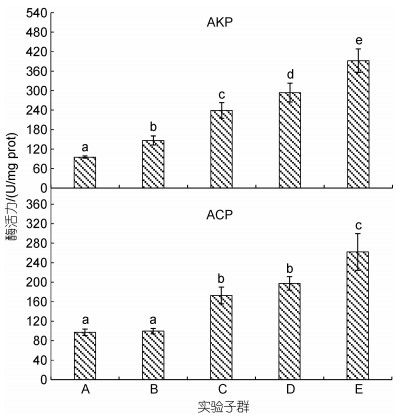 |
| 图 5 实验子群间内脏AKP和ACP活力的差异 Fig. 5 Differences in AKP and ACP activities in the viscera among experimental subgroups |
由图 6可见, 鳃组织SOD、CAT和POD酶活力分别呈A > B > C≈D≈E、A > E > B≈C≈D和A > B≈E > C > D。由此可知, 诸酶活力中与子群间增重性能排序相似性最高的抗氧化酶为SOD。
 |
| 图 6 实验子群间鳃组织抗氧化酶活力的差异 Fig. 6 Differences in antioxidant enzyme activities in gill tissues among experimental subgroups |
由图 7可见, 鳃组织Na+/K+-ATPase和Ca2+/Mg2+-ATPase酶活力均呈A > B≈C > D≈E; 内脏Ca2+/Mg2+-ATPase酶活力无组间差异(P > 0.05), Na+/K+-ATPase酶活力除A显著大于D、E子群(P < 0.05)外, 其余子群间均无显著差异(P > 0.05)。由此可知, 鳃组织ATP酶活力在区分不同增重性能子群上较内脏具更高的辨识度。
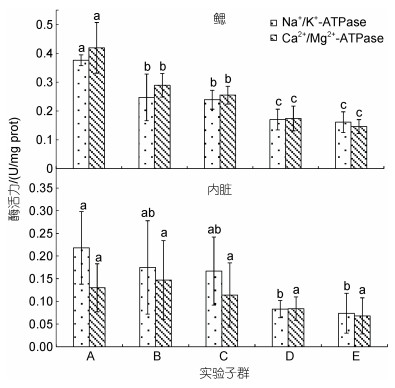 |
| 图 7 实验子群间鳃组织和内脏ATP酶活力的差异 Fig. 7 Differences in ATP enzyme activities in gill tissues and viscera among experimental subgroups |
动物的组织和脏器按其生理代谢功能可分为活性和惰性两部分(牟恩镟等, 2021)。鳃和内脏共同构成了鱼体的活性部分。“器官代谢活性假说”指出, 动物的活性内脏系数与其代谢水平呈正相关(Itazawa et al, 1983; Oikawa et al, 1992)。故, 本研究中鳃系数和内脏系数分别呈A≈B≈C≈D < E和A≈B≈C < D < E (表 1), 以及耗氧率性状聚类上首先聚为一支的分别为A-B子群和D-E子群(图 1b)的结果, 在印证鱼类活性内脏系数与其体质量呈负相关(Grim et al, 2012; Luo et al, 2013)这一论断可靠性的同时, 也客观反映了高企的机体代谢能耗是导致D、E子群增重性能明显弱于其他子群的本质。鱼类的耗氧昼夜节律与其摄食运动习性息息相关。经调研, 栖息于自然海域的大黄鱼往往具有昼伏夜出的生活习性。李有志等(2023)研究表明, 在网箱养殖生境下大黄鱼幼鱼以专注抢食为导向形成并固化了优先保障摄食运动代谢的生存对策, 其中A子群依托强劲的竞食优势, 建立了优先获得食物保障的高收益摄食策略, E子群为有效弥补在竞食中所处的劣势地位, 固化了通过显著提高机体代谢水平以大幅增加觅食运动量的低收益摄食策略。故, 本研究中图 1a所示在脏器比例性状聚类上首先聚为一支的分别为A-B子群和C-D子群, 与A、B子群耗氧率均呈昼均 > 夜均(P < 0.05), 而其余子群则均呈昼均 < 夜均(P < 0.05) (图 2)的结果, 所反映的子群间在机体能量代谢聚类和耗氧昼夜节律分化上完全相吻的情形, 既阐释了在日均耗氧率和窒息点均相近(图 2, 图 3)的情形下, 调整耗氧昼夜节律以积极响应投饲主要在白昼进行的传统养殖模式是导致A、B子群增重性能明显强于C、D子群的重要途径, 也揭示了在传统人工投饲场景(投喂时间相对固定且时长较短)下, 机体能量代谢上的差异是导致C、D、E子群在抢食运动能力中明显弱于A、B子群, 而不得不保持固有耗氧昼夜节律的根本原因。
3.2 抗氧化生理和ATP酶活力与增重性能间的相关性鳃不仅是大黄鱼唯一的呼吸器官, 并且还在其机体渗透压调节中发挥着极为重要的作用。窒息点系直接反映水生动物耐低氧能力的重要生理指标(杨程等, 2016)。Na+/K+-ATPase和Ca2+/Mg2+-ATPase酶均属调控细胞内外液渗透压的跨膜蛋白(李有志等, 2022)。故, 它们对鳃组织的生理状况均具重要的指示作用。据报道, 活性氧(Reactive oxygen species, ROS)作为生物有氧代谢产生的对细胞具毒害作用的副产物(Mittler, 2002), 不仅可通过阻断有氧呼吸链以减少ATP的形成, 而且还会通过增强脂质过氧化作用改变细胞膜的流动性和完整性, 从而导致ATP酶活性的下降(李海英等, 2008), 当体内过多的ROS不能被及时清除时, 势必会造成细胞内各类大分子的氧化损伤, 并进而引起生物有机体的各种生理病变(Li et al, 2001)。因此, 窒息点和ATP酶活力均可作为反映有机体健康状况的重要生理指标。SOD、CAT和POD作为抗氧化酶系统的重要成员, 在保持体内ROS动态平衡和维系细胞正常代谢中起着十分重要的作用(王志铮等, 2013)。其中, SOD在清除活性氧反应过程中最早发挥作用(张克烽等, 2007), 是最能代表机体抗氧化防御变化特征的指标酶(Wilhelm Filho et al, 1993)。故, 本研究中鳃组织SOD、CAT和POD酶活力分别呈A > B > C≈D≈E、A > E > B≈C≈D和A > B≈E > C > D (图 6), Na+/K+-ATPase和Ca2+/Mg2+-ATPase酶活力均呈A > B≈C > D≈E (图 7), 窒息点水中氧含量除E显著大于A、B (P < 0.05)外, 其他子群间均无显著差异(P > 0.05) (图 3), 以及在耗氧率性状聚类上首先聚为一支的分别为A-B子群和D-E子群(图 1b)的结果, 既表明A、B子群鳃组织强大的ROS清除能力不仅为支撑并维系它们在抢食竞争中的优势地位保证了持续而充足的能量供给, 而且也为它们在耗氧昼夜节律调整后有氧呼吸链仍不受影响提供了重要的生理保障, 从而有效促进了增重性能的明显跃升, 也映射了通过显著提高日均耗氧率(图 2)以增加摄食运动频率来弥补竞食能力处于劣势地位的窘境, 和高企鳃组织CAT和POD酶活力以抵御ROS的快速产出, 是导致E子群耐低氧能力显著受抑和增重性能显著下滑的重要原因。综上, 鉴于鳃组织SOD酶活力在甄别抢食能力上的良好区分度, 可将其视为大黄鱼同生群幼鱼抢食能力的指示酶。与此同时, 内脏Ca2+/Mg2+-ATPase酶活力无组间差异(P > 0.05), Na+/K+-ATPase酶活力除A显著大于D、E子群(P < 0.05)外, 其他子群间均无显著差异(P > 0.05) (图 7)的结果, 在进一步证实鳃组织在机体渗透压调节上较内脏更具重要性的同时, 也揭示了因增加摄食运动频率而高企的内脏能量代谢负荷是导致D、E子群Na+/K+-ATPase酶活力和增重性能均显著低于A子群的根本原因。
3.3 内脏消化生理和磷酸酶活力与增重性能间的相关性肝脏是鱼体的代谢中心(陆忠康, 2001)。研究发现, 肝胰脏不仅是鱼类淀粉酶中心生成器官(陈春娜, 2008), 而且也是鱼体诸脏器中淀粉酶活性的最高者(Uys et al, 1987; 周景祥等, 1999; 马爱军等, 2006; 刘忠义等, 2006)。故, 可将淀粉酶活力视为衡量鱼类肝脏健康程度的重要指标酶。由此, 本研究图 4所示内脏诸消化酶中仅淀粉酶活力大体上表露为随大黄鱼幼鱼增重性能下降而下降的结果, 所反映的大黄鱼幼鱼增重性能与其内脏淀粉酶活力具较强相关性的特征, 揭示了提高肝脏健康度对其内脏代谢降耗所具的重要作用。
AKP和ACP均属正磷酸单酯水解酶, 在机体骨化以及部分营养物质的消化、吸收和转运过程中起重要作用, 系广泛存在于各种动物体内的重要解毒体系(何海琪等, 1992)。其中, AKP作为营养吸收的标志物(Segner et al, 1989), 通过与ATP酶的共同作用, 可将消化酶作用产生的小的多肽和氨基酸穿过细胞膜(Gawlicka et al, 1995; Baglole et al, 1998); ACP系溶酶体的标志酶, 在细胞内消化过程中起重要作用。据报道, AKP和ACP活性在鱼体内的分布并不均衡, 其中大黄鱼高AKP活性的脏器主要为胃和前肠, 高ACP活性的脏器主要为肝脏和胃(俞军等, 2016), 即大黄鱼内脏较鳃和肌肉组织具更高的AKP和ACP活性。无疑, 本研究图 5所示内脏AKP和ACP酶活力分别呈A < B < C < D < E (P < 0.05)和A≈B < C≈D < E的结果, 所反映的它们与大黄鱼幼鱼增重性能间均存在负相关关系的特征, 无疑提示了它们作为非特异性免疫酶的重要成员, 在有效抑制因机体代谢能耗显著高企对内脏带来的损害中所起的重要保护作用。综上, 鉴于内脏AKP在甄别增重性能上较ACP酶活力具更好地区分度的结果, 故可将其视为评价大黄鱼同生群幼鱼增重性能的重要指示酶。
4 结论(1) 鳃系数、内脏系数和日均耗氧率的显著高企(P < 0.05)均可导致大黄鱼幼鱼增重性能的明显下降, 耗氧率性状聚类和脏器比例性状聚类分别对甄别C、E子群具良好的辨识效果。
(2) 耗氧昼夜节律的分化是引起大黄鱼幼鱼增重性能发生明显改变的主因, 调整耗氧昼夜节律以积极响应投饲主要在白昼进行的传统养殖模式是导致A、B子群增重性能获得明显增强的重要途径。
(3) 随窒息点水中含氧量的趋势性提高, 大黄鱼幼鱼的增重性能将表露出极明显的减弱效应。表明, 提高大黄鱼幼鱼的耐低氧能力, 对其在抢食运动中占据优势地位并进而增强增重性能具重要助益。
(4) 内脏消化酶和非特异性免疫酶中, 酶活力随增重性能增强呈单调增加的仅为AKP。故, 可将其作为评价大黄鱼同生群幼鱼增重性能的重要指示酶。
(5) 鳃组织非特异性免疫酶中, 与竞食地位最相关的仅为SOD。故, 可将其视为表征大黄鱼同生群幼鱼抢食能力的重要指示酶。
马爱军, 柳学周, 吴莹莹, 等, 2006. 消化酶在半滑舌鳎成鱼体内的分布及仔稚幼鱼期的活性变化[J]. 海洋水产研究, 27(2): 43-48. |
王志铮, 赵晶, 杨磊, 等, 2013. 三种养殖模式下日本鳗鲡(Anguilla japonica)养成品血清生化指标和脏器消化酶、抗氧化酶活力的差异[J]. 海洋与湖沼, 44(2): 403-408. |
刘忠义, 王璋, 2006. 草鱼和青鱼消化酶的分布特性[J]. 淡水渔业, 36(1): 14-18. DOI:10.3969/j.issn.1000-6907.2006.01.004 |
江柳, 傅荣兵, 蒋宏雷, 等, 2021. 大黄鱼幼鱼表型性状对体质量和净体质量的影响效果分析[J]. 浙江海洋大学学报(自然科学版), 40(3): 242-246. |
牟恩镟, 申屠琰, 叶文婷, 等, 2021. 池塘专养模式下中华鳖养成品组织和脏器质量对体质量的影响效果分析[J]. 浙江海洋大学学报(自然科学版), 40(6): 498-504. |
李有志, 牟恩镟, 申屠琰, 等, 2022. 越冬对池塘专养模式下中华鳖(Trionyx sinensis)机体形态、血清生化、脏器相关功能酶活力及肌肉和裙边物性的影响[J]. 海洋与湖沼, 53(2): 421-429. |
李有志, 蒋宏雷, 刘哲宇, 等, 2023. 大黄鱼(Larimichthys crocea)幼鱼同生群内不同增重性能子群间的形质差异[J]. 海洋与湖沼, 54(5): 1488-1497. |
李英英, 陈曦, 宋铁英, 2017. 不同生长速度的大黄鱼肠道菌群结构的差异[J]. 大连海洋大学学报, 32(5): 509-513. |
李海英, 赵娟, 李海生, 2008. Na+, K+-ATP酶和Ca2+, Mg2+-ATP酶活性影响因素的研究进展[J]. 现代中西医结合杂志, 17(9): 1449-1450. |
杨程, 刘哲宇, 朱卫东, 等, 2016. 水温对水产经济动物棘胸蛙(Paa spinosa)蝌蚪耗氧率、窒息点和排氨率的影响[J]. 海洋与湖沼, 47(6): 1233-1240. |
何海琪, 孙凤, 1992. 中国对虾酸性和碱性磷酸酶的特性研究[J]. 海洋与湖沼, 23(5): 555-560. |
张克烽, 张子平, 陈芸, 等, 2007. 动物抗氧化系统中主要抗氧化酶基因的研究进展[J]. 动物学杂志, 42(2): 153-160. |
张波, 姜丹, 张东玲, 等, 2023. 大黄鱼生长速率差异个体肌肉组织的转录组比较分析[J]. 水产学报, 47(3): 87-100. |
陆忠康, 2001. 简明中国水产养殖百科全书[M]. 北京: 中国农业出版社, 374.
|
陈春娜, 2008. 鱼类淀粉酶的研究进展[J]. 中国饲料, (5): 33-35. |
竺俊全, 焦海峰, 2004. 人工育苗条件下大黄鱼仔、稚鱼的摄食与生长[J]. 宁波大学学报(理工版), 17(4): 384-388. |
周景祥, 张东鸣, 黄权, 等, 1999. 大眼鰤鲈淀粉酶活性的研究[J]. 吉林农业大学学报, 21(S1): 65-67. |
俞军, 陈庆堂, 李昌辉, 等, 2016. 姜黄素对大黄鱼组织中磷酸酶活力及血清中细胞因子含量的影响[J]. 江西农业大学学报, 38(3): 524-532. |
BAGLOLE C J, GOFF G P, WRIGHT G M, 1998. Distribution and ontogeny of digestive enzymes in larval yellowtail and winter flounder[J]. Journal of Fish Biology, 53(4): 767-784. DOI:10.1111/j.1095-8649.1998.tb01831.x |
GAWLICKA A, TEH S J, HUNG S S O, et al, 1995. Histological and histochemical changes in the digestive tract of white sturgeon larvae during ontogeny[J]. Fish Physiology and Biochemistry, 14(5): 357-371. DOI:10.1007/BF00003374 |
GRIM J M, DING A A, BENNETT W A, 2012. Differences in activity level between cownose rays (Rhinoptera bonasus) and Atlantic stingrays (Dasyatis sabina) are related to differences in heart mass, hemoglobin concentration, and gill surface area[J]. Fish Physiology and Biochemistry, 38(5): 1409-1417. DOI:10.1007/s10695-012-9628-y |
ITAZAWA Y, OIKAWA S, 1983. Metabolic rates in excised tissues of carp[J]. Experientia, 39(2): 160-161. DOI:10.1007/BF01958874 |
LI H J, BAHN J H, EUM W S, et al, 2001. Transduction of human catalase mediated by an HIV-1 TAT protein basic domain and arginine-rich peptides into mammalian cells[J]. Free Radical Biology and Medicine, 31(11): 1509-1519. DOI:10.1016/S0891-5849(01)00734-1 |
LUO Y P, WANG W, ZHANG Y R, et al, 2013. Effect of body size on organ-specific mitochondrial respiration rate of the largemouth bronze gudgeon[J]. Fish Physiology and Biochemistry, 39(3): 513-521. DOI:10.1007/s10695-012-9716-z |
MITTLER R, 2002. Oxidative stress, antioxidants and stress tolerance[J]. Trends in Plant Science, 7(9): 405-410. DOI:10.1016/S1360-1385(02)02312-9 |
OIKAWA S, TAKEMORI M, ITAZAWA Y, 1992. Relative growth of organs and parts of a marine teleost, the porgy, Pagrus major, with special reference to metabolism-size relationships[J]. Japanese Journal of Ichthyology, 39(3): 243-249. DOI:10.1007/BF02905482 |
SEGNER H, RÖSCH R, SCHMIDT H et al, 1989. Digestive enzymes in larval Coregonus lavaretus L.[J]. Journal of Fish Biology, 35(2): 249-263. DOI:10.1111/j.1095-8649.1989.tb02974.x |
UYS W, HECHT T, 1987. Assays on the digestive enzymes of sharptooth catfish, Clarias gariepinus (Pisces: Clariidae)[J]. Aquaculture, 63(1/2/3/4): 301-313. |
WILHELM FILHO D W, GIULIVI C, BOVERIS A, 1993. Antioxidant defences in marine fish-I: Teleosts[J]. Comparative Biochemistry and Physiology Part C: Pharmacology, Toxicology and Endocrinology, 106(2): 409-413. DOI:10.1016/0742-8413(93)90154-D |
 2024, Vol. 55
2024, Vol. 55


