
中国海洋湖沼学会主办。
文章信息
- 滕峪, 汪鲁, 王占英, 崔正国, 曲克明, 公伟曼, 刘书凯, 崔鸿武. 2024.
- TENG Yu, WANG Lu, WANG Zhan-Ying, CUI Zheng-Guo, QU Ke-Ming, GONG Wei-Man, LIU Shu-Kai, CUI Hong-Wu. 2024.
- 一株嗜碱兼性好氧反硝化菌Marinobacter sp. B3的分离鉴定及脱氮性能研究
- ISOLATION AND IDENTIFICATION OF AN ALKALOPHILIC FACULTATIVE AEROBIC DENITRIFICATION STRAIN MARINOBACTER SP. B3 AND ITS DENITRIFICATION PERFORMANCE
- 海洋与湖沼, 55(2): 419-430
- Oceanologia et Limnologia Sinica, 55(2): 419-430.
- http://dx.doi.org/10.11693/hyhz20230900191
文章历史
-
收稿日期:2023-09-25
收修改稿日期:2024-01-04
2. 大连海洋大学水产与生命学院 辽宁大连 116000;
3. 崂山实验室 山东青岛 266237;
4. 上海海洋大学水产与生命学院 上海 201306;
5. 中国海洋大学化学化工学院 山东青岛 266100
2. College of Fisheries and Life Science, Dalian Ocean University, Dalian 116000, China;
3. Laoshan Laboratory, Qingdao 266237, China;
4. College of Fisheries and Life Science, Shanghai Ocean University, Shanghai 201306, China;
5. School of Chemistry and Chemical Engineering, Ocean University of China, Qingdao 266100, China
近年来, 水产养殖业快速发展, 为人类提供了丰富的水产优质蛋白, 但同时产生了不可忽视的环境问题。传统的养殖技术成本较高, 投饵量大, 产生大量的排泄物和残饵, 不仅破坏生态系统平衡, 还会影响养殖生物生长和品质。循环水产养殖系统(recirculating aquaculture systems, RAS)具有节水节地、高效、环保、系统可控等优点(Ren et al, 2021), 并且在减少养殖用水量和尾水排放量等方面具有显著优势(朱建新等, 2022)。在投饵型集约化高密度养殖模式中, 饵料投喂是氮污染的主要来源, 其分解、转化形成的NH4+和NO2-对养殖生物具有很强的毒性, 工厂化循环水养殖通常设置生物滤池通过硝化反应将其转化为生物毒性较低的NO3-, 并将90%~95%的水体再次循环利用。因此, “硝酸盐累积”是工厂化(RAS)中的常见现象, 未经处理的尾水排放会导致近海环境污染。目前, 全国多地相继出台的“养殖尾水排放标准”标志着养殖尾水全面达标排放势在必行。因此, 海水养殖尾水高效脱氮不仅符合我国“深入打好污染防治攻坚战”的战略需求, 也是海洋环境保护和海水养殖业绿色发展的迫切需要。
生物脱氮具有效率高、工艺流程简单和成本低等优点(刘波文等, 2022), 污水中的氮素依次经过硝化过程和反硝化过程被去除, 反硝化是生物脱氮中的重要步骤(周星煜等, 2022), 可以解决工厂化循环水系统中硝酸盐积累问题, NO3--N和NO2--N通过硝酸盐还原酶最终还原成N2排出, 其反硝化脱氮过程为: NO3-→NO2-→NO→N2O→N2。反硝化作用在生态系统中广泛存在, 细菌, 古生菌和真核生物均具有反硝化能力(黄锐等, 2022), 其中, 研究最多的反硝化菌为假单胞菌属(Pseudomonas)和产碱杆菌属(Alcaligenes) (刘函瑜, 2022)。研究发现, 目前发现的高效兼氧反硝化菌非常有限(魏荷芬等, 2016), 如Pseudomonas denitrificans G1, 其在好氧和厌氧条件下均能在24 h内生长, 但在好氧条件下, 菌株G1最终产物为N2O, 没有完全完成反硝化过程; 在厌氧条件下, 能够有效的进行完全反硝化, 最终产物为N2(Chen et al, 2020)。Enterobacter cloacae F2在脱氮过程中, 约有60%的氮转化为胞内氮, 仅有20%的氮被转化为气态氮, 可见菌株Enterobacter cloacae F2具有反硝化过程但主要通过同化作用去除氮素(张进等, 2018)。厌氧反硝化菌Halomonas sp. DN20在温度为30 ℃, 盐度为10, pH=7.5~8.5, 碳氮摩尔比(C/N)为4︰1条件下, 340 mg/L的硝态氮在3 h内被去除至低于58 mg/L, 去除率可达到82.9% (蒋欣燃, 2017), 但菌株DN20在好氧条件下无法进行反硝化作用。好氧反硝化菌Marinobacter sp. strain B108在最适条件下24 h对102.86 mg/L NO3--N去除率为100%, 总氮(TN)去除率为98.89%, 在厌氧条件下无法进行反硝脱氮, B108的硝酸盐还原途径包括同化还原途径和好氧反硝化的异化还原两条途径(王娇等, 2023)。
本研究从海水螺旋藻培养体系中分离获得的Marinobacter sp. B3为一株兼性好氧反硝化菌, 通过探究其氮代谢和生长特性, 发现在好氧条件和厌氧条件下均可进行生长且有效进行完整反硝化过程, 且在好氧条件下脱氮效率更高。通过对其进行设置不同溶解氧(DO)、C/N、pH和温度等单因素条件, 测定其反硝化脱氮性能, 其结果可应用于工厂化循环水系统硝酸盐氮累积问题。
1 材料与方法 1.1 材料实验菌株从中国水产科学研究院黄海水产研究所渔业环境与生物修复研究室保存的海水螺旋藻培养体系中分离获得。
1.2 方法 1.2.1 菌株筛选在超净台内取部分螺旋藻液, 后通过划平板方式多次划线分离纯化得到3种菌株, 记为B2、B3、B5。
1.2.2 培养基的配置2216E液体培养基: 用于海生细菌的培养。主要成分蛋白胨5.0 g/L, 酵母浸粉1.0 g/L, FeC6H5O7 0.1 g/L, NaCl 19.45 g/L, MgCl2 5.98 g/L, Na2SO4 3.24 g/L, CaCl2 1.8 g/L, KCl 0.55 g/L, Na2CO3 0.16 g/L, KBr 0.08 g/L, SrCl2 0.034 g/L, H3BO3 0.022 g/L, Na2O·nSiO2 0.004 g/L, NaF 0.002 4 g/L, NaNO3 0.001 6 g/L, NaH2PO4 0.008 g/L。2216E固体培养基添加15 g/L的琼脂。
海水培养基: 通过0.45 μm滤膜过滤的海水, C6H12O6 2.753 g/L (碳源质量浓度为1000 mg/L), KNO3 0.722 g/L (氮源质量浓度为100 mg/L), KH2PO4 0.022 g/L (磷源质量浓度为10 mg/L)。
1.2.3 菌株的形态观察及16S rRNA鉴定(1) 扫描电镜(SEM), 透射电镜(TEM)观察。取菌液40 mL, 以5 500 r/min离心5 min, 倒掉上清液取沉淀, 取黄豆粒大小, 放入1.5 mL离心管内, 使用体积分数为2.5%的戊二醛溶液固定24 h, 然后委托科学指南针通过扫描和透射电镜拍下菌株的细胞形态以及鞭毛情况。
(2) 16S rRNA鉴定。将海杆菌B3通过划平板方式纯化, 在2216E培养基内培养48 h后送至北京擎科生物科技有限公司, 委托该公司进行16S rRNA基因序列检测, 通过对其总DNA进行提取, PCR扩增产物切胶回收后, 测得海杆菌B3的DNA序列。
1.2.4 单因素对海杆菌B3氮代谢性能的影响分别测试了不同DO、C/N、pH和温度对海杆菌B3氮代谢等反硝化性能的影响。按照2% (体积百分数)的接种量, 吸取对数生长期菌液(OD600=0.830) 4 mL, 接种至装有200 mL已灭菌海水培养基的250 mL锥形瓶中。
(1) DO影响实验: DO通过设置摇床的振荡速度进行控制(马洪婧等, 2022), DO质量浓度通过便携式溶解氧测定仪(JPB-607A, 雷磁, 中国)测定。测定振荡速度分别设置为120 r/min (初始DO质量浓度为4.70 mg/L), 150 r/min (初始DO质量浓度为5.60 mg/L), 180 r/min (初始DO质量浓度为7.60 mg/L), 其余实验条件设置为温度30 ℃, pH=8.0±0.2, C/N=10, 在此条件下使用带砂芯硅胶塞, 进行好氧培养72 h。
(2) 温度影响实验: 培养温度通过培养箱来控制, 温度分别设置为25、30、35 ℃, 其余实验条件设置为pH=8.0±0.2, C/N=10, 振荡速度150 r/min(初始OD600=0.032), 在此条件下培养72 h。
(3) C/N影响实验: 将不同质量的葡萄糖分别加入海水培养基中, C/N的值分别设置为5、10、15, 其余实验条件设置为温度30 ℃, pH=8.0±0.2, 振荡速度150 r/min(初始OD600=0.032), 在此条件下培养72 h。
(4) 初始pH影响实验: 实验使用1 mol/L的氢氧化钠(NaOH)和盐酸(HCL)改变初始pH值, 使pH分别控制在(7.0±0.2)、(8.0±0.2)、(9.0±0.2), 其余实验条件设置为温度30 ℃, C/N=10, 振荡速度150 r/min (初始OD600=0.032), 在此条件下培养72 h。
(5) 实验设置: DO影响实验的生长环境为好氧环境, C/N、pH、温度影响实验设置好氧和厌氧环境, 分别使用带砂芯硅胶塞和橡胶塞, 培养72 h。每个处理设置3个平行, 每隔4 h取样一次, 使用紫外分光光度计(DR3900, HACH, 美国)测定其生长曲线(OD600); 使用高速离心机(3K15, SIGMA, 美国)将菌液样品以5 500 r/min离心10 min, 去除细胞抽取上清液, 再用0.22 μm的滤膜进行过滤, 稀释后, 通过营养盐自动分析仪(QUAATRO, 德国Seal, 德国)测定其脱氮能力(TN、NO3--N、NO2--N和NH4+-N); 通过总有机碳分析仪(TOC-V CPH, SHIMADZU, 日本)测定DOC浓度。
1.2.5 海杆菌B3在反硝化过程中的氮素转化分析通过单因素影响实验得出的结果, 按照2% (体积分数)的接种量, 吸取对数生长期菌液(OD600=0.830) 4 mL, 接种至装有200 mL已灭菌海水培养基的250 mL锥形瓶中, 使用单因素影响实验得出的反硝化性能最佳条件, 设置振荡速度150 r/min, C/N=10, pH=8.0±0.2, 温度为35 ℃, 在此条件下将菌株进行好氧培养72 h, 然后取5 mL菌液, 稀释后测定TN, NO3--N, NO2--N, NH4+-N, 另一部分通过超声波细胞粉碎机(KS-500F宁波海曙科生超声设备有限公司中国)(超声开4.0 s, 关6.0 s, 报警温度为70 ℃, 功率为50%, 时间为15 min)进行细胞粉碎处理。把超声波粉碎后的菌液通过高速离心机, 使用8 000 r/min离心10 min, 保留上清液, 上清液过0.22 μm滤膜, 然后通过营养盐自动分析仪(QUAATRO, 德国Seal, 德国)测定其TN、NO3--N、NO2--N、NH4+-N, 之后通过公式: (1)、(2)、(3), 计算出总有机氮、细胞内总氮和氮损失。
 (1)
(1)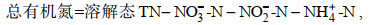 (2)
(2) (3)
(3)经16S rRNA测定, 菌株B3为海杆菌属, 通过对该菌落的形态观察显示, 菌落在2216E琼脂培养基上, 边缘与中央部位颜色一致, 呈淡黄色, 半透明, 直径为1.0~2.0 mm, 圆形, 边缘不整齐, 中间微微凸起, 表面粗糙, 质地湿润, 易挑取, 与培养基不结合(图 1a); 通过SEM和TEM观察显示, 细菌呈短杆状, 鞭毛明显(图 1b, 1c)。
 |
| 图 1 B3的菌落形态(a), SEM (b)和TEM (c) Fig. 1 The colony morphology of the strain B3 (a), and its SEM (b) and and TEM (c) images |
使用细菌基因组提取试剂盒提取菌株B3基因组DNA, 对菌种的16S rRNA序列进行测定。PCR扩增引物为细菌16S rRNA基因通用引物(孙雪梅等, 2012), 上游引物27F: 5′-AGAGTTTGATCCTGGCTCAG-3′和下游引物1492R: 5′-AAGGAGGTGATCCAGCCGCA-3′。16S rRNA基因测序的结果通过BLAST程序与GenBank数据库(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行对比检索, B3与多株海杆菌(Marinobacter)的同源性较高, 其中与菌株SL013A-34A-2一致性为99.93%, 通过MAGA 11软件构建菌株系统发育树(N-J法)(图 2)。系统进化分析显示, 海杆菌B3与SL013A-34A-2聚为一支, 亲缘关系最接近。结合菌株形态, 电镜观察以及16Sr RNA基因序列分析结果, 将该菌株鉴定为海杆菌属, 命名为Marinobacter sp. B3。于2022年10月31日, 将该海杆菌保存在中国普通微生物菌种保藏管理中心, 保藏号为NO.25998。
 |
| 图 2 基于16S rRNA基因序列同源性构建的海杆菌B3系统发育树 Fig. 2 Phylogenetic tree of Marinobacter sp. B3 based on the partial 16S rRNA sequences |
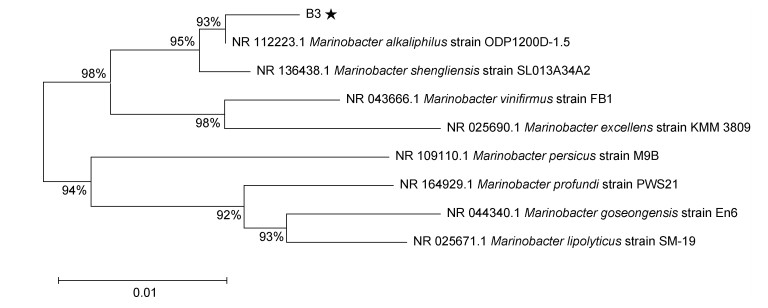
DO对大多数反硝化菌的影响都有一个阀值范围, 且不同菌属的反硝化菌, 其DO阀值差异较大(Wu et al, 2013; 杨婷等, 2022)。本实验通过改变摇床的振荡速度来控制DO浓度, 设置三个不同振荡速度(120、150、180 r/min), 以2%的体积分数的接种量, 吸取对数生长期的菌液分别接种至海水培养基中, 在好氧环境下培养72 h, 图 3显示了不同转速下海杆菌B3的脱氮性能及生长影响, 可以看出: 海杆菌B3在120 r/min时, 菌株生长缓慢(OD600=0.385), 72 h的NO3--N去除率为48.65%, 并且NO2--N积累严重, NO2--N最终质量浓度为17.98 mg/L; 当海杆菌B3在150 r/min时, 其生长速率加快(OD600=0.893), 且NO3--N在72 h去除率达到94.67%, 几乎无NO2--N积累; 海杆菌B3在振荡速度180 r/min时, 72 h的最大OD600值为0.806, NO3--N去除率为47.48%, 脱氮效率最低。转速为120、150和180 r/min时TN去除率分别为54.07%、86.49%和28.73%, 溶解有机碳(DOC)去除率分别为43.20%、99.36%和53.25%。当振荡速度较低时, 培养基内的DO较低, 菌体呼吸受到限制, 生长较缓慢。高DO对一氧化二氮还原酶(nitrous oxide reductase, Nos)具有较强的毒性, 抑制了N2O的进一步还原(巩有奎等, 2012), 进而影响其反硝化脱氮效率, 且当摇床振荡速度过高, 菌液与锥形瓶发生强烈碰撞, 使菌体B3细胞受到损伤(刘明等, 2013), 抑制了脱氮过程中硝酸盐还原酶(nitrate reductase, Nar)、亚硝酸盐还原酶(nitrite reductase, Nir)等反硝化还原酶的合成(张峰峰等, 2019), 导致海杆菌B3对氮素去除率降低。综上所述, 海杆菌B3在150 r/min振荡速度下脱氮效率达到最佳。高DO和低DO浓度都会影响菌株的反硝化脱氮能力(王永刚等, 2017), 本实验结果与晏俊伟(2021)研究的Cupriavidus oxalaticus T2研究结果一致, 在转速为150 r/min时具有最佳的脱氮效率。
 |
| 图 3 好氧条件下不同转速对海杆菌B3生长和脱氮性能的影响 Fig. 3 Effects of different rotational speeds on growth and nitrogen removal of Marinobacter sp. B3 under aerobic conditions |
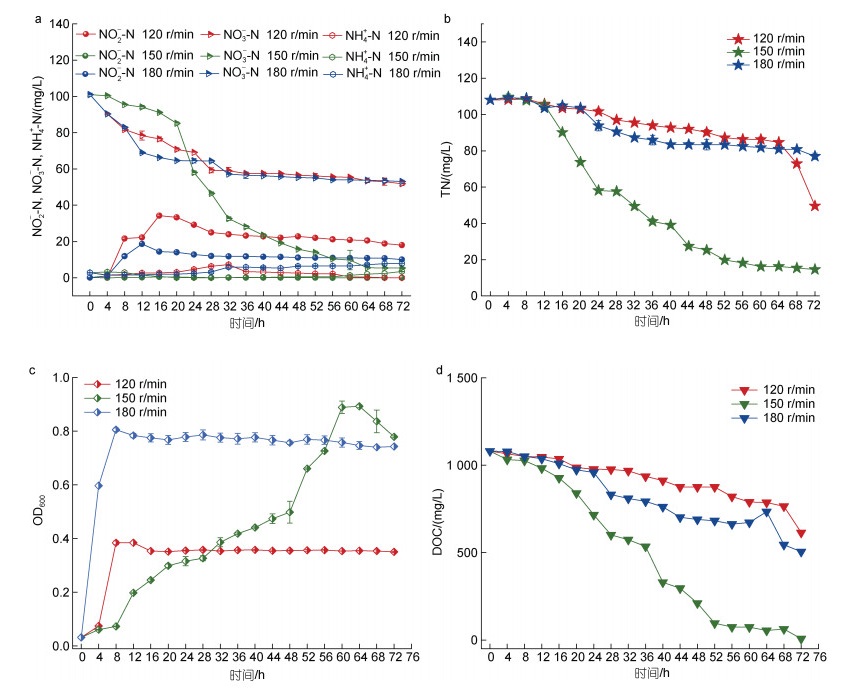
图 4表明温度对于菌株生长和脱氮性能具有较大影响, 温度是影响酶活性和反硝化速率的重要影响因素(Wang et al, 2018)。据目前研究, 大部分反硝化菌的最适脱氮温度都在25~37 ℃ (Joo et al, 2005), 为探究海杆菌B3的最佳脱氮温度, 实验分别设置了25、30、35 ℃三个温度梯度。由图 4可见, 海杆菌B3的生长速率和脱氮效率随温度上升而增加。菌株在25 ℃的好氧环境条件下(图 4a, 4b, 4c), 对环境需要一定的适应时间, 在8 h时开始迅速生长, 在60 h时达到顶峰, OD600从0.032上升至0.705, 但NO3--N去除率为53.78%, TN去除率仅有36.77%, 30 ℃条件下反应72 h后, NO3--N去除率达到94.88%, TN去除率为86.49%, 当温度继续升高到35 ℃时, NO3--N在60 h的去除率可达到100%, TN和DOC的去除率分别为94.83%和95.13%, 并且无NO2--N积累, OD600=0.830。厌氧条件下(图 4d, 4e, 4f), 菌株在25~35 ℃条件下72 h的最大OD600分别为0.831、0.915、0.991, 25和30 ℃时NO3--N去除分别为54.54%和92.14%, 而在35 ℃条件下, NO3--N去除率达到最高, 且在64 h已经去除100%, 无NO2--N和NH4+-N积累, DOC去除也达到92.07%。综上所述, 海杆菌B3的最适生长温度为35 ℃, 且在此温度下具有最大脱氮效率。这与Pseudomonas stutzeri DZ11 (郭超等, 2020)在35 ℃时反硝化脱氮效率最佳结果一致, 且在一定范围内生长速率随温度升高而升高。
 |
| 图 4 好氧(a, b, c)及厌氧(d, e, f)条件下不同温度对海杆菌B3生长和脱氮性能的影响 Fig. 4 Effects of different temperatures on growth and nitrogen removal of Marinobacter sp. B3 under aerobic (a, b, c) and anaerobic (d, e, f) conditions |
碳源是反硝化菌脱氮过程的能量来源, 它在为菌株进行反硝化反应提供电子的同时, 还为微生物有氧呼吸提供必需能量, 因此碳源和氮源含量的比例会影响微生物对底物的利用速率, 从而影响脱氮效率(丁晓宇等, 2022)。由图 5c可知, 一定程度上碳源越多, 海杆菌B3生长越快, OD600值越大。本实验设置碳氮比为5, 10, 15, 在好氧条件下(图 5a, 5b, 5c), C/N=5时, 由于碳源供应不足, OD600最大值为0.486, 限制了海杆菌B3的生长。在C/N=5时, 出现NH4+-N的积累, 反应72 h后, NH4+-N达到39.354 mg/L, 这可能是因为菌株B3在通过硝酸盐异化为铵路径将硝酸盐还原为铵, 在投放不同质量浓度的碳源会影响硝酸盐的代谢路(万雨轩等, 2021), 在C/N=5时, 有利于菌株B3进行硝酸盐异化为铵(dissimilatorynitrate reduction to ammonium, DNRA)过程。当C/N为10和15时, OD600分别为0.893和1.099, 都能达到较高的NO3--N去除, 分别为94.61%和89.85%; 厌氧条件下(图 5d, 5e, 5f), C/N=5时, 因电子受体供应不足, 菌株生长受到抑制, 产生NO2--N和NH4+-N的积累; C/N为10和15时, 菌株快速生长, 且脱氮效率提高, 均无NO2--N和NH4+-N的积累, C/N=10 (91.31%)时NO3--N去除率高于C/N=15 (79.72%)时, C/N=10时TN以及DOC的去除率大于C/N=15时。高碳氮比条件下, 部分碳源有机物会直接嵌入Nar、Nir等还原酶结构而影响酶的活性, 抑制反硝化作用的进行(毕墨涵等, 2021), 低碳氮比也不利于反硝化脱氮反应, 低碳源不足以供给细菌的生长繁殖, 从而导致细菌反硝化速率变低, NO2--N积累严重(李雪等, 2018; 于妍等, 2022)。综上所述, 海杆菌B3在C/N=10时, 脱氮效率达到最佳。可以发现, 海杆菌B3具备独立进行DNRA过程和反硝化过程的全部功能基因, 但对于NO3--N还原路径的选择, 可能受到碳源种类、C/N、pH、温度和溶氧的影响(万雨轩等, 2021)。据目前研究, 对于混菌条件, 高碳氮比有利于DNRA过程, 而低碳氮比更有利于反硝化过程(Liu et al, 2021)。对于单一菌种DNRA和反硝化竞争的选择机制, 仅有武汉水生所邱东茹研究员团队进行了报道(Liu et al, 2021), 文中指出无论碳氮比高低, 均伴随着一氧化氮和氧化氮气体的释放。细胞第二信使环状腺苷酸受体蛋白(cyclic AMP receptor protein, CRP)促进DNRA过程, 环状腺苷酸及其受体CRP家族在细菌对环境碳氮比的感知及DNRA和反硝化脱氮途径的抉择中发挥着重要作用。在碳氮比高时, 选择DNRA途径产能较多, 所需电子供体也较多, 所释放的NH4+依然可被吸收来合成氨基酸和蛋白质加以同化; 在碳氮比低时, 选择反硝化脱氮途径所需电子供体较少, 以单位碳源计所产生的能量较多, 可节省碳源用于细胞生长与繁殖, 但是会造成生物吸收同化的活性氮元素的损失。因此, 对于反硝化菌Marinobacter sp. B3的DNRA和反硝化选择机制, 有待进一步探究。
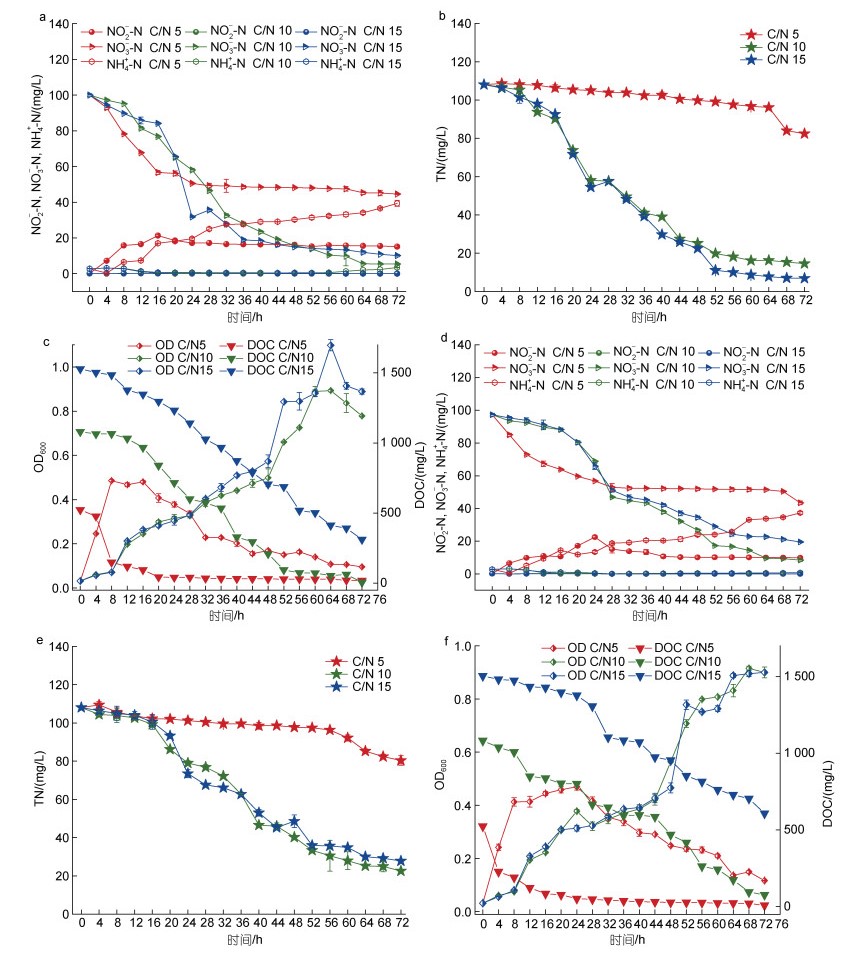 |
| 图 5 好氧(a, b, c)及厌氧(d, e, f)条件下不同C/N对海杆菌B3生长和脱氮性能的影响 Fig. 5 Effects of different C/Ns on growth and nitrogen removal of Marinobacter sp. B3 under aerobic (a, b, c) and anaerobic (d, e, f) conditions |
pH是影响微生物生长代谢的主要环境因素之一, 会直接或间接对微生物造成影响(唐婧等, 2014)。pH能通过影响细胞膜的通透性和Nar, Nir等反硝化还原酶的活性等来影响微生物的生长代谢(Li et al, 2019), 初始pH对反硝化菌脱氮能力的影响尤为重要, 张淑楠等(2015)等研究表明, 反硝化会增加外界环境中OH−浓度, 造成环境偏碱性。图 7为不同pH对海杆菌B3脱氮能力的影响。在好氧条件下(图 6a, 6b, 6c), pH=8.0±0.2时, 生长最快(OD600=0.893), pH=7.0±0.2和pH=9.0±0.2的最高OD600分别为0.671、0.858。结果表明, 海杆菌B3更适合在弱碱性(pH=8.0±0.2)的环境中生长。当pH=7.0±0.2时, 菌株生长较稳定, 但密度不高, 72 h的OD600值为0.648, NO3--N去除率较低(32.55%), 反硝化几乎无法进行; pH=8.0±0.2和9.0±0.2时, 分别有94.33%和98.54%的NO3--N去除率, 但当pH=9.0±0.2时, NO2--N积累达到24.81 mg/L, TN的去除率仅有58.44%。在厌氧条件下(图 6d, 6e, 6f), pH=(7.0±0.2)、(8.0±0.2)、(9.0±0.2)时, NO3--N去除率分别为57.98%、91.95%和73.65%, TN去除率分别为45.33%、80.49%和42.77%。pH对微生物的生长繁殖和脱氮功能有较大影响, 具体表现为pH影响菌株体内酶的活性, 引起细胞膜电荷变化, 从而影响菌株代谢活动中吸收营养物质的过程, 极端pH可能破坏微生物细胞结构, 从而抑制菌株生长或产生毒害作用(Hu et al, 2021)。综上所述, 海杆菌B3在pH=8.0±0.2时, 效率脱氮最佳。孙雪梅等(2012)等研究发现, 在pH=8.5时, 菌株Halomonas X3脱氮效果最好, 与本实验结果基本一致。
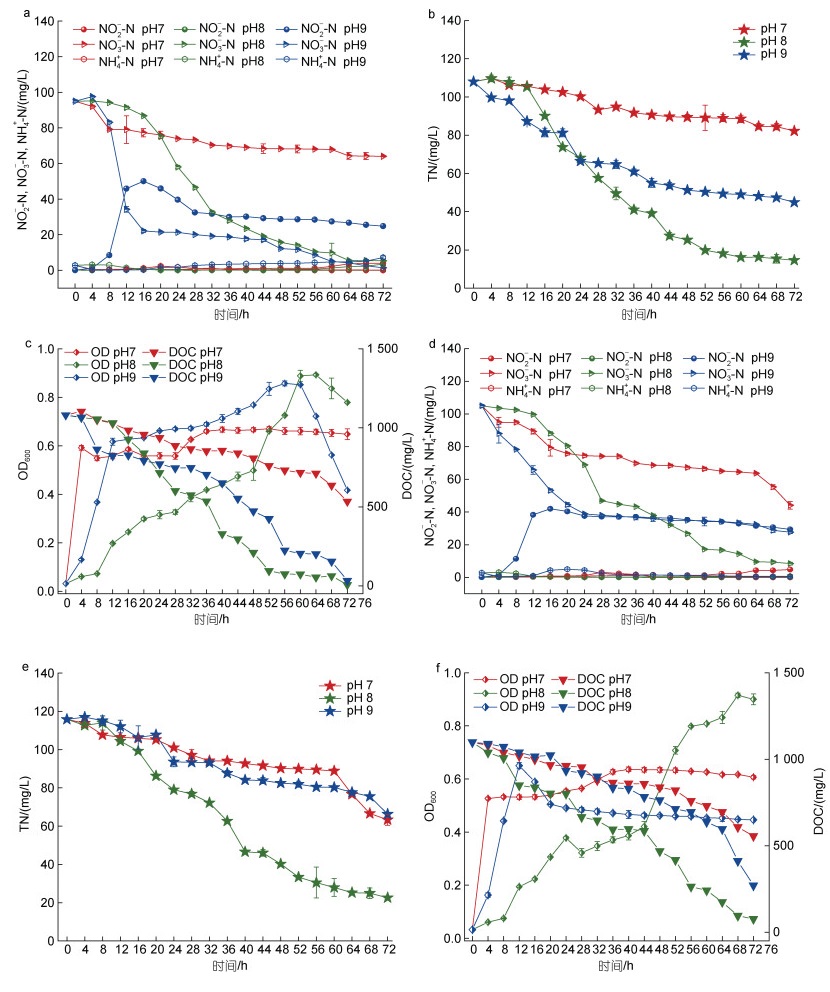 |
| 图 6 好氧(a, b, c)及厌氧(d, e, f)条件下不同pH对菌株B3生长和脱氮性能的影响 Fig. 6 Effects of different pHs on growth and nitrogen removal of strain B3 under aerobic (a, b, c) and anaerobic (d, e, f) conditions |
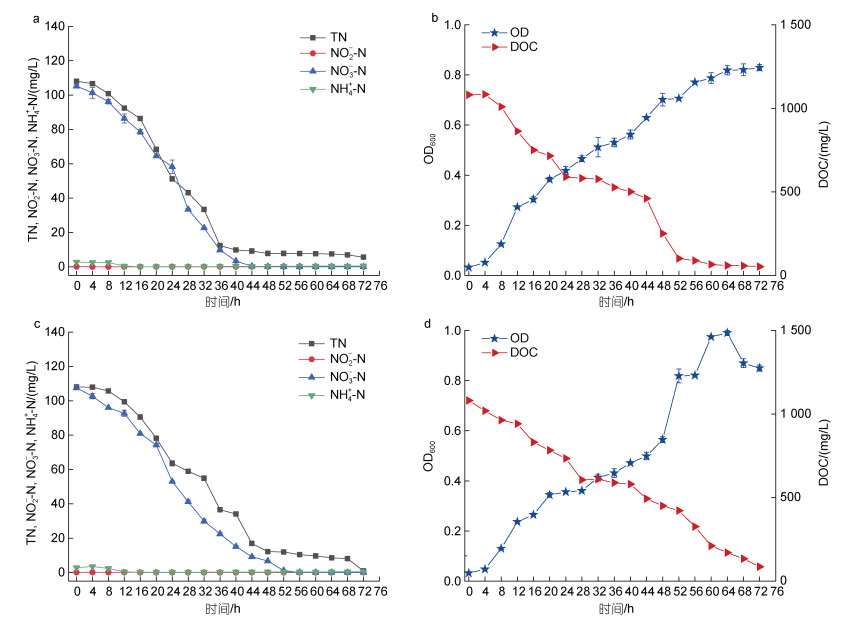 |
| 图 7 好氧(a, b)及厌氧(c, d)最优条件下海杆菌B3的最佳生长曲线和脱氮效 Fig. 7 Growth curve and nitrogen removal of Marinobacter sp. B3 under aerobic (a, b) and anaerobic (c, d) optimal conditions |
单因素影响实验结果显示, 海杆菌B3在好氧, 厌氧条件下的最佳生长条件均为振荡速度150 r/min, C/N=10, pH=8.0±0.2, 温度为35 ℃。使用100 mg/L的NO3--N, 在最优条件下, 测定海杆菌B3最优生长曲线(图 7)。
由图 7可以看出, 在好氧以及厌氧条件下, 海杆菌B3在0到4 h菌株均生长缓慢, 好氧条件下, 4~56 h为对数生长期, 细胞迅速增长, OD600值从0.051快速涨到0.771, 此时NO3--N去除率达到99.99%, TN去除率92.89%, 56~72 h为稳定期, 此时TN去除达到94.83%。培养基培养72 h后, 培养基中TN从初始浓度108.043 mg/L降低至5.583 mg/L, 脱氮速率为1.423 mg/h。厌氧条件下, 4~52 h为对数生长期, 在64 h达到顶峰(OD600=0.990 5)后开始下降, NO3--N在64 h后去除率达到100%。
2.7 海杆菌B3在反硝化过程中的氮素转化途径为探究海杆菌B3的氮转化途径, 进行了氮平衡分析(表 1), 将海杆菌B3在最佳条件培养72 h, 好氧环境, 测定其溶解态TN, 浓度5.58 mg/L, 通过超声波细胞粉碎机破碎, 测定破碎悬液中TN, 浓度为27.31 mg/L (菌体本身氮含量通过8 000 r/min离心5 min, 倒掉上清液取沉淀, 使用无菌水清洗后进行细胞破碎, 测得B3菌体本身胞内氮为3.22 mg/L), 通过公式(1), 计算出20.11%的NO3--N转化为胞内氮。测得溶解态NO3--N、NO2--N、NH4+-N的浓度分别为0、0、0.468 mg/L, 并根据公式(2)和(3), 得出有机氮浓度为5.115 mg/L, 5.583 mg/L的NO3--N转化为其他形态(NO2--N、NH4+-N和有机氮), 74.72%的NO3--N产生氮损失, 即NO3--N转化为气态产物从系统中排出。厌氧环境, 测定72 h溶解态TN浓度为0 mg/L, 超声破碎后TN浓度为29.32 mg/L, 根据公式(1), 计算出26.65%的NO3--N转化为胞内氮。测得溶解态NO3--N、NO2--N、NH4+-N的浓度分别为0、0、0.527 mg/L, 通过公式(2)和(3), 得出72.86%的NO3--N转化为气体排出。由此可见, 菌株B3通过氮还原可以将更多的NO3--N转化为气态氮。研究表明, 不同的菌株对于氮素转化的途径不同。如丁欣(2022)等研究发现, Acinetobacter sp. LV3在进行脱氮过程中, 大于60%的初始氮转化为气态氮, 其次主要转化为胞内氮, 菌株LV3主要通过反硝化作用以及同化作用进行脱氮。王彩蓄(2022)等研究的Pseudomonas sp. XS-18在NO3--N去除过程中, 没有检测到NH4+-N的产生, 除少量的氮素转化为生物量外(21.74%±0.32%), 大部分的氮素以有机氮的形式留存在细胞内, 转化为胞内氮(77.39%±0.26%), 整个脱氮过程无N2、N2O等气体产生, 菌株Pseudomonas sp. XS-18主要通过同化异化硝酸盐还原作用进行脱氨。本实验菌株B3通过氮还原, 可以将70%及以上的氮转化为气态氮排出, 可见, 菌株B3具有较好的脱氮能力。据研究表明, 不同碳氮比以及碳源会影响氮素转化途径的不同, 在实验过程中发现, C/N=5时会产NH4+-N, 因此对于B3的氮素转化途径的选择机制, 会进一步探究。
| 底物 | 初始TN/(mg/L) | 溶解态最终TN/(mg/L) | 胞内氮/% | 氮损失/% | ||||
| NO3--N | NO2--N | NH4+-N | 有机氮 | |||||
| 好氧 | 硝酸盐 | 108.043 | 0 | 0 | 0.468 | 5.115 | 20.11 | 74.72 |
| 厌氧 | 硝酸盐 | 108.043 | 0 | 0 | 0.527 | / | 26.65 | 72.86 |
(1) 从海水螺旋藻培养体系中分离获得一株嗜碱兼性好氧反硝化菌B3, 鉴定为海杆菌属, 记为Marinobacter sp. B3。保藏号为NO.25998, 该海杆菌是具有较好脱氮能力的反硝化菌。
(2) 通过对单因素影响实验中设置不同的DO、pH、C/N、温度, 观察不同环境条件下海杆菌B3的脱氮效率及生长影响, 实验结果表明: 海杆菌B3在振荡速度150 r/min, pH=8.0±0.2, C/N=10, 温度在35 ℃条件下脱氮效率最高, 生长较快。
(3) 最优条件下, 海杆菌B3在好氧环境和厌氧环境下, 72 h的NO3--N去除率均为100%, TN去除率分别为94.83%和99.18%, DOC去除率分别为95.13%和92.07%, 且无NO2--N和NH4+-N积累。海杆菌B3在好氧和厌氧条件下都能进行反硝化脱氮, 且好氧条件下, NO3--N去除能力更强。
(4) 以硝酸钾作为唯一氮源, 氮平衡实验得出: 好氧环境下, 20.11%的NO3--N转化为胞内氮, 74.72%转化为N2排出, 5.583 mg/L的NO3--N转化为其他形态的氮(NO2--N、NH4+-N和有机氮); 厌氧环境下, 26.65%的NO3--N转化为胞内氮, 72.86%的NO3--N变为N2释放。海杆菌B3具有较强脱氮性能, 在海水工厂化循环水养殖尾水处理方面具有良好的应用潜力。
丁欣, 2022. 用于烟气脱硝的耐汞好氧反硝化菌LV3的脱氮特性及耐汞机理研究[D]. 太原: 太原理工大学.
|
丁晓宇, 卢兴顺, 吕航, 等, 2022. 耐低温异养硝化-好氧反硝化菌的分离鉴定及脱氮特性[J]. 水处理技术, 48(12): 65-70, 76. |
于妍, 刘宁, 廖祖刚, 等, 2022. 铁型反硝化脱氮技术研究进展[J]. 中国环境科学, 42(1): 83-91. |
万雨轩, 王鑫, 2021. 废水处理中异化硝酸盐还原为铵的研究进展[J]. 土木与环境工程学报(中英文), 43(6): 134-144. |
马洪婧, 刘鹰, 慕欣廷, 等, 2022. 耐盐高效好氧反硝化菌Halomonas sp. HRL-11的分离鉴定及反硝化性能[J]. 大连海洋大学学报, 37(2): 227-234. |
王永刚, 王旭, 张俊娥, 等, 2017. 好氧反硝化细菌研究及应用进展[J]. 工业水处理, 37(2): 12-17. |
王娇, 林久淑, 王文鑫, 等, 2023. 耐盐好氧反硝化菌Marinobacter sp. strain B108的分离及脱氮特性[J]. 环境科学与技术, 46(8): 134-143. |
王彩蓄, 2022. 耐碱硝酸盐还原菌Pseudomonas sp. XS-18去除硝酸盐特性研究[D]. 哈尔滨: 东北农业大学.
|
巩有奎, 王淑莹, 王莎莎, 等, 2012. DO对短程反硝化过程中N2O产量的影响[J]. 中南大学学报(自然科学版), 43(1): 395-400. |
毕墨涵, 徐斐, 郭富成, 等, 2021. 响应面优化香蒲生物炭促进反硝化影响因素[J]. 环境科学与技术, 44(2): 97-103. |
朱建新, 刘慧, 程海华, 等, 2022. 工厂化循环水养殖技术研究与产业化发展[J]. 中国水产, (10): 41-49. |
刘明, 孙鹏, 张祥胜, 2013. 原油降解菌YSL28的分离鉴定及降解特性研究[J]. 东北农业大学学报, 44(5): 47-50. |
刘波文, 阳立平, 李海波, 等, 2022. SODP创新自养低碳绿色脱氮技术在餐厨废水中的应用研究[J]. 当代化工研究, (21): 92-94. |
刘函瑜, 2022. 农业开垦的泥炭地土壤氨氧化过程研究[D]. 长春: 东北师范大学.
|
孙雪梅, 李秋芬, 张艳, 等, 2012. 一株海水异养硝化-好氧反硝化菌系统发育及脱氮特性[J]. 微生物学报, 52(6): 687-695. |
李雪, 刘思彤, 陈倩, 2018. 一株好氧反硝化菌的鉴定及脱氮特性研究[J]. 北京大学学报(自然科学版), 54(6): 1276-1282. |
杨婷, 辛瑜, 时祎, 等, 2022. 好氧反硝化芽孢杆菌JD-014的分离鉴定及脱氮性能[J]. 食品与生物技术学报, 41(1): 68-76. |
张进, 叶坚, 彭焕龙, 等, 2018. 1株耐受Cu2+好氧反硝化菌及其饥饿特性[J]. 环境科学与技术, 41(S2): 43-50. |
张峰峰, 周可, 谢凤行, 等, 2019. 一株异养硝化菌AD-28氨氮去除特性研究[J]. 水产科学, 38(1): 92-97. |
张淑楠, 王心义, 夏大平, 2015. 初始pH值对微生物反硝化的影响[J]. 环境工程, 33(S1): 67-71. |
周星煜, 张金松, 2022. 活性污泥反硝化速率与功能基因活性关联分析[J]. 给水排水, 58(S1): 711-717. |
晏俊伟, 2021. 菌株Cupriavidus oxalaticus T2同步脱氮除酚特性及代谢机制研究[D]. 广州: 华南理工大学.
|
郭超, 尹辉, 范奎, 等, 2020. 一株好氧反硝化菌的分离鉴定及脱氮特性研究[J]. 安全与环境工程, 27(4): 41-47. |
唐婧, 肖亚男, 屈姗姗, 等, 2014. 一株耐盐好氧反硝化细菌的分离鉴定及其脱氮特性[J]. 环境工程学报, 8(12): 5499-5506. |
黄锐, 宋云杰, 田亮, 等, 2022. 厌氧氨氧化耦合反硝化工艺研究进展[J]. 环境科学与技术, 45(3): 212-222. |
蒋欣燃, 2017. 厌氧反硝化细菌的分离鉴定及其对水产养殖废水脱氮作用的初步研究[D]. 大连: 大连海洋大学.
|
魏荷芬, 韩保安, 王田野, 等, 2016. 一株荧光假单胞杆菌的分离鉴定与反硝化特性[J]. 微生物学通报, 43(8): 1679-1689. |
CHEN Z, JIANG Y L, CHANG Z Q, et al, 2020. Denitrification characteristics and pathways of a facultative anaerobic denitrifying strain, Pseudomonas denitrificans G1[J]. Journal of Bioscience and Bioengineering, 129(6): 715-722. DOI:10.1016/j.jbiosc.2019.12.011 |
HU X F, SU J F, AIL A, et al, 2021. Heterotrophic nitrification and biomineralization potential of Pseudomonas sp. HXF1 for the simultaneous removal of ammonia nitrogen and fluoride from groundwater[J]. Bioresource Technology, 323: 124608. DOI:10.1016/j.biortech.2020.124608 |
JOO H S, HIRAI M, SHODA M, 2005. Characteristics of ammonium removal by heterotrophic nitrification-aerobic denitrification by Alcaligenes faecalis No. 4[J]. Journal of Bioscience and Bioengineering, 100(2): 184-191. DOI:10.1263/jbb.100.184 |
LI B, LV R, XIAO Y, et al, 2019. A novel nitrite-base aerobic denitrifying bacterium Acinetobacter sp. YT03 and its transcriptome analysis[J]. Frontiers in Microbiology: 10. |
LIU S Y, DAI J C, WEI H H, et al, 2021. Dissimilatory nitrate reduction to ammonium (DNRA) and denitrification pathways are leveraged by cyclic AMP receptor protein (CRP) paralogues based on electron donor/acceptor limitation in Shewanella loihica PV-4[J]. Applied and Environmental Microbiology, 87(2): e01964-20. |
REN J L, MA H J, LIU Y, et al, 2021. Characterization of a novel marine aerobic denitrifier Vibrio spp. AD2 for efficient nitrate reduction without nitrite accumulation[J]. Environmental Science and Pollution Research International, 28(24): 30807-30820. DOI:10.1007/s11356-021-12673-8 |
WANG X J, YE C S, ZHANG Z J, et al, 2018. Effects of temperature shock on N2O emissions from denitrifying activated sludge and associated active bacteria[J]. Bioresource Technology, 249: 605-611. DOI:10.1016/j.biortech.2017.10.070 |
WU Z D, HUANG S B, YANG Y L, et al, 2013. Isolation of an aerobic denitrifying bacterial strain from a biofilter for removal of nitrogen oxide[J]. Aerosol and Air Quality Research, 13(3): 1126-1132. DOI:10.4209/aaqr.2012.07.0199 |
 2024, Vol. 55
2024, Vol. 55


