
中国海洋湖沼学会主办。
文章信息
- 薛彬, 李磊, 蒋丽勤, 张佳奇, 戴乾, 王君. 2024.
- XUE Bin, LI Lei, JIANG Li-Qin, ZHANG Jia-Qi, DAI Qian, WANG Jun. 2024.
- 基于稳定同位素的枸杞岛海藻场鱼类群落营养结构特征
- NUTRIENT STRUCTURE CHARACTERISTICS OF FISH COMMUNITY IN SEAWEED BEDS OF GOUQI ISLAND, ZHOUSHAN BASED ON STABLE ISOTOPE ANALYSIS
- 海洋与湖沼, 55(2): 431-440
- Oceanologia et Limnologia Sinica, 55(2): 431-440.
- http://dx.doi.org/10.11693/hyhz20231200279
文章历史
-
收稿日期:2023-12-27
收修改稿日期:2024-01-21
2. 中国水产科学研究院东海水产研究所 农业农村部海洋与河口渔业资源及生态重点开放实验室 上海 200090;
3. 浙江海洋大学 浙江舟山 316022
2. East China Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Key Laboratory of Marine and Estuarine Fisheries Resources and Ecology, Ministry of Agriculture and Rural Affairs, Shanghai 200090, China;
3. Zhejiang Ocean University, Zhoushan 316022, China
生态学研究中, 群落结构特征分析是衡量群落是否发生演替的重要基础。传统群落结构的研究方法一般基于物种组成、丰富度等基本指数, 群落中物种和功能群在不同的时空尺度上是不断变化的, 而这些变化并不能说明群落生态系统的稳定性发生了改变(Sheaves, 2006)。为了描述群落结构特征的变化, 可以通过食物网的能量流动和物质循环来分析群落营养结构的稳定性(Lindeman, 1942; Bersier et al, 2002; Kaartinen et al, 2012)。
食物网表现为物种与物种之间的营养关系, 其变动直接影响种群和群落的结构和动态(Paine, 1980; Polis et al, 1996)。研究鱼类的食性是理解其营养关系的第一步, 传统鱼类食性的研究方法是胃含物分析, 但其存在着鉴定难度大、结果不准确等缺点, 难以反映鱼类长期摄食和同化食物的综合信息(张波, 2005)。稳定同位素分析方法可以提供物种长期积累的营养数据, 生物的碳稳定同位素可以指示其食物来源, 氮稳定同位素可以准确定位生物在食物网中的营养位置, 能够便捷准确地反映各物种的营养信息(Michener et al, 1994), 基于稳定同位素的分析方法逐渐成为食物网营养结构研究的重要手段(Fry, 2006)。由于生物组织中的各稳定同位素比值能代表生物与环境的多维空间信息, 所以将由各个稳定同位素比值为坐标所组成的“δ-空间”定义为同位素生态位(isotopic niche) (Post, 2002; West et al, 2006; Newsome et al, 2007)。目前应用最多的是由δ13C-δ15N值双坐标图(bi-plots)组成的双维空间生态位(Layman et al, 2007; Schmidt et al, 2007; Turner et al, 2010)。Layman等(2007)提出了一种基于稳定同位素分析的定量描述群落营养结构的方法, 在碳氮稳定同位素比值所构建的二维空间中, 散点即可表示该物种在群落中的营养生态位, 各点之间的标准距离可以反映群落的营养宽度和食源多样性, 坐标间的相对位置可以表示群落内的营养冗余程度。目前, 该方法广泛应用到连续营养谱构建(蔡德陵等, 2005)和食物网营养结构分析(王荦等, 2017; 谢斌等, 2017), 在珊瑚礁(朱文涛等, 2020)、红树林(王瑁等, 2015)和海草床(章守宇等, 2007)等典型生态系统食物网分析方面发挥了巨大的作用。
枸杞岛是位于舟山群岛东北部一个亚热带岩礁型岛屿, 其近岸海域分布有大量的以铜藻(Sargassum horneri)和瓦氏马尾藻(Sargassum vachellianum)等大型藻类为支撑的海藻场(章守宇等, 2018), 海藻场内营养盐丰富、水质状况良好, 为褐菖鲉(Sebastiscus marmoratus)等岩礁性鱼类和小黄鱼等(Larimichthys polyactis)等众多经济洄游性鱼类的幼体提供了良好的索饵、栖息和繁殖场所(Matich et al, 2017)。近年来, 随着全球气温的持续上升、当地贻贝养殖规模的不断扩大及依托岛礁沿岸水域开展的海钓等海岛旅游业的持续发展, 使得枸杞岛及周边海域的生态环境承受巨大的压力, 导致岛礁沿岸的大型海藻资源量减少和海藻场规模减小(章守宇等, 2018), 直接影响鱼类的种类和数量, 导致整个生态群落营养结构发生变化(刘勇等, 2015)。本研究以枸杞岛近岸海域主要鱼类为研究对象, 应用稳定同位素分析的方法, 分析了枸杞岛近岸海藻场主要鱼类群落营养结构的季节变化, 以期为完善枸杞岛近岸海域食物网结构的研究, 为岛礁近岸海藻场鱼类群落结构变化的研究提供依据, 也为海藻场的生态修复提供一定的基础资料。
1 材料与方法 1.1 调查地点和时间分别于枸杞岛海藻场的衰退期(11~2月)和茂盛期(5~8月)在岛礁近岸的断桥(St.1)、后头湾(St.2)、黄石洞(St.3)、龙泉(St.4)、里西(St.5)和大王(St.6)六个站位点进行了样品采集工作(图 1)。
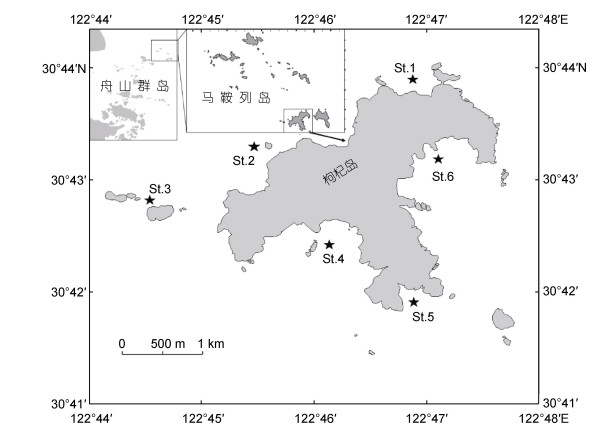 |
| 图 1 研究区地理位置和采样站点 Fig. 1 Location of the Gouqi Island and sampling station |
在枸杞岛近岸海藻场用三层流刺网(网长15 m, 内网目大26 mm, 外两层为210 mm)和当地渔民的蟹笼等工具采集鱼类和虾、蟹类生物样品。在实验室内对采集到的鱼类的进行体长和体质量等生物学测量, 并取其背部肌肉组织进行碳、氮稳定同位素测定。
用浅水I型浮游生物网(505 μm)采集桡足类等浮游动物, 用抄网采集附着在大型海藻等物体上的钩虾和麦秆虫等端足类。将浮游动物和端足类等样品去除杂质置于预先经0.45 μm滤膜过滤的海水中暂养2~4 h, 待胃排空后取样。钩虾、麦秆虫等有壳的小型甲壳类取整体用10% HCl酸化处理, 直至没有气泡产生。
所有样品置于60 ℃的烘箱中烘48 h至恒重, 然后用石英钵研磨成粉, 经165 μm的筛绢过筛后收集于样品瓶中, 然后置于干燥器中保存待同位素分析。
1.3 稳定同位素测试所有样品的稳定碳、氮同位素比值的测定通过同位素质谱仪(Isotope Ratio Mass Spectrometer)来完成。同位素丰度的计算方法为
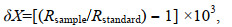 (1)
(1)式中, X=13C或15N, R=13C/12C或15N/14N。δ13C值的测定精度 < ±0.1‰, δ15N值的测定精度 < ±0.2‰。
1.4 数据处理与分析根据主要鱼类的摄食习性和端足类随海藻的变动, 将主要鱼类的饵料生物分为鱼类、虾类、蟹类、浮游动物、麦秆虫和钩虾等五大类。根据Layman等(2007)提出的群落营养结构计算方法, 以δ13C和δ15N稳定同位素值为横纵坐标构建二维坐标系来代表群落的营养生态位, 并计算群落的营养范围指标。本文选取了五个度量参数, 分别为: (1) δ13C差值(δ13C difference, CR): 群落所有物种δ13C的最大值和最小值的差值, 表示摄食来源多样性水平, 即基础食物来源。(2) δ15N差值(δ15N difference, NR): 群落所有物种δ13N的最大值和最小值的差值, 表示营养层次多样性水平, 即营养级长度。(3) 凸多边形总面积(total area, TA): 二维坐标系中, 所有物种所代表的坐标点组成的凸边型面积, 表示食物网中营养多样性的总程度, 即生态位总空间。(4) 标准椭圆面积(standard ellipse area, SEAc): 所有物种所代表的坐标点组成的椭圆面积, 对TA的校正, 表示生物对生态空间的利用情况, 即核心生态位空间。(5) 平均离心距离(mean distance to centroid, CD): 每一个物种所代表的坐标点到碳氮稳定同位素双位图重心的平均欧氏距离, 表示食物网中营养多样性平均水平, 即营养多样性。这5种参数(NR、CR、TA、SEAc和CD)可以反映营养结构的多样性。利用IsoSource多源模型分析了各饵料生物类群对主要鱼类的食源贡献。采用Excel 2019和Spss 26对数据进行统计分析, 通过R3.6.3软件的SIBER包进行参数计算, 利用Excel 2019和Origin 9.1软件进行图表的制作。
2 结果与分析 2.1 主要鱼类的碳氮稳定同位素比值在对枸杞岛海藻场不同时期(衰退期和茂盛期)的拖网调查中, 采集到主要鱼类种类共29种, 隶属于8目19科25属, 体长(全长)范围在4.6~48.7 cm, 除鲻鱼(Mugil cephalus Linnaeus)外, 其他鱼类的平均体长均小于30 cm。
稳定同位素结果显示, 海藻场茂盛期(春、夏季), 枸杞岛近岸海域鱼类的δ13C值范围为–20.4‰ ~ –12.8‰, 均值为–16.1‰, 其中丝背细磷鲀(Stephanolepis cirrhifer) 的值最大, 青鳞小沙丁鱼(Sardinella zunasi)的最小; δ15N值范围为4.1‰~10.4‰, 均值为8.4‰, 其中黄姑鱼(Nibea albiflora)的值最大, 赤鼻棱鳀(Thryssa kammalensis)的最小。海藻场衰退期(秋、冬季), 枸杞岛近岸海域鱼类的δ13C值范围为–17.9‰~–14.4‰, 均值为–16.1‰, 其中斑鳍天竺鲷(Apogon carinatus)的值最大, 赤鼻棱鳀(Thryssa kammalensis)的最小。δ15N值范围为7.6‰~12.9‰, 均值为9.7‰, 其中黑鲷(Sparus macrocephalus)的值最大, 大泷六线鱼(Hexagrammos otakii Jodan et Starks)的最小(表 1)。
| 种类 | 样本量 | δ13C/‰ | δ15N/‰ | 体长/mm |
| 鲱形目 Clupeiformes | ||||
| 鲱科 Clupddae | ||||
| 斑鰶 Konosirus punctatus | 1 | –17.2 | 9.6 | 225.8 |
| 青鳞小沙丁鱼 Sardinella zunasi | 5 | –17.6±1.5 | 9.2±0.9 | 138.5±21.3 |
| 鳀科 Engraulidae | ||||
| 赤鼻棱鳀 Thryssa kammalensis | 3 | –18.5±1.4 | 9.3±4.2 | 98.9±31.3 |
| 康氏公鱼属 Stolephorus | 1 | –17.9 | 7.8 | 71.9 |
| 鲇形目 Silluriformes | ||||
| 海鲶科 Ariidae | ||||
| 海鲇 Arius thalassinus | 1 | –15.7 | 9.8 | 244.8 |
| 灯笼鱼目 Myctophiformes | ||||
| 狗母鱼科 Synodontidae | ||||
| 长蛇鲻 Saurida elongata | 1 | –15.7 | 11.3 | 216.0 |
| 鳗鲡目 Anguilliformes | ||||
| 康吉鳗科 Congridae | ||||
| 星康吉鳗 Conger myriaster | 5 | –15.4±1.1 | 9.8±0.3 | 169.7±47.8 |
| 鲻形目 Mugiliformes | ||||
| 鲻科 Mugilidae | ||||
| 鲻鱼 Mugil cephalus Linnaeus | 7 | –17.3±2.8 | 10.2±3.3 | 258.2±154.3 |
| 马鲅科 Polynemidae | ||||
| 四指马鲅 Eleutheronema tetradactylum | 4 | –16.9±0.3 | 10.6±0.5 | 214.9±69.3 |
| 鲈形目 Perciformes | ||||
| 天竺鲷科 Apogonidae | ||||
| 斑鳍天竺鲷 Apogon carinatus | 1 | –14.3 | 9.2 | 120.0 |
| 石首鱼科 Sciaenidae | ||||
| 皮氏叫姑鱼 Johnius belengerii | 4 | –16.8±0.9 | 10.2±0.3 | 136.2±25.6 |
| 黄姑鱼 Nibea albiflora | 12 | –15.8±0.6 | 10.6±0.4 | 232.5±50.1 |
| 棘头梅童鱼 Collichthys lucidus | 3 | –17.6±0.1 | 7.9±0.4 | 93.9±1.8 |
| 小黄鱼 Larimichthys polyactis | 15 | –16.6±0.5 | 9.4±0.3 | 172.4±33.9 |
| 鮸鱼 Miichthys miiuy | 2 | –15.5±0.1 | 10.2±0.1 | 295.4±86.9 |
| 隆头鱼科 Labridae | ||||
| 花鳍副海猪鱼 Parajulis poecilepterus | 3 | –15.3±0.4 | 8.2±0.3 | 129.6±30.8 |
| 鲷科 Sparidie | ||||
| 黑鲷 Sparus macrocephalus | 1 | –15.6 | 12.8 | 170.1 |
| 日本鲭 Scomber japonicus | 1 | –16.7 | 6.8 | 152.8 |
| 颌针鱼目 Beloniformes | ||||
| 飞鱼科 Exocoetidae | ||||
| 尖头文鳐鱼 Hirundichthys oxycephalus | 1 | –16.9 | 9.2 | 284.1 |
| 鲉形目 Scorpaeniformes | ||||
| 鲉科 Scorpaenidae | ||||
| 褐菖鲉 Sebastiscus marmoratus | 19 | –15.3±0.5 | 8.1±1.4 | 122.7 ±36.1 |
| 六线鱼科 Hexagrammidae | ||||
| 大泷六线鱼 Hexagrammos otakii Jodan et Starks | 4 | –15.3±0.1 | 8.1 ±0.7 | 160.1±18.5 |
| 斑头鱼 Agrammus agrammus | 6 | –15.8±0.6 | 8.2±0.8 | 156.8±40.1 |
| 鲽形目 Pleuronectiformes | ||||
| 牙鲆科 Paralichthyidae | ||||
| 褐牙鲆 Paralichthys olivaceus | 5 | –15.7±0.4 | 8.2±0.6 | 203.8±30.4 |
| 鳎科 Soleidae | ||||
| 带纹条鳎 Zebrias zebra | 4 | –15.2±0.2 | 8.2±0.6 | 114.2±43.7 |
| 舌鳎科 Cynoglossidae | ||||
| 短吻三线舌鳎 Cynoglossus abbreviatus | 1 | –15.3 | 9.4 | 162.1 |
| 半滑舌鳎 Cynoglossus semilaevis | 1 | –15.7 | 9.1 | 179.1 |
| 日本须鳎 Paraplagusia japonica | 2 | –14.8±0.1 | 9.3±0.4 | 146.1±134.5 |
| 鲀形目 Tetraodontiformes | ||||
| 单角革鲀科Monacanthidae | ||||
| 丝背细鳞鲀 Stephanolepis cirrhifer | 1 | –12.8 | 9.1 | 92.1 |
| 鲀科Tetraodontidae | ||||
| 黄鳍东方鲀 Takifugu xanthopterus | 1 | –14.7 | 8.4 | 138.0 |
海藻场不同时期主要鱼类和饵料生物的稳定同位素组成存在差异(表 2)。在海藻场茂盛期, 主要鱼类的δ13C处于–17.2‰~–14.7‰的范围, 星康吉鳗的δ13C最大, 皮氏叫姑鱼的δ13C值最小; 主要鱼类的δ15N处于7.3‰~10.4‰的范围, 黄姑鱼的δ15N最大, 褐菖鲉的δ15N最小。饵料生物大类的δ13C处于–17.3‰~–14.4‰的范围, 蟹类的δ13C最大, 麦秆虫的δ13C最小; 饵料生物大类的δ15N处于3.3‰~9.1‰的范围, 虾类的δ15N最大, 麦秆虫的δ15N最小。
| 物种 | 海藻场茂盛期 | 海藻场衰退期 | |||||
| δ13C/(‰) | δ15N/(‰) | 样本数 | δ13C/(‰) | δ15N/(‰) | 样本数 | ||
| 黄姑鱼 Nibea albiflora | –15.7±0.2 | 10.4±0.5 | 2 | –16.1±0.7 | 10.7±0.5 | 10 | |
| 皮氏叫姑鱼 Johnius belengerii | –17.2±0.2 | 10.2±0.3 | 2 | –16.5±1.1 | 10.2±0.3 | 2 | |
| 星康吉鳗 | –14.7±0.0 | 9.5±0.1 | 2 | –15.9±1.3 | 10.1±0.5 | 3 | |
| 褐牙鲆 | –16.1±0.5 | 8.4±0.5 | 3 | –15.7±0.3 | 7.9±0.7 | 2 | |
| 褐菖鲉 | –15.9±1.2 | 7.3±1.9 | 16 | –15.4±0.4 | 8.2±0.5 | 14 | |
| 斑头六线鱼 | –15.7±0.5 | 7.8±0.7 | 3 | –16.2±0.7 | 8.5±1.1 | 3 | |
| 大泷六线鱼 | –15.4±0.2 | 8.9±0.2 | 2 | –15.4±0.1 | 7.6±0.4 | 2 | |
| 鱼类 | –15.6±0.8 | 8.2±1.3 | 32 | –15.5±0.7 | 8.4±0.6 | 20 | |
| 虾类 | –15.2±0.4 | 9.1±0.8 | 22 | –15.1±0.8 | 8.1±0.8 | 6 | |
| 蟹类 | –14.4±1.1 | 7.1±1.9 | 20 | –14.8±0.5 | 7.9±0.4 | 7 | |
| 麦秆虫 | –17.3±1.1 | 3.3±0.1 | 4 | –17.9±1.0 | 2.8±1.1 | 3 | |
| 钩虾 | –15.7±1.2 | 4.1±2.3 | 4 | –15.8±1.2 | 4.3±1.2 | 5 | |
在海藻场衰退期, 主要鱼类的δ13C处于–16.5‰~ –15.4‰的范围, 褐菖鲉的δ13C最大, 皮氏叫姑鱼的δ13C值最小; 主要鱼类的δ15N处于7.6‰~10.7‰的范围, 黄姑鱼的δ15N最大, 大泷六线鱼的δ15N最小。饵料生物大类的δ13C处于–17.9‰~–14.8‰的范围, 蟹类的δ13C最大, 麦秆虫的δ13C最小; 饵料生物大类的δ15N处于2.8‰~8.4‰的范围, 鱼类的δ15N最大, 麦秆虫的δ15N最小。
2.3 基于IsoSource混合模型计算潜在碳源对各消费者的贡献率基于IsoSource混合模型计算了海藻场不同时期鱼类、虾类、蟹类等潜在食源对主要鱼类食源贡献的中值(表 3)。
| 季节 | 种类 | 各种类碳源占比/% | |||||
| 鱼类 | 虾类 | 蟹类 | 浮游动物 | 麦秆虫 | 钩虾 | ||
| 茂盛期 | 黄姑鱼 | 6.0 | 60.0 | — | 34.0 | — | — |
| 皮氏叫姑鱼 | 18.0 | 26.2 | 1.0 | 53.6 | 0.9 | 0.3 | |
| 星康吉鳗 | 22.4 | 22.9 | 12.8 | — | 27.3 | 14.7 | |
| 褐牙鲆 | 12.4 | 11.0 | 11.8 | 33.9 | 19.8 | 11.2 | |
| 褐菖鲉 | 3.8 | 3.1 | 5.9 | 12.5 | 45.9 | 28.8 | |
| 斑头六线鱼 | 6.2 | 5.3 | 7.9 | 15.2 | 42.4 | 22.9 | |
| 大泷六线鱼 | 14.0 | 12.4 | 16.3 | 14.3 | 24.6 | 18.5 | |
| 衰退期 | 黄姑鱼 | 2.0 | 54.0 | — | 44.0 | — | — |
| 皮氏叫姑鱼 | 19.6 | 34.3 | 0.9 | 43.9 | 0.9 | 0.4 | |
| 星康吉鳗 | 60.0 | — | — | — | 38.0 | 2.0 | |
| 褐牙鲆 | 8.0 | 6.8 | 10.7 | 14.5 | 35.2 | 24.8 | |
| 褐菖鲉 | 9.0 | 8.3 | 14.4 | 11.2 | 28.2 | 28.9 | |
| 斑头六线鱼 | 11.9 | 10.3 | 10.5 | 36.1 | 19.6 | 11.5 | |
| 大泷六线鱼 | 3.5 | 3.1 | 6.3 | 9.8 | 35.1 | 42.1 | |
在海藻场茂盛期, 麦秆虫和钩虾对岩礁性鱼类的合计食源贡献率较高, 其中对斑头六线鱼、褐菖鲉的合计食源贡献率都超过了55%, 对星康吉鳗、大泷六线鱼的合计食源贡献率超过了40%。而其中, 仅麦秆虫对褐菖鮋和斑头六线鱼的食源贡献率就超过了42%。浮游动物对皮氏叫姑鱼的食源贡献率达到了53.6%。
在海藻场衰退期, 鱼类、虾类和浮游动物对主要鱼类的食源贡献率有所提高, 褐菖鮋和斑头六线鱼的食物来源中, 麦秆虫的贡献率相对下降, 鱼类和虾类的贡献率相对上升, 星康吉鳗在海藻衰退期比茂盛期摄食鱼类的比例提高了37.6%。
2.4 主要鱼类群落结构的季节变化根据δ13C-δ15N值的双位图得出基于稳定同位素量化营养结构的群落范围指标及其时期变化(图 2), 枸杞岛近岸海藻场不同时期的鱼类营养结构存在差异(图 3)。海藻场茂盛期, CR和NR值分别为5.9和7.5, TA值约为2.0, CD值为1.4; 海藻场衰退期, CR和NR值分别为7.9和7.5, TA值约为8.5, CD值为2.7。枸杞岛近岸海藻场茂盛期主要鱼类群落生态位总空间、核心生态位空间、基础食物来源、营养多样性的值均大于衰退期, 但两个时期的营养长度相等。海藻场茂盛期位于多边形顶点的种类分别为赤鼻棱鳀、青鳞小沙丁、丝背细鳞鲀和黄姑鱼; 海藻场衰退期位于多边形顶点的种类分别为赤鼻棱鳀、棘头梅童鱼、黑鲷、斑鳍天竺鲷、红鳍天竺鲷、红鳍东方鲀和大泷六线鱼。
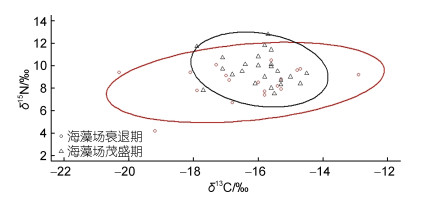 |
| 图 2 基于碳氮稳定同位素的枸杞岛近岸主要鱼类营养结构图 Fig. 2 Bi-plots based on stable isotope of common fishes in the offshore of Gouqi Island |
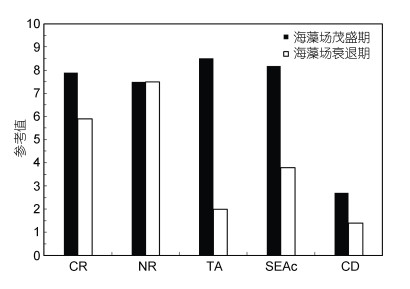 |
| 图 3 枸杞岛近岸主要鱼类群落参考值 Fig. 3 Reference value of common fish community in the offshore of Gouqi Island 注: CR: δ13C (‰)差值; NR: δ15N (‰)差值; TA: 凸多边形总面积; SEAc: 标准椭圆面积; CD: 平均离心距离 |
海藻场作为典型近岸海洋生态系统, 由支撑大型海藻构成的高空间异质性的生境, 为众多鱼类尤其是幼鱼提供了躲避空间和摄食场所, 具有重要的生物资源养护功能(Terazono et al, 2012; Tano et al, 2017; 章守宇等, 2019)。以铜藻和瓦氏马尾藻为支撑的枸杞岛海藻场, 为钩虾和麦秆虫等端足类提供了天然的附着场所, 同时浮游生物多样性也相对较大(王蕾, 2011), 为褐菖鲉等岩礁性鱼类和黄姑鱼等洄游鱼类提供了丰富的饵料生物来源(王凯等, 2012a)。
研究表明, 东山湾海域的褐菖鲉主要以短尾类(方蟹等)为食, 属于底栖动物食性(张雅芝等, 1993), 厦门东海域的褐菖鲉主要摄食长尾类(鼓虾、对虾)、磷虾类、短尾类、樱虾类、鱼类、口足类(虾蛄)和多毛类, 属于底栖生物和游泳动物食性(黄良敏等, 2008)。纪东平等(2014)研究发现荣成俚岛的大泷六线鱼主要以鱼类、多毛类、虾类等, 斑头鱼主要摄食多毛类(沙蚕)。表明褐菖鲉、大泷六线鱼和斑头鱼在不同的栖息环境的摄食种类有一定的差异。褐菖鲉、斑头六线鱼和大泷六线鱼是枸杞岛海藻场的优势种(王蕾等, 2011), 枸杞岛近岸3种生境鱼类群落组成, 主要摄食钩虾和麦秆虫(王凯等, 2012a, 2012b)。
黄姑鱼在海藻场茂盛期和衰退期均主要摄食虾类和浮游动物, 研究表明, 象山港海域黄姑鱼主要摄食虾类(林楠等, 2013), 枸杞岛沿岸区域的黄姑鱼主要摄食端足类和鱼类(王凯等, 2012b)。研究表明, 皮氏叫姑鱼主要摄食鱼类和虾类(李忠义等, 2009; 王凯等, 2012b), 本研究中皮氏叫姑鱼的主要食源是虾类和浮游动物, 这可能与不同的研究区域和季节有关系。星康吉鳗是典型的底层鱼类, 已有较多的学者研究了其摄食习性。张波等(2003)研究表明, 东、黄海的星康吉鳗主要摄食鱼类和虾类; 刘西方等(2015)研究表明, 海州湾星康吉鳗主要摄食鱼类、虾类和头足类; 刘鸿雁等(2018)研究表明, 崂山湾人工鱼礁区星康吉鳗主要摄食虾类、鱼类和头足类; 本研究中星康吉鳗的主要食源为鱼类、虾类和端足类。总体上, 星康吉鳗以鱼类和底栖虾类等为主, 不同海域星康吉鳗摄食种类存在差异, 与其栖息生境中的饵料生物供应有关。
本研究中, 海藻场茂盛期主要食源为端足类(麦秆虫和钩虾)、虾类和鱼类, 各食源间的贡献率相差不大; 而在衰退期主要食源为鱼类和端足类(麦秆虫), 其各食源间的贡献率存在较大的差异。海藻场衰退期大型海藻产生的碎屑为麦秆虫提供了丰富的饵料来源, 具有较大的生物量, 为星康吉鳗等鱼类提供了良好的饵料基础。褐牙鲆在海藻场茂盛期主要摄食浮游动物、麦秆虫、鱼类, 在衰退期主要摄食麦秆虫和钩虾, 其他饵料生物的食源贡献相对较小。
本研究基于碳稳定同位素分析了黄姑鱼等非海藻场定居性鱼类的食物来源, 与已有的通过胃含物分析得出的结论存在一定的差异, 主要存在两种可能的原因。一是鱼类摄食分析的方法存在差异, 基于胃含物分析主要反映了鱼类在采样较短时间尺度内的摄食情况, 而稳定同位素方法反映的是鱼类在较长一段时间的摄食情况(郭旭鹏等, 2007; 卢伙胜等, 2009); 二是与研究鱼类的栖息生境和季节有关, 相对于已有的研究报道, 海藻场作为一种特殊的生态系统类型, 在鱼类养护方面发挥重要作用。研究表明, 海藻场食物网主要通过碎屑食物链进行, 尤其是在大型海藻衰退阶段, 海藻分解产生的碎屑为麦秆虫等为主的端足类提供了丰富的饵料来源, 具有较大的生物量(刘书荣等, 2020), 为海藻场中的鱼类提供了良好的饵料基础, 对鱼类的食源贡献占较大的比例。
鱼类肌体的δ13C值会随栖息水层变化, 从中上层鱼类到底栖鱼类, 其δ13C值会增大(Davenport et al, 2002)。本研究中, 斑鰶、赤鼻棱鳀和青鳞小沙丁等中上层鱼类的δ13C值比星康吉鳗等底层鱼类的小, 反映了海藻场中不同栖息水层的鱼类产生了摄食分化, 这对降低海藻场鱼类间的食物竞争有重要的作用。
饵料生物的δ13C和δ15N比值的变化, 会通过捕食关系影响食物网的稳定同位素比值发生变化(颜云榕等, 2012; 麻秋云等, 2015)。本研究中, 不同季节饵料生物的δ15N比值没有显著性差异(P=0.496), 说明海藻场的不同阶段, 主要鱼类的饵料生物的营养级基本没有变化; 而δ13C比值具有显著的季节差异, 说明海藻场的茂盛和衰退对鱼类的营养贡献具有显著影响。
3.2 主要鱼类群落营养结构特征饵料生物多样性一定程度上反应了食物网结构的多样性, 本研究中海藻场茂盛期的CR值大于衰退期, 是因为海藻场茂盛期支撑了更高的生物多样性(章守宇等, 2007), 鱼类的食源多样性更大。枸杞岛近岸海藻场的NR无明显季节变化, 表示营养多样性平均水平CD值也无变化, 一定程度上表明枸杞岛海藻场主要鱼类具有相对稳定的食物网结构和营养多样性水平。海藻场茂盛期的TA (8.5)远远大于海藻场衰退期的TA (2.0), 表明海藻场茂盛期的群落营养结构总程度大于衰退期。
在鱼类营养结构图中, 位于多边形顶点的鱼种对于整个群落的营养结构具有重要的作用, 它们的缺失会引起CR、NR和TA这些度量参数的变化, 从而改变群落的营养结构(石焱等, 2018)。
在枸杞岛近岸营养结构图中, 位于多边形顶点的鱼类主要有三类: 黄姑鱼、黑鲷、大泷六线鱼等高级捕食者, 青鳞小沙丁、赤鼻棱鳀、棘头梅童鱼等群落关键种, 食底栖动物的黄鳍东方鲀、丝背细鳞鲀、斑鳍天竺鲷等。枸杞岛海藻场不同时期营养结构的差异, 反映了不同生态习性鱼类对海藻场利用策略的不同, 尤其是对于小黄鱼、黄姑鱼、鲻鱼和赤鼻棱鳀等具有季节洄游性的种类而言(王蕾等, 2011)。赤鼻棱鳀、青鳞小沙丁和丝背细鳞鲀等在海藻场茂盛期聚集到近岸水域进行索饵和繁殖等, 此时海藻场主要鱼类的营养结构由上述洄游性较强的上层浮游生物食性鱼类和底栖生物食性的鱼类等构成(王蕾等, 2011)。而在海藻场衰退期常见的鱼类主要是褐菖鲉等定居性种类, 营养结构主要由鱼类和底栖生物等食性的种类构成(汪振华等, 2013)。
从食物网组成的角度来看, 不同生态习性的鱼类是海藻场鱼类群落的重要组成部分, 对于群落结构有着维持稳定性的作用。因此, 在对枸杞岛海藻场的鱼类群落研究时, 应基于藻场生态系统的变化, 尽可能地关注不同生态习性鱼类对海藻场利用方式及其对渔业资源合理开发和持续利用的关系。
4 结论(1) 褐菖鲉、大泷六线鱼和斑头鱼是枸杞岛海藻场的优势种, 主要摄食钩虾和麦秆虫等端足类, 在不同栖息环境的摄食种类有一定差异。
(2) 中上层鱼类的δ13C值小于底层鱼类, 不同季节饵料生物的δ15N比值没有显著性差异, 说明海藻场的不同阶段, 主要鱼类的饵料生物的营养级基本没有变化; 而δ13C比值具有显著的季节差异, 说明海藻场的茂盛和衰退对鱼类的营养贡献具有显著影响。
(3) 枸杞岛海藻场茂盛期支撑了更高的生物多样性, 茂盛期CR值大于衰退期。NR值和CD值在一定程度上表明主要鱼类具有相对稳定的食物网结构和营养多样性水平。
(4) 枸杞岛海藻场茂盛期主要鱼类的营养结构由洄游性较强的上层浮游生物食性鱼类和底栖生物食性鱼类构成, 而衰退期营养结构主要由鱼类和底栖生物等食性的种类构成。
王凯, 章守宇, 汪振华, 等, 2012a. 马鞍列岛海域皮氏叫姑鱼渔业生物学初步研究[J]. 水产学报, 36(2): 228-237. |
王凯, 章守宇, 汪振华, 等, 2012b. 枸杞岛岩礁生境主要鱼类的食物组成及食物竞争[J]. 应用生态学报, 23(2): 536-544. |
王荦, 杜双成, 杨婷越, 等, 2017. 应用稳定同位素技术评价大连近岸海域食物网营养结构[J]. 生态学杂志, 36(5): 1452-1457. |
王瑁, 高雪芹, 丁弈朋, 等, 2015. 海南清澜港不同栖息位置红树林软体动物的食物来源[J]. 湿地科学, 13(2): 171-176. |
王蕾, 2011. 枸杞岛海藻场生态系统与鱼类群落季节变化的关系[D]. 上海: 上海海洋大学.
|
王蕾, 章守宇, 汪振华, 等, 2011. 枸杞岛近岸3种生境鱼类群落组成及岩礁区底栖海藻对鱼类群落结构的影响[J]. 水产学报, 35(7): 1037-1049. |
石焱, 何雄波, 李军, 等, 2018. 基于稳定同位素方法的闽江口常见鱼类群落营养结构的季节性变化[J]. 应用生态学报, 29(10): 3457-3463. |
卢伙胜, 欧帆, 颜云榕, 等, 2009. 应用氮稳定同位素技术对雷州湾海域主要鱼类营养级的研究[J]. 海洋学报, 31(3): 167-174. |
朱文涛, 秦传新, 马鸿梅, 等, 2020. 大亚湾珊瑚礁生态系统简化食物网的稳定同位素[J]. 水产学报, 44(7): 1112-1123. |
刘书荣, 周曦杰, 崔潇, 等, 2020. 贻贝筏式养殖区海藻群落对两类代表性藻栖端足目种群特征的影响[J]. 水产学报, 44(3): 461-468. |
刘西方, 刘贺, 薛莹, 等, 2015. 海州湾星康吉鳗的摄食生态特征[J]. 中国水产科学, 22(3): 517-527. |
刘勇, 程家骅, 2015. 东海、黄海秋季渔业生物群落结构及其平均营养级变化特征初步分析[J]. 水产学报, 39(5): 691-702. |
刘鸿雁, 孙彤彤, 曾晓起, 等, 2018. 崂山湾人工鱼礁区星康吉鳗摄食生态及食物网结构[J]. 应用生态学报, 29(4): 1339-1351. |
纪东平, 卞晓东, 宋娜, 等, 2014. 荣成俚岛大泷六线鱼摄食生态研究[J]. 水产学报, 38(9): 1399-1409. |
李忠义, 戴芳群, 左涛, 等, 2009. 长江口及南黄海水域秋季小黄鱼与皮氏叫姑鱼的食物竞争[J]. 水生态学杂志, 2(2): 67-72. |
汪振华, 赵静, 王凯, 等, 2013. 马鞍列岛岩礁生境鱼类群落结构时空格局[J]. 生态学报, 33(19): 6218-6226. |
张波, 2005. 中国近海食物网及鱼类营养动力学关键过程的初步研究[D]. 青岛: 中国海洋大学: 84-85.
|
张波, 唐启升, 2003. 东、黄海六种鳗的食性[J]. 水产学报, 27(4): 307-314. |
张雅芝, 李福振, 郭长春, 1993. 东山湾褐菖鲉食性研究[J]. 台湾海峡, 12(3): 233-241. |
林楠, 姜亚洲, 袁兴伟, 等, 2013. 象山港黄姑鱼的食物组成与摄食习性[J]. 中国水产科学, 20(6): 1284-1292. |
郭旭鹏, 李忠义, 金显仕, 等, 2007. 采用碳氮稳定同位素技术对黄海中南部鳀鱼食性的研究[J]. 海洋学报, 29(2): 98-104. |
黄良敏, 张雅芝, 潘佳佳, 等, 2008. 厦门东海域鱼类食物网研究[J]. 台湾海峡, 27(1): 64-73. |
麻秋云, 韩东燕, 刘贺, 等, 2015. 应用稳定同位素技术构建胶州湾食物网的连续营养谱[J]. 生态学报, 35(21): 7207-7218. |
章守宇, 向晨, 周曦杰, 等, 2018. 枸杞岛海藻场6种大型海藻光合荧光特性比较[J]. 应用生态学报, 29(10): 3441-3448. |
章守宇, 刘书荣, 周曦杰, 等, 2019. 大型海藻生境的生态功能及其在海洋牧场应用中的探讨[J]. 水产学报, 43(9): 2004-2014. |
章守宇, 汪振华, 林军, 等, 2007. 枸杞岛海藻场夏、秋季的渔业资源变化[J]. 海洋水产研究, 28(1): 45-52. |
谢斌, 李云凯, 张虎, 等, 2017. 基于稳定同位素技术的海州湾海洋牧场食物网基础及营养结构的季节性变化[J]. 应用生态学报, 28(7): 2292-2298. |
蔡德陵, 李红燕, 唐启升, 等, 2005. 黄东海生态系统食物网连续营养谱的建立: 来自碳氮稳定同位素方法的结果[J]. 中国科学C辑: 生命科学, 35(2): 123-130. |
颜云榕, 张武科, 卢伙胜, 等, 2012. 应用碳、氮稳定同位素研究北部湾带鱼(Trichiurus lepturus)食性及营养级[J]. 海洋与湖沼, 43(1): 192-200. |
BERSIER L F, BANAŠEK-RICHTER C, CATTIN M F, 2002. Quantitative descriptors of food-web matrices[J]. Ecology, 83(9): 2394-2407. DOI:10.1890/0012-9658(2002)083[2394:QDOFWM]2.0.CO;2 |
DAVENPORT S R, BAX N J, 2002. A trophic study of a marine ecosystem off southeastern Australia using stable isotopes of carbon and nitrogen[J]. Canadian Journal of Fisheries and Aquatic Sciences, 59(3): 514-530. DOI:10.1139/f02-031 |
FRY B, 2006. Stable Isotope Ecology [M]. New York, USA: Springer: 1-308.
|
KAARTINEN R, ROSLIN T, 2012. High temporal consistency in quantitative food web structure in the face of extreme species turnover[J]. Oikos, 121(11): 1771-1782. DOI:10.1111/j.1600-0706.2012.20108.x |
LAYMAN C A, ARRINGTON D A, MONTAÑA C G, et al, 2007. Can stable isotope ratios provide for community-wide measures of trophic structure?[J]. Ecology, 88(1): 42-48. DOI:10.1890/0012-9658(2007)88[42:CSIRPF]2.0.CO;2 |
LINDEMAN R L, 1942. The trophic-dynamic aspect of ecology[J]. Ecology, 23(4): 399-417. DOI:10.2307/1930126 |
MATICH P, KISZKA J J, GASTRICH K R, et al, 2017. Trophic redundancy among fishes in an east African nearshore seagrass community inferred from stable-isotope analysis[J]. Journal of Fish Biology, 91(2): 490-509. DOI:10.1111/jfb.13354 |
MICHENER R H, SCHELL D M, 1994. Stable isotope ratios as tracers in marine aquatic food webs [M] // LAJTHA K, MICHENER R H. Stable Isotopes in Ecology and Environmental Science. Oxford: Blackwell: 138-157.
|
NEWSOME S D, DEL RIO C M, BEARHOP S, et al, 2007. A niche for isotopic ecology[J]. Frontiers in Ecology and the Environment, 5(8): 429-436. DOI:10.1890/1540-9295(2007)5[429:ANFIE]2.0.CO;2 |
PAINE R T, 1980. Food webs: linkage, interaction strength and community infrastructure[J]. The Journal of Animal Ecology, 49(3): 666-685. DOI:10.2307/4220 |
POLIS G A, WINEMILLER K O, 1996. Food Webs: Integration of Patterns & Dynamics [M]. New York, USA: Springer: 1-464.
|
POST D M, 2002. Using stable isotopes to estimate trophic position: models, methods, and assumptions[J]. Ecology, 83(3): 703-718. DOI:10.1890/0012-9658(2002)083[0703:USITET]2.0.CO;2 |
SCHMIDT S N, OLDEN J D, SOLOMON C T, et al, 2007. Quantitative approaches to the analysis of stable isotope food web data[J]. Ecology, 88(11): 2793-2802. DOI:10.1890/07-0121.1 |
SHEAVES M, 2006. Scale-dependent variation in composition of fish fauna among sandy tropical estuarine embayments[J]. Marine Ecology Progress Series, 310: 173-184. DOI:10.3354/meps310173 |
TANO S A, EGGERTSEN M, WIKSTRÖM S A, et al, 2017. Tropical seaweed beds as important habitats for juvenile fish[J]. Marine and Freshwater Research, 68(10): 1921-1934. DOI:10.1071/MF16153 |
TERAZONO Y, NAKAMURA Y, IMOTO Z, et al, 2012. Fish response to expanding tropical Sargassum beds on the temperate coasts of Japan[J]. Marine Ecology Progress Series, 464: 209-220. DOI:10.3354/meps09873 |
TURNER T F, COLLYER M L, KRABBENHOFT T J, 2010. A general hypothesis-testing framework for stable isotope ratios in ecological studies[J]. Ecology, 91(8): 2227-2233. DOI:10.1890/09-1454.1 |
WEST J B, BOWEN G J, CERLING T E, et al, 2006. Stable isotopes as one of nature's ecological recorders[J]. Trends in Ecology & Evolution, 21(7): 408-414. |
 2024, Vol. 55
2024, Vol. 55


