
中国海洋湖沼学会主办。
文章信息
- 梁泽玮, 李伟业, 殷小龙, 徐羡, 孙闻婧, 王雪儿, 陈传悦, 廖智, 严小军, 张晓林. 2024.
- LIANG Ze-Wei, LI Wei-Ye, YIN Xiao-Long, XU Xian, SUN Wen-Jing, WANG Xue-Er, CHEN Chuan-Yue, LIAO Zhi, YAN Xiao-Jun, ZHANG Xiao-Lin. 2024.
- 温度对厚壳贻贝(Mytilus coruscus)鳃组织纤毛结构及摄食率的影响机制研究
- EFFECT OF TEMPERATURE ON FEEDING RATE AND GILL CILIA OF MYTILUS CORUSCUS
- 海洋与湖沼, 55(2): 471-478
- Oceanologia et Limnologia Sinica, 55(2): 471-478.
- http://dx.doi.org/10.11693/hyhz20231100257
文章历史
-
收稿日期:2023-11-28
收修改稿日期:2024-01-08
2. 浙江省舟山市水产研究所 浙江舟山 316000
2. Zhoushan Fisheries Research Institute, Zhejiang Province, Zhoushan 316000, China
适宜的温度是贝类摄食和生长发育的必要条件之一, 而贻贝养殖海域温度的不断升高是制约该产业高效发展的重要因素(韩国栋, 2018)。有研究报道夏季水温的异常增加是造成养殖贝类死亡的主要原因之一(张国范等, 1999)。厚壳贻贝主要分布在我国浙江沿海一带, 其人工养殖主要集中在浙江舟山海域, 目前浙江嵊泗海域厚壳贻贝的养殖面积超过1 466.7 hm2, 养殖产量高达20.98万t, 已成为该地的支柱产业。厚壳贻贝生存的温度范围较广, 但对高温的耐受能力较弱。江天棋等(2020)在探究高温胁迫对贻贝的影响研究中发现在30 ℃温度处理后, 厚壳贻贝的滤水率显著降低, 耗氧率与排氨率均显著升高, 代谢和免疫相关酶活均呈现组织特异性的变化。但到目前为止, 温度胁迫对厚壳贻贝的摄食行为以及重要摄食器官如鳃组织的影响尚未见研究。
纤毛是分布在鳃组织细胞表面的一种重要结构, 呈细线型, 可分为两种, 可运动的运动纤毛和不可运动的初级纤毛(Haimo et al, 1981; 陈子琏等, 2001)。运动纤毛在贻贝鳃组织上又细分为前纤毛、侧纤毛和后纤毛, 前纤毛向腹侧摆动, 将食物颗粒送入鳃瓣中(Jørgensen, 1982), 而侧纤毛和后纤毛是产生水流的主要动力来源(Jones et al, 1990)。初级纤毛起初被人们发现具有感知外界信号的作用, 已有研究报道初级纤毛具有激活细胞内在抗氧化机制的能力, 秦荣(2019)发现在人体肺内皮细胞中, 当细胞缺少初级纤毛时, 细胞无法启动其内在的抗缺氧损伤和抗氧化应激防御系统。后来Bloodgood(2010)发现所有的运动纤毛和初级纤毛都具有介导感知的功能, 这也说明无论初级纤毛还是运动纤毛都具备信号传导功能并具有激活内在抗热胁迫机制的潜能。也有学者认为贻贝科具有复合纤毛, 贝类通过复合纤毛作用收集水中的食物颗粒(Owen, 1978)。目前, 有关双壳贝类纤毛在酸化海水以及重金属暴露下的影响已有研究, 如海洋酸化会导致螠蛏(Sinonovacula constricta)鳃纤毛变短和缺失(梁健等, 2022), 贻贝在氯化汞暴露中纤毛会出现坏死(Sheir et al, 2010), 但是关于温度胁迫下贻贝鳃纤毛的响应未见报道。
根据本实验室已有的厚壳贻贝鳃的蛋白质组学数据, 我们在贻贝鳃组织上筛选出9个与运动纤毛、纤毛运动、纤毛组装、微管基体和微管运动等功能有关的基因, 依次为tektin1 (tekt1)、tektin2 (tekt2)、tektin3 (tekt3)、tektin4 (tekt4)、cilia- and flagella-associated protein 58 (caf58)、cilia- and flagella-associated protein 100 (caf100)、ift74、dnah和rsph9 (Liang et al, 2023)。其中, tektin基因家族在在整个动物界以及藻类中普遍存在, 但不同生物体具有的TEKT蛋白种类不同。例如, 斑马鱼只有TEKT2, 海胆精子尾部有3种不同的TEKT蛋白, 人类至少具有6种不同的TEKT蛋白。TEKT蛋白是纤毛的双微管、基体和中央微管的必要成分(Amos, 2008)。CAF蛋白家族是纤毛和鞭毛的特异性蛋白, 在轴突结构和纤毛运动中起到重要作用, 参与调节纤毛大小和形态。IFT蛋白家族主要起纤毛组装的作用, IFT将细胞内纤毛构建位点延伸至纤毛尖端睫状体位点, 起到睫状运输蛋白和运动蛋白之间的适配作用(Taschner et al, 2012)。DNAH是一类动力蛋白, 被证明与弱精子症和畸形精子有关(朱栋梁, 2019)。RSPH是放射状头部蛋白, 其突变与原发性纤毛障碍有关。贻贝摄食是一个依赖于纤毛运动的过程, 而纤毛的损伤到再生涉及纤毛组装等一系列生理活动, 因此, 探究上述纤毛相关蛋白编码基因的表达特征有助于分析温度变化下纤毛的分子响应机制。
本研究以厚壳贻贝为研究对象, 通过设置不同的温度条件处理后, 开展厚壳贻贝摄食率测定、鳃上纤毛形态特征观察以及抗氧化酶活和相关基因的表达变化分析。本研究的结果从纤毛的形态特征、生理生化响应角度揭示温度变化下贻贝摄食率降低的内在机制, 并发现纤毛基因表达能反映出高温导致的纤毛损伤变化。
1 材料与方法 1.1 厚壳贻贝的采集和暂养厚壳贻贝采自浙江省嵊泗县枸杞岛贻贝养殖场, 平均壳长(100.05±10.66) mm。采集的贻贝放入200 L的玻璃缸中暂养7 d, 暂养水温为(17±1) ℃, 盐度为28±1, 每天用螺旋藻粉投喂一次, 投喂30 min后换水一次。
1.2 不同温度的处理将厚壳贻贝分为3个组, 每组各15只贻贝放入20 L的实验水槽中, 设置3个温度梯度, 16、26、32 ℃, 其中16 ℃作为对照组, 另外两组在48 h内使用加热棒均匀升至26 ℃和32 ℃, 在达到预定温度后维持24 h, 并测定之后投喂1 h内的摄食率, 并取温度胁迫24 h后各处理组厚壳贻贝鳃组织样品保存于–80 ℃备用。
1.3 摄食率测定每组各3只厚壳贻贝置于5 L的实验水槽底部, 将螺旋藻粉完全溶于人工海水中制成藻液, 待贻贝张口后, 将螺旋藻液均匀加入实验水槽中, 用玻璃棒缓慢搅动, 若贻贝无闭口反应则开始计时, 每隔15 min取水样1 mL用于流式细胞仪(CytoFLEX)检测螺旋藻颗粒浓度。每组共取5次, 每次设3个平行和一个空白对照。
摄食率公式:
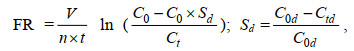 (1)
(1)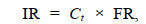 (2)
(2)式中, FR为滤水率(单位: L/h), IR为摄食率(单位: ×104 cells/h), V为实验时水槽中水体积(单位: L), C0、Ct为时间0和t时水槽内螺旋藻浓度(单位: cells/mL), n为贻贝个数, t为实验时间(单位: h)。
1.4 H.E染色取各处理组厚壳贻贝鳃组织, 人工海水漂洗之后, 用4%多聚甲醛固定24 h, 70%乙醇冲洗, 经70%乙醇脱水4 h, 80%乙醇脱水2次, 每次2 h, 95%乙醇脱水2次, 每次45 min, 100%乙醇脱水2次, 每次45 min, 然后用二甲苯透明, 石蜡包埋, 切片包括横切(垂直于鳃丝)和纵切(平行于鳃平面), 切片厚度5 μm, 经H.E染色、中性树胶封藏后光学显微镜观察并拍照。
1.5 酶活力测定将组织样品用人工海水漂洗三次, 滤纸拭干, 称重, 用组织捣碎机充分研磨, 并用9倍组织重量的PBS缓冲液制备组织匀浆。将组织匀浆置于冰上预冷5 min后, 3 000 r/min, 4 ℃的条件下离心10 min, 取上清液待测。使用BCA试剂盒(TaKaRa, 货号: T9300A)测定上清液中的蛋白浓度。使用南京建成生物研究所试剂盒检测待测鳃组织中的过氧化氢(H2O2)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)活力, 具体检测方法参见各酶活试剂盒说明书。
1.6 基因的相对表达量检测利用RNA提取试剂盒(Solarbio)提取样品的总RNA, 通过反转录试剂盒(PrimeSIRipt™ RT reagent Kit, TaKaRa)反转录后进行RT-PCR检测基因的相对表达量。选取的基因名称和引物序列见表 1。β-actin为内参基因, RT-PCR扩增采取三次重复, 采用最小二乘法(2–△△Ct法)进行数据处理。
| 基因名称 | 引物序列(5’~3’) |
| tekt1 | F: AATTCTGTGTGCCCTGAAGATTGG R: GCTGTCTGTTGTAGGATTCCATCG |
| tekt2 | F: AATCCATCACACCCTCCAACAAAC R: TGCCAATCCAGTTCATCCTTTGC |
| tekt3 | F: CTTCTGAGCGTCTTCGTGGTG R: TCTGGTGTTGAAGGAGTTGTTGAC |
| tekt4 | F: ACACTGGACCTGATATGGGAATCTC R: AATAATTCGTCTCGTGCCACTCTG |
| dnah | F: AACGCTGTCAAGGTCACCAATG R: TAATACGCTTCCACTGTTGTCCAAG |
| rsph9 | F: CAGGAGATCCGTCACATGAGTTTG R: TCACTGATGCTAGTCTGTCCTCTTC |
| ift74 | F: CGGTGGCAGTAGACCTAGAACAG R: TTGTCAGGCGGGTAGCAGTAC |
| caf58 | F: GCCACTGCCCTCAAACTTTCTC R: CTGCCATCTTCCATACTCTGTCAAG |
| caf100 | F: AGTGAACTTCCGTACAGCATCTATG R: GTCGGTCTCTTGTGACAGCTATTG |
| β-actin | F: ATGAAACCACCTACAACAGT |
| R: TAGACCCACCAATCCAGACG |
所有实验数据均以平均值±标准差(mean±SD)表示。使用SPSS 25.0软件进行数据的统计学分析, 并使用单因素方差分析(One-way ANOVA)中的Duncan’s进行多重比较, P < 0.05表示有显著性差异。
2 结果与分析 2.1 温度对厚壳贻贝摄食率影响温度是影响贻贝摄食的重要因素之一, 为探究不同温度胁迫下厚壳贻贝摄食率的变化, 测定了16、26和32 ℃温度处理下厚壳贻贝在0.25、0.5、0.75和1 h不同时间点的摄食率变化, 结果如图 1所示。26 ℃温度处理组的厚壳贻贝在摄食率测定的1 h内摄食率均显著高于16 ℃和32 ℃温度处理组(P < 0.05), 16 ℃温度处理组的摄食率也显著高于32 ℃处理组。由此说明, 一定温度范围内随着温度的增加, 厚壳贻贝的摄食率逐渐升高, 在达到26 ℃后, 温度继续增加, 摄食率呈现降低的趋势。相较于26 ℃, 32 ℃条件下厚壳贻贝的摄食率最低, 在投喂后的0.25 h其摄食率仅有(0.68±0.12) × 104 cells/h, 而26 ℃和16 ℃在投喂后0.25 h的摄食率为(3.12±0.24) × 104 cells/h和(2.51±0.27) × 104 cells/h, 分别是32 ℃处理组的4.6和3.7倍。随着投喂时间的延长, 各温度处理组的摄食率均呈现下降趋势, 到投喂后的1 h, 26 ℃和16 ℃温度处理组的摄食率均显著高于32 ℃处理组[(0.44±0.04) × 104 cells/h], 但是此时16 ℃处理组的摄食率[(1.08±0.05) × 104 cells/h)]略高于26 ℃处理组[(1.05±0.01) × 104 cells/h)], 这可能与此时水体中藻类浓度有关, 贻贝的摄食率随着水体中藻类浓度的降低而逐渐降低。
 |
| 图 1 温度胁迫对厚壳贻贝摄食率影响 Fig. 1 Effect of the ingestion rate of M. coruscus under temperature stress |
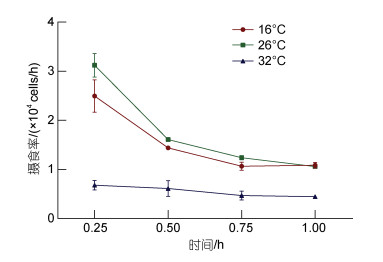
为了探究温度胁迫对厚壳贻贝鳃组织的形态学影响, 通过H.E染色对不同温度处理下厚壳贻贝鳃上纤毛进行了显微观察, 结果如图 2所示。16 ℃温度处理下鳃上纤毛清晰可见, 且形态完整, 血腔间隙较小, 侧纤毛细胞核和内皮细胞核数量和形态完整(图 2a, 2b)。由于TS区域对应内皮细胞横截面, 所以观察不到纤毛存在。26 ℃温度处理下鳃上纤毛同样清晰可见且形态完整, 但相较于16 ℃处理组, 26 ℃处理下血腔间隙略微增大, 这导致前纤毛细胞被压缩, 但鳃总体形态比较完整, 没有出现明显破损(图 2c, 2d)。然而, 在32 ℃高温处理下, 鳃上无论是前纤毛还是侧纤毛均受到严重损伤, 主要表现在前纤毛细胞和侧纤毛细胞受损严重并脱落, 切片中存在大量游离的受损细胞和细胞核, 前纤毛区域破裂并暴露, 后纤毛受损较轻且附着相对稳定(图 2e, 2f)。32 ℃处理下前纤毛区域破损严重, 中间血腔区域完全暴露, 无法观察到前纤毛细胞核和内皮细胞核。由此说明, 26 ℃温度胁迫下其纤毛结构没有明显影响, 而32 ℃高温胁迫对鳃上纤毛形态和血腔形态的影响均较为明显。纤毛形态的改变导致其摄食率的降低, 与上述32 ℃温度处理下的摄食率降低结果是一致的。
 |
| 图 2 温度胁迫对厚壳贻贝鳃组织病理学切片 Fig. 2 Histopathology sections of gill of M. coruscus under high temperature stress 注: a. 16 ℃处理组鳃组织横切图; b. 16 ℃处理组鳃组织纵切图; c. 26 ℃处理组鳃组织横切图; d. 26 ℃处理组鳃组织纵切图; e. 32 ℃处理组鳃组织横切图; f. 32 ℃处理组鳃组织纵切图。FC: 前纤毛; L: 侧纤毛; LC: 侧纤毛细胞; H: 血腔; S: 内皮细胞; RC: 后纤毛; DF: 受损的前纤毛; DC: 受损的细胞; TS: 纵切面中的虚线框对应横切面的虚线横截面 |
进一步测定了温度胁迫下厚壳贻贝的H2O2含量、CAT和GSH-Px酶活性, 以探究温度胁迫对厚壳贻贝组织氧化损伤的情况。结果如图 3所示, 从H2O2的含量变化来看, 与16 ℃相比, 26 ℃温度处理组H2O2的含量无显著变化, 32 ℃温度处理组H2O2的含量极显著升高(图 3a, P < 0.01)。而与16 ℃处理组相比, CAT的酶活在26 ℃温度处理组显著升高(P < 0.05), 32 ℃温度处理组显著降低(图 3b, P < 0.05), 而GSH-Px的活性在26 ℃和36 ℃温度处理下均显著降低(图 3c, P < 0.05)。由此可见, 在32 ℃的高温胁迫下, 鳃组织受到温度胁迫发生应激, 产生大量H2O2, 而H2O2可穿透细胞膜产生大量羟基自由基对纤毛造成氧化损伤, 而CAT和GSH-Px酶活降低表明此时厚壳贻贝的抗热胁迫能力降低。
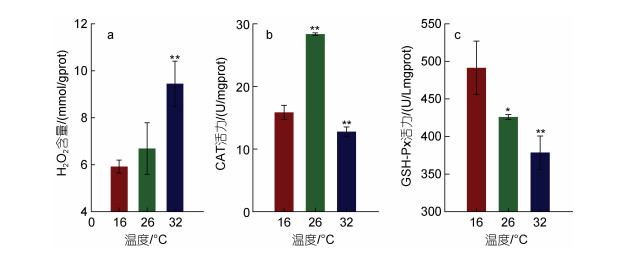 |
| 图 3 温度对厚壳贻贝鳃中H2O2、CAT和GSH-Px酶活力影响 Fig. 3 Effect of high temperature stress on H2O2, CAT and GSH-Px enzyme activity in the gills of the M. coruscus 注: a. H2O2含量; b. CAT活力; c. GSH-Px活力 |
为探究温度胁迫下厚壳贻贝纤毛相关基因的表达情况, 我们选取了9个与鳃丝运动纤毛、纤毛运动、纤毛组装、微管基体和微管运动等有关的基因, 通过荧光定量PCR检测了上述基因在不同温度处理下的相对表达量, 结果如图 4所示。与16 ℃温度处理组相比, 除tekt4和dnah外, 其他7个鳃纤毛相关基因(tekt1、tekt2、tekt3、caf58、caf100、ift74和rsph9)在26 ℃处理下均显著上调表达(P < 0.05); 在32 ℃温度处理下, 除tekt1和caf100之外, 其余7个基因(tekt2、tekt3、caf58、ift74和rsph9)均显著下调表达(P < 0.05)。由此说明, 适当的温度增加, 如在26 ℃的环境下, 有助于提升鳃上纤毛的运动、再生以及纤毛组装和感知能力, 但当温度达一定高度如32 ℃的时候, 其纤毛受到一定程度的破坏, 其运动再生、以及纤毛组装和感知能力都极大地降低。
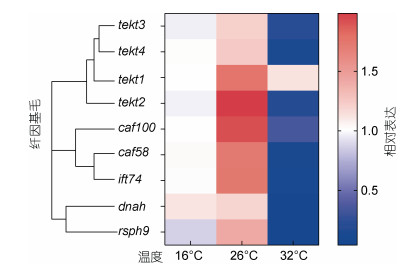 |
| 图 4 纤毛相关基因的相对表达量热图 Fig. 4 Heat map of cilia related gene expression |
温度是影响双壳贝类滤食的主要原因之一, Cranford等(1999)研究发现紫贻贝(Mytilus edulis)和北美扇贝(Placopecten magellanicus)的摄食率受季节等环境因子变化而差异较大。范嗣刚等(2014)发现大珠母贝(Pinctada maxima)和合浦珠母贝(Pinctada fucata)稚贝的摄食率先随着温度的升高而升高, 在26 ℃时其摄食率达到最大, 然后温度再升高摄食率呈现下降趋势。本实验显示, 与16 ℃相比, 厚壳贻贝在26 ℃下的摄食速率显著增加, 而32 ℃下的摄食率显著降低, 这与范嗣刚等人的结果一致, 说明在适宜的温度范围内(即低于26 ℃时), 温度的升高可以提高贝类的摄食率。
同时摄食率的变化与纤毛基因的表达变化趋势有紧密联系, 贻贝鳃纤毛基因在26 ℃刺激下, 除了tekt4和dnah无显著变化之外, 其余7个基因均显著上调表达(P < 0.05), 在32 ℃温度处理下除tekt1和caf100无显著变化之外, 其余基因均显著下调表达(P < 0.05)。两者之间的关联反映出纤毛基因的表达可能作为检测纤毛功能损伤的标志物, 关于纤毛在贻贝摄食中的作用模式已有详细的报道, 贻贝鳃上的纤毛是由腹侧长纤毛和中间带的短纤毛组成的复合纤毛, 前纤毛上的黏液有利于食物颗粒的捕获, 并向鳃丝腹侧运输, 腹侧纤毛有规律的摆动将食物颗粒运往食物沟(崔龙波等, 1996; Ward et al, 1998)。由切片结果可见, 前纤毛和侧纤毛脱落较多, 血腔间隙破损明显, 其纤毛功能受损严重, 由于失去前纤毛的作用, 食物颗粒的捕获难度将大大提高, 大量的食物颗粒将无法前往鳃丝腹侧, 最终在鳃丝表面随海水流失, 这是造成摄食率降低的主要原因(Jørgensen, 1975)。除此之外, 外套膜纤毛、腹感系统纤毛和足纤毛都有可能因高温胁迫而遭受氧化损伤, 由此造成的信号传导和纤毛运动减弱都可能威胁到贻贝的生存, 例如, 贻贝外套膜和腹感系统的纤毛有利于贻贝检测水质的变化, 当水质降低, 或者水体中存在有毒物质时, 贻贝将紧闭双壳, 防止海水进一步侵害, 但如果纤毛感知能力降低, 贻贝可能无法及时关闭双壳, 从而被污染的海水侵害, 这也是温度异常造成双壳贝类死亡的原因之一(Zhadan et al, 2003; Blaise et al, 2017)。
纤毛相关基因表达检测结果显示tekt2、tekt3、tekt4、caf58、dnah、rsph9和ift74在26 ℃处理之后, 相对表达量上调, 在此温度下厚壳贻贝的摄食率也上升。但是到投喂后的1 h时, 26 ℃组与16 ℃组摄食率趋近, 我们发现此时两组处理组水体中的藻浓度已经很低, 因此, 贻贝捕获藻颗粒的概率明显降低导致摄食率的降低。而32 ℃温度处理组纤毛基因的相对表达量下调, 与26 ℃处理组相反, 是由于在32 ℃温度胁迫下, 纤毛运动、纤毛组装、微管组成和基体蛋白的表达量减少, 贻贝在受到高温胁迫之后, 鳃纤毛再生将受到抑制, 纤毛损伤持续增加, 因此纤毛相关基因的表达量下调。本实验室在前期的饥饿胁迫实验中也发现贻贝鳃纤毛损伤的情况, 与本次实验相同的是tekt2、tekt3、tekt4、caf58、dnah、rsph9和ift74的表达也出现了显著下调(Liang et al, 2023)。饥饿和高温两种不同的胁迫造成的纤毛损伤与纤毛基因的表达高度一致, 纤毛损伤之所以具有成为检测细胞氧化损伤的标志物的潜能, 这是因为根据组织形态学分析, 细胞表面的纤毛损伤会比细胞损伤更容易被观察到, 换言之纤毛的损伤会比细胞损伤显现的更快, 这可能是纤毛不稳定的纤毛膜-微管-基质结构和暴露在胞外的固定模式造成的, 因此可以通过检测纤毛基因表达来预测纤毛的氧化损伤(Satir et al, 2007)。类似的方法也曾用于检测人类弱精症的发生, 研究表明tekt3和tekt4的表达量与精子尾部鞭毛活性直接相关, 两者表达量的降低会导致精子尾部鞭毛摆动缓慢, 从而使精子向前运动困难, 从而引发弱精症, 使精子与卵细胞结合受阻, 受孕几率更低(李慕军, 2012; 李玉山等, 2015)。
目前已有较多高温胁迫对双壳贝类生理活动、过氧化和抗氧化作用影响的研究, 例如高温胁迫对岩扇贝幼贝的鳃组织上CAT活力具有诱导性, 对T-AOC能力具有抑制作用(曹善茂等, 2018)。研究显示紫贻贝和翡翠贻贝的耗氧率和排氨率在一定范围内随温度的升高而升高, 在紫贻贝胁迫温度达到35 ℃, 翡翠贻贝达到42 ℃时则急剧降低, 同时会破坏两种贻贝的鳃组织结构(王静等, 2019)。本研究中选用常见的过氧化损伤物质H2O2为对象进行测定, H2O2为活性氧(ROS)的发生体, ROS在生物体内过量堆积会造成细胞的氧化损伤, CAT和GSH-Px两者均可将H2O2转化为无毒的O2和H2O。已有研究表明H2O2引起的细胞氧化损伤会导致细胞凋亡和细胞坏死, 例如, H2O2过量累积引起的人体皮肤细胞损伤(冯冰, 2012)。本实验中, H2O2的氧化损伤主要表现在纤毛上, 其发生过程为在高温胁迫下鳃组织产生大量H2O2, H2O2穿过前纤毛细胞膜并产生大量的羟基自由基, 该自由基造成的氧化损伤首先会表现在附着较不稳定的前纤毛上, 这与图 2切片结果一致, 另外切片结果显示前纤毛区域受损严重并破裂, 而后纤毛区域则没有破裂, 推测其原因也是由于纤毛细胞结构不稳定导致的。前纤毛区域纤毛丰富, 承担主要摄食功能, 而后纤毛区域则纤毛稀疏, 所以导致了后纤毛区域结构会比前纤毛区域结构较为稳定, 从而在高温胁迫中没有破裂。实验结果表明H2O2含量随温度升高而升高, 而CAT和GSH-Px活力却在32 ℃显著降低, 这种情况在螠蛏中也有发生, 螠蛏在25~35 ℃条件下, CAT含量逐渐降低, 直到35 ℃时达到最小(方佳琪等, 2023)。在贻贝中这种情况与推测的结果是不符的, 推测的结果下贻贝需要激活相关抗氧化酶活来抵御细胞氧化损伤, 否则ROS过量积累可能会导致贻贝死亡, 但是显然两种酶的表达在本实验中均受到抑制, 该现象一部分原因是纤毛信号传导受阻导致的。根据形态学结果显示, 鳃纤毛较脆弱的细胞结构导致其在高温胁迫中脱落严重, 因此推测在外套膜和腹感系统中承担主要感知功能的纤毛也同样受到高温胁迫的氧化损伤, 其纤毛受损势必引起信号传递功能受损, 从而使氧化应激系统无法激活, 与之相同的情况在人体中也有发生, 例如, 陈卓(2022)发现人体心肌细胞在缺乏初级纤毛的情况下, 受到外界缺氧刺激无法激活内在抗氧化机制。
目前, 随着全球气候变暖和极端天气的频繁发生, 需要加强对厚壳贻贝养殖区域高温天气预警, 也需要加强对贻贝抗高温苗种的选育, 以应对高温胁迫对厚壳贻贝鳃组织的损伤。
4 结论通过厚壳贻贝鳃组织形态学观察结合纤毛相关基因和摄食率数据分析, 本研究发现: 厚壳贻贝鳃组织在32 ℃高温胁迫后受损严重, 血腔破裂, 纤毛脱落, 而16 ℃和26 ℃没有明显破损。厚壳贻贝在16、26和32 ℃处理下, 摄食率表现为先上升后降低, 与形态学观察结果一致。纤毛相关基因在16、26和32 ℃处理下表现为先上调后下调, 这说明纤毛的运动再生、以及纤毛组装和感知能力都有所降低。本研究揭示了高温对贻贝鳃组织具有严重的破坏性, 高温诱导厚壳贻贝鳃组织氧化应激从而破坏其纤毛结构及摄食功能。
王静, 姚翠鸾, 2019. 温度胁迫对紫贻贝与翡翠贻贝生理活动的影响和Hsp27的响应[J]. 集美大学学报(自然科学版), 24(1): 1-9. |
方佳琪, 张敏, 郑凯, 等, 2023. 急性温度胁迫对缢蛏不同组织脂质过氧化及抗氧化生理响应的影响[J]. 食品与发酵工业, 49(2): 226-233. |
冯冰, 2012. 植物提取物防护H2O2诱导人皮肤细胞损伤的研究[D]. 无锡: 江南大学.
|
朱栋梁, 2019. DNAH1、DNAH5、DNAH11基因单核苷酸变异与弱精子症的关系研究[D]. 长春: 吉林大学.
|
江天棋, 张扬, 姜亚洲, 等, 2020. 高温胁迫对厚壳贻贝摄食、代谢和相关酶活性的影响[J]. 生态学杂志, 39(9): 3048-3056. |
李玉山, 陈河涛, 杨夕阳, 等, 2015. TEKT3在特发性弱精子症患者精子中的表达[J]. 郑州大学学报(医学版), 50(6): 843-846. |
李慕军, 2012. 不同类型精子发生障碍全基因组甲基化差异分析与重要功能基因的表达验证[D]. 南宁: 广西医科大学.
|
张国范, 李霞, 薛真福, 1999. 我国养殖贝类大规模死亡的原因分析及防治对策[J]. 中国水产, (9): 34-39. |
陈子琏, 曾园山, 张惠君, 2001. 人体结构学[M]. 北京: 科学出版社.
|
陈卓, 2022. 心肌细胞通过定位于初级纤毛的TRPV4启动抗缺氧损伤机制的研究[D]. 兰州理工大学.
|
范嗣刚, 黄桂菊, 刘宝锁, 等, 2014. 盐度与温度对大珠母贝和合浦珠母贝滤水率及摄食率的影响[J]. 水生态学杂志, 35(3): 61-65. |
秦荣, 2019. 初级纤毛在肺微血管内皮细胞抗缺氧损伤中的作用及机制研究[D]. 兰州: 兰州理工大学.
|
曹善茂, 王潇, 刘钢, 等, 2018. 温度胁迫对岩扇贝幼贝抗氧化酶活力的影响[J]. 大连海洋大学学报, 33(2): 223-227. |
崔龙波, 刘传林, 陆瑶华, 等, 1996. 紫贻贝(Mytilus edulis L.)鳃的研究[J]. 齐鲁渔业, 13(5): 11-14. |
梁健, 朱飞霞, 刘宇航, 等, 2022. 海洋酸化对缢蛏鳃组织结构的影响[J]. 经济动物学报, 26(4): 299-303. |
韩国栋, 2018. 典型潮间带贝类温度生理适应及其分子机制[D]. 厦门: 厦门大学.
|
AMOS L A, 2008. The tektin family of microtubule-stabilizing proteins[J]. Genome Biology, 9(7): 229. DOI:10.1186/gb-2008-9-7-229 |
BLAISE C, GAGNÉ F, BURGEOT T, 2017. Three simple biomarkers useful in conducting water quality assessments with bivalve mollusks[J]. Environmental Science and Pollution Research, 24(36): 27662-27669. DOI:10.1007/s11356-016-6908-6 |
BLOODGOOD R A, 2010. Sensory reception is an attribute of both primary cilia and motile cilia[J]. Journal of Cell Science, 123(4): 505-509. DOI:10.1242/jcs.066308 |
CRANFORD P, HILL P, 1999. Seasonal variation in food utilization by the suspension-feeding bivalve molluscs Mytilus edulis and Placopecten magellanicus[J]. Marine Ecology Progress Series, 190: 223-239. DOI:10.3354/meps190223 |
HAIMO L T, ROSENBAUM J L, 1981. Cilia, flagella, and microtubules[J]. Journal of Cell Biology, 91(3): 125s-130s. DOI:10.1083/jcb.91.3.125s |
JONES H D, RICHARDS O G, HUTCHINSON S, 1990. The role of ctenidial abfrontal cilia in water pumping in Mytilus edulis L.[J]. Journal of Experimental Marine Biology and Ecology, 143(1/2): 15-26. |
JØRGENSEN C B, 1975. Comparative physiology of suspension feeding[J]. Annual Review of Physiology, 37: 57-79. DOI:10.1146/annurev.ph.37.030175.000421 |
JØRGENSEN C B, 1982. Fluid mechanics of the mussel gill: the lateral cilia[J]. Marine Biology, 70(3): 275-281. DOI:10.1007/BF00396846 |
LIANG Z W, LI S W, ZHANG X L, et al, 2023. Morphological change and differential proteomics analysis of gill in Mytilus coruscus under starvation[J]. Frontiers in Physiology, 14: 1150521. DOI:10.3389/fphys.2023.1150521 |
OWEN G, 1978. Classification and the bivalve gill[J]. Philosophical Transactions of the Royal Society B: Biological Sciences, 284(1001): 377-385. |
SATIR P, CHRISTENSEN S T, 2007. Overview of structure and function of mammalian cilia[J]. Annual Review of Physiology, 69: 377-400. DOI:10.1146/annurev.physiol.69.040705.141236 |
SHEIR S K, HANDY R D, GALLOWAY T S, 2010. Tissue injury and cellular immune responses to mercuric chloride exposure in the common mussel Mytilus edulis: modulation by lipopolysaccharide[J]. Ecotoxicology and Environmental Safety, 73(6): 1338-1344. DOI:10.1016/j.ecoenv.2010.01.014 |
TASCHNER M, BHOGARAJU S, LORENTZEN E, 2012. Architecture and function of IFT complex proteins in ciliogenesis[J]. Differentiation, 83(2): S12-S22. DOI:10.1016/j.diff.2011.11.001 |
WARD J E, SANFORD L P, NEWELL R I E, et al, 1998. A new explanation of particle capture in suspension-feeding bivalve mollusks[J]. Limnology and Oceanography, 43(5): 741-752. DOI:10.4319/lo.1998.43.5.0741 |
ZHADAN P M, DAUTOV S S, 2003. Structure and mechanical properties of the sensory cilium in the abdominal sense organ of the bivalve mollusk[J]. Doklady Biological Sciences, 390(1): 279-281. |
 2024, Vol. 55
2024, Vol. 55


